|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesIn this study, considering the changes in the concentration of metal/metalloid and environmental factors over time of the target water system and the toxic effects of metals on various aquatic organisms, determined procedure of ecotoxicologically acceptable metal/metalloid concentration based on a biotic ligand model (BLM) was proposed in detail. As an application example, the ecotoxicologically acceptable Cu concentration for the Numedalslågen river in Norway was calculated.
MethodsThe Cu concentration and environmental factor time series data of the target water system were collected, and EC50[Cu]T, the total concentration of Cu in the water system showing a toxic effect of 50% on the target aquatic organisms, was calculated through BLM. In addition, the predicted no-effect concentration (PNEC) was obtained from the species sensitivity distribution using the acute-chronic ratio and adjustment factor, and the ecotoxicologically acceptable Cu concentration of the target water system was determined through the fixed monitoring benchmark (FMB).
Results and DiscussionEcotoxicologically acceptable Cu concentration of the target water system was determined as 1.15 μg/L. Dissolved organic carbon (DOC) showed the highest linear relationship with EC50[Cu]T (R2 = 0.94-0.98) compared to various environmental factors, and the Cu toxicity effect on aquatic organisms tended to decrease as the DOC concentration increased. Ca showed a low linear relationship with EC50[Cu]T (R2 < 0.04), which is presumed to be due to the decrease in Ca2+ concentration due to the complexese formation of DOC and Ca2+, which reduced the competitive effect with Cu2+.
ConclusionThe proposed procedure provides a useful method for calculating ecotoxicologically acceptable metal concentrations for the protection of aquatic organisms in water systems. In addition, it is expected that it can be used to calculate site-specific metal concentrations that can protect aquatic organisms in the target water system by reflecting the timing of sediment resuspension, which can cause rapid changes in the concentration of metals and environmental factors in the water system, and specific time points such as storm and flood seasons.
요약목적본 연구에서는, 대상 수계의 시간에 따른 중금속 농도 및 환경인자의 변화와 다양한 수생생물에 대한 중금속의 독성영향을 고려하여, 독성예측모델(biotic ligand model; BLM)기반 생태독성학적 허용가능 중금속 농도 산정 절차를 상세히 제안하고, 그 적용 예로서, 노르웨이 Numedalslågen강에 대한 생태독성학적 허용가능 Cu 농도를 산정했다.
방법대상 수계의 Cu 농도 및 환경인자 시계열 자료를 수집하고, 대상 수생생물에게 50%의 독성 영향을 나타내는 수계 내 Cu의 총 농도인 EC50[Cu]T을 BLM을 통해 계산했다. 또한, 종민감도분포를 도시하고, 급성-만성 비율 및 조정 계수를 활용하여 예측 무영향농도를 도출했으며, fixed monitoring benchmark (FMB)를 통해 대상 수계의 생태독성학적 허용가능 Cu 농도를 산정했다.
1. 서 론수생생물에 대한 중금속의 독성을 평가하고 대상 수계의 생태독성학적으로 허용가능한 중금속 농도(ecotoxicologically acceptable metal/metalloid concentration) 산정 시, 중금속의 생물학적이용성(bioavailability)을 고려하는 것의 중요성은 잘 알려져 있다[1]. 이는 대상 수계 내 중금속의 화학적 존재형태가 다양하며[2], 수계 내 다양한 물리화학적 환경인자(e.g., pH, 용존유기탄소(dissolved organic carbon; DOC), 주요 양이온(e.g., Ca2+, Mg2+, K+, Na+))에 따라 수생 생물에게 독성영향을 미칠 수 있는 중금속의 생물학적이용성이 달라질 수 있기 때문이다[3,4]. 따라서, 수생생물에 대한 중금속의 생물학적 이용성을 고려하여 중금속의 독성영향을 정량화 하기 위해 biotic ligand model (BLM)이 도입됐다[1].
BLM은 수생생물에 대한 중금속의 독성영향이 수계 내 총 중금속 농도와 관련이 있을 뿐만 아니라, 자유이온 형태의 중금속 이온이 biotic ligand (BL)라고 불리는 생물의 활성결합부위(active binding sites)에 결합한 경우 독성영향을 발현할 수 있다고 가정하며, 대상 수계 내 양이온들과의 경쟁효과(competitive effect)를 고려하여 중금속 독성영향을 합리적으로 정량화할 수 있는 중금속 독성 예측 모델이다[5-7]. 이러한 BLM의 개념은 중금속의 생물학적 이용성을 고려하여 수계에서 생태독성학적 허용 가능 중금속 농도를 산정하는 데 활용될 수 있다.
미국 환경 보호청(United States Environmental Protection Agency; USEPA)는 현장 별 구리(Cu) 수질 기준 도출 시 BLM의 활용을 권장하고 있다[8,9]. McConaghie et al. (2016) [10]은 미국 오리건 주 내 담수 수생생물 보호를 위한 Cu 수질 기준 개발을 위해 BLM을 활용하고 있으며, 오리건 주 내 담수 별로 0.70 μg/L-434.3 μg/L (중앙값 5.16 μg/L)의 BLM 기반 Cu 수질 기준을 산정한 바 있다. 이러한 사실에도 불구하고, BLM을 활용한 수질 기준의 산정방법은 다양한 국가 및 많은 미국 행정구역에서 널리 활용되지 않고 있다[11]. 이는 BLM이 개별 수생생물에 대한 종 특이적(species-specific)인 독성 예측 결과만 제공할 수 있으며, 특정 시점의 중금속 독성영향만을 예측할 수 있다는 단점이 존재하기 때문으로 판단된다. 이러한 BLM의 한계를 보완하기 위해 종민감도분포(species sensitivity distribution; SSD) 및 fixed monitoring benchmark (FMB) 접근 방식이 제안됐다[2,12].
동일한 중금속 농도로 노출되더라도 중금속의 독성영향은 다양한 수생생물에 따라 다르며[13], 다양한 수생생물에 대한 대상 중금속의 독성영향을 고려하여 수생생물 중금속 보호수준을 산정하기 위해 SSD를 활용할 수 있다[14]. SSD는 다양한 수생생물에 대한 중금속 독성 예측 값을 사용하여 누적 확률 분포 곡선을 구축하며, 전체 생물종의 95%를 보호할 수 있는 수준의 농도인 5% hazardous concentration (HC5) 및 생물에게 유해한 영향이 나타나지 않는다고 예측되는 환경 중 농도인 예측 무영향농도(predicted no effect concentration; PNEC)를 산정할 수 있는 방법이다[15,16]. 이러한 SSD는 종 특이적인 독성 값을 예측하는 BLM을 보완할 수 있는 확률 기반의 평가 방법으로 활용될 수 있다.
수생생물에 대한 중금속 독성영향에 미치는 대상 수계의 중금속 농도 및 환경인자는 시간에 따라 변동한다. 이는 특정 시점에 대한 중금속 독성영향을 예측하는 BLM을 통해 계산된 중금속 독성영향이 시간에 따라 변화할 수 있으며, 이를 통해 산정되는 중금속에 대한 대상 수계의 수생생물 보호 기준의 불확실성을 야기할 수 있다[2,9,11]. FMB는 BLM을 통해 예측된 중금속 독성영향과 대상 수계의 시간에 따른 중금속 농도 및 환경인자의 변동성을 통합하여 생태독성학적 허용가능 중금속 농도를 산정할 수 있는 확률기반의 접근방식으로, 목표초과빈도(3년에 1번)를 초과하지 않은 수준에서 가장 높은 중금속 농도를 대상 수계 중금속 농도 기준으로 활용한다[2,12,17]. 이와 같은 FMB 접근 방식은 대상 수계의 중금속 농도 및 환경인자의 장기 모니터링 결과와 BLM을 활용하여 산정된 모니터링 시간 별 중금속 독성영향을 통해 대상 수계의 수생생물을 보호할 수 있는 단일 중금속 농도를 산정할 수 있으며, 수생생물 보호를 위한 독성 지표로 활용될 수 있다[2].
다양한 국가들의 중금속의 수질기준은 대부분 총 농도를 기반으로 제시되고 있다. SSD 및 FMB를 활용한 BLM 기반 생태독성학적 허용가능 중금속 농도의 산정방법은 중금속의 생물학적 이용가능성을 고려하여 수질관리와 수생생물의 보호를 위한 현장 별 중금속 배출 허용 기준, 환경 모니터링 및 현장 수질기준 등 규제적인 맥락에서 활용가능한 프레임워크를 제공할 수 있다[7]. Jeong et al. (2022) [11]은 BLM 및 한강유역의 Cu 농도 및 환경인자(DOC, pH, 온도)를 통해 계산된 독성 예측 값을 활용하여 Cu 독성 예측값의 95% 신뢰한계 값을 산정하고 이를 물벼룩(Daphnia magna)를 보호하기위한 생태독성학적 허용가능 Cu농도로 도출한 바 있으며, 시간에 따라 변화하는 Cu 농도 및 환경인자로 인한 독성 예측 값의 변동을 고려하기 위해 FMB 접근방식의 활용을 제안한 바 있다. 또한, Jeong et al. (2020) [2]은 BLM 및 토양 공극수 내 Cu 및 환경인자(DOC, pH, 주요 양/음이온)을 통해 계산된 독성 예측 값과, SSD 및 FMB 접근방식을 활용하여 토양 생물에 대한 생태독성학적 허용가능 Cu농도를 산정한 바 있으나, FMB 활용을 위한 최소 24개의 모니터링 자료에 비해 적은 10개의 모니터링 자료를 활용했으며, Cu 농도 및 환경인자의 시간에 따른 변화를 고려하여 보다 정확한 FMB의 활용을 위해 장기간의 모니터링 자료를 활용할 필요성이 있음을 보고한 바 있다.
본 연구에서는, BLM 활용의 증진을 위해, BLM 기반 생태독성학적 허용가능 중금속 농도 산정 절차을 상세히 제안함으로써, 이에 대한 이해를 돕는데 목적이 있다. 또한, 절차 적용의 예로서, 대상 수계의 Cu 농도 및 환경인자 시계열 자료를 수집하여, BLM을 통해 다양한 수생생물종 별 Cu에 대한 50% effective concentration (EC50)을 산정하고, 종민감도분포를 도시하여 PNEC를 산정했으며, FMB를 통해 대상 수계에서 생태독성학적 허용가능 Cu 농도를 산정했다.
2. 재료 및 방법BLM 기반 생태독성학적 허용가능 중금속 농도 산정 절차는 Fig. 1과 같다. 수계 내 시간 별 중금속 농도 및 환경인자의 농도를 조사하고, 화학평형 프로그램을 활용하여 활성도로 환산하며, 대상 수생생물에게 50%의 독성 영향을 나타내는 수계 내 Cu의 총 농도인 EC50[Cu]T 를 계산한다. 이후 SSD를 활용하여 시간 별 PNEC를 산정하고 FMB를 통해 중금속 농도 및 환경인자의 시간에 따른 변동을 반영한 생태독성학적 허용가능 Cu 농도를 산정한다. 절차에 대한 상세한 설명은 아래(2.1-2.4)에 나타냈다. 본 연구에서는 절차 적용의 예로서, 단일 중금속을 대상으로 한 생태독성학적 허용가능 중금속 농도를 산정했으며, 대상 수계가 여러 중금속으로 복합 오염된 경우, 수생생물에 대한 다양한 중금속의 복합 독성이 발생될 수 있으므로, 이를 고려한 생태독성학적 허용가능 중금속 농도 산정을 위해 수계 내 다양한 중금속 농도 조사 및 중금속 복합 독성 예측이 가능한 BLM을 활용할 수 있다.
2.1. 수질 특성 시계열 자료 수집수계 내 중금속 농도 및 환경인자의 시간에 따른 변동을 고려하여 생태독성학적 허용가능 Cu 농도를 산정하기 위해서는, 일반적으로 충분히 긴 기간에 걸친 24개 이상의 Cu농도 및 수질 특성(e.g., pH, DOC, Ca)시계열 자료가 필요하다[9]. 따라서 해당 조건을 만족하는 노르웨이 Numedalslågen강의 2017년에서 2023년까지의 시계열 자료를 수집했다(Norsk Institutt For Vannforskning (NIVA) Aqa Monitor, https://aquamonitor.niva.no/portal/) [18].
2.2. BLM을 활용한 중금속 독성 예측 값 산출2.2.1. 화학평형 모델(Visual MINTEQ 3.1)을 활용한 활성도 산정수집한 Cu농도 및 환경인자 시계열 자료를 바탕으로, Cu 독성 예측 값(EC50[Cu]T)을 산정하기 위해 화학평형 모델인 Visual MINTEQ 3.1 (https://vminteq.lwr.kth.se/)을 사용하여 수계 내 Cu농도 및 주요 양이온들의 활성도를 계산했다. 대기 중 CO2 분압(Atmospheric CO2 pressure)은 0.00038 atm, 용존 유기물(dissolved organic matter)에 대한 Cu 결합 모델링은 Visual MINTEQ 3.1에 내장된 NICA-Donnan 모델을 사용했으며, 해당 모델은 DOC 농도로부터 유기금속 복합체의 농도를 추정할 수 있다[19-21].
2.2.2. 수생생물 별 Cu 독성 예측 값 산출수계 내 Cu의 경우 대상 수계의 수질특성에 따라 CuOH+ 및 CuCO3와 같은 무기 복합체로의 종분화가 일어날 수 있다. CuOH+ 및 CuCO3는 BL과 결합하여 수생생물에 대한 독성영향을 나타낼 수 있다고 보고된 바 있으므로[3], 이를 고려하여 Cu의 독성을 예측할 수 있도록 Cu2+뿐만 아니라 CuOH+ 및 CuCO3의 독성 영향도 고려한 다양한 수생생물 BLM을 조사했다(식 1-3). De Schamphelaere et al. (2006) [22]이 개발한 조류 BLM의 경우 Cu 독성값 예측 시 CuOH+ 및 CuCO3에 대한 BLM 매개변수를 고려하지 않는다(식 4). 그러나, 조류 BLM으로 예측된 Cu 독성영향의 평균 예측 오류가 2배 미만이며, 실제 독성실험을 통해 측정된 Cu 독성영향과의 강한 선형 관계(R2 = 0.93-0.96)를 나타내므로, 이를 활용하여 대상 수계의 Cu 독성 영향을 예측했다. Cu 독성 예측 값 계산을 위한 다양한 수생생물에 대한 BLM 매개변수는 Table 1에 나타냈다.
(1)여기서, 식 (1)-(4)는 각각 물벼룩(Daphnia magna), 잉어(Pimephales promelas), 무지개송어(Oncorhynchus mykiss), 조류(Pseudokirchneriella subcapitata, Chlorella vulgaris, Chlamydomonas reinhardtii)의 Cu BLM이다. fCuBL50%는 50%의 독성영향을 나타내기 위해 자유 이온 형태의 Cu가 차지하는 BL의 비율이며, KCuBL, KCaBL, KHBL은 자유 이온 형태의 Cu 및 환경인자(Ca, H+, OH-)가 BL에 결합하는 조건부 평형 상수(L/mol)를 나타낸다. KCuOHBL, KCuCO3BL는 수계 내 Cu의 종분화(speciation)시 수생생물에게 독성영향을 미칠 수 있는 독성인자인 CuOH 및 CuCO3가 BL에 결합하는 조건부 평형 상수(L/mol)를 나타내며, {Cu2+}, {Ca2+}, {H+}, {CO32-}, {OH-}는 Cu2+ 및 환경인자의 활성도(mol/L)를 나타낸다. 또한, EC50{Cu2+}는 50%의 독성 영향을 나타내는 자유 이온 형태의 Cu의 활성도, Q 및 SpH는 조류에 대한 pH 별 독성실험결과 선형회귀선의 기울기 및 절편을 나타낸다.
Visual MINTEQ 3.1을 활용하여 계산된 Cu 및 환경인자의 활성도와 조사된 BLM 매개변수를 활용하여 수생생물 별 50%의 독성 영향을 나타내는 Cu의 활성도를 계산했다. 이후 50%의 독성 영향을 나타내는 Cu의 활성도와 동일한 활성도를 나타내는 수계 내 Cu 농도를 Visual MINTEQ 3.1을 활용하여 역도출 했으며, 이는 EC50[Cu]T를 나타낸다.
2.3. 종민감도분포 도시 및 급성-만성 비율을 활용한 만성 PNEC 산정SSD는 BLM을 통해 계산된 수생생물 별 독성 예측 값을 통합하여 수계 내 HC5를 산정하기 위해 활용되며, SSD 도시를 위한 최소 기준은 국가마다 다르다. 한국, 호주 및 뉴질랜드의 경우 4개의 분류군(조류, 무척추동물(갑각류, 연체동물), 어류 등), 5종 이상의 독성 자료가 필요하고, 미국의 경우 8개의 분류군, 10종 이상의 독성자료, 캐나다의 경우 3개 분류군, 3종 이상의 독성자료가 필요하다[23,24].
만성 독성 자료는 대상 수생생물에 대한 중금속 독성영향을 급성 독성 자료에 비해 더 민감하게 나타내므로, 보수적 측면에서 더 선호된다[23,25-27]. 따라서 SSD를 활용한 PNEC 산정 시, 만성 중금속 독성 예측 값을 활용하는 것을 권장한다. 그러나, 만성 중금속 독성 값을 계산하기 위한 수생생물 별 만성 BLM은 부족한 실정이며, 이로 인해 SSD 최소 기준을 만족시키기에 어려움이 있다. 이러한 경우, 급성 BLM 및 SSD를 통해 계산된 HC5에 급성-만성 비율(acute-chronic ratio; ACR)을 적용하여 만성 HC5를 추정할 수 있다[27,28]. 이후 추정된 만성 HC5의 불확실성을 보완하기 위해 평가계수를 적용하여 PNEC를 산정할 수 있다. 평가계수는 1에서 5까지로 SSD 도시를 위한 독성자료가 충분한 경우 1, 대표성 부족 및 독성자료가 충분하지 않은 경우는 5를 적용할 수 있으며, 일반적으로 독성자료에 대한 최소 기준을 만족했으나 대표성이 부족한 경우 평가계수 3을 적용한다[29].
따라서, 본 연구에서는 계산된 급성 독성 값 및 미국 환경 보호청에서 제공하는 SSD tool box (https://www.epa.gov/chemical-research/species-sensitivity-distribution-ssd-toolbox)를 활용하여 대상 수계의 Cu 및 환경인자 모니터링 시간 별 HC5를 계산했으며, 미국 환경 보호청[30-32]에 보고된 Cu에 대한 담수 수생 생물종의 급성-만성 비율 3.22 및 평가계수 3을 적용하여 대상 수계의 시간 별 만성 Cu PNEC를 산정했다.
2.4. FMB를 활용한 생태독성학적으로 허용가능한 중금속 농도 산정FMB는 BLM 및 SSD를 통해 산출된 대상 수환경의 PNEC과 수환경 내 중금속 농도의 시간에 따른 변동을 반영하여 생태독성학적 허용가능 단일 중금속 농도를 산정할 수 있다[15]. FMB 계산식은 다음과 같다(식 5-10).
여기서, TUi 는 시간 i에서 수집된 단일 샘플에 대한 독성단위(toxic unit; TU)로, 수생생물이 수계 내 중금속에 의해 독성 영향을 받게 되는 정도를 식(5)를 통해 나타낸 값이며, TU가 1을 초과할 때, 수생생물에 대해 중금속의 독성이 나타날 수 있음을 의미한다. Mei는 시간 i에서 측정된 수계 내 중금속 농도(μg/L), IWQCi는 BLM 기반으로 산출된 순간 수질 기준(PNEC), EF는 목표초과빈도(3년에 1번, 1095일 중 하루, 0.0913%), TUEF는 TUi를 통해 산정된 목표초과빈도에서의 TU값, AF는 TUEF = 1을 만족하도록 하는 조정계수, ZEF는 표준정규분포에서 EF를 만족하는 Z-score, STU는 로그변환된 TUi의 표준편차, TUmedian는 TUi의 중앙값, Mei,comp는 EF를 준수하는 시간 i에서의 중금속 농도(μg/L), TUi,comp는 EF를 준수하는 시간 i에서의 TUi값, Memedian,comp는 EF를 준수하는 중금속 농도의 중앙값(μg/L), FMB는 EF를 넘지 않는 수준에서 발생가능한 가장 높은 수계 내 중금속 농도 즉, 생태독성학적으로 허용가능한 단일 중금속 농도이다. 본 연구에서는 대상 수계의 시간 별 Cu PNEC를 IWQCi로 사용했으며, 계산된 FMB를 대상 수계의 생태독성학적 허용가능 Cu 농도로 결정했다.
3. 결과 및 고찰3.1. 시계열 자료 수집 결과BLM 기반 생태독성학적 허용가능 중금속 농도 산정 절차 적용의 예로서, BLM 계산을 위한 중금속 농도, 환경인자 자료 및 FMB 적용을 위한 최소기준을 만족하는 노르웨이 Numedalslågen강의 2017년에서 2023년까지의 수질 특성 시계열 자료를 Fig. 2에 나타냈다. 대상 수계의 Cu, Ca, DOC, pH, 온도의 범위는 각각 0.33 μg/L-2.28 μg/L, 2.37 mg/L-5.12 mg/L, 0 mg/L-8.90 mg/L, 6.44- 7.05, 0.1℃-20.2℃이다. 검출 한계 미만으로 조사된 대상 수계의 DOC 농도(2017년 2월 자료)는 미국 환경 보호청(1990) [33] 및 식품의약품안전처(2015) [34]에 따라 0으로 가정했다.
3.2. BLM 및 종민감도분포를 활용한 만성 Cu PNEC 산정 결과수질 특성 시계열 자료 및 Visual MINTEQ 3.1을 통해 계산된 중금속 및 환경인자의 활성도와 조사된 BLM 매개변수를 수생생물 별 BLM 식에 적용하여 시간 별 EC50[Cu]T를 예측했다(Fig. 3). 수생생물 별 EC50[Cu]T의 범위는 물벼룩, 잉어, 무지개송어, 조류(Pseudokirchneriella subcapitata, Chlorella vulgaris, Chlamydomonas reinhardtii) 각각 0.80 μg/L-126.96 μg/L, 0.88 μg/L-130.87 μg/L, 1.12 μg/L-147.10 μg/L, 1.50 μg/L-237.15 μg/L, 8.78 μg/L-488.40 μg/L, 6.26 μg/L-426.40 μg/L으로 나타났다. 수생생물 별 EC50[Cu]T는 수질 특성 모니터링 시간에 따라 서로 다른 값을 나타냈으며, 이는 시간에 따른 환경인자 변화의 영향으로 추정된다.
De Schamphelaere et al. (2002) [3]은 유럽 5개국 14개의 수계를 대상으로 한 물벼룩 Cu 생태독성실험을 수행했으며, 산정된 물벼룩에 대한 Cu EC50은 35.2 μg/L-792 μg/L으로 대상 수계들의 서로 다른 수질 내 환경인자에 따라 Cu에 대한 EC50의 변동성이 있음을 확인한 바 있다. Sciera et al. (2009) [35]는 수계 내 환경인자의 변화에 따라 잉어에게 미치는 Cu 독성의 변동성을 확인하기 위해 DOC, pH, 경도 조건 변화에 따른 Cu 독성실험을 수행한 바 있으며, 산정된 Cu 반수치사농도(lethal concentration 50%; LC50)는 2.9 μg/L-427.3 μg/L로 확인한 바 있다. Adekunle et al. (2021) [36]은 수계 내 Cu 독성 감지가 가능한 부유형 미생물 연료전지 기반의 바이오 센서를 통해 Cu로 오염된 캐나다 온타리오주 부근의 Junction Creek 하천의 Garson 지점을 대상으로 60일간의 Cu 독성 모니터링을 수행한 바 있으며, 대상 수계의 시간에 따른 환경인자의 변화에 따라 미생물들의 호흡 및 대사 활동 억제 반응을 통해 수계 내 Cu의 독성을 나타내는 출력전압 저하 정도가[37-40] 약 0 mV-800 mV로 변동됨을 확인한 바 있다.
Fig. 4은 수생생물 별 EC50[Cu]T 결과와 Ca, DOC 및 pH, 온도 간의 선형관계를 나타낸다. DOC와 EC50[Cu]T는 가장 높은 양의 선형관계를 나타냈다(R2 = 0.94-0.98). DOC 농도 증가에 따른 EC50[Cu]T의 증가는 수생생물에 대한 Cu 독성 영향의 감소를 의미하며, 이러한 경향은 DOC 농도 변화에 따른 Cu 독성영향을 평가한 이전 보고된 문헌들에서도 관찰된 바 있다[1,11,22,42]. DOC는 Cu2+와 복합체를 형성하여 생물학적으로 이용가능한 Cu의 감소를 유발할 수 있다. 이와 유사하게 Ca2+ 또한 BL을 두고 Cu2+와 경쟁하여 수생생물에 대한 Cu 독성 영향을 감소시킬 수 있으나[11], Ca와 EC50[Cu]T는 낮은 선형관계(R2 < 0.04)를 나타냈다. 이는 DOC와 Ca2+의 복합체 형성의 영향으로 추정된다. Jeong et al. (2022) [11] 은 DOC 및 Ca2+ 변화 조건에서 BLM을 활용하여 Daphnia magna에 대한 Cu 독성 영향을 예측한 바 있다. DOC와 Ca2+이 공존하고 있는 상황에서 Ca2+ 농도를 증가시킴에도 불구하고 예측된 Cu 독성 영향은 유사했으며, 이는 DOC와 Ca2+의 복합체 형성의 영향으로 추정한 바 있다. 따라서, 본 연구에서 나타난 EC50[Cu]T와 Ca2+의 낮은 선형관계는 수계 내 DOC 및 Ca2+의 복합체 형성으로 인해 수생생물에 대한 Cu독성에 미칠 수 있는 Ca2+의 영향이 감소했기 때문으로 추정된다. EC50[Cu]T와 pH의 경우, 낮은 선형관계(R2 = 0.03-0.23)를 나타냈으며, pH의 감소는 수계 내 H+의 증가로 인해 경쟁효과가 증가하고 Cu의 독성 영향의 감소를 유발할 수 있다[43]. 온도의 경우 EC50[Cu]T와 낮은 선형관계(R2 < 0.02)를 나타냈다.
3.3. FMB를 활용한 생태독성학적 허용가능 Cu농도 산정Cu에 대한 시간 별 PNEC는 대상 수계의 Cu 농도 및 환경인자의 시간에 따른 변동에 따라 서로 다른 결과를 나타냈으며, 이를 고려한 단일 생태독성학적 허용가능 Cu농도를 산정하기 위해 FMB를 활용했다. 결과적으로, 대상 수계에 대한 단일 생태독성학적 허용가능 Cu농도는 1.15 μg/L이다(Fig. 7, Table 2). Jeong et al. (2022) [11]은 수생생물 보호를 위한 Cu농도 산정 및 비교를 위해 171종의 수생생물에 대한 총 2068개의 Cu 만성 독성 자료를 미국 환경 보호청의 독성자료 데이터베이스인 ECOTOX에서 수집하고 SSD 도시를 수행한 결과 HC5는 약 1.14 μg/L로 산정되었으며, Arambawatta-Lekamge et al. (2021) [44]은 열대 담수 생태계의 수생생물들에 대한 Cu 보호 농도 산정을 위해 5 분류군 6종의 수생생물에 대한 독성 실험을 수행했으며, 독성 실험 결과와 ECOTOX에서 수집된 27종의 Cu 독성 자료를 활용하여 SSD를 수행한 결과 HC5는 0.84 μg/L으로 산정됐다. 또한 Ryan et al. (2018) [12]는 FMB 접근법을 활용하여 미국 애리조나 주의 Agua Fria강 및 네브래스카 주의 Platte 강을 대상으로 수생생물 보호를 위한 Cu농도를 산정했으며, 각각 73.4 μg/L 및 23.9 μg/L로 나타났다. 호주 및 뉴질랜드의 경우 95% 수생생물 보호를 위한 담수 Cu 수질 기준은 1.4 μg/L이다[45].
수집된 수생생물 보호를 위한 다양한 담수 Cu 수질기준은 0.84 μg/L-73.4 μg/L이며, 본 연구에서 산정된 결과는 다소 높은 보호 수준을 제시하고 있다. 국가 또는 대상 수계 마다 상이한 수생생물 보호 기준이 도출되는 것은 서로 다른 대상 수계의 생물종, 수질 특성으로 인한 차이에 의해 발생할 수 있으며, 이를 고려한 현장 특이적(site-specific)인 생태독성학적 허용가능 중금속 농도 산정이 필요하다.
4. 결 론본 연구에서는, 대상 수계의 시간에 따른 중금속 농도 및 환경인자의 변화와 다양한 수생생물에 대한 중금속의 독성영향을 고려하여 BLM 기반 생태독성학적 허용가능 중금속 농도의 산정방법을 제시했다. BLM의 종 특이적, 특정 시점의 중금속 독성 예측이라는 한계를 보완하기 위해 SSD 및 FMB 접근방식을 활용했고, 적용 예로서, 노르웨이 Numedalslågen 강을 대상으로 생태독성학적 허용가능 Cu 농도를 산정했으며, 그 결과 1.15 μg/L로 나타났다. 제시한 산정 절차는 대상 수계에 대한 장기간 수질 모니터링을 기반으로 하며, 수계의 중금속 및 환경인자 농도의 급격한 변화를 유발할 수 있는 퇴적물 재부유(resuspension), 풍수기 및 홍수기와 같은 특정 시점을 반영하여 대상 수계의 수생생물을 보호할 수 있는 현장 특이적 중금속 농도 산정에도 활용될 수 있을 것으로 기대된다.
AcknowledgmentsThis work was supported by the Korea Environmental Industry & Technology Institute (KEITI) through the Aquatic Ecosystem Conservation Research Program, funded by the Korea Ministry of Environment (MOE)(2021003050001).
NotesDeclaration of Competing Interest The authors declare that they have no known competing interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 1.Schematic overview of the methodology used for estimating ecotoxicologically acceptable metal concentrations. 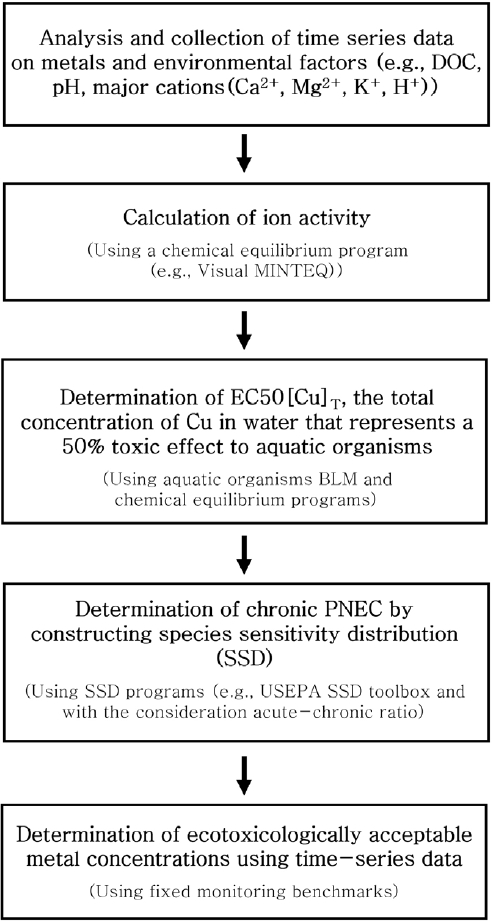
Fig. 2.Time series data on water quality characteristics (Cu, Ca, DOC, pH, and temperature) of Numedalslågen River, Norway (2017-2023)[33]. 
Fig. 3.Total concentrations of Cu in the water system (EC50[Cu]T), which exhibit a 50% toxic effects on various aquatic organisms calculated using the biotic ligand models. 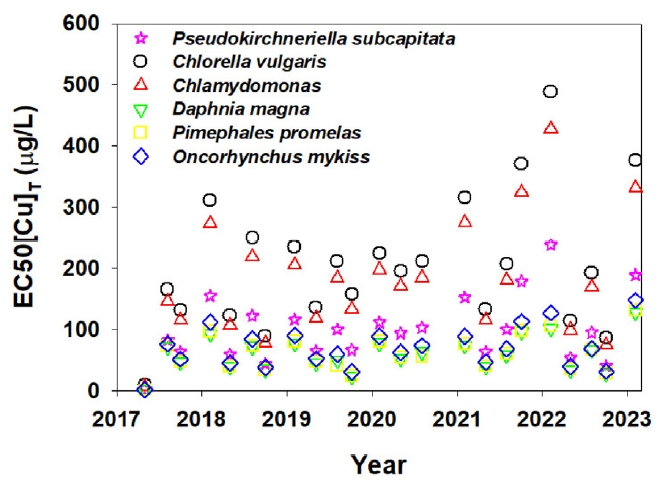
Fig. 4.Linear relationship between the total concentration of Cu in the water system (EC50[Cu]T) and environmental factor, which exhibit a 50% toxic effects on various aquatic organisms calculated using a biotic ligand models. (a): Represents the linear relationship between EC50[Cu]T for each aquatic organism calculated through DOC and BLM, (b): Ca and EC50[Cu]T, (c): pH and EC50[Cu]T, (d): temperature and EC50[Cu]T. 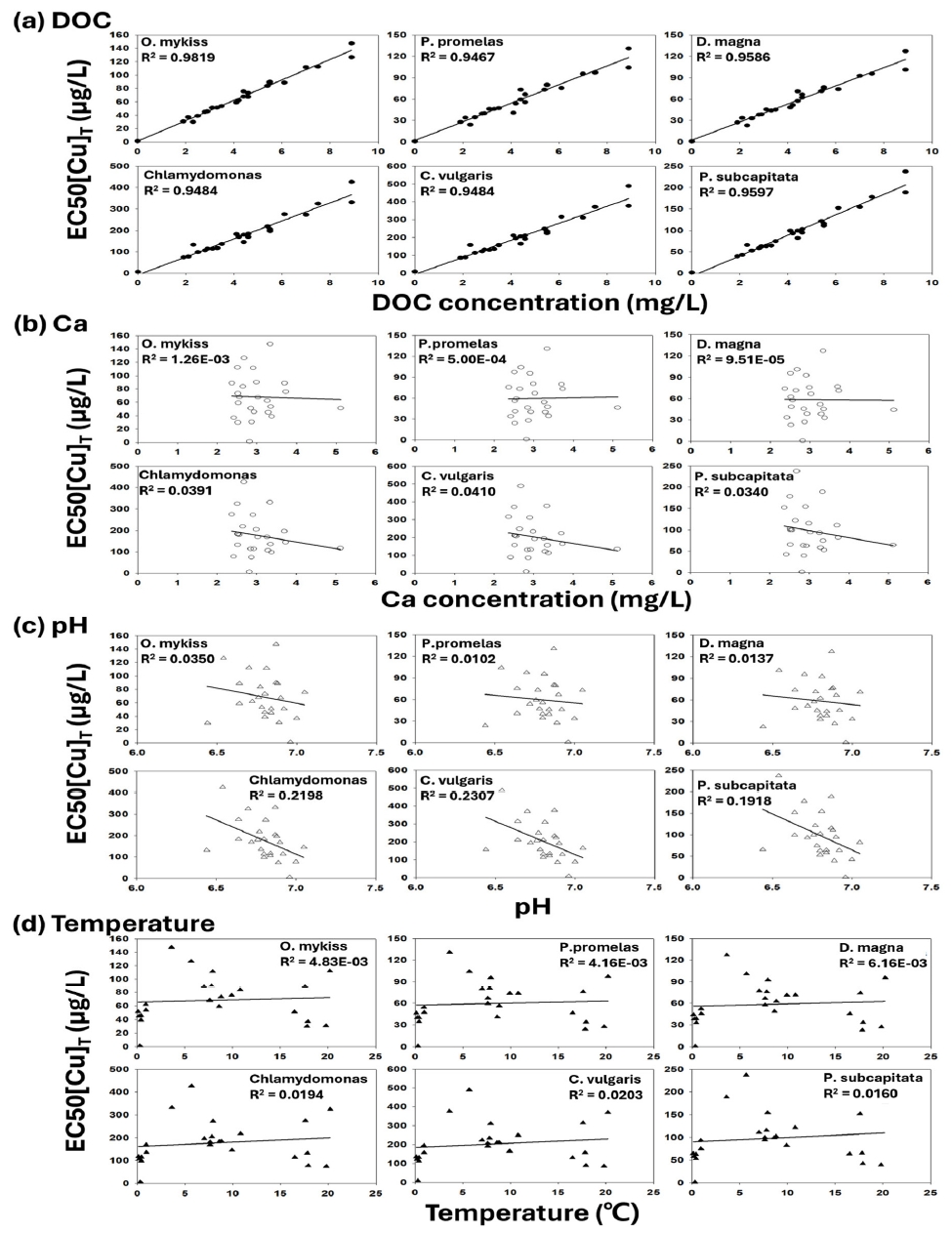
Fig. 5.Species sensitivity distributions calculated from BLM-drived EC50[Cu]T values for six different species in water. Its distribution in generated from time-series water quality characteristics data. 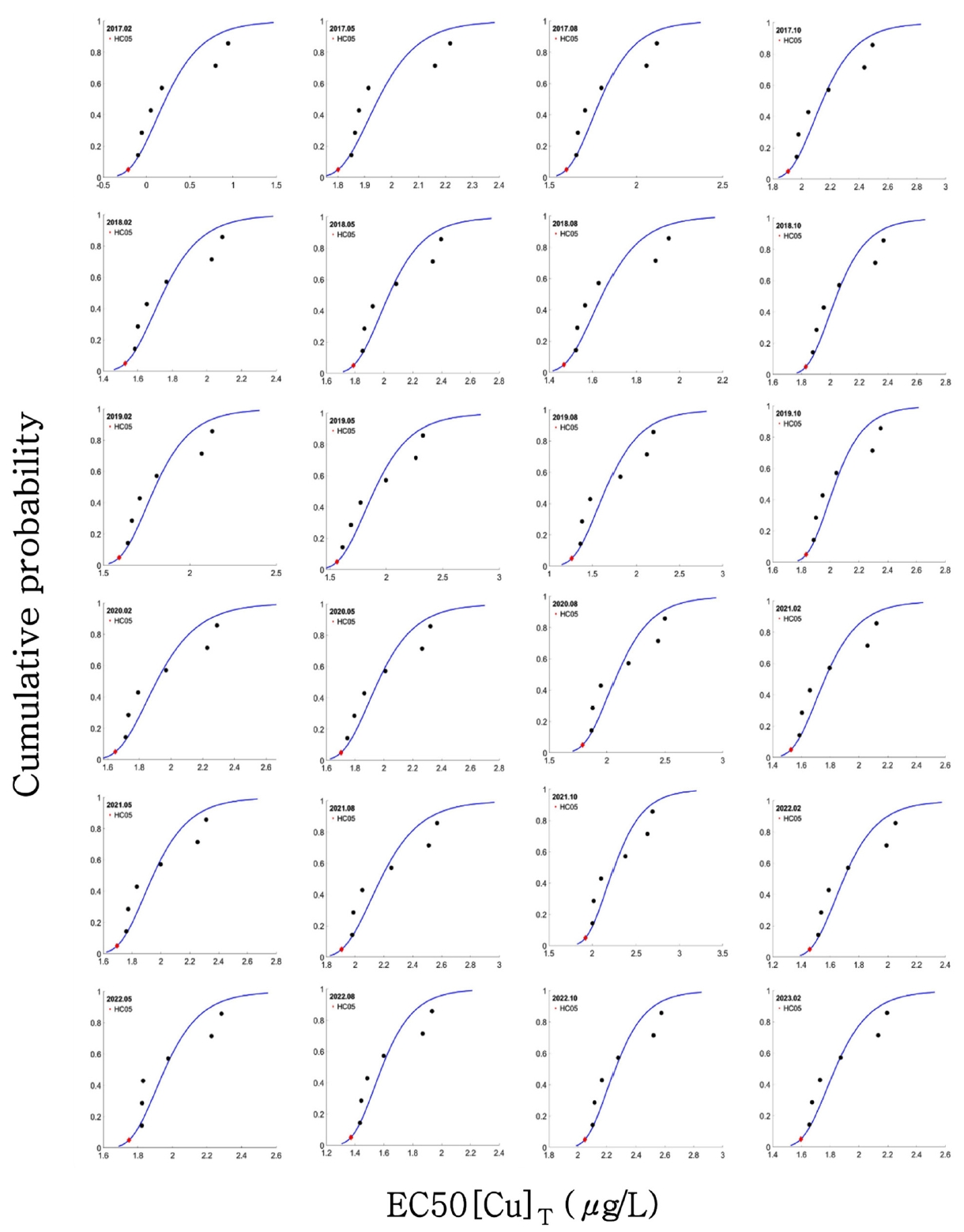
Fig. 6.Predicted no-effect concentration obtained from species sensitivity with acute-chronic ratio and adjustment factor by each monitoring time." 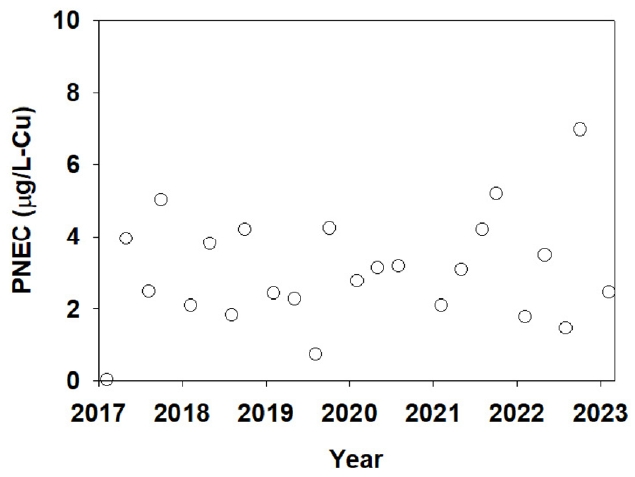
Fig. 7.Ecotoxicologically acceptable Cu concentration determined through fixed monitoring benchmarks (FMB). TUi is the toxic unit (TU) for a single sample collected at time i, and when it exceeds 1, it means that the heavy metal may be toxic to aquatic organisms. 
Table 1.Biotic ligand model parameters for calculating total concentration of Cu in the water system (EC50[Cu]T).
Table 2.Calculated through Equation 5-10 Toxic unit value at time i (TUi), TU at exceedance frequency (TUEF), Adjustment factor (AF), Total Cu concentration in compliance with exceedance frequency (Cui,comp), Toxic unit in compliance with exceedance frequency (TUi, comp), Fixed monitoring benchmark (FMB). References1. D.M. Di Toro, H.E. Allen, H.L. Bergman, J.S. Meyer, P.R. Paquin, R.C. Santore, Biotic ligand model of the acute toxicity of metals. 1. Technical Basis, Environ. Toxicol. Chem., 20(10), 2383-2393(2001).
2. B. Jeong, J. An, K. Nam, Time series analysis for determining ecologically acceptable Cu concentration from species sensitivity distribution with biotic ligand models in soil pore water, Environ. Eng. Res., 26(2), 14-21(2021).
3. K.A. De Schamphelaere, D.G. Heijerick, C.R. Janssen, Refinement and field validation of a biotic ligand model predicting acute copper toxicity to Daphnia magna, Comp. Biochem. Physiol. C Toxicol. Pharmacol., 133(1-2), 243-258(2002).
4. Y.-J. An, S.W. Kim, J. Moon, S.-W. Jeong, R.-Y. Kim, J.-K. Yoon, T.-S. Kim, An introductory research for development of soil ecological risk assessment in korea, J. Korea Soc. Environ. Eng., 39(6), 348-355(2017).
5. J. An, B. Jeong, K. Nam, Extension of biotic ligand model to account for the effects of pH and phosphate in accurate prediction of arsenate toxicity, J. Hazard. Mater., 385, 121619(2020).
6. W.-Q. Liang, M. Xie, Q.-G. Tan, Making the biotic ligand model kinetic, easier to develop, and more flexible for deriving water quality criteria, Water Res., 188, 116548(2021).
7. S. Niyogi, C.M. Wood, Biotic ligand model, a flexible tool for d eveloping s ite-specific water quality guid elines for metals, Environ. Sci. Technol., 38(23), 6177-6192(2004).
8. V.I. Slaveykova, K.J. Wilkinson, Predicting the bioavailability of metals and metal complexes: Critical review of the biotic ligand model, Environ. Chem., 2(1), 9-24(2005).
9. J.C. Gondek, R.W. Gensemer, C.A. Claytor, S.P. Canton, J.W. Gorsuch, Framework for derivation of water quality criteria using the biotic ligand model: Copper as a case study, Integr. Environ. Assess. Manag., 14(6), 736-749(2018).
10. J. McConaghie, A. Matzke, Technical Support Document: An evaluation to derive statewide copper criteria using the biotic ligand model, Oregon Department of Environmental Quality pp. 1-159(2016).
11. B. Jeong, J. An, K. Nam, Derivation of ecotoxicologically acceptable Cu concentrations in the Han River basin, Korea with emphasis on Ca concentration and instantaneously changing water characteristics, Sci. Total Environ., 828, 154495(2022).
12. A. Ryan, R. Santore, C. Delos, Application of a fixed monitoring benchmark approach to evaluate attainment of time variable water quality criteria: Copper biotic ligand model as a case study, Integr. Environ. Assess. Manag., 14(6), 722-735(2018).
13. L. Posthuma, T.P. Traas, G.W. Suter, General introduction to species sensitivity distributions, Species sensitivity distributions in ecotoxicology, Lewis, Boca Raton, FL, USA pp. 3-11(2002).
14. J. An, S. Jeong, H. S. Moon, K. Nam, Assessment of risk based pollution level of Pb and Cd in metal contaminated soils using biotic ligand model, J. Soil Groundwater Environ., 16(4), 23-30(2011).
15. K. Sorgog, M. Kamo, Quantifying the precision of ecological risk: Conventional assessment factor method vs. species sensitivity distribution method, Ecotoxicol. Environ. Saf., 183, 109494(2019).
16. T. Naaz, A. Kumar, A. Vempaty, N. Singhal, S. Pandit, P. Gautam, S.P. Jung, Recent advances in biological approaches towards anode biofilm engineering for improvement of extracellular electron transfer in microbial fuel cells, Environ. Eng. Res., 28(5), 220666(2023).
17. HydroQual, Calculation of BLM fixed monitoring benchmarks for copper at selected monitoring sites in Colorado. Mahwah (NJ). Prepared for US Environmental Protection Agency. pp 1-512008.
19. L. Monnin, P. Ciffroy, J.M. Garnier, J.P. Ambrosi, O. Radakovitch, Remobilization of trace metals during laboratory resuspension of contaminated sediments from a dam reservoir, J. Soils Sediments., 18(7), 2596-2613(2018).
20. R.C. Santore, D.M. Di Toro, P.R. Paquin, H.E. Allen, J.S. Meyer, Biotic ligand model of the acute toxicity of metals. 2. Application to acute copper toxicity in freshwater fish and Daphnia, Environ. Toxicol. Chem., 20(10), 2397-2402(2001).
21. A. Crémazy, C.M. Wood, T.Y.T. Ng, D.S. Smith, M.J. Chowdhury, Experimentally derived acute and chronic copper biotic ligand models for rainbow trout, Aquat. Toxicol., 192, 224-240(2017).
22. K.A. De Schamphelaere, C.R. Janssen, Bioavailability models for predicting copper toxicity to freshwater green microalgae as a function of water chemistry, Environ. Sci. Technol., 40(14), 4514-4522(2006).
23. J. Park, S.D. Kim, Derivation of predicted no effect concentrations (PNECs) for heavy metals in freshwater organisms in Korea using species sensitivity distributions (SSDs), Minerals., 10(8), 697(2020).
24. National Institute of Environmental Research Notice No. 2021-13, Regulations on specific methods of chemical risk assessment, etc. [Appendix 4] Minimum data requirements for using species sensitivity distribution (related to Article 6, Paragraph 6, Item 2), (2021).
25. H. Wigger, D. Kawecki, B. Nowack, V. Adam, Systematic consideration of parameter uncertainty and variability in probabilistic species sensitivity distributions, Integr. Environ. Assess. Manag., 16(2), 211-222(2020).
26. K.S. Smith, L.S. Balistrieri, A.S. Todd, Using biotic ligand models to predict metal toxicity in mineralized systems, Appl. Geochemistry., 57, 55-72(2015).
27. J. Chung, D.S. Hwang, D.H. Park, Y.J. An, D.H. Yeom, T.J. Park, J. Choi, J.H. Lee, Derivation of acute copper biotic ligand model-based predicted no-effect concentrations and acute-chronic ratio, Sci. Total Environ., 780, 146425(2021).
28. K.V. Brix, D.K. DeForest, W.J. Adams, Assessing acute and chronic copper risks to freshwater aquatic life using species sensitivity distributions for different taxonomic groups, Environ. Toxicol. Chem., 20(8), 1846-1856(2001).
29. B. Lee, B. Lee, P. Kim, H. Yoon, Ecological risk assessment of lead and arsenic by environmental media, J. Environ. Health Sci., 46(1), 1-10(2020).
30. U.S. Environmental Protection Agency, Aquatic Life Ambient Freshwater Quality Criteria - Copper; EPA/822/R-07/001, Office of Water: Washington, DC, pp 1-204(2007).
31. K.V. Brix, D.K. DeForest, L. Tear, M. Grosell, W.J. Adams, Use of multiple linear regression models for setting water quality criteria for copper: A complementary approach to the biotic ligand model, Environ. Sci. Technol., 51(9), 5182-5192(2017).
32. D.K. DeForest, R.W. Gensemer, E.J. Genderen, V. Genderen, J.W. Gorsuch, Protectiveness of water quality criteria for copper in western United States waters relative to predicted olfactory responses in juvenile Pacific salmon, Integr. Environ. Assess. Manag., 7(3), 336-347(2011).
33. USEPA, Guidance for Data Useability in Risk Assessment, EPA/540/G-90/008 (1990).
34. Ministry of food and drug safety, Guidelines for Completion of Hazard Assessment Report, (2015).
35. K.L. Sciera, J.J. Isely, J.R. Tomasso, S. Klaine, Influence of multiple water-quality characteristics on copper toxicity to fathead minnows (Pimephales promelas), Environ. Toxicol., 23(12), 2900-2905(2004).
36. A. Adekunle, C. Rickwood, B. Tartakovsky, On-line monitoring of water quality with a floating microbial fuel cell biosensor: field test results, Ecotoxicol., 30, 851-862(2021).
37. T. Naaz, A. Kumar, A. Vempaty, N. Singhal, S. Pandit, P. Gautam, S.P. Jung, Recent advances in biological approaches towards anode biofilm engineering for improvement of extracellular electron transfer in microbial fuel cells, Environ. Eng. Res., 28(5), 220666(2023).
38. S.P. Jung, S. Son, B. Koo, Reproducible polarization test methods and fair evaluation of polarization data by using interconversion factors in a single chamber cubic microbial fuel cell with a brush anode, J. Clean. Prod., 390, 136157(2023).
39. D. Yu, L. Bai, J. Zhai, Y. Wang, S. Dong, Toxicity detection in water containing heavy metal ions with a self-powered microbial fuel cell-based biosensor, Talanta., 168, 210-216(2017).
40. S. Naik, S.E. Jujjavarapu, Self-powered and reusable microbial fuel cell biosensor for toxicity detection in heavy metal polluted water, J. Environ. Chem. Eng., 9(4), 105318(2021).
41. J.D. Cuppett, S.E. Duncan, A.M. Dietrich, Evaluation of copper speciation and water quality factors that affect aqueous copper tasting response, Chem. Senses., 31(7), 689-697(2006).
42. K.J. Kramer, R.G. Jak, B. van Hattum, R.N. Hooftman, J.J. Zwolsman, Copper toxicity in relation to surface water-dissolved organic matter: Biological effects to Daphnia magna, Environ. Toxicol. Chem., 23(12), 2971-2980(2004).
44. S.H. Arambawatta-Lekamge, A. Pathiratne, I.V.N. Rathnayake, Sensitivity of freshwater organisms to cadmium and copper at tropical temperature exposures: Derivation of tropical freshwater ecotoxicity thresholds using species sensitivity distribution analysis, Ecotoxicol. Environ. Saf., 211, 111891(2021).
45. ANZG, Australian and New Zealand guidelines for fresh and marine water quality. Australian and New Zealand Governments and Australian state and territory governments, Canberra ACT, Australia, https://www.waterquality.gov.au/anz-guidelines (2020)
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||