|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesAn economical DSA that can be used for a longer period of time and reduce the amount of precious Ru metal required in preparing the electrode was tried to be developed by using an ionic liquid instead of the alcohols as a solvent for electrode catalyst coating when preparing the DSA and comparing the performance. In addition, the possibility of green hydrogen production using ammonia was investigated by examining the possibility of oxidation of non-aqueous ammonia with the fabricated DSA electrode.
Methods1, 2 and 3 mg/cm2 RuO2 electrodes were prepared using butanol and imidazolium-based ionic liquid (HMIM)HSO4 as a solvent for electrode coating. To optimize conditions, the electrodes prepared using butanol and ionic liquid were compared by evaluating physical and electrochemical properties. SEM-EDS and XRD were used for evaluating physicochemical properties and cyclic voltammetry was used to investigate the possibility of oxidation of non-aqueous ammonia and to compare the electrochemical properties.
Results and DiscussionThrough SEM-EDS measurement before and after the accelerated life time test, it was confirmed that there was a difference depending on the solvent, but in al electrodes, the cracks on the surface before the accelerated life test was desorbed and coated Ru was desorbed, revealing the matrix of the electrode. XRD analysis showed that crystallinity of the butanol solvent electrode was smaller than that of the ionic solvent electrode. Through an accelerated life test for 1, 2, and 3 mg/cm2 RuO2 electrodes by solvent, 1 mg/cm2 RuO2 produced using an ionic solution was the shortest, ending in 16 hours. The electrode 3 mg/cm2 RuO2 was terminated at 201 h, showing the longest lifetime. Through cyclic voltammetry, all RuO2 electrodes fabricated confirmed the possibility of 7 N non-aqueous ammonia oxidation and the active area of the electrodes fabricated using butanol showed a higher total electrochemical charge than the electrodes fabricated using an ionic solution.
ConclusionAs the DSA solvent affects the crystallinity of the electrode, it was shown that it affects the physical life of the electrode through the accelerated life test results. Through cyclic voltammetry, the RuO2 electrode confirmed the possibility of oxidation of 7 N non-aqueous ammonia. Through comparison of ruthenium loading amount, accelerated life test, and electrochemical total charge, it is considered that the most economical electrode is a butanol solvent 2 mg/cm 2 RuO2 electrode.
요약목적DSA 전극 제조 시 전극 촉매 코팅을 위한 용매로 기존의 알코올 류 대신 이온성 용액을 이용하여 전극을 제작하고 성능을 비교함으로써 소요되는 Ru 귀금속 양을 줄이고 보다 오래 사용 할 수 있는 경제성 있는 DSA 전극을 개발하고자 하였다. 또한 제작한 전극으로 비 수성 암모니아의 산화 가능성을 검토하여 DSA 전극을 이용한 암모니아 이용 그린 수소 생산의 가능성을 알아보고자 하였다.
방법기존의 부탄올과 imidazolium 계열의 이온성 용액 (HMIM)HSO4을 전극의 코팅을 위한 용매로 사용하여 각 1, 2, 3 mg/cm2 RuO2 전극을 제작하여 물리화학적 성능 비교와 전기화학적 성능 비교를 통해 최적의 조건을 도출하였다. SEM-EDS, XRD 분석을 통해 표면 분석, 결정화도를 비교하였고 0.5 M H2SO4를 전해질로 가속수명시험을 통해 전극의 수명을 비교하고자 하였다. 또한 순환전압전류법 (cyclic voltammetry; CV)을 시행하여 비 수성 암모니아의 산화 가능성과 용매에 따른 전극 별 전기화학적 활성을 비교하였다.
결과 및 토의가속수명시험 전, 후 SEM-EDS 측정을 통해 용매에 따른 차이가 있지만 모든 전극에서 가속수명시험 전 표면에 있었던 크랙이 시험 후 코팅된 Ru 이 탈착 되어 전극의 모체가 드러난 것을 확인하였다. XRD 분석을 통해 부탄올 용매 전극의 결정화도가 이온성 용액 용매 전극의 결정화도보다 작은 것으로 나타났다. 용매 별 1, 2, 3 mg/cm2 RuO2 전극을 대상으로 가속수명시험을 진행한 결과 이온성 용액을 이용하여 제작한 1 mg/cm2 RuO2 전극이 16시간 만에 종료되어 가장 짧았고, 부탄올을 이용하여 제작한 3 mg/cm2 RuO2 전극이 201시간에 종료되어 가장 긴 수명을 보였다.순환전압전류법을 통해 제작한 모든 RuO2 전극이 7 N 농도의 비 수성 암모니아에 대한 산화 가능성을 확인하였으며, 전기화학적 총 전하량을 비교한 결과 부탄올을 이용하여 제작한 전극의 활성 면적이 이온성 용액을 이용하여 제작한 전극보다 더 큰 값을 나타내는 것을 확인하였다.
1. 서 론탈 탄소 기조에 따른 경제성장과 에너지의 원천이 수소로 바뀜에 따라, 경제성과 환경 친화적인 수소 에너지 생산 방법이 필요하게 되었다[1]. 암모니아를 분해하여 수소 에너지 캐리어로 저장 및 운송에 이용하거나 암모니아 분자에 포함된 수소를 이용해 수소를 생산하는 방법은 액화 수소를 이용하는 방법, 액상유기수소 운반체방법보다 고밀도로 운반이 가능하고, 현재의 암모니아 관련 인프라를 활용할 수 있다는 장점 등 보다 현실적인 방법으로 떠오르고 있다[2]. 암모니아를 이용한 수소 생산 시 양극에서는 암모니아가 분해되어 질소가 발생하고, 음극에서는 수소가 발생하게 된다[3].
그간의 불용성 전극 (dimensionally stable anodes; DSA)은 Ru, Ir 등 희귀 금속을 Ti 기판에 코팅[4]을 통해 전극의 전기화학적 활성 층(active layer) 을 형성하여 산화 환원 반응을 통해 작동한다. 부식이 적고 반응성이 좋기 때문에, 폐수 속 암모니아를 분해하는 데 있어 우수한 성능을 입증하였고[5], 수전해에도 적용하여 수소를 생산하는 방안에 활용되기도 한다. 그러나 이는 수용성 용액을 기반으로 한 에너지 생산 방법으로, 수용액 상태의 암모니아를 분해하여 수소를 얻는 방법은 암모니아를 지지 전해질로 이용할 뿐 암모니아 분자 속의 수소를 이용하는 것이 아니기 때문에 진정한 암모니아 분해 수소 생산이라고 보기 어렵다는 단점을 갖고 있다[2]. 이러한 이유로 액화 암모니아를 이용한 수소를 생산하는 연구에서는 고온 혹은 고압 환경하에 주로 백금을 액화 암모니아 촉매로 활용한다[6].
불용성 전극을 제작하려면 전구체의 분산용 용매가 필요하다. 용매는 전구체 물질을 혼합해주면서 소성 시 용매 물질은 잘 휘발되고, 전구체 물질을 전극에 잘 부착시켜야 한다. 이러한 이유로 보통 알코올 류를 사용하며, 염산 등을 섞기도 한다[7-9]. 최근 사회적으로 기업들의 ESG 경영에 대한 관심이 많아지면서 전극 제조 분야에서도 ‘그린 용매(기능성 용매)’ 를 이용하여 전극의 제조나 전해질로 활용하여 기존 유기 용매의 인화성, 인체 피 독성을 줄이고 환경부하를 줄이려는 연구가 진행되고 있다[10]. 그린 용매 란, 이온성 용액 (ionic liquids, ILs)을 지칭하는 것으로 유기성 음이온(organic cation) 이 유기성 혹은 무기성 양이온과 아주 약한 결합으로 인해 증기압이 거의 없는 물질로, 휘발성이 거의 없고, 열 적안정성이 높으며, 탄화수소화물에 잘 섞이지 않고, 다양한 무기 및 유기금속 화합물을 쉽게 용해시키는 기능을 갖고 있다. 또한 pH를 용이하게 조절할 수 있는 등 독특한 물리화학적 성질을 갖고 있다[11].
이온성 용액의 종류는 hydrogen sulfate, alkyl sulfate, nitrate 등의 음이온 계열과 imidazolium, benzimidazolium, phosphonium 등의 양이온 계열로 구분한다. 특히 imidazolium 계열 이온성 용액은 산화, 환원에서의 안정성이 높고, 합성이 쉬워 가장 많은 연구가 진행되고 있다[12]. 예로, 전해질로써 이온성 용액을 활용하거나 폐수처리 용 전극으로의 연구는 많이 진행되고 있다[13-15]. 반면 DSA 를 이용한 암모니아 수소 에너지 촉매로의 연구는 부족한 실정이다.
그러므로 본 연구는 imidazolium 계열 이온성 용액 (HMIM)HSO4을 용매로 제조한 전극과 기존의 부탄올을 용매로 이용한 RuO2 전극을 제작하여 전극의 표면 분석과 가속수명시험을 통해 용매에 따른 전극의 물리적 성능을 비교하고, 순환전압전류주사법(cyclic voltammetry; CV)을 통해 RuO2 전극으로 비수성(non-aqueous) 암모니아 산화 가능성을 검토 하고, DSA 전구체 분산용 용매의 영향에 따른 전기화학적 활성을 비교하여 전구체 분산용 용매의 우수한 조건을 도출하고자 하였다.
2. 실험 재료 및 방법2.1. DSA (Dimensionally stable anodes; DSA) 제조모든 전극의 모체는 Ti plate(1 mm, 1×4 m2) 99.5%를 이용하였다. Ti plate를 sand blast로 이용하여 전처리 후 10% HCl 용액으로 10분간 에칭(etching)하였다. 부탄올을 이용한 전극은 부탄올과 0.5 M RuCl3(RuCl3․ nH2O, sigma-aldrich, MW 20743)을 하루 이상 충분히 교반하여 Ti Plate에 brushing 기법으로 코팅하였다. 코팅한 전극을 건조기와 회화로를 이용해 각각 105°C에서 건조, 350°C에서 열처리하여 1, 2, 3 mg/cm2 RuO2 전극을 제작하였다. 최종적으로 회화로를 이용하여 350°C에서 1시간 가열 및 냉각을 통해 RuO2 /Ti 형태의 전극을 제작하였다. 이온성 용액을 이용한 전극 제작은 상온 상태에서 고체 형태인 (HMIM)HSO4(C4H6N2․ H2SO4, sigma-aldrich, MW 180.18)을 건조기를 이용하여 110°C, 12시간 가온 하여 액체 형태로 만들고 이온성 용액 속의 수분을 제거하였다[16]. 수분을 제거한 이온성 용액을 0.5 M RuCl3와 혼합 후 교반기를 이용해 하루 동안 80°C, 100 rpm으로 지속적인 교반을 하였다. 그 후 부탄올을 이용한 전극 제작과 같은 방식을 사용하였다. 이온성 용액을 이용하여 제작한 전극은 점도가 높아 건조기를 사용하지 않고 회화로를 이용하여 550°C, 5분간 가열 및 냉각을 반복하였고 최종적으로 550°C, 1시간 소성하여 제작하였다.
2.2. 가속수명시험 (Accelerated lifetime test; ALT)DSA의 수명은 사용 환경에 따라 다르기 때문에 실제 환경보다 가혹한 운전 조건에서 수명을 평가하는 가속수명시험을 진행하였다. 가속수명시험을 위해 정 전류 방식으로 인가전류 밀도를 1 A/cm2 로 하고, 기기(원아테크, WBC3000S)의 한계 전압인 10 V 도달 시 시험을 종료하도록 설정하였다. 전해질은 0.5 M H2SO4용액으로 했고 전극 반응에 의한 전해질 온도 상승 방지를 위해 항온조를 이용하여 온도를 18±0.5°C 로 유지하였다.
2.3. 전극의 표면 분석전극의 표면 구조는 scanning electronic microscopy(SEM), 전극 표면 금속 조성은 energy dispersive spectroscopy(EDS) 로 분석하였다. 전극의 X-ray diffraction(XRD)을 측정하였다. 20° ~ 90° 범위에서 0.02° 간격으로 0.2초마다 scan mode 로 측정하였고 결정화도 측정을 위해 JCPDS 로 측정하였고, origin 프로그램을 이용해 주 피크에 대한 반치전폭(full width at half maximum; FWHM) 을 구하여 전극의 입자 크기를 계산하였다.
2.4. 순환전압전류법 (Cyclic voltammetry; CV)아크릴로 제작한 120 ml 반응기에 3전극 실험을 실시하였다. 작업 전극은 부탄올 이용 제작 전극, 이온성 용액 이용 제작 전극 각 1, 2, 3 mg/cm2 으로 하였다. 상대 전극은 Pt plate(1*4 cm2 )으로 하였고, 기준 전극은 Ag/AgCl(3.5 M KCl) 로 하였다. 모든 전극은 테프론 테이프로 반응 면적을 조절하여 실제 반응 면적을 1*1 cm2 로 하였다. 전압 범위는 2 ~ -2 V, 주사 속도는 50 mV/s로 하였다. 전해질은 메탄올과 암모니아의 혼합 용액(7 N NH3 in MeOH, sigma-aldrich), 99.9% 메탄올(99.9% MeOH, sigma-aldrich), 99.9% 메탄올 용액에 3차 증류수를 이용하여 7 N water in MeOH 를 제작하였다.
3. 결과 및 고찰3.1. 가속수명시험 (Accelerated lifetime test; ALT) 을 통한 전구체 분산용 용매 영향 평가
Fig. 1는 부탄올을 이용하여 제작한 전극과 이온성 용액을 이용하여 제작한 1, 2, 3 mg/cm2 RuO2 으로, 가속수명시험을 시행한 결과이다. 모든 전극은 20초의 휴지 단계 이후 본 실험을 진행하였다. 전극들의 초기 전압은 3.37 V ~ 3.96 V으로, 6개 전극의 평균 초기 전압은 3.66 V로 시작 시 전압은 비슷한 것으로 나타났다. 그러나 전극의 종류에 따라 10 V에 도달(종료 시점)하는 시간이 가장 짧은 것은 16시간이었고 가장 긴 시간이 소요된 전극은 201시간으로 나타나 전극 제작 시 사용한 용매에 따라서 또는 루테늄 로딩량에 따라 차이를 보였다. 이온성 용액을 이용하여 제작한 전극으로 1 mg/cm2 RuO2 인 전극은 16시간 만에 종료되었고, 이를 제외한 5개의 전극은 전압이 조금씩 상승하다 20 ~ 22시간 사이 간헐적인 전압 상승이 있고난 뒤 서서히 전압이 상승하여 10 V에 도달하였다. 부탄올을 이용하여 제작한 전극은 루테늄 로딩량이 적을수록 가속수명시험 시간이 짧게 나왔다. 부탄올을 이용하여 제작한 전극 중 1 mg/cm2 RuO2 경우 40시간 경과 후 전압이 급격하게 상승 되었다. 2 mg/cm2 RuO2 , 3 mg/cm2 RuO2 전극의 경우 160시간 이상 안정적인 전압을 유지 하다가 표면의 루테늄 코팅이 조금씩 탈착 되면서 170시간 경과부터 전압이 조금씩 상승하기 시작하였다. 190시간 경과 후 루테늄 코팅이 반응 면적의 40% 이상이 탈착 되고 티타늄 모재가 전해질에 노출이 되면서 전압의 급격한 상승 후 부탄올을 이용하여 제작한 전극 중 2 mg/cm2 RuO2 전극이 199시간에서 종료되었고 3 mg/cm2 RuO2 전극은 200시간 40분에 10 V에 도달하였다. 이온성 용액을 이용하여 제작한 전극 또한 루테늄 로딩량이 적을수록 가속수명시험 시간이 짧은 경향을 보였다. 이온성 용액을 이용하여 제작한 전극 중 1 mg/cm2 RuO2 인 전극의 경우 시험 초기부터 10시간 경과까지 전압이 꾸준히 상승하다 여섯 개 전극 중 가장 먼저 10 V에 도달하였다. 그러나 타 연구에서 본 연구와 같은 이온성 용액으로 제작한 1.2 mg/cm2 RuO2 전극을 사용한 결과와 전극수명시험 결과 비교 시 루테늄 로딩량이 0.2 mg/cm2 적지만 본 연구의 1 mg/cm2 RuO2 전극의 수명이 2배 정도 길었다[16]. 2 mg/cm2 RuO2 전극의 경우 20 ~ 22시간 사이 가장 큰 폭의 전압 상승을 보였으나, 다시 전압 하강 후 41시간 만에 10 V에 도달하였다. 3 mg/cm2 RuO2 전극의 경우 실험 초기부터 80시간까지 안정적인 전압을 보이다가 83시간부터 전압이 상승하기 시작하여 89시간에 10 V에 도달하였다.
가속수명시험 결과 부탄올을 이용하여 제작한 전극과 이온성 용액을 이용하여 제작한 전극은 공통적으로 전극에 루테늄 함량이 많을수록 내구성이 높은 것으로 나타났으며 사용된 용매의 비교 시 부탄올을 이용하여 제작한 전극의 결과가 이온성 용액을 이용하여 제작 전극보다 더 오랜 수명을 보이면서 우수한 것으로 나타났다. 또한, 가속수명시험 동안 루테늄의 탈착으로 전해질이 모두 흑색을 띄는 것으로 보아 유관상으로도 촉매전극으로써 활성이 감소하는 것으로 판단할 수 있었다.
3.2. 전극의 표면 분석을 통한 전구체 분산용 용매 영향 평가가속수명시험 시행 전, 후 SEM-EDS 로 전극 표면의 변화를 관찰하였다. Fig. 2은 부탄올을 이용하여 제작한 1, 2, 3 mg/cm2 RuO2 전극의 가속수명시험 전 (좌), 후 (우) 모습이다. 가속수명테스트 시험 전 부탄올을 이용하여 제작한 전극의 표면은 머드 크랙(mud crack)이 형성되어 있다. 머드 크랙은 열분해 방식으로 제작한 전극에서 볼 수 있는 전형적인 흔적으로, 전해질과 반응 시 산화된 가스상 물질의 탈착을 쉽게 해주는 역할을 하는 것으로 알려져 있다[17,18]. 그러나 가속수명 시험 후 머드 크랙이 파괴되면서 sand blast 처리한 Ti 모재의 거친 표면만 남게 되었다.
Fig. 3는 이온성 용액을 이용하여 제작한 전극으로 1, 2, 3 mg/cm2 RuO2 전극의 가속수명시험 전 (좌), 후 (우) 모습이다. 부탄올을 이용하여 제작한 전극은 머드 크랙이 형성되어 있었다. 반면 이온성 용액을 이용하여 제작한 전극은 형태가 불분명한 크랙이 관찰 되었다. 가속수명시험 후 불분명한 크랙이 사라지면서 부탄올을 이용하여 제작한 전극과 비슷한 거친 표면을 보였다.
Table 1의 EDS mapping 분석 결과를 통해 가속수명시험 전, 후 전극 표면의 원소 분포에서도 차이가 났다. 가속수명시험 시행 전 부탄올을 이용하여 제작한 전극으로 1, 2, 3 mg/cm2 RuO2 전극의 평균 루테늄 비율이 80.02%, 이온성 용액을 이용하여 제작한 전극으로 1, 2, 3 mg/cm2 RuO2 인 전극의 평균 루테늄 비율은 78.29%으로 유사하였다. 그러나 가속 수명시험 시행 후 SEM 을 통한 표면 분석의 결과에서 알 수 있듯이 루테늄이 탈착 되면서 티타늄의 비율이 높아졌다. 부탄올을 이용하여 제작한 전극의 평균 티타늄 비율이 98.59%, 이온성 용액을 이용하여 제작한 전극의 평균 티타늄 비율이 73.38%로 나타났다.
유관 관찰 및 EDS mapping 결과를 통해 이온성 용액을 이용하여 제작한 전극은 가속수명시험 후에도 전극에 루테늄이 상대적으로 더 많이 점착되어 있음을 알 수 있다. 이는 이온성 용액을 이용하여 전극 제작 시 550°C와 같은 높은 온도에서의 열처리로 인해 RuO2 이 티타늄 모체와의 결합이 부탄올을 용매로 사용하는 경우 보다 강한 영향이라고 사료된다.
Fig. 4은 XRD 측정 결과로 용매에 따라 차이가 있지만, 부탄올을 이용하여 제작한 전극과 이온성 용액을 이용하여 제작한 전극의 Ru, Ti 피크는 거의 일치하고 Ru, Ti 이외의 다른 성분은 보이지 않았다.
Table 2는 가속수명시험 전, 후 전극 표면의 결정화를 측정한 결과이다. 코팅 층의 생성 정도를 결정화로도 알 수 있는데 결정화 크기는 용매 물질의 영향을 받게 된다. 전극 표면의 결정화도가 낮을수록, 전극 표면에 활성 부분(active site)이 많아 전극의 여러 부위에서 반응을 잘 일으키고 이로 인해 단위면적당 전해질 부하가 감소하여 수명이 더 길어진다[19,20]. 용매에 따른 전극의 결정화도 비교한 결과 부탄올 이용 제작 전극의 결정화도가 좀 더 낮은 값을 나타내었고, 같은 용매 내에서 루테늄 로딩량이 많을수록 결정화도는 낮아지는 경향을 보였다. XRD 결과를 origin 프로그램을 이용하여 반치전폭을 구하여 비교하였다. 또한 반치전폭은 결정 크기와 반비례 관계로, 반치전폭의 값이 클수록 결정 크기는 작다는 것을 의미한다[21]. 반치전폭 결과 또한 결정화도 경향과 유사한 것으로 나타났다.
3.3. 순환전압전류법을 통한 전극의 활성도 평가 (Cyclic voltammetry; CV)서로 다른 용매로 제작한 RuO2 전극으로 암모니아 수용액 이외의 암모니아의 산화력을 증명하고, 전기화학적 활성을 비교하여 최적의 활성을 나타내는 조건을 도출하고자 하였다.
Fig. 5은 부탄올, 이온성 용액을 이용하여 제작한 2 mg/cm2 RuO2 전극으로, 암모니아의 산화에 대한 순환전압전류법 시행 결과이다. 메탄올에 혼합되어 있는 암모니아만의 고유 반응을 확인하기 위해, 바탕 용액인 메탄올과 시약 성분에 불순물로 적혀있는 물 성분에 대해 같은 방법으로 CV를 측정하였다. 99.9% 메탄올과 암모니아와 같은 농도(7 N)의 증류수를 메탄올에 혼합하여 CV 반응을 메탄올과 7 N 암모니아 용액의 CV 결과와 비교하였다. 그 결과 메탄올과 7 N 암모니아 혼합 용액은 0 V ~ -1.0 V 사이에서의 환원 반응과 – 0.3 V ~ 0.5 V 사이에서의 산화반응을 보여준 반면 99.9% 메탄올, 메탄올과 증류수(7 N) 혼합액에 대한 부탄올 이용 전극, 이온성 용액 전극 모두 전류가 0 A/cm2 로 흐르지 않아 암모니아 이외의 두 물질에 대한 루테늄 전극의 반응성은 없는 것으로 나타났다. 이를 통해 루테늄 전극이 비 수성 암모니아에 대한 산화력이 있음을 보여주었다.
Fig. 6은 용매 별 전극의 루테늄 로딩량에 따른 암모니아 산화력을 비교한 것으로 전해질은 Fig. 5와 같이 메탄올과 암모니아 혼합 용액을 대상으로 하였고 순환전압전류법 그래프의 면적을 적분하여 전기화학적 총 전하량(voltammetric charge values)을 Table 3 나타내었다. 메탄올과 전기화학적 총 전하량은 전극의 효율을 측정하는 인자로써 이 값이 클수록, 전극의 전기화학적 활성화 인자가 전극에 많이 점착될 수 있고 이는 보다 많은 전기화학적 반응을 보인다는 것을 순환전압전류법을 통해 유추할 수 있다[22]. 전기화학적 총 전하량 값이 큰 것은 부탄올 이용 제작 1 mg/cm2 RuO2 전극이었다. 두번째로 큰 값을 나타낸 것은 부탄올 이용 제작 3 mg/cm2 RuO2 전극이었다. 전기화학적 총 전하량 값이 제일 작은 것은 이온성 용액 제작 3 mg/cm2 RuO2 전극이었고 그 다음으로 작은 것은 이온성 용액을 이용하여 제작한 1 mg/cm2 RuO2 전극이었다.
전반적으로 부탄올을 이용하여 제작한 전극이 이온성 용액을 이용하여 제작한 전극보다 CV 면적이 넓었고, 이는 전기화학적 총 전하량 값 에서도 차이를 나타내었다. CV 그래프 면적 상으로 같은 2 mg/cm2 RuO2 을 보이는 부탄올 이용 전극과 이온성 용액을 이용하여 제작한 전극을 비교하면, 용매에 의한 차이를 더욱 명확히 알 수 있다. CV 그래프 면적 상으로 둘의 차이는 0.00078 mC/cm2 에 불과하지만 가속수명시험 결과에서 이온성 용액을 이용하여 제작한 전극은 세번 째로(41시간) 종료되었지만, 부탄올을 이용하여 제작한 전극은 다섯 번째로(199시간) 종료되었다. 또한 결정화도 비교 시 이온성 용액을 이용하여 제작한 전극은 두 번째로 결정화도가 컸으나, 부탄올을 이용하여 제작한 전극은 다섯 번째로 나타났다. 앞선 내용들을 종합하여 Table 4에 나타내었다.
가속수명시험, CV 면적은 작은 값 에서 큰 값 순으로 기재하였고, 결정화도 는 큰 값에서 작은 값 순으로 기재하였다. 그 결과 부탄올을 이용하여 제작한 전극으로 2 mg/cm2 RuO2 전극이 결정화도와 가속수명시험에서 3 mg/cm2 RuO2 보다 값이 적지만 차이가 근소하기 때문에 루테늄 금속의 경제성을 고려하면 2 mg/cm2 RuO2 전극이 가장 우수한 효과를 보이는 것으로 사료된다. 즉, 전극 제작에 있어 결정화도 가 높다는 것은 전극 표면에서 active site 가 상대적으로 적기 때문에 전기화학적 반응성이 낮고, 이는 순환전압전류 그래프로도 면적이 작게 나타나게 되며, 전극의 수명에도 영향을 미치게 되는 것이라 사료된다.
4. 결 론본 연구는 불용성 산화 전극의 비 수성 상태의 암모니아 산화의 가능성을 확인하고, 암모니아 산화 시 전구체 용매에 따른 전극의 수명에 미치는 영향을 알아보고자 하였다.
부탄올을 이용하여 제작한 전극과 imidazolium 계열 이온성 용액 (HMIM)HSO4을 전구체 분산용 용매로 하여 루테늄 1, 2, 3 mg/cm2 RuO2 전극을 제작하여 전극의 표면 분석, 결정화도를 통해 전극의 표면 형성이 전극의 수명에 미치는 영향을 분석하였다. 표면 분석을 통해 부탄올을 이용하여 제작한 전극은 머드 크랙이 형성되어 있음을 확인했으나, 이온성 용액을 이용하여 제작한 전극의 경우 불 특정한 크랙이 관측되었고, 가속수명시험 이후 모든 전극에서 형성된 크랙의 탈착을 관찰 할 수 있었다. 결정화도를 통해 부탄올을 이용하여 제작한 전극이 이온성 용액을 이용하여 제작한 전극보다 결정화도가 낮아 활성화 층이 상대적으로 더 많은 것을 확인하였다.
0.5 M H2SO4전해질 대상 부탄올과 이온성 용액을 용매로 제작한 1, 2, 3 mg/cm2 RuO2 전극으로 가속수명시험 결과 부탄올을 이용하여 제작한 전극이 이온성 용액을 이용하여 제작한 전극보다 수명 유지 시간이 긴 것으로 나타났다.
비 수성 암모니아를 대상으로 순환전압전류법 측정을 통해 모든 RuO2 전극에서 산화 반응을 보여줌으로써 DSA 의 암모니아 분해 수소 생산 가능성을 입증하였다. 메탄올과 7 N 암모니아 혼합 용액의 경우 전기화학적 산화 반응을 보였으나 그 외의 99.9% 메탄올과 메탄올 물 혼합액에 대해 전류의 흐름은 나타나지 않았다.
부탄올 용매 전극, 이온성 용액 용매를 이용한 1, 2, 3 mg/cm2 RuO2 전극의 순환전압전류법의 그래프를 통해 전기화학적 총 전하량을 비교하였을 때 부탄올을 이용하여 제작한 전극이 같은 루테늄 로딩량 조건에서 이온성 용액을 이용하여 제작한 전극보다 전기화학적 활성이 높은 것으로 나타났다.
표면 분석, 가속수명시험, 전기화학적 총 전하량 비교를 통해 기존에 많이 사용하는 부탄올 용매 대비 이온성 용액을 용매로 이용한 전극의 성능의 한계를 확인하였다. 향후 다양한 이온성 용액을 활용하여 물리적 수명 혹은 전기화학적 반응이 높은 DSA의 새로운 용매의 성능에 대한 연구가 필요하다.
NotesDeclaration of Competing Interest The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 2.SEM images (×1,000) of DSA with 1 mg/cm2 of Ru loading (A) before and (B) after ALT, DSA with 2 mg/cm2 Ru loading (C) before and (D) after ALT and DSA with 3 mg/cm2 Ru loading (E) before and (F) after ALT prepared by using butanol. 
Fig. 3.SEM images (x1,000) of DSA with 1 mg/cm2 of Ru loading (A) before and (B) after ALT, DSA with 2 mg/cm2 of Ru loading (C) before and (D) After ALT and DSA with 3 mg/cm2 of Ru loading (E) before and (F)after ALT prepared by using ionic liquid. 
Fig. 4.X-ray diffraction patterns (XRD) of RuO2 DSA prepared by using butanol (A) and ionic liquid (B). 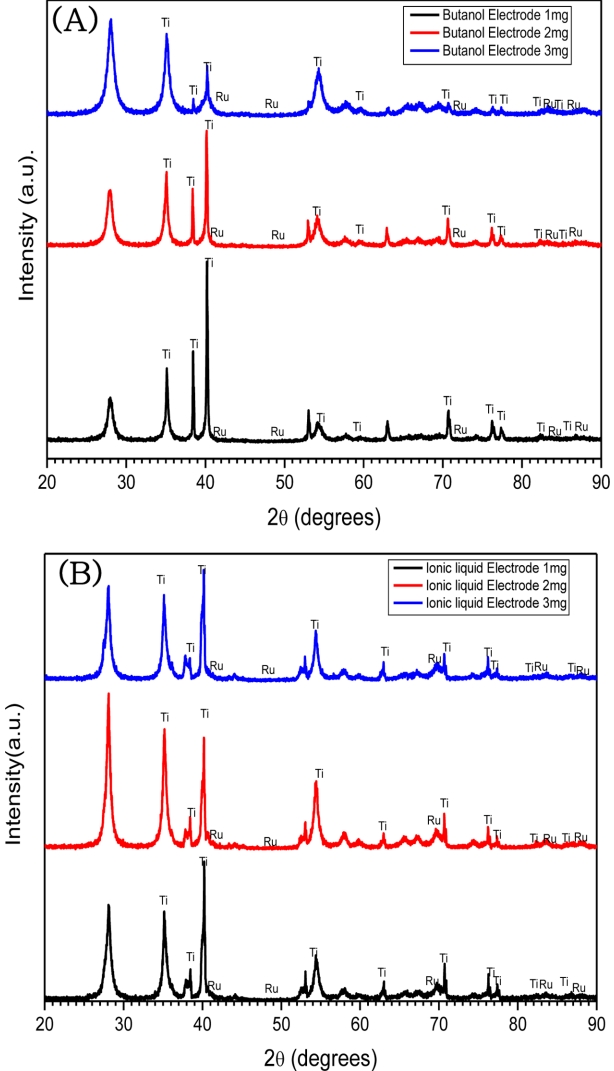
Fig. 5.Cyclic voltammograms obtained for the DSA (2 mg/cm2 RuO2) prepared using butanol (A) and ionic liquid (B) in the electrolyte containing 7 N NH3 in MeOH and 7 N water in MeOH. 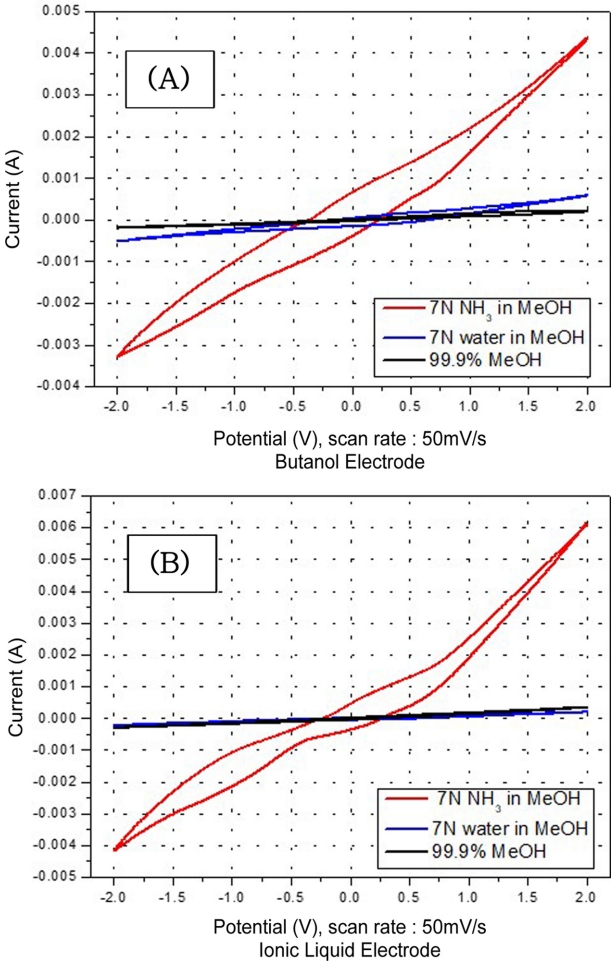
Fig. 6.Cyclic voltammograms obtained for DSA prepared using (A) butanol and (B) ionic liquid with scan rate of 50 mV/s in 7 N NH3 in MeOH. 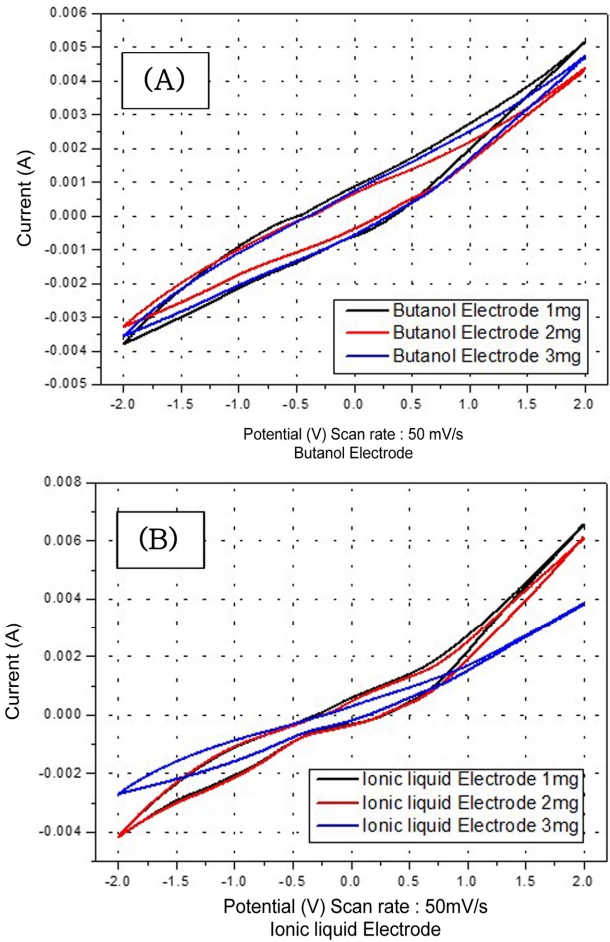
Table 1.SEM-EDS analysis of DSA with different Ru loading before and after ALT (Accelerated lifetime Test). Table 2.XRD-Crystallinity analysis of DSA prepared using butanol and ionic liquid. Table 3.Voltammetric charge obtained for DSA with different Ru loading prepared using butanol and ionic liquid.
Table 4.Performance comparison ranking of DSA prepared using butanol and ionic liquid. References1. S. H. Kim, Hydrogen production technology trend and development strategy to preoccupy the market, KDB Monthly Report., 779, 1-16(2020).
2. S. Y. Lee, H. J. Lee, Potential applicabilities of ammonia in future hydrogen energy supply industries, Applied Chemistry for Engineering., 30(6), 667-672(2019).
3. N. Akagi, K. Hori, H. Sugime, S. Noda, N. Hanada, Systematic investigation on anode catalysts for liquid ammonia electrolysis, Journal of Catalysis., 406, 222-230(2022).
4. S. R. Park, J. S. Park, An updated review of recent studies on dimensionally stable anodes (DSA), Journal of the Korean Electrochemical Society., 23(1), 1-10(2020).
5. S. M. Lee, D. W. Pak, Electrochemical treatment of high concentration ammonia using RuO2 /Ti anode and TiO2 nanotube cathode, Journal of Korean Society of Environmental Engineers., 42(7), 339-348(2020).
6. N. Hanada, S. Hino, T. Ichikawa, H. Suzuki, K. Takai, Y. Kojima, Hydrogen generation by electrolysis of liquid ammonia, Chemical Communications., 46(41), 7775-7777(2010).
7. M. H. Um, B. Y. Ha, H. C. Kang, Electrochemical treatment of dyeing wastewater using insoluble catalyst electrode, Clean Technology., 9(3), 133-144(2003).
8. Y. S. Park, Selection of optimum ratio of 3 components (Ir-Sn-Sb) electrode using design of mixture experiments, Journal of Environmental Science International., 25(5), 737-744(2016).
9. L. Xu, Y. Xin, J. Wang, A comparative study on IrO2 -TaO 5 coated titanium electrodes prepare with different methods, Electrochimica Acta., 54(6), 1820-1825(2009).
10. Y. M. Son, J. S. Kang, 2005 Tech-Issue Emerging S&T report, GOVP1200617154 pp. 11-13 KISTI(2005).
11. H. J. Lee, J. S. Lee, H. S. Kim, Applications of ionic liquids: the state of arts, Applied Chemistry for Engineering., 21(2), 129-136(2010).
12. G. A. O. Tiago, I. A. S. Matias, A. P. C. Ribeiro, L. M. D. R. S. Martins, Application of ionic liquids in electrochemistry-recent advances, Molecules., 25(24), 5812-5839(2020).
13. A. M. O’ Mahony, D. S. Silvester, L. Aldous, C. Hardacre, R. G. Compton, Effect of water on the electro-chemical window and potential limits of room-temperature ionic liquids, Journal of Chemical & Engineering Data., 53(12), 2884-2891(2008).
14. C. C. Jara, G. R. Salazar-Banda, R. S. Arratia, J. S. Campino, M. I. Aguilera, Improving the stability of Sb doped Sn oxides electrode thermally synthesized by using an acid ionic liquid as solvent, Chemical Engineering Journal., 171(3), 1253-1262(2011).
15. D. T. Araujo, M. A. Gomes, R. S. Silva, C. C. de Almeida, C. A. M. Huitle, K. I. B. Eguiluz, G. R. S. Banda, Ternary dimensionally stable anodes composed of RuO2 and IrO2 with CeO2 , SnO2 , or Sb 2 O 3 for efficient naphthalene and benzene electro-chemical removal, Journal of Applied Electrochemistry., 47, 547-561(2017).
16. A. R. Dória, R. S. Silva, P. H. Oliveira Júnior, E. A. dos Santos, S. Mattedi, P. Hammer, G. R. S. Banda, K. I. B. Eguiluz, Influence of the calcination temperature and ionic liquid used during synthesis procedure on the physical and electrochemical properties of Ti/(RuO2)0.8 -(Sb2O4)0.2 anodes, Electrochimica Acta., 354, 136625(2020).
17. D. J. Park, S. M. Choi, K. H. Lee, Effect of thermally grown TiO2 interlayer on chlorine evolution efficiency and durability of Ti/RuO2 -PdO-TiO2 Electrodes, Journal of the Korean institute of surface engineering., 51(4), 207-213(2018).
18. D. E. Kim, J. M. Yoo, Y. H. Lee, D.W. Pak, Fabrication of Ti/IrO2 /Ta 2 O 5 electrode with high electro-chemical activity and long lifetime, Journal of Korean Society on Water Environment., 33(1), 34-39(2017).
19. T. Audichon, T. W. Napporn, C. Canaff, C. Morais, C. Comminges, K. B. Kokoh, IrO2 coated on RuO2 as efficient and stable electroactive nanocatalysts for electrochemical water splitting, Journal of Physical Chemistry. C., 120(5), 2562-2573(2016).
20. J. Ribeiro, M. S. Moats, A. R. de Andrade, Morphological and electrochemical investigation of RuO2-Ta2O5 oxide films prepared by the pechini-adams method, Journal of Applied Electrochemistry., 38(6), 767-775(2008).
21. J. M. Cha, Y. J. Lee, S. C. Moon, S. E. Lee, A study on photo-luminescence spectrum properties of ZnS:Mn QD prepared by wet-process, Journal of the Korean Institute of Electrical and Electronic Material Engineers., 30(1), 42-47(2017).
22. D. Lian, A study on the effects of intermediate layer formation in the surface of electrode and production method of coating solution of DSA electrode The Graduate School, Catholic University of Daegu(2015).
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||