|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesThis study examined the degradation potential of PS by yellow mealworm larvae (Tenebrio molitor).
MethodsPS degradation characteristics by mealworm larvae were investigated by supplying PS as a nutrient, and the intestinal microflora of mealworms were analyzed. Decomposition products of PS by mealworm larvae were identified by Fourier transform infrared spectroscopy (FTIR) and solid nuclear magnetic resonance (NMR).
Results and DiscussionThe maximum amount of PS degradation by mealworm larvae (about 14.3 mg/mealworm) was measured at 30℃ and 80% relative humidity, but the maximum peak degradation rate (0.154 mg/d/mealworm) was observed at 30℃ and 70% relative humidity. Most of the intestinal microorganisms of mealworms were identified as Proteobacteria except for some Firmicute, and new colonies such as Acinetobacter, Exiguobacterium, and Pseudomonas were appeared. A carbonyl group presumed to be a conversion product of PS (C-O-C vibration, 1118 cm-1, O-C=O stretch, 1644 cm-1) was observed.
ConclusionMaximum decomposition of PS by mealworm larvae was achieved at 30℃ and 80% relative humidity, and structural changes of PS were observed in the decomposition product. Isolation of the intestinal pure microorganisms contributing to PS degradation and stimulation of PS degradation by the microorganism should be conducted at a follow-up study.
요약방법PS를 영양원으로 공급하여 밀웜에 의한 PS 분해 특성을 살펴보고, 밀웜 장내 미생물을 분석하였다. 푸리에 변환 적외선 분광법과 고체핵자기공명 실험에 의한 밀웜의 PS 분해산물을 확인하였다.
결과 및 토의30℃와 80% 상대습도에서 밀웜에 의한 최대 PS 분해량(약 14.3 mg/마리)이 측정되었으나, 최대 피크 분해율(마리 당 0.154 mg/d)은 30℃와 70% 상대습도에서 나타났다. 밀웜 장내 미생물은 일부 Firmicute를 제외한 대부분 Proteobacteria에 속하는 것으로 파악되었으며, Acinetobacter, Exiguobacterium, Pseudomonas 등과 같은 새로운 군집의 출현을 확인하였다. PS의 전환산물로 추정되는 카르보닐그룹(C-O-C vibration, 1118 cm-1 , O-C=O stretch, 1644 cm-1)이 관찰되었다.
1. 서 론플라스틱 오염 문제는 21세기의 환경오염에 기인한 큰 사회 문제들 중 하나로 떠오르고 있고 이러한 오염문제를 해결하기 위한 효과적인 전략이 절실히 필요하다. Geyer 등이[1] 추정한 연구에 따르면, 1950년 전 세계 플라스틱 생산량은 2백만 톤이었으나, 2015년에는 407백만 톤으로 65년 동안 200배 이상 증가하였다고 보고하고 있다. 플라스틱 유래 폐기물 중에는 포장재 폐기물이 가장 많고, 그 외 섬유 폐기물과 건설계 폐기물이 높은 비율을 차지하고 있으며 매년 늘어나는 플라스틱 사용량으로 주변환경은 폐플라스틱으로 넘쳐나고 있다[2]. 플라스틱 오염의 인간에 대한 위협을 제거하기 위한 전략은 플라스틱 폐기물의 수명 주기를 급속히 줄여줄 수 있는 어떤 획기적인 방법이 필요하며, 이를 위한 접근방법은 플라스틱을 생분해할 수 있는 박테리아 균주를 발견하고 분리하는 방법일 것이다[3-6].
비가수분해성(non-hydrolyzable) 또는 비닐 플라스틱(예: 폴리스티렌, 폴리에틸렌 및 폴리프로필렌)에 대한 미생물 분해 실험 중에서 플라스틱 분해 속도는 다양하지만 일반적으로 플라스틱 분해량이 전체 질량 기준 5%이내, 6 개월 (하루에 <0.03%)에서 2주 이내에 8% 이내로 (하루에 <0.6%) 분해성이 상당히 낮은 편이다[7,8]. 일반적으로 가수분해성 플라스틱 (예: 폴리에틸렌 테레프탈레이트와 같은 폴리에스터)은 미생물 분해 속도가 훨씬 더 높지만 미생물 생분해에 대한 근본적인 한계는 미생물에 대한 플라스틱의 제한된 생체 이용률에 있다고 보고되고 있다[9,10].
플라스틱 중 PS (−CH(C6H5)CH2 −]n)는 흔히 스티로폼으로 알려져 있으며 PS의 뛰어난 내구성과 제품 적용의 다양성은 짧은 시간에 우리 환경에서 PS 폐기물의 축적을 증가시켰다. 문제가 되는 것은 엄청난 양의 PS 파편이 환경에 “하얀 오염 물질”로 분산되어 세계적인 환경적 관심사가 되고 있다는 점이다. 기존 연구에 따르면 토양에서 분리된 순수 박테리아 중 몇몇 종은 PS 표면 일부분을 부식시킬 수 있지만, 이 미생물들이 PS의 생물 분해에 효과적이라는 것을 확신시키지 못했고, PS에 대한 미생물의 대사 활동을 명확히 해석하는 실험결과를 제공하기에는 다소 미흡하였다[11].
최근 알(egg), 유충(larva), 번데기(pupa), 성체(adult) 단계로 3개월 정도를 한 생애주기로 하는 밀웜(갈색거저리, Tenebrio molitor)이 플라스틱을 분해할 수 있는 지에 대한 연구가 시작되었으며, 이 연구를 통해 섭취된 PS가 CO2와 바이오매스로 전환되면서 배설물이 화학적, 물리적 성질의 변화를 기반으로 PS의 생분해 및 광물화가 밀웜의 장에서 발생한다는 연구결과가 보고된 바 있다[12,13,14]. 지금까지 플라스틱 분해에 관련하여 연구 보고된 곤충 종으로는 노란 거저리(Tenebrio molitor) [12,15,16], 검은 거저리(Tenebrio obscurus) [17], 슈퍼웜 (Zophabas atratus) [18,19], 인도밀나방(Plodia interpunctella) [20], 작은왁스나방(Achroia grisella) [21], 및 대형 밀랍나방(Galleria mellonella) [22-26] 등이 있다. 이 중 가장 특징적인 밀웜은 노란 거저리로[16] 섭취된 플라스틱이 거저리 내장에서 15~20시간 동안 거의 50 %가 CO2로 광물화 되었다고 (하루 >60%) 보고 되었다[12,15,16].
본 연구에서는 플라스틱을 분해할 수 있는 국내 밀웜의 생태학적 선호환경을 조사하고자 하였으며, 플라스틱의 분해와 관련된 밀웜 내장에 서식하는 미생물을 동정 분리하고, 이를 통하여 곤충 장내미생물을 이용한 폐플라스틱 문제를 해결하고자 하는 기초자료를 확보하고자 하였다. 이를 위하여 습도와 온도에 따른 밀웜의 플라스틱 분해량을 살펴보았으며, PCR (polymerase chain reaction)과 DGGE (Denaturing Gradient Gel Electrophoresis)기법을 이용하여 밀웜 장내 미생물의 동정하여 기존의 보고된 장내 미생물과 비교 분석 하였다. 또한 플라스틱의 생물학적 분해에 의해 발생되는 분해산물을 추적 분석함으로 플라스틱의 생물학적 전환으로 생성된 산물에 대한 확인과 분해산물의 생성기작을 추정하고자 하였다.
2. 실험방법2.1 밀웜의 배양 및 스티로폼
Fig. 1에 보여지는 실험에 사용된 밀웜(생기곤충농원, 충북 음성)의 평균 무게는 70~80 mg/worm이였다. 갈색거저리에 속하는 밀웜은, 실험에 사용되기 전 이틀동안 겨 (bran, 큰빛 밀웜 충남 아산)를 공급하였다. 밀웜의 성장량은 규칙적으로 개체의 길이 또는 무게를 측정하여 관찰하였으며, PS가 공급되어 배양된 밀웜과 겨를 공급하여 배양된 밀웜의 실험 결과를 비교 분석하였다. 밀웜에 공급된 PS는 0.0189±0.001 (g/cm3, n=5, ± standard deviation)의 겉보기 밀도를 가지는 직사각형 형태의 PS가 공급되었으며, 밀웜에 공급하기 전 에탄올로 세척한 후 상온에서 하루 이상 건조된 상태로 보관하였다. 온도와 습도에 따른 밀웜의 PS분해를 살펴보기 위해 항온항습기를 이용하였으며, 온도는 25℃, 30℃, 그리고 35℃ 에서, 습도는 70%와 80%에서 각각 진행되었다. 배양 후 육안으로 밀웜의 개체 수를 확인하였으며, 죽은 애벌레들은 즉시 실험공간에서 제거하였다.
밀웜의 PS 분해실험은 부드러운 공기의 흐름으로 PS 조각을 세척하고 깨끗한 상자로 옮긴 다음 배양기에서 밀웜과 같이 배양되었다. 밀웜의 분비물은 채집된 후 냉장보관 하였으며, 소비된 PS의 무게는 투입된 PS의 총 무게에서 분비물 중 소화되지 않은 PS와 PS 잔류물의 합 사이의 무게 차이로 계산하였다[15].
2.2 분자생물학적 기법을 통한 밀웜 장내 미생물 분석장내 미생물 분석을 위한 시료는 11,000 rpm에서 5분동안 원심분리하여 상등액을 제외한 침전물을 약 0.25 g이 되도록한 후, Power Soil DNA (deoxyribonucleic acid) Isolation Kit (MO BIO Laboratories, Inc.)를 사용하여 DNA를 추출하였다. 추출한 DNA template에서 16S rDNA의 가변 부위인 V3 region 증폭을 위해 서로 다른 2개의 primer sets을 사용하여 nested PCR을 실시하였다[27,28]. 실험에 사용된 primer (Bionics, Korea) 및 GC clamp의 sequence은 Table 1과 같다. DGGE는 40~60%의 변성제 농도 구배(변성제 농도 100%는 7M Urea, 40% Formaide)를 가지는 8% Polyacrylamide Gel을 만든 후(BioRad Ltd. Co., Model 475 Gradient delivery system) 전기영동을 실시하였다[29]. 분리된 DNA의 분석은 염기서열 분석 전문기관 (Bionics, Korea)에서 수행되었으며, 계통분류학적 확인을 위해 16S rDNA의 염기서열 결과는 NCBI BLAST (National Center for Biotechnology Information Basic Local Alignment Search Tool) Search Database에서 검색된 염기서열 정보를 이용하였다[30,31].
2.3. PS 분해산물의 분석방법PS 분해에 의해 생성된 폴리머의 말단 그룹의 변화를 살펴보기 위해 푸리에 변환 적외선 분광법(FTIR, Thermo Fisher Scientific Inc., Madison, WI, USA)과 고체핵자기공명 실험(700 MHz Agilent NMR Spectrometer. USA)을 통하여 분석 하였다. 본 실험에 사용된 고체 NMR 장비는 수소(1H)와 탄소 (13C) 핵종에 대하여 각각 699.7 MHz와 174 MHz 공명 주파수를 가진다. 분석 시료를 4 mm zirconia rotor에 채운 상태에서 CP-MAS 방법으로 13C 신호를 수집하였다. 13C NMR signal을 모으는 동안 시료의 spinning speed는 7 kHz 또는 9 kHz 로 유지 하였으며, 43 kHz TPPM 1H decoupling 하에서 진행하였다. FID signal은 2초간 간격으로 2000 scan 반복하여 저장하였으며, 250 Hz line broadening을 적용하여 Fourier Transform 하였다. FTIR은 400~4000 cm-1 범위의 주요 작용기를 분석하는데 사용되었으며 각 샘플에 대해 3회 반복 수행하였다.
3. 실험결과 및 논의3.1. 온도와 상대습도에 따른 밀웜의 PS 분해 특성공급된 PS를 섭취하며 성장하는 밀웜의 생태는 주입된 밀웜에 의해 PS가 섭취된 후 잔류하는 PS의 무게로 관찰되었다. PS 섭취량은 약 15 g의 사각형 PS를 밀웜을 넣어준 후 시간에 따른 PS의 무게 감소량을 측정하였다. 투입된 밀웜이 번데기 형태로 전환되는 즉시 실험에서 배제하고 새로운 개체를 투입하여 반응기 내 초기 밀웜의 개체수를 유지하였다. 밀웜은 생태 상 PS를 섭취하면서 PS 안으로 파고드는 습성으로 정확한 계측이 어렵고, 밀웜의 자체 포식으로 인해 밀웜의 수를 명확히 파악하기 까다롭기 때문에 공급된 PS의 두께를 조정하여 밀웜이 PS 내부로 파고들지 않도록 주의하였으며, 반복실험을 통해 실험적 오차를 배제하고자 하였다.
겨나 옥수수와 같은 일반 영양분을 공급하였을 때 밀웜 개체의 성장은 25~28℃에서 최적이라고 알려져 있으며 30℃ 이상의 온도에서는 생장이 어렵다고 보고된 바 있다[15]. 따라서 본 실험에서는 PS 공급에 따라 온도가 밀웜의 성장에 미치는 영향을 확인하기 위해 25℃, 30℃, 그리고 35℃에서 PS의 무게 감소량을 각각 측정하여 보았다. 초기에 약 15 g의 PS와 밀웜 1,200마리가 투입되었으나, 35℃에서 밀웜의 성장은 매일 5~8마리가 사멸하는 관계로 35℃의 실험은 더 이상 진행하지 않았다. 따라서 온도에 따른 PS의 무게 감소량은 25℃와 30℃에서 관찰되었다. 밀웜의 성장은 온도 뿐만 아니라 상대습도에 따라 서도 다르게 나타날 수 있고[15] 일반적으로 70~85%의 상대습도에서 관찰된다는 점을 고려하여[33] 본 실험에서는 70%와 80%의 상대습도에서 PS 섭취률을 동시에 관찰하여 보았다. Fig. 2는 25℃와 30℃에서 70%와 80%의 상대습도를 유지한 상태에서 PS의 무게 감소량을 측정한 결과이다.
소모된 PS 분해량에 대한 통계적 분석은 Sigmoidal model 3 parameters을 사용하였으며, 분석결과 70%의 습도조건에서 25℃와 30℃로 배양하였을 때 12.22 g과 15.72 g의 PS가 소비되었으며, 80%의 습도조건에서 25℃와 30℃로 배양하였을 때 16.38 g과 17.18 g이 각각 제거되는 것으로 분석되었다. 이 때의 회귀분석의 r제곱근 값은 0.972~0.997로 나타났다.
Fig. 3에 나타난 바와 같이 온도와 습도에 따른 분해 특성은 PS의 시간당 분해량을 회귀분석에서 도출된 식을 이용하여 분석해 보았을 때, PS의 무게 변화는 온도와 습도에 따라 그양상이 뚜렷하게 구분된다는 것을 알 수 있었다. 온도에 크게 상관없이 습도가 70%일 경우 PS의 최대 섭취률은 약 80일에서 관찰 되었으며, 80%의 습도로 조성된 경우 약 110일에서 최대 섭취률이 나타났다. 70% 습도가 조성된 상태에서 25℃와 30℃에서 최대 섭취량은 12.22 g과 15.72 g으로 약 28.6% 증가하였으나, 80%의 습도 조건에서는 25℃와 30℃에서 최대 섭취량이 16.38 g과 17.18 g으로 약 5% 정도 증가하는 것으로 보아 70%의 습도에서 온도에 따른 PS 섭취량이 80%의 습도 조건에서 보다 더욱 민감하였다. 이는 적정 범위에서 온도가 높을수록 PS 소모률이 높게 관찰된 Yang의 연구와는[15] 유사하였다.
밀웜 개체 당 PS 분해량을 기존 연구 결과와 비교하였을 때, 본 실험에서는 약 0.15 mg PS/d/mealworm 범위로 PS 소모률이 측정되었으며, 이는 유사한 조건에서 실험한 yang 의연구에서[16] 보고된 0.07~0.41 mg PS/mealworm/d의 중간 값 정도로 관찰되었다.
본 실험에 의해 밀웜에 의한 PS의 소비 패턴이 습도에 따라 확연히 다르게 나타날 수 있으며, 그 형태는 높은 습도에서 PS의 소비가 더 많이 일어날 수 있으나 순간 분해속도는 상대 적으로 느리게 진행되는 것으로 나타났다. 따라서 충분한 배양시간이 확보되었을 때 전체적으로 밀웜의 PS 분해량은 80%의 상대습도를 유지하는 것이 최대 소비량을 유지하는데 더 효과적이라고 판단하였다. 이는 겨와 같은 일반적인 먹이를 공급한 경우 밀웜의 질량과 길이가 습도에 따라 증가하였고, 상대습도 84%에서 사육한 경우 낮은 습도조건에서 보다 1.96배 더 무겁고 1.31배 더 길었다는 기존의 연구보고와[33] 유사한 결과이다.
30℃와 80%의 습도를 유지한 상태에서 밀웜의 성장 패턴을 확인하기 위해 겨와 PS를 단독 영양원으로 공급하고, 밀웜의 성장 패턴을 밀웜 몸체의 길이로 측정하여 관찰하였다. 밀웜이 충분히 성장하였을 때 성체의 평균 길이는 약 25 mm로 측정되었다. Fig. 4에 나타나는 바와 같이 겨만 공급하였을 때, 약 60일이 경과하면 약 25 mm 길이를 가지는 성체로 자라는 것이 관찰되었으나, PS가 공급 되었을 때는 겨가 공급하였을 때 보다 성장이 더디게 진행되어 겨가 공급되었을 때 보여지는 길이 만큼의 성장은 관찰되지 않았다. 이는 밀웜의 성장을 위한 충분한 영양분의 공급이 PS만으로는 부족하다는 것을 나타내는 것이며, 부족한 영양분은 밀웜의 생장 주기에도 영향을 미치고, 일반적인 성장주기인 3개월보다 극대 성장이 더디게 나타나 140일이 지나서도 성장이 지속적으로 진행된다는 것을 확인할 수 있었다. 이는 PS를 공급원으로 한 2세대 밀웜을 PS 분해에 적용하였을 떄 PS 분해량이 제한받을 수 있음을 의미한다.
3.2. 밀웜 장내 미생물의 동정밀웜의 PS 분해는 밀웜 내장의 미생물에 의한 것이라고 보고된 바 있으며[16,17], 이를 확인하기 위해 PS의 분해에 관여하는 밀웜 장내 미생물의 종류를 확인하여 보았다. 겨와 PS를 일정기간 사료로 제공한 후 밀웜의 장을 분리하여 미생물의 종류를 동정하였다. Fig. 5에 나타나는 바와 같이 PCR과 DGGE 분석에 의해 분류된 밀웜 장내 미생물 군집은 Acinetobacter sp. Ac3412, Citrobacter freundii, Uncultured bacterium clone HKT 520, Klebsiella aerogenes strain Ka37751, Genomospecies 7, Pseudomonas sp., Serratia marcescens, Uncultured bacterium clone OKB14, Serratia sp. YD25, Citrobacter freundii strain 705SK3, Exiguobacterium sp. YT2, Pseudomonas aeruginosa strain PA0750, Exiguobacterium sp, Klebsiella aerogenes으로 관찰 되었다. 이 미생물 군집 중 PS가 공급된 경우에만 출현된 종은 일부 Citrobacter 종과 Serratia 종 그리고 Exiguobacterium 종으로 관찰되었고, 검출된 미생물 종 대부분 proteobacteria 문에 속하고, Exiguobacterium 종만 Firmicutes 문에 속하는 것으로 분석되었다. DGGE band 상 나타나는 밝기가 미생물 군집의 양에 비례한다는 것을 상기하였을 때, PS를 공급함으로서 밀웜의 장내에 활성화되어 있는 종들은 Acinetobacter, Citrobacter, Klebsiella., 그리고 Exiguobacterium으로 판단된다.
본 실험을 통해 분석된 밀웜 장내 미생물의 종들을 기존에 보고된 [34] 미생물 종들과 비교하여 Table 2에 나열하여 보았다. 중복되어서 관찰된 종들은 Bacillus, Citrobacter, Enterococcus, Klebsiella, Lactococcus, Serratia, Spiroplasma가 관찰되었으나 많은 종들이 각 밀웜 실험에 따라 다르게 나타나는 것으로 보아 같은 밀웜 종일지라도 지역에 따라 또는 실험환경에 따라 PS를 분해하는데 기여하는 장내 미생물의 분포는 상이하게 나타난다고 보여진다. 특히 빈번하게 분석되는 우점종은 Citrobacter, Enterococcus, Klebsiella, 그리고 Spiroplasma이였으나 PS에 분해하는데 기여하는 우점종에 대한 판단이나 분해 양상을 확인하기 위해서는 단일 종에 대한 연구가 추가적으로 필요하다고 판단된다.
3.3. PS의 분해산물밀웜에 의한 PS의 분해산물을 살펴보기 위해 분비물에서 PS 잔류물에 대한 FTIR과 13C 고체 NMR 분석을 실시하였다. 25℃와 80%의 습도가 유지된 상태에서 PS를 공급하였고 애벌레 배양이 시작된 30일 후 분비물을 수집하였다. 공급된 PS와 분비물에서 FTIR 및 고체 상태 13C CP-MAS NMR 스펙트럼을 Fig. 6에 나타내었다. 공급된 PS 및 분비물 상 PS에 대한 FTIR 스펙트럼 비교에서 PS 화학결합 변화와 산소와의 통합을 관찰할 수 있었다. FTIR 스펙트럼에서 625~970 cm-1 (ring bending vibrations) 피크는 공급원료인 PS에서 강하게 나타나지만 분비물 시료에서는 훨씬 약하게 나타나고 있으며, 특징적인 피크는 카르보닐그룹을 나타내는 (C-O-C vibration, 1118 cm-1, O-C=O stretch, 1644 cm-1) 피크는 PS의 구조적 변화를 의미하는 것으로 생물학적변화나 노화과정으로 인한 분비물 시료에서 PS 전환산물로 관찰되었다. 분해산물의 카르보닐 그룹의 생성은 이미 기존의 연구결과에서 보고된 바 있으며[28], 이는 PS의 고리구조가 분쇄되고 산화되는 과정이라고 해석된 바 있다.
분비물에 대한 13C NMR 스펙트럼은 PS를 먹인 밀웜 분비물 상 뚜렷이 구분되는 새로운 피크들이 (153.9 ppm, 102.8 ppm, 17~54 ppm) 나타났다. 102.8 ppm에서 나타나는 피크는곤충 표피의 키틴에서 기인할 수 있고, 153.9 ppm에서 확인되는 피크는 새로운 방향족 공명 신호인 페닐 유도체에 기인할 수 있으며, 이 페닐 유도체는 PS의 해중합이나 산화 과정에서 생성된 단편적이고 작은 분자에 대한 생성물로 해석된다고 보고된 바 있다[12]. NMR 분석을 통하여 밀웜 내장 내에서 공급된 PS의 화학적 변형을 FTIR 분석과 더불어 확인할 수 있었다. 이로부터 좀 더 자세한 PS 분해 물질을 파악 하기 위하여 향후 좀 더 체계적인 연구가 필요할 것으로 판단 된다.
4. 결 론본 실험을 통하여 국내 딱정벌레목 거저리과 애벌레에 의한 PS의 분해 가능성을 확인하고자 하였으며, 실험결과 다음과 같은 결론을 도출할 수 있었다.
1. 1,200마리의 밀웜이 공급된 상태에서 70%의 습도조건에서 25℃와 30℃로 배양하였을 때 12.22 g과 15.72 g의 PS가 소비되었으며, 80%의 습도조건에서 25℃와 30℃로 배양하였을 때 16.38 g과 17.18 g이 소비되어, 30℃와 80% 습도에서 PS의 소비가 가장 활발하였다. 온도에 크게 상관없이 상대습도에 따른 밀웜의 시간 당 PS 분해율은 뚜렷한 패턴을 나타내었으며, PS 공급으로 인한 밀웜의 성장 양상은 일반적인 영양원 공급에 한 생태주기(약 60일)보다 길게 지속되는 것을 확인하였다.
2. 다양한 장내 미생물이 확인되었으며, 일부 Firmicute를제외한 대부분 Proteobacteria에 속하는 것으로 나타났으며, Acinetobacter sp. Ac3412, Citrobacter freundii, Uncultured bacterium clone HKT 520, Klebsiella aerogenes strain Ka37751, Genomospecies 7, Pseudomonas sp., Serratia marcescens, Uncultured bacterium clone OKB14, Serratia sp. YD25, Citrobacter freundii strain 705SK3, Exiguobacterium sp. YT2, Pseudomonas aeruginosa strain PA0750, Exiguobacterium sp, Klebsiella aerogenes 종들이 관찰 되었다. 보고된 미생물 종들과 비교하였을 때 중복되어서 관찰된 종들은 Bacillus, Citrobacter, Enterococcus, Klebsiella, Lactococcus, Serratia, Spiroplasma가 관찰되었으나 많은 종들이 각 밀웜 실험에 따라 다르게 나타나는 것으로 보아 같은 밀웜 종일지라도 환경에 따라 PS를 분해하는데 기여하는 장내 미생물의 분포는 상이하다고 판단되었다.
3. FTIR 스펙트럼에서 625~970 cm-1 (ring bending vibrations) 피크는 공급원료인 PS에서 강하게 나타나지만 분비물 시료에서는 훨씬 약하게 나타나고 있으며, 카르보닐그룹을 나타내는 (C-O-C vibration, 1118 cm-1, O-C=O stretch, 1644 cm-1) 피크는 PS의 구조적 변화를 의미하는 것으로 생물학적변화나 노화과정으로 인한 분비물 시료에서 PS 전환산물로 관찰되었다.
4. 분비물 상 PS에 대한 13C NMR 스펙트럼은 PS를 먹인 밀웜 분비물 상 뚜렷이 구분되는 새로운 피크들이 (153.9 ppm, 102.8 ppm, 17~54 ppm) 나타났으며, 이 피크들은 새로운 방향족 공명 신호인 페닐 유도체에 기인하며, 이 페닐 유도체는 PS의 해중합이나 산화 과정에서 생성된 단편적이고 작은 분자에 대한 생성물로 해석된다고 보고된 바 있다.
본 연구를 통하여 밀웜에 의한 PS의 분해를 뚜렷이 확인할 수 있었고, 이는 다양한 밀웜 장내 미생물이 PS의 분해에 영향을 줄 수 있다고 판단되었으나, 추후 보충 연구를 통해 장내 순수 미생물의 분리 및 PS 분해 활성화 가능성을 살펴보는 후속 연구가 필요하다고 사료된다.
NotesDeclaration of Competing Interest The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 2.Weight reduction of polystyrene with mealworm incubation. Initial number of mealworms was 1,200. Regression was accomplished by the Sigmoidal 3 parameter model by Sigma Plot for windows ver. 10., Palo Alto, CA, USA. 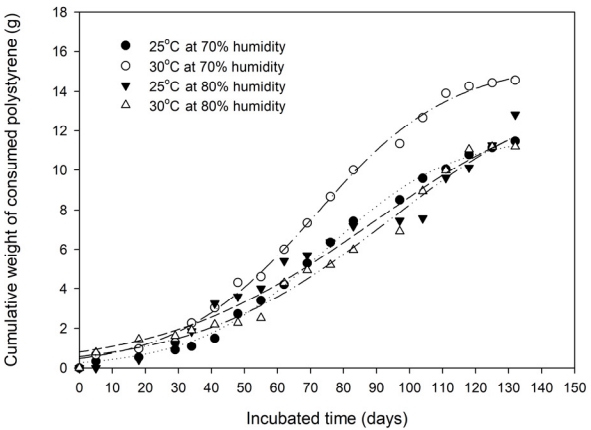
Fig. 3.Weight reduction rate (g/d) of polystyrene with mealworms incubation at 25℃ and 30℃ with 70% and 80% humidity. Regression of Sigmoidal 3 parameter model was accomplished by Sigma Plot for windows ver. 10. Palo Alto, CA, USA. 
Fig. 5.DGGE profile and microbial community of Tenebrio molitor larvae fed with bran (A lane) and PS only (B lane). *: Genomospecies 7 is classified as one of Citrobacter freundii. 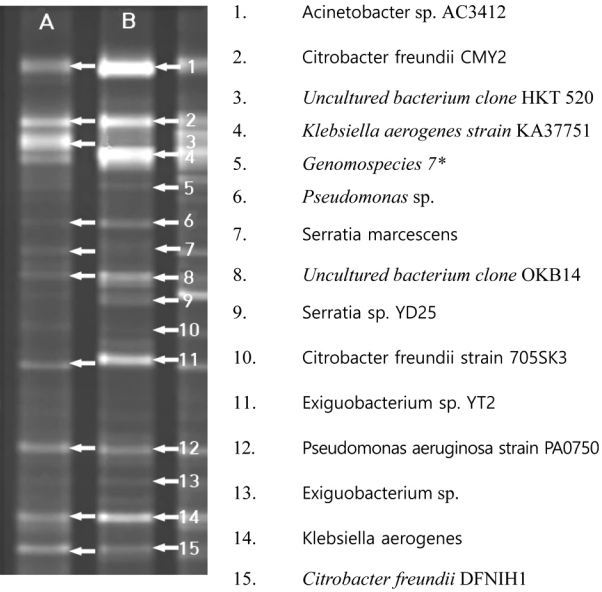
Fig. 6.(a) FTIR spectra and (b) 13C solid state NMR spetra of the fed PS (top) and PS in the egested frass (bottom). (ssb: spinning side band) 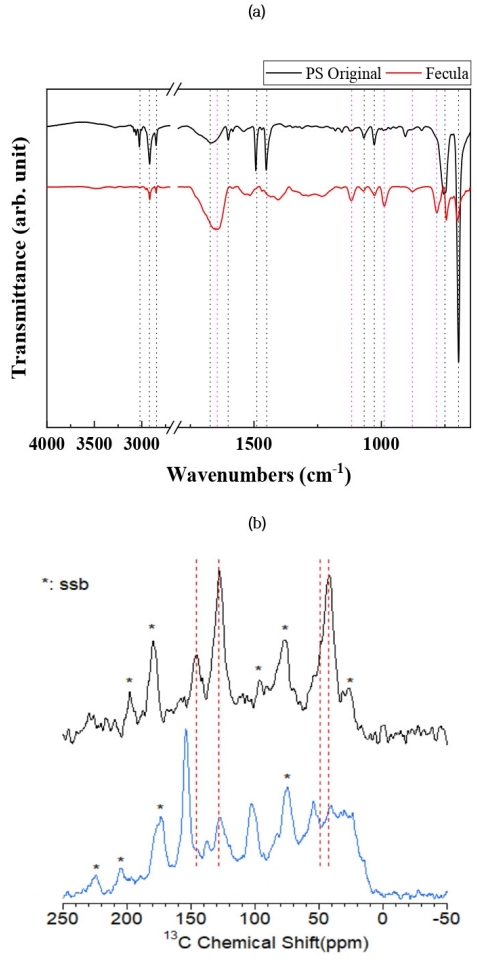
Table 1.PCR primers used in this study [32] Table 2.Microbial community of the gut microbiome References1. R. Geyer, J. R. Jambeck, K. L. Law, and fate of all plastics ever made, Sci. Adv., 7(3), e1700782(2017).
2. Y. Choi, H. J. Choi, S-W. Rhee, Current status and improvements on management of plastic waste in Korea, Resour. Recycl., 27(4), 3-15(2018).
3. R. Gautam, A. S. Bassi, E. K. Yanful, A review of biodegradation of synthetic plastic and foams, Appl. Biochem. Biotechnol., 141(1), 85-108(2007).
4. M. C. Krueger, H. Harms, D. Schlosser, Prospects for microbiological solutions to environmental pollution with plastics, Appl. Microbiol. Biotechnol., 99(21), 8857-8874(2015).
5. N. Wierckx, T. Narancic, C. Eberlein, R. Wei, O. Drzyzga, A. Magnin, H. Ballerstedt, S. T. Kenny, E. Pollet, L. Averous, Plastic biodegradation: Challenges and opportunities, consequences of microbial interactions with hydrocarbons, oils, and lipids biodegrad, bioremediat., 1-29(2018).
6. T. Narancic, K. E. O’Connor, Microbial biotechnology addressing the plastic waste disaster, Microb. Biotechnol., 10(5), 1232-1235(2017).
7. P. K. Roy, S. Titus, P. Surekha, E. Tulsi, C. Deshmukh, C. Rajagopal, Degradation of abiotically aged LDPE films containing pro-oxidant by bacterial consortium, Polym. Degrad. Stab., 93(10), 1917-1922(2008).
8. M. Sudhakar, M. Doble, P. S. Murthy, R. Venkatesan, Marine microbe-mediated biodegradation of low-and high-density polyethylenes, Int. Biodeterior. Biodegrad., 61(3), 203-213(2008).
9. S. Yoshida, K. Hiraga, T. Takehana, I. Taniguchi, H. Yamaji, Y. Maeda, K. Toyohara, K. Miyamoto, Y. Kimura, K. Oda, A bacterium that degrades and assimilates poly(ethylene terephthalate), Science., 351(6278), 1196-1199(2016).
10. V. Tournier, C. M. Topham, A. Gilles, B. David, C. Folgoas, E. Moya-Leclair, E. Kamionka, M-L. Desrousseaux, H. Texier, S. Gavalda, An engineered PET depolymerase to break down and recycle plastic bottles, Nature., 7802(580), 216-219(2020).
11. S. S. Yang, A. M. Brandon, D. F. Xing, J. Yang, J. W. Pang, C. S. Criddle, N. Q. Ren, W. M. Wu, Progresses in polystyrene biodegradation and prospects for solutions to plastic waste pollution, IOP Conf. Ser. Earth Environ. Sci., 150, 012005(2018).
12. Y. Yang, J. Yang, W-M. Wu, J. Zhao, Y. Song, L. Gao, R. Yang, L. Jiang, Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests, Environ. Sci. Technol., 49(20), 12087-12093(2015).
13. H-Y. Koo, S-G. Kim, H-K. Oh, J-E. Kim, D-S. Ch oi, D-I. Kim, I. Kim, Temperature-dependent development model of larvae of mealworm beetle, Korean J. Appl. Entomol., 52(4), 387-394(2013).
14. A. M. Brandon, A. M. Garcia, N. A. Khlystov, W-M. Wu, C. S. Criddle, Enhanced bioavailability and microbial biodegradation of polystyrene in an enrichment derived from the gut microbiome of Tenebrio molitor(mealworm larvae), Environ. Sci. Technol., 55(3), 2027-2036(2021).
15. S-S. Yang, A. M. Brandon, J. C. A. Flanagan, J. Yang, D. Ning, S-Y. Cai, H-Q. Fan, Z-Y. Wang, J. Ren, E. Benbow, Biodegradation of polystyrene wastes in yellow mealworms (larvae of Tenebrio molitor Linnaeus): factors affecting biodegradation rates and the ability of polystyrene-fed larvae to complete their life cycle, Chemosphere., 191, 979-989(2018).
16. S-S. Yang, W-M. Wu, A. M. Brandon, H-Q. Fan, J. P. Receveur, Y. Li, Z-Y. Wang, R. Fan, R. L. McClellan, S-H. Gao, Ubiquity of polystyrene digestion and biodegradation within yellow mealworms, larvae of Tenebrio molitor Linnaeus (Coleoptera: Tenebrionidae), Chemosphere., 212, 262-271(2018).
17. B-Y. Peng, Y. Su, Z. Chen, J. Chen, X. Zhou, M. E. Benbow, C. S. Criddle, W-M. Wu, Y. Zhang, Biodegradation of polystyrene by dark (Tenebrio obscurus) and yellow (Tenebrio molitor) mealworms (Coleoptera: Tenebrionidae), Environ. Sci. Technol., 53(9), 5256-5265(2019).
18. Y. Yang, J. Wang, M. Xia, Biodegradation and mineralization of polystyrene by plastic-eating superworms Zophobas atratus, Sci. Total Environ., 708, 135233(2020).
19. B. Y. Peng, Y. Li, R. Fan, Z. Chen, J. Chen, A. M. Brandon, C. S. Criddle, Y. Zhang, W. M. Wu, Biodegradation of low-density polyethylene and polystyrene in superworms, larvae of Zophobas atratus (Coleoptera: Tenebrionidae): Broad and limited extent depolymerization, Environ. Pollut., 266, 115206(2020).
20. J. Yang, Y. Yang, W-M. Wu, J. Zhao, L. Jiang, Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms, Environ. Sci. Technol., 48(23), 13776-13784(2014).
21. H. Kundungal, M. Gangarapu, S. Sarangapani, A. Patchaiyappan, S. P. Devipriya, Efficient biodegradation of polyethylene (HDPE) waste by the plastic-eating lesser waxworm (Achroia grisella), Environ. Sci. Pollut. Res., 26(18), 18509-18519(2019).
22. H. G. Kong, H. H. Kim, J. H. Chung, J. H. Jun, S. Lee, H. M. Kim, S. Jeon, S. G. Park, J. Bhak, C. M. Ryu, The galleria mellonella hologenome supports microbiota-independent metabolism of long-chain hydrocarbon beeswax, Cell Rep., 26(9), 2451-2464(2019).
23. L. Ren, L. Men, Z. Zhang, F. Guan, J. Tian, B. Wang, J. Wang, Y. Zhang, W. Zhang, Biodegradation of polyethylene by enterobacter sp. D1 from the guts of wax moth galleria mellonella, Int. J. Environ. Res. Public Heal., 16(11), 1941(2019).
24. A. Peydaei, H. Bagheri, L. Gurevich, N. de Jonge, J. L. Nielsen, Impact of polyethylene on salivary glands proteome in Galleria melonella, Comp. Biochem. Physiol. Part D Genomics Proteomics., 34, 100678(2020).
25. Y. Lou, P. Ekaterina, S-S. Yang, B. Lu, B. Liu, N. Ren, P. F-X. Corvini, D. Xing, Biodegradation of polyethylene and polystyrene by greater wax moth larvae (Galleria mellonella L.) and the effect of co-diet supplementation on the core gut microbiome, Environ. Sci. Technol., 54(5), 2821-2831(2020).
26. B. J. Cassone, C. M. R. Lemoine, H. C. Grove, O. Elebute, S. M. P. Villanueva, Role of the intestinal microbiome in low-density polyethylene degradation by caterpillar larvae of the greater wax moth, Galleria mellonella, in Proceedings of the Royal Society B., 287(1922), 20200112(2020).
27. B. Liu, L. He, L. Wang, T. Li, C. Li, H. Liu, Y. Luo, R. Bao, Protein crystallography and site-direct mutagenesis analysis of the poly(ethylene terephthalate) hydrolase PETase from ideonella sakaiensis, ChemBioChem., 19(14), 1471-1475(2018).
28. L. Øvreås, L. Forney, F. L. Daae, V. Torsvik, Distribution of bacterioplankton in meromictic Lake Saelenvannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA, Appl. Environ. Microbiol., 63(9), 3367-3373(1997).
29. M. Salvador Pedro, S. Haruta, M. Hazak a, R. Shimada, C. Yoshida, K. Hiura, M. Ishii, Y. Igarashi, Denaturing gradient gel electrophoresis analyses of microbial community from field-scale composter, J. Biosci. Bioeng., 91(2), 159-165(2001).
30. G. Muyzer, K. Smalla, Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology, Antonie Van Leeuwenhoek., 73(1), 127-141(1998).
31. S. F. Altschul, T. L. Madden, A. A. Schäffer, J. Zhang, Z. Zhang, W. Miller, D. J. Lipman, Gapped BLAST and PSI-BLAST: a new generation of protein database search programs, Nucleic Acids Res., 25(17), 3389-3402(1997).
32. S. K. Khanal, W. H. Chen, L. Li, S. Sung, Biological hydrogen production: effects of pH and intermediate products, Int. J. Hydorg. Energy., 29(11), 1123-1131(2004).
33. N. S. Johnsen, J. L. Andersen, J. Offenberg, The effect of relative humidity on the survival and growth rate of the yellow mealworm larvae (tenebrio Molitor, J. Insects Food Feed., 7(3), 311-318(2021).
|
|
|||||||||||||||||||||||||||||||||||