|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractThe purpose of this study is to evaluate effect of phenol toxicity of Vibrio fischeri using MicroTox Ⓡ CTM. A continuous flow system for biomonitoring tool has been used to assess the toxicity of phenol. The bioluminescence inhibition of different dillutions of phenol (1.5, 2.0, 2.5, 3.0 mg/L) with deionized water for reference was evaluated from 3.5 to 97.4% and the EC20 and EC50 from inhibition curve were estimated in 1.7 and 2.2 mg/L, respectively. Meanwhile, the bioluminescence inhibition of mixtures of phenol (2.0, 3.0, 5.0, 7.0 mg/L) with effluent wastewater for reference was evaluated from 5.4 to 99.2% and the EC20 and EC50 from inhibition curve were estimated in 2.9 and 4.4 mg/L, respectively. Using MicroTox Ⓡ
CTM provides a simple, rapid and sensitive method for accessing the toxic risks posed by phenol to aquatic ecosystems and has practical applications for municipal and industrial wastewater management and screening of contaminants in fresh water streams and lakes.
요약본 연구에서는 발광박테리아(vibrio fischeri)를 이용한 온라인 생물감시장치인 MicroToxⓇ CTM을 사용하여 페놀에 대한 독성반응을 평가하였다. 연속적인 흐름에 의한 독성모니터링 시스템으로 대조구와 실험구를 교대로 주입하여 독성반응을 확인하였다. 증류수를 대조구로 하여 페놀 표준용액의 주입 농도별(1.5, 2.0, 2.5, 3.0 mg/L) 발광저해도는 3.5 ~ 97.4%를 나타내었고, inhibition curve를 직선식으로 하여 추정한 EC20과 EC50은 각각 1.7, 2.2 mg/L로 계산되었다. 한편, 폐수 방류수를 대조구로 하여 페놀첨가 폐수의 주입 농도별(2.0, 3.0, 5.0, 7.0 mg/L) 발광저해도는 5.4 ~ 99.2%를 나타내었고, inhibition curve를 직선식으로 하여 추정한 EC20과 EC50은 각각 2.9, 4.4 mg/L로 계산되었다. MicroToxⓇ CTM 장치를 이용한 독성감시는 페놀에 의한 수생태계의 독성 위해성을 간편하고, 빠르고, 민감하게 평가할 수 있으며, 하․폐수처리시설 및 하천이나 호수의 수질 오염에 대한 독성스크린 도구로 유용할 것으로 판단된다.
1. 서 론수생태계 건강성을 위협하는 독성물질의 유입여부 및 위해성 판별을 위해 미생물, 물벼룩, 물고기, 조류 등 다양한 생물종을 이용한 생물독성감시장치(Biosensor)에 대한 현장 적용 및 연구가 이루어져 왔다[1~4]. 우리나라의 경우 1991년 낙동강 페놀오염사고를 계기로 하천 및 호소의 수질변화를 신속하고 체계적으로 모니터링하기 위해서 1995년에 낙동강 수계에 수질자동측정소 2개소를 운영하기 시작하여 현재 전국 주요 하천 및 호소에 70개소의 수질자동측정소가 운영되고 있다. 상류에 위치한 수질오염물질 배출시설의 방류수 및 사고로 인한 오염물질의 유입에 대한 조기감시를 목적으로 48개소에서 생물감시장치를 운영하고 있으며, 생물종에 따라 미생물, 물벼룩, 조류로 구분되어 진다[5].
생물검정법(Bioassay)은 화학적 방법에 비해 측정 및 분석이 편리하고, 시간 단축 및 비용이 저렴하며 오염물질에 대한 영향을 시험 생물의 반응으로 관찰하여 수용체 중심의 감시가 가능하다. 다양한 물리화학적 분석 방법과 더불어 수중으로 유입된 독성물질에 대한 시험 생물의 신진대사, 번식감소, 생체작용 변화 등의 영향을 조사·분석함으로써 생태계 영향을 시험종으로부터 판별할 수 있는 도구로 간주되고 있다[6,7]. 특히, 발광박테리아를 이용한 독성시험은 동물을 남용하는 것을 피할 수 있어 윤리적 문제를 최소화하고 경제적 측면에서도 효용성이 높아 독성시험법으로 대체 가능한 기술로 발전되고 있으며 다양한 분야에서 활용되고 있다[8,9]. 또한, V. fischeri는 동결건조(freeze-dried)된 키트(kit)로 판매되며 사용 시 활성화 용액을 주입하여 빠르게 사용이 가능하다. 그러나 물고기나 물벼룩과 같은 생물들은 실험실에서 항상 배양해야 하는 번거로움이 있으며 배양된 생물을 유지관리하기 위한 시간과 비용이 추가적으로 요구된다. V. fischeri는 해양환경공정시험법에서 생태독성 시험종으로 채택하고 있으며, 해양에 직접 방류되는 폐수에 대한 생태독성시험에 사용되고 있다. 우리나라의 수질오염공정시험기준에는 생물독성시험법으로 물벼룩 단일종에 의한 시험법만 채택하고 있으나, 최근에 생물종 다변화에 관한 연구가 활발히 진행되고 있다[10~12]. 동결 건조된 V. fischeri를 이용한 시험방법은 국제표준시험법(ISO 11348-3)으로 1998년에 제정되어 많은 나라에서 채택하여 사용하고 있으며, 지표수뿐만 아니라 다양한 오염물질 배출원에 적용이 가능하다[13]. 물벼룩과 같은 염분에 독성을 나타내는 생물과 달리 염분함량이 높은 폐수에도 시험이 가능하여 적용범위가 넓은 장점을 가지고 있다. WHO에서 규정하고 있는 생물안전도 분류에서 BL1 (Biosafety level 1)으로 인간과 환경에 최소의 잠재적 위험성을 나타내어, 생물의 수출입에 제한이 없으며, 취급 시 안전장비를 필요로 하지 않는다. 이미 국내 현장에서 적용되어 활용되고 있다.
본 연구에서 사용된 생물종은 발광성 박테리아로 해수, 담수 및 육지에 이르기까지 넓은 영역에서 다양하고 풍부하게 존재한다. 이 생물은 모두 그람음성의 운동성 간균으로 통성 혐기성세균에 해당된다. 지금까지 알려진 종에 대해 세부적으로 연구된 것이 채 1%로도 되지 않으며, 이중에 V. fischeri는 해양 미생물이라는 제한점이 있으나 유해물질에 대한 높은 민감도를 나타내고 단시간의 노출에도 독성 반응성이 우수한 장점이 있어 독성스크린 도구로 많이 사용되고 있는 생물종이다. 또한 저렴한 비용으로 하천수나 배출수에 대한 독성모니터링이 가능하여 현장에 적용한 사례가 많아지고 있다[14,15]. 특히 수질오염물질 배출시설에 있어, 독성 물질을 함유한 원수에 의한 시설운영 악화를 제어하거나 방류된 수질의 영향을 경감시킬 수 있는 대책을 수립하는데 유용하다[16].
한편, 페놀계 화합물은 가정, 농업, 공업용으로 폭넓게 사용되는 물질이다. 페놀은 염료, 플라스틱, 의약품 등 다양한 유기화합물 제조공정의 원료로 사용되고 있으며 광범위한 농약의 사용 및 반응생성물 그리고 하․폐수처리시설의 방류수로부터 생태계로 지속적으로 유입되고 있는 실정이다. 수계의 페놀 오염은 수생물의 세포막 지질을 산화하여 막의 투과성 등의 성질의 변화를 일으켜 세포의 정상적인 대사기능을 저해시킨다[17,18].
본 연구에서는 페놀에 대한 발광박테라아(V. fischeri)의 독성반응 특성을 MicroToxⓇ CTM (MODERNWATER, UK) 온라인 생물감시장치를 이용하여 평가하였다. 발광박테리아가 페놀 독성에 의해 나타나는 발광저해도를 계산하여 EC20과 EC50을 추정하였으며, 실제 폐수처리장 방류수에 페놀을 첨가하여 독성반응을 모의하는 실험을 수행하였다. 그리고 발광박테리아를 이용한 생물감시장치의 페놀에 대한 감지 가능한 농도수준과 현장 적용성을 검토하였다.
2. 이 론2.1. V. fischeri의 발광메커니즘박테리아의 발광 반응은 발광효소라고 불리는 luciferase에 의한 효소촉매반응으로 나타난다. V. fischeri는 luciferin이라는 두가지 기질(substrates)을 갖고 있으며, 이들은 환원 플라빈 모노 뉴클레오타이드(flavin mono nucleotide, FMNH2)와 탄소수가 7개에서 16개를 갖는 지방족 알데하이드(a long chain fatty aldehyde, RCHO)이다. 이 luciferin은 산소를 이용하여 luciferase를 촉매로 하여 산화․환원 반응이 일어난다. FMNH2는 FMNH로 환원되고, RCHO는 RCHOO로 산화되며 이 과정에서 luciferase의 중간 생성물(flavin mono oxygenase oxidoredutase)이 들뜬 상태였다가 서서히 안정한 상태로 변화면서 옅은 청록색의 빛을 발한다. 이때 빛에너지는 약 475 nm에서 최대 파장을 나타낸다. 발광반응의 총괄식을 식 (1)에 나타내었다[19].
발광박테리아의 발광반응은 기질의 산화와 환원에 의한 전자전달 과정에서 나타난다. 따라서 발광박테리아 독성물질에 노출 또는, 영양물질 및 온도, 염분농도와 같은 외부환경의 변화로 인해 발광반응이 저해되면 빛에너지는 감소하게 된다. 이러한 외부자극은 발광박테리아의 발광기작에 영향을 주고 이때 발생되는 빛에너지의 변화를 Photomultiplier Tube (PMT)로 측정함으로써 독성물질의 영향을 쉽게 검출할 수 있다.
2.2. Quorum sensingQuorum sensing은 정족수 인식 또는 감지로 박테리아는 동종인 개체의 밀도를 인식할 수 있다. 이는 각 미생물들이 분비하는 신호 물질을 인식하는 것으로 이 신호물질이 일정농도 이상에 이르면 박테리아가 가진 특정 유전자의 발현을 조절한다. V. fischeri의 경우 그람 음성균에서 공통적으로 나타나는 신호 전달물질인 homoserine lactone (AHL)의 분비에 의해 quorum sensing이 나타난다. V. fischeri의 세포내에는 AHL을 생성하는 단백질인 LuxI와 AHL을 수용하는 단백질인 LuxR이 있고 AHL은 세포 내외부로 확산된다. 하지만 개체밀도가 낮을 때에는 AHL 농도도 낮아 LuxR이 활성화되지 않다가 AHL 농도가 일정 수준 이상이 되면 LuxR이 활성화된다. LuxR이 활성화되면 발광유전자인 Lux-CDABE가 발현하여 빛에너지를 생성할 수 있게 된다[20].
3. 연구방법3.1. 실험물질 및 폐수 방류수 성상독성반응 실험에 사용된 페놀은 순도 99.0% 이상의 Sigma-Aldrich사 제품으로 표준용액을 조제하여 농도별로 희석하여 사용하였다. 장치의 독성 검정을 위해 사용된 아연(Zn2+) 표준용액은 Accustandard사 제품을 사용하였다. 배양기에 공급되는 영양염(Nutrient)은 1 L 당 NaCl 30.0 g, NaH2PO4 H2O 6.1 g, K2HPO4 3H2O 2.75 g, MgSO4 7H2O 0.204 g, (NH4)2HPO4 0.5 g, Glycerol 3 mL, Caso peptone 5.0 g, Yeast extract 0.5 g의 성분으로 구성되어 있다. 실험에 사용된 폐수는 실제 운영하고 있는 폐수처리장(청주시 소재)의 방류수를 채수하였으며, 방류수 수질분석은 수소이온농도(pH), 전기전도도(EC) 및 용존산소농도(DO)에 대하여 portable sensor (600XL, YSI, USA), 총유기탄소(TOC)는 온라인 분석장비(StarTOCⓀ, BLprocess, Korea), 총질소(TN)와 총인(TP)은 온라인 분석장비(TNTP-300, Horiba, Japan)로 각각 측정하였고, 페놀류와 염소이온(Cl-)은 수질오염공정시험기준에 따라 분석하였으며, 측정분석 결과는 Table 1에 나타내었다.
3.2. 실험장치 및 영향인자실험장치의 흐름도는 Fig. 1과 같으며, 시료와 NaCl 25% 용액, 생물시료를 연속적으로 주입할 수 있는 시스템으로, 활성화된 발광박테리아(Vibrio fischeri NRRL-B-11177, MicrotoxⓇ Reagent)는 배양기로부터 일정량의 생물시료(Bioreagent)로 공급된다. 정량펌프에 의해 연속적으로 주입된 시료는 NaCl 25% 용액 일정량이 첨가되고 생물시료와 만나 타이밍 코일(Timing coil)을 거치면서 혼합된 후 PMT를 지날 때 발광량(Luminescent)이 측정된다. 장치에 도입된 시료가 발광량이 측정되기까지 걸리는 시간은 약 2분이며, 배양기로 영영분이 연속적으로 공급되고 있어 생물시료로 공급되는 발광박테리아가 건강성을 유지하는 배양조건이 갖추어진다. 배양기 내의 발광박테리아는 증식과 사멸이 공존하는 상태로 초기 운전 시 높은 밀집도를 나타내고 서서히 밀집도가 낮아져 약 1개월간 측정분석이 가능한 배양상태를 유지할 수 있으며, 이후에는 멸균과정을 거쳐 재배양과정을 거쳐야 장비의 운전이 가능하다. 실험장치의 운전조건을 Table 2에 나타내었다. V. fischeri의 성장과 독성반응에 미치는 영향인자는 매우 다양하지만, 중요한 요인으로 온도와 염분농도를 들 수 있다. 연속배양을 위한 최적 온도는 18~26℃이고, NaCl 농도는 0.9~2.0% 범위가 최적 조건으로 제시되고 있다[21]. 본 연구에서는 배양기와 측정이 이루어지는 부분에서 유지되는 온도가 22 ± 1℃이고 염분농도의 경우 시험대상 시료에 염분이 없는 경우에 25%의 NaCl 용액과 생물시료에 포함된 염분이 더해지면 약 1.4%의 NaCl 농도를 나타낸다. 발광대사는 산소를 필요로 하기 때문에 용존산소농도가 부족할 경우 발광이 저해될 수 있어 추가적인 포기 등이 필요할 수 있다. 물의 색이 진하거나 탁하면 빛을 흡수하거나 산란시킬 수 있어 발광 손실을 나타낼 수 있으므로 현장시료와 증류수를 비교하여 측정하거나, 현장시료의 발광량을 베이스라인으로 하여 측정할 수 있다. 색도에 의해 현장수의 발광량이 현저하게 낮을 경우에는 희석하여 측정할 필요가 있다.
3.3. 독성도 계산 및 검정독성도 계산은 독성물질에 대한 발광박테리아의 발광저해 특성을 이용하여 대조구의 발광박테리아의 발광량(Reference PMT value)과 실험구의 발광량(Sample PMT value)으로부터 발광량 감소로 인한 독성저해도(Inhibition)를 산출하였다[16,22]. 본 실험장치에서 발광량(PMT value) 측정주기는 10초로 설정하였으며, 실험구와 대조구를 약 10분 간격으로 교대로 노출시켰다. 증류수 대비 페놀 표준용액의 농도별 독성도 실험에서는 3회씩 교대로 노출시키고, 현장수를 바탕시료로 하는 페놀 모의 독성실험은 현장수와 폐놀을 첨가한 현장수를 2회씩 교대로 노출시켜 발광량(PMT value)을 10초 간격으로 연속 측정하였다. 독성도 계산은 대조구에서 실험구로 시료가 전환되어 발광량이 변화는 구간의 측정자료는 제외하고 전후 5분간의 발광량을 평균값으로 계산하여 주입농도별 발광저해도를 산출하였다. 식 (2)에 발광저해도 계산식을 나타내었다.
I : Inhibition(%)
Ir : mean PMT value for reference
Is : mean PMT value for sample
위 식 (2)에 계산된 발광저해도로부터 농도별 평균값을 사용하여 최소제곱법(least-squares statistics)에 의한 Inhibition curve를 직선식으로 나타내어 EC20와 EC50 값을 추정하였다. V. fischeri의 독성표준물질 중 하나인 아연(Zn2+) 표준용액을 이용하여 동일한 방법으로 검정을 수행하였다.
4. 결과 및 고찰4.1. 페놀 독성평가페놀은 대표적인 생물독성 시험물질로 안정성과 반복성이 우수하여 독성테스트에 많이 사용되고 있다[23,24]. 페놀은 수용액 상태에서 약한 산성을 띠며, 사용된 페놀 표준원액은 1000 mg/L로 pH가 5.6이고, 희석된 농도에 따라 pH가 5.6~6.0으로 약산성의 농도를 나타내었다(Table 3). Fig. 2에 MicroToxⓇ CTM 장비에 증류수와 페놀 표준용액을 농도별(1.5, 2.0, 2.5, 3.0 mg/L)로 3회씩 교대로 주입시켜 측정된 발광량(PMT value)의 변화를 나타내었다. 시료로 사용된 페놀 농도에 따라 1.0 mg/L에서는 발광량 변화를 확인할 수 없었으나, 1.5 mg/L에서 발광량의 변화가 관찰되었으며, 증류수를 기준으로 약 3.5% 정도의 발광량이 감소하였다. 페놀 2.0 mg/L에서는 약 40.7%, 2.5 mg/L에서는 70.9%, 3.0 mg/L에서는 약 97.4.%로 각각 발광량이 감소하였다. 페놀의 농도에 따른 발광저해도를 최소제곱법(least-squares statistics)으로 구하여 직선식(Inhibition curve)을 Fig. 3에 나타내었다. 이 직선식으로부터 20%, 50%에 해당하는 발광저해 영향농도(EC20, EC50)를 산출하였고, EC20과 EC50은 각각 1.7, 2.2 mg/L로 계산되었다(Table 4). 타 생물종에서 페놀에 대한 독성반응성을 연구한 결과를 살펴보면, Daphnia magna의 경우 48시간 반수영향농도(48 h-LC50)가 9.59 mg/L [25]와 11.64 mg/L [26], 24시간 반수영향농도(24 h-LC50)는 30.59 ppm [2]으로, 조류(Algae)인 Lemna paucicostata의 2시간 반수영향농도(2 h-EC50)는 2.05 mg/L [18]로 조사되었으며, 펜타클로로페놀에 대하여 Daphnia magna의 경우 24시간 반수영향농도(24 h-LC50)가 0.56 mg/L [27]와 V. fischeri의 경우 15분 반수영향농도(15 min-EC50)가 0.61 mg/L27)로 보고되었다(Table 5). 다른 생물종과 비교하였을 때 MicroToxⓇ CTM은 약 2분이라는 짧은 반응시간임에도 불구하고 페놀에 대한 독성 민감도가 높게 나타났다.
4.2. 현장수의 모의 독성반응페놀을 함유한 폐수에서 생물종에 따른 독성민감도(Toxic sensitivity)에 관한 연구에 의하면 발광박테리아, 조류, 물벼룩 순으로 민감한 것으로 보고된 바 있다[28]. 폐수 방류수에 페놀을 첨가하여 발광박테리아의 반응성을 모의하는 실험을 통해 실제 현장수에서 나타나는 반응패턴을 분석하였다. Fig. 4에 MicroToxⓇ CTM 장비에 폐수 방류수와 페놀을 첨가한 조제수를 농도별(2.0 3.0, 5.0, 7.0 mg/L)로 2회씩 교대로 주입하여 측정된 발광량(PMT value)의 변화를 나타내었다. 페놀 표준용액의 독성반응에서는 페놀농도 1.5 mg/L에서 발광량의 변화가 감지되었으나, 페놀첨가 폐수의 경우 2.0 mg/L에서 발광량의 변화가 관찰되었으며, 현장수를 기준으로 약 5.6%의 발광저해도를 나타내었다. 페놀 3.0 mg/L에서는 약 16.8%, 5.0 mg/L에서는 약 67.9%, 7.0 mg/L에서는 99.2%의 발광저해도를 나타내었다. 페놀첨가 농도에 따른 방류수의 발광저해도의 직선식(Inhibition curve)을 Fig. 5에 나타내었다. 이 직선식으로부터 20%, 50%에 해당하는 발광저해 영향농도(EC20, EC50)를 산출하였고, EC20과 EC50은 각각 2.9, 4.4 mg/L로 계산되었다(Table 4). 페놀 표준용액과 방류수에 페놀을 첨가한 경우에 동일한 페놀농도에서 다른 독성저해도를 나타내는데, 이는 방류수에 존재하는 배경물질과 페놀이 반응하여 발광박테리아에 직접적으로 미치는 독성영향이 감쇄된 것으로 판단되며, 페놀 표준용액과 페놀을 첨가한 현장수에서의 독성반응 패턴은 페놀 농도가 증가함에 따라 발광저해도도 증가하는 선형적 반응패턴을 보여주고 있다.
4.3. 표준용액 검정국제표준시험법(ISO 11348-3)에서 제시한 표준용액은 K2Cr2O7, 3,5-Dichlorphenol, ZnSO4 4H2O의 3가지 화합물로, 이 중 저 농도에서 반복성과 재현성이 우수한 아연(Zn2+)을 이용하여 장비의 민감도를 검정하였다. 증류수와 아연 표준용액을 농도별(0.2, 0.3, 0.5, 0.7 mg/L)로 하여 연속적으로 3회씩 교대로 주입시켜 측정된 발광량(PMT value)의 변화로부터 아연 농도별 발광저해도를 Table 6에 나타내었다. 아연 농도 0.1 mg/L에서는 발광량의 변화가 거의 없었으나, 0.2 mg/L에서 35.2%의 발광저해도를 나타냈으며, 0.3과 0.5 mg/L에서는 각각 66.2, 84.5%의 발광저해도를 나타내었다. 아연 농도 0.7 mg/L에서는 88.9%의 발광저해도를 나타내었고, 아연 주입농도에 따른 발광저해도는 로그함수와 유사한 반응패턴을 보여주고 있다(Fig. 6). EC50이 해당하는 농도구간인 0.2와 0.3을 최소제곱법으로 하는 직선식으로부터 EC50을 추정하였다. 아연의 EC50은 0.24 mg/L로 계산되었으며, Table 3과 같이 페놀의 경우 농도별 발광저해도의 표준오차가 0.5~8.1로 비교적 큰데 비하여 아연은 0.1~1.9 (Table 6)로 비교적 낮은 오차를 나타내고 있어 검정용액으로 사용하기에 적합한 것으로 판단된다.
4.4. 현장 적용성 검토발광박테리아 생물감시장치를 현장에 적용할 경우 생물의 이용성, 민감성, 채집 및 운송 등에 대한 내성, 환경요인에 대한 내성, 노출경로, 생태적․경제적 적절성, 표준화된 방법, 운영의 편리성, 수질오염물질에 대한 감시농도 등을 고려하여야 한다[10~12]. 발광박테리아는 이용성 측면에서 상수원수, 하천수, 폐수 등 다양한 시료에 적용이 가능하다. 특히, 염분을 다량으로 함유하는 폐수에도 적용이 가능하여 물벼룩을 이용한 생태독성시험으로 평가가 어려운 시료에도 적용이 가능하다. 독성에 대한 민감성은 대상 시료의 성상에 따라 차이를 보이나 독성반응시간이 짧아 현장 적용에 유리하다. 채집 및 운송 등에 의한 내성보다는 상업용 키트를 구매하여 사용이 가능하여 냉동된 상태로 운반 및 보존이 요구되며, 실험 시 재활성화 용액으로 쉽게 생물시료를 준비할 수 있다. 환경요인에 대한 내성은 해양성 생물이기 때문에 해양과 유사한 환경시료에 상대적으로 발광도가 높게 나타나는 특성이 있고, 외부환경에 노출되지 않는 배양기로부터 생물시료가 연속적으로 주입되기 때문에 환경시료에 대한 내성은 없다. 국내의 경우에는 해양환경공정시험법에서 표준화된 방법으로 사용되고 있으며, 국제적 표준시험방법으로 채택되어 다양한 수질환경에 적용되고 있다. 현장에서 독성에 대한 반응성 평가를 위해 증류수 및 표준용액을 이용하여 원격지에서 생물의 반응성 테스트가 가능하다. 수질오염물질의 배출허용기준은 지역구분에 따라 달리 적용되는데, 페놀류의 경우 청정지역(I)은 1 mg/L 이하, 가지역(II)과 나지역(III)은 3 mg/L 이하 그리고 특례지역(IV)은 5 mg/L 이하로 적용된다(Table 4). MicroToxⓇ CTM 장비로 페놀에 대한 EC20 수준의 농도(1.7~2.9 mg/L)로 경보기준을 운영할 경우 청정지역을 제외한 가, 나 그리고 특례지역에서 페놀류의 배출허용기준을 초과하여 방류하는지를 감시할 수 있을 것으로 판단되며, 페놀류 유출사고와 같이 고농도로 하천에 유입되는 경우에도 독성스크린 도구로 유용할 것으로 사료된다.
5. 결 론본 연구에서는 발광박테리아(Vibrio fischeri)를 생물종으로 하는 온라인 생물감시장치인 MicroToxⓇ CTM의 페놀에 대한 독성반응 특성 및 현장 적용 가능성을 평가하였다. 증류수를 대조구로 하는 페놀 표준용액의 발광저해도를 직선식(Inhibition curve)으로 하여 추정한 EC20과 EC50은 각각 1.7, 2.2 mg/L로 나타났다.
한편, 방류수를 대조구로 하는 페놀 첨가폐수의 발광저해도를 직선식으로 하여 추정한 EC20과 EC50은 각각 2.9, 4.4 mg/L로 나타났다. 페놀표준용액과 비교했을 때 페놀 첨가폐수의 반수영향농도가 2.2 mg/L 정도 높은데, 이는 바탕시료인 증류수와 달리 현장수에는 페놀과 반응할 수 있는 다양한 배경물질이 존재하여 발광박테리아에 직접적으로 반응하는 페놀독성이 감소하여 독성저해에 영향을 미치는 것으로 판단된다. 페놀 표준용액과 페놀을 첨가한 현장수에서의 독성반응 패턴은 페놀 농도가 증가함에 따라 발광저해도도 직선적으로 증가하는 유사한 반응성을 보여주고 있다.
발광박테리아를 이용한 생물감시장치에 대한 현장적용성 검토 결과, 다양한 시료에 적용이 가능하고 환경시료에 대한 내성이 없으며, 현장에서 쉽고 빠르게 독성을 모니터링할 수 있어 배출시설의 방류수 또는 하천수의 페놀 독성을 감시하는 도구로 활용이 가능할 것으로 판단된다. 본 연구에서는 페놀에 대한 독성영향을 평가하였으나, 실제 수환경에서는 다양한 오염물질에 의한 독성영향이 고려되어야 하므로 중금속 등 독성물질 및 현장수를 대상으로 한 후속연구가 필요할 것으로 사료된다.
Fig. 2.Variations of the PMT value in response to (a) 1.5 mg/L, (b) 2.0 mg/L, (c) 2.5 mg/L, (d) 3.0 mg/L of phenol diluent (DW: Deionized Water, P: phenol). 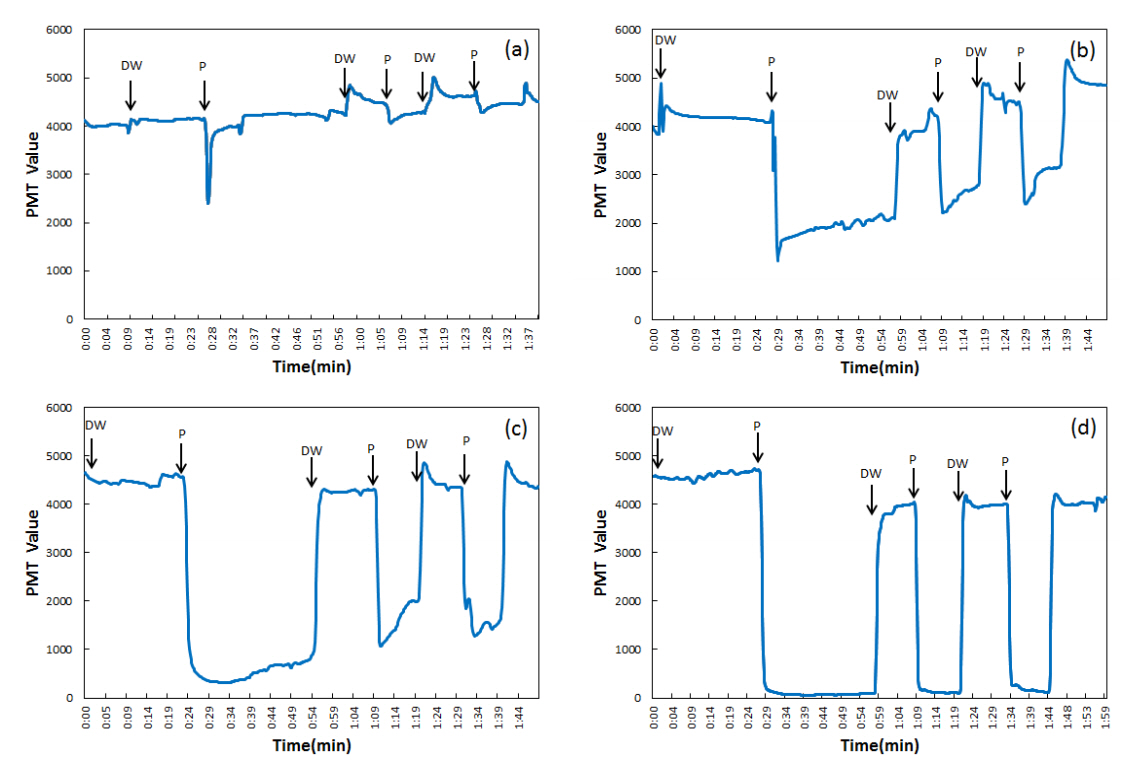
Fig. 4.Variations of the PMT value in response to mixtures of effluent wastewater with ( a) 2.0 mg/L, ( b) 3.0 mg/L, ( c) 5.0 mg/L, ( d) 7.0 mg/L of phenol ( EWW: effluent wastewater, P: EWW+phenol). 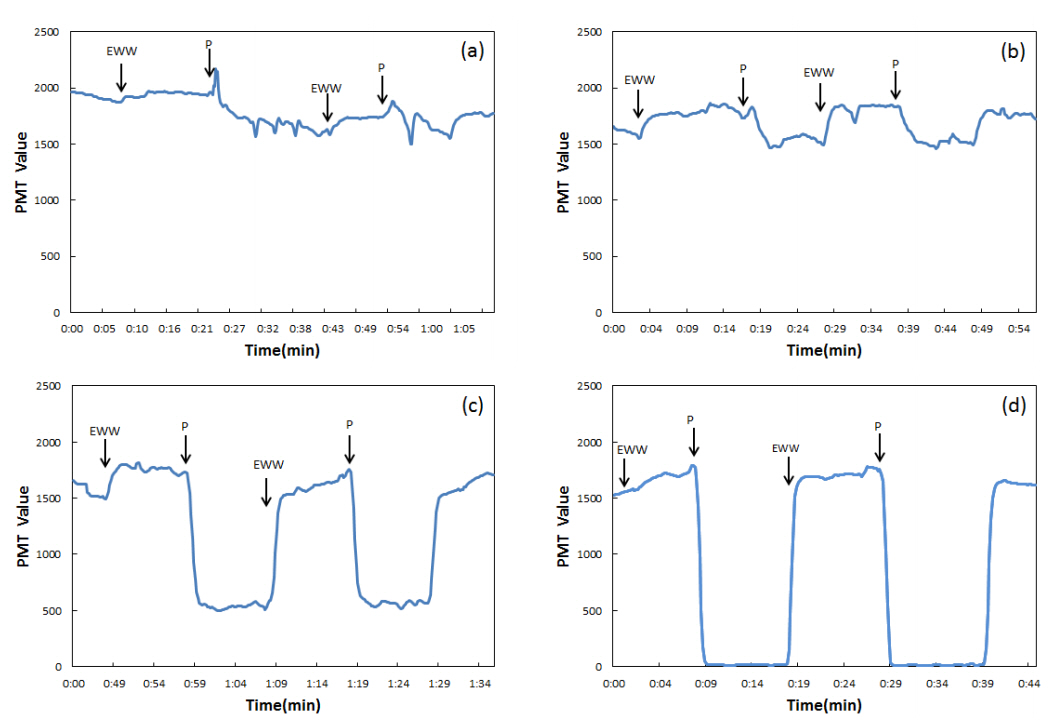
Table 1.Water qualities of effluent wastewater
Table 2.Operating condition of MicroToxⓇ CTM
Table 3.Inhibition and initial pH for MicroToxⓇ CTM exposed to phenol toxicity
Table 4.Estimated EC20 and EC50 of phenol by MicroToxⓇ CTM and limits of phenols for wastewater in Korea
Table 5.EC50 (or LC50) for bioassays exposed to phenols in the literature
References1. M. B.. Gu, G. C.. Gil, A multi-channel continuous toxicity monitoring system using recombinant bioluminescent bacteria for classification of toxicity, Biosens. Bioelectron., 16, 661-666(2001).
2. B. C.. Kim, K. S.. Park, S. D.. Kim, M. B.. Gu, Evaluation of a high throughput toxicity biosensor and comparison with a Daphnia magna bioassay, Biosens. Bioelectron., 18, 821-826(2003).
3. W. H.. van der Schalie, T. R.. Shedd, P. L.. Knechtges, M. W.. Widder, Using higher organisms in biological early warning systems for real-time toxicity detection, Biosens. Bioelectron., 16, 457-465(2001).
4. L. O.. Teles, M.. Fernandes, J.. Amorim, V.. Vasconcelos, Video-tracking of zebrafish (Danio rerio) as a biological early warning system using two distinct artificail neural networks: Probabilistic neural network (PNN) and self-organizing map (SOM), Aquat., 165, 241-248(2015).
5. Ministry of Environment, Notification No. 2017-74 of the Ministry of Environment, (2017).
6. I. C.. Kong, H. J.. Kwon, K. S.. Ko, Bioassessment and comparison toxicity of arsenics based on the results of various bioassays, J. Korean Soc. Environ. Eng., 32(8), 795-801(2010).
7. B. W.. Gu, I. C.. Kong, Toxicity assessment of nanoparticles based on seed germination and germination index, J. Korean Soc. Environ. Eng., 36(6), 396-401(2014).
8. L.. Bolelli, G.. Gentilomi, M.. Musiani, Improved detection of toxic chemicals using bioluminescent bacteria, Analytica Chimica Acta., 471, 113-120(2002).
9. V. L. K.. Jennings, M. H.. Rayner-brandes, D. J.. Bird, Assessing chemical toxicity with the bioluminescent photobacterium (Vibro fisheri): A comparison of three commercial systems, Water Res., 35, 3448-3456(2001).
10. National Institute of Environmental Research, Han-river Environment Research Laboratory, Han-river Environment Research Laboratory, "Bioassay on aquatic indicators (Daphnia magna, Vibrio fischeri) of wastewater (I), (2002).
11. National Institute of Environmental Research, Han-river Environment Research Laboratory, Han-river Environment Research Laboratory, "Bioassay on aquatic indicators (Daphnia magna, Vibrio fischeri) of wastewater (II), (2003).
12. National Institute of Environmental Research, Han-river Environment Research Laboratory, Han-river Environment Research Laboratory, "Bioassay on aquatic indicators (Daphnia magna, Vibrio fischeri) of wastewater (III), (2004).
13. ISO, Water quality-determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (luminescent bacteria test)-part3 : method using freeze-dried bacteria bacteria, ISO., 11348, 3(1998).
14. E.. Fulladosa, J. C.. Murat, M.. Martinez, I.. Villaescusa, Patterns of metals and arsenic poisoning in Vibrio fischeri bacteria, Chemosphere., 60, 43-48(2015).
15. J.. Marugan, D.. Bru, C.. Pablos, M.. Catala, Comparative evaluation of acute toxicity by Vibrio fischeri and fern spore based bioassays in the follow-up of toxic chemicals degradation by photocatalysis, J. Hazard. Mater. 213-214, 117-122(2012).
16. V. P.. Utgikar, N.. Chaudhary, A.. Koeniger, H. H.. Tabak, J. R.. Haines, R.. Govind, Toxicity of metal and metal mixtures: analysis of concentration and time dependence for zinc and copper, Water Res., 38, 3651-3658(2004).
17. J.. Michalowicz, B.. Bukowska, W.. Duda, The differences in phenolic content in rivers exposed and non-exposed to anthropogenic contamination, Chemosphere., 71, 735-741(2008).
18. J. S.. Park, M. T.. Brown, T. J.. Han, Phenol toxicity to the aquatic macrophyte Lemna paucicostata, Aqua Toxicol., 106-107, 182-188(2012).
19. E.. Bolelli, E. N.. Ferri, S.. Girotti, The management and exploitation of naturally light-emitting bacteria as a flexible analytical tool: A tutorial, Anal. Chim. Acta., 934, 22-35(2016).
20. C. M.. Miyamoto, Y. H.. Lin, E. A.. Meighen, Control of bioluminescence in Vibrio fischeri by the LuxO signal response regulator, Mol. Microbiol., 36(3), 594-607(2000).
21. S.. Scheerer, F.. Gomez, D.. Lloyd, Bioluminescence of Vibrio fischeri in continuous culture: Optimal conditions for stability and intensity of photoemission, J. Microbiol. Meth., 67, 321-329(2006).
22. A.. Soupilas, C. A.. Papadimitriou, P.. Samaras, K.. Gudulas, D.. Petrdis, Monitoring of industrial effluent ecotoxicity in the greater Thessaloniki area, Desalination., 224, 261-270(2008).
23. M. D.. Hernando, O.. Malato, M.. Farre, A. R.. Fernandez-Alba, D.. Barcelo, Application of ring study: Water toxicity determination by bioluminescence assay with Vibrio fischeri, Talanta., 69, 370-376(2006).
24. S.. Kottuparambil, Y. J.. Kim, H.. Choi, M. S.. Kim, A.. Park, J. H.. Park, W. G.. Shin, T. J.. Han, A rapid phenol toxicity test based on photosynthesis and movement of the freshwater flagellate, Euglena agilis Carter, Aqua Toxicol., 155, 9-14(2014).
25. M.. Arambasic, S.. Bjelic, G.. Subakov, Acute toxicity of heavy metals, phenol and sodium on allium cepa L., lepidium sativum L. and daphnia magna st.: Comparative investigations and the practical applications, Water Res., 29(2), 497-503(1995).
26. K. T.. Kim, Y. G.. Lee, S. D.. Kim, Combined toxicity of copper and phenol derivatives to daphnia magna: effect of complexation reaction, Environ. Int., 32, 487-429(2006).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||