미량오염물질 제거능 향상을 위한 생물활성탄 공정의 강화
Enhancement of Biological Activated Carbon (BAC) Process to Improve Removal Efficiency of Micropollutants
Article information
Abstract
목적
본 연구에서는 생물막 특성이 강화된 BAC 공정에서의 미량오염물질의 제거효율을 일반 BAC 공정과 비교· 평가하여, 정수장의 BAC 공정에서 미량오염물질의 제거효율을 상승시킬 수 있는 방안을 제시하고자 하였다.
방법
대상 미량오염물질로는 dibromo-methylparaben (Br2-MP)를 선정하였다. 회분식 실험과 실험실 규모 컬럼 실험을 수행하여 일반 BAC 공정과 인(P) 및 과산화수소(H2O2)를 첨가하여 생물막 특성을 강화한 BAC에서 Br2-MP의 제거 효율을 평가하였다. 회분식 및 실험실 규모의 컬럼 실험 결과를 사용하여 생분해 동역학을 평가하였다.
결과 및 토의
동일한 생체량 조건(2.0±0.2×107 cells)에서 Br2-MP의 제거효율을 비교한 회분식 실험에서 생물학적 활성도가 높게 나타난 강화 BAC 공정의 생물분해 속도상수(kbio)는 일반 BAC 공정보다 1.2배 높았다(강화 BAC: 3.4±0.3 mg·C/g·hr, 일반 BAC: 2.9±0.4 mg·C/g·hr). 동일한 습중량(1 g) 조건으로 Br2-MP의 제거효율을 비교한 회분식 실험에서, 생체량 함량이 높은 강화 BAC 공정의 생물분해 속도상수(kbio)는 일반 BAC 공정보다 1.9배 더 높았다(강화 BAC: 3.5±0.4 µg·ATP/g·GAC, 일반 BAC: 2.3±0.2 µg·ATP/g·GAC). 회분식 실험을 통해 강화 BAC 공정은 부착된 박테리아의 생체량과 활성이 증가하여 Br2-MP 제거에 더 효율적이었다. 다양한 수온(5, 25℃)과 공탑 체류 시간(EBCT: 5-40분) 조건에서 실험실 규모의 컬럼 실험을 진행한 결과, 전체 운전 기간 동안 일반 BAC 공정에 비해 강화 BAC 공정에서 Br2-MP의 제거효율이 더 높은 것으로 나타났다. 특히, 저온(5℃)과 짧은 EBCT(5분)에서 강화 BAC 공정과 일반 BAC 공정의 Br2-MP 제거효율은 큰 차이를 나타내었다. 5℃와 25℃에서 일반 BAC 공정의 kbio는 각각 0.0229 min-1, 0.0612 min-1, 강화 BAC 공정의 kbio는 각각 0.0470 min-1, 0.1421 min-1로 강화 BAC 공정이 일반 BAC 공정에 비해 2배 이상 빠른 Br2-MP 생분해능을 나타내었으며, 이러한 결과는 회분식 실험결과와도 유사하였다. 또한, 하절기 잦은 EBCT 변경에 대한 영향을 시뮬레이션한 실험에서 강화 BAC 공정은 일반 BAC 공정에 비해 상대적으로 안정적인 Br2-MP 제거효율을 유지하였다.
결론
강화된 BAC 공정은 일반 BAC 공정에 비해 우수한 미량오염물질 생물분해능을 나타내었다. 다만 경제성(인산염과 과산화수소 비용 등)과 수질을 고려할 때 하절기와 같이 EBCT가 단축되거나 수온이 낮아지는 동절기에 한하여 간헐적으로 강화 BAC 공정을 운영하는 것도 효율적인 대안으로 평가되었다.
Trans Abstract
Objectives
In this study, the removal efficiency of micropollutants in the biological activated carbon (BAC) process was investigated, and a method for improving the removal efficiency of micropollutants in the BAC process of water treatment plants was proposed.
Methods
Dibromo-methylparaben (Br2-MP) was selected as the target micropollutant. Batch and lab-scale column experiments were conducted to evaluate the removal efficiencies of Br2-MP in the conventional BAC process and the BAC with enhanced biofilm properties by the addition of phosphorus (P) and hydrogen peroxide (H2O2). Biodegradation kinetics were evaluated using results from batch and lab scale column experiments.
Results and Discussion
As a result of comparing the removal efficiency of Br2-MP in a batch experiment with the same biomass concentrations (2.0±0.2×107 cells), the biodegradation rate constant (kbio) of the enhanced BAC process was found to be 1.2 times higher than that of the conventional BAC process due to its higher biological activity (enhanced BAC: 3.4±0.3 mg·C/g·hr, conventional BAC: 2.9±0.4 mg·C/g·hr). Comparison of removal efficiencies of Br2-MP in batch experiments with the same wet weight of BAC (1 g) showed that the biodegradation rate constant (kbio) of the enhanced BAC process was 1.9 times higher than that of conventional BAC process due to higher biomass (enhanced BAC: 3.5±0.4 µg·ATP/g·GAC, conventional BAC: 2.3±0.2 µg·ATP/g·GAC). Through the batch experiments, the enhanced BAC process was efficient in removing Br2-MP via increasing both biomass concentrations and activity of attached microorganisms. Lab-scale column experiments conducted under different water temperatures (5 and 25℃) and empty bed contact time (EBCT: 5-40 min) conditions showed higher removal efficiency of Br2-MP in the enhanced BAC process than the conventional BAC process throughout the entire period of operation. In particular, the removal efficiency of Br2-MP between the enhanced and conventional BAC processes showed significant differences at low temperature (5℃) and short EBCT (5 min). At 5℃ and 25℃, the kbio of the conventional BAC process was 0.0229 min-1 and 0.0612 min-1, respectively, and the kbio of the enhanced BAC process was 0.0470 min-1 and 0.1421 min-1, respectively, These results showed that the enhanced BAC process had two times higher biodegradability of Br2-MP than the conventional BAC process. These results showed a similar trend to the results from the batch experiment. In an experiments simulating the impact of frequent EBCT changes during summer, the enhanced BAC process maintained a relatively stable removal efficiency of Br2-MP compared to the conventional BAC process.
Conclusion
The enhanced BAC process showed superior biodegradation of micropollutant compared to the conventional BAC process. Considering economic costs (e.g., costs of adding phosphate and hydrogen peroxide) and water quality, it appears to be an efficient alternative to operate the enhanced BAC process intermittently, limited to cases where EBCT is shortened, such as summer, or when water temperature is low, such as in winter.
1. 서 론
강이나 호수 등 상수원수 내에 잔존하는 유기성 미량오염물질은 수질 저하의 주요 요인으로 평가되고 있어 최근에는 수중의 미량오염물질에 대한 관심이 고조되고 있다[1]. 수중에 잔존하는 미량오염물질의 대부분은 하·폐수처리장 방류수에서 유래되며[2-4], 이러한 문제들이 이슈화되어 사회적 문제로 부각됨에 따라 최근 국내에서도 하수처리장 방류수 중에 잔존하는 미량오염물질의 모니터링과 다양한 공법을 이용한 고도처리에 대한 연구들이 활발히 진행중이다[5-8].
국내의 대형 정수장에서는 원수 중에 잔존하면서 정수공정으로 유입되는 미량오염물질 제거를 위해 활성탄 흡착을 주요 제거공정으로 사용하고 있으며, 분말활성탄(powdered activated carbon, PAC) [9] 보다는 입상활성탄(granular activated carbon, GAC) 공정을 대부분 운영하고 있다[10,11].
GAC 공정에서 활성탄에 흡착된 미량오염물질은 GAC 표면과 세공에 형성된 박테리아 군집에 의해 잠재적으로 생물분해된다. 생물분해 기작은 GAC의 흡착능을 회복시켜 사용연한을 연장하고, 흡착된 미량오염물질이 GAC에서 탈착되어 처리수로 유출되는 것을 방지한다[12]. 이 시기에는 물리적 흡착 보다는 생물학적 분해가 우세하지만 흡착과 생물분해 기작이 상호보완적으로 작용하며, 이러한 단계에 도달한 GAC 공정을 BAC (biological activated carbon) 공정으로 평가한다[13].
여러 연구결과들에서는 BAC 공정이 소독부산물, 이취 유발물질, 조류 독소물질, 개인 위생용품 첨가제, 잔류 의약물질 등을 효과적으로 제거하지만, 수온 저하와 접촉시간 감소가 이들의 제거율에 큰 영향을 미치는 것으로 보고하고 있다[14-21].
최근, BAC 공정의 효율 향상을 목적으로 BAC 공정 강화(enhancement)에 관한 연구가 활발히 진행되고 있다[22,23]. 강화 BAC 공정은 적정 농도의 무기성 영양물질(인(P), 질소(N))과 과산화수소를 유입수에 첨가하여 BAC 생물막의 생체량 및 활성도 증진을 유도하여 생물분해 효율을 향상시킨다[24,25].
실제 정수장에서는 유입되는 인(P)의 대부분이 응집공정에서 제거되어 후단의 BAC 여과지 유입수 중에 잔존하는 인(P) 농도는 0.01 mg/L 이하인 것으로 보고되고 있다[26]. 인(P)은 박테리아의 증식과 생장에 필요한 필수 무기성 영양물질로 BAC 공정을 운영 중인 국내의 대형 정수장에서도 BAC 공정 유입수에 잔존하는 낮은 인(P) 농도로 인해 BAC 공정에서의 제거 효율 감소와 손실수두 증가 등의 부작용이 유발될 가능성이 높다[27]. Son 등[23]은 적정 농도의 인(P) 첨가로 인하여 BAC 공정에서 생물분해 가능한 용존 유기탄소(biodegradable dissolved organic carbon, BDOC) 제거율이 2배 이상 증대된 것으로 보고하고 있다.
과산화수소는 생물막에 용존산소를 공급하고, 유기화합물 산화를 촉진시키는 과산화효소 발현을 유도하여[28] 유기화합물의 생물분해능을 증대시킨다. Jung 등[27]은 BAC 공정의 유입수에 적정 농도의 과산화수소 첨가로 난분해성 유기화합물에 대한 분해능이 뛰어난 α-와 β-Proteobacteria의 우점율이 증가하였으며[25], 활성 박테리아가 증가하여 생물막의 안정도가 향상된 것으로 보고하고 있다.
Paraben류는 다양한 산업제품, 의약품 및 개인위생용품 등에서 세균, 효모 및 곰팡이 등의 성장 억제용 보존제로 널리 이용되고 있다[29]. 낙동강을 대상으로 4종의 paraben류에 대해 모니터링한 연구결과에서 4종의 paraben류 중에서 methyl paraben (MP)의 검출 빈도(100%)와 농도(13.2∼33.9 ng/L)가 월등히 높았고, 특히 개인위생용품의 사용량이 증가하는 하절기에 하수처리장 방류수와 본류 지점들에서의 검출 농도가 더욱 증가하는 것으로 보고하고 있다[4].
폐놀계 화합물인 MP는 정수장에서 산화·소독 목적으로 사용되는 염소와 반응성이 높아서 염소와의 반응으로 5종의 할로겐화-MP들로 전환[30]되며, 이들은 Daphnia magna 및 Vibrio fischeri에 대한 급성독성을 나타내는 것으로 보고되고 있다[31].
상수원수에 잔존하는 MP가 정수공정으로 유입되면 전염소 처리(pre-chlorination)에 의해 대부분 할로겐화-MP들로 전환되며, 특히 상수원에서의 MP 농도가 증가하는 하절기에는 남조류[32,33] 사멸을 위해 전염소 투입농도를 더욱 증가시켜 운영[34,35]하기에 할로겐화-MP들의 생성 농도는 더욱 증가한다. 응집-침전 공정에서 이들의 제거율은 5% 미만[7]으로 매우 낮기 때문에 생성된 할로겐화-MP들의 대부분이 오존/BAC 공정으로 유입된다. 할로겐화-MP들은 오존처리에 의해 용이하게 제거가 가능하지만[36] 오존처리 공정이 구비되지 않은 정수장이나 오존 처리 시설이 구비되어 있더라도 오존처리 후에 잔존하는 할로겐화-MP들은 후단의 BAC 공정에서 최대한 제거해야한다. 이들은 할로겐화로 인해 생물분해능이 비교적 낮은 것으로 알려져 있으며[37], 특히 5종의 할로겐화-MP 중에서 Br2-MP의 생물 분해능이 가장 낮아[18] 수온 저하로 생물분해능 낮아지는 동절기와 생산량 증가로 체류시간이 단축되는 하절기에는 BAC 공정에서 Br2-MP의 완전한 제거에는 어려움이 있다[18].
본 연구에서는 회분식 실험과 실험실 규모 컬럼 실험을 통하여 인(P)과 과산화수소(H2O2)의 투입으로 일반 BAC 공정에 비해 생물막의 특성이 강화된 BAC 공정에서의 Br2-MP의 제거효율을 일반 BAC 공정과 비교・평가하였으며, 점진적으로 증가하는 미량오염물질 이슈로 인해 정수처리에 여러 가지 어려움을 겪고 있는 대형 정수장들을 대상으로 BAC 공정에서 미량 오염물질의 제거효율을 상승시킬 수 있는 대처 가능한 하나의 방법을 제시하고자 하였다.
2. 실험재료 및 방법
2.1. Br2-MP
Br2-MP (methyl 3,5-dibromo-4-hydroxybenzoate)는 TCI사(Tokyo, Japan)에서 순도 99% 이상의 제품을 구입하여 실험에 사용하였다. 내부 표준물질로 사용된 d4-MP (methyl 4-hydroxybenzoate-2,3,5,6-d4)는 CDN Isotopes사(Quebec, Canada)의 순도 98%인 제품을 구입하여 사용하였다.
2.2. 일반 및 강화 BAC용 활성탄 채집
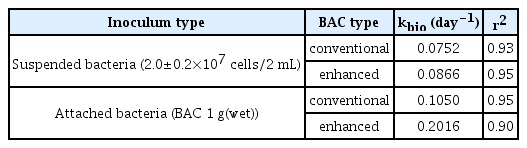
실험에 사용된 일반 및 강화 BAC는 파일럿 규모의 일반 및 강화 BAC (PO4-P와 H2O2 공급) 컬럼(내경: 20 cm, 높이: 250 cm)에서 2년간 지속적으로 운전된 BAC(석탄계, 신기화학, Korea)를 채집하여 사용하였다[25]. 일반 및 강화 BAC 컬럼의 여층 상층부(표면~-5 cm)에서 각각 채집 후 멸균된 생리식염수로 5회 세척하여 회분식 및 실험실 규모 컬럼 실험에 사용하였으며, 부착 박테리아의 생체량과 활성도 분석에도 이용하였다. Table 1에 나타낸 생체량과 활성도 분석결과를 보면 강화 BAC가 일반 BAC에 비하여 각각 1.5배와 1.2배 정도 높게 나타났다.
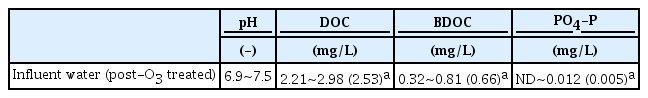
2.3. 실험실 규모 BAC 컬럼 유입수
실험실 규모 BAC 컬럼의 유입수는 낙동강 하류의 원수를 정수처리하는 파일럿플랜트 후오존 처리수(후오존 투입농도 : 1±0.2 mg·O3/mg·DOC)를 사용하였다. 후오존 처리수를 채수하여 2시간 정도 실온에 방치하여 잔류오존을 제거한 후 실험에 사용하였다. 실험기간(21년 2월~21년 12월) 동안의 후오존 처리수 성상을 Table 2에 나타내었다.
2.4. 회분식 실험[38]
일반 및 강화 BAC 부착 박테리아의 Br2-MP 생물분해능 평가를 위하여 회분식 실험을 수행하였다. Fig. 1에서 볼 수 있듯이 회분식 실험은 3개의 단위실험들로 나누어 수행하였다. 각각의 단위실험별 실험목적은 (1) 부유성 박테리아에 의한 Br2-MP의 생물분해능 평가(Fig. 1(left)), (2) 부착성 박테리아에 의한 Br2-MP의 생물분해능 평가(Fig. 1(middle)) 및 (3) 비활성 조건(NaN3 투입)에서 Br2-MP에 대한 BAC 잔여 흡착능 평가(Fig. 1(right))이다.

Batch experimental design for evaluation of Br2-MP biodegradability of attached bacteria of conventional and enhanced BACs.
회분식 반응기로는 300 mL BOD병을 이용하였으며, 깨끗이 세척된 300 mL BOD병 18개에 인산염 완충용액 200 mL와 무기 영양염[39]을 투입하여 멸균기(LAC-5060SD, Daihan Labtech, Korea)에서 멸균 후, 각각의 BOD병에 Br2-MP를 1000 ng/L의 농도로 투입하였다. Fig. 1에서와 같이 각각의 단위실험들의 조건에 따라 식종한 후, 회전식 배양기(LSI-3016R, Daihan Labtech, Korea)에서 20℃, 150 rpm의 조건으로 배양하였다.
비활성 조건에서 Br2-MP에 대한 BAC 잔여 흡착능 평가실험은 분말상의 NaN3 (≥99.5%, Sigma-aldrich, USA)를 500 mg/L의 농도로 회분식 반응기에 투입하여 NaN3를 완전히 용해시킨 이후에 각각의 BAC 식종물(inoculum)을 투입하였다.
부유성 박테리아 식종은 일반 및 강화 BAC를 생리식염수로 5회 세척 후, 실험용 티슈(science wiper, Yuhan kimberly, Korea) 위에서 10분간 건조시켜 일반 및 강화 BAC 각각 1 g씩을 전자 저울(XP-204, Mettler-Toledo, Switzerland)로 계량하였다. 건조된 각각의 BAC를 유리 바이알에 투입하고, 멸균된 10 mL의 생리식염수를 주입한 후 초음파 조사기(Sonics and Materials, VCX750, USA)에서 42 KHz로 2분간 초음파 처리[40]하여 부착 박테리아를 탈리시켰다. 탈리액을 공극 2.0 µm의 필터(Isopore membrane filter, Millipore, USA)로 여과하여 입자성 이물질을 제거하였다. 여과된 각각의 탈리액에 대해 flow cytometry (Cyto FLEX, Beckman Coulter, USA)를 이용하여 활성 박테리아(intact cell)를 계수하였다[23,27]. 생리식염수로 활성 박테리아 세포수를 1.0±0.1×107 cell/mL로 희석하여 식종액으로 사용하였다. 식종은 시료수 200 mL가 주입되어 있는 회분식 반응기 각각에 식종액을 2 mL씩 투입하였다. 식종액을 희석하여 사용한 이유는 두 식종액 내의 intact cell 수를 동일하게 하기 위함으로 이는 박테리아 활성도 차이에 따른 Br2-MP의 제거능을 평가하기 위함이다.
부착성 박테리아 식종은 채집된 일반 및 강화 BAC를 부유성 박테리아 식종에서와 동일하게 세척 및 수분이 제거된 일반 및 강화 BAC 1 g씩을 시료수 200 mL가 주입되어 있는 회분식 반응기에 각각 투입하였다.
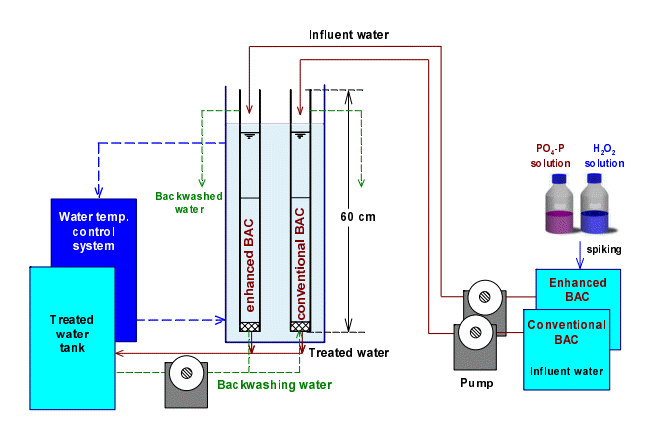
2.5. 실험실 규모 BAC 컬럼 시스템
BAC 컬럼 시스템은 Fig. 2에 나타내었듯이 2개(일반 및 강화 BAC 공정)의 아크릴 재질 컬럼(내경: 2.8 cm, 높이: 60 cm), 유입수와 역세척수를 공급하는 정량 펌프(MasterflexⓇ L/SⓇ, Cole-Parmer, USA), 수온변화(5℃, 25℃)를 위한 수온조절 시스템(Buchi, F-308 recirculating chiller, Switzerland) 및 용량20 L의 유입수조와 처리수조로 구성되었다.
채집 후 잘 세척된 일반 BAC와 강화 BAC를 각각의 BAC 컬럼에 50 mL씩 충진하였으며, 정량 펌프로 유입수(후오존 처리수) 공급 유량을 1.25~10 mL/min으로 변화시켜 각각의 BAC 컬럼의 공탑 체류시간(empty bed contact time, EBCT)을 5~40분으로 변화시켰다.
강화 BAC 컬럼 유입수조에는 PO4-P(85%, Sigma-aldrich, USA)와 H2O2(30%, Sigma-aldrich, USA) 농도가 각각 0.010 mg/L와 1 mg/L가 되도록 투입하였다[23].
BAC 컬럼 시스템의 준비 완료 후, Br2-MP를 100 ng/L의 농도로 각각의 유입수조에 투입하여 수온 20±0.5℃, EBCT 20분의 조건으로 운전하면서 4주간의 순응기간을 두었다. 실험을 진행하면서 역세척은 손실수두 증가와 관계없이 정량 펌프를 사용하여 처리수로만 주 1회 수행하였다.
2.6. 실험실 규모 BAC 컬럼 실험
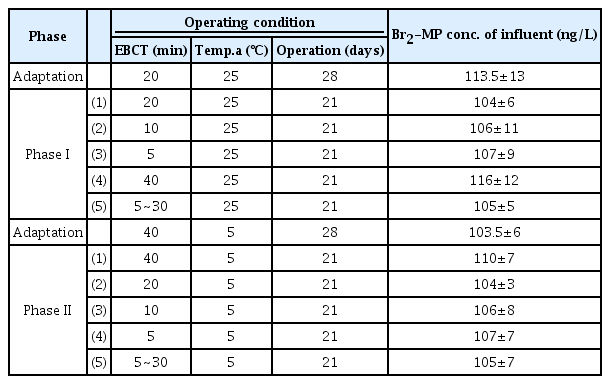
실험실 규모 BAC 컬럼 실험은 Table 3에서와 같이 두 단계(phase)로 나누어 실험을 수행하였으며, 각각의 단계별 실험 수행 이전에 수온조건 변화에 대한 28일간의 순응기간(adaptation)을 두었다. Phase I에서는 수온 25℃, EBCT 5분~40 분의 조건으로 Br2-MP에 대한 제거능을 평가하였으며, phase I (1)~(4)는 각각의 EBCT에서 21일간 동일한 조건으로 운전하면서, 주 2회 유입수와 유출수의 Br2-MP 농도를 분석하였다. 또한, phase I (5)에서는 21일간의 실험기간 동안 3일마다 EBCT를 5분~30분의 조건으로 변화시키면서 3일 동안 2회 채수하여 유입수와 유출수의 Br2-MP 농도를 분석하였으며, 잦은 EBCT 변화가 일반 및 강화 BAC 공정의 Br2-MP 제거능에 미치는 영향을 평가하고자 하였다.
Phase II의 실험에서는 수온 조건만 5℃로 변화되었으며, 모든 실험조건들이 phase I과 동일하였다. 순응기간을 포함한 phase I과 II의 모든 실험들에서 Br2-MP의 유입농도는 100 ng/L로 투입하였으며, phase I과 II의 세부 단계별 Br2-MP의 평균 유입농도를 Table 3에 나타내었다.
2.7. Br2-MP 분석[18]
Br2-MP의 분석은 UPLC (Agilent, 1290 series, Singapore)와 TQ/MS (Agilent, G6495C, Germany)를 사용하였다. 분석용 LC 컬럼은 Agilent사의 XDB C18 (4.6×150 mm, 3.5 µm)을 사용하였다. 시료수를 PTFE 재질의 0.45 µm 멤브레인 필터로 여과하여 80 µL를 주입하였으며, ESI (-) mode로 이온화하였다. Precursor ion은 308.9이며, product ion은 249.9(CE: 24 eV)와 80.9(CE: 38 eV)였으며, 이동상은 1 mM ammonium fluoride와 methanol을 사용하였고, 0.4 mL/min의 유량으로 분석하였다.
2.8. 부착 박테리아 생체량 및 활성도 측정[23,25]
부착 박테리아의 생체량(ATP 농도)은 채집 후 멸균 생리식염수로 세척된 BAC 습중량 1 g을 Velten 등의 방법[41]으로 전처리하여 luminometer (GlomaxⓇ Navigator, Promega, USA)를 이용하여 분석하였다. 또한, 박테리아 활성도는 3H-thymidine이 박테리아 DNA에 흡수되는 양을 평가하는 방법을 이용하여 분석하였다[23]. 채집 후 멸균 생리식염수로 세척된 BAC 습중량 1 g을 전처리하여 liquid scintillation analyzer (PerkinElmer, Quantulus 1220, USA)로 분석하여 구한 DPM (disintergrate per minute) 값으로 박테리아 DNA에 결합된 thymidine의 양을 계산하여 BAC g 당 생체량으로 환산하였다[23].
3. 결과 및 고찰
3.1. 회분식 실험
일반 BAC (conventional BAC)와 강화 BAC (enhanced BAC)의 Br2-MP 생물분해능 평가를 위해 Fig. 1에서와 같이 3개의 단위실험들로 수행된 회분식 실험결과를 Fig. 3에 나타내었다.

Br2-MP concentration in batches containing various inocula. (a) suspended bacteria inoculation (biotic), (b) attached bacteria inoculation (biotic), (c) attached bacteria inoculation (abiotic).
일반 및 강화 BAC에서 탈리시킨 부유성 박테리아(2.0±0.2×107 cells)를 식종하여 배양시간에 따른 Br2-MP의 잔존농도를 평가한 결과를 Fig. 3(a)에 나타내었다. Fig. 3(a)에서 볼 수 있듯이 식종한 경우(conventional BAC, enhanced BAC)에는 배양 15일 후에 Br2-MP가 완전히 제거되었으며, 전체적인 Br2-MP의 농도감소 경향도 매우 유사하게 나타났다. 식종하지 않은 경우(no inoculum)에는 자가 분해에 의한 결과로 보여지는 소폭의 농도 감소경향이 나타났으나 감소된 농도는 초기 농도의 10% 미만이었으며, Fig. 3(b)와 Fig. 3(c)에서의 식종하지 않은 경우(no inoculum)에도 거의 유사한 경향을 보였다.
일반 및 강화 BAC의 부착성 박테리아(습중량 BAC 1 g)를 식종하여 배양시간에 따른 Br2-MP의 잔존농도를 평가한 결과를 Fig. 3(b)에 나타내었다. 부유성 박테리아를 식종한 Fig. 3(a)의 경우와는 달리 부착성 박테리아를 식종한 경우에는 배양 초기부터 빠른 농도감소 경향을 나타내었고, 각각 배양 5일째(enhanced BAC) 및 8일째(conventional BAC)에 Br2-MP가 완전히 제거되었으며, 강화 BAC를 식종한 경우가 더욱 우수한 생물분해능을 나타내었다. 이는 Table 2에 나타낸 일반 및 강화 BAC의 부착 박테리아 생체량의 차이에서 비롯한 것으로 강화 BAC의 부착 박테리아 활성도(activity)는 3.2±0.4 mg·C/g·hr로 일반 BAC의 2.9±0.3 mg·C/g·hr에 비해 1.2배 정도 높게 나타난 반면, 생체량의 경우는 강화 BAC의 생체량(3.5±0.4 μg·ATP/g·GAC)이 일반 BAC의 생체량(2.3±0.2 μg·ATP/g·GAC)에 비하여 대략 1.5배 정도 많은 것으로 나타났다. 동일한 박테리아 생체량 조건에서 Br2-MP의 생물분해능을 평가한 Fig. 3(a)를 보면 배양 초기부터 Br2-MP가 완전히 생물분해되어 제거되는 시점까지의 전체적인 Br2-MP의 농도감소 경향은 거의 유사하게 나타나 1.2배 정도의 활성도 차이가 유기성 오염물질의 생물분해 제거율에는 유의미한 차이를 유발하지 않는 것처럼 나타났다.
일반 및 강화 BAC 부착 박테리아의 활성을 억제(비활성)하여 각 BAC의 잔여 흡착능을 평가한 결과를 Fig. 3(c)에 나타내었다. 일반 및 강화 BAC가 식종된 반응기에서는 식종 이후 3일 정도까지는 Br2-MP 농도가 점진적으로 감소하였으나 그 이후로는 의미있는 농도 감소현상은 나타나지 않았다. 일반 및 강화 BAC가 투입된 반응기에서 운전기간 15일 동안의 Br2-MP 흡착 제거율은 19~23%, 흡착 제거량은 40~47 ng/BAC·g으로 평가되어 Br2-MP에 대한 흡착능이 잔존하였다.
일반 및 강화 BAC 부착 박테리아의 활성도 차이(동일한 박테리아 세포수 식종)와 생체량의 차이(활성 BAC 1 g씩 식종)가 Br2-MP의 생물분해에 미치는 영향을 직접적으로 평가하기 위하여 Fig. 3(a)와 Fig. 3(b)의 실험결과를 이용하여 각각의 조건에 대한 생물분해 동력학을 평가하였다. Fig. 4와 같이 ln (C/C0) vs. time이 직선식으로 나타날 경우 pseudo-first order rate로 표현 가능하다. 따라서 Fig. 3(a)와 Fig. 3(b)의 생물분해 반응을 pseudo-first order rate로 표현하였고, 식 (1)을 이용하여 생물분해 속도상수(biodegradation rate constant, kbio)를 구한 것을 Table 4에 나타내었다.

Pseudo-first order reaction plots for the biodegradation of Br2-MP in batch experiments using both suspended and attached bacteria from the conventional and enhanced BAC.
Biodegradation rate constants (kbio) of Br2-MP in batch experiments using both suspended and attached bacteria from the conventional and enhanced BAC.
Table 4에서 볼 수 있듯이 강화 BAC 박테리아를 식종한 경우의 생물분해 속도상수(kbio)가 모두 높게 나타났다. 동일한 세포수의 부유성 박테리아를 식종한 경우(활성도 차이에 따른 Br2-MP 생물분해능)는 1.15배 정도, 부착성 박테리아(활성 BAC 1 g)를 식종한 경우는 1.92배 정도 강화 BAC의 kbio가 높게 나타났다. 이러한 결과는 Table 1에 나타낸 부착 박테리아의 활성도 및 생체량 결과들과 비교해보면 아주 유사한 경향으로 강화 BAC의 경우 활성도는 일반 BAC에 비해 1.17배 정도, 생체량은 1.52배 더 높았다.
회분식 실험결과로 보면 강화 BAC의 강화된 생물막 특성(활성도와 생체량)이 Br2-MP의 생물분해능을 증진시킨 것으로 평가되었다. 따라서 실제 BAC 공정에서의 수온과 EBCT 변화에 따른 강화 BAC 공정의 효율을 모의하기 위해 실험실 규모 BAC 컬럼을 이용하여 일반 BAC 공정과의 비교실험을 수행하였다.
3.2. 실험실 규모 BAC 컬럼 실험
실험실 규모의 일반 및 강화 BAC 컬럼을 장기간(260일 이상) 운전하면서 수온(5℃, 25℃)과 EBCT 변화(5~40분)에 따른 Br2-MP의 제거능 변화를 모니터링하였다(Fig. 5). Fig. 5에서 볼 수 있듯이 수온을 25℃로 고정하여 운전한 1단계(phase I)에서 일반 및 강화 BAC 컬럼의 EBCT가 40분(phase I (4)), 20분(phase I (1)), 10분(phase I (2)) 및 5분(phase I (3))으로 감소할수록 Br2-MP 유출농도는 점진적으로 증가하는 경향을 나타내었다. 또한, EBCT 감소에 따른 Br2-MP 유출농도의 증가폭은 강화 BAC의 경우가 일반 BAC 보다 훨씬 작았다. 이러한 경향은 수온을 5℃로 고정하여 운전한 2단계(phase II)에서 더욱 명확히 나타났으며, 이는 일반 BAC에 비하여 강화 BAC가 생물학적 분해에 직접적인 영향을 미치는 EBCT 감소와 수온 저하시에도 더욱 안정적인 성능을 나타낸다는 것을 의미한다.
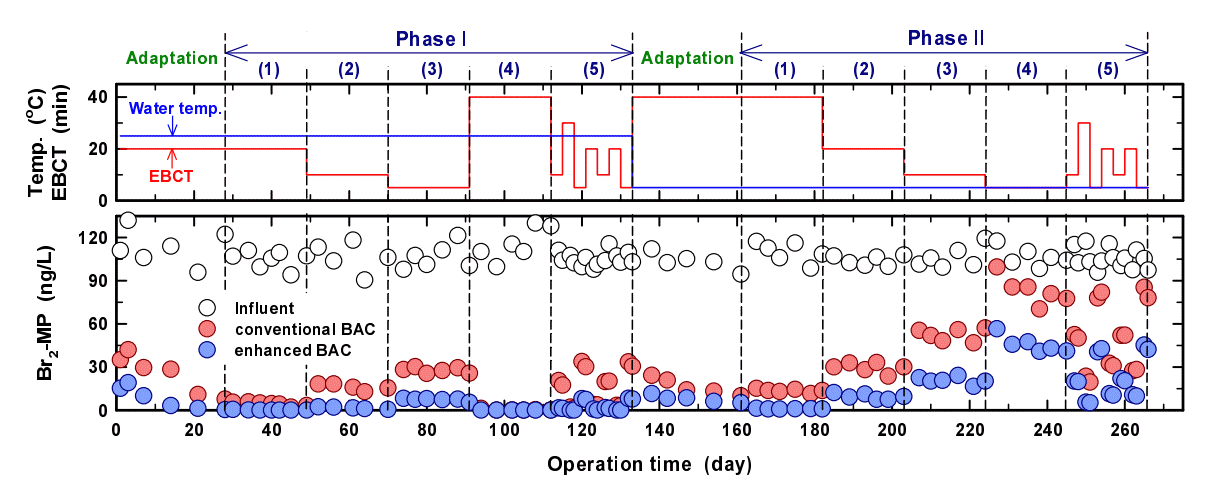
Evaluation of the impact of changes in EBCT and water temperature on the performance of the conventional and enhanced BAC filter.
수온 25℃에서 EBCT의 변화 없이 장기 운전(21일)한 조건(phase I과 II의 (1)~(4))과 2~3일 주기로 EBCT 변화가 잦은 운전 조건(phase I과 II의 (5))에서의 Br2-MP의 제거능 변화를 평가한 결과를 Table 5에 나타내었다. 수돗물 사용량이 증가하는 하절기에는 하루 중 시간대별로 수돗물 사용량이 급격히 변화하며, 이러한 변화는 정수장의 여러 공정들의 운영뿐만 아니라 효율에 적지 않은 영향을 미친다. Table 5에서는 이러한 목적으로 하절기(수온 25℃)에 BAC 공정에서의 급격하고 잦은 EBCT의 변화가 일반 및 강화 BAC 공정의 제거효율에 미치는 영향을 비교 평가하였다.

Comparison of Br2-MP removal efficiency for frequent and infrequent EBCT changes in conventional and enhanced BAC processes at water temperature 25℃.
Table 5에서 볼 수 있듯이 일반 BAC 조건에서는 EBCT 5분~20분에서의 평균 제거율은 EBCT 변화 없이 장기 운전한 조건(infrequent)의 경우 73.9%~95.9%였으며, 2~3일 주기로 EBCT 변화가 잦은 운전 조건(frequent)의 경우는 69.4%~96.6%로 나타나 EBCT 5분과 10분의 조건에서는 잦은 EBCT 변화로 Br2-MP의 제거율이 각각 4.5%와 2.8% 정도 감소하였으나 EBCT 20분의 조건에서는 제거율에 차이를 보이지 않았다. 강화 BAC 조건에서는 EBCT를 5분으로 운전한 경우에서만 잦은 EBCT의 변화로 평균 제거율이 0.6% 정도 감소된 것으로 나타났다.
짧은 주기의 잦은 EBCT 변화는 미량오염물질의 생물분해 제거율 변화에 큰 영향을 미치지는 않았지만 EBCT가 짧은 운전조건일수록 제거율의 감소폭이 컸으며, 이러한 경향은 강화 BAC 보다 일반 BAC 컬럼에서 더욱 명확히 나타났다. 실제로 하절기 정수장에서의 생산량 변화(BAC 공정에서의 EBCT 변화)는 일 1~3회 정도로 잦기 때문에 본 연구의 2~3일 주기의 EBCT 변화조건에 비하여 더욱 변화강도가 높다. 따라서 하절기에 일반 BAC 공정을 강화하여 운영하면 EBCT의 급변에도 불구하고 미량오염물질에 대한 제거효율 감소를 최소화할 수 있을 것으로 판단된다. Jung 등의 연구결과25)에서는 장기간 운전한 일반 BAC 공정을 강화 조건으로 대체(PO4-P와 H2O2 투입)하여 운전한 경우, 50일 정도 경과 후에 부착 박테리아의 생체량과 활성도가 최대치 부근까지 상승한 것으로 보고하고 있다. 따라서 원수 수질과 정수장 운영 측면에서 BAC 공정의 효율 증진이 필요한 특정시기에 BAC를 강화하여 운영하는 것도 경제성과 수질 측면을 모두 만족시키는 효율적인 하나의 대안으로 고려해 볼 수 있을 것이다.
Fig. 5의 장기간 운전결과를 바탕으로 각각의 조건별로 평균 제거율(잔존율)로 변환한 것을 Fig. 6에 나타내었다. EBCT 30분 조건에 대한 결과는 Fig. 5의 phase I (5)와 phase II (5)에서 수행된 2회 실험결과를 이용하였으며, 나머지 조건들에서 도출된 실험결과는 phase I과 II의 (1)~(5)에서 6회~8회의 실험 결과를 이용하였다.
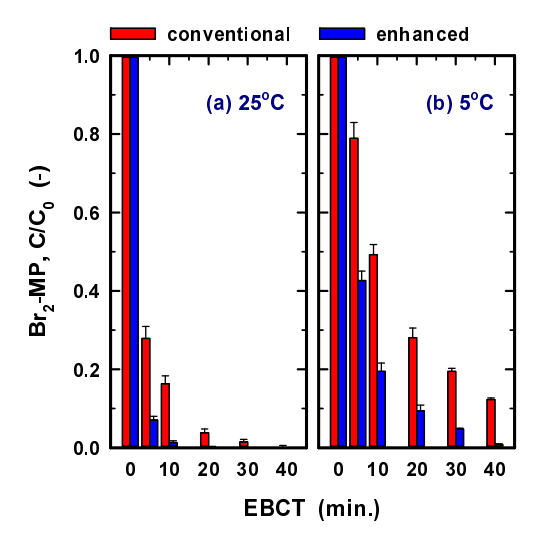
Changes in the Br2-MP residual ratio as a function of water temperature and EBCT in the conventional and enhanced BAC filter.
Fig. 6(a)에서 볼 수 있듯이 일반 BAC의 경우, 수온 25℃에서는 EBCT 5분~40분에서 Br2-MP 제거율이 72.1%~ 99.8%였으나 수온이 5℃로 저하되면 Br2-MP 제거율이 21.1%~87.7%로 감소하였다. 반면, 강화 BAC의 경우, 수온 25℃에서는 EBCT 5분~40분에서 Br2-MP 제거율이 92.9%~ 100%였으나 수온이 5℃로 저하되면 57.3%~99.2%로 감소하였다.
강화 BAC는 수온 5℃에서도 EBCT 20분의 조건에서 Br2-MP 제거율이 91% 정도로 나타났으며, EBCT 40분의 조건에서는 99% 이상의 제거율을 보였다. 또한, 수온이 25℃일 때는 EBCT 5분의 조건에서 Br2-MP 제거율이 93% 정도였으며, EBCT 20분의 조건에서는 99.9%의 제거율을 나타내어 동일한 실험조건에서 일반 BAC에서의 Br2-MP 제거율과는 다소 차이를 나타내었다. 특히, 동절기 수온 조건을 모의한 수온 5℃에서는 강화 BAC에 비하여 일반 BAC 공정의 제거율 감소가 급격하였으며, EBCT가 짧은 운전조건일수록 이러한 경향은 더욱 뚜렷이 나타났다.
수온 저하에 따른 BAC 공정에서의 제거효율 감소는 생물막(부착 박테리아)의 활성이 낮아져 유발되는 것이며, Melin 등[42]은 생물여과 공정에서 수온의 변화에 따른 유기물질 제거능을 평가한 연구결과에서 수온 변화시에 부착 박테리아의 생체량에 비해 활성도가 큰 폭으로 감소하여 BDOC의 생물분해능도 함께 감소한 것으로 보고하고 있다. 생물여과 공정의 일종인 BAC 공정에서 소독부산물[14,43]과 이취유발물질[16]의 제거능을 평가한 연구결과들에서도 수온 저하에 따른 이들 물질들의 생물분해 제거율의 급격한 감소현상이 보고되었다.
Fig. 6에 나타낸 일반 및 강화 BAC 공정에서 수온과 EBCT 변화에 따른 Br2-MP의 잔존율 결과를 바탕으로 생물분해 동력학을 평가(Fig. 7)하여 생물분해 속도상수(biodegradation rate constant, kbio)를 구한 결과를 Table 6에 나타내었다. Table 6에서 볼 수 있듯이 수온 5℃와 25℃에서 일반 BAC 공정의 kbio가 각각 0.0229 min-1와 0.0612 min-1인 반면, 강화 BAC 공정의 kbio는 각각 0.0470 min-1와 0.1421 min-1으로 평가되어 수온 5℃와 25℃에서 강화 BAC 공정의 kbio가 일반 BAC 공정에 비해 각각 2.05배와 2.32배 정도 큰 것으로 나타났다. 이는 Fig. 4와 Table 4에서 부착성 박테리아(BAC 1 g 식종)에 의한 Br2-MP의 회분식 생물분해 실험에서 도출된 결과와도 유사하였다.

Pseudo-first order reaction plots for the biodegradation of Br2-MP in column experiments using the conventional and enhanced BAC filter
4. 결 론
강화 및 일반 BAC 공정에서 Br2-MP 제거능을 비교・평가하기 위해 회분식 실험과 실험실 규모 컬럼 실험을 수행하여 다음과 같은 결론을 얻을 수 있었다.
회분식 실험에서 동일한 세포수의 부유성 박테리아를 식종한 경우에는 강화 BAC가 일반 BAC에 비해 Br2-MP에 대한 생물분해 속도상수(kbio)가 1.15배 높았고, 부착성 박테리아(활성 BAC 1 g)를 식종한 경우에는 강화 BAC의 kbio가 일반 BAC에 비해 1.92배 높았다.
실험실 규모 컬럼 실험에서 일반 BAC 공정에 비해 강화 BAC 공정에서의 Br2-MP 제거율이 높았다. 특히, 수온 5℃ 조건에서는 강화 BAC에 비하여 일반 BAC 공정에서의 제거율이 급격히 감소가 급격하였고, EBCT가 짧을수록 제거율 차이는 더욱 증가하였다. 수온 5℃와 25℃에서 Br2-MP에 대한 일반 BAC 공정의 kbio가 각각 0.0229 min-1와 0.0612 min-1, 강화 BAC 공정의 kbio는 각각 0.0470 min-1와 0.1421 min-1으로 나타나 일반 BAC 공정에 비해 강화 BAC 공정이 Br2-MP에 대해 2배 이상의 빠른 생물분해능을 나타내었다. BAC 공정에서 잦은 EBCT 변화는 Br2-MP 제거율 감소에 영향을 미쳤으며, 이러한 영향은 강화 BAC 공정에 비하여 일반 BAC 공정에서 훨씬 크게 나타났다.
경제성(인산염과 과산화수소 비용 등)과 수질을 고려할 때 하절기와 같이 EBCT가 단축되거나 수온이 낮아지는 동절기에 한하여 간헐적으로 강화된 BAC 공정을 운영하는 것도 효율적인 대안으로 평가되었다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.