자연유기물질 구성물질 특징에 따른 소독부산물 생성능 평가
The estimation of DBPs formation potential depending on the molecular structure of natural organic matter
Article information
Abstract
목적
자연유기물질(natural organic matters, NOM)은 생태계에서 발생하는 물질로써 그 기원에 따라 다양한 특성을 가지고 있다. 특히 수계에 존재하는 NOM은 수처리 공정의 효율을 떨어뜨리거나, 소독공정에서 소독부산물을 발생시키는 물질로 알려져 있다. 본 논문은 열분해 가스크로마토그래피 기술을 활용하여 자연유기물질의 분자구조를 파악하고 소독부산물 생성능과의 연관성을 확인하는 것을 목적으로 한다.
방법
다양한 기원의 NOM을 포함할 것으로 예상되는 수질 시료를 준비하여 소독부산물 생성능을 측정하였다. 분석을 위한 시료는 IHSS에서 구입한 Suwannee River NOM (SRNOM), Mississippi River NOM (MRNOM)과 낙동강 강물, 진해 하수처리장 방류수, 창원시 소재의 소하천에서 채수하였다. 총 유기탄소분석기, UV 흡광광도계, 형광분광광도계, 크기배제 크로마토그래피 기법을 활용하여 NOM 특성 분석을 하였으며, 액상 시료를 동결건조한 후에 열분해 가스크로마토그래피 질량분석기를 활용하여 분자 구조 분석을 진행하였다.
결과 및 토의
유기물질 분자량크기는 SRNOM과 MRNOM은 1400 Da 정도로 가장 작았으며, 낙동강 강물 NOM, 진해 하수처리장 방류수 NOM, 소하천 NOM은 8813 Da, 5537 Da, 7738 Da 정도 크기로 분석되었다. SRNOM과 MRNOM의 경우는 py-GC-MS 분석결과 유기물질의 소수성 및 humic 성분인 polyhydroxy aromatics와 lignin의 비율이 높은 분자구조가 유사했으며, 그에 따른 소독부산물 생성능이 높았다. 낙동강 강물, 진해 하수처리장 방류수, 소하천의 소독부산물 생성능 순서는 강물 > 방류수 > 소하천의 순서였다. IHSS에서 구입한 시료와는 달리 낮은 소수성과 미생물 기원의 물질(protein)의 함유량이 높은 것을 확인하였다.
결론
NOM의 다양한 기원에 따른 특성을 파악할 수 있었으며, 열분해 기술을 활용한 분자구조 분석을 통해 humic 성분 함량이 높을수록 높은 소독부산물 생성능을 보이는 것을 확인하였다.
Trans Abstract
Objectives
Since natural organic matter(NOM) is generated from an ecosystem, it has various characteristics depending on its origin. Especially, aquatic NOM reduces an efficiency of water treatment system and forms disinfection-by-products(DBPs) as a precursor. In this study, DBP formation potential was estimated according to the molecular structure of NOMs resulted by pyrolysis-gas chromatography-mass spectrometer(py-GC-MS).
Methods
Five NOM samples were characterized: Suwannee River NOM(SRNOM), Mississippi River NOM(MRNOM), Nakdong River NOM(NR), NOM in effluent of Jinhae wastewater treatment plant(WP), and NOM in a small stream(SG) in Changwon city. The various analytical instruments were used including TOC analyzer, UV spectrometer, fluorescence spectrometer, and size-exclusion chromatography. After freeze drying of NOMs, molecular structure of samples was identified by py-GC-MS.
Results and Discussion
Molecular weights of SRNOM and MRNOM were similar each other (~1400Da). The others(NR,WP,SG) were larger than the SRNOM and MRNOM. Hydrophobicity of the samples followed the order: SRNOM≒MRNOM > NR > WP > SG. Py-GC-MS results showed that SRNOM and MRNOM contain high portion of humic components. Otherwise, NR, WP, SG have protein which is originated from microbials. The DBP formation potential of SRNOM and MRNOM were the highest.
Conclusion
This research shows the different characteristics of NOMs originated from different source. The results confirmed that NOM contained high portion of humic components results in the formation of high concentration of DBPs.
1. 서 론
수 중에 존재하는 유기 물질은 대부분 자연유기물질(natural organic matters, NOM)이며[1], 자연유기물질은 탄수화물, 단백질, 리그닌, 유기산 등 다양한 크기와 특성을 가진 유기물들의 혼합 복합체로 존재한다[2]. 자연유기물질의 특성과 농도는 정수처리 공정 운영에 영향을 미칠 뿐만 아니라 맛, 냄새와 같은 수질 인자에 영향을 주며 소부산물(disinfection by-products, DBPs)의 생성에 많은 영향을 미친다. 소독부산물은 발암성 또는 돌연변이성을 유발한다고 보고되고 있다[3,4]. 대표적으로 소독부산물 중 클로로포름(chloroform)은[5,6] 메탄(CH4)에 결합된 3개의 수소가 염소로 치환된 화합물로 동물실험결과 발암성이 확인되어 인간에게도 발암물질로 작용할 가능성이 높은 것으로 알려져 있으며[7], 중추신경계의 기능을 저하시키고 간이나 신장에 손상을 일으킨다고 보고되어[8,9] 우리나라는 1990년부터 규제하고 있다.
자연유기물질 특성 분석을 위한 방법으로는 용존 유기 탄소(dissolved organic carbon, DOC), UV254(ultraviolet absorbance at a wavelength of 254 nm), SUVA(specific UV absorbance)측정을 일반적으로 사용하고 있다. 이러한 방법들은 유기물 농도와 같은 총량적인 지표로 활용할 수 있으나 특성에 관한 정보를 파악하는 데에 있어서는 복잡한 측정방법으로 인해 현장측정의 어려움, 다양한 성분을 포함하고 있는 자연유기물질의 특성이 하나의 수치로 표현되는 점 등의 한계가 있다. 이러한 한계를 극복하고 분자구조적 특성을 파악하기 위한 여러 가지 방법들이 존재한다. 분광학적 원리를 이용하는 fluorescence excitation-emission matrix(FEEM) [10]와 크로마토그래피를 이용한 high performance size exclusion chromatography(HPSEC) [11], 열분해 기법을 활용하는 pyrolysis gas chromatography mass spectrometry(py-GC-MS) [12]는 NOM 기원 및 분자구조 특성 분석에 유용한 방법들로 알려져 있다.
Py-GC-MS는 무산소 조건 하에서 분석시료를 가열하였을 때 시료로부터 휘발되거나 분해되어 나오는 가스들의 조성을 기체크로마토그래피 질량분석기로 분리 및 검출하여 시료의 특성을 파악하는 방법이다. 열분해를 통해 발생된 가스는 고분자 물질의 고유특성을 반영하므로 유기 분자의 정성 분석에 사용된다. Schulten과 Gleixner [13]는 자연유기물질을 탄수화물, 페놀, 리그닌, 지질, 알킬방향족 등 다양한 바이오 폴리머 그룹과 방향족 질소 화합물, 스테롤, 펩티드, 수베린 및 느슨하게 결합된 지방산의 10개 그룹으로 분류하고 유기물의 기원을 추론하였다.
정수처리공정에서 염소 소독은 비용이 저렴하고 살균력이 뛰어나며 잔류성이 길다는 장점으로 일반적으로 많이 사용되고 있지만, 물 속에 존재하는 NOM과 반응하여 인체에 유해한 소독부산물을 생성한다는 단점이 있다. 소독부산물의 생성에 있어 NOM 특성 및 농도, 소독제 농도, 수온, pH 및 소독제 접촉시간 등이 영향을 미치며[14,15], 특히 수중의 NOM은 소독부산물 생성 시 소독부산물의 종류와 농도에 큰 영향을 주는 주요 인자이다[16]. 이러한 이유로 기존에 NOM 특성에 따른 소독부산물 생성능에 관한 많은 연구가 이루어져 왔다. Goel 등[17]은 소수성 유기물과 소독부산물 생성능을 설명하였고, 소수성 유기물이 소독부산물 생성능에 영향을 준다는 것을 입증하였다. 또한 최근 형광 분석을 통해 소수성 특성을 가진 유기 물질이 소독부산물 생성을 증가시킨다고 발표하였다.
이처럼 현재까지 다양한 관점에서 NOM과 소독부산물 생성능에 관한 분석들이 많이 이루어져 왔다. 하지만 py-GC-MS는 유기 고분자를 분석하는 데에 효과적인 방법이며, 분자 특성을 파악할 수 있는 유용한 기술임에도 py-GC-MS를 활용한 NOM의 분자 특징과 소독부산물 생성에 대한 연구는 부족한 실정이다. 따라서 본 연구에서는 다양한 환경에서 생성된 NOM의 분자 특성을 py-GC-MS를 활용하여 파악하고 그 특징에 따른 소독부산물 생성능을 확인하고자 하였다.
2. 실험방법
2.1. 실험재료
기원이 다른 유기물질의 비교 분석을 위해 국제휴믹학회(International Humic Substances Society, IHSS)에서 판매하는 Suwannee River natural organic matter (SRNOM)(1R101N, IHSS)과 Mississipi River natural organic matter (MRNOM) (1R110N, IHSS)를 사용하여 용존유기물 시료를 만들었다. 또한 낙동강 원수(NR), 진해 하수처리장 방류수(WP) 그리고 창원시 소재의 소계천(SG)에서 채수하여 실험을 진행하였다. 모든 시료는 10월 중순에 채취하였으며, 시료는 0.45 um 필터로 여과한 후 4℃로 냉장보관 하여 분석 전까지 시료의 변질을 최소화하였다.
2.2. NOM 특성분석
유기물질의 양을 측정하기 위해 용존 유기 탄소와 UV254를 표준시험방법 및 수질오염공정시험기준에 따라 0.45 um 필터를 통과시켜 입자상 물질을 제거한 후 실험에 사용하였다. 용존 유기 탄소는 비분산 적외선 분광 검출기를 이용한 총 유기 탄소 분석기(TOC-LCPH, Shimadzu, Japan)를 이용하였고, 소수성 정도를 파악하기 위해 자외선-가시선 분광계(UV-1800, Shimadzu, Japan)를 사용하여 254 nm에서 흡광도를 측정하여 SUVA 값을 계산하였다. SUVA는 용존 유기물질 중 소수성 유기물질의 비율을 나타내므로[18] 용존 유기 탄소에 대한 UV254 측정값의 비로 나타낼 수 있다. 형광분석기(RF-6000, Shimadzu, Japan)를 사용하여 여기 파장(excitation wavelength) 230 nm에서 550 nm까지 5 nm 간격으로 설정하여 측정하였고, 방출 파장(emission wavelength) 250 nm에서 600 nm까지 2 nm 간격으로 설정하여 측정하였다. 시료의 용존 유기 물질 분자량과 크기 분포를 측정하기 위해 SEC컬럼(Protein Pak 125, 10 um, 7.8 × 300 mm)이 장착된 고성능 액체 크로마토그래피(LC-20A, Shimadzu, Japan)에 254 nm로 설정한 UV 검출기를 사용하였다. 시료의 주입량은 100 uL로 설정하였으며, 이동상으로는 phosphate buffer(96.0 mM NaCl + 1.6 mM Na2PO4 + 2.4 mM Na2HPO4)를 사용하여 0.7 mL/min의 유량 조건으로 분석하였다.
2.3. Py-GC-MS를 통한 NOM 구조 분석
15L의 시료를 회전증발농축기로 농축한 뒤 동결건조기(Bondiro, Ilshinbiobase, Repulic of Korea)를 사용하여 동결 건조 과정을 거쳤다. 건조된 시료 약 0.1 mg을 강자성 호일로 감싸고 퀴리점 열분해기(JCI-55, JAI, Japan)를 사용하여 590℃에서 열분해하였다. 열분해를 거친 시료는 가스크로마토그래피 질량분석기(GCMS-QP2020 NX, Shimadzu, Japan)에 주입한 후 DB-5MS(30 m × 0.25 mm × 0.50 um)컬럼을 사용하여 분리하였다. 분리된 유기물질은 library을 이용하여 유사도 70% 이상으로 일치하는 분자들로 구성성분을 확인하였으며, 확인된 결과는 기존에 제시된 열분해 유기물질을 구분하는 Bruchet 등[19]에 의한 기준에 따라 polysaccharides(PS), polyhydroxy aromatics(PA), lignin, protein, lipid, amino sugar (AS)로 구분하였다.
2.4. 소독부산물 생성능 측정
소독부산물의 생성능을 측정하기 위해 염소계 소독부산물인 트리할로메탄에 대한 실험을 진행하였다. 트리할로메탄 생성능(trihalomethane fomation potential, THMFP) 실험은 EPA Method 551.1와 먹는물수질공정시험기준(ES 05551.2c)을 참고하였다. 시료를 인산염 완충용액(phosphate buffer solution)을 사용하여 pH 7.0 ± 0.2 로 조정한 후, 차아염소산나트륨 용액을 각 시료의 DOC 농도에 4배 농도로 염소를 주입하였다. 염소를 주입한 시료는 공기층 없이 뚜껑을 닫아 20℃ ± 2℃ 인큐베이터에서 48시간 동안 반응 후 싸이오황산소듐(Na2S2O3)을 첨가하여 염소를 고정하여 분석을 진행하였다. 생성능 반응 후 기체크로마토그래피 질량분석기(GCMS-QP2020 NX, Shimadzu, Japan)와 퍼지 앤 트랩(ATOMX, Teledyne tekmar, USA)을 사용하여 분석하였다. 운반가스는 헬륨을 사용하였고, SGE사의 BPX-VOL(60 m × 0.25 mm × 1.4 um)을 column flow 1.8 mL/min으로 하여 분리하였다. 초기 오븐 온도 60℃에서 10℃/min의 속도로 150℃로 승온 한 뒤, 150℃에서 250℃까지 승온 속도 50℃/min로 하였으며 250℃에서 유지 시간을 3분으로 하였다. 이온 소스 온도는 220℃, 인터페이스 온도는 250℃로 설정하였다.
3. 결과 및 고찰
3.1. 유기물의 일반적 특성
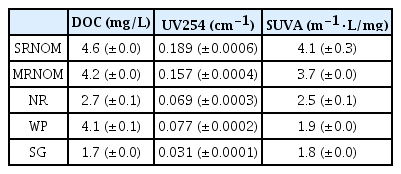
각 시료의 특성을 파악하기 위해 분석을 진행한 결과를 Table 1에 나타내었다. 측정된 용존 유기 탄소는 SRNOM이 4.6 mg/L으로 가장 높았고 MRNOM은 4.2 mg/L, WP는 4.1 mg/L, NR는 2.7 mg/L, SG는 1.7 mg/L 순서로 나타났다. 또한 소수성 유기물의 지표인 UV254 측정 결과는 SRNOM이 0.189 cm-1로 가장 높았고 MRNOM이 0.157 cm-1으로 뒤를 따랐으며, WP는 0.077 cm-1, NR는 0.069 cm-1, SG는 0.031 cm-1로 측정되었다. DOC와 UV254 측정 결과값의 비로 나타낸 SUVA 값은 물 속에 존재하는 유기 물질들의 소수성을 나타내는 데에 사용할 수 있다. SUVA 값이 4-5 정도이면 비교적 분자량이 큰 소수성 방향족 화합물로 구성되어 있고, SUVA 값이 2이하이면 상대적으로 humic 물질의 농도가 낮고 친수성 저분자 유기물이 다량 포함되어 있다고 알려져 있다[18]. SRNOM과 MRNOM의 경우 SUVA 값이 4.14과 3.7로 소수성 고분자 유기물질을 주로 포함하고 있다고 볼 수 있으며, NR, WP, SG의 경우 2.5, 1.85, 1.78 로 친수성 저분자 물질이 주를 이룬다고 볼 수 있다. 이러한 분석 결과는 humic 물질이 많은 기원의 시료(SRNOM, MRNOM)와 그렇지 않는 일반 호소수 및 인간활동에 의해 발생된 유기물질(NR, WP, SG)간의 차이를 보여준다. NR의 경우 기존 논문의 결과에서도 낮은 DOC 농도와 SUVA 값을 보여주고 있으며[20], SG의 경우는 유기물 유입이 적은 하천 상류의 특성으로 수중에 포함된 유기물질의 농도가 매우 낮고 humic 성분이 존재하기가 어려운 상황이다. WP의 경우 인간활동에 발생하는 하수를 처리한 시료이기 때문에 식물기원 유기물질의 오랜 분해 산물로 발생하는 humic 성분이 존재하기 어려운 이유로 SUVA 값이 낮게 나타난 것으로 판단된다.
Weishaar 등[21]에 의한 결과에서도 SRNOM의 높은 SUVA 값에 대해 소수성 방향족 유기물을 이유로 밝히고 있으며, NR과 SG와 같은 일반 하천수에 대해서도 Seo 등[22]은 친수성 저분자 유기물의 존재 비율이 높은 이유로 낮은 SUVA 값에 대해 보고하였다. 선행 연구에서도 하수처리장 방류수 시료에 대한 분석 결과로 SUVA값이 4이하로 친수성 저분자 유기물의 비율이 높은 것으로 제시하였고[18], 이러한 결과는 본 연구에서 얻은 결과와 매우 높은 유사성을 보인다.
Fluorescence excitation-emission matrix 분석은 전체 파장에 대한 형광스펙트럼을 나타내고 있기 때문에 전체적인 형광특징을 파악하는데에 있어 효율적인 방법으로, 다양한 출처의 휴믹질과 비휴믹질을 구별하기 위한 기술로 사용된다. FEEM 분석을 할 경우, 일반적으로 5가지의 peak가 관측되며 humic substance (HS)를 나타내는 peak A(ex:237~260 nm / em: 400~500 nm)와 peak C(ex: 300~370 nm / em:400~500 nm), protein 영역을 나타내는 peak B(ex: 225~237 nm / em: 309~321 nm)와 peak T1(ex: 275 nm / em: 340 nm), peak T2(ex: 225~237 nm / em: 340~381 nm)로 분류된다[23].
Fig. 1은 시료의 유기물 특성 조사를 위해 FEEM 분석을 수행한 결과이다. 모든 시료에서 peak A를 살펴볼 수 있었으며 SRNOM과 MRNOM은 peak A 영역에서 강한 peak가 나타났고, NR과 SG의 경우 비교적 약하게 나타났다. SRNOM과 MRNOM의 경우 peak A와 peak C가 나타나 humic acid와 fulvic acid를 포함하는 휴믹 물질이 함유되어 있을 것으로 보이는데, 이는 앞서 언급한 DOC와 UV254, SUVA의 결과와 일치한다고 볼 수 있다. 또한 NR시료와 SG시료에서는 humic-like 영역의 peak 뿐만 아니라 peak B와 peak T1, T2의 protein-like 영역의 peak도 나타났다. 이는 일반 하천수에서 나타나는 일반적인 특성으로 다양한 동식물에 의한 생태적 환경영향을 받는 수계에서 나타나는 것으로 알려져 있다. WP 시료의 경우 humic-like 영역에서 peak를 보이기도 하지만 protein-like 영역에서 강한 peak를 관찰할 수 있었다. 이는 하수처리 방류수에서 humic-like과 protein-like 영역이 나타나는 것은 미생물 활동에 의해 발생되는 soluble microbial product(SMP)의 영향에 의해 나타난 것으로 알려진 앞선 연구와 유사한 결과로 볼 수 있다[24-26].
3.2. Size exclusion chromatography 분석 결과
시료에 존재하는 NOM의 분자 크기를 파악하기 위해 크기배제크로마토그래피(LC-20A, Shimadzu, Japan) 분석을 진행하였고, 그 결과를 Fig. 2에 나타내었다. 해당 결과에서 NR과 SG가 가장 큰 분자량 분포를 나타내었고, 그 다음은 WP가 뒤를 이었으며 SRNOM과 MRNOM이 가장 작은 분자량 분포를 보여주었다. SRNOM과 MRNOM은 1436.8 Da과 1375.1 Da으로 앞선 연구들[27]에서 알려진 바와 같이 휴믹물질이 가지는 분자량과 유사한 결과값을 나타내었다. 이와 같은 결과는 앞선 SUVA, FEEM 결과에서 설명한 바와 같이 SRNOM, MRNOM 이 다량의 humic 성분으로 구성되어 있다는 것과 일치한다. NR은 8813.3 Da, SG는 7738.6 Da, WP는 5337.1 Da 로 각각 측정되었는데, 이는 미생물에 의해 발생되는 생분해성 다당류 또는 단백질 구조로 인한 것으로 판단된다. 이러한 예측은 다음 절에서 설명되는 py-GC-MS 분석 결과와 일치한다.
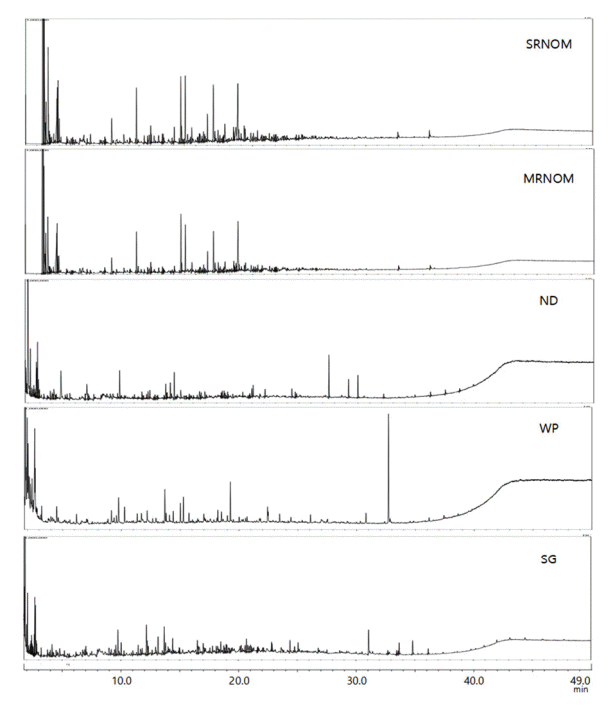
3.3. Py-GC-MS 분석 결과
Py-GC-MS를 통한 구성성분의 질량분석 결과를 Fig. 3에 나타내었다. 구조 분석 결과 모든 시료의 구성 성분 중에서 비교적 높은 비율로 단당류 단위체로 추정되는 성분이 검출되었고, SRNOM과 MRNOM은 포함하고 있는 성분의 비율이 유사한 것으로 분석되었다(Fig. 4). SRNOM은 polysaccharides 53.7%, amino sugar 2.8%, protein 9.2%, polyhydroxy aromatics 15.6%, lignin 10.8%, lipid 8.0%의 비율로 구성되어 있었으며 MRNOM은 polysaccharides 49.3%, amino sugar 2.5%, protein 14.6%, polyhydroxy aromatics 13.7%, lignin 8.3%, lipid 11.6%로 구성되어 두 시료의 구성 성분은 유사함을 보였다. SRNOM과 MRNOM은 FEEM과 SEC 분석 결과에서도 두 물질의 특성이 유사한 결과치를 나타내어 해당 분석 결과와 상응하는 결과로 판단된다. NR은 polysaccharides 40.9%, amino sugar 13.1%, protein 28.1%, polyhydroxy aromatics 1.7%, lignin 10.8%, lipid 5.3%의 비율로 polysaccharides와 protein성분이 차지하는 비율이 높게 나타났다. WP는 polysaccharides 41.6%, amino sugar 9.8%, protein 28.8%, polyhydroxy aromatics 8.9%, lignin 9.2%, lipid 1.6%으로 분석되어 polysaccharides와 protein이 높게 나타났지만 polyhydroxy aromatics와 lignin 성분도 10% 가까운 수치를 나타냈다. SG는 polysaccharides 30.0%, amino sugar 11.7%, protein 32.5%, polyhydroxy aromatics 6.8%, lignin 10.3%, lipid 8.6%로 나타났으며 protein과 polysaccharides가 높은 비율을 차지하였다. 유기물질 성분 분석 결과에서도 SRNOM, NRNOM 과 NR, WP, SG 간의 차이가 나타나는 것을 확인할 수 있다. 이는 SRNOM, MRNOM의 기원적 특성의 유사성에서 비롯된 것으로 국제휴믹학회(International Humic Substances Society, IHSS)에서 제공하는 정보에 따르면 SRNOM, MRNOM 은 휴믹물질이 풍부한 강에서 물질을 얻는다는 점에서 높은 SUVA 값과 상대적으로 높은 polyhydroxy aromatics의 값을 보인다. NR, WP, SG의 경우는 미생물 활동과 식물의 부패에 의해 발생하는 유기물질들의 혼합된 형태의 유기물질 분자구조 분석 결과를 보여주었다. 이는 FEEM 분석결과에서 protein-like영역의 peak가 나타났던 결과와 일치한다고 볼 수 있다. 또한 프랑스 Seine-Aval 처리장 방류수의 DOM 열분해 생성물 중 아세토니트릴과 아세트아미드와 같은 질소를 함유한 화합물들이 높은 비율을 차지 하고 있음을 확인할 수 있는데[28] 이는 WP와 같이 처리수에서 질소가 풍부한[29-31] 동일한 결과를 나타내고 있다.
3.4. 소독부산물 생성능 평가
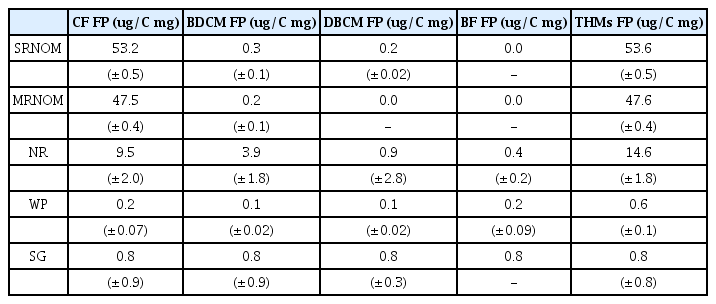
각 시료에 염소를 주입하여 소독부산물 생성능을 평가한 결과는 다음과 같다(Table 2). 트리할로메탄 생성 농도는 SRNOM이 53.6 ug/C mg 로 단위 탄소질량당 가장 높게 나타났고 MRNOM이 47.6 ug /C mg 로 두 번째로 높게 측정되었다. NR이 14.6 ug /C mg 농도로 뒤를 이었으며 그 다음으로 WP가 0.6 ug/C mg 그리고 SG가 0.8 ug/C mg 농도로 트리할로메탄이 생성되었다. 먹는물 수질기준에서 트리할로메탄의 농도 기준은 100 ug/L으로 되어 있다. 일반적인 원수의 DOC 농도가 2~3 mg/L 인 것을 고려하면, SRNOM과 MRNOM 은 기준치 이상으로 소독부산물을 생성할 수 있는 특성을 지닌 것으로 판단된다.
소독부산물 생성물의 py-GC-MS를 이용한 유기물 분자 구조 분석과 비교할 때 polyhydroxy aromatics와 lignin의 비율이 높았던 순서와 트리할로메탄 생성능 값이 일치함을 알 수 있었다. NOM에 의해 소독부산물이 생성되는 주요 원인은 NOM에 포함된 방향족 유기물질이 원인으로 알려져 있다[17,32]. 휴믹물질 등과 같이 방향족 분자구조를 포함한 NOM 은 유리염소가 존재할 경우 염소치환반응에 의해서 염소를 포함한 트리할로메탄으로 생성되는데 본 연구 결과에서 분자구조 단위로 유기물질을 정밀 분석한 결과를 통해 기존의 이론을 다시 한번 입증할 수 있었다.
트리할로메탄 4종 중 성분별로 보면 SRNOM과 MRNOM은 chloroform(CF)의 생성이 대부분을 차지하였으며, bromodichl oromethane(BDCM)과 dibromochloromethane (DBCM)의 생성은 미미하였고 bromoform(BF)은 생성되지 않음을 확인할 수 있었다. 브롬의 경우는 자연계에서 화합물 형태로 존재하고 그 농도가 낮아서 인간활동에 의해 유입되지 않는 한 수계에 높은 농도로 존재하지 않는다[33]. 이는 py-GC-MS 분석 결과에서 SRNOM과 MRNOM의 구성성분 중 브롬화합물을 찾기 힘들었던 것과 일치하는 결과이다.
4. 결론
본 연구에서는 NOM 분자구조에 따른 특성 및 소독부산물 생성능을 평가하기 위해 기원이 다른 유기물질은 선택하여 다양한 분석 기법을 통해 시료를 정밀 분석하였고 다음과 같은 결론을 얻을 수 있었다.
1) 일반적인 유기물질 특성을 나타내는 DOC, UV254, SUVA 값을 확인하였을 경우, SRNOM이 4.6 mg/L, 0.189 cm-1, 4.1 m-1·L/mg로 가장 높게 측정되었고, 형광 분석 측정 결과에서 SRNOM, MRNOM 은 대부분 humic 물질로 구성되어 있음을 알 수 있었다. 이와는 달리 NR, WP, SG는 humic 물질을 포함하여 미생물을 기원으로 하는 protein-like 성분을 포함하는 결과를 얻었다.
2) 분자량 크기 분포에서는 SRNOM과 MRNOM은 1436.4 Da과 1375.5 Da로 측정되었으며, NR은 8813.3 Da, SG는 7738.6 Da, WP는 5337.1 Da으로 각각 측정되었다. 시료 중 NR의 분자량이 가장 크게 측정되었다.
3) 유기물 분자구조 분석 결과 각 시료에서 모두 polysaccharides가 높은 비율을 차지하고 있었다. SRNOM과 MRNOM은 휴믹물질을 많이 포함한 유사한 성분 구조를 가진 것으로 판단되며. NR, WP, SG 시료는 polyhydroxy aromatics, lignin, protein 성분이 측정되었으며 SRNOM, MRNOM과 비교해보았을 때 polyhydroxy aromatics와 lignin의 구성 비율은 낮았다.
4) 트리할로메탄 생성능 평가 결과 SRNOM이 53.6 ug/C mg로 가장 많이 생성되었고, MRNOM은 47.6 ug/C mg, NR은 14.6 ug/C mg, WP는 0.6 ug/C mg, SG는 0.8 ug/C mg 생성되었다. SRNOM과 MRNOM의 경우 트리할로메탄 4종 중 클로로포름의 생성이 대부분을 차지하였다. 분자구조분석 결과와 비교할 경우, 방향족 분자구조를 포함하는 휴믹성분, polyhydroxy aromatics, lignin 등에 의해 소독부산물이 생성됨을 확인하였다.
Acknowledgements
이 논문은 2021~2022년도 창원대학교 자율연구과제 연구비 지원으로 수행된 연구결과입니다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.