지속가능한 수생태계 정화 기술로서의 퇴적물 미생물 연료전지의 동향 및 전망
Trends and Prospects of Sediment Microbial Fuel Cells as Sustainable Aquatic Ecosystem Remediation Technology
Article information
Abstract
퇴적물 미생물 연료전지(sediment microbial fuel cell, SMFC)는 수계 정화를 위하여 MFC를 수계의 퇴적물층에 적용한 시스템이다. SMFC는 퇴적물의 오염물질 제거 및 유기물 분해를 수행함과 동시에 전기 에너지를 생산할 수 있다. SMFC는 수계 하부의 퇴적물에 산화전극과 퇴적물 위의 물층에 환원전극을 설치하고, 외부 회로를 통해 두 전극을 연결하는 형태로 설치된다. 초기의 SMFC는 접근하기 어려운 수심이 깊은 지역이나 오지에서의 전력 공급원으로 사용될 목적으로 개발되었다. 하지만, 최근에는 자체 전력 공급을 통해 오염물질을 생물학적으로 정화하는 기술로 많은 관심을 받고 있다. 나아가 설치된 지역의 환경 상태를 감시하는 수단으로도 개발되고 있다. SMFC의 중요성에도 불구하고, 아직까지 국내 독자에게 SMFC의 연구의 동향과 전망을 담은 총설 논문은 발표된 바 없다. 이에 본 총설 논문에서는 SMFC의 메커니즘과 유기물, 무기물, 중금속의 제거의 기작, 그리고 이에 대한 기술의 현황에 대해서 다루었고, 향후 전망에 관해서 제시하였다.
Trans Abstract
A sediment microbial fuel cell (SMFC) is a system in which MFC is applied to a sediment layer of an aqueous system for water purification. SMFCs can remove contaminants from sediments and decompose organic matter while simultaneously producing electrical energy. SMFC is installed in the form of installing an anode in the sediment at the bottom of the water system and a cathode in the water layer above the sediment, and connecting the two electrodes through an external circuit. Early SMFCs were developed to be used as power sources in hard-to-reach deep water areas or remote areas. However, recently, it has attracted a lot of attention as a technology for biologically purifying pollutants through its own power supply. Furthermore, it is being developed as a means of monitoring the environmental condition of the installed area. Despite the importance of SMFC, no comprehensive review has yet been published to the Korean readers on the trends and prospects of SMFC research. Therefore, in this review paper, the mechanism of SMFC, their mechanism of removal of organic, inorganic, and heavy metals, and the current state of SMFC technology are discussed, and future prospects are presented.
1. 서 론
수계의 퇴적물은 유기탄소, 질소, 인 및 미량 원소가 다량 함유되어 있어, 고대로부터 농업에 있어 좋은 비료로 사용되었다[1,2]. 강의 범람이 주기적으로 발생하는 거대한 강 주변에서 초기 인류 문명이 발생한 이유도 강의 범람에 의한 퇴적물에 의해 농업 생산량이 증가했기 때문이다. 하지만 현대의 농업은 수계의 범람에 의존한 비료 공급에 의존하지 않고 있으며, 현대적인 기술의 물 관리 시스템에 구축되어 있다. 영양분 함량이 높은 수 생태계 보다 깨끗한 수 생태계를 유지하여 양질의 물을 공급하는 것이 훨씬 중요한 시대에 현재의 인류는 살아가고 있다.
현대에는 유기성 오염 물질뿐만 아니라 중금속이나 기타 난분해성 물질들이 다양한 산업 활동에 의해 배출되어 수생태를 오염시킨다. 유임된 오염물질은 점차 하부의 퇴적물로 축적되고 지속적으로 상층부의 수질을 오염시킨다. 오염된 퇴적물은 물이나 생태적인 경로를 통해 인간의 건강의 위험을 초래할 수 있다.
세계적으로 농약의 사용, 채광 및 제련과 같은 오염된 물, 공업용수 등에 의해서 토양과 퇴적물의 오염이 심각해지고 있다[3-6]. 2025년에는 인류가 배출하는 폐기물이 약 22억 톤에 이를 것으로 예상되며, 이 중 3천만 톤의 농약과 같은 인공 발생원에 의해 생성된 화학 물질에 의해 토양과 퇴적물이 오염될 것으로 예상된다[7,8].
현재 토양 및 퇴적물 정화를 위해 매립, 화학적 환원(chemical reduction), 화학적 산화(chemical oxidation), 안정화(stabilization), 고정화(solidification), 토양 세척(soil washing), 동전기법(electrokinetic remediation) 등 많은 물리 및 화학적 토양 정화 기법이 개발되었다[9-11]. 이러한 기법들은 비용의 문제, 2차 오염, 토양 침식과 같은 문제 등으로 넓은 범위에서 사용이 제한된다[12].
최근 기존 기술의 문제점을 해결하기 위해 식물이나 미생물을 이용한 생물학적 정화(bioremediation)가 많은 관심을 받고 있다. 생물학적 정화는 물리 화학적 정화 기법과 비교하면 환경 친화적이고 비용 효율적이지만, 일반적으로 오염물질의 농도가 특정 한계를 초과하면 정화하는데 시간이 오래 걸리고 처리 효과가 감소한다[13,14]. 생물학적 정화에는 퇴적물 속 오염 물질의 독성을 경감하기 위해 다양한 대사 경로를 이용하는 미생물 군집이 사용되는데, 이들이 최적의 활성을 띄는데 필요한 환경 조건을 맞추어야 하며 처리 속도나 처리 효율이 낮은 단점이 있다[14-18]. 따라서 기존의 생물 정화에 비하여 빠르게 오염물질의 제거함과 동시에 에너지를 생산하는 생물학적 정화 시스템이 필요하다[19-22].
미생물 전기화학 시스템(microbial electrochemical system, MES)은 전기적 활성을 띈 미생물 군집을 이용하여 전극 기반의 전기화학적 시스템에서 에너지를 발생하거나 유용한 물질을 생산하는 시스템이다. MES에는 미생물 연료전지(microbial fuel cell, MFC), 미생물 전기분해 전지(microbial electrolysis cell, MEC), 미생물 역전기투석 전지(microbial reverse-electrolysis cell, MRC), 미생물 탈염 전지(microbial desalination cell, MDC), 미생물 전기합성 전지(microbial electro-synthesis cell, MESC) 등이 있다[22-26]. MES는 전극을 기반하는 시스템을 통해 미생물 군집을 이용하므로, 생물학적 공정의 친환경적인 장점과 물리화학적 공정의 빠른 처리 속도와 안정성의 장점을 모두 가지고 있다[27,28].
이중 퇴적물 미생물 연료전지(sediment microbial fuel cell, SMFC)는 수계 정화를 위하여 MFC를 수계의 퇴적물 층에 접목한 것으로 퇴적물의 오염물질 제거 및 유기물 분해를 함과 동시에 전기 에너지를 생산하는 시스템이다[14]. SMFC는 수계 하부의 퇴적물에 산화전극(산화전극, anode)과 퇴적물 위에 있는 물층에 환원전극을 설치하여 외부 회로를 통해 연결하는 형태로 제작된다[29,30]. 초기의 SMFC는 접근하기 어려운 수심이 깊은 지역이나 오지에서의 전력 공급원으로 사용될 목적으로 개발되었다[31-33]. 하지만, 최근에는 자체 전력 공급을 통해 오염물질을 생물학적으로 정화하는 기술로 많은 관심을 받고 있다[34-38]. SMFC는 이뿐만 아니라 전기 신호를 통하여 퇴적물과 그 내부의 미생물의 상태를 감지하는 기술로도 개발되고 있다(Table 1) [39,40].
지금까지 많은 SMFC 연구가 진행된 바 있다. 하지만 아직까지 국내 독자에게 SMFC의 연구의 동향과 전망을 담은 총설 논문은 발표된 바 없다. 이에 본 총설 논문에서는 SMFC의 메커니즘과 유기물, 무기물, 중금속의 제거의 기작, 그리고 이에 대한 기술의 현황에 대해서 다루었고, 향후 전망에 관해서 제시하였다.
2. SFMC의 메커니즘
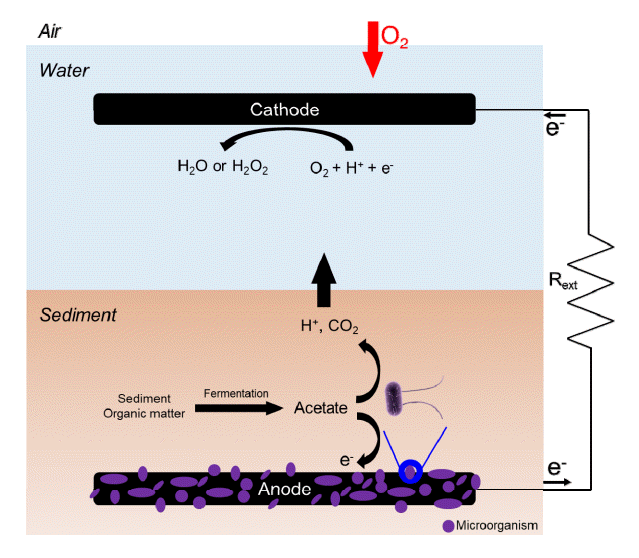
일부 MFC는 생성된 전자를 환원전극으로 이동하기 위해 전자 매개체가 필요하거나, 생성된 양성자를 환원전극으로 전달하기 위한 양성자 교환막이 필요하다[41-44]. 그러나 SMFC는 양성자 교환막이나 전자 매개체가 필요하지 않다. 이러한 SMFC는 산화전극은 퇴적물에 매립하고, 환원전극은 퇴적물 위에 있는 물에 띄워 구성한다. 산화전극은 퇴적물에서 미생물에 의해서 유기물을 분해하고 전자를 생산 및 CO2 발생시킨다(Eq. 1) [45]. 생성된 전자는 외부 회로를 통해 이동하면서 전류를 생산하고 환원전극에 있는 최종 전자 수용체와 반응을 한다. SMFC에서 일반적인 최종 전자 수용체는 높은 산화 전위와 접근성이 용이한 산소이며, 산소 환원 반응(oxygen reduction reaction, ORR)을 통해 물이나 과산화수소를 생성한다(Eq. 2, 3, 4, 5) [46-50]. 물을 생성하는 반응은 4개의 전자가 필요해 4전자 전달 반응으로 불리며, 과산화수소를 생성하는 반응은 2개의 전자가 필요해 2전자 전달 반응으로 불린다. 4전자 전달반응은 반응에 필요한 전위가 2전자 전달 반응보다 높아 2전자 전달 반응이 실제 운전에서 더 많이 일어난다. 이러한 과정으로 SMFC는 유기물을 분해함과 동시에 전기를 생산하며, 산화전극에서는 유기물뿐만 아니라 환원성 무기물의 분해나 중금속의 정화도 가능하다[45,51]. SMFC에서 퇴적물의 깊이가 증가하면 퇴적물에는 점점 더 강력한 환원제를 축적한다[52-54]. 즉, 산화전극에서 생성된 전자는 i) 환원전극 표면에 풍부한 미생물, ii) 침전물에 용해된 고체상의 환원된 이온을 환원전극으로 이동하여 전기를 생산할 수 있다[55]. 각 전극에서 발생하는 반쪽 반응식과 전위값은 다른 문헌에 이미 잘 정리가 되어 있다.
미생물 연료전지의 경우 생물학적 시스템이므로, 생물학적 표준 조건(STP, pH =7)에서의 생물학적 표준 환원 전위(vs. SHE)를 주로 사용한다. 각 조건에서 pH가 주요 화학물질의 농도가 변화하는 경우 네른스트 식(Nernst equation)에서 해당 화학 물질 농도를 대입하여 전극이 위치한 환경의 실제 전극 전위의 이론적 근사치를 계산할 수 있다. 아래 생물학적 표준 상태에서 대표적인 전극 반응식과 전위값을 열거하였다. 아세테이트가 분해될 시 산화전극 전위는 다음과 같다.
산성 환경에서 산소 환원작용이 일어날 때 환원전극 전위는 다음과 같다. 참고로 미생물 연료전지의 환원전극에서는 산소의 완전 환원에 의한 물분자의 생성 작용(Eq. 2-1)보다 산소의 불완전 환원에 의한 과산화수소 작용이 주로 일어난다(Eq. 2-2).
염기성 환경에서 산소환원작용이 일어날 때 환원전극 전위는 다음과 같다.
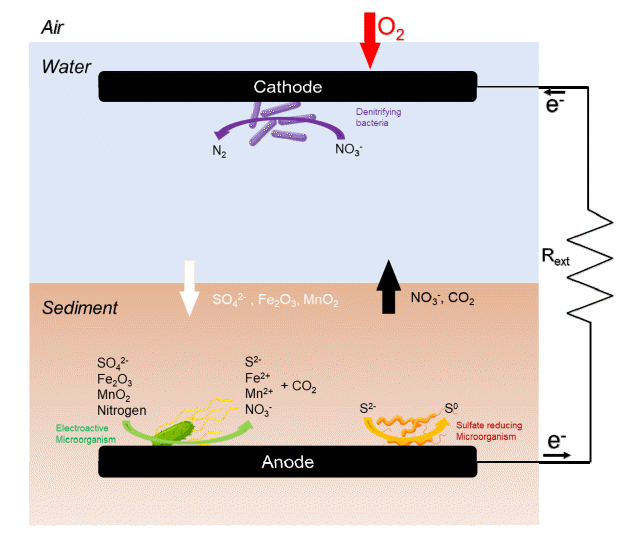
SMFC에서 미생물은 유기물을 분해하여 유기 화학적 에너지를 전기 에너지로 변환하기 위해 주로 전기 활성 미생물과 비전기 활성 미생물의 상호작용에 의존하며, 이 전기 활성 미생물은 세포 외로 전자를 수송할 수 있어 전자를 산화전극으로 전달하고 오염물질 제거함과 동시에 전력을 생산한다[56-58]. 또한, 일부 SMFC는 미생물을 환원전극에 접목한 바이오캐소드(biocathode)를 사용하여 환원전극의 산소 환원 반응을 촉진시킨다[59-62]. 이전 SMFC 연구에서 산화전극의 생물막이 일반적으로 Desulfucapsa 또는 Geobacteracea 2가지 미생물이 우점종이라고 밝혔다[39]. Desulfucapsa는 S0를 SO42-로 산화시키고, Geobacteracea는 퇴적물에 존재하는 아세테이트를 산화시킨다[63]. 또한, 산화전극에서 S2-는 S0로 산화반응이 일어날 수 있다[64]. 추가적으로 산화전극에서 유기물이 산화될 때 O2, MnO2, Fe2O3, SO42-가 환원 된다[65]. 이러한 산화 및 환원반응시 생성되는 전자는 외부 회로를 통해 환원전극으로 이동하고 그에 따라 전류를 생성한다.
3. SMFC의 유기물 및 무기물 분해
3.1. SMFC의 유기물 분해
수중 환경의 중요한 구성 요소인 유기물이 풍부한 퇴적물은 재생 가능한 에너지의 풍부한 잠재적 원천으로 간주될 수 있다. 그러나 산업 폐수 및 도시 폐수는 퇴적물의 표층을 유기물, 중금속, 질소 및 인과 같은 잔류성 유기 오염물질(persistent organic pollutants, POPs)로 오염시킨다[66]. 이러한 POPs는 전자 공여체 및 수여체가 없기 때문에 퇴적물에 있는 미생물만으로 정화 및 분해하기가 어렵다. 이러한 POPs를 제거하는 방법 중 하나는 SMFC를 사용하여 제거하는 것이다. SMFC에서 공기에 노출된 상부 표면이나 상부 물에 부유된 환원전극은 퇴적물에 매립 되어있는 산화전극의 유기물 산화를 위한 미생물의 최종 전자 수용체 역할을 하거나, 산화전극을 유기물 분해를 위한 전자 수용체로 사용한다(Fig. 1) [67,68]. 퇴적물에서 쉽게 분해되는 유기물의 경우 질산염(NO3-), Fe(III), 황산염(SO42-) 및 이산화탄소가 환원되어 아질산염(NO2-), Fe(II) 및 황화물(S2-) 등을 생성을 생성하고 메탄을 배출한다(Fig. 2) [69]. 또한, 산화전극에서 분해가 더 잘 일어나는 경우 산화전극에 존재하는 미생물이 더 많은 호흡을 하는 것을 의미한다. 즉, 더 많은 미생물 호흡은 SMFC의 산화전극 주변에서 총 유기 탄소(TOC), 용해 유기 탄소(DOC), 지방산의 증가로 오염물질 분해가 증가한다[70,71]. 이러한 SMFC에서 유기물을 처리하고 생성된 전류는 퇴적물에서 유기물 제거 효율과 비례적인 결과를 보인다[72,73].
이러한 유기물은 전기 활성 미생물에 의해 직접 분해되기도 한다. 따라서 SMFC는 특정 미생물 종(Pseudomonas, Desulfobulbus, Geobacter)을 풍부하게 하면 유기물 분해를 증가시킬 수 있다[74]. 이전 연구를 보면 Desulfobulbus 및 Geobacter와 같은 전기 활성 미생물이 전극에 풍부하게 있는 경우 오염물질의 분해가 증가했다[75]. 내화성 유기물(refractory organinc)의 경우 SMFC는 항생제, 다환 방향족 탄화수소, 석유 탄화수소 등의 분해를 향상시킬 수 있다[36,76,77]. 이러한 내화성 유기물의 분해는 산화전극이 내화성 유기물 산화의 전자 수용체의 역할을 하기 때문에 분해가 된다. 하지만 내화성 유기물의 경우 일반적인 유기물과 다르게 전기 활성 미생물이 직접적으로 분해를 하지 못한다. 그래서 내화성 유기물을 분해서 전기 활성 미생물이 아닌 Clostridium, Longilinea, Acetoanaerobium와 같은 다른 미생물의 양이 증가했다. 이러한 미생물은 전기 활성 미생물의 전자 공여체 역할을 하며, 이러한 상호작용을 통해 내화성 유기물을 분해할 수 있게 만든다[36,75]. 또한 석유 탄화수소로 오염된 퇴적물을 사용한 SMFC에서 황산염 제거 및 pH 증가가 관찰되었으며, 이는 석유 탄화수소 분해 과정은 황산염 환원 박테리아(sulfate-reducing bacteria, SRB)의 활성을 향상시킬 수도 있는 것을 의미한다[76].
이 외에도 유기물 분해 속도를 향상시키기 위해 SMFC에 외부 전원 공급 장치를 사용하기도 한다[78]. 이전 연구를 보면 바이오캐소드에 인산염 환원 박테리아를 접종하고 0.8 V(SHE 대비)를 환원전극에 인가한 SMFC를 설계했다[79]. 다른 연구에서는 탄소의 주요 공급원으로 1 g/L 농도의 아세테이트를 사용하고, 환원전극부 내부용액은 200 mg/L의 황산염(SO42-), 50 mg/L의 나이트로벤젠(C6H5NO2)를 사용했다. 36시간 동안 0.8 V의 전압을 인가하여 SMFC에서 나이트로벤젠의 약 98%가 제거되었다[49]. 환원의 주요 생성물은 황화물(0.51 mM) 및 아닐린(0.32 mM)으로 이었다. 또한, Wollinela sp. 및 Desulfovibrio sp. 이 2가지 종은 주요 황산염 및 니트로벤젠 환원제로 발견되었다. 전기화학적 산화를 적용한 미생물이 없는 환원전극은 나이트로벤젠의 69%를 제거했지만 황산염의 환원은 확인되지 않았다[49]. 또 다른 연구에서 염소화페놀을 6시간 동안 0.4V의 전압을 인가하여 산화전극부에서 H2O2 생성과 분해가 동시에 되었다[63]. 이 외의 탄소원과 오염 물질의 유형에 따른 유기물 및 무기물 제거 효율과 SMFC의 전력 밀도는 Table 2에 나와있다.
3.2. SMFC의 무기물 분해
3.2.1. 질소
과도한 무기질소(NH4+, NO2-, NO3-)는 수질을 저하 및 수생 환경의 부영양화를 유발한다. 이러한 무기질소는 오염원에서 유입되기도 하지만 퇴적물 축적되어 있던 무기질소가 물로 유출되기도 한다[80,81]. 퇴적물에서 총 질소(TN) 제거는 암모니아화(ammoniation), 질산화(nitrification), 탈질화(denitrification), 흡수 및 동화(assimilation), 휘발(volatilization)와 같은 일련의 과정이 있다[81]. SMFC의 산화전극은 퇴적물에 존재하는 질소 화합물의 무기화작용을 촉진하여 퇴적물에서 무기질소의 유출한다. 즉, 산화전극은 전자 수용체로 작용하여 퇴적물의 산화환원 전위(soil redox potential, Eh)값을 증가시켜 산화전극에서 간극수로 암모늄(NH4+)의 이동을 촉진한다. 그 결과 간극수 또는 퇴적물 위에 있는 물에서 암모늄 및 질산염(NO3-)이 축적됐다[74,82]. 그리고 바이오캐소드 또는 환원전극에서는 탈질을 촉진할 수 있으며, 이는 물에 축적된 질산염과 아질산염(NO2-)을 질소 가스 형태로 수중 질소를 제거한다[83,84].
3.2.2. 인
인은 수생 생태계의 부영양화에 기여하는 주요 요인이다[85]. 담수에서 인은 유기인과 무기인으로 2가지로 구분이 된다. SMFC는 금속, 칼슘, 철과 같은 물질을 사용해 인을 흡착한 뒤 퇴적물로 침전해서 수중 인을 제어할 수 있다[86,87]. 그럼에도 불구하고, 퇴적물에 축적된 인은 미생물 작용, 퇴적물의 산화환원 전위의 변경 및 pH의 변경을 통해 물로 다시 유출될 수 있다[86]. 수중 인 농도를 제어하는 핵심은 혐기성 환경에서 낮은 퇴적물 산화환원 전위를 극복하고 전자를 제어하여 Fe(III)의 비율을 높이는 것이다. 예를 들어, 철 환원 박테리아(iron-reducing bacteria, IRB)은 Fe(III)를 환원시켜 Fe(II)의 환원적 용해를 가능하게 하고, 인은 수중으로 유출된다. 철 환원 박테리아는 SMFC 산화전극 주변에 풍부하고, 전자를 환원전극으로 이동시킨다[88]. 이 전자가 이동시 퇴적물 산화환원 전위와 물의 pH를 증가시켜 궁극적으로 인의 용해 및 유출을 억제한다. 퇴적물 산화환원 전위 증가는 Fe(II)의 산화를 촉진시키고, pH의 증가는 칼슘, 인 및 기타 알칼리성 물질을 통한 인 제거에 영향을 준다.
3.2.3. 황
황 원소 또는 황산염으로 산화될 수 있는 침전물에 포함된 환원된 황은 SMFC의 전자 공여체 역할을 한다[89]. 산화전극 근처에 풍부한 황산염 환원 박테리아는 산화전극이 전자 수용체 역할을 하는 황산화의 주요 요인으로 간주된다[90,91]. 즉, 황산염에서 환원된 황이 재산화되어 전류 생성을 위한 전자를 제공하며, 이러한 과정에는 외전기 발생 박테리아(exoelectrogen bacteria, EB), 황 산화 박테리아(sulfur-oxidizing bacteria, SOB) 및 황산염 환원 박테리아가 관여한다[92,93]. EB, SOB 및 SRB 간의 연관성은 이전 연구에서 입증되었으며, 이러한 박테리아는 산화전극의 생체 촉매로 작용하여 황화물 산화를 통해 전기를 생성할 수 있다[94]. 대부분의 황화물은 SOB를 통해 황산염으로 산화되거나 부분적으로 황 원소(SO)로 산화될 수 있다. 생성된 황산염은 낮은 퇴적물 산화환원 전위 조건에서 SRB에 의해 황화물로 환원될 수 있다[92]. 한편, 황산염의 환원은 황화수소(H2S)의 생성으로 이어질 수 있으며, 이는 Fe(III)와 반응하여 황 원소를 형성할 수 있다[93]. 황 원소는 또한 황화철(FeS)로 전환되고 궁극적으로 황철석(FeS2)으로 전환되어 침전물에 축적될 수 있다. 이 외에도 SMFC을 사용해서 토양의 메탄 생성 속도와 황산염 생성을 감소시켜 토양의 색을 검은색에서 갈색으로 정화하는데 성공한 연구도 있다[95,96].
4. SMFC의 중금속 제거
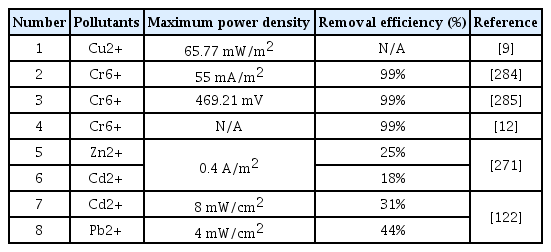
중금속과 같은 금속 오염물질은 완벽히 제거될 수 없어 제거되지 않은 금속 오염물질은 퇴적물에 잔류하게 된다. 이전 연구들을 보면 MFC는 폐수에 존재하는 오염물질이나 금속 오염물질을 대부분 제거할 수 있으며, 혐기성 소화조와 같은 기존 폐수 처리 기술을 대체할 수 있는 가능성을 보였다[97]. 즉, 금속 오염물질은 MFC를 통해 퇴적물에 존재하는 중금속을 정화하는데 활용할 수 있다[14]. 퇴적물에 존재하는 중금속 이온은 특정 상황에서 퇴적물의 위에 있는 물로 확산될 수 있지만, SMFC는 금속 오염물질을 퇴적물에 고정시키거나 산화 및 환원을 통해 제거할 수 있다[14,98-100]. SM FC에서 퇴적물의 위에 있는 물에 부유하는 환원전극은 중금속의 탈착, 흡착 과정에서 중요한 역할을 하며, SMFC에 의한 중금속 제거의 주요 메커니즘 중 하나는 환원전극에서의 환원이다. 환원전극에서 금속 이온은 산소 대신 최종 전자 수용체로 사용할 수 있으며, 이를 통해 중금속의 제거가 가능하다. 중금속에 따른 제거 효율과 SMFC의 전력 밀도는 Table 3에 나와있다.
4.1. 크롬
크롬(Cr)은 6가 크롬(Cr(VI)) 및 3가 크롬(Cr(III))으로 오염된 폐수를 처리하는 과정에서 퇴적물에 유입되는 독성 중금속이다[101]. 6가 크롬은 3가 크롬보다 반응성이 크며, 암 발병에 대한 심각한 건강 위험을 가지고 있다[102]. 3가 크롬은 불용성이며 퇴적물에서 생물적으로 이용이 거의 불가능하다. 그래서 3가 크롬은 용해되지 않기 때문에 6가 크롬을 3가 크롬으로 환원시키는 것이 크롬의 독성을 줄이는 효과적인 방법으로 알려져 있다. MFC는 환원전극에서 최종 전자 수용체로 6가 크롬을 사용하여 3가 크롬으로 환원할 수 있다. 최근 연구에 따르면 SMFC에서 6가 크롬을 3가 크롬으로 환원시켜 퇴적물에 존재하는 크롬을 제거했다[103,104]. 이러한 연구 중에서 저항에 따라 크롬의 제거율을 연구한 사례가 있다[100]. 충적토(fluvo-aquic soil)에서 100 Ω에서 최대 99.1%의 제거율을 보였고, 1000 Ω에서는 64.3%의 제거율을 보였다. 또한, 황토에서는 100 Ω에서 62.7%, 1000 Ω에서는 50.4%의 제거율을 보였다. 이 연구는 퇴적물과 저항이 크롬 제거에 많은 영향을 미치는 것을 밝혔다. 이와 유사한 연구로 식물을 사용한 SMFC에서 6가 크롬을 99% 제거한 연구가 있다[105]. 이 연구에서는 6가 크롬의 제거율은 초기 6가 크롬의 농도에 따라 달라지는 것을 밝혔다. 이뿐만 아니라 농업 토양과 SMFC을 사용해서 크롬을 제거한 연구도 있으며, 이 연구는 SMFC을 사용해서 토양의 크롬을 제거하는 것을 다시 한번 더 입증했다[106].
4.2. 비소
SMFC는 크롬과 같이 독성이 더 적은 물질로 환원시키는 것 이외에도 비소와 같은 중금속이 산화철 표면에서 퇴적물의 간극수로 확산되는 것을 방지할 수 있다. 이전의 여러 연구에서 SMFC의 산화전극이 산화철에 미치는 영향을 밝혔다[87,107-109]. 이러한 연구에서 SMFC의 산화전극은 철의 환원을 억제하여 철이 퇴적물의 간극수로 용해되는 것을 방지할 수 있다고 밝혔다. 퇴적물에 MFC를 적용한 SMFC는 퇴적물에 용해된 유기물의 분해 속도가 증가하고, 용해된 유기물의 조성의 변동이 줄어든다. 즉, 퇴적물에 존재하는 미생물이 이용할 수 있는 전자 공여체가 감소하여 산화철이 감소하고 산화철에 결합하여 침전된 중금속을 퇴적물의 간극수로 확산시킨다[110]. 이러한 철의 환원을 감소시키는 것 외에도 퇴적물의 산화훤원 전위를 변화하여 제1철(Fe(II))을 제2철(Fe(III))로 산화하는 것을 향상시킨다[107,109]. 최근 연구에 따르면 SMFC를 통해 용존 유기물의 감소로 인한 산화철이 감소하여 비소의 생체이용률(bioavailability)을 최대 47%까지 감소시켰다[110,111] 또 다른 연구에서는 SMFC를 사용해서 퇴적물에 존재하는 비소를 46.6%를 제거했다[112].
4.3. 우라늄
우라늄(U)은 광산이나 광산 폐수 등 우라늄이 포함된 폐수를 통해 퇴적물에 유입되는 중금속이다[113]. 또한, 우라늄은 수용성이 높을수록 독성이 강하며, 우라늄에 노출되면 신장 및 간 질환을 유발한다[114,115]. 산성 상태의 퇴적물에서 여러 형태의 우라늄중 U(IV)가 상대적으로 이동성이 높으면서 가장 많이 존재하고, 환원 조건에서는 난용성 U(IV)이 가장 많이 존재한다[114]. 이러한 U(IV)은 철 및 황산염 환원 박테리아(iron- and sulfate-reducing bacteria)가 전자 수용체로 사용하여 U(IV)의 이동성을 줄일 수 있다[116,117]. 하지만 이러한 반응은 전자 공여체의 부족과 철 및 황산염 환원 박테리아 군집의 상대적 낮은 풍부함으로 일어나기가 어렵다. 그리하여 아세테이트와 같은 전자 공여체를 퇴적물에 지속적으로 추가하여 철 및 황산염 환원 박테리아의 풍부함을 증가시켜 U(IV)의 침전을 촉진 시켰지만, 이는 추가적인 비용의 발생과 자연환경에 부정적인 영향을 미쳤다[116,117]. 아세테이트와 같은 전자 공여체를 퇴적물에 추가하는 방법이 아닌 SMFC를 접목하면 비용과 자연환경의 부정적인 영향을 줄일 수 있다. 이전 연구에서 Geobacter가 우라늄으로 오염된 퇴적물에 더 많이 존재하는 것을 확인했고, Geobacter가 생산하는 전자를 사용하여 우라늄을 제거하는 것을 제안했다[118-120]. 이를 기반으로 SMFC를 이용하여 우라늄 제거를 2005년 처음 연구되었다[99]. 이 연구에서는 산화전극을 –500 mV로 고정하여 퇴적물의 산화환원 전위를 변경하여 우라늄을 제거하는 것을 입증했다.
4.4. 기타 금속
MFC가 생산하는 전력을 퇴적물에 존재하는 중금속을 제거하기 위해서 사용한 연구가 있다[121]. 이 연구에서 동전기법(electrokinetic remediation, EKR)에 필요한 전력을 MFC를 통해 생산했다. 또한, 이 연구는 MFC를 사용하면 기존 EKR보다 저렴한 비용으로 논에서 아연과 카드뮴을 제거할 수 있다고 밝혔다. 이를 기반으로 SMFC를 사용해 퇴적물에 존재하는 카드뮴(Cd)을 31.0%, 납(Pd)을 44.1% 제거했으며, 이는 EKR를 사용한 결과와 유사했다[122]. 이 외에도 SMFC를 통해 구리(Cu)를 제거한 연구가 있다[12]. 이 연구는 SMFC의 산화전극 부분에 있는 구리 이온이 환원전극으로의 이동을 촉진할 수 있고, 추가적으로 구리를 회수할 수 있다고 밝혔다. 또한, 전류 생산량은 구리 이온의 이동과 밀접한 관련이 있다고 밝혔다. 또 다른 연구에서는 SMFC가 퇴적물에서 지하수로 침출되는 중금속을 줄이는데 활용할 수 있음을 밝혔다[123]. 이 연구의 결과를 보면 SMFC를 운전한지 약 100일 후에 퇴적물에 존재하는 납을 37.2%, 아연을 15.1% 제거했다. 또한, SMFC를 통해 수은 및 은을 제거한 연구가 있다[124]. 이 연구에서는 SMFC를 운전한지 약 60일 후에 수중에 있는 수은과 은을 각각 97.3%, 98.5% 제거했다.
5. SMFC 성능에 영향을 주는 요소
SMFC 성능은 많은 요소에 영향을 받는다. 대표적으로 유기물 및 무기물의 분자량, 친수성 및 소수성, pH, 퇴적물 성상, 수분 함량, 온도, 유기물 종류, 다공성 등이 있다[125,126]. 또한, SMFC에서 질소 및 인을 첨가하여 전자의 손실을 방지하기도 한다[127]. SMFC의 성능은 낮은 외부 저항이나 염분으로 인한 전극 부식의 영향도 받는다[128,129]. 그리하여 이번 장에서는 SMFC의 성능에 많은 영향을 주는 요소에 대해서 소개한다.
5.1. 기질
SMFC에서는 아세테이트, 포도당, 전분, 석유 기반 탄화수소, 유제품 및 식품 기반 폐수와 같은 다양한 기질을 사용할 수 있다. 기질은 생분해성의 특성에 따라 선택해야한다[130]. SMFC의 성능은 기질의 농도와 미생물이 유기물을 분해하는 속도에 따라 다르다[131]. 이전 연구에 따르면 기질의 농도가 50 mg/L에서 250 mg/L로 증가함에 따라 전력 밀도가 증가했다[132]. 하지만 농도가 500, 1,000 mg/L로 더욱 높아지면 전력 밀도가 33.7, 21.3 mW/m2으로 오히려 낮아졌다. 이는 기질의 농도가 증가하면 환원전극에 고농도의 유기물이 도달할 수 있으며, 이는 환원전극에서 산소 요구량을 증가시켜 환원 반응을 제한하게 된다. 또한, 고농도의 기질은 환원전극에서 종속 영양 미생물의 성장을 촉진하여 전극 반응의 생성물 및 반응물의 물질 전달을 제한할 수 있다[133]. 다른 연구를 보면 기질의 농도가 560 mg/L에서 1,100 mg/L로 증가하자 DO 농도가 2 mg/L에서 0 mg/L에 가까워졌고, 반응기의 전압이 약 700 mV에서 200 mV까지 감소했다. 그에 따라 쿨롱 효율이 0.27%에서 0.045%까지 감소했다[134].
추가적으로 기질은 SMFC의 산화전극에 존재하는 미생물과 퇴적물에 존재하는 미생물 사이의 경쟁을 유발한다. 이전의 연구에 따르면 SFMC는 퇴적물의 유기물 제거와 전력 생산을 동시에 했으며, 전류 생산은 유기물 제거와 밀접한 관계가 있는 것을 입증했다[135]. 다른 연구를 보면 SMFC를 사용해서 강의 퇴적물의 유기물을 제거 및 분해한 결과 유기물이 자연적으로 분해되는 것보다 SMFC를 사용해서 분해하는게 약 10배 높았다[136]. 즉, SMFC가 유기물 분해 속도를 증가시키고 산화전극에 존재하는 미생물과 퇴적물에 존재하는 미생물 사이에서 기질 경쟁을 일으킨다. 기질 경쟁은 산화 및 환원이 중요한 금속 오염물질과 유기물과의 상관관계가 있어 금속 오염물질 제거에 중요하다. 유기물은 세포 외부로 전자 전달을 위한 전자 공여체와 수송체 역할을 하기 때문에 금속 환원 미생물의 관점에서 중요하다[137,138]. 따라서 퇴적물 속의 유기물이 제한되면 중금속의 미생물 유리율도 감소한다. 이전 연구를 보면 비소와 철의 제거에서 숯이 영향을 평가를 했으며, 숯을 통해 유기물이 증가하여 미생물의 활동을 자극했고 그에 따라 생체이용률이 증가해 비소와 철의 제거율 향상시켰다[139]. 또 다른 연구에서 유기물 농도가 높을 때 철 환원이 높아졌고, 유기물의 농도가 낮을 때 철 환원이 낮아졌다[140]. 정리하면 너무 높은 농도의 기질은 오히려 SMFC의 성능을 저하시킨다.
5.2. 산소 농도
수역의 특성, 흐름, 형태, 성분 등은 SMFC의 성능에 중요한 요소이다[72,141]. 예를 들어 정체된 수역은 흐름이 원활한 수역에 비해 더 높은 성능을 보였다[142]. SMFC에서 산소는 가장 이상적인 말단 전자 수용체이기 때문에 용존산소 즉, 산소 농도가 중요한 요소이다[55,143]. 따라서 환원전극이 있는 수역의 산소 농도를 증가시키는 것은 SMFC의 성능을 높이는 효과적인 방법이다[144]. 하지만 담수에서 산소의 확산은 느리기 때문에 이를 해결하기 위해 촉매를 사용하여 개질[145], 회전식 환원전극(rotating cathode) [146-148], 부유식 환원전극(floating cathode) [149-151], 외기 환원전극(air cathode) [151,152], 바이오캐소드[153], 가스가 포함된 퇴적물(cold seep sediments) [154] 등을 연구했다. 회전 환원전극에서 환원전극 디스크의 회전을 통해 산소 농도를 증가시키고, 부유식 환원전극은 수면에 떠 있어 환원전극의 일부가 공기에 노출되어 있다. 부유식 환원전극은 외기 환원 전극 방식과 중복된다. 이러한 기술들은 산소의 농도를 높여줘 성능을 향상시킬 수 있지만, 몇 가지 단점이 있다. 예를 들어 회전식 환원전극은 외부 기계나 추가적인 장비가 필요하고, 촉매는 비용이 높으며, 부유식 환원전극은 어류나 조류에 의해 파손의 위험이 있다. 이러한 산소 농도는 온도와 밀접한 연관이 있다. 온도가 낮을수록 산소 농도가 증가해 SMFC의 성능이 증가하지만, 너무 낮은 온도는 오히려 미생물의 활동을 저해해 성능이 감소한다.
5.3. 퇴적물
SMFC의 산화전극은 혐기성 퇴적물이나 토양에 묻힌다. 이러한 퇴적물은 지구 표면의 약 75%를 차지하며, 광물 입자와 유기물을 포함한 육지 및 해양 물질의 저장고이다[67]. 즉, 대부분의 생지화학적 순환은 퇴적물에서 일어난다[155]. 이러한 퇴적물은 다양한 지리적 특징, 인간의 활동과 관련된 다양한 정보와 출처를 가지고 있다[156]. 이러한 퇴적물은 채취하는 곳에 따라 특성은 다를 수 있지만, 퇴적물에서 일어나는 물리화학적 과정은 유사하다. 수중 용존 산소는 유기물의 호기성 분해 과정을 통해 소모된다[157]. 이후 잔류 유기물은 느린 속도로 질산염, 철, 황산염 환원 등 여러 과정을 통해 혐기성 미생물에 의해 분해된다[157]. 정리하면 퇴적물은 혐기성을 띠며 여러 금속 이온, 침전물 및 유기물이 풍부하다. 따라서 이러한 특성을 가지고 있는 퇴적물을 사용하여 SMFC를 운전하는데 적합하다. 그리하여 본 절에서는 SMFC를 운전하는데 적합한 해양 퇴적물과 담수 퇴적물에 관하여 논한다.
5.3.1. 해양 퇴적물
해양 퇴적물을 사용한 최초의 SMFC는 라리탄 만(Tuckerton, New Jersey, USA) 어귀에서 채취하여 실험을 수행했다. 불완전한 전극 설계와 온도로 인해 최대 전력 밀도가 0.01 mW/m2였지만, 이 연구는 해양 퇴적물을 통해 전기를 생산할 수 있다는 것을 증명했다. 이후 라리탄 만과 야퀴나 만(Newport, Oregon, USA)에 SMFC를 직접 설치해 현장에서 후속 연구를 진행했다[158]. 이 연구에서는 흑연 디스크를 전극으로 사용했다. 야퀴나 만에 설치한 SMFC는 수위가 4 m인 지점에 설치했으며, 산화전극은 퇴적물 15 cm 아래, 환원전극은 퇴적물 위 15 cm에 설치했다. 라리탄 만에 설치한 SMFC는 수위가 1.5 m에 설치했으며, 산화전극은 퇴적물 10 cm 아래, 환원전극은 퇴적물 위 20 cm에 설치했다. 야퀴나 만에 설치한 SMFC의 최대 전력 밀도는 28 mW/m2이었으며, 라리탄 만에 설치한 SMFC의 최대 전력 밀도는 18 mW/m2이었다. 이후 반응기 구성, 전극 형태, 전극 재료 등 많은 연구가 진행되어 해양 퇴적물을 적용한 SMFC의 성능은 점점 증가하여 수천 mW/m2까지 증가했다[159-163].
5.3.2. 담수 퇴적물
담수 퇴적물은 SMFC에서 가장 많이 사용하는 퇴적물이다. 대표적인 담수 퇴적물은 하천, 호수, 논, 자연 습지, 인공 습지 등이 있다. 이중 육지에서 바다로 이동하는 하천은 지구의 에너지와 물질 순환에서 중요한 연결 방법이다. 또한 하천은 인간의 활동과 밀접하게 연관되어 있으며 도시 개발에 중요한 역할을 한다[156]. 이러한 하천의 주요 기능 중 하나는 POPs를 흡수하여 정화하는 것이며, POPs를 포함한 많은 유기물은 하천 퇴적물에 축적이 된다[164]. 하천 퇴적물에 축적된 유기물은 SMFC의 산화전극에 존재하는 미생물의 전자 공여체 역할을 할 수 있다. 하지만 하천 퇴적물은 해양 퇴적물보다 염도와 이온 전도도가 낮아 내부 저항이 상대적으로 높고 그에 따라 성능이 낮아 해양 퇴적물을 사용하여 SMFC를 운전하는 것보다 더 어렵다[89,165]. 이를 극복하기 위해 몇몇 연구에서는 하천 퇴적물에 과립형 탄소, 바이오차(biochar), 수용성 구연산 철(soluble ferric citrate) 및 콜로이드성 옥시수산화철(colloidal iron oxyhydroxide) 등을 추가하여 성능을 개선했다[166-168]. 이외에도 SMFC의 유기물 분해 및 남세균 분해에 대한 탁월한 성능으로 부영양화 호수에 설치하여 연구한 사례가 있다[108]. 호수 퇴적물은 염도 및 이온 전도도는 하천 퇴적물과 유사다. 하지만 호수 퇴적물의 유기물 함량이 하천 퇴적물의 유기물 함량보다 높아 더 높은 성능을 보인다[169]. 하천이나 호수 퇴적물 외에도 논, 자연 습지, 인공 습지 등에 SMFC을 적용하여 오염 물질을 정화했다[170-173]. 연구에 따르면 토양과 습지에서 자라는 식물은 퇴적물에 유기물을 지속적으로 공급하여 SMFC의 성능이 증가한다고 밝혔다[174-176]. 또한 다른 연구에서는 전도성이 낮은 토양에 규산을 추가하여 토양의 저항을 줄이고 전도성을 높여 SMFC의 성능을 약 10배 향상시켰다[177].
5.4. 전극의 재료
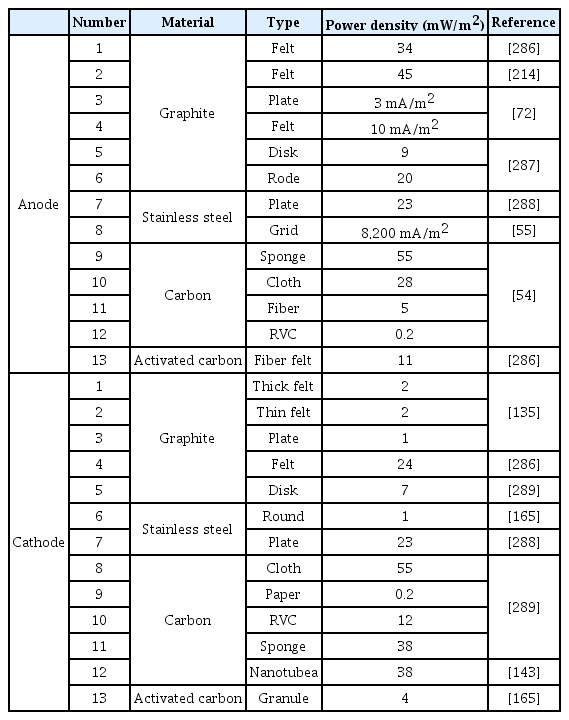
전극의 재료와 촉매는 SMFC의 성능에 많은 영향을 미치며, SMFC 설계시 이 두 가지는 매우 신중하게 결정해야 한다. SMFC에서 탄소 기반 재료와 백금(Pt)기반 촉매를 가장 많이 사용하고 있다[112,178]. 이전 연구에 따르면 탄소 기반 재료에 헤테로 원자를 도핑하면 전기화학적 특성이 향상되어 SMFC의 성능이 향상된다[179]. 특히, 질소 계열을 도핑하면 산화전극에서는 미생물의 성장과 밀집도가 향상되고 환원전극에서는 산소 환원 반응이 향상된다[46,180,181]. 전극의 재료를 선택할 때는 높은 전기전도성, 생체 적합성, 화학적 안정성, 낮은 부식률, 높은 표면적, 낮은 저항 등을 고려해야하며 이를 기반으로 탄소 종이(carbon paper), 탄소 천(carbon cloth), 활성탄 천(activated carbon cloth), 탄소 펠트(carbon felt), 활성 탄소 섬유 펠트(activated carbon fiber felt), 흑연 펠트(graphite felt), 탄소 섬유 브러쉬(carbon fiber brush) 등을 사용한다[44,182,183]. 이러한 재료를 최근 SMFC에서 사용하고 있고, 최적의 효율성을 입증하고 있는 중이다[184]. 대표적인 예로 탄소 펠트는 생물막 형성을 위한 우수한 전도성을 가지고 있으나 너무 두꺼운 두께 때문에 생물막은 탄소 펠트 외부에만 생성되고 내부에는 생성되기가 어렵다. 그리하여 최적의 재료를 찾는 것은 SMFC의 성능 향상에 중요하며, 추가적인 많은 연구가 필요한 실정이다. 이번 절에서는 산화전극과 환원전극의 재료와 재료에 따른 특성에 관하여 소개한다. 전극의 재료에 따른 SMFC의 전력 밀도는 Table 4에 나와있다.
5.4.1. 산화전극
산화전극 재료의 구성, 형태 및 표면 특성은 최적의 성능을 위해 중요한 요소이다. 이러한 특성을 고려하여 표면적, 다공성 및 전기 전도도가 높은 탄소 계열 재료를 많이 사용한다[185]. 이러한 탄소 계열의 산화전극 재료는 높은 표면적과 다공성으로 미생물 부착 및 생물막 형성을 원활하게 할 수 있다[186]. 탄소 계열뿐만 아니라 금속 계열 재료도 사용하는데 대표적으로 스테인리스 스틸이 있으며, 구리는 미생물에 대한 독성 때문에 사용되지 않는다[187]. 이러한 산화전극의 재료와 구성에 따라 i) 평면형, ii) 과립형, iii) 브러쉬형 3가지로 구분할 수 있다.
첫 번째로 평면형 구성은 탄소 종이, 탄소 시트(carbon sheet), 탄소 천 등이 있으며 이는 산화전극에서 선호되는 재료이다[188]. 이러한 재료 중에서 흑연 판(graphite plate), 탄소 판(carbon plate)의 경우 천이나 시트보다 높은 강도를 가졌으며, 표면이 거칠어 더 높은 전력을 생산할 수 있다[189,190]. 이전 연구에서는 탄소 천과 탄소 종이보다 저렴하지만 더 높은 표면적과 다공성을 가진 탄소 메쉬(carbon mesh)를 암모니아 가스로 처리하여 산화전극으로 사용했으며, 결과는 탄소 천과 종이보다 더 높은 전력을 생산했다[191]. 전극의 재료에서 다공성이 높을수록 전극의 기하학적 표면적당 전력 생산량이 증가한다. 또한, 다공성이 높은 재료는 산화전극에서 미생물의 부착할 수 있는 부위가 증가하여 동일한 면적대비 더 높은 미생물 군집도를 나타내며, 이는 더 높은 성능을 달성할 수 있다[192].
두 번째로 미생물이 부착할 수 있는 부위를 증가시키기 위해 산화전극부에 흑연 과립(graphite granules), 과립형 막대(granular rod), 과립형 활성탄(granular activated carbon)과 같은 물질을 산화전극으로 사용하기도 한다[193]. 이러한 과립형 전극의 다공성은 30%에서 50%의 범위를 가지지만 일정 시간이 지나면 바이오 파울링(bio-fouling)이 발생하여 공극이 막혀 성능이 저하되기도 한다[194]. 또한 과립형은 전기 전도도가 낮고 반응기 속에서 부유하기 때문에 금속 메쉬와 같은 물질로 단단하게 고정하는 것이 필요하다[195]. 이전 연구를 보면 2 mm와 5 mm의 흑연 과립과 흑연 펠트, 탄소 펠트를 비교한 결과 과립형 활성탄을 사용한 실험이 약 2.5배 더 높은 전력을 생산했으며, 이는 과립형 전극의 가능성을 보였다[196].
마지막으로 브러쉬형 전극은 높은 표면적, 효율적인 전류 포집, 높은 다공성 등 많은 장점을 가졌으며, 현재 MFC에서 가장 많이 사용하는 형태이다[197]. 일반적으로 브러쉬 형태의 전극은 탄소나 흑연 섬유를 티타늄 와이어에 꼬아서 제작을 한다[22,198-200] 이러한 브러쉬형은 일반적으로 지름과 길이가 2.5 cm이며, 다공성은 95%, 표면적은 18,200 m2/m3이다[201]. 이 외에도 많은 크기의 브러쉬가 제작되었다. 여러 크기의 브러쉬중 지름이 5 cm, 길이가 7 cm가 있으며, 이 브러쉬는 다공성이 98%, 표면적이 7,170 m2/m3이다. 이 2개의 브러쉬 전극를 탄소 종이와 비교한 결과 탄소 종이는 600 mW/m2의 전력 밀도를 생산했지만, 작은 크기의 브러쉬는 2,400 mW/m2, 큰 크기의 브러쉬는 1,430 mW/m2의 전력 밀도를 생산했다[202,203]. 현재 SMFC의 산화전극의 재료의 연구는 높은 표면적과 전류 포집 등이 위주로 진행되고 있지만, 다공성과 성능에 관한 연구는 많이 진행되지 않았다. 그리하여 향후 연구는 다공성과 성능에 관한 연구가 필요하다.
5.4.2. 환원전극
SMFC에서는 산화전극에서 발생한 전자가 외부 회로를 통해 환원전극으로 이동하면서 물에 용존되어 있는 산소와 반응한다. 이러한 부분에서 환원전극은 SMFC의 높은 성능을 달성하기 위해 중요하다[204]. 이 중 환원전극 재료는 앞서 언급한 것과 같이 생체 적합성, 화학적 안정석, 높은 전도성 등이 우수하고 저렴한 재료인 탄소 기반 재료를 사용한다. 이러한 재료를 기반으로 SMFC의 환원전극은 외기 환원전극, 수중 환원전극(aqueous air-cathodes), 바이오캐소드 3가지를 주로 제작하며, 촉매는 산소 환원 촉매, 탄소 기반 촉매, 금속 기반 촉매, 금속-탄소 하이브리드 촉매 등을 사용한다[205,206]. 특히 SMFC에서는 환원전극의 가격을 낮추기 위해 촉매를 사용하지 않고 운전을 할 수 있는 재료를 사용하기도 한다[207].
탄소 종이는 상대적으로 다공성인 평면 탄소질 재료이지만, 쉽게 찢어지고 가격이 비싸다[208]. 탄소 종이를 환원전극으로 사용한 이전 연구를 보면 탄소 섬유 브러쉬를 사용한 환원전극 보다 낮은 전력 밀도를 생산했으며 4.6 mW/m2 vs 30 mW/m2), 이는 탄소 종이의 표면이 평면의 형태이므로 탄소 섬유 브러쉬보다 더 낮은 표면적에 의한 것이다[209]. 흑연 막대(graphite rod)는 낮은 다공성과 표면적 때문에 현실적으로 사용하기가 힘들다. 이전 연구에 따르면 환원전극을 흑연 막대에서 흑연 펠트로 교체했을 때 전력 출력이 약 3배 증가했으며, 이는 흑연 막대보다 높은 표면적을 가진 흑연 펠트가 더욱 높은 성능을 나타낼 수 있음을 증명했다[210]. 이러한 펠트 형태의 재료는 기계적 유연성, 압축성, 우수한 전기 전도성 및 합리적인 비용 으로 SMFC에서 유용하게 사용할 수 있는 다공성 전극 재료 이다. 또 다른 연구를 보면 탄소 종이, 스테인리스 스틸(stainless steel), 흑연 펠트 3가지를 환원전극으로 사용하여 성능을 비교했다[211]. 실험의 결과는 흑연 펠트가 109.5 mW/m2으로 가장 높은 성능을 나타냈으며, 이는 흑연 펠트가 가장 높은 표면적과 우수한 촉매 활성 때문이다. 즉, 환원전극 재료에서 낮은 촉매 활성은 성능 저하의 원인이 되며, 나아가 SMFC에서 촉매의 사용은 지속적인 반응과 외부 요인에 의해서 지속성이 낮으며, 높은 비용으로 인해 권장되지 않는다[187]. 여러 촉매 중 특히 금속계 촉매는 향후 SMFC의 규모를 키울 경우 비용 및 안정성에서 문제를 야기 할 수 있으며, 안정적으로 운전을 하기 위해서는 장시간 운전이 필요하므로 권장되지 않는다[212,213]. 그리하여 환경친화적임과 동시에 안정적인 성능을 보이면서 저렴한 재료와 촉매를 연구하는 것이 향후 SMFC의 중요한 과제이다.
귀금속을 사용하지 않은 바이오캐소드는 SMFC에서 사용되는 지속 가능한 대안으로 제안되었다. 촉매를 사용한 환원 전극과 비교할 때 바이오캐소드는 비용이 저렴하고 장기간 운전이 가능하다[66,214]. 환원전극의 생물막은 낮은 활성화 손실을 통해 산소 친화성이 증가하고 과전압을 감소시킬 수 있다[215]. 이러한 바이오캐소드는 환원전극의 재료의 특성이나 구성에 따라 세포외 전자 전달에 영향을 미칠 수 있다[34]. 이러한 바이오캐소드의 최적의 재료는 탄소 재료로 밝혀졌으며, 대표적으로 탄소 나노튜브, 흑연 펠트 등이 있다[216].
5.5. 미생물
퇴적물 1 g 당 약 2,000~830만 종의 미생물이 존재한다[217]. 퇴적물에서 평균적인 미생물 개체수와 유기물 함량은 약 109 cell/g, 100 mg/g이다[218]. 대부분의 퇴적물은 SMFC에서 사용할 수 있으며, 이 퇴적물에 함유되어 있는 유기물과 미생물 함량에 따라 SMFC의 성능에 영향을 준다[219]. 여러 미생물 군집이 SMFC에서 발견되고 있으며, 단일 미생물 군집과 혼합 미생물 군집을 비교하면 혼합 군집이 더욱 높은 성능을 보인다[220].
산화전극의 높은 전위가 생물학적 산화를 촉진하여 미생물의 활동을 향상시킬 수 있다[221]. SMFC의 전기화학적 시스템은 전기장을 형성하여 물질 수송 및 혼합을 향상시킬 수 있다[222]. 이러한 전기화학적 자극을 전극 자극이라 칭할 수 있으며, 이는 MFC나 생물학적 정화에 사용되기도 한다[221]. SMFC에 접종된 미생물은 산화전극의 형태, 재료, 전극 자극 등과 같은 여러 요인에 따라 접종 이후 미생물 군집이 바뀔 수 있다[223]. 이전 연구에 따르면 미생물 군집의 Shannon 지수는 전극 자극 이후 감소한다[67]. 즉, 전극 자극은 미생물 다양성을 감소시키지만 미생물을 선택적으로 성장시켜 SMFC의 성능을 향상시킨다. 이러한 전극 자극은 전극의 전위가 증가함에 따라 미생물 군집의 변화 폭이 더 커진다[224]. 이전 연구를 보면 SMFC에 여러 외부 저항을 연결하여 전압과 전류를 변경시켰고, 전류 기울기에 따라 미생물의 상대적 비율이 변화하는 것을 확인했다[111]. 다른 연구를 보면 전극을 기준으로 여러 거리에서 미생물 군집을 분석한 결과 산화전극에 가까울수록 델타-프로토박테리아(Deltaproteobacteria)의 상대적 비율이 증가하는 것을 발견했다[168]. 또한 산화전극이 매립되는 깊이에 따라서도 미생물 군집이 달랐는데, 매립되는 깊이가 깊을수록 델타-프로토박테리아의 상대적 비율이 증가했다[175].
Proteobacteria, Bacteroidetes, Firmicutes, Chloroflex sp., Geobacter은 SMFC에서 가장 많이 발견되는 미생물이다[225]. 이중 프로토박테리아중 하나인 델타-프로토박테리아가 최대 70% 이상으로 가장 풍부하며, 해양 퇴적물에서는 감마-프로토박테리아(Gammaproteobacteria)가 담수 퇴적물에서는 베타-프로토박테리아(Betaroteobacteria)가 델타-프로토박테리아 다음으로 풍부하다. 2002년 해양 퇴적물을 사용한 SMFC에서 델타-프로토박테리아의 농축을 발견한 이후 많은 연구를 통해 해양 퇴적물뿐만 아니라 담수, 염습지, 논, 호수 등의 퇴적물을 사용해도 농축되는 것을 밝혔다[89,226-228]. Geobacteraceae는 Proteobacteria 문, Deltaproteobacteria 강, Desulfuromonadales 목에 속하며, 대표적으로 Geobacter spp.가 있다[229]. SMFC에서발견된 Geobacteraceae는 변성 구배 젤 전기영동(denaturing gradient gel electrophoresis, DGGE)와 같은 분석을 통해 Geobacter spp.와 밀접하게 관련되어 있다는 것이 밝혀졌다[89,227,228]. 또한 Geobacter spp.는 일반 퇴적물보다 산화전극이 매립된 퇴적물에서 더 풍부했으며, 이는 Geobacter spp.가 MFC와 동일하게 SMFC의 주요 미생물인 것으로 밝혀졌다[90,144,170,174,230-232]. 이 외에 Desulfuromonas, Desulfobulbus, Desulfocapsa, Desulfovibrio spp.는 Desulfobulbaceae과에 속하며 산화전극 또는 산화전극 주변에서 자주 검출이 된다[67]. 이 미생물들은 황산염의 환원 및 황화물의 산화와 관련이 있다[233]. 환원된 황은 퇴적물에 널리 분포되어 있기 때문에 이미생물들은 황화물을 전자 공여체로 사용하고 산화전극에서 전기 생성을 위한 전자 수용체로 사용할 수 있다[233]. 델타-프로토박테리아에 속하는 미생물 외에도 감마-프로토박테리아에 속하는 미생물들이 산화전극 주변에서 발견된다. 이 미생물들은 탄소원을 젖산염이나 아세테이트와 같은 물질로 전환하거나 추가적인 산화를 통해 전기를 생성할 수 있다[70,233,234]. 또 다른 미생물인 Pseudomonas spp.는 전기 활성 생물막을 형성하거나 산화환원 매개체를 생성하여 전기를 생산할 수 있고, Geothrix spp.는 전형적인 철 환원 미생물이며 담수 퇴적물을 사용한 SMFC에서 주로 발견된다[235,236].
5.6. 기타
SMFC에서 pH는 전력 생산과 오염물질 제거뿐만 아니라 이온 농도, 미생물 세포질 pH, 양성자 이동 및 생물막 형성 등에도 영향을 미친다. SMFC에서는 각 전극의 환경이 저서층과 수계층으로 상이하므로, 환원전극은 수계의 pH의 영향을 받는다. 이전 연구에서 pH 6-9 사이가 생물막 성장에 적합하다고 보고되었다[237,238]. 또 다른 연구를 보면 anode의 성능은 pH가 6에서 495 mW/m2, 6.5에서 712 mW/m2, 7에서 687 mW/m2, 7.5에서 645 mW/m2, 8에서 636 mW/m2이다[182]. 일반적으로 하천의 평균 pH는 7.57이며 약 알칼리성이며, 이전 연구에 따르면 환원전극의 pH는 산성일수록 성능이 증가했다[182]. 정리하면, 산화전극은 pH가 중성이나 약 알칼리성 일때, 환원전극은 pH가 약 산성일 때 최대의 성능을 나타낼 수 있다. SMFC의 산화전극에서 유기물은 미생물을 통해 분해되고 수소 이온과 전자를 생성한다. 이론적으로 수소 이온은 퇴적물과 물을 통해 환원전극으로 이동하여 환원전극 부분의 pH가 산화전극 부분보다 더 낮아지지만, 실제 pH는 환원전극 부분이 더 높다. 이는 산화전극에서 생성된 전자가 외부 회로를 통해 환원전극으로 이동하게 되고, 이 전자는 환원전극에서 중금속 이온이 아닌 산소와 반응하여 수산화이온을 생성하거나 수소 이온과 반응하여 물을 생성하기 때문이다[12,105,200]. 환원전극에서 생성된 수산화이온은 중금속의 침전에 영향을 미친다[239,240]. 예를 들어 알칼리 조건에서 Cu2+는 수산화이온과 반응하여 Cu(OH)2의 형태로 침전된다. 그리고 산화전극와 환원전극의 pH 차이로 인한 두 전극간의 전기장(electric field)이 형성된다. 두 전극간에 형성된 전기장으로 인해 중금속 이온은 산화전극에서 환원전극의 이동이 촉진된다[241,242]. 전기장을 통해 이동하는 중금속 이온은 전기적 이동(electro-migration)과 전기적 삼투(electro-osmosis)를 2가지 방법이 있다[243]. 이렇게 이동한 중금속 이온은 앞서 서술한 것과 같이 수산화이온이나 철과 같은 금속과 반응 및 결합하여 침전된다. 또한, 퇴적물의 pH 변화는 유기물과 무기물의 순환에 영향을 미친다. 이전 연구에 따르면 환원전극 주위의 pH 증가는 호기성 토양에서 철 및 기타 금속 산화물의 침전을 촉진하여 금속 오염물질과 기타 유기물을 고정시킬 수 있다[87,124]. pH에 관한 결론은 다음과 같다. i) pH는 산화전극보다 환원전극에서 더 높은 경향이 있다. ii) 전기장에 의해 중금속 이온이 환원전극으로 이동한다. iii) 환원전극의 상대적 높은 pH는 수산화이온을 생성 및 중금속 이온과 반응하여 중금속이 침전된다. iv) SMFC에서 최적의 pH는 산환전극은 중성에서 약 알칼리성이며, 환원전극은 산성일 때 최대 성능을 나타낼 수 있다.
낮은 외부 저항은 높은 전류 밀도와 제거율을 얻을 수 있지만, 높은 외부 저항은 SMFC의 접종 및 산화전극에 존재하는 미생물의 성숙에 긍정적인 영향을 준다[128,199]. 퇴적물의 내부 저항은 SMFC의 성능에 중요한 부분이며, 내부 저항이 커지면 SMFC의 성능이 감소한다. 내부 저항은 퇴적물의 성상, 입자의 크기, 수분 함량, 온도, 전해질의 저항, 전극간의 거리, 전기전도도와 같은 많은 요소에 따라 달라진다[35]. 퇴적물의 내부 저항은 숯을 추가하거나 수분 함량을 높이면 감소할 수 있고, 이는 토양 공극 투과성을 증가시켜 오염물질 처리 및 전력 생산 성능을 향상할 수 있다[244]. 퇴적물에 염분을 첨가하면 전기전도도를 높일 수 있지만, 퇴적물의 염도가 너무 높아지면 오히려 삼투압 현상으로 성능이 감소하거나 새로운 생태학적 문제를 일으킬 수 있다. 이전 연구에 따르면 SMFC에서 생산하는 전력은 내부 저항이 많은 영향을 주는 것으로 확인됐다[237]. 또한, 전극간의 거리는 물질 이동과 내부 저항에 영향을 미치며, 이는 결과적으로 SMFC의 성능에 영향을 준다[245]. 이러한 내부 저항을 줄이기 위해서는 전극간의 거리를 줄여 내부 저항의 대부분을 차지하는 옴 저항(ohm resistance)을 줄이거나, 전극에 추가적인 처리를 통해 전하 이동 저항(charge transfer resistance)을 줄여야 한다[246,247]. 하지만 전극간의 거리가 너무 가까우면 오히려 성능이 감소할 수 있다[26,198,244,248,249]. 그리하여 SMFC의 성능을 향상시키기 위해서 전극간의 최적의 거리에 관한 추가적인 연구가 필요한 실정이다.
반응기의 형태도 SMFC에서 중요하며, 지금까지 컬럼형, U형, 삽입형, 다중 산화전극형, 관형 등 여러 형태의 SMFC가 연구되고 있다[78,129,184,250,251]. 이중 삽입형 SMFC는 일반적인 SMFC보다 6배 높은 제거율을 달성했다. U형 SMFC은 4쌍의 전극을 사용했으며, 이를 통해 산화전극과 환원전극의 성능을 향상시켰지만, 전기장 또는 수분 증발로 인한 확산이나 삽투압을 통해 U형 SMFC에서 환원전극부가 산화전극부 보다 염분 농도가 높았으며, 이는 성능의 저하를 초래했다[129]. 또한, 장기간 SMFC 운전과 제거 범위를 증가시키기 위해 산화전극형 SMFC를 개발했다. 이러한 반응기의 형태는 현재 많은 연구를 진행하고 있으며, 추가적인 연구를 통해 최적화가 필요하다. 또한, 전극의 부식은 장기간 SMFC을 제한하는 요인이며, SMFC를 운전하기 전에 염분으로 인한 부식도 고려해야 한다.
미생물은 일반적으로 특정 최적 온도가 있어 온도에 따라 성능이 달라지며, 이는 SMFC의 성능과 직결된다[252]. SMFC의 초기 온도는 생물막 형성에 중요하며, 상대적으로 고온에서 안정적으로 생물막을 형성했고 그 결과 SMFC의 성능이 향상됐다[177,253]. SMFC의 적정 온도는 30~45℃이며, 이는 생물막의 대사 활동이 최대가 되는 온도이다. 즉, 온도가 낮아지면 생물막의 대사 활동이 감소하여 성능의 감소로 이어지고, 반대로 온도가 너무 높아지면 미생물의 단백질이 변형되어 성능이 급감한다[237]. SMFC의 성능을 온도에 따라 정밀하게 분석한 데이터는 없지만, 대부분의 연구에서 오염물질의 제거와 전력 생산은 온도가 증가함에 따라 증가했다[254]. 이러한 이유는 SMFC의 옴 저항은 온도와 반비례하는 경향이 있으며, 온도가 증가함에 따라 옴 저항은 감소하고 그로 인해 전기전도성이 증가하기 때문이다. 정리하면 SMFC의 초기 온도는 생물막 형성에 매우 중요하며 이는 SMFC 성능에 직접적으로 영향을 준다.
물질이동은 침전물, 슬러지, 토양 및 수질 정화에 사용되는 SMFC의 핵심 매개변수이다. 이전 연구에 따르면 석유 탄화수소 제거율이 산화전극에서 멀리 있는 것보다 산화전극 주위가 더 높다는 것을 밝혔다[78]. 이는 산화전극 주위가 물질이동 속도가 더 높아 더 빠른 처리가 가능하기 때문이다. 이러한 물질이동은 퇴적물의 성분도 영향을 받는다. 모래 성분이 높은 SMFC는 모래로 인해 공극률이 향상되었고 그에 따라 더 좋은 성능을 향상시킬 수 있다[255]. 즉, 모래를 첨가함으로써 다공성이 증가하고 그에 따라 물질이동이 증가되어 오염물질 제거율과 전력 생산량이 증가한다[256]. 또한 오염물질 제거 범위는 주로 오염물질의 특성에 따라 다르다[78]. 분자량이 낮은 원소는 퇴적물의 공극으로 쉽게 이동할 수 있고 친수성이 높다[168]. 즉, 분자량이 높은 석유 탄화수소 등은 SMFC로 제거 및 정화하기 전에 분자량이 낮은 물질로 전처리를 하면 제거율이 향상된다[251]. 추가적으로 다양한 오염물질에 의해 오염된 퇴적물은 오염물질의 흡착률이 증가하고 이는 물질이동의 감소로 이어져 제거율이 감소하게 된다[257].
수분 함량이 높은 퇴적물에서는 산소와 같은 전자 수용체의 고갈로 인해 퇴적물의 산화환원 전위가 감소한다[258,259]. 하지만, SMFC의 산화전극은 높은 전위를 가진 전자 수용체로 사용할 수 있으며, 유기물 분해를 통해 퇴적물의 정화와 전자를 반영구적으로 지속할 수 있다[129,260]. 퇴적물이 산화전극을 매립시 초기에 산화환원 전위가 급격하게 감소하는 경우가 있는데 이는 퇴적물에 존재하는 최종 전자 수용체의 고갈에 의한 것이며, 시간이 지남에 따라 산화환원 전위는 증가한다. 산화 전극 주변의 퇴적물에서 산화환원 전위의 증가는 이전의 연구에서 확인됐다[135,261]. 이전의 연구에 따르면 SMFC 산화전극을 퇴적물에 매립하기 전의 산화환원 전위가 -143 mV였지만, 산화전극을 매립 후 산화환원 전위가 246 mV까지 증가한 것을 확인했으며, 다른 연구에서는 -185 mV에서 185 mV까지 증가했다. 퇴적물의 산화환원 전위의 증가는 금속 산화물의 미생물 환원을 방지할 수 있어 금속 오염물질 제거에도 이점이 있다. 또한 6가 크롬이 3가 크롬으로 환원하는 것과 같은 금속의 반응 및 생체이용률 등도 퇴적물의 산화환원 전위의 영향이 있다[262,263]. 이전 연구에 따르면 비소의 이동성과 용해도는 퇴적물이 환원 조건(산화환원 전위가 음의 값)에서 크게 증가하는 것을 밝혔다[264]. 즉, 환원 조건에서 미생물은 금속 산화물을 환원시켜 금속 산화물과 함께 침전되었던 중금속 등을 물이나 퇴적물로 다시 유출될 수 있다[265,266]. 다른 연구를 보면 산화 조건(산화환원 전위가 양의 값)에서 수은의 유출이 감소하는 것을 밝혔다[176,267]. 이는 산화 조건에서 수은의 메틸화가 감소한 결과이며 이를 통해 퇴적물에서 물로의 유출이 감소한 것이다. 또 다른 연구에서 산화환원 전위가 증가하면 황화수소의 생성이 감소하고 수질이 향상되는 것을 확인했다[260]. 황화수소를 생성하기 위해서는 산화환원 전위가 -100 mV 미만이어야 하기 때문에, 산화환원 전위가 증가하면 황화수소가 감소하게 된다. 정리하면 SMFC의 산화전극은 퇴적물 산화환원 전위를 증가시켜 오염물질의 유출 및 변형을 방지할 수 있다.
6. 향후 전망
화석 연료는 점점 증가하는 에너지 수요를 충분히 공급하는 데 어려움을 겪고 있으며, 그에 따라 지속 가능하고 재생 가능한 에너지원을 찾는 것이 필요하다[21,22,44]. 또한, 기술이 발전함에 따라 퇴적물의 오염이 심각해지고 있으며, 이 오염물질을 제거하기 위해 환경친화적이고 저렴한 기술을 개발하는 것이 중요하다. 여러 기술 중에서 생물학적 정화는 가장 환경친화적이고 저렴한 기술로 간주된다. 퇴적물 미생물 연료전지(sediment microbial fuel cell, SMFC)는 자연 퇴적물에서 에너지를 추출하고 퇴적물에 존재하는 오염물질을 정화 및 제거하기 위해 광범위하게 연구되었다. 이러한 SMFC의 활용 가능성은 무궁무진하지만 이를 실용화하기 위해서는 여러 문제를 해결하고 반응기를 최적화해야 하며, 나아가 실용적이고 상업적인 기술로 인식되기 위해서는 비용의 절감과 전력 생산 및 오염물질 제거 성능이 더욱 향상되어야 한다[268].
SMFC의 성능은 산화환원 전위, pH, 물질이동, 내부 저항, 외부 저항, 기질, 전극의 재료, 온도, 미생물, 반응기의 형태와 같은 여러 요소에 따라 달라지며, 성능을 향상시키기 위해 이러한 요소의 최적화가 현재 절실한 상황이다. 퇴적물의 화학적 및 물리적 특성은 다음 4가지 메커니즘이 SMFC의 오염물질 제거에 영향을 준다[269]. i) 퇴적물의 높은 pH 및 전기전도도는 생산성을 향상시킨다. ii) 퇴적물의 양이온의 양과 양이온의 운동성 및 유기탄소가 낮고, 비표면적이 클수록 오염물질의 이동성이 촉진된다. iii) pH, 온도, 전기전도도로 형성된 전기장 하에 전자와 오염물질의 이동이 촉진된다. iv) 농도 구배, 공극의 크기, 공극의 부피가 오염물질의 이동을 촉진한다. 이와 같은 4가지 메커니즘이 SMFC의 오염물질 제거를 향상시키는 대표적인 기작이다. 이 외에도 전극간의 거리에 따른 내부 저항, 온도와 오염물질 제거 및 전력 생산과의 상관관계, 퇴적물 산화환원 전위에 따른 오염물질 제거 및 전력 생산, 반응기 구성이나 전극의 배열에 따른 성능 등도 추가적인 세밀한 연구를 통해 최적화를 해야 한다.
퇴적물에 존재하는 미생물은 다양성이 높고, 불균일하게 분포하고 있어 SMFC에 중요한 역할을 한다. 또한, 퇴적물에 존재하는 미생물과 SMFC 산화전극에 존재하는 미생물은 전자 및 양이온을 공유하기도 한다[35]. 기술이 발전함에 따라 전기 활성 미생물 군집구조에 대한 지식이 점점 늘어나고 있다. 하지만 미생물 생태학의 관점에서 SMFC를 연구하는데 아직도 몇 가지 문제점이 남아있다. 첫 번째로 SMFC의 전자 전달 메커니즘의 연구가 필요하다. 막 단백질, 나노 와이어(nanowire) 등을 통한 직접 전자 전달(direct electron transfer)과 전자 셔틀을 기반으로 전자를 수송하는 간접 전자 전달(indirect electron transfer)에 관한 자세한 연구가 필요하다. 이러한 연구를 진행하면 SMFC의 향상시키는데 많은 도움이 될 것이다. 두 번째로는 SMFC의 미생물 연구는 분류학적 연구에만 초점이 맞춰져 있다. 이는 특정 대사 경로나 기능적 변화를 알 수 있으므로, 분류학적 연구가 아닌 다른 접근 방식을 사용하여 SMFC 의 미생물에 관한 추가적인 연구가 필요하다. 마지막으로 SMFC의 생물학적 정화가 진행하는 동안 미생물 군집의 변화에 대한 연구가 필요하다. 즉, SMFC의 미생물 연구는 생물학적 정화를 기준으로 정화 전과 정화 후의 미생물 군집에 관한 연구에 초점을 맞출 필요가 있다. 이러한 추가적인 연구를 진행하면 SMFC의 성능 향상에 많은 도움이 될 것이다.
SMFC 전극의 재료와 적용에 관한 많은 연구가 진행되었고, 전기전도성, 화학적 안정성, 생체 적합성, 표면적 등과 같은 몇 가지 요소가 재료에 중요하다고 알려졌다[22,44,46]. 이러한 특성들은 전하 이동 저항의 감소로 인한 내부 저항 감소, 오염된 환경에서 화학적 안정성, 우수한 생물막 성장 등에 밀접한 연관이 있다[270]. SMFC의 주요한 문제 중 하나는 퇴적물에 적용하기 때문에 생성된 전자가 외부 회로를 통해 환원전극으로 이동하지 않고 퇴적물로 확산되어 전자의 손실이 발생하는 것이다. 그리하여 적절한 재료를 사용해서 이 손실을 줄여야 한다. 즉, 지금까지 사용한 재료뿐만 아니라 더욱 다양한 재료를 사용하고 연구해야 한다. 향후 파일럿 규모나 실제 습지나 강가 등에서 SMFC를 적용하기 위해서는 장기간 운전시 전극의 재료가 뛰어난 내구성, 우수한 전기전도성 등이 있어야 하며 추가적으로 오염물질 제거에 탁월해야 한다.
SMFC의 실용화를 위해서는 파일럿 규모 및 실험실에서 규모를 키운 연구나, 실제 습지나 강가와 같은 현장에 적용한 사전 연구가 필요하다[271]. 그리고 그에 따른 요소를 최적화해야 한다. 현재 SMFC는 대부분 실험실에서만 연구가 되고 있다. SMFC를 실험실 규모로 연구한 결과들은 SMFC는 오염 물질 제거에 우수한 성능을 보였다. 하지만, 현장에 적용한 연구의 경우 더 많은 장애물이 있으며, 그에 따른 관리의 어려움이 있다. 대표적인 장애물로 물 위에 부유하고 있는 환원전극에 조류나 식물이 성장하여 SMFC의 성능이 감소할 수 있으며, 그에 따라 안정적인 SMFC 성능을 유지하기 어렵다. 또 다른 장애물은 산화전극의 매립이다. SMFC의 산화전극은 일반적으로 퇴적물에 매립하여 사용한다. 하지만 물의 깊이가 너무 깊은 경우 산화전극의 매립이 어렵고, 퇴적물에 존재하는 어류나 갑각류 등에 의해 산화전극이 부식되거나 파손될 수 있다. 그리고 폭우나 강풍과 같은 자연재해로 전극이 파손될 수 있다. 이러한 장애물들을 극복하고 현장에 적용한 연구는 필요하며, 나아가 실용화를 위한 초석이 될 것이다.
본 문헌은 SMFC의 유기물 및 무기물 분해, 중금속 제거, 여러 요소와 같은 전반적인 내용을 다루었다. SMFC는 생물학적 정화를 통해 전 세계적으로 많은 문제가 되고 있는 에너지 문제와 오염 정화 문제를 동시에 해결할 수 있는 기술이다. SMFC의 실용화를 위해서는 본 문헌에서 다루었던 여러 문제를 고려하고 극복해야 한다. SMFC의 기술을 더욱 발전하기 위해서 에너지 수집, 규모의 증가, 효율적인 재료의 사용 등 추가적인 연구가 필요한 실정이다. 지금까지 SMFC의 연구는 퇴적물 정화의 가능성을 확인했지만, 주로 전력 생산에만 초점이 맞춰져 있다. 하지만 SMFC의 연구는 전력 생산이 아닌 퇴적물 정화에 초점이 맞춰져야 하며, 실제 생태계에 적용해서 퇴적물의 생물학적 정화와 생태계에 대한 전기화학적 영향을 연구해야 한다. SMFC는 환경, 화학, 에너지, 미생물, 생물학, 전기화학, 재료 등과 같은 무수히 많은 학문이 결합된 독특한 학제간 연구 중 하나이다. 그리하여 다분야 연구 접근 방식을 접목 및 협력을 통해 유일무이한 퇴적물 정화와 동시에 에너지를 생산 기술로 발돋움할 수 있다.
Acknowledgements
이 연구는 대한민국 과학기술정보통신부 재원으로 한국연구재단 중견연구자지원사업의 지원을 받아 수행되었습니다(NRF-2021R1A2C1013989).
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.