별 불가사리(Asterina pectinifera) 바이오차를 이용한 오염된 수용액 내 Cu, Zn, Pb, Cd 수착(Sorption) 능력 평가
Sorption of Cu, Zn, Pb and Cd from a Contaminated Aqueous Solution Using Starfish (Asterina pectinifera) Derived Biochar
Article information
Abstract
목적
중금속 오염 및 축적은 인간과 동물의 건강에 해로운 영향을 주며, 전 세계적으로 심각한 문제이다. 현재 오염 폐수 처리를 위해 다양한 기술이 사용되어왔으며, 그중 흡착은 경제적으로 가장 흔히 알려진 기술로서, 많은 연구자들은 비용 면에서 효과적이며 쉽게 이용 가능한 흡착제를 찾기 위해 많은 노력을 하고 있다. 이에 본 연구는 별 불가사리(Asterina pectinifera, SF)를 바이오차로 제조하여 여러 기기분석을 통해 물리적 특성과 표면 특성을 평가하였으며, 이후 batch 실험을 진행하여 흡착 능력을 평가하였다.
방법
별 불가사리(Asterina pectinifera, SF)를 밀폐전기로에서 아르곤 가스 100 cc/min를 주입(무산소 조건)하면서 승온온도 7℃/min로 500℃까지 도달시킨 후, 2시간 동안 열분해시켜 바이오차(Pyrolyzed Starfish at 500℃, PSF500)로 제조하였다. 이후, SEM, TGA, XRD, 중금속분석, FT-IR 분석을 통해 표면의 특성을 평가하였으며, 중금속 오염 폐수를 이용한 batch 실험을 통해 PSF500의 최적흡착조건 및 모델을 도출하였다.
결과 및 토의
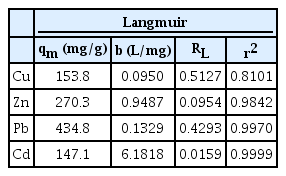
PSF500은 XRD분석을 통해 CaCO3, Ca(OH)2, CaO의 형태임을 확인하였으며, 흡착에 영향을 주는 다양한 작용기 및 표면에 다량의 공극이 형성됨을 관찰하였다. batch 실험 결과, 최대 흡착량은 153.8, 270.3, 434.8, and 147.1 mg/g (Cu, Zn, Pb, Cd)이었으며, 각 중금속 모두 무기 오염물질 분석에 가장 적합한 모델인 유사2차방정식과 Langmuir 모델에 부합함을 확인하였다. 흡착 실험 후, PSF500의 잔여물을 이용하여 XRD와 SEM 분석을 진행하였으며, 이에 각 중금속은 CuO, Zn5(CO3)2(OH)6, Pb3(OH)2(CO3)2, Cd(OH)2 및 CdCO3 형태로 표면에 침전된 것을 확인하였다.
결론
본 연구에서는 PSF500이 중금속에 대하여 흡착 및 침전의 복합적인 메커니즘을 따르는 것을 확인하였으며, 이에 PSF500은 CaCO3를 주성분으로 한 천연폐자원으로서 친환경적인 수착제로 이용 가능할 것으로 보인다.
Trans Abstract
Objectives
Heavy metal contamination and accumulation have a harmful effect on the health of humans and animals and are serious problems worldwide. Currently, various technologies have been used for the treatment of contaminated wastewater, of which adsorption is the most commonly known and economically feasible technology. Many researchers are making attempts to find an effective and easily available adsorbent in terms of cost. In this study, starfish (Asterina pectinifera, SF) derived biochar was prepared and its characteristics were evaluated through various device analyses. After the biochar evaluation, the adsorption capacity was evaluated by conducting batch experiments.
Methods
Biochar (Pyrolyzed Starfish at 500℃, PSF500) was produced by pyrolysis at 500℃ for 2 h in anaerobic conditions. Moreover, the characteristics of the surface were evaluated through SEM, TGA, XRD, elemental analysis and FT-IR analysis. In addition, batch experiments using heavy metal contaminated wastewater were conducted.
Results and Discussion
In PSF500, CaCO3, Ca(OH)2 and CaCO3 were identified as the main phases by XRD analyses and various functional groups and pores that affect adsorption were observed on the surface of the sample. The batch experiment confirmed that the maximum adsorption was 153.8, 270.3, 434.8, and 147.1 mg/g for Cu, Zn, Pb and Cd, respectively. Also, it was confirmed that all heavy metals fit the similar Pseudo-second-order kinetic model and Langmuir model, which are the most suitable models for analyses of inorganic pollutants. After the sorption experiment, XRD and SEM analyses were conducted using the residue of PSF500, and in each sample CuO, Zn5(CO3)2(OH)6, Pb3(OH)2(CO3)2, Cd(OH)2 and CdCO3 were confirmed to be deposited on the surface of the sample.
Conclusions
It was confirmed that PSF500 follows the complex mechanism of adsorption and precipitation with respect to heavy metals. Based on the experimental results, PSF500 could be used as an eco-friendly sorbent with CaCO3 as its main ingredient.
1. 서 론
중금속 오염은 산업, 농업 및 광업 폐기물 처리와 같은 인간 활동의 결과로 발생한다. 산업화가 고도화되는 사회에서 중금속 오염은 갈수록 증가하고 있으며, 이러한 고농도의 중금속 오염은 탁도, 산소 요구량 증가, pH 변화 등 다양한 형태의 수계에 물리적, 화학적 및 생물학적 변화를 일으킬 수 있다. 또한 식품 안전에 대한 잠재적인 위협과 인간 및 동물의 건강에 비가역적인 악영향 미칠 수 있어 면밀한 관리가 필요하다[1,2].
현재 중금속 오염폐수 처리에는 화학적 침전(Chemical precipitation), 증발(Evaporation), 전기 도금(Electroplating), 식물 추출(Phytoextraction), 역삼투(Reverse osmosis), 이온 교환(Ion exchange) 등 많은 기술이 사용되고 있다. 그러나 이러한 공법들은 불완전한 제거, 높은 비용 및 독성 슬러지 생성 등의 단점들이 존재한다[3,4]. 이에 반해 흡착(Adsorption)법은 타 기술보다 적은 비용과 에너지가 요구되며, 운영 측면에서 유지 및 관리가 쉬운 장점이 있다[5,6]. 현재 활성탄을 이용한 중금속 흡착 처리가 가장 많이 연구되었으나, 이 또한 높은 비용으로 대규모 적용에 제한적이며[6,7], 이러한 문제에 따라 경제성과 이용성이 우수한 흡착제 개발이 필요하다[4,8-10]. 그 중 바이오차는 바이오매스를 제한된 산소 조건에서 열분해하여 생성된 10~90%의 탄소 등의 유・무기물을 함유한 고형물로[11], 다공성 구조와 다양한 작용기의 존재로 흡착제로서 많은 연구가 진행 중에 있다[12]. 그러나 wood bark, pine wood, rice husk 등의 농업부산물을 활용한 연구로 국한된 경향을 보여, 천연폐자원을 활용한 더 다양한 연구가 필요할 것으로 보인다[11,12]. 석회석(limestone)은 주성분이 탄산칼슘(CaCO3)으로, 중금속과 반응 시 흡착과 침전작용, 특히 용해성이 낮은 안정적인 순수 광물상(pure mineral phase)의 생성물에 의해 중금속 활성을 낮출 수 있는 금속 보유(retention) 메커니즘을 제공하는 것으로 알려져 있다[13]. 이와 같이 흡착 및 침전, 복합체 형성 등 수용액으로부터 고체상으로 금속이온을 전달하는 모든 과정을 수착(sorption)이라고 한다[14]. 이러한 석회석과 중금속의 수착 과정에 따라, 폐수 내 중금속 제어 시 높은 제거 능력을 보유한 것으로 보고되었다[15]. 그러나 석회석을 폐수처리에 적용 시 자원의 재생 불가능성을 고려한 환경지속가능성 원칙에 모순된다[4,16]. 이에 따라, 현재 탄산칼슘의 대체 자원으로 굴껍질과 달걀껍질, 게껍질, 불가사리 등을 활용한 많은 연구가 진행되고 있다[4,5,8,9]. 불가사리는 포식성으로 인해 해양생물로서 양식장에 큰 피해를 줄 뿐만 아니라 막대한 개체수로 처리에 많은 어려움을 겪고 있다. 현재 관련한 연구로는 불가사리를 첨가한 산성 토양 개선 연구와, 불가사리 소재 다공성 세라믹을 이용한 중금속 흡착제로서 이용가능성을 평가한 연구가 존재한다[17,18]. 특히, 별 불가사리(Asterina pectinifera)는 300℃의 열분해 온도 조건의 바이오차로 가공하여, 중금속 흡착 능력을 평가한 연구가 선행 게재되었다. 그러나 흡착능력의 한계를 보였으며 타 연구결과와 비교 시 다양한 조건으로 많은 연구가 필요하다고 보고하였다[11]. 이에, Hongbo [12] 등이 열분해 온도의 증가는 흡착에 영향을 주는 표면의 다공성, 표면적, pH 등의 증가에 크게 기여한다는 보고에 따라, 본 연구에서는 별 불가사리(Asterina pectinifera)를 500℃에서 바이오차로 가공하여 이에 대한 특성평가, 흡착 실험, 기기분석을 진행하였으며, 이후 흡착 능력 관찰 및 흡착 메커니즘을 도출하여 중금속 폐수 내 이용가능성을 평가하였다.
2. 재료 및 방법
2.1. 실험 재료
본 실험에서 사용한 바이오차는 전라남도 여수시 인근 A섬으로부터 수거한 별 불가사리(Asterina pectinifera, SF)를 흐르는 물에 3일 동안 담가 놓은 후, 다시 증류수로 세척하여 자연 건조시켰다. 이후, 믹서로 분쇄하여 10 mesh 체(sieve)로 분리하였다. 이것을 밀폐 전기로(Furnace, Scien Tec Co.)를 사용하여 도가니에 담은 별 불가사리(Asterina pectinifera, SF)를 석영관 내에 넣은 후, 내부 압력을 1 × 10-2 torr 이하로 조정한 무산소 조건에서 아르곤 가스를 100 cc/min의 유량으로 주입하면서 불가사리를 승온 온도 7℃/min에서 500℃까지 도달시킨 후 2시간 동안 유지하여 열분해시켰고, 이를 PSF500 (Pyrolyzed Starfish at 500℃)으로 명명하였다. 이후 제조한 PSF500은 추후 실험을 위해 데시게이터에 보관하여 사용하였다.
2.2. 실험 용액
본 실험에서 사용한 인공폐수의 중금속은 폐수 내 주로 오염되어있는 Cu, Zn, Pb, Cd로 정하였으며, 각각 Cu(NO3)2・ 3H2O, Zn(NO3)2・6H2O, Pb(NO3)2 (EP, DAEJUNG, Korea), Cd(NO3)2・4H2O (GR, KANTO, Japan)의 시약을 사용하여 제조하였다. 모두 단일용액으로 진행하였으며, 용액의 pH는 0.1 N NaOH 용액과 0.1 N HNO3 용액을 사용하여 3.00 ± 0.05로 조절하였다.
2.3. 특성 평가
SF와 PSF500의 표면 형태를 관찰하기 위해 FE-SEM (HITACHI, S-4800)분석과, 그 표면의 중금속 구성 분석을 위해 EDS (HORIBA, ISIS310) 분석을 실시하였다. 표면의 작용기 파악은 FT-IR (Thermo Fisher, Nicolet 6700)을 사용하여 분석하였으며, PSF500의 열적 특성을 파악하기 위하여 TGA (TA Instruments, TGA2050)를 분석하였다. 또한 결정 구조 확인을 위한 XRD (Malvern panalytical, X’pert3 MRD) 분석과, 원소분석기(Thermofinnigan, FlashEA112) 분석을 통해 탄소(C), 수소(H), 산소(O), 질소(N), 황(S)의 함량을 확인하였으며, 표면 공극의 비표면적 측정은 BET 분석기(MicrotracBEL corp, BELSORP-mini Ⅱ)를 사용하여 분석하였다.
2.4. Batch 실험
2.4.1. Kinetics
최적 교반 시간 도출을 위해 시간에 따른 제거량 실험을 진행하였다. 각 중금속의 농도는 100 mg/L, pH는 3.00 ± 0.05인 2 L의 단일 인공폐수로 제조하였다. 이후, 각 제조한 인공폐수에 PSF500을 2 g씩 투입 후, 교반기로 150 rpm에서 교반시켰다. 실험은 24시간 동안 진행하였으며, 일정 시간 간격으로 상등액을 채취하였다. 이후, 0.45 µm의 실린지 필터로 필터링하여 이를 ICP-OES (Pekin Elmer, DV-5700)로 분석하였으며, PSF500에 대한 각 중금속의 흡착반응속도를 확인하기 위해 분석 결과를 1차 반응속도 모델(Pesudo-first-order kinetic model)과(식 (1)), 2차 반응속도 모델(Pesudo-second-order kinetic model)(식 (2))에 적용하였다.
여기서, k1과 k2는 각각 1차, 2차 반응속도 상수(min-1), qe는 평형상태에서의 흡착량(mg/g), t는 시간(min), qt는 반응시간 t에서의 흡착량(mg/g)을 의미한다.
또한 식(3)을 사용하여 시간에 따른 제거율(R%, 식 (3))을 그래프로 나타내었으며, 이에 따른 pH 변화도 관찰하였다.
여기서, Co는 중금속의 초기 농도(mg/L), Ce는 평형상태에서 중금속의 농도(mg/L)를 의미한다.
2.4.2. Equilibrium
각 중금속의 농도 변화에 따른 흡착량 변화를 관찰하기 위해 실험을 진행하였다. 농도는 10 ~ 500 mg/L로 범위를 달리하였으며, pH는 3.00 ± 0.05으로 조절하여 제조하였다. 이후, 300 mL 삼각 플라스크에 각 제조한 용액 100 mL와 PSF500을 0.1 g씩 투입 후 밀봉하여 인큐베이터에 24시간 동안 20℃에서 150 rpm으로 교반시켰다. 실험은 3회 반복하였으며, 위와 같은 방법으로 샘플을 채취 및 분석하였다. 이후 식 (4)를 사용하여 흡착량을 계산하였으며, 이를 그래프로 나타내었으며, 이에 따른 pH 변화도 관찰하였다.
여기서, V는 용액의 부피(L), M은 수착제의 양(g)을 의미한다.
또한, PSF500의 성능 평가를 위해 일정 온도에서 흡착질의 평형농도(Ce)와 흡착제의 평형흡착량(qe)의 관계를 정의하는 Langmuir와 Freundlich 흡착등온식에 적용하였다[19]. Langmuir 흡착등온식은 한 층에서 흡착 후, 그 이상의 층에서는 흡착이 일어나지 않는다는 것으로, 단분자층 흡착을 가정하며, 식(5) 표현된다[20]. 또한 Langmuir 흡착등온식은 RL(무차원 상수)의 값을 통해 흡착에 대해 RL > 1일 때 비호의적, RL = 1일 때 선형, 0 < RL < 1 일 때 호의적, RL = 0 비가역적으로 나눌 수 있다(식 (6)) [21].
여기서 qe는 평형상태에서의 흡착량(mg/g), qm는 최대 흡착량(mg/g)을 나타내고, b는 흡착상수(L/mg)를 나타낸다.
Freundlich 흡착등온식은 다분자층 흡착을 가정하며, 식(7)로 표현된다.
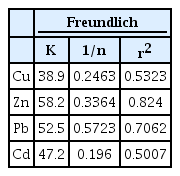
여기서 qe는 평형상태에서의 흡착량(mg/g), Ce는 평형 흡착 농도(mg/L), K는 흡착능, 1/n은 흡착강도를 나타내는 함수이다. K는 값이 증가할수록 흡착 능력이 좋으며, 1/n 값은 낮을수록 흡착제와 흡착질의 흡착 강도가 강함을 의미한다.
3. 결과 및 고찰
3.1. 특성평가
SF와 PSF500 표면의 형태를 관찰하기 위한 FE-SEM 분석 결과를 Fig. 1에 제시하였다. 결과, SF에 비해 PSF500의 표면에 상대적으로 다량의 공극이 관찰되었으며, 이는 고온의 열분해 과정에서 탈수산 작용(Dehydroxylation)에 의한 수분 손실 및 휘발성 물질의 제거에 기인한다[12,22].
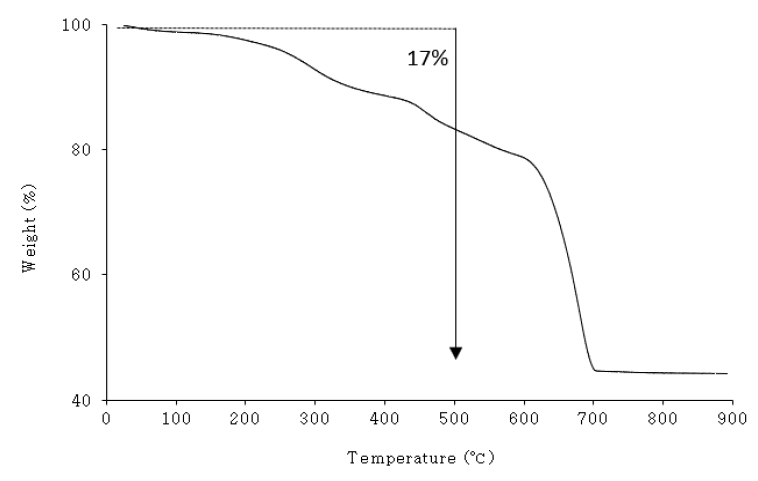
이후 SF의 열적 특성 파악을 위한 TGA 분석 결과(Fig. 2), 처음부터 질량이 감소하는 경향을 보였으며, PSF500의 해당 온도구간(500℃)에서 약 17%의 질량 감소를 보였다. 이는 유기물 연소와 관련된 것으로 판단되며[23], SF에 열이 가해지면서 CO2의 탈기로 인하여 CaCO3의 일부가 CaO로 전환됐을 것으로 보인다(식 (8)). 이것은 XRD를 통해서도 확인할 수 있었다.
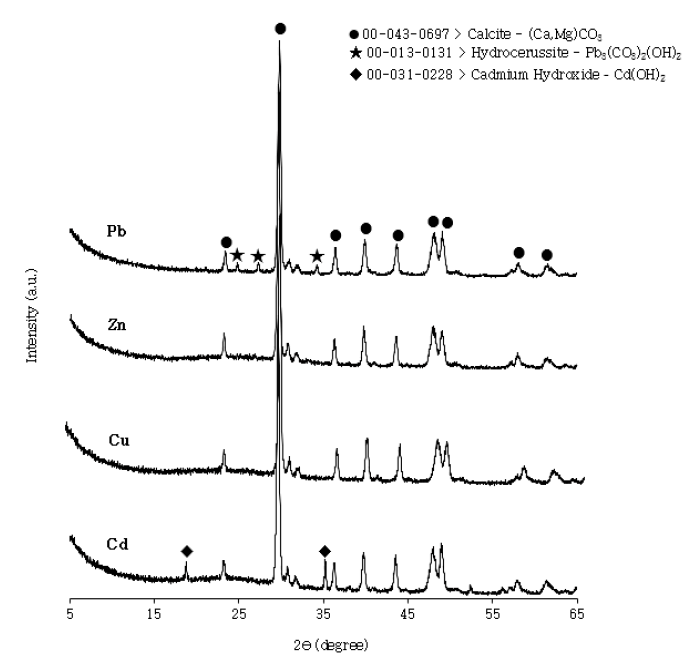
XRD 분석 결과(Fig. 3), 기존의 SF는 2θ 값 29.7, 39.8, 43.6, 48.1, 49.1에서 peak가 나타나 CaCO3를 주성분으로 한 형태를 띄었으며, PSB500은 SF와 동일한 peak와, 이외에 18, 34.1, 50.8에서 Ca(OH)2 peak, 37.3에서 CaO peak를 확인하였다.
한편, 원소 분석 결과(Table 1), SF에서 PSB500으로 열분해 시 수득률은 66.46%임을 확인하였다. 또한 본래 바이오차는 탄소보유능으로, 열분해 온도가 증가할수록 탄소함량이 증가한다고 보고되었는데, 본 연구에서는 18.07%에서 14.38%로 감소하였다. 이는 유기 및 무기 복합물질로 이루어진 SF의 열분해 과정 중 유기탄소의 감소와 달리(식 (8)), 무기 탄소의 감소는 크지 않았을 것으로 보이며, 이는 Table 1에서 증가된 O 함량을 통해서도 확인할 수 있다[11]. 한편 pH는 7.41에서 12.6으로 증가하였으며, 이는 위의 식 (8, 9)과 같이 SF의 주성분인 CaCO3가 열분해 중 Ca(OH)2와 CaO로 부분 변환됨에 따라 PSF500이 알칼리화된 것으로 판단된다. 표면적과 공극 부피는 각 0.33 m2/g, 0.002 cm3/g에서 3.4 m2/g, 0.034 cm3/g로 증가하였다.
Fig. 4는 SF와 PSF500의 FT-IR 분석 결과이다. SF와 PSF500의 작용기 스펙트럼은 비슷한 경향을 보여주었으나, 열분해된 PSF500의 peak는 대체적으로 완만해진 것을 볼 수 있었다. 이는 열분해로 인한 휘발성 물질 감소로 판단된다[24,25]. SF와 PSF500은 공통적으로 1,805 cm-1 및 1,416 cm-1에서 탄산염(CO32-)의 존재를 나타내는 C=O peak와 C-O peak, 874 cm-1와 715 cm-1에서 calcite peak가 나타났다. 또한 SF는 추가적으로 3,369 cm-1에서는 O-H peak로, 물 분자 사이의 수소 가교(Hydrogen-bridging)로 인해 매우 넓은 band가 나타났으며[26], 2,854 ~ 2,956 cm-1에서 aliphatic C-H peak, 1,651 cm-1에서 amide C=O peak, 1,084 cm-1에서 aryl carbonate, PSF500은 3,643 cm-1에서 carboxyl group의 O-H peak가 나타났다[11,27].
흡착제 표면의 다공성, 표면적 및 작용기 등은 중금속과 강한 상관관계를 가지고 있으며, 흡착에 영향을 미치는 주요 인자로 알려져 있다[28]. 본 SF와 PSF500의 특성평가 결과, SF의 열분해를 통해 제조된 PSF500의 흡착능을 향상시킬 수 있는 인자가 개선된 것을 확인할 수 있었다.
3.2. 접촉 시간에 따른 제거량
접촉 시간에 따른 각 중금속의 제거율을 Fig. 5에 나타내었다. Cu를 제외한 Zn, Pb, Cd는 빠른 속도로 제거가 진행되다가, 이후 느린 반응 속도로 Cu는 1,440분에서 96.5%, Zn은 120분에서 99.8%, Pb는 360분에서 99.3%, Cd는 30분에서 99.8%로 평형에 도달하였다. 이는 PSF500의 흡착 부위(site)와 각 중금속과의 강한 상호작용으로 빠른 흡착이 진행되다가, 접촉 시간이 증가함에 따라 흡착 부위(site)가 포화되어 반응이 느리게 진행되는 것으로 보인다. 한편, 각 중금속마다 평형에 도달하는 시간은 상이하여, 이후 실험의 반응시간은 1,440분으로 하였다.
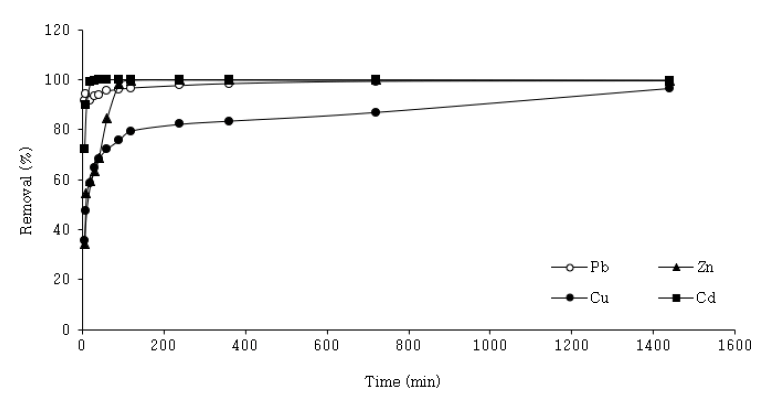
Heavy metals removal rate according to contact time (Concentration = 100 mg/L; pH = 3.00 ± 0.05; temperature = 20 ± 5℃).
Table 2에서는 유사1차반응식과 유사2차반응식에 적용한 결과를 제시하였다. 각 중금속은 r2 값이 모두 0.99 이상으로 유사2차반응식에 부합하였다. 유사2차반응식은 무기 오염물질 분석에 대해 가장 적합한 모델로, 흡착 과정이 흡착질의 농도가 아닌 흡착제 표면의 흡착 부위(site)와 관련되며, 주로 전자 공유 및 교환을 포함한 화학적 흡착을 따르는 것을 나타낸다[29]. 한편, K2 값을 통해 흡착속도는 Cd ≫ Pb > Zn ≥ Cu 임을 확인하였으며, 이를 통해, 같은 실험 조건에서 각 중금속마다 다른 흡착속도 및 제거 능력을 확인하였다. 이는, 각 중금속은 서로 다른 기본 특성을 가지고 있으며, PSF500의 표면에 대한 용해성, 전기음성도, 친화력 및 이온 교환 능력 등의 차이에 기인한다[30,31]. Ma [30] 등은 보통 CaCO3의 Ca+과의 이온반경이 가까울수록, 전기음성도가 클수록, MCO3, M(OH)2로 생성된 생성물의 용해성이 낮을수록 흡착 능력이 높다고 보고하였으며, 이러한 조건들은 흡착에 있어서 개별적인 인자에 결정되지 않고 모두 상관관계가 있다고 보고하였다.

The pseudo-first-order kinetic and pseudo-second-order kinetic model parameters for heavy metals by PSF500.
추가적으로, 접촉 시간에 따른 pH 변화는 Fig. 6에 나타내었다. 중금속 모두 식 (9~11) 과 같은 반응으로 pH가 상승한 것으로 보이며, Cu, Zn, Cd는 초기 3.00 ± 0.05에서 5.75 ~7.56까지 상승하였으며, Pb는 10.89로 유독 높은 pH 경향을 보였다. Wen [32] 등은 CaCO3의 중금속 흡착은 용액으로 방출되는 Ca2+과 상관관계를 가진다고 보고하였다. 또한 각각 다른 가수분해를 가진 중금속은 용액에서 서로 다른 산도를 나타낸다고 보고하였으며, 이에 따라 용액으로 방출되는 Ca2+의 양뿐만 아니라 CO32-, OH의 양 또한 다르다고 보고하였다. 본 연구에서 Pb는 초기 5분에서 Zn, Cu, Cd 보다 조금의 높은 pH를 보임에 따라, CaCO3와 더 강한 화학 반응을 일으켜, Ca2+과 함께 CO32-, OH의 방출되는 양이 컸을 것으로 판단된다. 그러나 pH에 대한 Pb 와 CaCO3의 관계에 대한 추가적인 연구가 더 필요할 것으로 판단된다. 한편, 중금속은 산성광산 배수, 도금폐수와 같은 높은 산도의 폐수에서 농도가 크게 증가하며, 그에 따라 주변 환경 문제를 야기한다[17]. Fig. 6과 같이, PSF500은 폐수의 pH를 조절하여 안정화시키는 것으로 보아, 수착제로 사용했을 시 중금속 제거와 함께 중화 및 완충작용의 기능에 효과적일 것으로 보인다.

pH change according to contact time (Concentration = 100 mg/L; pH = 3.00 ± 0.05; temperature = 20 ± 5℃).
3.3. 중금속 농도에 따른 흡착량 변화
Fig. 7은 농도에 따른 각 중금속의 흡착량 변화와 Freundlich 및 Langmuir 흡착등온선을 그래프로 나타낸 결과이다. 흡착량은 Cu, Zn, Pb, Cd 순으로 10.9 ~ 194.7, 9.8 ~ 258.4, 9.2 ~ 420.3, 9.5 ~ 132.4 mg/g의 결과를 보여주었다.

Variation in the amount adsorbed according to heavy metals concentration and the calculated value from the Freundlich and Langmuir adsorption isotherm.
pH는 Fig. 8과 같이, 각 중금속 모두 낮은 농도에서 10.8 ~ 11.3까지 도달하였다가, 농도가 증가함에 따라 5.7 ~ 7.5 사이로 감소하여 평형에 도달하였다. 이러한 경향은 앞서 서술한 바와 같이 CaCO3의 경우 흡착 및 표면 침전의 복합적인 메커니즘에 의한 것으로 판단된다. 특히, 흡착은 주로 낮은 농도에서 CaCO3의 흡착 부위(site)에서 발생하며, 높은 농도에서는 표면 침전 및 결정 구조와의 결합이 주를 이루는 것으로 알려져 있다[13,15,32,33]. 이에, 초기에 각 중금속과 PSF500과의 빠른 흡착 반응 중, 위의 식 (9 ~ 11)과 같이 가수분해가 일어나 pH가 급격히 증가하였다가[34], 식 (12 ~ 15)와 같이[35-37] 높은 농도에서 PSF500 표면의 CaCO3와 각 중금속과의 반응으로 생성된 생성물과 함께 분리된 H+로 인하여, 용액의 pH가 감소한 것으로 보이며[35], 이후, 표면에 덮힌 생성물에 의해 포화되어 평형에 도달한 것으로 보인다. 한편, 이 반응식의 근거는 실험 후 추가적인 XRD와 SEM 분석을 통해 확인하였다(Fig. 9, 10).

pH variation according to heavy metals concentration (Concentration = 10 ~ 500 mg/L; pH = 3.00 ± 0.05; temperature = 20 ± 5℃).
Langmuir 및 Freundlich 흡착등온식의 적용 결과는 Table 3, 4에 나타내었다. 각 중금속 모두 r2 값이 Cu, Zn, Pb, Cd 순으로 0.81, 0.98, 0.99, 0.99으로, Langmuir 모델에 부합하였다. Langmuir 모델은 무기 오염물질 제거에 적합한 것으로 알려져 있으며, 단분자층 흡착을 한다는 가정에 따라, Fig. 7의 각 중금속의 흡착량 경향을 더 뒷받침하였다. PSF500에 대한 각 중금속의 최대흡착량(qm)은 Cu, Zn, Pb, Cd 순으로 153.8, 270.3, 434.8, 147.1 mg/g이었으며, 분리계수 RL이 각 중금속 모두 0 < RL < 1으로, PSF500에 대한 각 중금속의 흡착은 호의적인 것을 확인하였다.
Table 5는 최근 문헌에서 제시된 다양한 열분해 온도 조건의 바이오차와 PSF500의 최대흡착량을 표로 정리해놓은 것이다. PSF500의 우수한 흡착량을 확인할 수 있으며, 특히 선행 게재된 별 불가사리 연구와의 비교 시 열분해 온도의 변경만으로 흡착량이 현저하게 개선됨을 확인할 수 있었다. 이에 중금속 제거에 대한 PSF500의 효과적인 수착제로서의 가능성이 있음을 보여주었다.
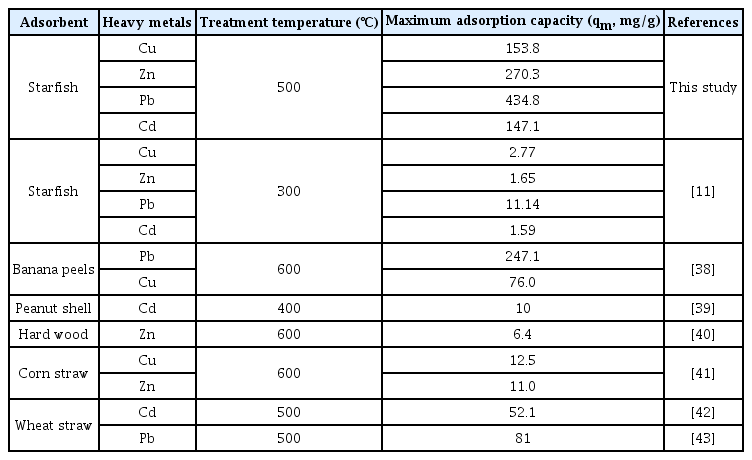
Pyrolysis temperature conditions and maximum adsorption amount for different biochars reported in this study and other literature.
실험 후, PSF500의 잔여물을 이용하여 표면에 수착된 각 중금속의 광물학적 형태와 그에 따른 Image 관찰을 위한 XRD와 SEM 분석을 진행하였다. SEM 분석 결과(Fig. 9), Dey [44] 등, Giri [45] 등, Cunha [46] 등, Khairy [47] 등, Shinde [48] 등의 문헌에서 제시된 각 CuO, Zn5(CO3)2(OH)6, Pb3(OH)2(CO3)2, Cd(OH)2 및 CdCO3 Image와, 본 연구의 SEM Image와 유사함을 보였다. 이에 각 중금속이 위와 같은 형태로 PSF500의 표면에 존재하는 것으로 판단된다.
또한 XRD 결과에서 Pb는 Pb3(CO3)2(OH)2, Cd는 Cd(OH)2의 peak를 확인하였으며, Zn5(CO3)2(OH)6, CuO, CdCO3는 SEM Image에서 확인한 것과 달리, XRD 결과에서 확인할 수 없었다. 이는 Du [15] 등이 보고한 20℃의 실험 조건에서 생성물의 낮은 결정도 특성 때문인 것으로 보인다. 이를 통해, papadopoulos [35] 등은 Cd는 CaCO3에서 Ca2+과 가장 비슷한 이온반경을 가지고 있어(Cd2+: 0.095 nm, Ca+ : 0.100 nm) 이온 교환을 통해 CdCO3로 생성된다고 보고하였고, papadopoulos [36] 등은 CaCO3 표면에서 생성된 CuO는 열역학적으로 안정적인 형태로 존재한다고 보고하였으며, Zn은 Zn5(CO3)2(OH)6로 생성된다고 보고하였다. 또한 Godelitsas [49] 등은 Pb는 PbCO3 또는 Pb3(OH)2(CO3)2로 생성된다는 보고에 따라, 본 결과와 일치함을 확인하였다. 이에, PSF500은 석회석의 대체제로서 중금속 폐수처리에 활용 가능할 것으로 판단되며, Al-Degs [10] 등은 CaCO3의 표면에서 Ca2+과의 이온교환을 통한 흡착 및 탄산염 복합체를 형성하는 금속은 불용성의 광물 형태로 강하게 수착(sorption) 된다고 보고하였으며, 여러 문헌에서는 이를 CaCO3가 표면에 중금속을 보유(Retection)한다고 보고하였다[13,50,51].
4. 결 론
SF를 바이오차로 제조 후(PSF500), 특성평가와 Cu, Zn, Pb, Cd로 오염된 폐수를 이용하여 흡착 실험을 진행하였다. TGA와 XRD 분석 결과, SF를 PSF500으로 가공하였을 시, SF의 주성분인 CaCO3가 일부 CaO, Ca(OH)2로 전환된 것을 확인하였다. 또한, PSF500 표면의 공극과 비표면적이 증가됨을 확인하였으며, 흡착에 영향을 주는 여러 작용기도 확인할 수 있었다. 이는 선행 게재된 연구 결과와 비교했을 시 열분해 온도 조건에 따른 PSF500의 더욱 개선된 면을 확인하였으며, 이에 중금속 흡착 처리에 있어서 더 높은 반응으로 우수한 흡착 능력을 보여줄 수 있을 것으로 판단하였다. 이후 batch 실험을 통해 PSF500은 무기 오염 물질 분석에 가장 적합한 모델인 유사2차방정식과, Langmuir 모델에 부합함을 확인하였으며, 최대흡착량(a, mg/g)은 Cu, Zn, Pb, Cd 순으로 153.8, 270.3, 434.8, 147.1 mg/g이었다. 실험 후, PSF500의 잔여물을 이용하여 XRD와 SEM 분석을 하였으며, 이에 따라 각 중금속은 초기 빠른 흡착 이후, 탄산염 복합체의 광물(CuO, Zn5(CO3)2(OH)6, Pb3(OH)2(CO3)2, Cd(OH)2, CdCO3)로 수착된 것을 확인하였다. 따라서 PSF500은 CaCO3를 주성분으로 한 천연폐자원로서, 여러 문헌에서 보고된 석회석(CaCO3)의 중금속 처리 메커니즘과 일치함을 확인하였다. 이에, 석회석의 대체제로서, 친환경적인 수착제로 이용 가능할 것으로 보이며, 향후 여러 변수(흡착제량, pH, 온도 등)에 따른 영향 및 중금속 보유 메커니즘의 확실성 파악을 위한 연속추출법 등의 추가적인 연구가 필요할 것으로 보인다.
Acknowledgements
본 연구는 한국연구재단(NRF)의 기초연구사업(과제번호 : 2019R1F1A1053374)의 지원으로 수행한 연구이며, 이에 감사드립니다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.