고전압 임펄스에 의해 가속화된 배관 내 CaCO3 스케일 생성의 속도론 연구
Kinetic Study of CaCO3 Precipitation Accelerated by High Voltage Impulse
Article information
Abstract
목적
HVI (high voltage impulse) 기술을 활용하여 배관 및 열교환기 등에서 발생하는 탄산칼슘 스케일 형성을 가속화하는 반응을 속도론(kinetics) 관점에서 해석하여 반응 차수(n)와 반응속도상수(k)를 도출하는 것이 본 연구의 목적이다.
방법
Ca2+ 농도 2.5 mM이 포함된 인공 시료를 조제하여 HVI를 인가하였다. 온도 25, 40, 60℃에서 HVI의 전압을 각각 0, 5, 10, 15 kV로 변화시켜가며 감소하는 칼슘이온의 농도를 이온크로마토그래피로 측정하여 탄산칼슘(CaCO3) 형성 반응의 반응 차수 및 반응속도 상수를 구하였다.
결과 및 토의
Ca2+이 탄산칼슘으로 침전되는 반응의 반응 차수는 2분자 2차 반응으로 나타났다. 반응속도 상수, k는 온도와 HVI의 인가 전압이 증가할수록 커졌다. 25℃에서 대조군(HVI를 인가하지 않은 경우)의 반응속도 상수 k는 3.0×10-3 L/(mmol・hr)이었으나, 15 kV의 경우의 k값은 8.2×10-3 L/(mmol・hr)로 나타나 대조군의 k보다 2.7배 큰 것으로 나타났다.
결론
탄산칼슘 형성 반응은 온도와 인가 전압이 증가할수록 가속되었으며, 이를 통해 HVI가 대체 탈염 공정으로 활용될 수 있는 가능성을 확인하였다.
Trans Abstract
Objectives
Determination of reaction order (n) and rate constants (k) of the CaCO3 scale formation reaction that was accelerated by the HVI (high voltage impulse) induction.
Methods
HVI was inducted to the synthetic solution containing 2.5 mM of Ca2+ ion at different temperatures of 25, 40, 60℃. The concentration of Ca2+ ion has been monitored as voltages of the HVI increased from 0 to 5, 10, 15 kV. Reaction order and the rate constants of the CaCO3 formation reaction were determined with the experimental dataset of Ca2+ concentration vs. time plots.
Results and Discussion
The CaCO3 formation was determined to follow two-molecules 2nd order reaction. The reaction rate constant, k increased as temperature and the applied voltages of HVI increased. The rate constant, k at 25℃ and 15 kV of HVI was 8.2×10-3 L/(mmol・hr), which was 2.7 times greater than the k of the control at 25℃, 3.0×10-3 L/(mmol・hr).
Conclusions
The reaction of CaCO3 formation was accelerated by HVI as the applied voltages of HVI increased, indicating that the HVI could be used as an alternative desalting technology for scale control.
1. 서 론
경수에 의한 스케일 형성은 상수관로, 용수처리 시설, 열교 환기, 냉각탑 또는 보일러 배관의 통수 능력 및 열 전달 효율을 저하시켜 불필요한 에너지 소비의 원인이 되고 스케일 제거를 위한 장비의 유지관리 비용을 증가시켜 경제적 손실을 유발한다[1,2]. 따라서 용수 사용 이전에 스케일 형성의 주된 물질인 Ca2+을 제거하는 연수화 또는 탈염 공정을 수행하여야 한다. 연수화 공정은 크게 물리적인 방법과 화학적인 방법으로 구분할 수 있다. 물리적 방법은 전기투석, 역삼투, 나노 여과 등이 이용되고 있으며, 화학적 방법은 석회소다 연수화법, 이온교환, 산 성분이 주된 역할을 하는 스케일 억제제를 투여하는 방법 등이 있다[3]. 그러나 물리적 방법은 에너지 소비가 매우 큰 편이며, 화학적 방법은 2차 오염물질이 발생하여 이를 다시 처리 및 처분하여야 하는 번거로움이 있다[4]. 또한, 화학약품의 이송, 저장, 취급 및 사용에 관한 안전 규제가 강화되는 추세에 있어서 화학약품의 사용에 따른 안전 비용이 부담으로 작용한다. 따라서 기존의 물리, 화학적 연수화 또는 탈염 공정을 보완할 수 있는 대체 탈염 기술 개발에 대한 요구가 지속되고 있다.
최근 탈염기술의 일환으로 HVI (high voltage impulse)에 대한 관심이 높아지고 있다. HVI는 수십 kV 단위의 전압을 ns ~ μs (10-9초 ~ 10-6초)의 단위로 방전하여 고전압 펄스 전기장을 형성시키는 기술이다[5,6]. HVI는 1990년대 중반부터 펄스전기장(pulsed electric fields)이라는 기술로 알려지면서 식품, 의학, 생물, 환경 등 분야에서 활발히 연구가 진행되었다[7-9]. 고전압 펄스 기술은 식품성분 중 단백질 및 영양성분이 열에 의해 변성되는 것을 막기위한 비열살균(non-thermal sterilization) 기술로 주로 활용되어 왔다[10-13]. 또한, HVI는 슬러지 가용화와 소독부산물 발생이 없는 대체 소독공정 등에 활용되어 왔으나 아직 초기 연구단계 수준이다[14,15]. HVI 장치를 구성하기 위해서는 초기 투자비용이 많이 요구되며 특히, 고전압 장치에 대한 안전장치가 담보되어야 하는 점이 현장에서의 활용을 저해하는 요인으로 작용하고 있다.
특히, HVI를 이용한 탈염(desalting) 연구는 스케일 문제를 해결해야 하는 모든 산업에 적용할 수 있기 때문에 가장 활발히 연구되고 있는 분야이다. 따라서 본 연구에서는 HVI를 탈염 기술로 활용하여 수중 칼슘이온(Ca2+)을 탄산칼슘(CaCO3)으로 침전하여 제거하는 연구를 수행하였다. 탄산칼슘에 의한 스케일 형성은 다음과 같은 평형 반응식 (1)~(3)으로 설명할 수 있다. 중탄산염(HCO3-)은 pH에 따라 탄산염(CO32-)으로 존재하고, Ca2+와 반응하여 탄산칼슘, CaCO3으로 침전된다[16].
식 (3)의 표준엔탈피, ΔH°=12.36 kJ/mol이고, 표준깁스자유 에너지, ΔG°=-47.70 kJ/mol이다[17]. 따라서, CaCO3 침전 반응은 자발적 흡열반응(spontaneous endothermic reaction)임을 알 수 있다. 또한, 탄산칼슘(CaCO3)의 용해도곱상수(Ksp)는 25℃에서 4.57×10-9 (mol2/L2)이지만 60℃에서는 1.82×10-11 (mol2/L2)로 크게 감소한다[18]. 즉, 온도가 상승할수록 CaCO3의 용해도곱상수는 작아진다. 보일러, 냉각탑 또는 커피 메이커와 같이 높은 온도에서 운영되는 배관에 스케일이 더욱 잘 생성되는 이유가 여기에 있다. CaCO3 침전이 온도의 영향을 크게 받으며 온도가 높아질수록 CaCO3 스케일 석출이 용이하다는 의미이다. 따라서 본 연구에서는 HVI를 이용한 탈염 실험을 3개의 온도로 구분하여 수행하였다. 즉, 상온(25℃), 중온(40℃)과 고온(60℃)으로 구분하여 각 온도에서 HVI 탈염 실험을 수행하여 온도가 CaCO3 침전반응에 미치는 영향을 살펴보고자 하였다.
HVI는 탄산칼슘의 침전 반응 속도를 증가시켜 탈염 공정으로 응용이 가능한 것으로 알려져 왔다[17,19,20]. 즉, 용수 사용 이전에 HVI로 처리하여 탄산칼슘 침전반응을 유도한 후 용수 사용을 하는 것이다. 이렇게 되기 위해서는 탄산칼슘의 침전 반응 속도가 중요하다. 즉, 칼슘 이온이 빠른 속도로 탄산칼슘으로 침전되어야 탈염 공정으로의 응용이 용이하다. 열교환기, 배관 및 용수처리 공정에서 탄산칼슘 스케일 제어를 위한 다양한 연구가 있었지만, 탄산칼슘의 침전에 대한 반응 속도론(kinetics)에 기반한 연구는 거의 없는 실정이다. 따라서 HVI에 의해 얼마나 빨리 탄산칼슘 침전 반응이 일어나는지에 대한 체계적인 해석 및 반응속도 연구가 필요한 이유가 여기에 있다.
탄산칼슘 스케일을 형성하는 식 (3)의 전체반응속도(overall reaction rate)를 식으로 표현하면 식 (4)와 같다. k는 반응속도 상수(rate constant)이다. 이때 α와 β는 각각 반응 물질인 Ca2+와 CO32-의 부분 반응 차수(individual reaction order)이고, 전체반응차수(overall reaction order)는 α+β이다.
본 연구에서는 HVI의 중요한 운전 인자인 인가 전압과 접촉 시간에 따라 Ca2+ 농도가 감소하는 정도를 관찰하고 이를 이용하여 Ca2+와 CO32- 각 이온의 부분 반응 차수, α와 β 그리고 전체반응차수를 구하고자 하였다. 또한, HVI를 인가하지 않은 대조군의 반응속도 차수와 반응속도 상수를 구하여 HVI 인가실험에 얻은 자료와 비교하고자 하였다. 이렇게 얻은 반응속도에 관한 자료들은 CaCO3 침전에 의한 스케일 생성 문제를 안고 있는 다양한 분야 — 수처리 시설의 배관, 냉각탑, 열교환기 등 — 에서 HVI 기술이 탈염 공정으로 사용될 때 필요한 기본 자료를 제공하는 것이 본 연구의 궁극적인 목적이다.
2. 실험재료 및 방법
2.1. HVI 시스템
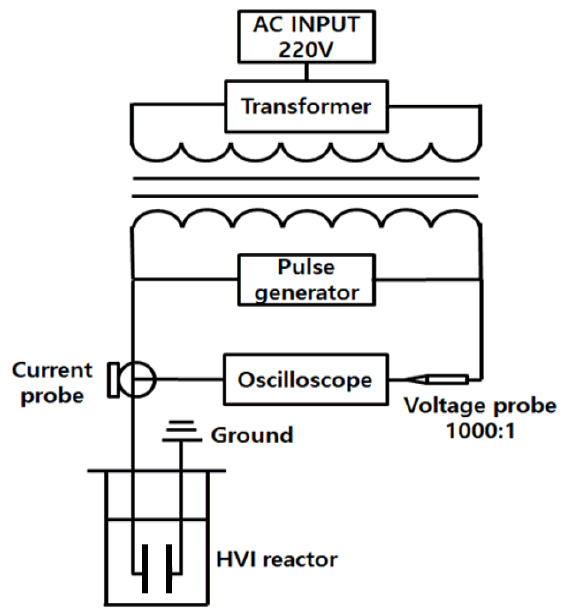
연구에 사용된 HVI 시스템은 인가 전압 0-30 kV, 펄스길이 4-40 μs, 주파수 100-300 Hz로 조절이 가능하도록 설계되어 제작되었다. Fig. 1은 HVI 시스템의 등가회로이고, Fig. 2는 실험실에 설치된 장치의 사진이다.
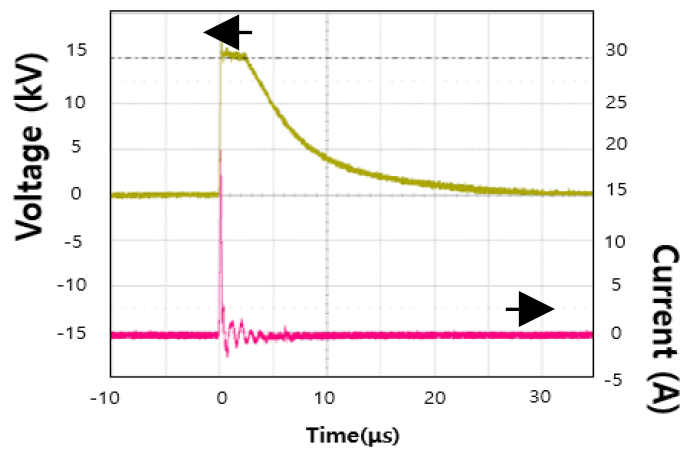
인입 전압 220 V를 kV 단위로 변압한 후, 반도체 스위치를 이용한 내부 회로로 구형파(square wave) 형태의 고전압 펄스를 생성시킨다. HVI 시스템에서 발생한 펄스를 시료에 인가하기 위해 제작된 HVI 반응기 내부의 전극에 연결하여 전계를 형성시키도록 구성되어 있다. 전압 프로브(PVM-6 1000:1, North star, USA)와 전류 프로브(CP150, LeCroy current probe, Teledyne LeCroy Inc., USA)를 오실로스코프(104xi-A, Teledyne LeCroy Inc., USA)에 연결하여 발생 펄스의 전압과 전류를 관찰하였다. Fig. 3은 발생한 펄스의 전압과 전류 파형을 오실로스코프에서 관찰한 이미지이다. 전압은 인가 직후 빠르게 상승하여 최고 값(15 kV)에 도달하고 일정시간 동안 구형파의 형태를 유지한 후 차츰 지수적으로 감소하여 0에 도달한다. 전류는 전압이 인가됨과 동시에 서지전류(surge current)의 영향으로 순간적으로 상승 후 곧바로 0으로 감소한다.
HVI 반응기의 직경은 150 mm, 높이는 250 mm이며 최대 용량은 3 L이다. 반응기 내부의 전극은 판 대 판(plate to plate)의 형식으로 설치되었으며 전극의 지름은 35 mm이다. 전극판 사이의 간격은 10 ~ 30 mm로 조절이 가능하지만, 본 연구에서는 10 mm로 고정하고 실험을 진행하였다. 전극 사이에 인가된 전계(electric field)의 세기, E는 인가 전압(V)에 비례하고 전극 거리(d)에 반비례한다: E = V/d. 따라서 본 연구에서는 전극 거리가 1 cm이므로, 만약 10 kV의 전압을 인가한 경우의 E = 10 kV/cm이다. HVI 반응기의 외부는 항온조에서 일정온도로 조절된 냉각수가 펌프를 이용하여 순환할 수 있도록 제작되었다.
HVI 인가 전압을 0, 5, 10, 15 kV로 증가시켜가며 Ca2+의 농도변화를 관찰하였다. 0 kV는 HVI를 인가하지 않은 대조군이다. 시료의 온도를 각각 25, 40, 60℃로 조절하여 HVI 인가 실험을 수행하였다. 시료의 용량은 2 L이며 펄스 길이 4 μs, 펄스 주파수는 100 Hz이다. HVI를 인가하면서 일정 시간마다 시료를 채취하여 감소한 Ca2+의 농도를 측정하였다.
2.2. 시료 조제와 이온 농도 분석
CaCl2 (Junsei Inc., Japan)와 NaHCO3 (Junsei Inc., Japan)를 초순수(18.3 MΩ)에 용해시켜 2.5 mM의 Ca2+, 2.5 mM의 HCO3-의 농도를 갖는 인공시료를 조제하였다. 2.5 mM의 Ca2+ 농도는 250 mg/L as CaCO3에 해당하며, 일반적인 경도 분류에 따르면 경수(hard water)에 해당한다. 따라서 CaCO3 침전반응이 충분히 발생할 수 있도록 Ca2+의 초기농도를 2.5 mM로 결정하였다. 또한, CaCO3에 침전반응에서 Ca2+와 CO32-는 1:1로 반응하므로 HCO3-의 초기농도도 2.5 mM로 결정하였다. 실험 목적에 따라 Ca2+와 HCO3-의 초기농도를 다르게 하여 조제하였다. 조제된 인공시료의 전기전도도는 약 1,200 μS/cm이었다.
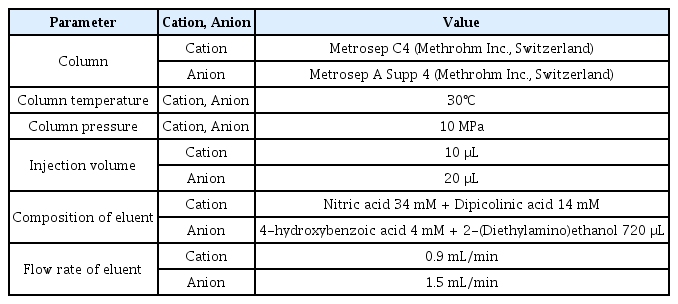
Ca2+와 HCO3-의 농도를 정성 및 정량분석하기 위해 이온크로마토그래피(881 Compact IC pro, Methrohm Inc., Switzerland)를 사용하였다. Ca2+와 HCO3-를 정량하기 위해서 각각 양이온과 음이온 전용 컬럼을 사용하였다. Ca2+ 분석을 위한 이동상의 조성, 이동상의 유량, 압력 및 컬럼의 운전온도 등 이온크로마토그래피의 상세한 운전조건은 Table 1에 제시하였다. 이온크로마토그래피에 전기전도도 검출기(conductivity detector)가 내장되어 있으며, 양이온과 음이온 표준용액을 이용하여 검량선을 작성 후 각 이온의 농도를 정량 하였다. Ca2+와 HCO3-의 농도는 이온크로마토그래피로 3회 분석하여 평균치를 대표농도로 사용하였다.
2.3. 반응차수와 반응속도 결정 실험
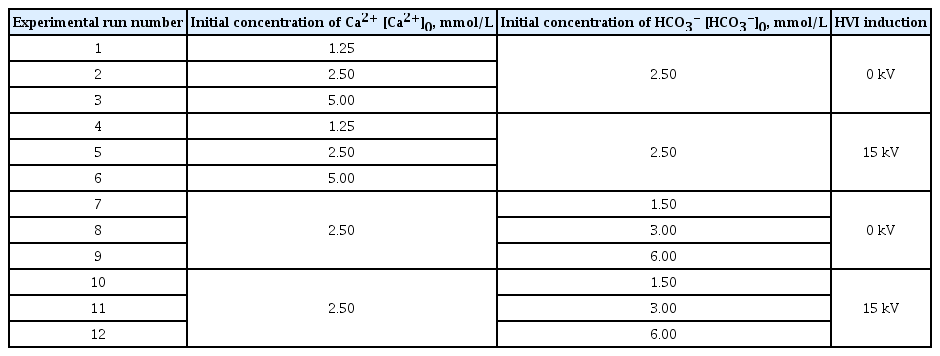
CaCO3 생성반응의 전체 반응 차수를 알아보기 위해 Ca2+와 HCO3-의 부분 반응차수를 구하는 실험을 각각 진행하였다. Table 2에서처럼 Ca2+와 HCO3-의 초기농도를 변화시켜가며 반응속도를 측정하여 반응차수를 알아내고자 하였다. 즉, Ca2+의 반응차수를 알아보기 위한 실험에서는 Ca2+의 초기농도를 1.25, 2.50, 5.00 mM로 변화시키고, HCO3-의 농도는 2.50 mM로 고정하여 Ca2+만의 반응속도를 구하여 반응차수를 추산하였다. 반면에 HCO3-의 반응차수를 구하기 위한 실험에서는 HCO3-의 초기농도를 1.50, 3.00, 6.00 mM로 변화시켰으며, Ca2+의 농도는 2.50 mM로 고정하여 HCO3-의 반응속도를 측정하여 반응차수를 구하였다. 반응시간은 Ca2+와 HCO3-의 농도가 더 이상 감소를 보이지 않을 때까지 농도관찰을 지속하였다. Ca2+의 경우 약 21시간, HCO3-의 경우에는 약 15시간 정도의 반응시간이 소요되었다.
3. 결과 및 고찰
3.1. HVI의 인가 전압과 온도에 따른 칼슘 농도 저감
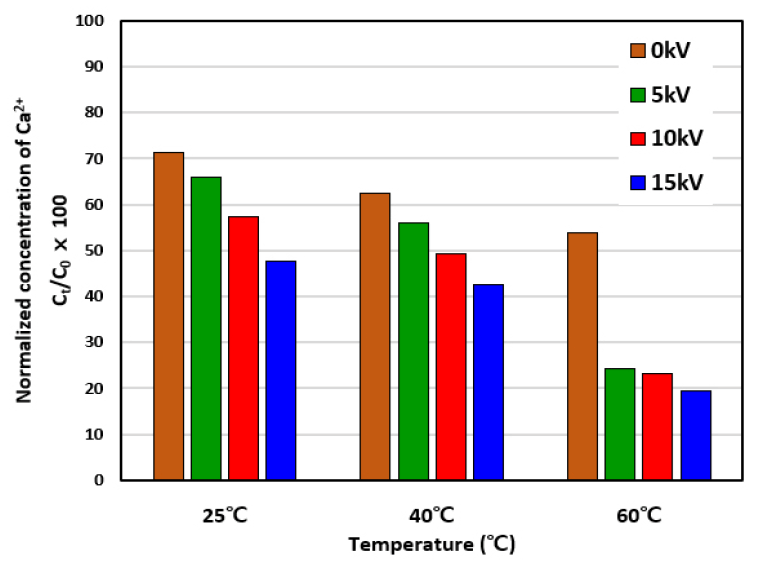
HVI의 인가 전압과 온도에 따른 Ca2+ 농도 감소를 알아보기 위해 인가 전압을 0, 5, 10, 15 kV로 변화시켜가면서 관찰된 Ca2+의 농도변화를 Fig. 4에 나타냈다. HVI 인가 실험은 25, 40 및 60℃에서 각각 수행되었으며, 더 이상의 Ca2+ 농도 감소를 보이지 않는 21시간 경과 후 종료하였다.
Fig. 4에서 보듯이 HVI를 인가한 경우의 Ca2+ 농도 감소 폭이 HVI를 인가하지 않은 대조군보다 큰 것을 알 수 있다. 그리고 HVI 전압이 5 kV에서 15 kV로 증가할수록 Ca2+ 농도가 더욱 크게 감소되는 것을 확인할 수 있다. 25℃에서는 HVI를 인가하지 않은 대조군의 Ca2+ 농도는 초기농도 대비 29% 감소한 반면, 15 kV에서는 53% 감소하였다.
Yang 등(2010) [21]의 연구에 의하면 펄스방전을 약 20시간 인가하였을 경우 Ca2+의 초기농도에서 26~32% 정도 감소하는 결과를 보였다. 조제된 Ca2+ 시료의 초기 농도, 시료 온도, 시료의 부피 및 펄스 또는 스파크 방전을 위해 인가한 에너지가 동일하지 않기 때문에 Ca2+ 농도 감소율을 본 연구의 결과와 직접 비교하는 것은 큰 의미가 없다. 그러나 본 연구에서 얻은 Ca2+의 감소효율이 문헌에서 보고된 값들과 유사하거나 더 큰 것을 알 수 있다.
또한, 온도가 60℃로 증가한 경우에는 Ca2+ 농도가 더욱 크게 감소하고 있음을 알 수 있다. 대조군의 Ca2+은 초기농도 대비 46%까지 감소하였지만 HVI를 15 kV로 인가한 조건에서는 81%까지 감소하였다. 그러나 HVI의 인가 전압이 5에서 15 kV로 상승하여도 Ca2+ 농도 감소 폭이 크지 않음을 알 수 있다. 이는 CaCO3 침전 반응이 흡열반응이기 때문에 온도가 높은 조건에서는 이미 상당 부분 침전이 유도된 이후이기 때문에, 인가 전압의 증가가 침전을 유도하는 효과가 상대적으로 크지 않은 것으로 해석된다. 즉, 60℃에서는 반응에 필요한 활성화에너지 장벽이 이미 많이 낮아진 상태이기 때문에 전압을 높여주어도 큰 효과가 없는 것으로 판단된다.
3.2. 탄산칼슘 석출의 반응차수와 반응속도상수 결정
Ca2+와 HCO3- 각각의 부분 반응차수를 구하여, CaCO3 생성 반응의 전체 반응차수를 구하고자 하였다. Table 2에 정리된 바와 같이 Ca2+의 반응차수를 구하기 위해 HCO3-의 초기농도를 2.50 mM로 고정하고 Ca2+의 농도를 1.25, 2.50, 5.00 mM로 변화하여 Ca2+의 농도 변화를 관찰하였다. Fig. 5는 HVI를 인가하지 않은 대조군의 Ca2+ 농도 자료이다.

Plots of Ca2+ concentration vs. time under different initial concentration of Ca2+ without induction of HVI.
다음 식 (5)를 이용하여 Ca2+의 반응속도를 구하였다. 즉, Fig. 5의 칼슘농도 변화량을 시간 변화량으로 나누어 반응속도를 구하였다.
Ca2+의 초기농도가 1.25, 2.50, 5.00 mM일 때 반응속도는 각각 0.014, 0.033, 0.075 mM/hr로 계산되었다. Ca2+의 초기농도가 두 배 증가할 때마다 반응속도 역시 약 두 배 증가하였기 때문에 1차 반응으로 볼 수 있다.
다음은 HVI 15 kV를 인가한 후 Ca2+ 농도 변화를 관찰하였다(Fig. 6). 마찬가지로 식 (5)를 이용해 각 농도에서의 반응속도를 구하였다. Ca2+의 초기농도가 1.25, 2.50, 5.00 mM일 때 각 반응속도가 0.033, 0.068, 0.140 mM/hr로 HVI를 인가하지 않고 실험한 경우와 마찬가지로 Ca2+의 농도가 두 배 증가함에 따라 반응속도도 약 두 배 증가하였다. 즉, HVI를 인가한 경우에도 Ca2+의 개별 반응차수는 1차 반응을 따르는 것으로 확인되었다.
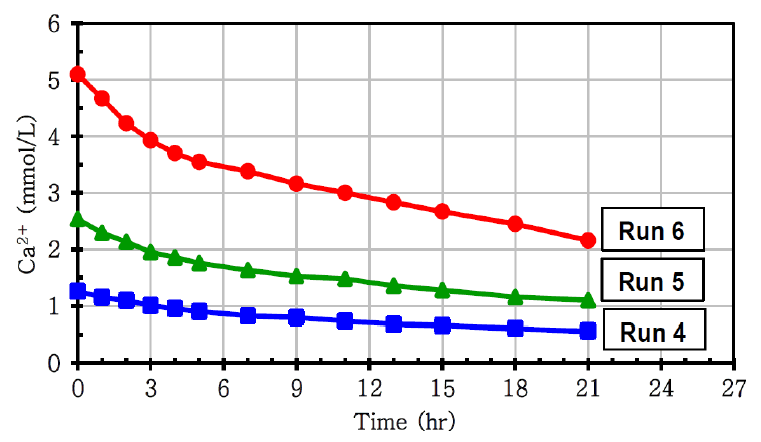
Plots of Ca2+ concentration vs. time under different initial concentration of Ca2+ with induction of 15 kV of HVI.
HCO3-의 반응차수를 알아보기 위해 Ca2+의 초기농도를 2.50 mM로 고정하고, HCO3-의 초기농도를 1.50, 3.00, 6.00 mM로 변화시켜가며 HVI가 인가되지 않은 조건에서 HCO3- 농도변화를 관찰하였다(Fig. 7). HCO3-의 초기농도가 1.50, 3.00, 6.00 mM일 때 반응속도는 각각 0.029, 0.049, 0.096 mM/hr로 나타났다. 초기농도가 두 배 증가할 때마다 반응속도 역시 약 두 배 증가하였다. Ca2+와 마찬가지로 1차 반응으로 평가할 수 있다.

Plots of HCO3- concentration vs. time under different initial concentration of HCO3- without induction of HVI.
HVI 15 kV를 인가하면서 HCO3- 농도변화를 관찰하였다(Fig. 8). HCO3-의 초기농도가 1.50, 3.00, 6.00 mM일 경우 각 반응속도는 0.055, 0.103, 0.194 mM/hr로 초기농도가 두 배 증가할 때마다 반응속도 또한 두 배 증가하였다.
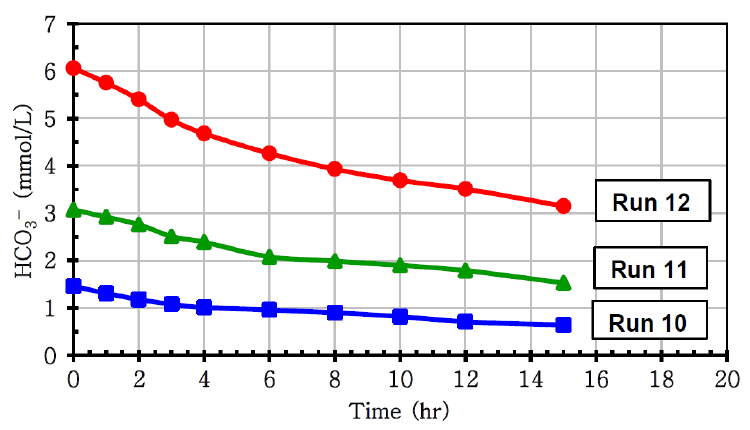
Plots of HCO3- concentration vs. time under different initial concentration of HCO3- with induction of 15 kV of HVI.
이상의 결과를 요약하면 Ca2+와 HCO3-는 HVI 인가 여부와 관계없이 1차 반응으로 확인되었다. 따라서 CaCO3 생성반응의 전체 반응 차수는 다음 식 (6)과 같이 2분자 2차 반응이라는 것을 확인할 수 있다.
Cho 등(2017) [20]에 의해 수행된 연구에서는 HVI에 의해 가속화되는 CaCO3 침전반응 즉, Ca2+ + CO32- ⇌ CaCO3 반응을 2차 반응으로 해석하였다. 그러나 위 침전반응을 Ca2+ 이온만의 단 분자 2차 반응(mono molecule 2nd order reaction)으로 해석하여, 반응속도= k[Ca2+]2로 실험 결과를 해석한 바 있다. 그러나 본 연구 결과에서 보듯이 CaCO3 침전반응과 HVI에 의해 가속화된 CaCO3 침전반응 모두 2분자 2차 반응임이 밝혀졌다.
반응식 A + B ⇌ C + D의 반응속도가 d[A]/dt = k[A]・[B]와 같이 주어지는 2분자 2차 반응을 따른다면, 아래와 같이 변수분리 후 적분과정을 통하여 식 (10)을 얻을 수 있다. 즉, 식 (6)을 변수 분리 후, A는 A0에서 A까지, B는 B0에서 B까지, 시간 t는 0에서 t까지 적분하면 식 (7)을 얻는다[18].
양 변에
양 변에 자연로그, ln를 취하면
양 변을 A0-B0을 나눠주면
A0, B0: 시료 A와 B의 초기 농도, A, B: 임의의 시간 t에서의 A와 B의 농도
따라서 CaCO3의 생성반응이 2분자 2차 반응임을 확인하기 위하여 y축은
온도와 인가 전압 변화에 따른 반응속도 상수, k를 구하기 위해 Fig. 4의 실험자료를 이용하여 y축을

Plots of
Fig. 9에서 얻은 그래프들의 선형회귀분석 자료를 Table 3에 요약하였다. HVI를 가하지 않는 대조군의 선형회귀계수(r2)는 0.754 ~ 0.878을 보이고 있어서 통계적으로 2분자 2차 반응으로 해석하기에 다소 무리가 있을 수 있다. 그러나 HVI를 인가한 경우의 r2는 0.933 ~ 0.997 정도로 2분자 2차 반응으로 해석할 수 있다. HVI를 인가하면 CaCO3 생성반응의 메커니즘 또는 calcite, aragonite 등과 같은 결정구조가 어떻게 변화하는지 현 상태에서는 확인할 수 없으나, HVI 인가로 인한 CaCO3 침전 생성 반응은 2분자 2차 반응으로 해석할 수 있다고 결론지을 수 있다. 또한 Fig. 9의 각 직선의 기울기를 구하여 반응속도 상수, k를 계산하였고 그 결과를 Table 4에 정리하였다.
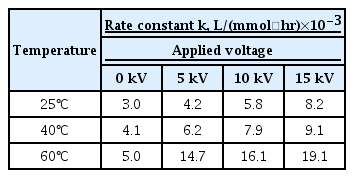
Comparison of the reaction rate constant calculated under different temperature and applied voltages of HVI.
반응속도 상수가 가장 큰 경우는 60℃일 때 15 kV의 HVI를 인가한 경우이다. 이때의 반응속도 상수, k는 19.1×10-3 (L/(mmol・hr)이고 같은 온도의 대조군보다 약 3.8배 크다. 반응속도 상수가 가장 작은 25℃에서 대조군의 k는 3.0×10-3 (L/(mmol・hr)이다. 동일온도에서 15 kV의 HVI를 인가한 경우의 반응속도 상수, k는 8.2×10-3 (L/(mmol・hr)로 대조군보다 약 2.7배 큰 것으로 나타났다. 이상의 결과를 종합하면 HVI에 의해 CaCO3 생성반응 속도가 2.7 ~ 3.8배 촉진됨을 알 수 있으며, 이는 HVI가 대체 탈염 공정으로 활용될 수 있는 가능성을 보여주고 있음을 시사한다.
용수 사용에 있어서 관내에 스케일 발생이 문제가 되는 이유는 침전 반응속도가 느려서 침전 반응이 천천히 진행되어 관내에 스케일이 점진적으로 발생하기 때문이다. 따라서 용수 사용 이전에 HVI 공정을 적용하여 침전 반응을 가속화하여 수중의 칼슘 농도를 충분히 감소시키면 이후 공정에서 스케일 발생이 억제될 것이다. 종합하면 HVI 공정을 대체 탈염 공정의 일환으로 사용할 수 있다고 결론지을 수 있다.
4. 결 론
본 연구에서는 HVI 기술을 활용하여 수중 Ca2+를 CaCO3 형태로 석출되는 반응을 속도론적 관점에서 접근하여 반응속도 차수와 반응속도 상수를 구하였다. 아울러 HVI 공정을 운영하는데 중요한 운전변수인 인가 전압의 영향을 25℃, 40℃, 60℃에서 각각 살펴보았으며 도출된 결과를 다음과 같이 요약하였다.
1) HVI를 인가하지 않은 대조군보다 HVI를 인가한 경우의 Ca2+ 농도가 더욱 크게 감소하였다. 또한, HVI의 인가 전압을 5 kV에서 15 kV로, 온도는 25℃에서 60℃로 높아질수록 Ca2+ 농도는 더욱 크게 감소하였다.
2) Ca2+ 이온이 CaCO3 형태로 석출되는 반응의 전체 반응 차수를 알아보기 위하여 Ca2+와 HCO3-의 부분 반응차수를 각각 구하였다. CaCO3 생성반응은 Ca2+와 HCO3-에 대하여 각각 1차 반응이었다. 따라서 CaCO3로 석출되는 전체 반응은 2분자 2차 반응으로 확인되었다.
3) HVI에 의해 CaCO3 생성 반응의 속도상수, k가 HVI를 인가하지 않은 대조군보다 2.7 ~ 3.8배 정도 큰 것으로 확인되었으며, 이는 HVI가 대체 탈염 공정으로 활용될 수 있음을 시사하고 있다.
Acknowledgements
본 연구는 한국연구재단의 연구비 지원으로 수행되었습니다(과제번호: 2019R1F1A1042061). 이에 감사드립니다.