토양 세척 후 발생하는 2차 폐수에서의 방사성세슘 제거 연구
Removal of Radioactive Cesium in Secondary Wastewater after Soil-washing Process
Article information
Abstract
목적
본 연구에서는 원자력발전소 인근 방사성 세슘으로 오염된 토양의 복원을 위한 토양 세척공정에서 발생되는 2차 폐수 중의 방사성세슘을 일라이트를 이용한 흡착공정을 통해 제거 가능성을 평가해 보고자 하였다.
방법
본 연구에서는 폐수 중 존재하는 방사성세슘을 처리하기 위해 흡착제로 충북 영동에서 채취한 영동 일라이트와 이를 고온산처리(60℃, 0.01 M HCl)하여 인위적으로 풍화시킨 풍화일라이트를 이용하였다. 풍화 전후 저농도 세슘(1 ppm)에서의 일라이트의 흡착율을 비교하였으며, 경쟁 이온인 칼륨(1.5 ppm)을 이용하여 흡착제의 탈착율을 비교 및 평가하였다.
결과 및 토의
일라이트를 인위적으로 풍화시키면, 일라이트 내 층간 이온이 용출되면서 풍화된 모서리면의 양이 증가하였다. 흡착 및 탈착 실험 결과, 풍화일라이트의 흡착율은 영동 일라이트보다 산성 조건(pH 3)에서는 약 11%, 중성 조건(pH 6.2)에서는 약 26% 증가하였으며, 탈착율은 산성 조건(pH 3)과 중성 조건(pH 6.2)에서 약 6% 감소하는 것으로 나타났다. 영동 일라이트와 풍화일라이트는 산성 조건보다 중성 조건에서 흡착율이 높게 나타났는데, 이는 높은 pH에서 일라이트의 표면이 음전하를 띠게 되어 양이온으로 존재하는 세슘과의 반응성이 증가하였기 때문이다.
결론
인위적인 풍화과정울 통하여 흡착제로써의 일라이트 성능을 개선시켰으며 이는 원자력발전소에서 발생하는 방사성세슘 제거를 위한 효과적인 흡착제로 활용될 수 있음을 시사한다.
Trans Abstract
Objectives
Secondary wastewater is generated as the soil washing process proceeds to restore contaminated soil near the nuclear power plants (NPPs). In this study, we tried to evaluate the possibility of removing radioactive cesium from secondary wastewater through the adsorption process using illite.
Methods
To treat radioactive cesium present in wastewater, as an adsorbent, we used illite collected from Yeongdong, Chungbuk, and weathering illite artificially weathered by high temperature and acid treatment (60℃, 0.01 M HCl). Before and after weathering, the adsorption rate of illite at low concentrations of cesium and the desorption rate of adsorbents were compared and evaluated using a 1.5 ppm of competitive potassium ion similar to that of groundwater.
Results and Discussion
When the illite was artificially weathered, the amount of frayed edge sites increased as the interlayer ions in the illite eluted. As a result of the adsorption and desorption experiments, it was confirmed that the adsorption rate of weathering illite increased by about 11% in acid condition (pH 3) and about 26% in neutral condition (pH 6.2), and the desorption rate of weathering illite decreased by about 6% in acid and neutral conditions, compared to Yeongdong illite. Yeongdong illite and weathering illite showed higher adsorption rate under neutral condition than acidic condition, because the surface of the illite became negatively charged at high pH so the reactivity with cesium present as a cation increased.
Conclusions
The artificial weathering process has improved the performance of illite as an adsorbent. We expect that weathering illite can be used as an effective adsorbent for the removal of radioactive cesium from NPP.
1. 서 론
원자력발전소 운영 및 해체 시 방사성핵종의 누출은 다양한 방식으로 발생한다. 이 중 우라늄과 플루토늄의 핵분열 반응으로 발생하는 방사성세슘은 핵무기 폭발, 체르노빌과 후쿠시마 원자력발전소 사고, 그리고 원자력발전소 해체 시와 같은 여러 원인을 통해 발생한다[1]. 실제로 후쿠시마 사고 이후, 일본 최남단지역인 규슈지역을 제외하고 일본 전역이 방사성세슘으로 오염되었다고 발표되었다[2].
국내외 원자력발전소 사고 및 해체 시 발생하는 방사성세슘은 흡착성이 강하기 때문에 원전 주변 토양에 흡착되어 오염을 발생시킨다[3]. 이러한 오염된 토양에서의 방사성세슘을 제거하는 방법으로는 토양 세척, 토양 세정 및 동전기 등의 기술이 있다[4]. 이 중 토양 세척은 단시간 내에 광역의 토양을 제염하고 용이성 및 경제적 효율성이 높아 광범위하게 사용되고 있다[5,6]. 특히, 방사성세슘은 매우 높은 용해도를 가지고 있기 때문에 토양 세척 시 발생하는 2차 폐수에 가장 많이 존재할 것으로 예상된다[7]. 토양 세척은 세척수에 따라 결정되는데, 산 세척수를 이용한 제염 공정은 물을 이용할 때보다 토양의 표면장력을 더욱 약화시켜 세슘과 토양을 고효율로 분리시킬 수 있는 장점이 있으나, 다량의 산폐액을 발생시킨다는 단점이 있다[4]. 이로 인하여, 세척수로물을 이용하여 제염하는 공정 또한 개발되고 있다[4]. 따라서 토양 세척 후 발생하는 2차 폐수는 산성 및 중성조건으로 존재할 수 있으며 2차 폐수에 존재하는 방사성세슘을 제거하는 효율적인 방법이 필요하다.
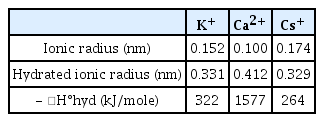
최근 수중 환경으로부터 방사성세슘을 격리시키는 데 상당한 연구가 진행되어오고 있으며, 방사성세슘 제염에 사용되는 기술로는 용매 추출, 침전, 이온교환, 그리고 흡착 등이 있다[8]. 이 중 흡착은 환경에서 방사성세슘을 제거하는 데 중요한 공정이다[9]. 방사성세슘을 강하게 흡착하는 성질을 가진 점토광물 중 하나인 일라이트((K,H3O)Al2(Si,Al)4O10(H2O,OH)2)는 카올리나이트와 함께 우리나라 토양에 가장 많은 점토 광물이며, 가장자리에 풍화된 모서리면(frayed edge sites, FES)이라는 흡착 지점이 존재하기 때문에 흡착에 매우 효율적인 광물로 알려져 있다[10,11]. 일라이트 구조는 2개의 Si/Al 사면체판과 층간 양이온들에 의해 결합된 중심의 팔면체판을 갖는 2:1층으로 구성된다. 일라이트는 일반적으로 층간 위치에 칼륨이 있으며 층간 간격은 약 1.0 nm이다. 하지만 다른 1가 및 2가 양이온들이 층간에 존재하는 칼륨과 이온교환하여 층간 구조를 왜곡시킬 수 있다[12]. 수화된 칼슘은 이 자리에 치환되어 일라이트의 층간 간격을 약 1.4 nm로 팽창시킨다[13]. 이처럼 풍화는 수화 및 탈수 중간층 사이에 부분적으로 확장된 영역을 생성하며, 이를 풍화된 모서리면이라고 한다[14]. 이러한 풍화된 모서리면은 다른 1가 및 2가 양이온보다 세슘을 선택적으로 흡착한다. 그리고 이렇게 흡착된 세슘은 기존의 다른 흡착제보다 상대적으로 용액으로 잘 탈착되지 않아 환경에서의 세슘의 이동성을 제어하는 데 중요한 역할을 한다[15-17]. 이처럼 풍화된 모서리면의 존재여부는 세슘의 흡착율에 밀접한 연관이 있다. 일라이트의 풍화 처리를 통한 풍화된 모서리면의 흡착 연구는 활발히 연구되어오고 있으나, 대부분 중성 조건에서의 일라이트의 흡착 연구로 집중되어져 왔다. 따라서, 2차 폐수의 다양한 pH 조건을 고려하여 산성 및 중성 조건에서의 일라이트의 흡착 연구 및 흡착제로써의 안전성 평가를 위한 일라이트의 탈착 연구가 필요하다.
따라서 본 연구에서는, 토양 세척 후 발생하는 2차 폐수에서의 세슘 제거를 위해 흡착제로 일라이트를 사용하였으며, 일라이트의 흡착 성능을 증가시키기 위하여 인위적인 풍화를 진행하였다. 그리고 이를 확인하기 위해 SEM, BET, XRD, 그리고 TEM 분석을 실시하였고 산성 및 중성조건에서 흡착 실험을 진행하였다. 또한 흡착제의 안전성을 평가하기 위해 풍화 전후 산성 및 중성조건에서의 물리적 및 화학적 탈착 실험을 통해 일라이트의 세슘 탈착율 변화를 관찰하였다.
2. 실험방법
2.1. 재료 및 분석
본 연구에서 흡착제로 사용한 일라이트는 영동 지방에서 채취한 영동 일라이트(Yeongdong illite, YD illite)로, 이를 체거름으로 입자를 분류하여 75~150 µm 크기의 영동 일라이트 시료를 실험에 사용하였다. 산 세척수로는 옥살산, EDTA, 그리고 인산 등이 사용되며 이 중 옥살산이 많이 사용되므로 1 L 부피플라스크에 초순수 증류수 1 L를 넣고 Oxalic acid 0.090 g (1 mmol)을 넣어 pH 3인 1 mM 옥살산용액을 만들어 사용하였다[6,18]. 중성 세척수로는 초순수 증류수(pH 6.2)를 사용하였다[18]. 모의 폐수는 방사성 세슘(Cs-137 등)과 화학적 성질이 유사한 안정동위원소인 Cs-133을 사용하였다. 7.52 µmol (1.466 mg)의 cesium nitrate (CsNO3, Sigma-Aldrich, Germany)를 옥살산 용액 및 증류수에 넣어 1 ppm의 세슘을 포함한 모의 폐수를 제작하여 사용하였다.
탈착 실험 시, 토양 세척 후 발생하는 2차 폐수에 존재하는 세슘을 흡착한 일라이트가 얼마나 탈착되는 지를 관찰하기 위하여 세슘의 경쟁이온인 칼륨을 사용하였으며 농도는 지하수와 유사한 환경을 기준으로 하였다. 따라서 칼륨의 농도는 지하수 내 칼륨의 평균 농도인 약 1.5 ppm으로, 3.7×10-2 mmol (3.802 mg)의 potassium nitrate (KNO3, Sigma-Aldrich, Germany)를 산성 및 중성 용액에 넣어 탈착용액으로 사용하였다[19]. 또한, 모든 실험에 대하여 삼중(triplicate)으로 시료를 제작하였다.
풍화 전후 시료의 광물학적 형태 및 변화는 전계 방출형주사 전자 현미경(SEM, JSM-7800F Prime, JEOL Ltd)을 사용하여 분석하였다. 시료는 백금(Pt) 코팅(20 mA, 15초)을 실시한 후 500 V 조건에서 분석을 실시하였다. 시료의 비표면적은 BET 비표면적 분석기(BET, BELSORP-mini Ⅱ, MicrotracBEL)를 사용하여 측정하였다. 시료 내 층간 간격의 변화는 구면수차보정 투과 전자 현미경(TEM, JEM-2200FS, JEOL)을 사용하여 측정하였으며, 전압 200 keV에 상온에서 측정하였다. 또한 영동 일라이트와 풍화일라이트 시료의 결정학적 특성 및 변화 분석을 위해 XRD (X-ray diffraction) 분석을 실시하였다. XRD 분석은 X-선 회절분석기(XRD, MiniFlex600, Rigaku, Japan)를 사용하여 측정하였으며, 회절 패턴은 3~80°, 2 theta degree (2θ) 구간에서 스텝크기 0.01°로 측정하였다. X-선의 전류는 15 mA, 전압은 40 kV를 사용하였다. 흡착 및 탈착 전후 세슘의 농도는 유도결합플라즈마 질량분석기(ICP-MS, NexIon 300D, PerkinElmer)로 분석하였다.
2.2. 풍화
풍화된 모서리면의 양을 증가시켜 영동 일라이트의 흡착 성능을 개선시키기 위하여 영동 일라이트를 고온산처리를 통해 인위적으로 풍화시켰다. 먼저, 100 mL 비커에 0.01 M 염산 50 mL (pH 1.0)와 영동 일라이트 1 g를 넣어준 후 가열 교반기(PC-620D, Corning)에서 60℃, 300 rpm으로 1일 동안 시료를 반응시켜주었다[20]. 이후, 50 mL 코니칼 튜브에 옮겨 담고, 원심분리기(Centrifuge, Eppendorf 5702)를 이용하여 3,000 rpm에서 20분 동안 원심 분리시켰다. 시료에 의한 pH 영향을 제거하기 위하여 원심 분리를 통해 침전된 풍화일라이트(Weathering illite)는 초순수 증류수를 이용하여 상등액의 pH가 6 이상의 값을 가질 때까지 반복적으로 세척하였다. 이를 50℃에서 24시간 건조시킨 후 세슘에 대한 흡착 및 탈착 실험에 사용하였다.
2.3. 흡착
고체 시료와 용액의 비율은 1:100으로, 50 mL 코니칼 튜브에 영동 일라이트 및 풍화일라이트 시료 0.5 g과 1 ppm의 세슘 용액 50 mL를 넣어준 후, 충분한 흡착을 위하여 교반기(Lab Companion, SK-300)를 이용하여 250 rpm에서 3일 동안 교반시켜 주었다[21-23]. 흡착 반응 뒤 원심분리기를 이용하여 3,500 rpm에서 20분간 원심 분리한 뒤 상등액을 채취하였고, 상등액에 잔류한 세슘의 농도는 2% 질산 용액으로 희석한 뒤 ICP-MS로 측정하였다. 시료의 세슘 흡착율은 초기 세슘 농도(C0, mg/L)와 흡착 뒤 상등액에 잔류한 세슘 농도(C1, mg/L)의 차이를 이용하여 계산하였다(Eq. (1)) [24].
2.4. 탈착
흡착된 시료는 탈착 실험을 위하여 오븐(Lab Companion, OF-21E)에서 60℃에서 24시간 동안 건조시켰다. 탈착 실험은 초순수 증류수 세척을 통한 물리적 탈착 실험과 경쟁 이온과의 이온 교환을 통한 화학적 탈착 실험으로 나누어 진행하였다. 화학적 탈착 실험에 앞서, 흡착 후 건조시킨 시료에는 풍화된 모서리면에 흡착된 세슘 이외에 흡착제 표면에 묻어있는 세슘이 존재할 수 있기 때문에, 이를 제거하기 위하여 초순수 증류수를 이용하여 세척하였다. 고체 시료와 용액의 비율은 1:100으로, 흡착 실험과 동일한 코니칼 튜브에 초순수 증류수 50 mL를 넣고 3시간 동안 교반기를 이용하여 250 rpm에서 교반시켜 주었다. 이를 원심분리기로 3,500 rpm에서 20분간 원심 분리한 뒤 상등액을 채취하였고, 상등액에 존재하는 세슘의 농도는 흡착 실험과 동일하게 ICP-MS로 측정하였다. 초순수 증류수 세척은 상등액에서 세슘이 측정되지 않을 때까지 세척하였고 본 실험에서는 4번 실시하였다.
이후 시료를 오븐에서 60℃에서 24시간 동안 건조시킨 후 화학적 탈착 실험을 진행하였다. 이온 교환을 위한 세슘의 경쟁 이온으로는 칼륨을 이용하였다. 건조시킨 시료에 1.5 ppm의 KNO3 용액 50 mL를 넣고 교반기를 이용하여 250 rpm으로 교반시켰다. 반응 시간에 따른 탈착율을 관찰하기 위하여 탈착 용액 주입 후 1 h, 6 h, 12 h, 24 h, 3 d, 7 d, 그리고 14 d에 시료를 원심 분리 후 상등액에서 용액을 0.1 mL 채취하여 2% 질산으로 100배 희석 후 세슘의 농도를 ICP-MS를 이용하여 측정하였다. 측정된 세슘의 농도를 통해 시간에 따른 영동 일라이트 및 풍화일라이트의 탈착율을 Eq. (1)을 이용하여 계산하였다.
3. 결과 및 고찰
3.1. 영동 일라이트 및 풍화일라이트 시료의 특성
영동 일라이트와 풍화일라이트의 광물학적 형태를 관찰하기 위하여 SEM 분석을 수행하였다.
광물 시료들을 50,000배 비율로 확대하여 보았을 때, Fig. 1의 영동 일라이트 및 풍화일라이트 모두에서 판형 구조의 집합체가 관찰되었다. 하지만 SEM 이미지를 통해서는 수 nm의 층간 간격 변화를 확인하기에는 한계가 있어, 풍화 정도를 표면상으로는 확인할 수 없었다.

Scanning electron microscopy images of YD illite and weathering illite for surface morphology analysis - (a) YD illite, x 50,000; (b) Weathering illite, x 50,000.
풍화 전후 고체 시료의 비표면적 변화를 관찰하기 위하여 BET 분석을 수행하였다.
광물 시료의 BET 분석결과 Table 1에서 볼 수 있듯이 풍화 과정 전후 크게 차이를 발견할 수 없었다. 영동 일라이트의 총 공극 부피 값이 0.019 cm3/g에 반해 풍화일라이트는 0.018 cm3/g로 큰 차이가 없었다. 마찬가지로, 평균 공극 직경은 영동 일라이트가 14.51 nm에서 풍화 후 13.68 nm로 약간의 감소를 보였으나 큰 차이가 없음을 확인할 수 있다. 공극의 변화는 주로 기계적(물리적) 풍화로 인해 발생하는 현상이며[25], 본 연구에서 진행한 화학적 풍화에서는 풍화 전후 일라이트의 공극은 큰 차이가 발생하지 않았다는 것을 확인할 수 있다.
따라서, 영동 일라이트와 풍화일라이트의 구성 광물을 확인하기 위해 XRD 분석을 실시하였다.
Fig. 2는 XRD 분석결과를 나타내며, 영동 일라이트와 풍화일라이트 모두 석영, 장석, 그리고 일라이트가 주요 광물로 동정되었다. 영동 일라이트와 풍화일라이트 모두 피크의 첨도와 강도가 높은 것을 보아 결정성이 뛰어나며 일라이트의 메인 피크(2θ=9.04, 17.90)와 같은 형상을 보인다. 일반적으로 영동 일라이트에 약간의 풍화가 진행될 경우, 층간에 존재하는 칼륨 이온이 강하게 결합되어 팽창되지 못하는 상황이 발생한다. 이때, 가장자리에 존재하는 칼륨 이온만 용출이 되어 닳은 모서리를 형성하게 된다. 하지만, 영동 일라이트가 강한 풍화 과정을 겪는 경우, 칼륨 이온이 용출되고 빠져나온 자리에 칼슘 이온이 자리하게 되면서 층간이 팽창된다[26,27]. 양이온은 수화 상태에서 이동성을 갖는데, 용액 내 수화된 세슘의 수화반경은 칼륨의 수화반경과 비슷하여 다른 양이온에 비해 쉽게 풍화된 모서리면에 진입할 수 있다. 세슘이 풍화된 모서리면에 진입하게 되면 기존의 비수화 상태로 존재하는 칼륨과 치환을 한다. 칼륨의 수화에너지는 세슘의 수화에너지에 비해 높으므로 칼륨은 세슘의 물분자를 빼앗아, 세슘은 비교적 안정한 비수화 상태로 풍화된 모서리면에 흡착하게 된다. 따라서 세슘은 일라이트의 풍 화된 모서리면에 비가역적으로 흡착하게 된다(Table 2) [7,28].
풍화일라이트의 풍화 정도를 보기 위하여 일라이트의 메인 피크(2θ=9.04, 17.90) 부근에서 피크의 형상을 확대하여 Fig. 3에 도시하였다.

Changes of peak intensity after artificial weathering - (I = Illite main peak, Q = Quartz main peak).
일라이트 메인 피크들은 풍화 전후 강도가 크게 변하였다. 영동 일라이트를 산처리 시 가장자리에서 컬링이 발생하여 풍화된 모서리면이 생성되는데, 이는 약간의 비정질 구조가 생성됨을 의미한다. 따라서 산처리 시 풍화가 일어나 XRD에서 일라이트 피크의 강도가 감소하게 된다(Table 2) [29,30].
이러한 XRD 결과를 뒷받침하기 위하여 TEM 분석을 실시하였다.
Fig. 4는 (a) 영동 일라이트, (b) 풍화일라이트의 투과 전자 현미경 분석 결과를 보여준다. 분석 결과, 주사 전자 현미경에서 분석하지 못한 수 나노미터 범위의 일라이트 구조를 확인할 수 있었다. 풍화 전 영동 일라이트의 층간 간격은 약 1.0 nm였으며 가장자리 또한 1.0 nm의 간격을 유지하였다. 풍화일라이트에서는 중간 부분과는 다른 형태로 가장자리 부분에서 휘어지는 현상이 나타났으며 가장자리의 층간 거리를 측정한 결과 약 1.4 nm로 증가한 것을 알 수 있다. 이는 고온산처리의 풍화 과정을 거치면서 일라이트의 가장자리에서 칼륨이온이 용출되고 칼슘이온이 들어가면서 층간 간격을 팽창시켜 풍화된 모서리면이 생성됨을 알 수 있다.
3.2. 세슘 흡착
영동 일라이트와 풍화일라이트의 산성 및 중성조건에서의 세슘 흡착 실험 결과, 시료의 인위적 풍화 여부에 따라 흡착율에 차이를 보였다. 산성 및 중성 조건에서의 세슘 흡착율을 Fig. 5에 도시하였다.

Changes of adsorption rate before and after artificial weathering under acid and neutral conditions.
산성 조건에서의 영동 일라이트와 풍화일라이트의 세슘 흡착율은 각각 약 55%와 66%로 전처리를 통해 제조된 풍화일라이트가 약 11% 높은 흡착율을 보였다. 또한 중성 조건에서는 두 일라이트의 흡착율은 각각 69%와 95%로 산성 조건에 비하여 큰 흡착율 차이를 보이는 것으로 나타났다.
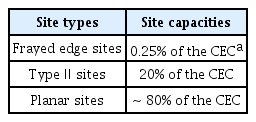
일라이트와 같은 점토광물의 흡착은 표면흡착과 층간 양이온과의 이온교환에 의한 흡착으로 나뉜다[31]. 일라이트 표면에는 세슘에 선택적 흡착을 하는 풍화된 모서리면(FES)과 세슘과 선택적 흡착을 하지 않는 표면 자리(planar site, PS), Type Ⅱ (intermediate sites) 자리가 존재한다[32-34]. 풍화된 모서리면은 세슘에 높은 친밀도와 낮은 수용성을 갖는 반면 Type Ⅱ는 낮은 친밀도와 높은 수용성을 갖는다[32].
Table 3은 일라이트의 흡착 지점과 차지하는 비율을 나타낸 표이며, 흡착 지점의 양은 표면 자리가 가장 많이 차지하며 풍화된 모서리면이 가장 적게 차지하는 것을 확인할 수 있다[32]. 본 실험에서의 저농도 세슘의 흡착 특성은 풍화된 모서리면에 기인한 것으로, 풍화된 모서리면의 양이 흡착지점에서 차지하는 비율이 낮기 때문에 세슘의 농도가 높아질수록 일라이트의 흡착율이 떨어지는 것도 이 때문이다[35,36]. 영동 일라이트와 비교하여 풍화일라이트는 고온산처리되는 과정에서 일라이트 층간 양이온의 용출로 인하여 층간 간격이 팽창되어 풍화된 모서리면의 양이 증가하였고, 풍화된 모서리면은 세슘을 선택적으로 잘 흡착하기에, 이러한 구조적 변화가 세슘 흡착율 증가의 주요 요인인 것으로 판단된다.
pH에 따른 일라이트의 세슘 흡착율의 경우, 중성일 때가 산성일 때보다 높은 흡착율을 보인다. 이는 일라이트는 특정 흡착지점마다 다른 세슘 흡착율을 보이며 특히 저농도 세슘의 주요 흡착지점인 풍화된 모서리면에서는 산성보다 중성에서 높은 흡착율을 보이기 때문이다[1,37,38]. 또한 일라이트의 PZC (Point of Zero Charge)는 3.9로[39], 높은 pH에서는 흡착제의 표면이 음전하를 띠고 있으며 세슘은 주로 양이온 형태로 존재하기 때문에 pH가 높아질수록 흡착제와의 반응성이 커진다. 또한 낮은 pH에서는 흡착제의 표면이 양전하를 띠고 있어, 세슘과의 반응성이 감소하게 된다. 따라서 고농도의 옥살산의 경우 강산으로 존재하기 때문에 일라이트의 세슘 흡착율은 감소하게 되며, 산성 조건보다 중성 조건에서 영동 일라이트 및 풍화일라이트의 세슘 흡착율은 증가하게 된다[40-42].
3.3. 세슘 탈착
초순수 증류수를 이용한 세척 횟수에 따른 물리적 탈착율은 Fig. 6에 도시하였다.
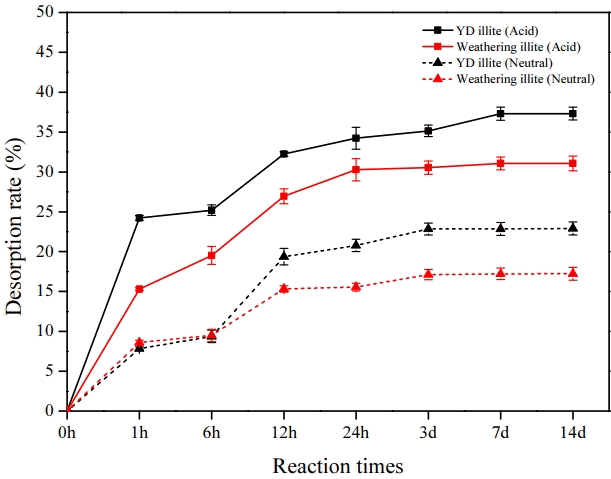
산성 및 중성 조건 모두 4번 세척 후 세슘의 농도가 측정되지 않았고, 이는 흡착제 표면에 묻어있는 세슘이 모두 물리적으로 탈착되었다고 판단된다. 침전된 시료는 건조 후 경쟁 이온인 칼륨을 이용한 화학적 탈착 실험을 진행하였다. 산성 조건에서의 영동 일라이트와 풍화일라이트의 화학적 탈착 실험 결과는 Fig. 7에 도시하였다.
시간이 지남에 따라 일라이트에서의 세슘의 탈착율이 증가하며, 7일 이후에는 영동 일라이트는 약 37%의 탈착율을, 풍화일라이트는 31%의 탈착율을 나타내며 평형에 도달하였다. 평형에 도달한 7일에서의 탈착율의 경우 풍화일라이트의 탈착율이 영동 일라이트의 탈착율보다 낮은 결과를 나타냈다. 풍화된 모서리면에 흡착된 세슘은 경쟁 이온인 칼륨의 수화에너지보다 작기 때문에 수화상태로 존재하는 칼륨으로부터 물분자를 빼앗을 수 없어 안정된 비수화상태로 존재하게 된다. 따라서 세슘은 일라이트의 풍화된 모서리면에 비가역적으로 흡착되며 이로 인해 풍화일라이트에서 세슘이 덜 탈착되었다고 판단된다[7,28].
중성 조건 또한 산성 조건에서와 같이 시간이 지남에 따라 세슘의 탈착율이 증가하였고, 중성 조건에서는 3일 이후 영동 일라이트는 약 23%의 탈착율을, 풍화일라이트는 17%의 탈착율을 나타내며 평형에 도달하였다. 중성조건에서 풍화일라이트의 낮은 세슘 탈착율은 산성 조건에서와 같이 풍화된 모서리면의 선택적 세슘 흡착의 영향에 기인한 것으로 판단된다[7,28]. 또한 중성 조건에서의 탈착율이 산성 조건보다 낮았으며 이는 일라이트는 높은 pH에서 표면 전하가 음전하를 띠게 되므로 양이온으로 존재하는 세슘과 반응성이 커져 탈착율이 감소하기 때문이다[41].
따라서 저농도의 세슘이 흡착된 일라이트는 칼륨 용액과 반응하였을 때 위 Fig. 7과 같이 탈착되며, 영동 일라이트를 고온산처리를 통해 인위적으로 풍화시키면 풍화된 모서리면의 증가로 인해 산성 및 중성 조건에서 영동 일라이트보다 탈착율이 낮아진다는 것을 확인할 수 있다.
4. 결 론
본 연구에서는 원자력발전소 운영 및 해체 시 발생하는 세슘으로 인해 오염된 원전 주변 토양을 산성 및 중성 세척 후 발생하는 2차 폐수에서의 세슘을 제거하기 위하여 영동 지역에서 채취한 영동 일라이트를 흡착제로 사용하였다. 일라이트는 풍화된 모서리면이라는 특이한 흡착 지점이 존재하여 저농도의 세슘을 선택적으로 잘 흡착한다. 이러한 흡착 지점을 증가시켜 영동 일라이트의 세슘 흡착율을 높이기 위하여 영동 일라이트를 고온산처리를 통하여 인위적으로 풍화시켰다. XRD 분석 결과, 고온산처리 후 일라이트의 피크의 강도가 크게 감소하였으며 이는 일라이트에 풍화가 발생하였음을 의미한다. 투과 전자 현미경 분석 결과, 풍화 전후 일라이트의 가장자리의 층간 간격이 1.0 nm에서 1.4 nm로 증가하였고 이를 통해 풍화된 모서리면의 생성을 입증할 수 있다. 이후 영동 일라이트와 풍화일라이트의 흡착 및 탈착 실험을 통하여 산성 및 중성조건에서의 흡착제의 특성을 비교 및 분석하였다. 풍화일라이트는 영동 일라이트보다 흡착율의 경우 산성 조건에서는 약 11%, 중성 조건에서는 약 26% 증가하였고, 탈착율의 경우 산성 및 중성 조건에서 모두 약 6% 감소하였다. 이는 고온산처리를 통해 영동 일라이트를 인위적으로 풍화시키면 흡착제로써의 일라이트의 성능을 개선시킬 수 있으며 이는 토양 세척 후 발생하는 2차 폐수에서의 방사성세슘 제거를 위한 효과적인 흡착제로 활용될 수 있음을 시사한다.
Acknowledgements
본 연구는 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 에너지기술개발사업의 지원을 받아 수행한 연구입니다(No. 20181510300800).