열분해 온도가 NaOH로 전처리된 소나무 톱밥 바이오차에 의한 Carbamazepine과 Ibuprofen 흡착에 미치는 영향
Effects of the Pyrolysis Temperature on Adsorption of Carbamazepine and Ibuprofen by NaOH Pre-treated Pine Sawdust Biochars
Article information
Abstract
목적
본 연구에서는 열분해 온도가 소나무 톱밥을 NaOH로 전처리하여 제조한 Biochar를 이용한 의약품(i.e., ibuprofen (IBF) and carbamazepine (CBZ)) 제거에 끼치는 영향에 대해서 평가하였다.
방법
본 연구에서는 600℃와 800℃에서 열분해한 Biochar들(PB-600, PB-800)에 의한 의약품의 제거 기작을 조사하기 위해 2가지 동역학 모델과 2가지 흡착 등온식 모델을 이용하였다. 또한, 다양한 조건들을 조절하면서(adsorbent doses: 5 - 40 mg/L; 20 - 160 mg/L; temperature: 15 - 45℃; ionic strength: 0 - 0.5 M) 변수들이 의약품 제거에 미치는 영향을 알아보았다.
결과 및 토의
PB-800은 PB-600에 비해 더 넓은 비표면적(PB-600 = 408.70 m2/g; PB-800 = 472.92 m2/g)과 공극부피(PB-600 = 0.336 cm3/g; PB-800 = 0.658 cm3/g), 공극크기(PB-600 = 4.63 nm; PB-800 = 6.25 nm)를 가졌기 때문에 CBZ과 IBF에 대해 더 높은 제거효율을 가지는 것으로 판단된다. 이를 통해, PB-600과 PB-800의 물리적 특성이 CBZ과 IBF의 제거에 대하여 크게 기여하는 것을 알 수 있었다. 등온흡착 실험의 결과, PB-600에 의한 IBF의 흡착은 단층 흡착의 특성을 가진 Langmuir 등온식이 더 적합하였고, PB-600에 의한 CBZ의 흡착과 PB-800에 의한 IBF과 CBZ의 흡착은 다층 흡착의 특성을 가진 Freundlich 등온식이 더 적합하였다. PB-600과 PB-800에 의한 CBZ의 흡착은 온도의 영향을 크게 받지 않는 것으로 나타났으나, IBF의 흡착은 온도가 증가하면 약한 상호 작용력이 발생하여 제거효율이 감소하였다. 이온강도가 PB-600과 PB-800에 의한 CBZ과 IBF의 제거에 끼치는 영향에 대하여, IBF의 흡착은 이온강도가 증가할수록 제거효율이 증가하는 것으로 나타났으나, CBZ의 흡착에는 영향을 상대적으로 적게 끼치는 것으로 나타났다.
결론
본 연구는 높은 열분해 온도가 Biochar에 의한 대상 의약품의 제거효율을 향상시킬 수 있다는 것을 입증하였다. 또한, 대상 의약품에 대한 Biochar들의 흡착 메커니즘은 비표면적, 공극부피와 공극크기에 의존하는 것으로 사료된다.
Trans Abstract
Objective
The main purpose of this study was to examine the impacts of the pyrolysis temperature on the removal of pharmaceuticals (i.e., ibuprofen (IBF) and carbamazepine (CBZ)) using NaOH pre-treated biochars produced from pine sawdusts.
Methods
Two different types of kinetic and isotherm models were applied to investigate the adsorption mechanisms of IBF and CBZ by the NaOH pre-treated biochars produced at 600℃ (PB-600) and 800℃ (PB-800). In addition, the removal efficiencies of IBF and CBZ by PB-600 and PB-800 were compared under various conditions (adsorbent doses: 5-40 mg/L; 20-160 mg/L; temperature: 15-45℃; ionic strength: 0-0.5 M) to assess their feasibility as an alternative adsorbent for the removal of pharmaceuticals.
Results and Discussion
PB-800 could more effectively remove CBZ and IBF than PB-600 because of its larger specific surface area (PB-600 = 408.70 m2/g; PB-800 = 472.92 m2/g), pore volume (PB-600 = 0.336 cm3/g; PB-800 = 0.658 cm3/g), and pore size (PB-600 = 4.63 nm; PB-800 = 6.25 nm). The Langmuir isotherm was more suitable for adsorption of IBF by PB-600 and the Freundlich isotherm was well fitted to the adsorption of CBZ by PB-600 and adsorption of CBZ and IBF by PB-800. The adsorption of CBZ by PB-600 and PB-800 was not affected by temperature while the removal efficiency of IBF was decreased with increasing the temperature due to the increased repulsive interaction between IBF and the biochars. Furthermore, the effects of the ionic strength on the adsorption of IBF were more pronounced than that of CBZ due to the differences in the surface charge properties.
Conclusions
The higher pyrolysis temperature can improve the physicochemical properties of the NaOH pre-treated pine sawdust biochars associated with the removal of the pharmaceuticals (i.e., CBZ and IBF). Moreover, the adsorption mechanisms of CBZ and IBF by the biochars were strongly influenced by their specific surface area, pore volume and pore size.
1. 서 론
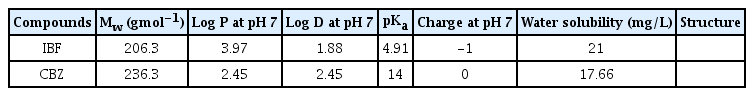
전 세계적으로 의약품은 인간 또는 동물들의 질병을 예방 및 치료하기 위하여 널리 사용되고 있다. 최근, 기대수명의 증가로 인하여 노년인구가 증가함에 따라 의약품의 소비도 크게 증가하면서, 일부 선진국의 경우 2017년 기준으로 0.1 - 1 mg/L의 의약품이 유출되는 것으로 보고되었다[1]. 의약품은 주로 생활하수, 축산폐수, 제약공장의 폐수를 통하여 수계로 유입되고 있으며, 매우 적은 농도(ng/L - µg/L)에서도 인간 및 수생 생물에게 부정적인 영향(내분비 교란, 기형아 유발)을 일으킬 수 있는 것으로 알려져 있다[2-6]. 또한, 지속적으로 병원성 세균에 노출될 경우 항생물질에 내성을 일으키는 등 다양한 문제를 일으키기 때문에 폐수 내에 존재하는 의약품 제거의 필요성이 대두되고 있다[7-12]. 이에 따라, 수계에서 발견되는 대표적인 의약품인 carbamazepine (CBZ)과 ibuprofen (IBF)를 제거하는 실험을 진행하였다[13].
현재 하폐수처리를 위해 널리 이용되고 있는 생물학적 처리 공정들은 유기물질 및 영양염류의 제거에는 효과적이지만, 일부 의약품에 대한 제거효율이 낮다는 단점이 있어 문제가 되고 있다[14]. 이에 따라, 이온 교환 공정, 분리막 공정, 산화 공정, 전기 화학적 공정과 같은 고도 수처리 기술들이 의약품 제거를 위해 하폐수처리에 적용되는 사례가 증가하고 있다[15-18]. 그러나, 이러한 고도 수처리 기술들은 건설비용 또는 운영비용이 높아 경제성이 낮다는 문제점들이 존재한다[19]. 이에 따라, 독성물질의 영향을 받지 않고, 운전, 유지 및 관리가 쉬운 흡착기술이 의약품 제거를 위한 수처리 공정으로 주목받고 있다[20]. 기존의 흡착공정에는 활성탄이 주로 이용되고 있는데, 활성탄을 이용한 흡착 공정은 유지 및 관리 비용이 매우 높아 실제 의약품 처리에 적용되기에는 제한적이다[21]. 따라서, 최근에는 의약품을 효과적으로 제거할 수 있는 저비용, 고효율 흡착제 개발에 대한 연구가 주목받고 있다.
최근 Biomass 폐기물을 재활용하여 저비용으로 제조할 수 있는 Biochar는 넓은 비표면적, 다공성, 물리・화학적 특성으로 인해 친환경적인 흡착제로서 부각되고 있다[22,23]. 또한, Biochar는 토양 비옥도를 향상시키고, 대기의 이산화탄소 격리를 촉진하여 기후변화 현상을 저감할 수 있으며, 토양의 포함된 중금속의 안정화에 효과적인 것으로 알려져 있다[24-26]. 이에 따라, Biochar를 이용하여 토양을 안정화시키고, 기후변화를 저감하기 위한 연구들이 활발히 수행되고 있다. 다양한 Biomass 중에서, 소나무 폐기물의 경우 스웨덴과 핀란드 같은 북유럽 국가에서 목재가공 과정을 통해 매년 10,000,000 m3 발생하고 있다고 보고되었다[27,28]. 또한, 소나무는 국내의 주요 산림자원 중 하나로써 하루에 5000 ton의 목재 폐기물이 발생하는 것으로 알려져 있다[27,28]. 소나무 폐기물은 일반적으로 소각을 통해 처리하고 있지만, 이러한 경우 이산화탄소와 같은 온실가스 배출을 통해 2차 오염을 일으킬 수 있어 문제가 되고 있다[27,28]. 이에 따라 본 연구에서는 다양한 국가의 목재 폐기물에서 주성분인 소나무의 톱밥으로 제조한 Biochar를 이용하여 실험을 진행하였다[27,28].
본 연구에서는 Biochar의 열분해 온도에 따른 의약품들의 흡착효율을 비교하였다. 500℃에서 제조할 경우 다량의 타르가 발생하여 500℃ 이상의 온도(600℃, 800℃)에서 제조한 Biochar를 이용해 투여량과 온도 및 이온강도와 같은 조건들이 의약품 흡착에 미치는 영향을 평가하였고, 흡착 동역학과 등온흡착 실험들을 통하여 소나무 톱밥으로 제조한 Biochar에 의한 CBZ 및 IBF의 흡착 메커니즘을 조사하였다.
2. 재료 및 방법
2.1. 의약품 표준용액 제조
CBZ과 IBF (Sigma-Aldrich,St. Louis, MO, USA)는 비극성 물질이기 때문에 비극성 용매인 에탄올 20 mL에 각각 20 mg씩 넣고 교반을 통해 약품을 녹인 후, 증류수 180 mL를 추가하여 농도가 100 mg/L인 CBZ과 IBF Stock solution (volume of each stock solution = 200 mL)을 제조하였다. 제조한 Stock solution들은 흡착실험 전에 필요한 농도(0.5 - 7 mg/L)를 맞추기 위하여 증류수로 희석하여 사용하였다. CBZ과 IBF의 특성들은 Table 1에 나타내었다.
2.2. Biochar 제조
직사광선이 없는 곳에서 건조된 소나무 톱밥(나무애, Incheon, Gyeonggi-do, Republic of Korea)은 Deionized (DI) water를 이용하여 수차례 세척한 후 24 h 동안 105℃에서 오븐에 건조하였다. NaOH는 더 뛰어난 다공성을 갖도록 활성화시킬 수 있기 때문에 건조된 소나무 톱밥 3 g당 4 M NaOH(대정화금, Siheung, Gyeonggi-do, Republic of Korea) 40 mL의 비율로 혼합하여 상온에서 4 h 동안 교반한 후 일주일 동안 105℃에서 오븐에 건조하였다[29]. 전처리한 소나무 톱밥은 Tubular furnace (PyroTech, Namyangju, Gyeonggi-do, Republic of Korea)를 이용해 무산소 조건(atmospheric gas = N2 (Purity ≥ 99%); Flow rate = 0.2 L/min)에서 온도에 따라 NaOH가 비표면적을 증가시키는 것을 보기 위해 각기 다른 온도(600℃, 800℃)까지 10℃/min의 승온속도로 2 h 동안 열분해하고 상온까지 방냉하였다[30]. 제조된 Biochar들에 남아있는 불순물을 제거하기 위해 DI water로 pH가 7이 될 때까지 수차례 세척하였고, 4 h 동안 110℃에서 오븐에서 건조되었다. 위의 과정을 거친 소나무 톱밥 Biochar들은 열분해 온도에 따라 각각 PB-600과 PB-800으로 명명하여 사용하였다.
2.3. Biochar 특성분석
PB-600과 PB-800의 표면특성은 Brunauer Emmett Teller (BET) analyzer (BELSORP-mini II, Microtrac BEL, Osaka, Japan)를 이용해 분석되었다. 비표면적과 총 공극직경은 BET 방정식을 이용하여 계산되었고, 총 공극부피는 Barrett-Joyner-Halenda 방법을 이용하여 계산하였다. PB-600과 PB-800의 원소함량은 Elemental analyzer (EuroEA3000 CHNS-O, EuroVector S.p.A, Via Tortona, Milan, Italy)를 사용해 분석되었다. 회분 함량은 흡착제의 전체 질량 분율에서 탄소(C), 수소(H), 산소(O)와 질소(N)의 함량을 뺌으로써 계산되었다. 원소분석을 통해 얻은 결과를 기초로 하여, H/C, O/C와 N/C는 ratio를 산출해 방향성 및 극성을 유추하였다.
2.4. 흡착 실험
2.4.1. 최적 투여량
각 의약품(CBZ과 IBF)에 대한 흡착제의 최적 투여량을 알아보기 위하여 삼각 플라스크에 각각 초기 의약품 농도를 1 mg/L로 하고, 의약품 용액 25 mL를 분취한 삼각플라스크에 흡착제의 양(PB-600: 20 - 160 mg/L; PB-800: 5 - 40 mg/L)을 조절하여 투여한 후 24 h 동안 Shaking Incubator (VS-8480, Vision Scientific, Daejeon-Si, Republic of Korea)를 이용해 25℃ 조건에서 150 rpm으로 교반하였다.
2.4.2. 동역학 실험
흡착 반응속도 실험을 위해 초기 의약품 농도를 1 mg/L로 하고, 의약품 용액 25 mL를 분취한 삼각플라스크에 각 흡착제의 최적 투여량을 넣고, 일정시간(0.5 - 24 h) 동안 Shaking Incubator를 이용해 25℃ 조건에서 150 rpm으로 교반하였다. 흡착실험 완료 후, 용액으로부터 흡착제를 제거하기 위해 0.7 µm의 공극을 가지는 Glass fiber Filter (GF/F, Whatman, Maidstone, UK)를 이용하여 여과하였고 UV-Vis Spectrophotometer (UV-1280, Shimadzu, Kyoto, Japan)를 이용하여 CBZ과 IBF을 각각 210 nm, 200 nm에서 흡광도를 측정하였다. 모든 실험은 오차를 최소화하기 위해 세 번씩 수행되었다. 이 때, 흡착제 질량 단위당 흡착된 각 의약품의 양, qt (mg/g)은 다음 식 (1)을 통해 계산되었다.
여기서, V는 용액의 부피(L)이며, C0와 C는 용액의 초기 및 최종 의약품 농도(mg/L), m은 사용된 흡착제의 질량(g)이다. 또한 각각의 의약품 제거율은 다음의 식 (2)와 (3)을 통해 계산하였다.
여기서, V는 용액의 부피(L)이고, C0와 Ce는 용액의 초기 및 평형에서의 의약품 농도(mg/L)이다.
Biochar들에 의한 CBZ과 IBF의 역학적 특성과 흡착능력은 다음의 두개의 방정식을 이용하여 조사하였다[31].
여기서, qe는 평형일 때의 흡착능이다. k1 (L/min)은 유사 1차 방정식의 상수이고, k2 (g/mg・min)는 유사 2차 방정식의 상수이다.
2.4.3. 등온흡착 실험
제조된 Biochar들에 의한 약품의 등온흡착 특성을 알아보기 위하여 CBZ과 IBF의 농도(0.5 - 7 mg/L)를 조절하고 흡착제의 최적 투여량을 주입하여 흡착 실험을 수행하였다. 흡착 평형에 도달하기 위해 24 h 동안 Shaking Incubator를 이용해 25℃에서 150 rpm으로 교반하였다. 흡착 실험결과는 Langmuir Isotherm 모델(흡착이 균질한 흡착 Sites에서 발생)과 Freundlich Isotherm 모델(흡착이 비균질한 흡착 Sites에서 발생)을 이용하여 분석하였다[32-34].
여기서, Ce는 평형에서의 의약품 농도(mg/L), Qe는 평형일 때의 흡착능(mg/g)이다. Qmax (mg/g)는 Langmuir Isotherm 모델에서의 최대 흡착능이고, KL (dm3/mg)은 선형화를 통해 결정할 수 있는 Langmuir 방정식의 평형 상수이다. Langmuir 등 온선의 흡착 선호도를 비교하기 위해 KL에서 도출해낸 RL=1/(1+KLC0)을 이용할 수 있으며, 이 식의 C0는 가장 높은 초기 의약품 농도이다.
여기서, KF는 Freundlich 흡착 상수이고, n은 흡착 강도를 나타내는 경험적 매개변수이다. 방정식을 선형화하여 KF와 n 매개변수를 계산할 수 있다.
2.4.4. 온도와 이온강도의 영향
온도와 이온강도가 Biochar들에 의한 의약품 흡착량 변화에 미치는 영향을 알아보기 위하여 다양한 온도(15 - 45℃) 및 이온강도(0 - 0.5 M) 조건에서 흡착실험을 수행하였다. 이온강도 실험은 NaCl(대정화금, Siheung-si, Gyeonggi-do, Korea)을 이용하여 실험하였다. 초기 의약품 농도가 각각 1 mg/L인 의약품 용액 25 mL를 삼각 플라스크에 분취한 후 최적 흡착제 투여량을 첨가하여 수행하였다(agitation time = 12 h, agitation speed = 150 rpm). 흡착실험 완료 후, 위와 동일한 방법으로 흡착제를 용액으로부터 제거하고, 잔류 의약품 농도를 측정하였다(Section 2.4.2).
3. 결과 및 고찰
3.1. 흡착제의 특성분석
Table 2는 PB-600과 PB-800의 원소성분 함량과 표면 특성 분석결과를 나타내고 있다. PB-600과 PB-800의 탄소와 Ash의 함량(C content of PB-600 = 78%; C content of PB-800 = 75%; Ash content of PB-600 = 19%; Ash content of PB-800 = 24%)은 비슷한 것으로 나타났다. 이는 더 높은 열분해 온도에서 Biochar를 제조할 경우, 생산량이 감소되고 회분 함량이 증가되기 때문으로 사료된다[35]. 그러나 수소함량의 경우 PB-600이 PB-800보다 약간 높은 값(H content of PB-600 = 2%; H content of PB-800 = N.D.)을 가지고 있었다. 이는 열분해 온도가 높아질수록 Biochar 내에 존재하는 수소의 결합이 단절되기 때문이다[36]. PB-600과 PB-800의 극성(O/C + N/C)과 방향성(H/C)의 경우 PB-600의 수소함량을 제외하고 관측되지 않았기 때문에 유추하기 어려웠다[13]. 표면특성 분석결과, PB-800이 PB-600보다 비표면적(PB-600 = 408.70 m2/g, PB-800 = 472.92 m2/g)이 넓고, 총 공극부피(PB-600 = 0.336 cm3/g, PB-800 = 0.658 cm3/g)가 큰 것을 확인할 수 있었다. 일반적으로 Biochar에 의한 의약품 흡착은 비표면적 크기에 의해 최대 흡착능이 결정되기 때문에 비표면적 및 공극크기가 상대적으로 큰 PB-800이 PB-600보다 의약품 제거에 더 효과적이라는 것으로 판단된다[37].
3.2. 투여량의 영향
PB-600과 PB-800의 투여량 변화에 따른 CBZ과 IBF의 제거효율 변화를 Fig. 1에 나타내었다. PB-600과 PB-800의 투여량이 증가함에 따라 CBZ과 IBF의 제거효율 또한 높아지는 것으로 나타났다. 이러한 결과는 투여량이 증가할수록 의약품을 흡착할 수 있는 Biochar의 표면 활성부위가 많아져서 의약품의 흡착이 촉진되기 때문으로 사료된다[38-40]. 평형상태를 기준으로, PB-800은 PB-600보다 더 많은 CBZ(removal efficiency of PB-600 = 71%; removal efficiency of PB-800 = 93%)과 IBF(removal efficiency of PB-600 = 66%; removal efficiency of PB-800 = 87%)를 흡착할 수 있었는데, 이는 높은 열분해 온도가 Biochar의 비표면적을 증가키시고, 큰 공극부피의 형성을 유도했기 때문으로 사료된다. 그러나, 일정 투여량 이상 Biochar가 투여될 경우 활성부위의 간섭작용으로 인하여 의약품의 제거효율은 크게 증가하지 않았다[38-40]. PB-600에 의한 CBZ의 제거는 흡착제 투여량 80 mg/L에서, IBF의 경우 120 mg/L에서 평형상태에 도달하였고, PB-800에 의한 CBZ과 IBF의 제거는 모두 흡착제 투여량 20 mg/L에서 평형상태에 도달하였다. 이에 따라, 평형상태의 투여량을 최적 투여량으로 하여 이후의 흡착실험에 적용하였다.
3.3. 동역학 실험
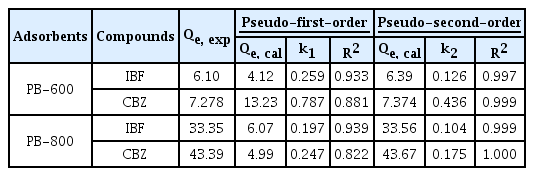
Fig. 2은 PB-600과 PB-800에 의한 CBZ과 IBF의 동역학적 흡착 경향을 나타내고 있다. 두 의약품 모두 초기에 빠르게 흡착이 진행되었으나, 일정 시간 경과 후(CBZ ≤ 3 h ; IBF ≤ 12 h)에는 표면 활성부위의 포화됨에 따라 흡착이 느리게 진행되어 12 h이 지났을 때 모두 평형에 도달하였다. 등온흡착 모델의 속도상수와 상관계수를 계산한 결과값은 Table 3에 제시되었다. PB-600과 PB-800에 의한 CBZ과 IBF의 흡착은 유사 1차 모델(R2 of CBZ by PB-600 = 0.881; R2 of CBZ by PB-800 = 0.822; R2 of IBF by PB-600 = 0.933; R2 of IBF by PB-800 = 0.939)보다 유사 2차 모델(R2 of CBZ by PB-600 = 0.999; R2 of CBZ by PB-800 = 1.000; R2 of IBF by PB-600 = 0.997; R2 of IBF by PB-800 = 0.999)에 적합하였다. 이에 따라, PB-600과 PB-800에 의한 CBZ과 IBF의 흡착은 화학적 흡착(i.e., 전자의 교환 또는 공유)에 기인한 것으로 판단된다[30]. 또한, PB-600에 의한 CBZ (Qe, cal = 7.374 mg/g)와 IBF (Qe, cal = 6.39 mg/g)의 평형 흡착능보다 PB-800의 의한 CBZ (Qe, cal = 43.67 mg/g)와 IBF (Qe, cal = 33.56 mg/g)의 평형 흡착능이 높은데, 이는 PB-800이 대상 의약품의 흡착에 더 효과적이라는 것을 나타낸다.

The adsorption kinetics of CBZ and IBF onto the (a) PB-600 (adsorbent dose = 120 mg/L) and (b) PB-800 (adsorbent dose = 20 mg/L) (C0 = 1 mg/L; agitation speed = 150 rpm; pH = 7; temperature = 25℃).
3.4. 등온흡착실험
Table 4는 PB-600과 PB-800에 의한 CBZ과 IBF의 등온흡착 특성 분석결과를 보여주고 있다. PB-600에 의한 IBF의 흡착은 다층 흡착의 특성을 가진 Freundlich 등온식(R2 of IBF by PB-600 = 0.897)보다 단층 흡착의 특성을 가진 Langmuir (R2 of IBF by PB-600 = 0.951)에 적합하였다. PB-600에 의한 CBZ의 흡착, PB-800에 의한 CBZ 및 IBF의 흡착은 Langmuir에 의한 단층 흡착(R2 of CBZ by PB-600 = 0.964; R2 of IBF by PB-800 = 0.755; R2 of CBZ by PB-800 = 0.975)보다 Freundlich에 의한 다중 흡착 특성(R2 of CBZ by PB-600 = 0.993; R2 of IBF by PB-800 = 0.969; R2 of CBZ by PB-800 = 0.995)을 따르는 것으로 나타났다. Freundlich 등온식에서 n > 1일 때 흡착제가 대상물질에 대하여 선호적임을 의미하는데, PB-600에 의한 CBZ의 흡착, PB-800에 의한 CBZ 및 IBF의 흡착은 n > 1으로(n of CBZ by PB-600 = 2.132; n of IBF by PB-800 = 1.791; n of CBZ by PB-800 = 2.467) 다층 흡착에 선호적임을 알 수 있었다[34].
Langmuir 등온식을 따르는 단층 흡착의 경우 RL > 1이면 비선호적, 0 < RL < 1이면 선호적, RL = 0이면 비가역적으로 정의되는데, PB-600에 의한 IBF의 흡착은 0 < RL < 1이므로(RL of IBF by PB-600 = 0.101) 단층 흡착에 선호적인 것으로 사료된다 [41]. 그리고, PB-600에 비하여 높은 PB-800에 의한 IBF과 CBZ의 최대흡착능(Qmax of IBF by PB-800 = 200.00 mg/g; Qmax of IBF by PB-600 = 13.76 mg/g; Qmax of CBZ by PB-800 = 161.29 mg/g; Qmax of CBZ by PB-600 = 26.81 mg/g)은 PB-800이 PB-600보다 의약품 흡착에 더 효과적이라는 것을 나타내고 있다.
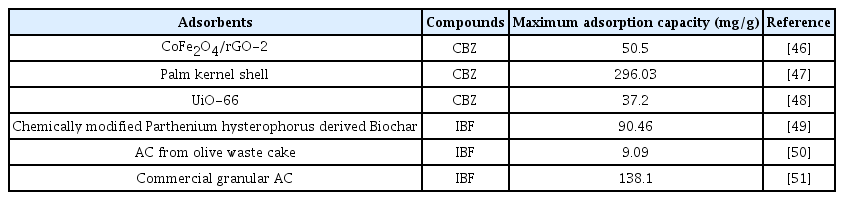
PB-600과 PB-800에 의한 CBZ과 IBF의 최대흡착능을 비교하였을 때, CBZ의 최대흡착능이 IBF의 최대흡착능보다 높은 것을 알 수 있다. 이는 CBZ의 Log D 값이 IBF의 Log D 값(Log D of CBZ = 2.45; Log D of IBF = 1.88)보다 높아 CBZ의 소수성이 더 높은 것을 유추할 수 있고, 이에 따라 소수성을 띄는 Biochar와 더 많은 상호작용이 일어난 것으로 사료된다[42]. Table 5는 CBZ과 IBF에 대한 다른 흡착제의 최대흡착능을 보여주고 있다. CBZ에 대한 흡착의 경우 CoFe2O4/rGO-2(50.50 mg/g)와 UiO-66(37.20 mg/g)는 PB-600보다 더 뛰어난 최대흡착능을 보여주었지만 PB-800보다는 매우 낮은 수치를 보여주었다. 이에 반해 Palm kernel shell (296.03 mg/g)의 경우 PB-600과 PB-800보다 더 높은 최대흡착능을 보여주었다. IBF에 대한 흡착의 경우, AC from olive waste cake (9.09 mg/g)같은 경우 PB-600과 PB-800보다 낮은 최대흡착능을 보여주었고, Chemically modified Parthenium hysterophorus derived Biochar (90.46 mg/g)와 Commercial granular AC (138.1 mg/g)는 PB-600보다는 높지만 PB-800보다는 낮은 최대흡착능을 보여주었다.
3.5. 온도의 영향
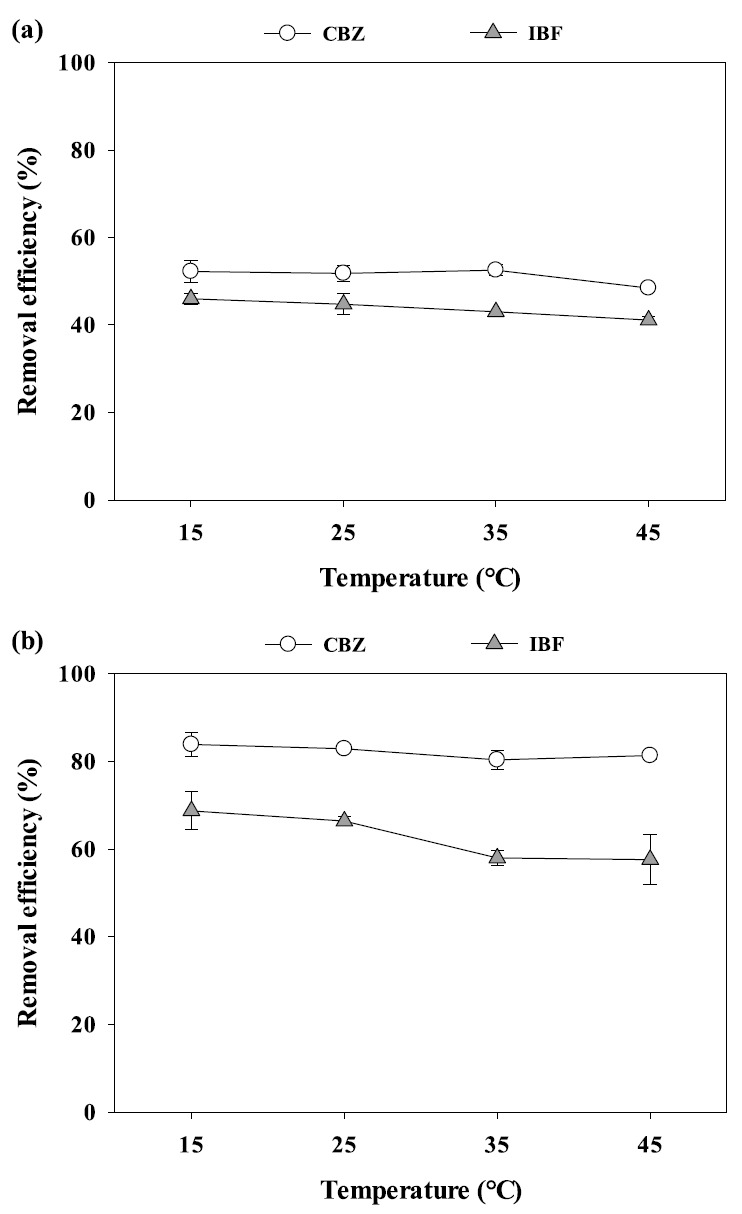
온도변화가 PB-600과 PB-800에 의한 CBZ과 IBF 흡착에 미치는 영향을 알아보기 위하여 4가지 다른 온도조건(15 - 45℃)에서 수행한 흡착실험 결과를 Fig. 3에 나타내었다. PB-600과 PB-800에 의한 CBZ의 흡착은 온도의 변화에 크게 영향을 받지 않는 것으로 확인되었다(removal efficiency of CBZ by PB-600 = 52% at 15℃, 48% at 45℃; removal efficiency of CBZ by PB-800 = 84% at 15℃, 81% at 45℃). 반면, PB-600과 PB-800에 의한 IBF의 제거효율 (removal efficiency of IBF by PB-600 = 46% at 15℃, 41% at 45℃; removal efficiency of IBF by PB-800 = 69% at 15℃, 58% at 45℃)은 온도가 증가함에 따라 감소하였는데, 이는 온도가 증가하면 약한 상호 작용력 (van der Waal force 및 수소 결합)이 발생하여 흡착효율을 감소시키기 때문으로 판단된다[40,43].
3.6. 이온강도의 영향
이온강도가 PB-600과 PB-800에 의한 CBZ 및 IBF 흡착에 미치는 영향은 Fig. 4에 나타내었다. PB-600과 PB-800에 의한 CBZ (removal by PB-600 = 60% at 0 M; 75% at 0.5 M; removal by PB-800 = 85% at 0 M; 95% at 0.5 M)과 IBF (removal by PB-600 = 29% at 0 M; 71% at 0.5 M; removal by PB-800 = 65% at 0 M; 91% at 0.5 M)의 제거효율은 이온강도가 증가함에 따라 증가하는 것으로 나타났는데, CBZ의 경우 IBF에 비해 이온강도의 영향을 적게 받는 것으로 확인되었다. 이러한 결과는 CBZ이 중성 pH에서 이온화 되지 않은 상태로 존재하기 때문에 Salting-in effect 에 영향을 적게 받았기 때문으로 사료된다[44]. IBF 흡착의 경우, 이온강도가 증가하면 흡착제 표면의 전기이중층이 조밀화 또는 압축되면서 탄소계 흡착제에 의한 음이온성 화합물의 흡착이 향상될 수 있는 스크리닝 효과에 의해 이온강도의 영향을 크게 받는 것으로 판단된다[45].
4. 결론
본 연구는 높은 열분해 온도가 Biochar들에 의한 대상 의약품의 제거효율을 향상시킬 수 있다는 것을 입증하였다. 또한, 대상 의약품에 대한 Biochar들의 흡착 메커니즘은 비표면적, 공극부피와 공극크기에 의존하는 것으로 사료되며, CBZ이 IBF보다 Log D 값이 높아 소수성이 더 높은 것을 유추할 수 있고, 따라서 Biochar와 더 많은 상호작용이 일어난 것으로 판단된다. 본 연구의 주요 결론은 다음과 같다:
1) 원소분석 및 BET 분석결과 PB-800이 PB-600에 비해 탄소함량은 적으나, 더 우수한 비표면적, 공극부피 및 공극크기를 갖는 것으로 나타났다.
2) PB-600과 PB-800에 의한 IBF과 CBZ 흡착은 유사 2차 모델을 따르는 것으로 보아 의약품 분자와 Biochar 사이의 흡착이 전자의 공유 또는 교환에 의한 것으로 판단된다.
3) PB-600에 의한 IBF의 흡착은 Langmuir 등온식을 따르는 단층 흡착에 적합하였고, PB-600에 의한 CBZ의 흡착, PB-800에 의한 IBF과 CBZ 흡착은 Freundlich 등온식을 따르는 다층 흡착이 적합하였다. 그리고 다른 흡착제와 비교하였을 때, PB-600의 경우 최대흡착능이 매우 낮지만, PB-800의 경우 다른 흡착제와 비슷하거나 오히려 뛰어난 모습을 보였다.
4) PB-600과 PB-800에 의한 IBF의 흡착은 온도가 증가함에 따라 약한 상호 작용력이 발생하여 제거효율이 감소하였고, 이와 반대로 CBZ의 흡착의 경우 온도의 영향을 받지 않는 것으로 나타났다.
5) PB-600과 PB-800에 의한 IBF과 CBZ의 흡착은 이온강도가 증가함에 따라 모두 증가하였지만, CBZ의 경우 비이온화 상태이므로 IBF에 비해 이온강도에 대한 영향을 적게 받는 것을 알 수 있었다.
Acknowledgements
본 연구는 한국연구재단의 이공학 개인기초연구 연구지원사업(NRF-2018R1D1A1B07044718)과 강원대학교 공동실험실습관의 지원을 받아 수행되었습니다.