불소 제거를 위한 소성 굴폐각의 흡착 특성
Adsorption Characteristics of Calcined Oyster Shell for the Removal of Fluoride
Article information
Abstract
목적
암석을 통한 자연적인 불소 유입과 산업 활동을 통한 인위적인 불소 유입으로 인하여 지하수가 오염된다. 우리나라에서 굴폐각은 폐기물로 지정되어 있어 6개월 이상 보관하지 못하기 때문에 이를 비료로 만들어 농가에 공급하였지만 농가에서 악취와 염분으로 인해 사용하지 않으면서 더욱 처리가 어려운 상황이다. 본 연구에서는 굴폐각을 열처리하여 불소를 흡착시켜 제거하는 실험을 수행하였고 소성 굴폐각에 대한 불소 흡착 특성을 규명하였다.
방법
굴폐각을 100-900℃의 조건으로 열처리하여 가장 높은 불소 흡착량을 띄는 700℃ (OS700)을 이용하여 동역학적 흡착 실험, 평형 흡착 실험, 열역학적 흡착 실험, 불소 용액의 pH에 따른 흡착 실험, 불소 용액에 존재하는 다른 이온의 농도에 따른 흡착 실험, OS700의 주입량에 따른 불소 흡착 실험을 수행하였다.
결과 및 토의
OS700과 불소 용액 300 mg/L이 1시간 만에 평형에 도달하는 것을 볼 수 있다. 평형 흡착 실험에서 OS700의 불소 흡착은 Freundlich 모델보다 Langmuir 모델이 더 적합한 것으로 나타났고, 이는 불소가 OS700에 단층 흡착을 이룬다는 것을 알 수 있다. 열역학적 흡착 실험을 통하여 OS700의 불소 흡착은 흡열반응이며 비자발적으로 일어나는 것을 알 수 있다. 불소 용액의 pH에 따른 OS700의 흡착량은 pH가 3에서 11로 증가함에 따라 감소하는 것으로 나타났다. 다른 이온의 존재에 따른 OS700의 불소 흡착에 대한 영향은 CO32-와 PO43-의 존재에서는 불소의 흡착을 감소시켰지만 Cl-의 존재에서는 불소의 흡착에 영향을 미치지 않는 것으로 나타났다. OS700의 주입량에 따른 불소의 제거율은 증가하였지만 OS700의 단위질량당 불소 제거량은 감소하였다.
결론
본 연구를 통하여 소성 굴폐각의 불소 흡착 특성을 분석하였고, 소성 굴폐각은 수중의 불소를 제거하기 위하여 효과적이고 환경친화적인 흡착제로 사용될 것으로 판단된다.
Trans Abstract
Objectives
Groundwater is contaminated with fluoride by industrial activities. In Korea, oyster shell is considered as a waste and cannot be stored for more than 6 months, and it was made as a fertilizer and supplied to farms. But it cannot be used in farms because of odors and salinity. In this study, an experiment was performed to remove fluoride using calcined oyster shell and the characterization of fluoride adsorption on calcined oyster shell was investigated.
Methods
The oyster shell was calcined to enhance its adsorption capacity for fluoride and the temperature of thermal treatment on oyster shell ranges from 100℃ to 900℃. Kinetic adsorption test, equilibrium adsorption test, thermodynamic adsorption test, adsorption experiment according to pH of fluoride solution, adsorption experiment in the presence of competitive ions in fluoride solution, and adsorption experiment under different dose of adsorbents were performed using oyster shell thermally treated at 700℃ (OS700).
Results and Discussion
Oyster shell thermally treated at 700℃ was found to have the highest fluoride removal. Equilibrium for fluoride adsorption onto OS700 was achieved within 1 h at a fluoride concentration of 300 mg/L. Equilibrium experiments showed that fluoride adsorption onto OS700 was better fitted by Langmuir model than the Freundlich model, inferring that fluoride adsorbs onto OS700 as a mono-layer. Thermodynamic experiments showed that fluoride adsorption onto OS700 is endothermic and non-spontaneous. The increase of pH from 3 to 11 decreased the amount of fluoride adsorption onto OS700 from 86.4 mg/g to 68.5 mg/g. The presence of both CO32- and PO43- decreased the fluoride adsorption onto OS700, but the influence of Cl- concentration on fluoride adsorption was insignificant. Although the fluoride removal percentage increased with the increase of dose amount of OS700, the amount of fluoride adsorption on unit mass of OS700 decreased.
Conclusions
In this study, the fluoride adsorption characteristics of the OS700 were analyzed. OS700 is expected to be used as an effective and environmentally friendly adsorbent to remove fluoride in water.
1. 서 론
불소(F, fluorine)가 많이 함유되어 있는 암석에서 천천히 용해되어 지하수로 방출되는 자연적인 활동과 반도체 제조, 석탄 발전소, 전기 도금과 같은 산업 활동을 통하여 지하수로 방출되는 인위적인 활동으로 인하여 고농도의 불소가 지하수를 오염시킨다[1]. 이와 같은 산업활동에 의해 배출되는 폐수에는 불소의 농도가 수십에서 수천 mg/L에 이른다[2]. 특히 미국, 아프리카, 아시아에서는 지하수에 불소의 농도가 최대 30 mg/L 이상으로 존재하기도 한다[3]. 수중의 불소가 0.1-1.0 mg/L의 농도로 존재할 경우 치아우식증을 예방하여 수돗물과 치약에 활용되고 있다. 그러나, 수중의 불소가 1.5 mg/L의 농도로 존재할 경우 불소침착증을 유발하여 골격이나 치아에 부정적인 영향을 미치기 때문에 세계보건기구(World Health Organization)에서는 먹는 물의 불소허용기준에 대하여 1.5 mg/L 이하로 규정하였다[4]. 수중에서 불소의 농도가 10 mg/L 이상일 경우 신체기능에 심각한 손상을 일으키는 불소침착증을 유발한다[2]. 국내에서는 불소허용기준 중에서 수돗물은 1.5 mg/L 이하, 샘물 및 먹는 샘물은 2.0 mg/L 이하로 수질 기준에 대한 규정(환경부령 제122호, 2002.6.21.)을 제정하였다.
지하수에 함유된 불소를 제거하기 위한 방법으로 막 공정, 이온교환, 흡착 및 응집/침전이 있다[5]. 불소를 제거하기 위하여 널리 사용되는 응집/침전은 불소가 저농도에 도달하게 하는 것이 불가능하며 많은 양의 침전제를 사용하여 엄청난 양의 슬러지가 발생된다는 단점이 있다[6]. 흡착은 다른 제거 기술보다 적은 비용을 요구하고 적은 에너지를 필요로 하며 기술의 유지와 관리가 쉽다는 장점이 있다[7]. 불소를 흡착으로 제거하기 위해 사용된 흡착제로는 폐콘크리트, 아타풀자이트, 돌로마이트 등이 있다[8-10].
굴폐각은 우리나라 통영의 굴 양식장에서 한해 30만톤의 굴이 수확되며 15만톤의 굴폐각이 처리하기 곤란한 상황이다. 굴폐각을 건조시켜 고운 가루로 갈아서 비료로 만들어 농가에 무료로 공급하여 사용하게 했지만 굴폐각의 냄새로 인한 불편함과 염분으로 인하여 식물이 자라지 않아 농가에서도 사용하지 않게 되었다. 굴폐각은 폐기물로 지정되어 있어 6개월 이상 보관할 수 없어 더욱더 심각한 상황이다(2019.11.15.일자 KNN뉴스). 최근 굴폐각을 이용한 불소 제거에 대한 연구는 일부 진행되었지만[11-13], 굴폐각을 소성시켜 불소 제거에 대한 연구는 수행되지 않았다. 탄산칼슘이 주성분인 굴폐각은 770℃에서 열처리를 하면 주성분인 탄산칼슘이 산화칼슘으로 열분해 되어 오염물질에 대한 반응성이 높아진다고 보고되었다[14].
따라서 본 연구에서는 수중의 불소 제거를 위하여 소성 굴폐각을 활용하였으며, 실험을 통하여 적용성을 평가하였다. 반응 시간, 용액의 농도, 반응 온도, 용액의 pH, 다른 이온과의 경쟁, 소성 굴폐각의 주입량에 따른 여러 변수에 대하여 불소 흡착 능력을 평가하였다. 실험을 통해 얻은 결과는 동역학적 모델, 평형 모델 그리고 열역학적 모델을 이용하여 소성 굴폐각에 대한 불소 흡착 특성을 분석하였다.
2. 재료 및 방법
2.1. 실험 재료
실험에 사용되는 굴폐각은 경남 통영의 양식장에서 공급받았으며, 굴폐각의 흡착 특성 평가를 위하여 굴폐각의 열처리 과정을 수행하였다. 소성 굴폐각은 증류수를 이용하여 세척한 다음 105℃에서 건조하였다. 균일한 입경의 흡착제를 얻기 위하여 425 µm ~ 850 µm 크기의 표준체로 체거름 하였다. 소성 굴폐각은 관형 전기로(CRFT 830S, Dongseo Science Co. Ltd, Korea)를 사용하여 설정된 온도 조건에서 질소가스를 이용하여 반응기 내부를 무산소 조건으로 만든 후 열처리를 수행하였다.
2.2. 흡착 실험
0℃, 100℃, 300℃, 500℃, 700℃, 800℃, 900℃(NT, OS100, OS300, OS500, OS700, OS800, OS900)에서 열처리된 소성 굴폐각의 불소 흡착량을 알아보기 위하여 소성 굴폐각 0.3 g과 불화나트륨(NaF, Sigma aldrich, Germany)으로 표준용액 1000 mg/L를 제조하고 이를 50 mg/L으로 희석한 불소 용액 30 mL와 24 h 반응시켰다. 열처리를 통한 소성 굴폐각의 불소 흡착량이 가장 높은 OS700을 이용하여 동역학적 흡착 실험(kinetic), 평형 흡착 실험(equilibrium), 열역학적 흡착 실험(thermodynamic), 불소의 pH에 따른 흡착 실험, 다른 이온과의 경쟁 흡착 실험, OS700의 주입량에 따른 흡착 실험을 수행하였다. 동역학적 흡착 실험은 OS700의 0.1 g과 불소 용액 300 mg/L를 0.25, 0.5, 1, 2, 3, 6, 12, 24 h에 따라 반응시켜 분석하였다. 평형 흡착 실험은 OS700의 0.1 g과 불소의 농도(5, 10, 30, 50, 100, 200, 300, 400, 500, 700 mg/L)에 따라 24 h 반응시킨 다음 분석하였다. 열역학적 흡착 실험은 평형 흡착 실험과 같은 방법으로 15℃, 25℃, 35℃ 조건의 반응온도를 설정하여 OS700의 0.1 g과 불소 용액 300 mg/L를 0.25, 0.5, 1, 2, 3, 6, 12, 24 h에 따라 반응시켜 분석하였다. 불소 용액의 pH에 따른 OS700의 불소 흡착량을 알아보기 위하여 0.1 M의 NaOH와 0.1 M의 HCl을 이용하여 불소 용액 300 mg/L의 pH를 3, 5, 7, 9, 11로 제조하였다. pH의 조건을 달리한 불소 용액과 OS700의 0.1 g을 24 h 반응시켜 분석하였다. 불소 용액에 다른 이온이 존재할 경우 OS700의 불소 흡착량의 변화를 알아보기 위하여 NaHCO3, K2HPO4, NaCl을 사용하여 300 mg/L의 불소 용액에 혼입하여 각각 0 mM, 1 mM, 10 mM의 다른 이온이 존재하는 불소 용액과 OS700의 0.1 g을 24 h 반응시켜 분석하였다. OS700의 주입량에 따른 불소 흡착량의 변화를 알아보기 위하여 주입량을 0.1, 0.2, 0.3, 0.4, 0.5 g으로 설정하여 불소 용액 300 mg/L와 24 h 반응시켜 불소 제거량을 분석하였다. OS700과 불소용액의 원활한 반응이 일어날 수 있도록 교반기의 속도는 100 rpm으로 설정하였다. 동일 조건에서 모든 실험은 3회 반복 수행하였고, 평균값과 오차를 그래프에 나타내었다. 불소 용액과 OS700의 반응이 끝난 다음 흡착제를 용액과 분리시키기 위하여 여과지(공극 크기: 0.45 µm, Advantec, Japan)를 사용하였다. Na2CO3, NaHCO3를 이용하여 용리액을 제조하였고, 1.00 mL/min 유량으로 용리액을 칼럼(Dionex Ionpac AS14 RFIC, 4×250 mm)에 흘려 주었다. 불소분석을 위해 사용된 이온크로마토그래피(DX-100, Dionex, USA)의 방법검출한계는 0.1 mg/L이다.
2.3. 데이터 분석
동역학적 흡착 실험의 결과를 유사 1차 모델(Pseudo first-order model)을 나타내는 Eq. 1과 유사 2차 모델(Pseudo second-order model)을 나타내는 Eq. 2를 이용하여 분석하였다.
qt는 시간 t에서의 OS700의 단위질량당 흡착된 불소의 양(mg/g), qe는 흡착 반응이 평형상태에 도달하였을 때 OS700의 단위질량당 흡착된 불소의 양(mg/g), k1은 유사 1차 반응 상수(1/h), 그리고 k2는 유사 2차 반응 속도 상수(g/mg/h)이다.
평형 흡착 실험 결과를 Langmuir 모델을 나타내는 Eq. 3과 Freundlich 모델을 나타내는 Eq. 4를 이용하여 분석하였다.
Qm은 OS700의 단위질량당 최대 불소 흡착량(mg/g), KL은 결합 에너지와 연관된 Langmuir 흡착 상수(L/mg), Ce는 반응이 평형인 상태에서 수중의 불소 농도(mg/L), KF는 분배 계수(L/g), 그리고 n는 Freundlich 상수이다.
Langmuir model의 무차원 분리상수 RL은 Eq. 5를 이용하여 구하였다.
반응 온도에 따른 열역학적 흡착 실험 결과는 아래 나타낸 식을 이용하여 열역학적 특성을 분석하였다.
Eq. 6에서 ∆G0는 Gibb’s 자유 에너지의 변화(kJ/mol), ∆H0는 엔탈피의 변화(kJ/mol), ∆S0는 엔트로피의 변화(J/K・mol)를 나타낸다. Eq. 7에서 Ke는 평형 상수(-), R은 기체 상수를 의미한다. 그리고 Eq. 9에서 는 흡착제의 주입량(g/L)을 의미한다. ∆S0와 ∆H0는 Eq. 7의 lnKe와 1/T의 관계식을 통하여 구하였다.
3. 결과 및 고찰
3.1. 열처리 온도에 따른 소성 굴폐각의 불소 흡착량
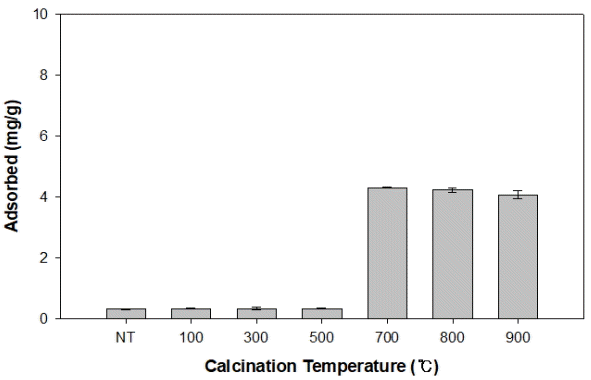
본 연구에 사용된 소성 굴폐각의 열처리 온도에 따른 불소 흡착 특성을 파악하기 위하여 열처리되지 않은 NT와 100℃, 300℃, 500℃, 700℃, 800℃, 900℃에서 열처리된 소성 굴폐각(NT, OS100, OS300, OS500, OS700, OS800, OS900)의 0.3 g과 50 mg/L의 불소 용액을 24 h 반응시켜 각각의 열처리 온도에 따른 불소 흡착량을 결정하여 Fig. 1에 나타내었다. 열처리 온도가 증가함에 따라 소성 굴폐각의 불소 흡착량은 0.32 mg/g(NT)에서 4.31 mg/g(OS700)까지 증가하였고, 800℃와 900℃에서 흡착량은 각각 4.23 mg/g과 4.07 mg/g으로 차이가 미미하였다. 700℃에서 열처리된 소성 굴폐각(OS700)의 불소 흡착량이 4.31 mg/g으로 가장 높게 나타났다. 굴폐각의 성분인 CaCO3가 CaO로 변환하기에 가장 알맞은 온도는 소성 반응식을 통하여 848℃로 계산되어 다른 논문에서는 오차와 다른 손실을 감안하여 900℃에서 굴폐각을 소성시켜 실험에 사용하였다고 보고되었다[15,16]. 하지만 실제로 모든 온도에서의 소성 굴폐각의 흡착량 차이로 보아 700℃에서 가장 높은 흡착량을 보였기 때문에 본 연구에서는 OS700을 흡착제를 사용하였다. 이러한 결과는 770℃ 이상에서부터 굴폐각의 주성분인 탄산칼슘이 산화칼슘으로 열분해 되기 때문에 700℃에서 흡착량이 크게 증가한 것으로 판단된다[14].
3.2. OS700의 불소 흡착에 대한 동역학적, 평형, 열역학적 흡착 특성
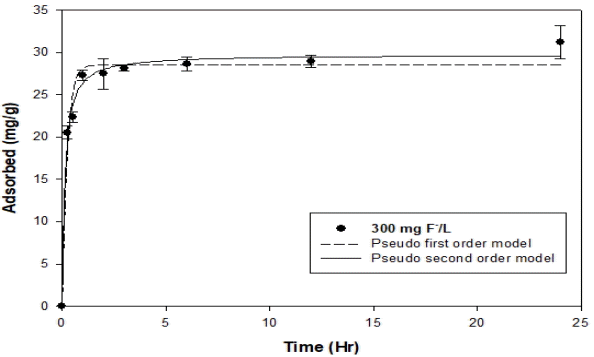
불소에 대한 OS700의 동역학적 흡착 실험의 결과를 Fig. 2에 나타내었다. 300 mg/L의 불소에 대한 OS700 0.1 g의 불소 제거는 1시간 만에 흡착 반응이 평형에 도달하는 것을 볼 수 있다. 이러한 실험 결과를 유사 1차 모델과 유사 2차 모델을 통하여 얻은 분석 결과를 Table 1에 나타내었다. 유사 1차 모델의 R2는 0.9719이고, 유사 2차 모델의 R2는 0.9906이다. 유사 1차 모델은 물리적 확산이 흡착속도의 제한 인자인 것을 나타내는 모델이고, 유사 2차 모델은 화학적 흡착이 흡착속도의 제한 인자인 것을 나타내는 모델이다. 이러한 결과를 통해 OS700의 불소 흡착 속도가 물리적 확산과 화학적 흡착에 의해 결정되는데 이러한 과정에서 화학적 흡착이 좀 더 영향을 미치는 것으로 판단된다[17].

Model parameters for pseudo first order model and pseudo second order model obtained from fluoride adsorption onto OS700.
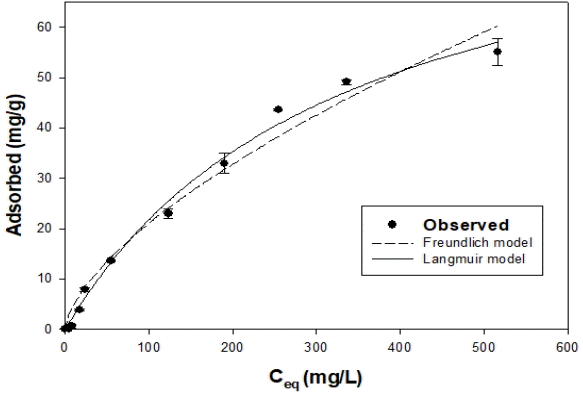
불소에 대한 OS700의 평형 흡착 실험의 결과를 Fig. 3에 나타내었다. Langmuir model과 Freundlich model을 통한 분석의 결과를 Table 2에 나타내었다. Langmuir model의 R2은 0.9930이고, Freundlich model의 R2는 0.9776으로 OS700의 불소 흡착은 Langmuir model이 더 적합한 것으로 나타났다. 이러한 결과를 통하여 불소 흡착에 대한 OS700의 흡착 형태는 주로 단층으로 이루어진 것을 알 수 있었다[18]. Langmuir model에서 불소에 대한 OS700의 최대 흡착량은 93.2922 mg/g으로 나타났다. 불소를 제거하기 위해 사용된 다른 흡착제의 단위흡착량과 비교 결과, 아타풀자이트(4.89 mg/g), 폐콘크리트(28.50 mg/g)보다는 크게 나타났지만, 돌로마이트(163.7 mg/g)보다는 작게 나타났다[8-10]. Langmuir model에서 무차원 분리상수 RL의 값에 따라 비친화적(RL>1), 친화적(0<RL<1), 비가역적(RL=0)으로 분류된다[19]. 불소 흡착에 대한 OS700의 RL의 값은 0.3197-0.9850의 범위로 OS700이 불소 흡착에 대하여 친화적인 것을 알 수 있다.

Model parameter for Langmuir model and Freundlich model obtained from fluoride adsorption onto OS700.
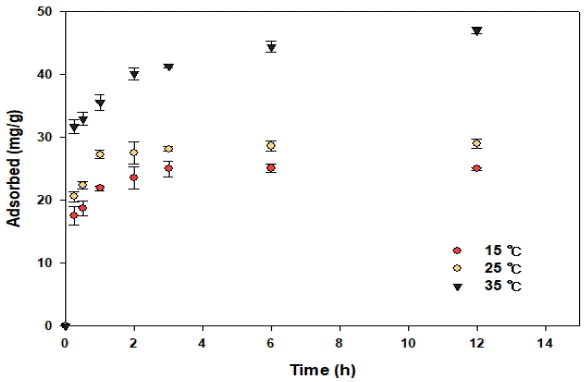
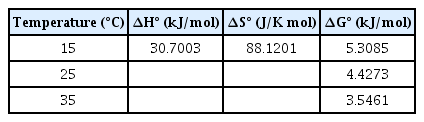
동역학적 흡착 실험과 같은 실험 조건으로 반응온도의 변화에 따른 OS700의 불소 흡착량을 Fig. 4와 Table 3에 나타내었다. 반응온도가 15℃, 25℃에서 불소 흡착량의 차이가 크지 않지만 35℃에서는 차이가 나타났다. 반응온도가 올라갈수록 흡착량이 증가하는 것으로 나타났다. Table 3에서 ∆S°가 88.1201 J/Kmol로 고체와 액체 경계면에서 흡착 반응이 엔트로피가 증가하는 방향으로 진행되는 것으로 나타났고, ∆H°이 30.7003 kJ/mol인 것을 통하여 OS700의 불소 흡착은 ∆H°가 양수이기 때문에 흡열반응이라는 것을 알 수 있다[20]. ∆G°이 15℃에서 5.3085 kJ/mol, 25℃에서 4.4273 kJ/mol, 35℃에서 3.5461 kJ/mol이므로 온도가 증가할수록 ∆G°가 감소하는 것을 나타내며, 모든 값이 양수로 나타나 불소와 OS700의 반응은 본 실험 조건에서 비자발적인 반응인 것을 알 수 있다[21].
3.3. 용액의 pH, 다른 이온의 존재, 흡착제 주입량에 따른 흡착 특성
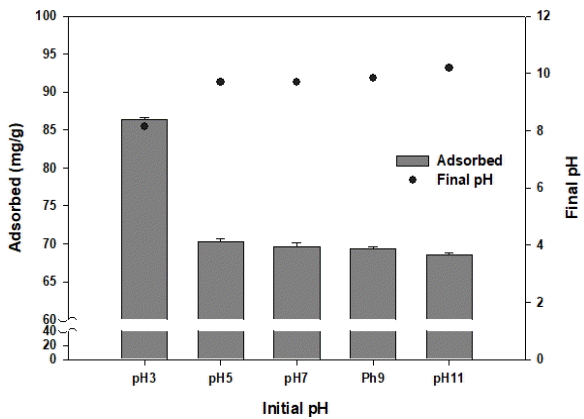
OS700의 불소 흡착에 대하여 불소 용액의 pH에 따른 흡착량 변화를 Fig. 5에 나타내었다. pH 3에서 가장 높은 흡착량(86.4085 mg/g)을 나타냈고, pH 11에서 가장 낮은 흡착량(68.5359 mg/g)을 나타내었다. 불소 용액의 pH가 증가할수록 OS700의 흡착량이 감소하는 것으로 나타났다. 이는 pH가 높아질수록 OS700의 표면전하인 음전하가 커져 음이온을 띄는 F-과 반발력이 발생하면서 OS700의 불소 흡착량이 감소하는 것으로 판단된다[21].
OS700의 불소 흡착에 대하여 불소 용액 내에 다른 이온의 존재 여부에 따른 흡착량 변화를 Fig. 6에 나타내었다. 자연계에 흔히 존재하는 음이온 탄산염(CO32-), 인산염이온(PO43-), 염소이온(Cl-)을 이용하여 OS700의 불소 흡착량에 대한 영향을 분석하였다. 다른 이온의 농도에 따른 차이도 알아보기 위하여 다른 이온의 농도를 1 mM, 10 mM로 설정하여 실험하였다. 다른 이온이 존재하지 않는 0 mM에서의 불소 흡착량은 36.2624 mg/g이고, 다른 이온의 농도가 1 mM에서 불소 흡착량은 CO32-에서 35.7126 mg/g, PO43-에서 26.9677 mg/g, Cl-에서 35.6700 mg/g으로 나타났다. 다른 이온의 농도가 10 mM인 경우 불소 흡착량은 CO32-에서 24.6669 mg/g, PO43-에서 11.0137 mg/g, Cl-에서 34.1649 mg/g으로 나타났다. CO32-의 경우 불소 용액 내의 다른 이온의 존재가 0 mM에서 10 mM로 증가할수록 OS700의 불소 흡착량이 1.52%, 31.98%로 감소하였고, PO43-의 경우 25.63%, 69.63%로 감소하였고, Cl-의 경우 1.63%, 5.78%로 감소하였다. 이러한 결과를 통하여 불소 용액 내의 다른 이온이 존재할 경우 OS700의 불소 흡착능력이 감소하는 것으로 나타났다. PO43-가 CO32-와 Cl-보다 OS700의 불소 흡착능력에 더 큰 영향을 미치는 것으로 나타났다. 이러한 결과는 shared charge와 electro-negativity로 인한 영향이라고 판단된다[22]. Shared charge는 중심원자의 원자가를 결합되어있는 산소 원자의 수로 나눈 값으로 결정되는데, CO32-는 1.33, PO43-는 1.25 그리고 Cl-는 결합된 산소가 없어서 존재하지 않는다. 음이온의 존재는 음이온간의 정전기적 반발력을 불소 이온의 흡착을 방해하는데, shared charge가 작을수록 흡착제와 더 강한 정전기적 인력을 형성하여 흡착 효율을 감소시킬 수 있다[23-25]. 또한 음이온의 electro-negativity는 PO43-(2.19) < CO32-(2.55) < Cl-(3.16) 순으로, electro-negativity가 작을수록 흡착제에 강한 결합을 형성하므로, 불소 흡착에 Cl- < CO32- < PO43- 순서로 영향을 미쳤다[23,26].
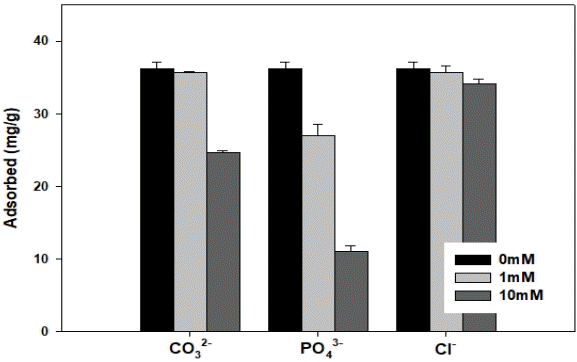
Effect of competing anions (CO32-, PO43-, Cl-) on fluoride adsorption onto OS700 (inital fluoride concentration: 300 mg/L (15.79 mM).
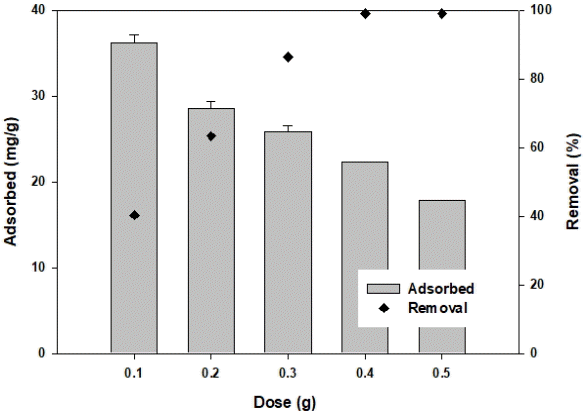
불소에 대한 OS700의 주입량에 따른 흡착량의 변화를 Fig. 7에 나타내었다. OS700의 주입량이 0.1 g에서 0.5 g으로 증가함에 따라 불소 흡착량이 36.2624 mg/g에서 17.8721 mg/g까지 감소하였고, 제거율은 40.29%에서 99.07%까지 증가하였다. OS700의 주입량이 증가할수록 OS700의 단위질량당 불소 흡착량은 감소하지만 OS700의 불소 제거율은 증가하는 것으로 나타났다. OS700의 주입량 증가에 따라서 단위질량당 불소 흡착량이 감소하는 이유는 흡착제 주입량이 증가하면 불소를 흡착할 수 있는 흡착 공간이 많아져 불소 흡착을 위한 공간이 포화되지 않아 흡착되지 않은 공간이 존재하기 때문으로 판단된다[27]. 반면에 흡착제의 주입량이 증가할수록 흡착제 표면의 흡착 가능한 부위 또는 표면적이 증가되어 불소 흡착이 가능한 흡착제의 용량이 증가하여 불소의 제거율은 증가하였다[28].
4. 결 론
본 연구에서 소성 굴폐각을 이용한 불소 흡착특성을 분석하였다. 소성 굴폐각을 열처리하여 불소에 대한 흡착량을 분석한 결과 700℃에서 열처리된 소성 굴폐각에서 가장 높은 불소 흡착량을 보였다. 동역학적 흡착 실험의 결과로 OS700의 불소 흡착은 1시간 만에 평형에 도달하였고, 유사 1차 모델과 유사 2차 모델에 대한 결과를 통해 화학적 흡착이 반응속도에 대한 제한 인자인 유사 2차 모델에 더 적합하며 OS700은 화학적 흡착이 반응속도에 영향을 미치는 것으로 판단된다. 평형 흡착 실험의 결과로 OS700의 불소 흡착은 Freundlich model보다 Langmuir model이 더 적합한 것으로 나타났고, 불소의 최대 흡착량은 93.2922 mg/g으로 나타났다. 열역학적 흡착 실험의 결과로 불소 흡착에 대한 OS700의 흡착반응은 흡열반응이며 비자발적으로 일어나는 것으로 나타났다. OS700의 불소 용액의 pH에 대한 흡착량 변화에 대한 실험 결과 pH 3에서 86.4085 mg/g으로 가장 높은 흡착량이 나타났다. OS700의 불소 용액 내의 다른 이온의 존재에 대한 흡착량 변화에 대한 실험 결과 PO43- > CO32- > Cl- 순으로 불소 흡착량이 감소되며 OS700의 불소를 흡착하는 반응에 부정적인 영향을 미치는 것으로 나타났다. OS700의 주입량에 따른 불소 흡착량 변화에 대한 실험 결과 OS700의 주입량이 증가할수록 단위질량당 불소 흡착량은 감소하지만 제거율은 증가하였다. OS700을 실제 수처리에 적용하기 위해서는 1시간 이상의 반응시간이 필요하며, 알칼리 조건보다는 산성 조건에서 불소 제거가 효과적으로 이루어질 수 있다. 또한 인산염과 탄산염은 불소흡착을 저해하므로 인산염과 탄산염이 다량 포함된 원수에서는 흡착제의 주입량을 증가시켜 불소를 제거해야 한다.
Acknowledgements
본 연구는 농림축산식품부의 재원으로 농림수산식품기술 기획평가원의 가축질병대응기술개발사업의 지원을 받아 연구되었음(No.1180952).