저비용 이산화티타늄 광촉매 제조 및 특성평가
Preparation and Characteristic Evaluation of Low-Cost TiO2 Photocatalyst
Article information
Abstract
본 연구에서는 TiCl4의 총인(T-P) 제거율과 응집 반응 후 생성된 슬러지를 소성하여 이산화티타늄을 제조하고 제조된 이산화티타늄의 경제성에 대해 분석하였다. 하수처리장 방류수를 취수해 2.5 mg/L의 총인 농도를 가진 원수를 제조하였으며, 제조된 원수에 대해 TiCl4를 0.6 mL 주입 시 99.93%의 총인 제거율을 얻을 수 있었다. 실험 후 생성된 슬러지를 인발 후 건조하고 300~1000°C의 각각 다른 온도에서 소성하여 이산화티타늄을 제조하였으며, 제조된 이산화티타늄의 표면특성과 결정성 분석을 실시하였다. 700~800°C에서 제조된 이산화티타늄의 표면이 가장 선명한 둥근 모양의 입자를 나타내었으며, 500~800°C에서는 아나타제, 900~1000°C에서는 루타일 결정구조가 나타났다. 제조된 이산화티타늄 1 kg의 생산단가는 약 5,400원으로 P-25 광촉매보다 저렴한 가격으로 제조 및 판매를 기대할 수 있으며, 하수처리장에 적용 시 비싼 TiCl4 비용을 보완하고 슬러지의 친환경인 재활용으로 제조된 이산화티타늄의 유통 및 현장적용을 통해 경제적, 환경적으로 우수하다고 판단된다.
Trans Abstract
In this study, TiCl4 was used as a coagulant to remove total phosphorus (T-P) in the waste water and the economic feasibility of TiO2 prepared from the precipitated sludge was analyzed. After taking from the sewage treatment plants experimental, experimental water was prepared at a T-P concentration of 2.5 mg/L for the test. The optimum amount of TiCl4 coagulant injected was 0.6 ml and the total removal rate was 99.93%. The precipitated sludge was drawn, dried and calcinated at different temperatures of 300 to 1000°C to prepare TiO2. XRD and SEM test was performed to analyze the surface properties and crystallinity of prepared TiO2. The surface of TiO2 prepared at 700~800°C showed the most rounded shape. Anatase crystal structure was observed at calcinated temperature of 500~800°C, however, rutile crystal structure appeared at 900~1000°C. The price of 1kg of TiO2 produced by this study is about 5,400 WON, which is lower than that of commercial P-25 photocatalyst. It is also found that TiCl4 coagulants, which are more expensive than conventional coagulants, are cost-competitive through sludge recycling.
1. 서 론
사염화티타늄(TiCl4)는 이산화티타늄(TiO2)을 제조하기 위한 출발물질 중 하나로 염소법이나 수열합성법으로 이산화티타늄을 제조할 때 사용되어진다[1~3]. 최근에는 TiCl4를 수중의 오염물질을 처리하기 위한 응집제로 사용하고, 생성된 슬러지를 건조, 소성하여 이산화티타늄을 제조하는 연구가 활발히 진행되고 있다[4,5]. TiCl4를 응집제로 사용하게 되면 인 제거에 있어 효과적으로 적용할 수 있으며, 특히, Ti이온은 치과 임플란트나 식품첨가물, 의학 장비로 사용할 만큼 인체와 수생태 환경에 무해하기 때문에 FeCl3, Alum, PAC와 같은 기존 응집제들이 가지고 있는 색도유발, 알츠하이머 질병과 같은 2차적인 오염발생을 사전에 예방할 수 있다[6~8]. 또한, 기존 응집제들은 3가 양이온 응집제인 반면, TiCl4는 4가 양이온 응집제이므로 양전하가수가 더 크기 때문에 응집효과와 Floc의 크기가 커 침전속도가 빨라 기존의 응집제들보다 침전시간을 줄일 수 있는 장점이 있다[4]. 응집제 사용 후 생성된 슬러지의 처리방안에 있어서 기존 응집제 적용 후 생성된 침전 슬러지의 대부분은 하수슬러지 위탁처리 업체를 통해 소각 및 매립, 재활용 되고 있는 실정이나, TiCl4를 응집제로 사용할 경우에는 생성된 슬러지를 인발하여 건조, 소성하면 이산화티타늄으로 재활용 할 수 있어 슬러지를 친환경적으로 처리가 가능하며[9], 일반 광촉매에 비해 저렴하게 생산이 가능하므로 전체적인 하수슬러지 처리비용을 절감할 수 있다. 최근까지 진행되고 있는 TiCl4를 사용하여 이산화티타늄을 제조하는 연구들은 대부분이 응집슬러지의 침강성 평가, 제조된 이산화티타늄의 특성평가 그리고 최적응집 효과를 얻기 위한 조건 선정 등을 중점적으로 연구되어 왔으나[10-14], 응집슬러지를 재활용하여 이산화티타늄 제조 시의 경제성 분석에 관한 연구는 아직 미흡한 실정이다. 따라서 본 연구에서는 TiCl4를 하수처리장 방류수에 주입하여 잔류 총인(T-P) 성분을 제거한 후 생성된 슬러지를 인발하여 건조 및 소성과정을 통해 이산화티타늄을 제조하였고 경제성 분석을 실시하였다. 제조 시 응집제로 사용된 TiCl4의 주입농도에 따른 총인 제거율 평가를 통해 최적의 주입량을 산정하였으며, TiCl4와 반응하여 생성된 슬러지의 침강성을 평가하기 위해 기존의 응집제(Al2(SO4)3, FeCl3)들과의 비교 실험을 실시하였다. 또한 침전된 슬러지를 인발, 건조 및 소성 과정을 통해 제조된 이산화티타늄의 특성을 분석하였다. 마지막으로 본 연구를 통해 제조된 저비용 이산화티타늄의 경제성을 분석하기 위해 TiCl4의 주입량에 따른 이산화티타늄의 최종 생산량 평가, 제조 시 사용된 건조로와 소성로의 경제적 비용 산정 등을 전부 고려하여, 최종적으로 이산화티타늄 1 Ton을 생산하기 위해 필요한 모든 단가를 산출하였다. 그리고 기존 하수처리장의 총인처리를 위해 흔히 사용되는 응집제인 PAC와 본 연구에서 응집제로 사용된 TiCl4를 사용하여 동일 용량의 하수처리에 따른 응집제 사용량 및 비용, 슬러지발생량 및 처리비용을 비교하였다.
2. 실험 및 분석방법
2.1. 실험방법
본 연구에 사용된 실험원수는 창원시에 소재한 D 하수처리장의 2차 침전지 방류수를 취수하여 사용하였다. 취수한 방류수는 20 L통에 담아 원수의 수질을 유지하기 위해 냉장 보관하였다. 총인 제거율 실험에 앞서 방류수의 낮은 총인 농도를 고려하여 실험에 사용할 원수의 총인 농도를 조절하기 위해 KH2PO4(99%, Kanto, Japan)를 이용해 100 mg/L의 인 표준용액 1 L을 제조하였으며, 1 L의 방류수에 대해 인 표준용액 20 mL를 주입하여 원수의 총인 농도가 2 mg/L 이상이 되도록 제조하였다. 실험에 사용된 응집제는 철염계열인 FeCl3(38%, Daejung, Korea)와 알루미늄계열인 Al2(SO4)3·18H2O(Al2O3 함량 8%, Sigma-Aldrich, USA), 티타늄계열 응집제인 TiCl4(40 wt%, Bentech Frontier, Korea)를 증류수와 1:1 무게비율로 희석하여 20 wt%로 제조하여 사용하였다. 응집실험을 실시하기 위해 본 연구에 사용된 Jar-tester는 6개의 패들과 교반속도 조절이 가능하다(SF6/Digital Programmable Jar-Tester, Misung Scientific, Korea). 총인 농도가 2.5 mg/L로 제조된 원수 1 L가 담긴 6개의 비커에 TiCl4를 0, 0.2, 0.4, 0.6, 0.8 그리고 1 ml씩 각각 주입하여 Jar-test실험을 실시하였다. Jar-test 조건은 예비실험을 통해 얻어진 실험 조건으로 1분 동안 100 rpm으로 급속교반 후 10분 동안 30 rpm으로 완속교반을 진행한 후 30분간 침전시간을 가졌다.
2.2. 분석방법
응집실험 전, 후 원수의 상등수를 취수하여 총인 농도를 측정하였다. 총인 농도는 원수와 처리수의 상등수를 GF/C 필터(0.45 um)로 여과하여 분광광도계(DR 2800 Spectrophotometer)를 이용하여 DR 2800 Spectrophotometer PROCEDURES MANUAL의 Method 8190에 따라 저농도 범위(0.06 to 3.50 mg/L PO43- or 0.02 to 1.10 mg/L P) 시약키트를 사용하여 측정하였다. 측정된 흡광도 값을 이용해 총인 농도를 산출하여 총인 제거효율을 구하였다. 또한 각각의 응집제에 의해 생성된 응집슬러지의 침전시간 분석을 위해 완속교반 직후의 원수를 1 L 메스실린더에 옮겨 시간에 따른 침전상태를 분석하였다.
2.3. 이산화티타늄 제조
이산화티타늄 제조는 생성된 슬러지를 원심분리기(HA12, Hanil Science, Korea)를 사용하여 침전된 슬러지들을 농축, 수거하여 증발접시에 옮겨 담아 105°C 온도조건의 건조로(NO1000, Dongah Testing Machine, Korea)에서 슬러지의 함수율을 낮추기 위해 4시간 동안 건조 후 건조된 슬러지를 도가니에 옮겨 담아 소성로(DMF-801, 대일엔지니어링, Korea)에서 300, 400, 500, 600, 700, 800, 900 그리고 1000°C의 각각 다른 소성온도로 4시간 동안 건조된 슬러지를 소성시켜 이산화티타늄을 제조하였다.
2.4. 제조된 이산화티타늄 분석
TiCl4 응집제 사용에 따라 생성된 슬러지에서 제조된 이산화티타늄의 각각 다른 소성온도에 따른 표면특성을 분석하기 위해 전자파주사전자현미경(SEM, CZ/MIRA I LMH, TESCAN, Czech)을 사용해 15 kv에서 100 k 배율로 촬영하였으며, 제조된 이산화티타늄의 구성원소의 함량을 분석하기 위해 SEM에 부착된 에너지 분산 엑스레이 분광기(EDX, Energy Dispersive X-ray Spectroscopy)를 이용하여 분석하였다. 결정성 분석을 위해 X선 회절분석기(XRD, D8 ADVANCE, BURKER, Germany)를 이용하여 40 keV/40 mA, 5~85°, 2theta 구간에서 주사간격 0.02 °/s의 분석조건으로 촬영을 실시하였다.
2.5. 경제성 분석
총인 제거 실험을 통해 얻어진 TiCl4 최적 주입량과 주입량에 따른 이산화티타늄의 생산량, 이산화티타늄을 제조하기 위해 사용된 건조로 및 소성로의 전기료 등을 계산하여 제조된 이산화티타늄 1 Ton에 대한 단가를 산출하였다. 또한 기존 하수처리장의 총인처리를 위해 흔히 사용되는 응집제인 PAC와 본 연구에서 응집제로 사용된 TiCl4를 사용하여 동일 용량의 하수처리에 따른 응집제 사용량 및 비용, 슬러지발생량 및 처리비용을 비교하였다.
3. 결과 및 고찰
3.1. TiCl4 주입량에 따른 인 제거율
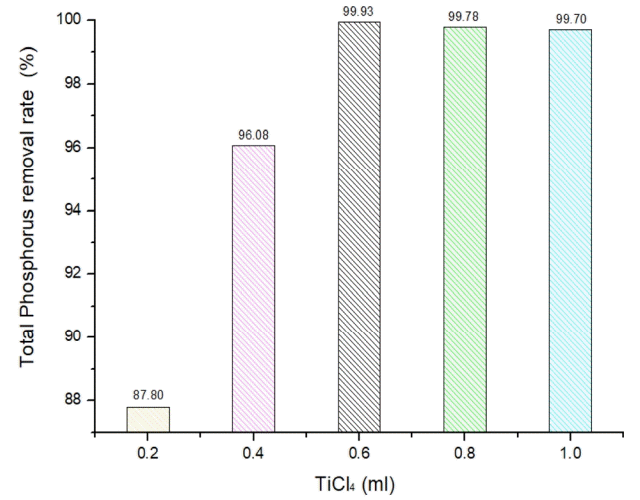
최적의 TiCl4 주입량을 선정하기 위해 실시한 응집실험결과를 Fig. 1에 나타내었다. 원수의 총인 농도는 2.5 mg/L이며, TiCl4를 0.2 ml/L 주입하였을 때 총인 농도는 0.31 mg/L였다. 주입량을 높여 0.4, 0.6, 0.8 그리고 1.0 ml/L로 주입하였을 때 총인 농도는 각각 0.098, 0.0019, 0.0056, 그리고 0.0074 mg/L로 90% 이상의 총인 제거효율을 나타내었으나 0.8 ml/L 이상 주입하였을 경우 총인 제거율은 다시 감소되는 경향을 보였다. 이와 같은 결과는 응집제 과다 주입으로 인해 플록 입자의 재안정화와 재분산이 일어나 응집효율이 감소한 것으로 판단된다. 따라서 TiCl4의 최적주입량은 총인 제거율이 99.93%인 0.6 ml/L로 선정하였다.
3.2. 응집제에 따른 슬러지 침전시간 분석
TiCl4와 FeCl3, Al2(SO4)3응집제의 응집슬러지 침강성을 비교하기 위해 완속교반이 끝난 직후의 원수를 1 L 메스실린더에 옮겨 담아 15분 동안 침전상태를 관찰하였으며, 그 결과를 Fig. 2에 나타내었다. 15분 경과 후 TiCl4의 응집슬러지는 대부분 침전되었지만 FeCl3와 Al2(SO4)3 응집제의 슬러지는 침전 중임을 확인할 수 있었다. 이와 같은 결과는 Ti 이온은 4가 양이온 이므로 3가 양이온인 기존 응집제들보다 유기물이나 인을 더 많이 응집시킬 수 있어 슬러지의 밀도와 무게가 더 커 침전 속도가 빠른 것으로 판단된다[4].
3.3. 제조된 이산화티타늄의 SEM/EDX 분석결과
Fig. 3은 TiCl4 응집 슬러지를 건조 후 300~1000°C의 온도조건에서 100°C씩 증가시켜 각각 다른 소성온도에서 4시간 동안 소성시킨 이산화티타늄 표면의 색깔을 보여주고 있다. 육안으로 보이는 바와 같이 300°C에서 제조된 이산화티타늄은 짙은 갈색으로 소성 전, 후의 색 차이가 거의 나지 않았다. 이는 낮은 소성온도로 인해 슬러지에 함유되어 있는 유기물질이 아직 남아있기 때문이라고 판단되며, 소성온도가 증가할수록 회색빛을 발현하였다. 900~1000°C에서 제조된 이산화티타늄은 연녹색을 나타내었으며, 높은 소성온도의 영향으로 인해 변색된 것으로 판단된다. 각각의 다른 온도에서 제조된 이산화티타늄 표면특성 분석결과를 Fig. 4에 나타내었다. 소성온도가 높아질수록 표면이 점점 거칠어지고 입자간의 부분적 소결로 인해 수축이 일어나 입자크기가 커지는 것을 확인할 수 있었다. 600°C에서부터는 입자의 모양이 둥근 형태로 나타나기 시작하였으며, 소성온도가 700~800°C일 때 입자의 모양이 아주 선명한 구형의 공과 같은 둥근 형태를 나타내었다. 하지만 900°C 이상에서는 표면의 입자형성이 대부분 일어나지 않았으며, 매끄러운 표면이 관찰되었다. 이와 같은 현상이 일어난 이유는 높은 소성온도로 인해 입자성장이 촉진되어 이산화티타늄 입자간의 응집현상이 일어났기 때문이라고 판단된다. 제조된 이산화티타늄의 평균 입자크기는 30~50 nm의 크기로 형성되었다.

TiO2 produced with different calcination temperatures (300~1000oC) for sludge generated after TiCl4 coagulant injection.

SEM images of TiO2 produced with different calcination temperatures (300~1000oC) for sludge generated after TiCl4 coagulant injection.
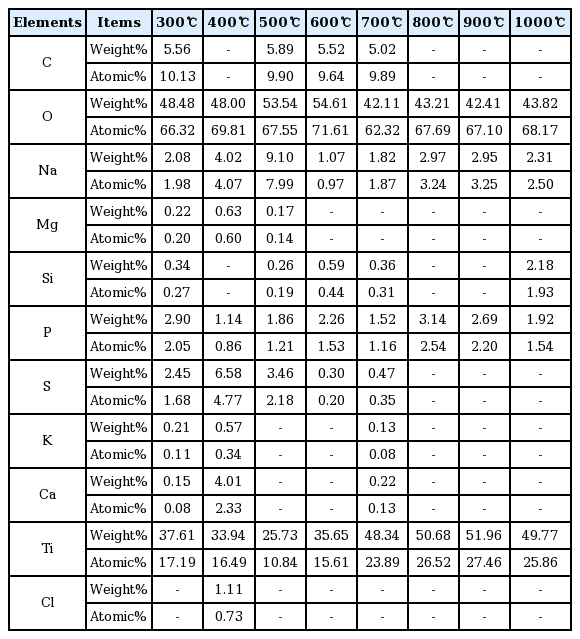
또한, 각각 다른 소성온도에서 제조된 이산화티타늄의 EDX결과를 Table 1에 나타내었으며, 인을 포함하여 총 7~10종의 다양한 원소들이 검출되었다. C, Na, Mg, Si 등과 같은 다양한 원소들이 검출된 것은 실제 하수처리장의 방류수를 원수로 사용해 이산화티타늄을 제조하였기 때문이라 판단된다. 제조된 이산화티타늄 내의 인 함량은 1~3 wt%로 검출되었으며, 인이 검출된 이유는 TiCl4에 의한 응집으로 슬러지에 함유되어 이산화티타늄으로 제조되면서 잔존한 것으로 판단된다. 각각 다른 소성온도에 따른 Ti와 O의 총 함량은 86.09%, 81.94%, 79.27% 90.26%, 90.45%, 93.89%, 94.37%, 93.59%로 각각 나타났으며, EDX로 확인된 다양한 원소들에 비해 높은 비율을 차지하고 있어 대부분 이산화티타늄으로 제조되었다고 판단된다. 소성온도에 따라 검출된 원소가 다른 이유는 Ti와 O원소 외 C, Na, Mg, Si 등의 원소들이 차지하고 있는 함량이 너무 적어 측정 시 측정위치에 따라 오차가 발생했기 때문이라고 판단된다.
3.4. 제조된 이산화티타늄의 XRD 분석결과
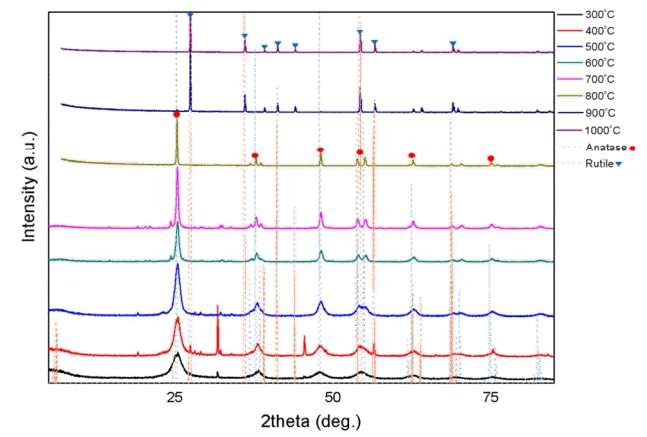
각각 다른 소성온도에서 제조된 이산화티타늄의 결정성을 알아보기 위해 XRD 분석을 실시하였으며 Fig. 5와 같은 결과를 얻었다. 400°C 이하에서는 비결정질을 나타내었으며, 500°C로 소성하였을 때 이산화티타늄의 아나타제 결정구조 피크를 나타내기 시작하였다. 700~800°C에서 가장 선명한 아나타제 결정구조 피크를 나타냈으며, 900°C 이상에서는 아나타제에서 루타일로 상변이가 일어나 이산화티타늄의 루타일 결정구조 피크만 나타났다. 일반적으로 비정질의 이산화티타늄은 소성온도에 따라 300°C 이상에서 아나타제 결정구조를 가지게 되고 약 800°C에서 루타일 결정구조로 상변화가 일어나는 것으로 알려져 있으나[15], 본 연구에서 제조된 이산화티타늄은 슬러지에 함유되어 있는 인과 유기물질 및 불순물들의 영향으로 비교적 높은 소성온도에서 아나타제와 루타일 결정구조의 상변이가 나타났다고 판단된다. 또한, 이산화티타늄 제조 시 소성온도에 따라 얻고자 하는 결정구조를 선택해서 제조할 수 있다고 판단되며, 본 연구에서 제조하고자하는 이산화티타늄은 아나타제 결정구조를 지닌 이산화티타늄이므로 제조 시 필요한 소성온도는 700°C로 판단된다.
3.5. 제조된 이산화티타늄의 경제성 분석
Jar-test의 결과에 따라 2 L의 원수에 TiCl4 1.2 ml를 주입하고 응집 실험 후 생성된 슬러지를 인발하여 건조 및 소성하여 300~1000°C까지 각각 다른 소성온도에서 제조된 이산화티타늄의 무게를 측정하였으며, 그 결과는 Table 2에 나타내었다. 소성온도가 증가함에 따라 유기물질이 제거되어 무게가 감소하다가 700°C 이상의 소성온도에서는 유기물질과 다른 불순물들이 모두 제거되었기 때문에 무게변화가 크게 나타나지 않은 것으로 판단된다. 따라서 평균적으로 2 L의 원수에 1.2 mL의 TiCl4를 주입하면 약 0.1 g의 이산화티타늄이 생산된다.

Production results of TiO2 produced with different calcination temperature (300~1000℃) for sludge generated after TiCl4 coagulant injection
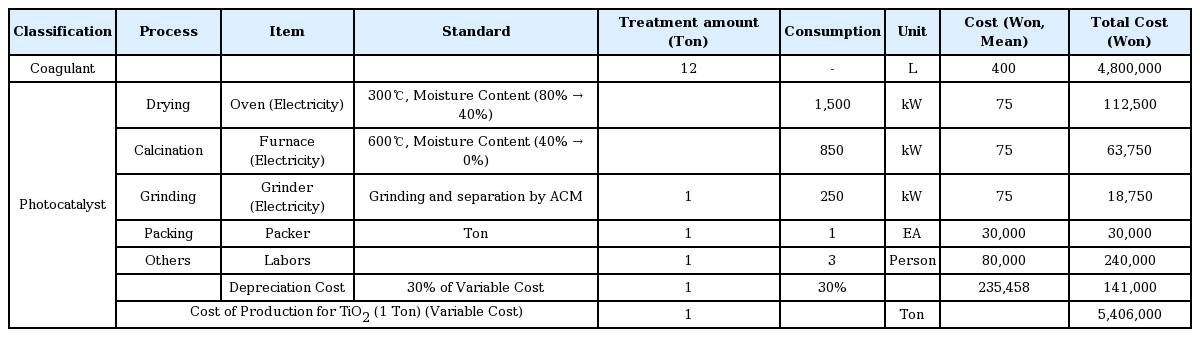
제조된 이산화티타늄의 단가를 산출하기 위해 환경부 환경기술개발사업의 ‘수중 인을 제거하기 위한 티타늄 계열의 응집제 개발’ 보고서를 참고하였으며[16], 응집제 비용과 슬러지의 건조 및 소성 비용, 분쇄, 포장 그리고 노무비 등을 고려한 금액을 Table 3에 나타내었다. TiCl4의 비용은 본 연구에서 실시한 이산화티타늄 제조 실험 시 결정된 TiCl4 최적주입량에 따른 이산화티타늄 1 Ton을 제조하기 위해 필요한 TiCl4 주입량을 계산하였다. 실험을 통해 얻은 결과값으로 TiCl4를 1.2 mL 주입하면 약 0.1 g의 이산화티타늄이 제조되었으므로, 1 Ton의 이산화티타늄을 제조하기 위해선 약 12 Ton의 TiCl4가 필요하다. 따라서 TiCl4 단가를 고려하여 12 Ton에 대한 비용을 계산하여 Table 3에 나타내었다. 건조로와 소성로 및 분쇄에 대한 전기료와 제조된 이산화티타늄의 포장비용, 노무비 등을 고려하여 이산화티타늄 1 Ton에 대한 생산단가를 산출하였으며, 이산화티타늄 1 Ton의 생산단가는 5,406,000원으로 제조된 이산화티타늄은 1 kg의 단가는 약 5,400원으로 계산되었다.
본 연구에서 제조된 이산화티타늄의 단가는 1 kg당 약 5,400원으로 상업용 광촉매로 흔히 사용되고 있는 독일산 P-25 (Degussa) 이산화티타늄 광촉매의 가격인 약 80,000원에 비해 아주 저렴하게 제조 및 판매를 기대할 수 있다고 판단된다.
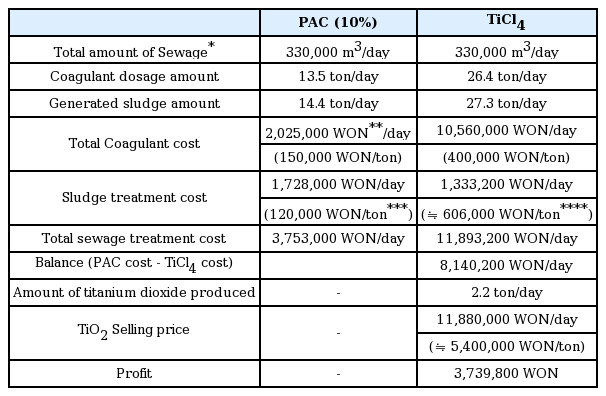
Table 4는 기존 하수처리장의 총인처리를 위해 흔히 사용되는 응집제인 PAC (10%)와 본 연구에서 응집제로 사용된 TiCl4를 사용하여 동일한 하수량에 따른 응집제 사용량 및 비용, 슬러지발생량 및 처리비용을 비교하였다. 또한 TiCl4를 적용한 후 생성된 슬러지를 활용하여 이산화티타늄 제조 시, 이산화티타늄의 제조량과 판매 수익 등을 고려하여 전체적인 경제성 분석을 실시하였다. Table 4에 나타난 PAC 응집제 주입에 따른 실험결과는 Jang 등[17]의 연구결과를 바탕으로 응집제 주입량, 슬러지 처리비 등을 산정하였으며, 응집제 주입량이 40.8 mg/L일 때 초기 총인농도가 2.581 mg/L에서 0.094 mg/L로 나타났다[17]. 슬러지 처리비용은 창원시 D 하수처리장의 평균 처리비용을 적용하였으며, 전체 처리목표량 330,000 m3/일을 처리할 때 소비되는 총 처리비용은 약 3,753,000 원/일로 나타났다. 반면 TiCl4의 경우 본 연구에서 얻은 결과를 바탕으로 응집제 주입량을 선정하였으며, 주입량이 80 mg/L일 때 초기 총인농도가 2.5 mg/L에서 0.098 mg/L로 나타났다. 슬러지 처리비용은 Table 3의 이산화티타늄 생산 단가를 적용하여 TiCl4 비용을 제외한 건조, 소성, 분쇄 등의 비용으로 1,333,200원이 발생하는 것으로 나타났다. 따라서 TiCl4를 사용하여 330,000 m3/일을 처리할 때 소비되는 총 처리비용은 약 11,893,200원/일이다. 이산화티타늄 제조량은 12 Ton의 TiCl4가 사용되었을 때 1 Ton의 이산화티타늄이 제조되므로 26.4 Ton의 TiCl4가 사용됨에 따라 2.2 Ton의 이산화티타늄이 제조되는 것을 알 수 있다.
본 연구에서 산출한 슬러지에서 제조한 이산화티타늄의 생산단가는 1 kg당 5,400원으로, 판매금액을 생산단가인 5,400원으로 하였을 경우 제조된 2.2 Ton의 이산화티타늄의 판매금액은 11,880,000원으로 계산된다. 이때, TiCl4 가격 및 이산화티타늄 제조비용인 11,893,200원에서 기존 응집제인 PAC 사용비용 및 슬러지 처리비용인 3,753,000원을 제외한 금액인 8,140,200원을 이산화티타늄 판매금액인 11,880,000원에서 감면하고도 3,739,800원의 이익이 발생하는 것으로 판단된다. 만약 판매금액을 생산단가의 2배인 10,800원(P-25의 약 1/8가격)으로 하였을 경우 제조된 이산화티타늄의 판매금액은 23,760,000원이 되며, 보완해야할 금액인 8,140,200원을 제외하고도 15,619,800원의 이익이 발생하는 것으로 판단된다. 따라서 TiCl4에 의해 제조된 이산화티타늄은 PAC에 비해 비싼 TiCl4의 가격과 PAC에 의해 생성된 슬러지의 처리 비용 및 이산화티타늄 생산비용 등을 고려해 적절한 판매금액을 선정하게 된다면 저렴한 가격으로 시장성 확보를 통해 오히려 경제적 이익을 볼 수 있다고 판단된다. 다만, 응집제 주입량과 슬러지 발생량 및 이산화티타늄 제조량은 실제 하수처리장에 적용할시 하수의 수질특성에 따라 변동될 수 있는 점을 고려해야 한다.
4.결 론
본 연구에서는 TiCl4의 총인(T-P)제거 효율과 제조된 이산화티타늄의 특성분석을 실시하였으며, 제조된 원수 총인 농도 2.5 mg/L 대해 TiCl4 0.6 mL/L를 주입하면 99.93%의 총인 제거율을 얻을 수 있었다. 제조된 이산화티타늄의 특성분석 결과 30~50 nm의 입자크기를 가지며 600~800°C의 온도에서 제조한 이산화티타늄은 아나타제 결정구조를 가지고 있었다. 또한 900~1000°C의 온도에서는 루타일 결정구조가 나타났다. 본 연구에서 제조한 이산화티타늄의 단가는 약 5,400원으로 대표적인 이산화티타늄 P-25 광촉매보다 저렴하게 제조 및 판매를 기대할 수 있으며, 하수처리장에 적용 시 기존 응집제보다 비싼 TiCl4 비용을 슬러지에서 생산된 이산화티타늄을 이용하여 보완해줄 수 있다고 판단된다. 또한, 슬러지를 친환경적으로 재활용이 가능하고 제조된 이산화티타늄의 유통 및 현장적용을 통해 경제적, 환경적으로 우수하다고 판단된다.
Acknowledgements
본 연구는 국토교통부 건설기술연구사업(18SCIP-B149189-01)의 연구지원비에 의해 수행되었습니다.