BAC 공정에서 파라벤 및 할로겐화 파라벤류의 생물분해 특성 및 동력학 평가
Evaluation of Biodegradation Characteristics and Kinetic of Parabens and Halogenated Parabens in Biological Activated Carbon (BAC) Process
Article information
Abstract
상수원수 중에 잔존하는 methylparaben류(MPs)가 정수처리 공정으로 유입되면 염소와 반응하여 할로겐화된 paraben 류가 생성된다. 본 연구에서는 할로겐화된 paraben류들의 생물활성탄 공정에서의 생물분해 제거 특성에 대해 평가하였다. Methylparaben (MP)와 할로겐화 MP류 5종의 생물분해능은 MP가 가장 높았으며, chloro-methylparaben (Cl-MP), bromomethylparaben (Br-MP), dichloro-methylparaben (Cl2-MP), bromo,chloro-methylparaben (Br,Cl-MP) 및 dibromo-methylparaben (Br2-MP) 순으로 나타났다. MP, Cl-MP 및 Br-MP는 수온 5℃에서도 empty bed contact time (EBCT) 5분에서 완전 제거되었으나, Cl2-MP와 Br2-MP의 경우는 EBCT 15분에서도 각각 79.8%와 65.3% 제거되었으며, 수온 25℃, EBCT 15분의 조건에서도 각각 99.1% 및 94.6%의 제거율을 나타내어 BAC 공정에서 제어하기가 어려운 물질로 평가되었다. BAC 공정에서 수온 5℃~25℃에서의 Br2-MP의 생물분해 속도상수(kbio)와 반감기(t1/2)는 각각 0.0671 min -1~0.2358 min-1 및 2.9 min~10.3 min이었으며, Cl2-MP의 경우는 kbio와 t1/2이 각각 0.1005 min-1 ~0.3458 min-1 및 2.0 min~6.9 min이었다. Cl2-MP, Br,Cl-MP 및 Br2-MP의 생물분해 중간생성물질로 MP가 생성되며, BAC 공정 처리수 중에 MP가 잔존할 경우 후염소 처리에 의해 할로겐화-MP류의 재생성 가능성이 있어 이에 대한 추가적인 연구가 필요하였다.
Trans Abstract
When the methylparabens (MPs) remaining in the raw water is introduced into the water treatment process, halogenated parabens are produced by reacting with chlorine. In this study, biodegradation characteristics of halogenated parabens in biological activated carbon (BAC) process were evaluated. The biodegradability of methylparaben (MP) and five halogenated MP species were highest in MP, followed by chloro-methylparaben (Cl-MP), bromo-methylparaben (Br-MP), dichloro-methylparaben (Cl2-MP), bromo,chloro-methylparaben (Br,Cl-MP) and dibromo-methylparaben (Br2-MP). MP, Cl-MP and Br-MP were completely removed under conditions of water temperature 5℃ and EBCT 5 min. In the case of Cl2-MP and Br2-MP, 79.8% and 65.3% of removal rate were represented at EBCT 15 min and 99.1% and 94.6% of Cl2-MP and Br2-MP were removed under conditions of water temperature 25℃ and EBCT 15 min. These results indicate that these compounds are difficult to control the BAC process. The biodegradation rate constants (kbio) and half-life (t1/2) of Br2-MP at the water temperature of 5℃ to 25℃ in the BAC process were 0.0671 min-1~0.2358 min-1 and 2.9 min to 10.3 min, respectively, and in case of Cl2-MP, kbio and t1/2 were 0.1005 min -1 ~0.3458 min-1 and 2.0 min~6.9 min, respectively. MP is produced as a biodegradation intermediate of Cl2-MP, Br, Cl-MP and Br2-MP, and if MP remains in the BAC-treated water, the possibility of regeneration of halogenated-MPs by post-chlorination and further study is needed.
1. 서 론
파라벤류는 각종 화장품류, 식료품류 및 의약물질류 등에 첨가되어 세균, 효모 및 곰팡이들의 성장을 억제하는 보존제로 널리 이용되고 있다[1~3]. 일상생활에서 파라벤류의 과도하고 잦은 사용으로 인해 하수처리장 방류수, 지표수, 수영장 등 기타의 많은 수환경에서 ng/L~μg/L의 농도범위로 검출되고 있다[4~6]. 설치류를 이용한 단기 및 장기독성 연구결과에서 실제로는 독성이 없는 것으로 보고하고 있다[7]. 일부 파라벤은 시험 관내(in vitro) 및 생체 내(in vivo) 분석에서 에스트로겐 활성을 갖는 것으로 밝혀졌지만[8], 연구에 따르면 파라벤의 에스트로겐 활성이 너무 낮아 일반적인 노출 시나리오에서는 인체에 유해한 에스트로겐 활성을 유발하지 않는 것으로 나타났다[9]. 그럼에도 불구하고, 파라벤류는 인체에 다양한 악영향(anti-androgenicity, genotoxicity) 및 Daphnia magna와 Vibrio fischeri와 같은 수생 생물에 대한 급성 독성을 유발할 수 있는 것으로 밝혀졌다[10~12].
다양한 수환경에서 할로겐화 파라벤류(mono-Cl- (Cl-), mono-Br- (Br-), di-Cl- (Cl2-), Br,Cl- 및 di-Br- (Br2-))가 검출되었다[13~16]. 파라벤류는 페놀계 화합물로 염소와 쉽게 반응하고[17~19], 염소는 정수장과 하수처리장뿐만 아니라 수중의 병원성 미생물의 살균목적으로 일상생활에서 다양하게 이용되기 때문에 할로겐화 파라벤류는 폐수, 강물 및 수영장 물에서 파라벤류 보다 높은 농도로 검출되는 경우도 있다.
파라벤류에 비해 할로겐화 파라벤류는 물벼룩에 대한 만성 독성과 에스트로겐 활성은 더 낮은 것으로 보고[20,21]되어 있으나 Daphinia와 Vibrio에 대해서는 더 높은 급성 독성을 유발하는 것으로 알려져 있다[11]. 또한, methylparaben (MP)과 dichloro-methylparaben (di-Cl2-MP)에 대해 수중 미생물에 독성을 유발하는 농도를 조사한 Li 등[22]의 연구결과에서 MP의 경우 23.8 ng/L에서 독성을 유발한 반면, Cl2-MP의 경우는 19.1 ng/L의 더욱 낮은 농도에서 독성을 유발하는 것으로 보고하고 있다. 할로겐화 파라벤류는 파라벤류에 비해 친유성 및 소수성이 증가되며[23], 이러한 특성으로 인해 생물학적 수처리 공정에서 파라벤에 비해 생분해능이 큰 폭으로 감소하는 것으로 보고하고 있다[15,22].
낙동강 수계에서 파라벤류의 검출특성에 대해 조사한 Yoom 등[24]의 연구결과에서는 낙동강 본류에서 MP의 검출빈도(100%)와 검출농도(2.4~44.2 ng/L)가 가장 높았으며, 특히 하절기에 검출농도가 증가하는 것으로 보고하고 있다. 낙동강 하류에 위치한 대규모 정수장들은 조류의 살조 및 pH 저하목적으로 전염소 처리공정을 운영[25]하고 있는 상황을 고려할 경우, 원수에 잔존하는 MP가 전염소 처리에 의해 할로겐화 MP로 전환되어 후단의 정수처리 공정으로 이송될 가능성이 높다. 또한, MP의 농도가 상승하는 하절기에는 조류의 과다 번성으로 인하여 전염소 농도를 더욱 높여서 정수장을 운영하기 때문에 유입 원수에 MP가 잔존할 경우, 할로겐화 MP로의 전환율은 더욱 높아질 것이다.
낙동강 수계에 위치한 대규모 정수장들은 고도 정수처리공정의 일종인 생물활성탄(biological activated carbon, BAC)공정을 운영 중에 있다. 생물활성탄 공정은 수중에 함유된 미량 오염물질들을 효과적으로 제거할 수 있는 공정[26]으로 운전 초기에는 흡착이 주요 제거기작이나 운전 기간이 증가함에 따라 박테리아들이 자연적 부착으로 인한 생물막(biofilm)의 형성으로 생물분해능이 점진적으로 증가한다[26].
본 연구에서는 낙동강 하류에 위치한 정수장에 할로겐화 MP가 유입된 경우, 또는 MP가 유입되어 전염소 처리에 의해 할로겐화 MP로 전환되어 후단공정으로 유입될 경우, BAC공정에서 이들의 제거능을 평가하는 것이 본 연구의 목적이다. BAC 공정에서의 생물분해능은 수온의 변화와 공탑체류시간(empty bed contact time, EBCT)에 많은 영향[27]을 받기 때문에 유입수의 수온과 EBCT의 변화에 따른 MP와 5종의 할로겐화 MP에 대한 제거능을 평가하였다. 또한 생물분해 동력학 평가를 통하여 정수장의 BAC 공정으로 MP와 할로겐화 MP류가 유입될 경우에 이들의 완전 제거에 필요한 EBCT의 예측이 가능하도록 하는 것이 목적이다.
2. 실험재료 및 방법
2.1. MP, 할로겐화 MP류 및 유입수 성상
분석 및 제거실험에 사용된 모든 MP 및 할로겐화 MP류는 순도 95% 이상의 표준물질급을 사용하였다. MP는 Sigma-Aldrich사(USA)에서 구매하였으며. 5종의 할로겐화 MP의 경우, Cl-MP (chloro-methylparaben), Cl2-MP (3,5-dichloromethylparaben) 및 Br-MP (bromo-methylparaben)는 Fluorochem사(UK)에서 구매하였고, Br,Cl-MP (3-bromo,5-chloromethylparaben)은 FCH Group사(Ukraine)에서 구매하였으며, Br2-MP (3,5-dibromo-methylparaben)은 TCI사(Japan)에서 구매하여 실험에 사용하였다. 내부 표준물질로 사용된 d4-MP (methyl 4-hydroxybenzoate-2,3,5,6-d4)는 CDN Isotopes사(Canada)의 제품을 사용하였다.
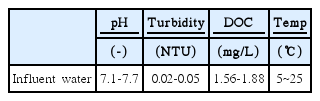
실제 정수장의 BAC 공정과 동일한 운전조건으로 실험을 수행하기 위하여 유입수로는 pilot-plant(처리용량: 300톤/일)의 후오존 처리수를 실험에 사용하였다. MP 및 5종의 할로겐화 MP류를 잔류오존이 제거된 후오존 처리수에 투입하여 lab-scale biofilter와 BAC 컬럼으로 유입되는 MP 및 5종의 할로겐화 MP류 각각의 농도가 100 ng/L가 되도록 하였다. Table 1에는 실험에 사용된 유입수(후오존 처리수)의 성상을 나타내었다.
2.2. Lab-scale BAC와 biofilter 컬럼 운전조건
본 실험에서는 석탄계 재질의 BAC (F400, Calgon, USA)와 anthracite-biofilter(한국 안트라사이트)를 이용하여 MP와 5종의 할로겐화 MP에 대한 생물분해능을 평가하였다. BAC와 biofilter에 사용된 활성탄과 안트라사이트의 입경은 8~30 mesh로 후오존 공정이 설치된 100톤/일 규모의 pilotplant에서 3.8년 정도(운전 bed volume : 203,000 정도) 사용한 것을 실험에 사용하였다. Pilot-plant에서 BAC와 안트라사이트를 채집하여 lab-scale의 컬럼들에 실험조건에 맞추어 충진하고 수온을 20℃로 조절하여 2주간 순응시킨 후 각각의 컬럼 표층 부분의 생물활성탄과 안트라사이트를 채집하여 부착 박테리아 생체량과 활성도를 측정한 결과를 Table 2에 나타내었다. 활성탄(BAC)의 경우가 안트라사이트(biofilter)에 비해 생체량은 22배, 활성도는 1.5배 정도 높게 나타났다.
Lab-scale BAC 및 biofilter 컬럼의 운전은 후오존 처리수에 각각 100 ng/L의 농도로 80 L 용량의 유입수 조에 투입 후 정량펌프를 사용하여 유입수 조에서 18 mL/min으로 분배조로 이송한 후 6개의 투명 아크릴 컬럼(직경 2 cm, 길이 20 cm)으로 3 mL/min씩 균등하게 분배되도록 하였다. 컬럼 내 활성탄을 각각 15, 30, 45 mL씩 충진하여 EBCT가 5, 10, 15분이 되도록 조절하였고, 6개의 컬럼들은 하향류 방식으로 운전하였으며, 개략적인 시스템의 개략도를 Fig. 1에 나타내었다. 역세척은 각각의 컬럼 하부로 처리수를 공급하여 활성탄 층이 50% 정도 팽창되도록 하여 주 1회 실시하였고, 공세는 실시하지 않았다. 컬럼 내부의 수온변화는 Fig. 1에서와 같이 수온조절 장치(Buchi, Recirculating chiller B-740, Swiss)를 이용하여 수온을 5℃, 15℃ 및 25℃로 조절하였으며, 수온 조절 후 4주간 변화된 수온에 대한 순응기간을 거친 후 실험을 실시하였다.
2.3. 회분식 생물분해 실험
MP 및 할로겐화 MP류에 대한 회분식 생물분해 실험은 Son 등[28]의 방법을 이용하였다. 300 mL BOD병에 무기 영양염을 보충[29]한 순수 200 mL를 채운 후, MP 및 할로겐화 MP류 5종을 1종씩 각각 100 ng/L의 농도로 각각의 BOD병에 투입하였다. 종속영양성 박테리아의 식종을 위해 3년 6개월간 운전한 BAC 컬럼의 상층부에서 생물활성탄을 채집하였다. 채집된 생물활성탄 1 g(습중량)을 생리식염수 20 mL가 담긴 멸균된 비이커에 투입한 후 초음파 처리하여 생물활성탄에 부착된 박테리아들을 탈리시켰다. 200 mL의 시료수(BOD병)들에 탈리된 부착 박테리아 식종액을 2 mL씩 투입한 후 4종의 에스트로겐류가 각각 함유된 4개의 BOD병을 shaking incubator (HB201SF, 한백과학)에서 20℃, 150 rpm의 조건으로 배양하면서 회분식 생물분해 실험을 수행하였다.
2.4. MP 및 할로겐화 MP류 분석
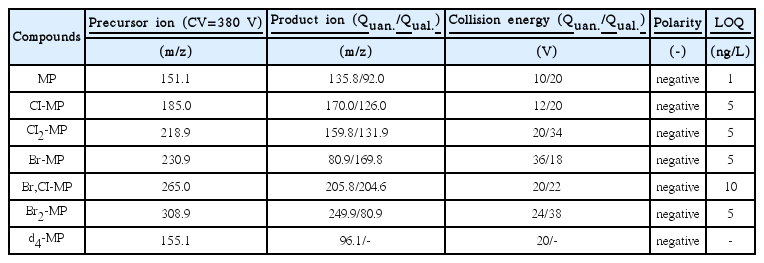
MP 및 할로겐화 MP류의 분석에는 on-line SPE가 장착된 LC-MS/MS를 사용하였다. SPE 카트리지는 Agilent사의 PLRP-S (2.1 × 12.5 mm, 15~20 μm)를 사용하였다. 시료 분석시 autosampler에서 시료 900 μL를 취하여 SPE 카트리지에 농축시킨 후 LC의 이동상으로 SPE 카트리지에 흡착(농축)된 파라벤류를 LC 분석컬럼으로 용출시켰다. LC 컬럼은 Agilent사의 poroshell EC-C18 (100 × 2.1 mm, 2.7 μm)을 사용하였다. 흡착된 파라벤류의 용출이 끝난 SPE 카트리지는 IPA/ACN/MeOH 혼합용액으로 세척 후, MeOH와 순수로 재활성화(reconditioning)시켰다. 용매와 LC의 tubing들에서 극미량으로 용출되는 파라벤류를 분석 대상시료의 파라벤피크와 분리하여 실제 시료에 잔존하는 농도보다 높게 측정되는 것을 방지하기 위해 trapping 컬럼(50 × 4.6 mm, 5 μm, Agilent)을 SPE 카트리지 전단에 장착하였다. 물질의 분리를 위한 이동상은 5 mM ammonium acetate + 0.05% formic acid (solvent A)와 ACN + 0.1% formic acid (solvent B)이며, 대상물질의 효율적인 분리를 위해 시간에 따른 두 가지 용매의 분율을 달리하였으며, 이동상, 용리조건 및 기기조건은 Table 3에 나타내었다.
MS/MS 분석조건은 가장 감도가 낮은 물질이 최적으로 분석되는 조건을 선정하였으며, MS/MS의 분석조건을 Table 4에 나타내었다.
3. 결과 및 고찰
3.1. 회분식 생물반응기에서 MP와 할로겐화 MP류의 생물분해 특성
호기성 조건에서 박테리아에 의한 파라벤의 생물분해 단계는 에스테르 결합의 가수분해가 유발되어 파라벤이 p-hydroxybenzoic acid (p-HBA)로 전환되고, 이어서 탈카르복실화에 의해 페놀로 전환된다[30]. 호기성 박테리아에 의해 파라벤에서 p-HBA로의 전환은 비교적 빠른 반면, p-HBA에서 페놀로의 전환은 비교적 느린 것으로 보고하고 있다[30].
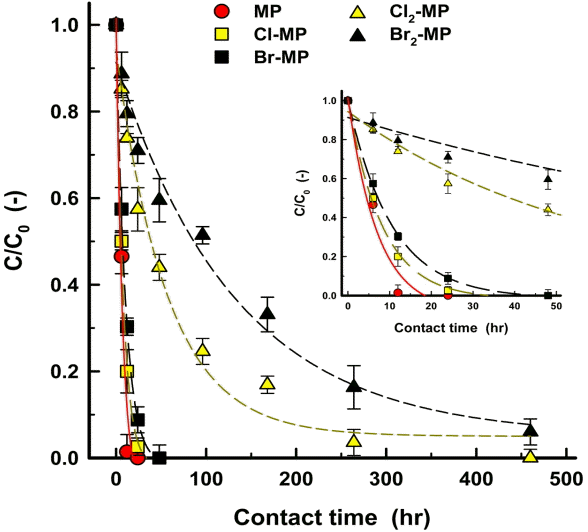
생물활성탄 부착 박테리아 식종액을 각각의 회분식 생물반응기에 식종한 후 배양시간 경과에 따른 MP, Cl-MP, Br-MP, Cl2-MP 및 Br2-MP의 잔존비(C/C0) 변화를 Fig. 2에 나타내었다. Fig. 2에서 볼 수 있듯이 MP, Cl-MP 및 Br-MP의 경우, 배양 초기부터 급격하게 잔존비가 감소하는 것으로 나타나고 있다. MP는 배양 24시간 후에 100% 제거되었고, Cl-MP와 Br-MP는 배양 48시간 이후에 100% 제거된 것으로 나타났다. 반면 Cl2-MP와 Br2-MP의 경우는 배양 480시간 이후에 각각 100%와 94%의 제거율을 나타내어 MP, Cl-MP 및 Br-MP에 비해 90% 이상 제거에는 매우 긴 배양시간을 요하는 것으로 나타났다.
Table 5에 나타낸 생물분해 속도상수(kbio)와 반감기(t1/2)를 살펴보면 MP의 경우 kbio와 t1/2이 각각 0.1676 hr-1과 4.1 hr인데 비해 Cl-MP는 0.1265 hr-1과 5.5 hr, Br-MP는 0.0978 hr-1과 7.1 hr, Cl2-MP는 0.0149 hr-1과 46.5 hr, Br2-MP는 0.0066 hr-1과 105.0 hr로 나타나 Cl-MP의 경우 MP에 비해 1.3배 정도 느린 생물분해능을 나타내었으며, Br-MP는 1.7배, Cl2-MP는 11.2배, Br2-MP는 25.4배 정도 생물분해능이 낮은 것으로 나타났다.
MP 및 할로겐화 MP에 대해 하수처리장의 활성슬러지를 이용하여 회분식 생물분해 실험을 수행한 González-Mariño 등의 연구결과[15]에서는 MP, Cl-MP, Cl2-MP 및 Br2-MP의 반감기(t1/2)가 각각 1.8일, 3.3일, 8.6일 및 9.7일로 보고하고 있어 MP에 비해 할로겐화 MP의 경우 1.8배~5.4배 정도 생물분해능이 낮은 것으로 보고하고 있다. 일반적으로 할로겐화 부산물의 경우, 할로겐족 원소의 수가 증가할수록, Cl 보다는 Br과의 결합에 의해 생물분해능이 큰 폭으로 감소한다[31]. BAC 공정에서 HAA (haloacetic acid) 5종의 생물분해 특성을 평가한 Son 등의 연구결과에서 수온 20℃에서의 monochloro-AA의 생물분해 속도상수(k, min-1)가 0.9211 min-1에 비해 dichloro-AA, dibromo-AA 및 trichloro-AA의 생물분해 속독상수의 경우는 각각 0.6444 min-1, 0.5077 min-1 및 0.1842 min-1으로 나타나 할로겐족 원소의 수가 증가할수록 그리고 Cl 보다는 Br과의 결합에 의해 생물분해 속도상수가 급격히 감소하는 것으로 보고하고 있다[32].
3.2. MP와 할로겐화 MP류의 생물분해 경로
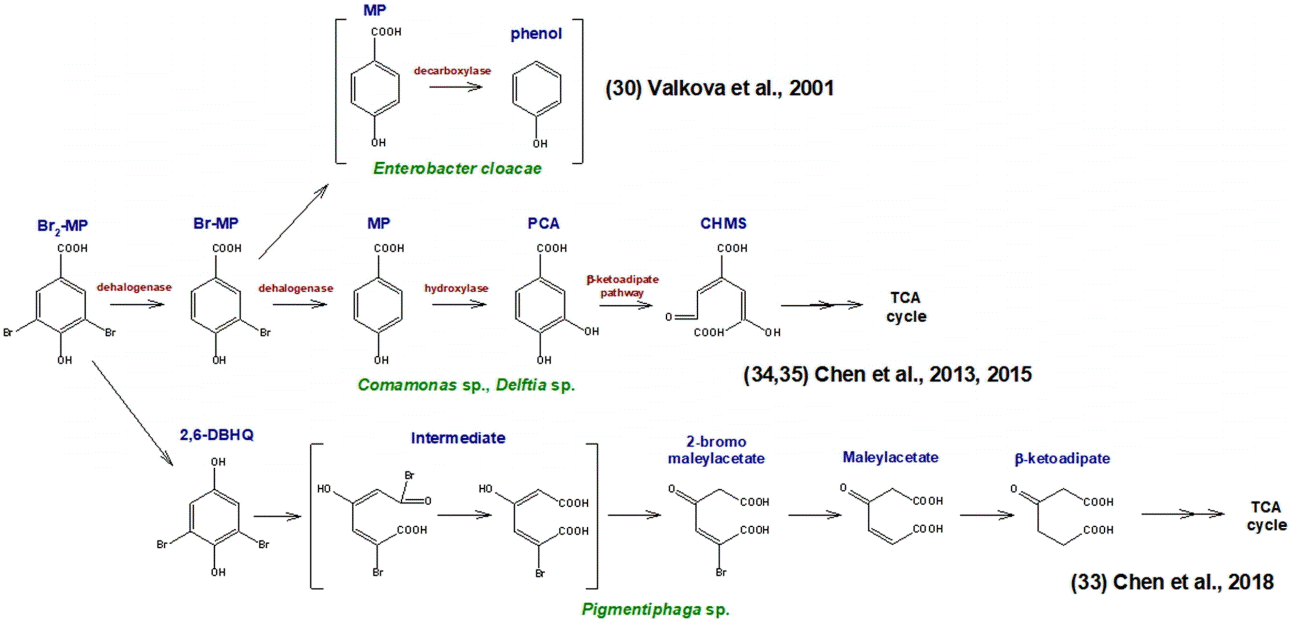
회분식 생물분해 실험결과(Fig. 2)에서 생물분해능이 가장 낮은 것으로 평가된 Br2-MP에 대해 회분식 생물분해 반응기의 체류시간별 LC-MS/MS 분석 크로마토그램을 Fig. 3에 나타내었다. Fig. 3에서 볼 수 있듯이 4.4분대의 Br2-MP peak가 회분식 생물반응기에서의 접촉시간이 증가할수록 점진적으로 감소하고, 5.2분대의 Br-MP peak와 4.5분대의 MP peak가 새로이 생성되어 증감하고 있는 현상을 나타내고 있다. 이는 회분식 생물반응기에서 Br2-MP의 생물분해 경로를 대략적으로 유추할 수 있는 결과로 Br2-MP가 Br-MP로 전환된 후, Br-MP가 MP로 전환되는 과정을 나타낸다. 호기성 박테리아인 Comamonas sp.와 Delftia sp.를 이용하여 Br2-MP의 생물분해 메카니즘에 대해 연구한 Chen 등의 연구결과[33,34]에서도 Br2-MP의 생물분해시 중간생성물질로 Br-MP와 MP가 생성되는 것으로 보고하고 있다.
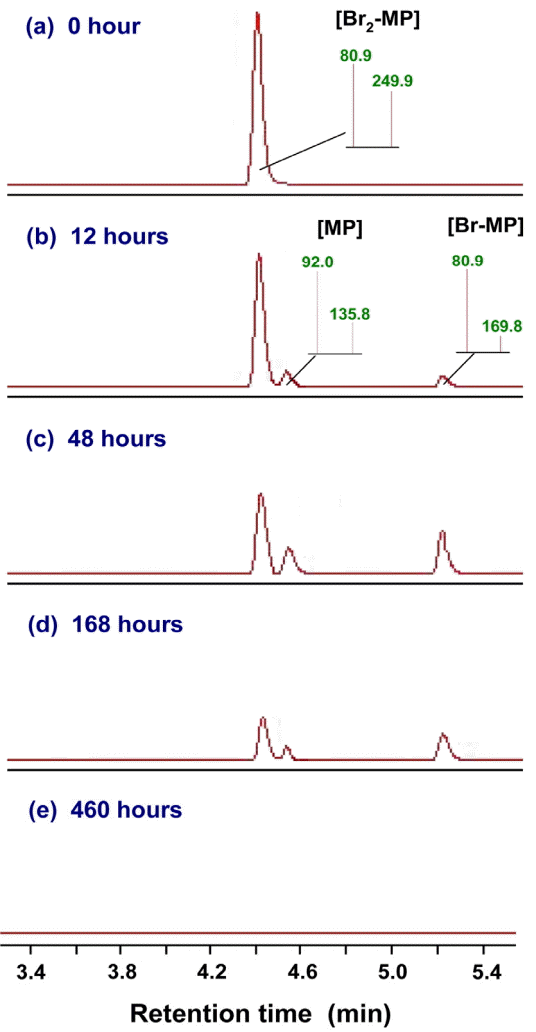
Variations of total ion chromatograms according to contact times in the batch biodegradation test of Br2-MP.
호기성 박테리아에 의한 할로겐화 MP (Br2-MP)의 생물분해 메카니즘에 대한 기존의 연구결과들을 정리하여 Fig. 4에 나타내었다. 앞에서 언급한 Comamonas sp.와 Delftia sp.는 Br2-MP를 Br-MP, MP, PCA (protocatechuate), CHMS (4-carboxy-2-hydroxymuconate-6-semialdehyde) 등으로 생물분해하는 것으로 보고하고 있다[33,34]. 또한, 최근의 연구결과[35]에서는 Pigmentiphaga sp.에 의해 Br2-MP는 2,6-DBHQ (2,6-dibromohydroquinone)로 전환되어 고리열림(ring cleavage)이 먼저 유발된 후 2-bromomaleylacetate, maleylacetate 및 β-ketoadipate로 분해가 진행되는 것으로 보고하고 있어 박테리아 종에 따른 Br2-MP의 생물분해 경로는 다양한 것으로 나타났다. Enterobacter cloacea의 경우는 MP를 최종적으로 페놀로 생물분해한다[30].
Chen 등[35]은 Br2-MP의 생물분해에 관여할 수 있는 박테리아 종으로 Pseudomonas sp., SphingomonasC sp. 및 Burkholderia sp. 등을 언급하고 있으며, 이러한 박테리아 종들은 낙동강 원수를 정수처리하는 BAC 공정에서 우점종들로 분포하는 종들로 알려져 있다[36,37].
3.3. BAC와 biofilter 공정에서의 MP 및 할로겐화 MP류의 생물분해 특성
3.3.1. EBCT 변화에 따른 MP 및 할로겐화 MP류의 생물분해 특성
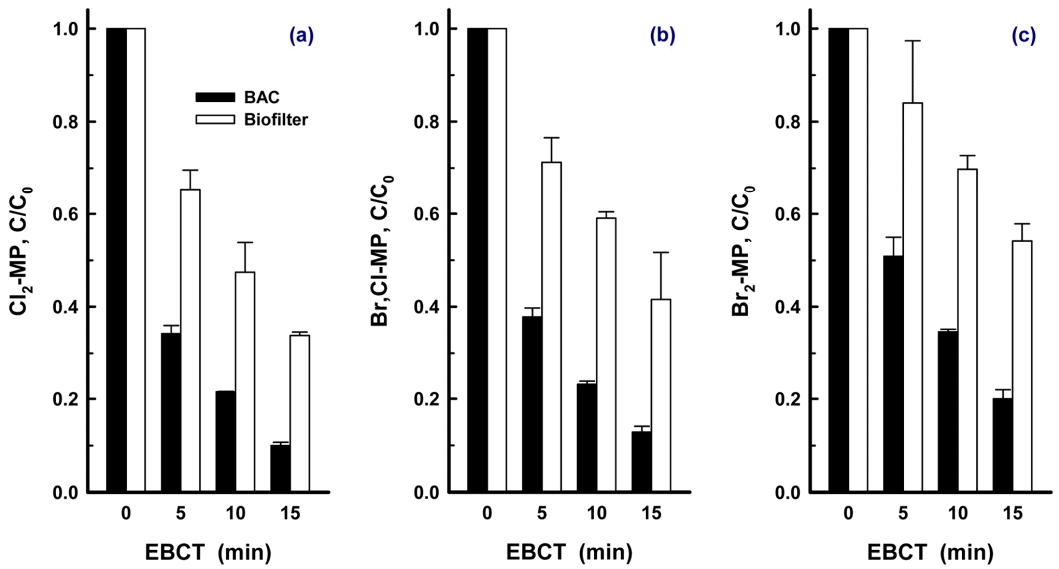
유입수의 수온이 15℃일 때 할로겐화 MP류 3종 각각을 100 ng/L의 농도로 개별 투입하여 BAC 및 biofilter에서의 EBCT 5분~15분에 대한 제거율 평가결과를 Fig. 5에 나타내었다. MP, Cl-MP 및 Br-MP의 경우는 BAC와 biofilter 모두 EBCT 5분에서 모두 제거되어 Fig. 5에는 나타내지 않았다, Fig. 5(a)에 나타낸 BAC와 biofilter에서의 Cl2-MP의 제거율을 살펴보면 EBCT 5분~15분에서 각각 66%~90% 및 35%~67%로 나타났다. 또한 Br,Cl-MP와 Br2-MP의 경우, BAC와 biofilter에서 EBCT 5분~15분에서의 제거율이 각각 62%~87%와 29%~58% 및 49%~80%와 16%~46%로 나타나 회분식 생물분해 실험에서와 같이 Br2-MP의 생물분해 제거능이 가장 낮은 것으로 나타났다.
Fig. 5((a)~(c))에서 볼 수 있듯이 BAC와 biofilter에서의 할로겐화 MP의 제거율에는 많은 차이를 보인다. 이는 BAC의 여재인 활성탄과 biofilter의 여재인 안트라사이트가 가지는 여재특성의 차이에서 기인한 결과로 활성탄에는 세공(pore)과 흡착능이라는 박테리아의 서식에 유리한 장점이 있다. 즉, 세공은 박테리아의 부착과 서식에 유리한 서식지를 제공하며, 흡착능은 지속적으로 능동적인 유기 탄소원의 공급원 역할을 수행한다. 반면 안트라사이트는 흡착능이 없기 때문에 유기탄소원의 공급측면에서도 활성탄에 비해 수류의 흐름에 따라 생물막으로 전달되는 유기 탄소원을 제거하는 매우 수동적인 제거 메카니즘을 가진다[36]. 따라서 여재의 이러한 특성들로 인하여 BAC와 biofiter에서의 할로겐화 MP류의 제거율에 많은 차이를 나타내었다.
3.3.2. 수온 변화에 따른 MP 및 할로겐화 MP류 생물분해 특성
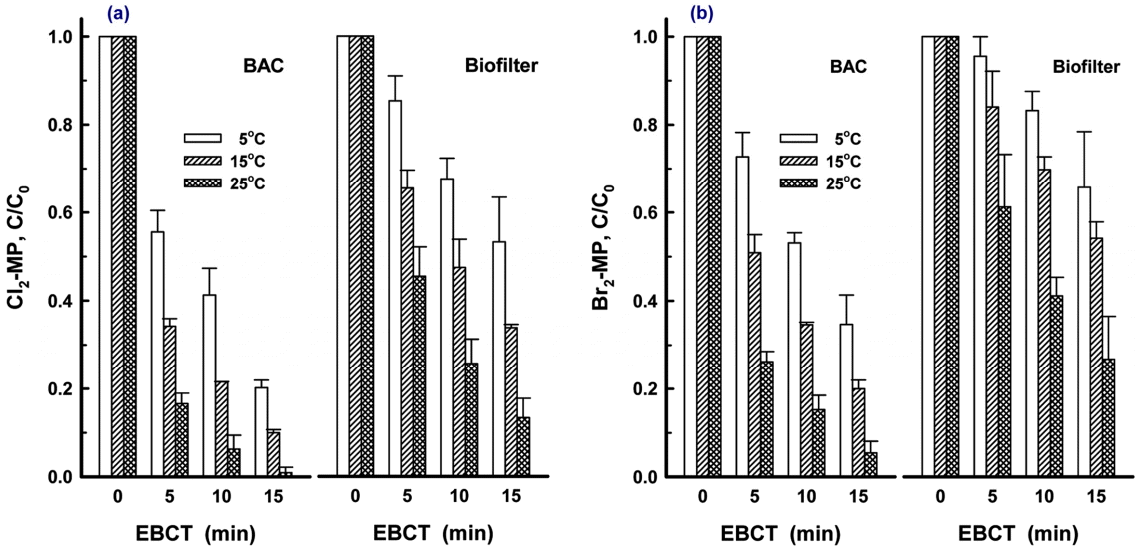
BAC와 biofilter에서 유입수의 수온변화에 따른 MP 및 할로겐화 MP류에 대한 생물분해 특성 평가하였으며, Cl2-MP와 Br2-MP의 결과를 Fig. 6에 나타내었다.
수온변화에 따른 BAC와 biofilter에서의 MP 및 할로겐화 MP류의 생물분해 특성을 살펴보면 Fig. 6에는 나타내지는 않았으나 MP, Cl-MP 및 Br-MP의 경우는 수온 5℃, EBCT 5분의 조건에서 모두 제거되었다.
Cl2-MP의 생물분해 특성을 나타낸 Fig. 6(a)를 보면 수온이 5℃, 15℃ 및 25℃일 때 BAC 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 44.5%~79.8%, 65.8~90.0% 및 83.4%~99.1%로 나타났다. 또한, 수온이 5℃, 15℃ 및 25℃일 때 biofilter 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 14.7%~46.8%, 34.6%~66.2% 및 54.6%~86.7%로 나타났다.
반면, 할로겐화 MP류 5종 중 회분식 생물분해 실험에서 생물분해능이 가장 낮았던 Br2-MP에 대해 BAC와 biofilter에서의 수온 5℃, 15℃ 및 25℃에서의 생분해 특성을 나타낸 Fig. 6(b)를 보면 BAC 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 27.3%~65.3%, 49.15%~80.0% 및 73.8%~94.6%로 나타났다. 또한, 수온이 5℃, 15℃ 및 25℃일 때 biofilter 컬럼에서 EBCT 5분~15분에서의 제거율은 각각 4.5%~34.4%, 16.0%~45.9% 및 38.8%~73.2%로 나타났다. 유입수의 수온변화에 따라 BAC와 biofilter 공정에서의 할로겐화 MP류에 대한 제거효율에는 많은 차이가 유발되었으며, BAC와 biofilter 공정에서 에스트로겐류 4종의 생물분해 특성을 평가한 Son 등의 연구결과[27]에서도 수온의 변화가 이들의 제거율에 가장 큰 영향을 미치는 인자로 평가하고 있다.
따라서 수온이 낮은 동절기에 Br2-MP가 BAC 공정으로 유입될 경우, 15분 이상의 EBCT에서도 완전한 제거가 어렵기 때문에 상수원에서 MP가 검출되면 전염소 처리를 중단하여 MP가 di-halo-MP류로의 전환되는 것을 방지해야 한다. 또한, Fig. 3과 Fig. 4에서와 같이 di-halo-MP류의 생물분해 중간생성물질로 MP가 생성되기 때문에 BAC 공정에서 충분한 EBCT로 처리되지 않을 경우, BAC 처리수에 MP가 잔존하여 후염소 처리에 의해 배·급수관망에서 염소와 반응하여 할로겐화 MP로 전환될 가능성이 있어 이에 대한 추가적인 연구가 필요한 실정이다.
3.4. BAC와 biofilter 공정에서의 MP 및 할로겐화 MP류의 생물분해 동력학 평가
BAC 및 biofilter 공정의 각각의 EBCT에서의 수온변화에 따른 MP 및 할로겐화 MP류의 생물분해율을 이용하여 pseudo-first order rate로 생물분해 속도상수(biodegradation rate constant, kbio)와 반감기(half-life, t1/2)를 구하였다(식 (1)과 식 (2)). 식 (1)과 식 (2)에서 C는 반응시간 후 농도, C0는 초기 농도, kbio는 생물분해 속도상수, t는 반응시간(EBCT)이다.
BAC와 biofilter 공정에서 유입수 수온이 5℃, 15℃ 및 25℃일 때의 3종의 di-halo-MP류에 대한 생물분해 속도상수(kbio)와 반감기(t1/2)를 Table 6에 나타내었다. MP, Cl-MP 및 Br-MP의 경우는 수온 5℃~25℃의 EBCT 5분~15분의 모든 조건에서 100% 제거되어 생물분해 속도상수(kbio)와 반감기(t1/2)를 구할 수 없었다.

Biodegradation rate constants (kbio) and half-lives (t1/2) for 3 halogenated MPs at various water temperatures
수온 5℃~25℃일 때, 가장 낮은 생물분해율을 나타낸 Br2-MP의 경우, BAC 컬럼에서 kbio와 t1/2이 각각 0.0671 min-1~0.2358 min-1 및 2.9 min~10.3 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0259 min-1~0.0898 min-1 및 7.7 min~26.8 min이었다. 또한, di-halo-MP류 중에서 가장 빠른 생물분해능을 나타낸 Cl2-MP의 경우는 수온 5℃~25℃일 때 BAC 컬럼에서 kbio와 t1/2이 각각 0.1005 min-1~0.3458 min-1 및 2.0 min~6.9 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0411 min-1~0.1428 min-1 및 4.9 min~16.9 min이었다.
따라서 수온이 5℃에서 25℃로 상승시 BAC 및 biofilter에서의 di-halo-MP류의 제거속도는 각각 3.4배~3.5배 및 3.1배~3.5배 정도 증가하였다. 또한, 물질별로는 Br,Cl-MP 및 Br2-MP의 경우는 Cl2-MP에 비해 각각 1.1배~1.3배 및 1.5배~1.9배 정도 느린 생물분해능을 나타내었다.
4. 결 론
BAC 공정에서 EBCT 및 수온변화에 따른 MP 및 할로겐화 MP류 5종에 대한 생물분해 제거특성을 조사한 결과, 다음과 같은 결론을 얻을 수 있었다.
1) MP와 할로겐화 MP류 5종의 생물분해능은 MP가 가장 높았으며, Cl-MP, Br-MP, Cl2-MP, Br,Cl-MP 및 Br2-MP 순으로 나타났다.
2) MP, Cl-MP 및 Br-MP는 수온 5℃에서도 EBCT 5분에서 완전 제거되었으나, Cl2-MP와 Br2-MP의 경우는 EBCT 15분에서도 각각 79.8%와 65.3% 제거되었으며, 수온 25℃, EBCT 15분의 조건에서도 각각 99.1% 및 94.6%의 제거율을 나타내어 BAC 공정에서 제어하기가 어려운 물질로 평가되었다.
3) BAC 공정에서 수온 5℃~25℃에서의 Br2-MP의 생물분해 속도상수(kbio)와 반감기(t1/2)는 각각 0.0671 min-1~0.2358 min-1 및 2.9 min~10.3 min이었으며, Cl2-MP의 경우는 kbio와 t1/2이 각각 0.1005 min-1~0.3458 min-1 및 2.0 min~6.9 min이었다.
4) Cl2-MP, Br,Cl-MP 및 Br2-MP의 생물분해 중간생성물질로 MP가 생성되며, BAC 공정 처리수 중에 MP가 잔존할 경우 후염소 처리에 의해 할로겐화-MP류의 재생성 가능성이 있어 이에 대한 추가적인 연구가 필요하였다.