하수처리의 탈인 흡착제로서 아민형 poly-GMA의 활용성 평가
Applicability of Aminated Poly-GMA as an Adsorbent for Phosphorus Removal in Sewage Treatment
Article information
Abstract
본 연구는 하수로부터 PO4-P 이온을 제거하기 위한 흡착제로서 아민형 poly-GMA의 활용 가능성을 평가하는데 초점을 두고 있다. 하수로부터 PO4-P 제거를 위한 아민형 poly-GMA의 흡착특성은 회분식과 고정층 칼럼 실험을 통해 조사하였다. 아민형 poly-GMA는 상용의 음이온교환수지와 비교하여 PO4-P에 대한 흡착능과 흡착선택성이 뛰어났지만 아민형 poly-GMA에 의한 PO4-P 제거 역시 하수 중에 공존하는 음이온, 특히 SO42- 이온에 의해 크게 영향을 받았다. 아민형 poly-GMA의 PO4-P 제거효율은 흡착경쟁이온의 제거 또는 pH 조절과 같은 하수의 전처리를 통해 어느 정도 향상시킬 수 있었다. 아민형 poly-GMA 흡착제는 단순한 소금물 세척과정을 통해서 흡착능 저하 없이 재생할 수 있었다.
Trans Abstract
This study focused on evaluating the applicability of aminated poly-glycidyl methacrylate (poly-GMA) as an adsorbent for the removal of PO4-P ion from sewage effluent. The adsorption properties of aminated poly-GMA for PO4-P removal from sewage were investigated in a batch mode and fixed bed columns. Although aminated poly-GMA have superior adsorption capacity and selectivity for PO4-P compared to the commercially available anion-exchange resin, the PO4-P removal by aminated poly-GMA was also significantly affected by the presence of coexisting anions, especially SO42- ion, in sewage. The removal efficiency of PO4-P by aminated poly-GMA could be improved considerably by a pretreatment of sewage such as the removal of competing anions or the control of pH. The aminated poly-GMA adsorbent could be regenerated by a simple washing process using NaCl solution without significantly lowering the adsorption capacity.
1. 서 론
최근 강이나 하천에서 녹조의 발생이 매년 심각한 수준에 이르게 됨에 따라 조류발생을 억제하기 위해 많은 노력이 이루어지고 있다. 일반적으로 조류의 발생요인은 온도, 햇빛, 체류시간, 영양염류 등으로 알려져 있다. 이들 중 인위적으로 제어 가능한 요인은 영양염류이며, 특히 인이 조류 발생의 가장 중요한 원인물질로 작용한다고 알려져 있다. 2012년부터 공공하수처리장의 총인에 대한 방류수 수질기준이 기존 2.0 mg/L에서 0.2~0.5 mg/L로 강화되었다. 이에 따라 하수 처리공정에서 생물학적 처리공법만으로는 강화된 방류수 수질기준을 충족하는데 한계가 있어 탈인시설이 빠르게 도입되고 있다[1]. 현재 도입되고 있는 탈인시설은 대부분 약품을 투입하여 총인을 슬러지로 석출 제거하는 화학적 처리공법이다[2]. 현재 화학적 탈인처리는 주로 알루미늄계와 철염계 응집제를 사용하여 인을 불용화시켜 분리제거하는 것으로 비교적 처리공정이 간단하면서도 처리효율이 높다는 장점이 있는 반면에 응집조건을 최적화하지 못할 경우 오히려 부정적인 영향을 초래할 수 있고, 추가적으로 약품비용과 슬러지 처분비용 등이 소요된다는 단점이 있다[3~5].
흡착법 또는 이온교환법은 미량으로 용존하는 이온성 물질을 효율적으로 제거할 수 있고 슬러지와 같은 부산물의 발생이 거의 없을 뿐만 아니라 처리공정과 유지관리가 단순하면서도 용이하다는 장점을 가지고 있어, 탈인시설과 같은 고도처리시스템을 구축하는데 있어 가장 적용하기 쉬운 단위공정 중 하나이다[6]. 현재까지 음이온성 영양염류를 제거하기 위해 다양한 흡착제가 개발되었고, 일부는 그 우수성이 인정되고 있지만[7~10] 낮은 흡착능, 심각한 흡착경쟁, 재생의 비효율성 등의 문제로 아직까지 이들 흡착제를 이용한 흡착법이 하수처리의 고도처리시스템으로 적용된 사례는 없는 실정이다. 흡착법이 경쟁력 있는 하수의 탈인시설로 적용되기 위해서는 인산성 인(PO4-P)에 대해 보다 높은 흡착능과 흡착선택성을 갖는 흡착제의 개발이 여전히 선결되어야 하는 주요과제로 남아 있다.
본 연구실에서는 PO4-P에 대해 높은 흡착능과 흡착선택성을 갖는 고분자 흡착제를 개발하여 왔다[11~13]. 최근 라디컬 중합반응과 표면개질반응을 통해 아민형 glycidyl metha crylate 중합체(poly-GMA)를 제조하고 그 성능을 평가한 결과, diethylenetriamine (DETA)으로 아민화한 poly-GMA 흡착제가 PO4-P에 대해 매우 높은 흡착능과 흡착선택성을 보여 하․폐수 중의 인 제거용 흡착제로 활용 가능성이 높다고 보고한 바 있다[14]. 그러나 선행연구 결과는 인공폐수를 이용한 회분식 흡착실험을 통해 얻은 것으로 실제 폐수와 처리장치의 조건을 반영하지는 못하였다. 본 연구는 상기의 선행연구를 바탕으로 아민형 poly-GMA 흡착제를 제조하고, 실폐수 조건에서 PO4-P에 대한 흡착능과 흡착선택성을 회분식과 고정층 칼럼식 흡착실험을 통해 재평가하는데 목표를 두고 있다. 지금까지 국내는 물론 국외에서도 하수와 같은 실폐수를 대상으로 흡착제의 탈인 성능을 평가한 사례는 찾기 어렵다. 본 연구를 통해 하수처리의 탈인공정으로 흡착법을 적용하는데 있어 고려되어야 할 기초적 자료를 제공하고자 한다.
2. 실험재료 및 방법
2.1. 실험재료 및 시약
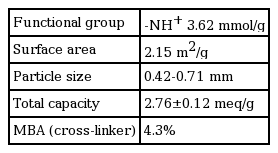
단량체인 glycidyl methacrylate (GMA, 98%, Junsei)는 구입한 그대로 정제과정 없이 사용하였다. GMA 중합반응의 개시제로는 potassium peroxydisulphate (K2S2O8)를, 가교제로는 N,N'-methylene-bis-acrylamide (MBA, Aldrich)를, 반응용매로는 cyclohexane, 계면활성제로는 Tween-80을 각각 사용하였다. 아민화 시약으로는 diethylenetriamine (DETA, 97%, Deajung)을 사용하였다. 흡착실험용 인공폐수는 Na2HPO4 적정량을 증류수, 아세트산 완충용액(pH 4.7) 또는 하수처리수에 용해시켜 제조하였다. 하수처리수로는 M시 NH하수종말처리장에서 방류수를 채취하여 사용하였다(Table 1). 흡착경쟁 음이온 원으로는 NaCl, NaNO3, Na2SO4를 사용하였다. 비교 흡착제로는 삼양사의 강염기성 음이온교환수지(PA308, -N+(CH3)3Cl-)를 사용하였다.
2.2. 흡착제의 제조
아민형 poly-GMA 흡착제의 제조과정은 Fig. 1과 같다. 먼저 500 mL의 삼구플라스크형 반응조에 증류수 170 mL, K2S2O8 1 g과 MBA 0.5 g을 투입하고 기계식 교반기(300 rpm)를 이용하여 약 5분간 혼합하였다. 이 혼합액에 GMA 15 mL, cyclohexane 15 mL와 Tween-80 0.5 g을 혼합한 단량체 용액을 첨가한 다음 70℃에서 4시간 동안 교반(150 rpm)하면서 GMA의 중합을 유도하였다. 이 반응에서 생성된 GMA 중합체는 분리하여 증류수와 메탄올로 세척하고 60℃에서 완전히 건조하였다. 건조된 GMA 중합체는 표준체를 이용하여 20~40 mesh (0.42~0.71 mm)로 입도를 조절한 다음 흡착제 제조에 사용하였다. GMA 중합체의 아민화는 100 mL 유리병에 GMA 중합체 5 g과 EDA 50 mL를 넣고 60℃에서 4시간 동안 반응시키는 방법으로 실시하였다. 아민화된 GMA 중합체는 미반응 아민이 완전히 제거될 때까지 증류수로 세척한 다음 60℃에서 완전히 건조하였다. 제조된 아민형 poly-GMA 흡착제의 물리화학적 특성을 Table 2에 정리하여 나타내었다.
2.3. 흡착특성평가
아민형 poly-GMA의 흡착특성은 인공폐수와 하수처리수를 대상으로 회분식과 칼럼식 흡착실험을 바탕으로 평가하였다. 회분식 흡착실험은 흡착질 용액 100 mL에 아민형 poly-GMA 흡착제 0.01~0.1 g을 투여하고 회전식 항온교반기를 이용하여 25℃에서 120 rpm으로 4시간 동안 교반하는 방법으로 실시하였다. 흡착이 완료된 후 0.45 μm 박막 여과지로 여과하고 그 여액 중에 잔류하는 음이온 농도를 수질공정시험법에 따라 UV (Shimadzu UV 2401-PC)를 이용하여 분석하였다. 흡착량(mg/g)은 흡착반응 전과 후 여액의 음이온 질량수지를 바탕으로 계산하였다.
여기서 C0와 C는 각각 초기 및 흡착실험 후 여액의 음이온 농도(mg/L)이며, V는 흡착질 용액의 부피(L), W는 흡착제 투여량(g)이다.
칼럼식 흡착실험은 내경 4.6 mm의 PE제 칼럼을 이용하여 상온에서 실시하였다. 칼럼은 PE섬유를 지지체로 0.1~0.2 g의 아민형 poly-GMA 흡착제를 충전밀도 0.241 g/cm3로 충전하는 방법으로 제조하였다. 이 칼럼에 고압피스톤펌프(Dual pump KP-21, FLOM, Japan)를 이용하여 인공폐수 또는 하수처리수를 유속 150 mL/h(공탑속도 0.25 cm/s)로 일정하게 주입하고, 칼럼을 통과한 유출수를 10~30분 간격으로 일정량씩 채취하여 음이온 농도를 분석하였다.
고정층 칼럼은 1 M의 소금물을 유속 150 mL/h로 적정시간 주입하는 방법으로 재생한 다음 반복 사용하여 재생횟수별 흡착효율의 변화를 평가하였다.
3. 결과 및 고찰
3.1. 회분식 흡착실험
3.1.1. 흡착등온
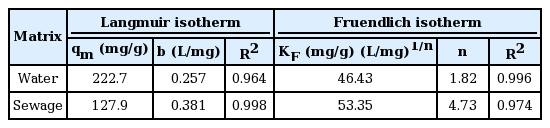
하수처리수에서 아민형 poly-GMA 흡착제의 PO4-P 흡착 특성을 확인하기 위하여 하수처리수와 증류수(0.1 M 아세트산 완충용액)를 바탕용액으로 적정량의 Na2HPO4를 첨가하여 초기농도 0.2~2.0 mmol/L의 PO43- 이온이 함유되도록 흡착질 용액을 제조한 다음 흡착등온실험을 실시하였다. 각각의 결과를 Langmuir 흡착등온식[15]과 Freundlich 흡착등온식[16]에 적용하여 Fig. 2에, 각각의 직선회귀식으로부터 구한 상수들은 Table 3에 각각 나타내었다. 아민형 poly-GMA의 PO4-P에 대한 흡착거동은 증류수 바탕의 폐수에서는 흡착이 진행될수록 흡착에너지가 지수적으로 감소되는 Freundlich 흡착등온식(2)과 잘 일치하는데 반해, 하수처리수 바탕의 폐수에서는 단분자층의 흡착특성을 갖는 Langmuir 흡착등온식(3)과 더 잘 일치되는 경향을 나타내었다.
여기서 Ce는 평형농도(mg/L), qe는 평형흡착량(mg/g), qm은 단일층 최대 흡착량(mg/g), KF와 n은 Freundlich 상수, b는 Langmuir 상수이다. 흡착등온에서 보인 차이는 경쟁이온의 영향을 반영한 것으로 하수처리수의 경우 전술한 바와 같이 다량의 Cl-이온과 SO42-이온을 함유하고 있어 이들 이온들과 PO4-P 이온이 흡착경쟁을 하기 때문으로 판단된다. 즉, 흡착사이트가 공존 음이온 특히 SO42-이온에 의해 점유되어 PO4-P 이온이 흡착할 수 있는 흡착사이트가 상대적으로 제한되었기 때문이다. Langmuir 흡착등온식에서 구한 단일층 최대흡착량 qm값은 증류수 바탕의 폐수에서는 222.7 mg/g, 하수처리수 바탕의 폐수에서는 127.9 mg/g으로 바탕용액에 따라 큰 차이가 있음을 알 수 있다.
3.1.2. 흡착경쟁
아민형 poly-GMA 흡착제의 PO4-P 흡착능에 미치는 공존 음이온별 영향을 확인하기 위하여 PO43- 이온 5 mg/L와 Cl-이온 0~400 mg/L 또는 SO42-이온 0~70 mg/L 공존하는 조건에서 흡착실험을 실시하였다(Fig. 3). Fig. 3에는 동일 조건에서 실시한 상용의 강염기성 음이온교환수지 PA308의 흡착경쟁도 같이 표시하여 아민형 poly-GMA 흡착제와 비교해 나타내었다. 흡착실험은 흡착질 용액 100 mL에 흡착제 0.1 g을 투여하고 25℃에서 4시간 동안 교반하는 조건에서 실시하였다. Fig. 3에 나타낸 바와 같이 아민형 poly-GMA의 PO4-P 흡착능에 미치는 공존 음이온의 영향은 PO43-이온 농도 대비 SO42- 14배 또는 Cl- 80배가 공존하는 조건에서도 PO4-P 흡착량 감소율이 각각 0.5% 또는 2.5% 이하에 불과할 정도로 매우 작게 나타났다. 이에 반해 상용의 음이온교환수지 PA308은 공존 음이온에 따른 PO4-P 흡착량 감소율이 SO42-의 경우 38%, Cl-의 경우 82%로 매우 크게 나타났다. 이러한 차이는 보통 아민형 poly-GMA와 음이온교환수지의 PO4-P에 대한 흡착선택성 차이로 해석할 수 있으나 흡착능 차이로 인한 결과일 수도 있다. Fig. 4는 흡착제 투여량별 아민형 poly-GMA의 PO4-P 흡착에 미치는 공존 음이온의 영향을 확인한 것으로 흡착제 투여량이 적을수록 PO4-P 흡착에 미치는 공존 음이온의 영향이 증가함을 보여주고 있다. 즉, PO4-P와 Cl- 또는 SO42-의 이성분계로 이루어진 증류수 바탕의 인공폐수에서의 PO4-P 제거율은 PO4-P 이온만을 포함하는 인공폐수와 비교해 흡착제 투여량 0.4 g/L까지 거의 같은 값을 보이다가 그 이하의 투여량부터 투여량이 감소할수록 급격히 감소하는 경향을 보여 PO4-P 이온의 흡착에 공존 음이온의 영향이 나타나기 시작하고, Cl-이온보다 SO42-이온이 공존할 때 훨씬 크게 감소함을 알 수 있다. 이 결과는 투여량 0.4 g/L에서 아민형 poly-GMA의 음이온 흡착능이 거의 포화값에 도달하였고 그보다 적은 투여량 조건에서 비로소 한정된 흡착사이트에 대한 상대적 흡착선택성에 따라 공존 이온간 흡착경쟁이 일어나고 있음을 의미한다. 한편 하수처리수에서는 흡착제 투여량의 영향이 더욱 뚜렷하게 나타나 아민형 poly-GMA의 PO4-P 흡착에 미치는 영향이 보다 복합적임을 시사하였다.

Effect of competing anions on the PO4-P adsorption capacity of aminated poly-GMA and commercial anionexchange resin.
3.2. 고정층 칼럼식 흡착실험
3.2.1. 파과곡선과 경쟁이온 영향
Fig. 5는 PO43-이온을 5 mg/L 함유하는 증류수 바탕 인공폐수와 하수처리수를 아민형 poly-GMA를 고정층높이(H)/칼럼직경(D)의 비가 5.4가 되도록 충전한 칼럼에 공탑속도 0.25 cm/s로 주입하는 조건에서 구한 PO43-이온과 하수처리수에 공존하는 음이온의 파과곡선 및 그들이 PO43-이온의 파과곡선에 미치는 영향을 보여주고 있다. PO43-이온의 파과가 시작되는 시간은 경쟁이온이 없는 증류수 바탕의 인공폐수의 경우 245분이었으나 다양한 경쟁이온을 포함하는 하수처리수의 경우 15분 정도로 매우 짧아졌다(Fig. 5(a)). 하수처리수에 포함된 주요 음이온이 PO43-이온의 파과시간에 미치는 영향을 이온별로 확인하기 위해서 증류수에 적정량의 Na2HPO4 (PO43- 5 mg/L)와 함께 NaCl (Cl- 400 mg/L) 또는 Na2SO4 (SO42- 70 mg/L)를 첨가한 이성분계 인공폐수를 제조하여 위와 동일 조건에서 칼럼실험을 실시하고 각 용액 조건에서 얻은 PO43-이온의 파과곡선을 Fig. 5(a)에 비교하여 나타내었다. Cl- 이온이 경쟁이온으로 공존하는 경우 PO43-이온의 파과시간은 190분으로 경쟁이온이 없을 경우에 비해 55분 정도 단축되었고, SO42- 이온이 공존하는 경우에는 PO43-이온의 파과시간이 45분으로 훨씬 더 단축되어 PO43-이온과의 흡착경쟁이 Cl- 이온에 비해 매우 높았음을 알 수 있게 하였다. 정상적인 파과곡선이라면 초기 농도의 50%가 검출되는 파과시간 즉 C/C0=0.5인 시간을 이상파과시간이라 하며 고정층의 흡착량에 대한 척도가 된다. 즉, 고정층에 의한 피흡착질의 흡착량은 다음 식으로 구할 수 있다.

Breakthrough curves for the removal of PO4-P by aminated poly-GMA at different chemical composition of base solution (a). Also shown breakthrough curves for the removal of coexisting NO3- and SO42- ion at the discharge water from sewage treatment plant(b).
여기서 F0는 용액의 공급속도(L/h), C0는 피흡착질의 초기농도(mg/L), t*b는 이상파과시간(h), W는 고정층에 충전된 흡착제 무게(g)이다. 이상파과시간을 바탕으로 구한 고정층의 PO43-이온 흡착량은 경쟁이온이 없는 증류수 바탕의 경우 약 136 mg/g에서 Cl- 이온이 400 mg/L 공존하는 조건의 경우 약 29 mg/g으로, SO42- 이온이 70 mg/L 공존할 경우 약 9 mg/g으로, 다양한 경쟁이온이 공존하는 하수처리수의 경우 약 8 mg/g으로 급격히 감소하였다. Fig. 5(b)는 하수처리수를 대상으로 하는 칼럼실험에서 PO43-이온과 공존하는 NO3-와 SO42-이온의 파과곡선을 비교하여 보여주고 있다. 각 이온들의 파과시간은 SO42- > PO4-P > NO3- 순으로 나타났다. pH가 6.9인 하수처리수 중의 PO4-P 이온은 주로 2가(HPO42-)이온과 1가(H2PO4-)이온으로 존재하는 점을 고려할 때 아민형 poly-GMA의 흡착선택성이 공존 이온들의 산화수에 많은 영향을 받고 있음을 알 수 있다.
3.2.2. 고정층 높이 영향과 흡착반응대
Fig. 6(a)는 PO43-이온을 5 mg/L 함유하는 하수처리수를 공탑속도 0.25 cm/s로 주입하는 조건에서 고정층 높이별 PO4-P 이온의 파과곡선(점)과 수치모델식을 적용하여 이론적으로 계산한 파과곡선(선)을 보여주고 있다. PO4-P 이온의 파과가 시작되는 시간과 이상파과점(C/C0 = 0.5)에 도달하는 시간은 고정층의 높이가 증가할수록 즉, H/D의 비가 증가할수록 비례적으로 지연되었다. 이는 고정층의 높이가 증가할수록 흡착제 충전량이 증가하여 고정층에 의한 흡착량이 증가하였기 때문이다. 파과곡선을 해석하기 위한 수치모델식으로는 Bohart-Adams model을 사용하였다. Bohart-Adams model은 흡착속도가 흡착제의 흡착능과 피흡착질 농도에 지배된다는 가정에서 유도된 모델로 다음과 같은 직선식이 제시되었다[17].
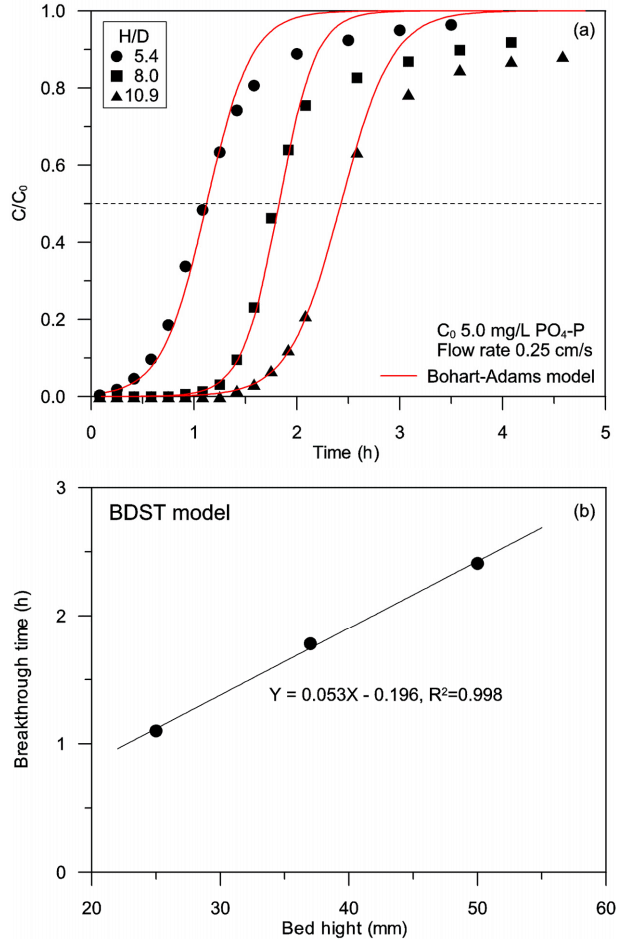
Breakthrough curves (a) and BDST model plot (b) for the removal of PO4-P from the discharge water of sewage treatment plant by aminated poly-GMA adsorbent at different H/D ratios.
여기서 C0와 C는 유입수와 유출수 중의 피흡착질 농도(mg/L), KBA는 속도상수(L/mg•h), N0는 흡착능(mg/L), Z는 흡착층 높이(mm), U0는 공탑속도(mm/h), t는 시간(h)이다. Bohart-Adams model로부터 산출한 특성상수들을 직선회귀상수와 함께 Table 4에 나타내었다. 칼럼의 고정층 높이가 증가할수록 속도상수 KBA는 감소하였으나 흡착능 N0는 가장 낮은 H/D = 5.4를 제외하고는 오차범위 내로 수렴되는 경향을 보였다. 이는 고정층에서의 흡착반응대에 의해 지배되는 흡착제 사용분율의 차이를 반영한 결과로 추측된다. 고정층에서의 흡착반응대는 흡착이 일어나는 영역으로 이상적이라면 흡착제의 절반만 피흡착질로 포화되는 구간으로 흡착질의 농도와 공탑속도가 일정하다면 고정층의 높이와 관계없이 일정한 길이를 갖는 것으로 알려져 있다. 따라서 흡착반응대의 길이가 증가할수록, 고정층의 높이가 감소할수록 고정층에서의 미사용 흡착제 비율이 증가하게 되어 고정층의 흡착능은 감소하게 된다. 고정층에서 흡착반응대의 길이는 고정층 높이와 파과시간의 관계를 Bed Depth Service Time (BDST) model에 적용함으로서 추정할 수 있다. BDST model 식은 다음 식과 같이 주어졌다[18].
여기서 tb는 파과시간(h), N0는 흡착능(mg/L), C0는 유입수중의 피흡착질 농도(mg/L), U0는 공탑속도(mm/h), Z는 고정층 높이(mm), Z0는 흡착반응대의 길이(mm)이다. C/C0=0.5에 도달할 때를 파과점으로 설정하여 BDST model을 적용한 결과, Fig. 6(b)에 나타낸 바와 같이 고정층 높이와 파과시간이 직선식으로 수렴되는 관계를 보여 모델식과 잘 일치하였다. 이 직선식으로부터 구한 흡착능은 2,441 mg/L (10.1 mg/g), 흡착반응대의 길이는 3.7 mm 정도였다. 이 흡착반응대가 고정층에서 차지하는 비율은 H/D 5.4에서 14.8%, H/D 8.0에서 10.0%, H/D 10.9에서 7.4%로 모든 조건에서 흡착제 사용분율이 85% 이상임을 알 수 있었다.
3.2.3. 흡착능 개선
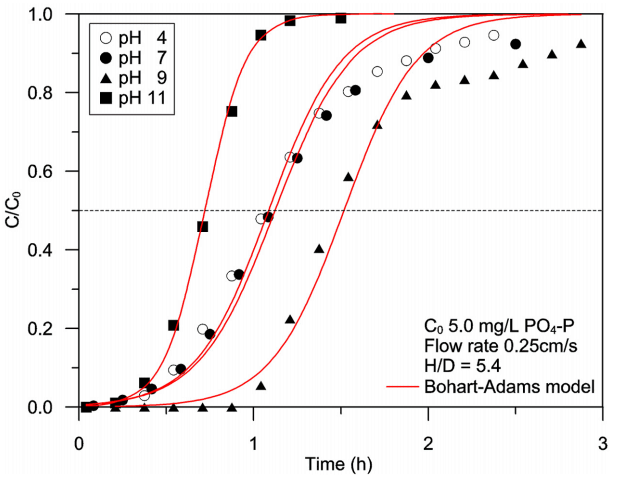
하수처리수에서 아민형 poly-GMA의 PO4-P 이온에 대한 흡착능을 개선하기 위해서 흡착경쟁이온의 영향을 줄이는 방법과 PO4-P 이온의 산화수를 변화시켜 흡착경쟁력을 높이는 방법을 고려하여 보았다. 우선 PO4-P 이온과 강하게 흡착경쟁하는 SO42- 이온을 적정량의 BaCl2와 반응시켜 BaSO4로 침전시켜 제거하는 방법으로 흡착경쟁이온의 영향을 감소시켜 보았다. 그 결과 Fig. 7에 나타낸 바와 같이 SO42- 이온을 제거함에 따라 PO4-P 이온의 파과시간은 지연되었다. 각 파과곡선에 Bohart-Adams model을 적용하여 산출한 PO4-P 이온의 흡착량은 SO42- 이온을 22 mg/L까지 제거했을 때 18.46 mg/g, 1 mg/L 이하로 제거했을 때 37.07 mg/g으로 SO42- 이온을 제거하지 않았을 때와 비교할 때 4배 이상 증가하였다. 또 다른 방법으로 하수처리수에 적정량의 HNO3 또는 NaOH를 첨가하여 pH를 4~11로 조절하여 PO4-P 이온의 산화수를 변화시킨 다음 칼럼실험을 실시하였다. 실험에 사용한 하수처리수의 pH는 6.89로 용존되어 있는 PO4-P 이온은 1가(H2PO4-)와 2가(HPO42-)가 대략 50%씩 공존하며, pH를 4로 감소시킬 경우 99% 이상이 1가의 형태로, pH를 9로 증가시킬 경우 98% 이상이 2가의 형태로, pH를 11로 증가시킬 경우 95% 이상이 3가(PO43-)의 형태로 존재하게 된다. 따라서 아민형 poly-GMA의 PO4-P 이온에 대한 흡착능이 단순히 PO4-P 이온의 산화수에 비례한다면 pH가 증가할수록 그 흡착능이 증가해야 한다. 그러나 실험결과는 하수처리수의 pH를 4로 조절한 경우 하수처리수와 거의 중첩되는 파과특성을 보인 반면 pH를 9로 조절한 경우 파과시간이 지연되었으나 pH를 11로 조절할 경우 파과시간이 다시 단축되는 파과특성을 보였다(Fig. 8). 이처럼 pH 4에서 흡착능이 감소되지 않고 오히려 pH 11에서 흡착능이 감소되는 이유는 pH에 따라 아민형 poly-GMA의 표면전위가 변화하였기 때문으로 추측할 수 있다. Park and Na [11]는 DETA계 아민형 흡착제의 등전점이 pH 9 정도라고 발표한 바 있다. 즉, pH 9 이하에서는 표면전위가 양(+)이 되어 음이온의 흡착능이 증가되는 반면 pH 9 이상에서는 표면전위가 음(-)이 되어 전기적 반발력으로 인해 음이온의 흡착능이 감소된다고 주장하였다. 이로 미루어 볼 때 pH 9에서 상대적으로 파과시간이 지연될 수 있었던 것은 흡착제 표면이 양전위를 띠면서 PO4-P 이온의 산화수가 가장 높아지는 조건이기 때문으로 생각할 수 있다. Bohart-Adams model을 이용하여 산출한 흡착능은 pH 9에서 12.44 mg/g으로 하수처리수를 그대로 처리할 때와 비교하여 1.45배 증가하였다.

Breakthrough curves for the removal of PO4-P by aminated poly-GMA adsorbent before and after pre-removal of SO42- ion from the discharge water of sewage treatment plant.
3.2.4. 재생효율
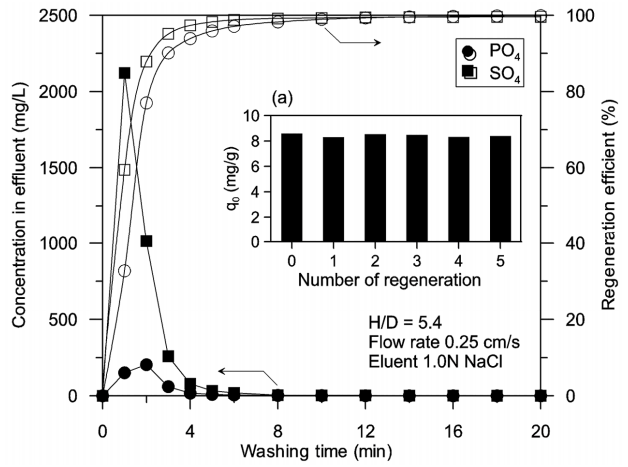
아민형 poly-GMA의 흡착-재생실험은 PO43-이온을 5 mg/L 함유하는 하수처리수를 H/D=5.4인 고정층 칼럼에 공탑속도 0.25 cm/s로 C/C0=0.9 이상까지 주입하는 흡착과정과 PO4-P로 흡착 포화된 칼럼에 1 M의 소금물을 0.25 cm/s로 유출액의 PO43-이온 농도가 0.5 mg/L 이하가 될 때까지 주입하고 증류수로 세척하는 재생과정을 5회 반복 실시하였다. Fig. 9는 재생과정에서 유출폐액의 PO43-이온과 SO42-이온의 시간별 농도변화와 재생횟수별 재생효율을 보여주고 있다. 고정층 칼럼의 재생과정에서 유출수의 시간별 PO43-이온과 SO42-이온의 농도는 소금물 세척 2분 후 최대 피크값을 보인 후 급속히 감소하여 15분 후에는 각각 0.5 mg/L와 1.0 mg/L 미만이 되었다. 이때 소요된 소금물 재생액은 칼럼부피의 약 90배 정도였다. 이상파과시간을 기준으로 계산한 PO4-P 흡착량은 재생이 반복됨에 따라 불규칙적이지만 약간 감소하는 경향을 보였으며 5회 반복재생에서의 최솟값이 8.29 mg/g으로 초기 사용에 비해 약 3.4% 감소하는 수준에 불과하였다(Fig. 9(a)). 이는 고정층이 소금물 세척으로 통해 재생가능하며 흡착 및 탈착과정에서 물리화학적 내구성 변화가 거의 없음을 의미한다.
4. 결 론
실폐수인 하수처리수를 대상으로 아민형 poly-GMA 흡착제의 인산성 인(PO4-P) 흡착특성을 회분식 및 고정층 칼럼식 흡착실험을 통해 검토한 결과, 다음과 같은 결론을 얻을 수 있었다.
1) 아민형 poly-GMA의 PO4-P에 대한 흡착거동은 증류수 바탕의 폐수에서는 Freundlich 흡착등온식과 잘 일치하는데 반해 하수처리수 바탕의 폐수에서는 Langmuir 흡착등온식과 더 잘 일치되는 경향을 나타내었다.
2) 아민형 poly-GMA의 PO4-P 흡착은 공존 음이온과 흡착경쟁에 의해 영향을 받았으며, 그 영향력은 Cl-이온보다 SO42-이온이 훨씬 크게 나타났다.
3) 고정층 컬럼에서 공존이온들의 파과시간은 SO42- > PO4-P > NO3- 순으로 나타나 아민형 poly-GMA의 흡착선택성이 공존 이온들의 산화수에 많은 영향을 받고 있음을 알 수 있었다.
4) 아민형 poly-GMA의 PO4-P 이온에 대한 흡착능은 하수처리수로부터 SO42- 이온을 제거하거나 하수처리수의 pH를 9 정도로 조절하는 전처리 방법을 통해 개선할 수 있었다.
5) 아민형 poly-GMA 흡착제는 1.0몰 소금물을 이용한 세척공정을 통해 흡착능 및 물리적 내구성의 심각한 저하 없이 재생 사용이 가능하였다.
6) 하수의 탈인처리 시설로서 흡착공정이 폭넓게 활용되기 위해서는 흡착제의 PO4-P 흡착선택성을 보다 더 강화시킬 필요가 있다.