커피찌꺼기로 지지된 나노영가철을 이용한 폐수 중 납과 카드뮴 흡착
Adsorption of Lead and Cadmium from Wastewater Utilizing Nano Zero Valent Iron Supported by Coffee Ground
Article information
Abstract
나노영가철은 높은 반응성과 환원력으로 중금속 흡착제로 많은 관심을 받고 있다. 그러나 나노영가철은 강력한 표면 에너지와 자성으로 인해 큰 입자로 응집되는 성질이 있고 이는 현장 적용 시 표면적과 반응성을 감소시키는 문제가 있다. 본 연구에서는 나노영가철의 입자 간 응집 문제를 해결하기 위해 나노영가철이 커피찌꺼기에 지지되도록 합성시켰으며 합성 한 재료를 이용하여 Pb2+과 Cd2+에 대한 회분식 흡착실험을 진행하였다. pH 6, 20℃ 조건에서 등온흡착실험 결과 Langmuir 모형으로부터 Pb2+과 Cd2+에 대해 각각 814.95 mg/g, 196.06 mg/g의 최대흡착능을 가진 것으로 확인되었다. Pb2+의 경우 환원 반응 기작이 작용하여 실험 결과를 등온흡착곡선 모형으로 설명하기 어려운 것으로 나타났다. 반응 평형 시간은 Pb2+에 대해 1시간, Cd2+에 대해 8시간이 소요되었다. 유사 2차반응속도 모형이 반응속도를 잘 설명할 수 있는 것으로 나타났기에 흡착 형태는 화학적 흡착으로 추정된다. 물질 전달 메커니즘 분석 결과 Pb2+과 Cd2+은 각각 80%와 60%가 표면 확산을 통해 빠른 속도로 전달된 이후 나머지는 입자 내부 확산을 통해 전달됨을 확인하였다. 커피찌꺼기로 지지되는 나노영가철은 입자 간 응집이 억제되어 높은 중금속 흡착능과 제거율을 가진 것으로 생각되며, 나노영가철-커피찌꺼기는 고농도 중금속 폐액이 발생하는 산업현장에서 적용가능성이 뛰어날 것으로 판단된다.
Trans Abstract
Nano zero valent iron (NZVI) is an emerging adsorbent for heavy metal removal with its high reactivity and reduction potential. However, NZVI tends to aggregate to bigger particles, thus surface area and reactivity could be decreased in applications. In this study, NZVI is synthesized while attached on coffee ground to prevent agglomeration. Then batch adsorption tests for Pb2+ and Cd2+ in wastewater were studied. Adsorption isotherm under pH 6 and 20℃ revealed that maximum adsorption capacity from the Langmuir model was 814.95 mg/g and 196.06 mg/g for Pb2+ and Cd2+ respectively. Based on mechanism of removing Pb2+ involves reduction, adsorption isotherm did not fit well in experiments data. Time to reach equilibrium was 1 hour and 8 hours for Pb2+ and Cd2+, respectively. Pseudo 2nd order kinetic model explain well kinetics of heavy metal adsorption, thus adsorption is likely to be chemi-sorption. According to the mass transfer mechanism study, 80% of Pb2+ and 60% of Cd2+ were transported rapidly by surface diffusion and residuals are transported by interparticle diffusion. High adsorption capactiy for Pb2+ and Cd2+ would be related with suppression of aggregation, hence NZVI-coffee ground showed the outstanding potential on industrial wastewater treatment facilities with high concentration of heavy metals.
1. 서 론
폐수를 통해 방류되는 중금속 이온은 생태계와 인간의 건강에 치명적인 영향을 미칠 수 있다. 중금속은 음용수, 피부 접촉, 생물 농축된 식재료 등의 다양한 경로로 인체에 노출될 수 있다[1]. 산업폐수로 배출되는 대표적인 중금속인 납과 카드뮴은 합금, 안료, 전지, 반도체 등 다양한 산업 활동 이후 부산물로 폐수로 방류된다[2]. 개정된 먹는 물 수질기준 및 검사 등에 관한 규칙에서는 먹는 물의 납과 카드뮴 농도가 각각 0.01 mg/L와 0.005 mg/L로 기준이 강화되었다[3].
폐수 중 중금속을 제거하기 위한 공정으로 화학적 침전, 이온교환, 흡착, 멤브레인 여과, 응집-침전, 부상 공정 및 전기화학적 방법 등이 연구된 바가 있다. 이 중 흡착 공정은 중금속 제거가 효율적이며 경제적인 공정으로 주목받고 있으며 반응조 설계 및 운영 측면에서 유연성이 높은 것으로 알려져 있다. 기존 흡착제로는 가장 많이 적용되는 재료는 활성탄이지만 재료 고갈에 따라 가격이 인상되는 문제가 있다. 이에 대한 대안으로 벤토나이트, 카올린 등 자연의 재료를 흡착제로 활용하는 저비용 흡착제(Low-cost adsorbent)가 관심을 받았으나 흡착능을 높이기 위해서는 표면 작용기를 개질하는 등 추가적인 비용을 소요하는 단점이 있다. 또한 발생원이 많고 비용이 저렴한 바이오매스를 흡착제로 적용하는 방안도 연구가 진행되고 있으나 연구가 많이 진행되지 않았으며 이러한 바이오흡착제를 흡착 공정 이후에 분리하는 것이 어렵다는 단점이 있다[4].
나노영가철은 독특한 core-shell 구조와 강력한 정전기적 인력과 환원력을 가지고 있어 중금속을 제거하는 능력이 매우 뛰어난 것으로 보고되고 있다[5]. 표면에 존재하는 산화철 및 수산화철로 인해 나노영가철은 넓은 비표면적을 가질 수 있어 흡착에 유리하다[6]. 나노영가철의 자성은 자기장을 형성하여 전하를 가진 중금속 이온을 흡착시킬 수 있다[7]. 철의 표준환원전위(-0.44 V, 25℃)는 물 속의 중금속 이온을 환원시켜 나노영가철 표면에 부착시키는 기작을 설명할 수 있다[8]. 또한 나노영가철은 제조가 쉬우며, 원료인 철을 자연에서 쉽게 얻을 수 있어 경제성이 뛰어나다[9].
그러나 나노영가철은 높은 표면에너지와 자성으로 인해, 입자들이 큰 입자로 응집되는 경향이 있으며 이에 따라 현장에 적용할 경우 나노영가철의 표면적과 흡착 능력이 감소되는 문제점이 있다[10]. 또한 나노 단위로 존재하는 입자를 실제 공정에서 분리하여 재사용하는 것은 매우 어렵다[11]. 따라서 나노영가철의 입자 간 응집 현상을 억제하여 현장에서 적용할 수 있도록 나노영가철을 벤토나이트, 활성탄, 그래핀 등 적절한 매체로 지지하는 것에 대한 연구가 이루어지고 있다[12-14].
커피찌꺼기는 나노영가철을 고정시키기에 적절한 대안이 될 수 있다. Franca 등[15]에 의하면 커피찌꺼기는 영전하점(point of zero charge, PZC)이 3.4-3.6이므로 표면에 음전하를 갖고 있는 물질이다. 이에 반해 Sun 등[16]에 의하면 나노영가철은 영전하점이 8.3으로 표면에 양전하를 갖고 있는 물질이다. 따라서 커피찌꺼기와 나노영가철을 함께 합성하면 나노영가철이 커피찌꺼기에 의해 지지되며 나노영가철의 입자 간 응집이 억제될 것으로 기대된다. 또한 커피찌꺼기는 2014년 기준으로 국내에서 연간 104,000톤이 발생하고 있어 재료를 구하는 것이 매우 쉽다. 대부분의 커피찌꺼기가 현재 매립되고 있는 실상을 고려하면 매립지에서 혐기성 분해에 의해 발생하는 온실가스의 발생량도 줄일 수 있을 것이다[17].
본 연구에서는 전술한 바와 같이 발생량이 많은 폐기물을 활용하여 간단히 제조할 수 있는 나노영가철-커피찌꺼기를 중금속 이온 흡착제로 활용하여 수용액 중 Pb2+과 Cd2+에 대한 흡착 특성을 평가하기 위한 기초실험을 실시하였다. 이를 통해 흡착 평형 특성 및 흡착 동력학 특성을 확인하고 나노영가철이 다른 재료에 지지된 사례와 비교하여 현장 적용 가능성을 확인하고자 하였다.
2. 연구방법
2.1. 실험 재료
커피찌꺼기는 서울대학교 도서관 카페로부터 제공받았다. FeCl3·6H2O과 에탄올, NaBH4는 ㈜대정화금로부터 구입하였으며 이들 재료는 나노영가철을 합성하는데 사용되었다. 중금속 시약인 PbCl2와 Cd2·6H2O는 각각 ㈜대정화금과 Sigma-Aldrich (U.S.A)로부터 구입하였다.
2.2. 나노영가철-커피찌꺼기 합성
본 연구에서는 Fe2+ 또는 Fe3+를 환원시커 나노영가철을 회수하는 borohydride reduction method를 적용하여 나노영가철을 커피찌꺼기에 부착하였다[18,19]. 이 방법은 용액 중 Fe2+ 또는 Fe3+ 이온을 BH4- 이온과 반응시켜 영가철로 환원하는 방법이다. 철과 커피찌꺼기의 질량 비율이 1:1인 경우의 합성방법은 다음과 같다. 80% 에탄올 수용액(v/v) 30 mL을 50 mL centrifuge tube에 담고, 용매에 7.26 g의 FeCl3·6H2O을 용해시켰다. FeCl3·6H2O 용액에 커피찌꺼기 1.5 g을 투여한 뒤, 2시간 동안 교반시켰다. 교반시킨 진탕액을 250 mL 플라스크에 옮긴 뒤 자석 교반기로 교반시키면서 1.0 M NaBH4 용액 100 mL를 천천히 떨어뜨려 Fe3+ 이온을 영가철로 환원시켰다. 진탕액의 색상이 완전히 검은색이 된 것을 확인한 뒤, 30 분간 더 교반시켰다. 혼합액을 0.45 µm micro filter로 여과하여 나노영가철-커피찌꺼기를 회수하였고, 20 mL 에탄올로 3회 세척하였다. 세척이 끝난 나노영가철-커피찌꺼기는 24시간 동안 50℃ 오븐에서 건조하였다.
2.3. 나노영가철-커피찌꺼기 성상 분석
커피찌꺼기의 성상을 파악하기 위해 삼성분 분석과 원소 분석을 실시하였다. 1 M HNO3 50 mL에 나노영가철-커피찌꺼기 0.01 g을 투여하여 철을 용출시킨 뒤 ICP-OES (iCAP- 7400, Thermo Scientific, U.S.A)로 나노영가철-커피찌거기의 철 함량을 확인하였다. 커피찌꺼기와 나노영가철-커피찌꺼기 1 g을 증류수 20 mL가 담긴 50 mL Centrifuge tube에 투여한 뒤, 20분 간 교반한 뒤 pH meter (Orion StarTM A216, Thermofisher, U.S.A)를 이용하여 표면 pH를 측정하였다. 커피찌꺼기와 실험실에서 합성한 나노영가철, 나노영가철-커피찌꺼기의 공극 반지름과 비표면적을 ASAP-2010 (Micromeritics, U.S.A)를 이용하여 BET (Brunauer-Emmett-Teller) 법으로 분석하였다.
2.4. 회분식 등온흡착실험
PbCl2와 CdCl2·6H2O를 증류수에 용해시켜 1,000 mg/L의 중금속 용액 1 L를 준비하였다. Pb2+ 용액을 180 mg/L, 360 mg/L, 540 mg/L, 720 mg/L, 900 mg/L로 희석하였고 Cd2+ 용액을 80 mg/L, 160 mg/L, 240 mg/L, 320 mg/L, 400 mg/L로 희석하였다. 0.05 M NaOH 용액을 이용하여 pH를 6으로 조정하였다. 희석한 용액 20 mL을 50 mL centrifuge tube에 옮긴 뒤 나노영가철-커피찌꺼기 0.02 g을 투여한 뒤 16시간 동안 교반시켰다. 평형에 도달한 용액의 일부를 취하여 ICP-OES로 중금속 농도를 측정하였다. 초기농도와 평형농도를 측정하였으며 모든 실험은 3회 시행하였다.
평형흡착능 qe (mg/g)는 식 (1)으로부터 계산하였다.
이 때 C0 (mg/L)와 Ce (mg/L)는 각각 중금속 용액의 초기농도와 평형농도를, V (L)는 중금속 용액의 부피를, W (g)는 투여한 흡착제의 질량을 나타낸 값이다.
중금속 제거율은 Re (%)은 식 (2)로부터 계산하였다.
2.5. 흡착반응속도 실험
0.05 M NaOH을 이용하여 pH를 7로 조정한 100 mg/L PbCl2와 CdCl2·6H2O 용액 100 mL를 250 mL 플라스크에 옮긴 뒤 나노영가철-커피찌꺼기 0.1 g을 투여하였다. 자석 교반기로 용액을 혼합시키며 5분, 15분, 30분, 45분, 1시간, 2시간, 4시간, 8시간, 12시간, 20시간이 경과했을 때에 용액의 일부를 취하여 중금속 농도를 ICP-OES를 이용하여 측정하였으며 모든 실험은 3회 시행하였다.
시간에 따른 단위 질량당 흡착량 qt (mg/g)는 식 (3)로부터 계산하였다.
이 때, Ct (mg/L)는 흡착 반응이 진행된 지 시간 t 경과 후 중금속 용액 농도이다.
2.6. 등온흡착곡선 모형
흡착 평형특성을 파악하기 위해 등온흡착곡선 모형을 활용하였다. 등온흡착곡선은 평형상태에서 농도와 평형흡착능을 나타내는 곡선으로 흡착질의 상 분배를 확인할 수 있는 곡선이다. 중금속 평형농도 Ce (mg/L)와 평형흡착능 qe (mg/L)를 SigmaPlot ver. 10.0을 이용하여 Langmuir 모형과 Freundlich 모형으로 근사하였다.
Langmuir 모형은 흡착 지점이 균일한 표면 에너지를 갖고 있으며 흡착질이 단층으로 흡착된다는 가정하에 제시된 곡선이다. Langmuir 모형은 식 (4)과 같이 계산하였다[20].
이 때, qm (mg/g)은 단위 질량당 최대흡착능을 의미하며, b (L/mg)는 흡착 결합 에너지와 관련된 상수이다. Langmuir 모형으로부터 Seperation Factor인 RL을 계산하여 흡착 시스템을 예측할 수 있다. Seperation Factor RL은 식 (5)와 같이 계산된다.
RL값이 0인 경우 흡착이 비가역적이며, 0 < RL < 1인 경우 흡착이 호의적이며 RL > 1인 경우 흡착이 비호의적이다.
Freundlich 모형은 여러 기작에 의한 흡착을 표현하는 경험식이다. Freundlich 모형은 식 (6)와 같이 계산된다[21].
이 때, Kf는 흡착제의 흡착 능력과 관련된 상수이며, n은 흡착 강도와 관련된 상수로 흡착제의 불균일성에 따라 달라지는 것으로 알려져 있다. n 값이 클수록 흡착효율이 높다.
2.7. 흡착반응속도 모형
시간에 따른 흡착량을 유사 1차 반응속도 모형과 유사 2차 반응속도 모형으로 근사하였다. 1차 반응속도 모형은 흡착질과 흡착지점에 일대일로 대응되며 흡착되는 경우를 모사하며, 2차 반응속도 모형은 화학적 흡착이 이루어질 경우를 모사하는 모형이다. 유사 1차 반응속도 모형과 유사 2차 반응속도 모형은 각각 식 (7), (8)과 같이 표현된다.
qe는 평형상태에서 흡착제 단위 질량에 흡착된 대상물질의 질량으로 단위는 mg/g이다. k1는 1차 흡착반응속도상수로 단위가 h-1이다. k2는 2차 흡착반응속도상수로 단위가 g·mg-1h-1이다.
2.8. 입자 내부 확산 모형
흡착 과정에서 물질전달은 흡착질이 흡착제 표면으로 확산되는 과정, 흡착제 표면으로부터 흡착제 입자 내부로 확산되는 과정, 입자 내부로 이동한 흡착질이 흡착되는 세 가지 과정으로 진행된다. 흡착 과정은 상대적으로 매우 빠르므로 전체 반응속도에 영향을 미치지 않는다고 가정할 수 있다. 따라서 반응속도는 표면 확산과, 공극 내부 확산 두 가지 과정에 의해 결정된다[22]. 이러한 과정을 설명하는 입자 내부 확산 모형은 식 (9)와 같이 표현된다.
이 때, ki는 입자 내부 확산 속도 상수(mg·g-1h0.5)이며, C는 절편을 나타낸다. 속도 결정단계가 입자 내부 확산 한 가지라면 이 모형은 원점을 지나는 하나의 직선으로 표현된다. 표면 확산이 속도 결정단계에 포함될 경우 이 모형은 두 가지 이상의 직선을 갖게 되며, 원점을 지나는 첫 번째 직선이 표면 확산을 나타내고 원점을 지나지 않는 두 번째 직선이 공극 내부 확산을 나타낸다.
3. 결과 및 고찰
3.1. 나노영가철-커피찌꺼기 성상
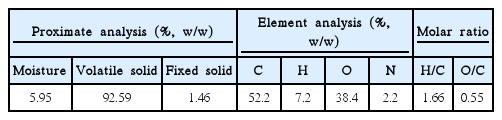
커피찌꺼기는 질량 기준으로 수분이 5.95%, 가연분이 92.59%, 회분이 1.46%로 나타났다. 가연분 함량이 높은 것은 커피찌꺼기가 셀룰로오스, 리그닌 등의 유기물로 구성되어 있기 때문인 것으로 생각되며, 높은 가연분 함량은 바이오 연료, 바이오 가스 등 다양한 활용 가능성을 제시한다[23]. 원소분석 결과 커피찌꺼기는 탄소, 수소, 산소, 질소의 질량 비율이 각각 52.2%, 7.2%, 38.4%, 2.2%로 나타났다. H/C 몰 비는 1.66, O/C 몰 비는 0.55로 나타났으며 이를 통해 커피찌꺼기가 산소와 수소로 이루어진 작용기를 가지고 있을 것으로 추론된다(Table 1).
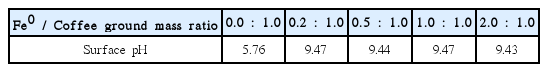
철과 커피찌꺼기를 각각 0.2:1, 0.5:1, 1.0:1, 2.0:1의 질량비로 합성한 경우 흡착제의 철 함량은 각각 107.89±4.21 mg/g, 191.42±8.12 mg/g, 174.96±19.43 mg/g, 302.74±18.98 mg/g으로 나타났다(Fig. 1). 커피찌꺼기의 표면 pH는 5.76으로 나타났으며, 나노영가철-커피찌꺼기의 표면 pH는 철-커피찌꺼기 질량비와 무관하게 9.43-9.47의 범위로 나타났다(Table 2). 표면 pH가 7보다 크게 나타난 것은 나노영가철의 표면의 산화철에 OH기가 형성되기 때문인 것으로 추정된다. Pb2+, Cd2+과 같은 양이온 중금속은 수용액에서 양성자를 제공하는 약산으로 작용하는 것을 고려할 때, 약산-약염기 작용으로부터 흡착을 설명할 수 있을 것으로 사료된다[24].
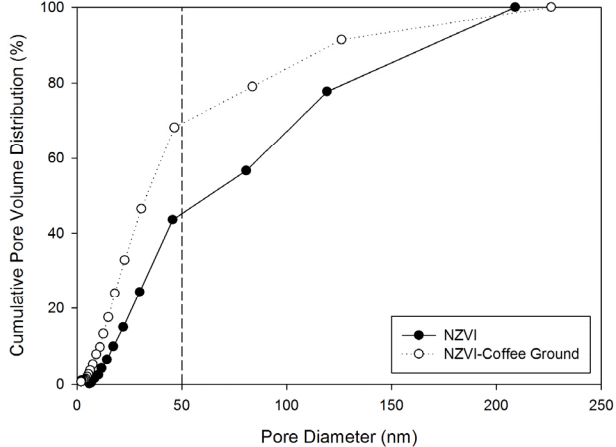
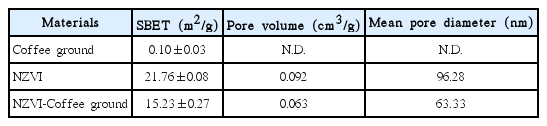
BET 분석 결과로부터 커피찌꺼기, 나노영가철, 나노영가철-커피찌꺼기의 비표면적은 각각 0.10±0.03 m2/g, 21.76±0.08 m2/g, 15.23±0.27 m2/g임을 확인하였다. BJH (Barrett-Joyner-Halenda) 분석 결과 나노영가철과 나노영가철-커피찌꺼기의 단위 질량당 공극 부피는 각각 0.092 cm3/g, 0.062 cm3/g으로 나타났다. 커피찌꺼기의 비표면적 및 공극 부피는 나노영가철에 비해 무시할 만큼 작으므로, 나노영가철-커피찌꺼기의 공극은 지지되는 나노영가철에만 존재하는 것으로 가정할 수 있다. 철 단위질량 당 나노영가철-커피찌꺼기의 비표면적 및 공극 부피는 각각 87.05 m2/g-Fe와 0.35 cm3/ g-Fe로 계산되어 나노영가철보다 약 4배가 큰 것을 알 수 있었다. 공극 크기의 분포를 분석한 결과 나노영가철-커피찌꺼기는 나노영가철에 비해 직경이 2-50 nm인 meso pore가 차지하는 비율이 24.6% 더 많은 것으로 나타났으며, 나노영가철-커피찌꺼기의 공극 평균 직경은 63.33 nm로 나노영가철의 공극 평균 직경인 96.28 nm보다 작게 나타났다(Fig. 2, Table 3).
Nurmi 등에 따르면 나노영가철은 직경 1.5 nm 이하의 입자들이 20-100 nm의 구형으로 뭉쳐있는 상태로 존재한다[25]. 나노영가철의 단위입자 직경이 1.5 nm 이하이므로 나노영가철에서 발생하는 meso pore는 입자 내부 공극이 아닌 입자 간 공극으로 해석할 수 있다. 입자 간 응집력이 강할 경우 입자 간 간극이 좁혀져 meso pore가 발달하지 못할 것이다. 나노영가철-커피찌꺼기의 철 단위 질량 당 비표면적, 공극 부피가 나노영가철보다 크게 나타난 것은 커피찌꺼기에 의해 나노영가철의 응집이 억제되어 철 입자 사이에 meso pore가 발달할 수 있었기 때문인 것으로 추론된다.
3.2. 중금속 제거율
나노영가철-커피찌꺼기를 1 g/L의 비율로 투여하였을 때, 180 mg/L Pb2+ 용액은 흡착 이후에 농도가 검출한계인 0.002 mg/L 이하로 측정되었다. 이는 흡착 뿐 아니라 산화-환원 반응에 의한 Pb2+의 불용화 기작이 동시에 작용하여 거의 모든 Pb2+가 액상에서 제거된 것으로 판단된다[26,27]. 농도가 높아질수록 제거율은 서서히 낮아져서 360 mg/L, 540 mg/L, 720 mg/L Pb2+ 용액에서는 90% 이상의 제거율을 보였으며 900 mg/L Pb2+ 용액에서는 77.11±13.70%의 제거율을 보였다. Cd2+에 대해서는 비교적 낮은 제거율을 보였는데, 80 mg/L Cd2+ 용액에서 제거율은 85.46±2.22%로 나타났으나 농도가 높아짐에 따라 제거율이 낮아져 80%보다 낮은 제거율을 보였으며 400 mg/L Cd2+ 용액에서 제거율은 45.03± 2.04%로 나타났다(Fig. 3). Cd2+보다 Pb2+의 제거율이 더 높은 것은 Pb2+이 Cd2+보다 공유결합지수가 높아 흡착제 표면의 작용기와 상호작용하는 경향이 높은 것과, Pb2+의 흡착 기작에는 영가철에 의한 환원 작용이 포함되는 것 등이 그 이유일 것으로 추정된다[2,26,27]. 흡착 이후에 철 용출이 일어나지 않음을 확인하였다.
Li와 Zhang [26]에 따르면 중금속 혼합용액에서의 나노영가철을 이용하여 중금속을 흡착 제거할 경우 Pb2+가 Cd2+보다 흡착에서 우세함을 확인하였다. 본 연구에서는 혼합용액에 대한 흡착 경쟁성을 평가하지는 아니하였으나 순수한 용액에서는 선행 연구와 마찬가지로 Pb2+에 대한 흡착 제거율이 Cd2+에 비해 높게 나타났다. 이와 같은 점을 고려할 때 중금속 혼합용액이 폐수로 발생하는 현장에서 본 재료를 적용하기 위해서는 Cd2+이 Pb2+에 비해 제거율이 낮고 흡착 경쟁에서 우월하지 않은 점을 고려해야 할 것으로 생각된다. 단 실제 현장에서는 용액 성상 및 조건 등 현장 특이적 요소가 있으므로 이에 대한 별도의 실험과 해석에 따른 설계가 필요할 것으로 생각된다.
3.3. 등온흡착실험
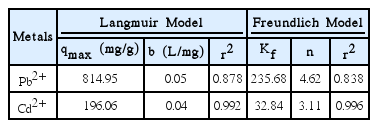
Langmuir 모형에서 Pb2+와 Cd2+에 대한 최대흡착능 qmax은 각각 814.95 mg/g과 196.06 mg/g으로 매우 높은 값으로 나타났다(Table 4). Seperation Factor인 RL은 1보다 작아 흡착 반응이 호의적임을 확인할 수 있으며, 농도가 높아질수록 가역성이 낮아지는 것을 확인하였다. RL이 Pb2+에 대해서 더 낮았기에 Pb2+ 흡착이 Cd2+ 흡착보다 호의적이다(Table 5).
Freundlich 모형에서 Freundlich 상수 Kf는 Pb2+와 Cd2+에 대해 각각 235.68과 32.84로 나타나 Pb2+에 대한 흡착능력이 더 우수함을 확인하였다. n은 Pb2+와 Cd2+에 대해 각각 4.62, 3.11로 나타났다. Freundlich 모형의 형태와 1보다 큰 n으로부터 저농도에서 높은 제거율을 가질 것으로 추론할 수 있다(Table 4).
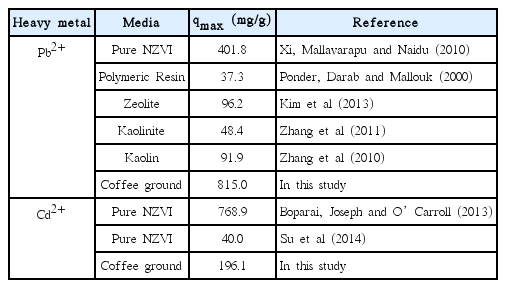
나노영가철-커피찌꺼기의 중금속 흡착능을 선행연구결과와 비교하기 위해 선행연구의 나노영가철의 중금속 흡착능을 Table 6에 정리하였다. Kaolin 등의 매질에 나노영가철을 부착시킨 선행연구보다 Pb2+에 대한 흡착능이 뛰어난 것으로 나타났으며, 나노영가철 자체의 흡착능보다도 본 연구에서 제조한 흡착제의 흡착능이 더 높은 것을 확인하였다[27~33]. Boparai 등의 연구결과에 따르면 나노영가철의 Cd2+ 최대흡착능은 768.9 mg/g으로 나노영가철-커피찌꺼기보다 흡착능이 높게 나타났다[32]. 그러나 나노영가철-커피찌꺼기의 철 함량이 174.96±19.43 mg/g이므로 영가철 단위 질량 당 Cd2+ 흡착량은 1,120.60 mg/g이므로 영가철 단위 질량당 흡착량은 나노영가철-커피찌꺼기가 더 우수한 것을 확인할 수 있다. 이와 같이 나노영가철-커피찌꺼기의 중금속 흡착능이 기존 연구보다 뛰어난 것은 BET 분석결과에서 살핀 바와 같이 커피찌꺼기가 나노영가철의 입자 간 응집 현상을 억제하여 넓은 표면적과 높은 반응성을 유지할 수 있기 때문인 것으로 추론된다.
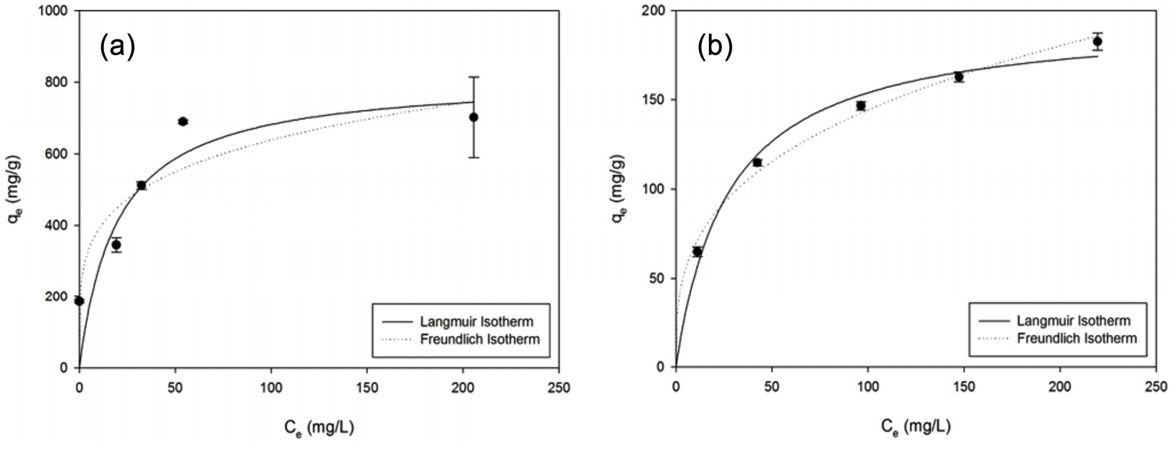
Fig. 4(a)와 Table 4를 통해 Pb2+의 경우 등온흡착곡선 모형과 잘 맞지 않고, 결정계수가 Langmuir 모형에 대해 0.878, Freundlich 모형에 대해 0.838로 낮게 나타남을 확인할 수 있다. Pb2+의 흡착평형특성이 일반적인 흡착 모형으로 설명되지 않는 것은 Pb2+의 제거 기작에는 흡착이 아닌 다른 경로의 반응이 수반되기 때문인 것으로 추정된다. Pb2+는 나노영가철에 흡착될 때 환원된 형태(Pb0)와 산화되어 석출된 형태(PbO)로 존재하는 것으로 알려져 있기에 여러 반응 경로를 평가하는 모형의 적용이 필요할 것으로 사료된다[26,27]. 이에 따라 흡착 지점을 결합에너지가 다른 두 가지가 있는 것으로 가정한 2-site Langmuir 모형을 적용하였으나 결정계수는 0.878로 변화가 없었다[24]. Pb2+ 제거 기작을 보다 잘 설명할 모형에 대한 연구가 필요한 것으로 사료된다.
Fig. 4(b)를 보면 Cd2+는 두 모형에 대해 모두 0.99 이상의 높은 결정계수를 보였다. 두 모형에 대해 모두 높은 결정계수를 보이므로 Langmuir 모형으로부터 흡착 지점이 단층이며 균일한 흡착면을 갖는다고 해석할 수 있다. 이는 Fe2+와 Cd2+의 표준 환원 전위차가 거의 없기 때문에(-0.41 V, -0.40 V) 나노영가철에 의한 Cd2+의 제거 기작은 표면 복합체 형성에 의한 흡착으로 알려진 것과 일치하는 결과이다[26,32].
3.4. 흡착반응속도
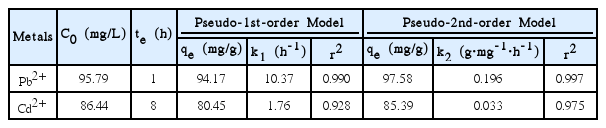
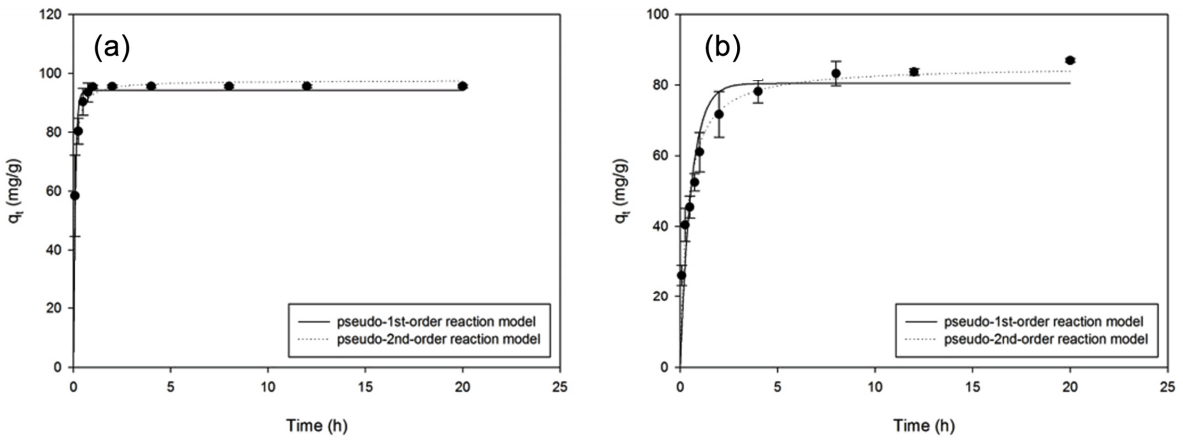
반응속도 실험결과를 Table 7과 Fig. 5에 제시하였다. 흡착 평형이 이루어지는 동안 철 용출은 이루어지지 않음을 확인하였다. Pb2+과 Cd2+은 각각 1시간, 8시간째에 흡착 평형에 도달하였다. Pb2+는 15분 이내에 80% 이상이 제거되는 것을 확인하였다. Cd2+는 초기 30분 째에 50% 이상의 Cd2+이 제거되었으나 반응속도가 점점 느려지며 서서히 흡착량이 증가하는 형태를 보였다. Pb2+의 경우 나노영가철로 수행한 선행 연구에 비해 평형도달시간이 빠르지 않았다. Zhang 등에 의하면 나노영가철을 Kaolin에 부착한 경우 30분 이내에 평형이 이루어졌다[30,31]. Cd2+의 경우 Boparai 등32)이 확인한 평형도달시간 24시간에 비해 빠르게 흡착 평형이 이루어짐을 확인하였다.
Pb2+의 경우 유사 1차 반응속도 모형과 유사 2차 반응속도 모형 모두에 적합한 형태를 보였고 결정계수도 0.99 이상의 높은 값을 보였다. Cd2+는 유사 1차 반응속도 모형보다 유사 2차 반응속도 모형에 적합한 형태를 보였고, 결정계수도 유사 2차 반응속도 모형에서 더 높은 값을 보였다. Cd2+는 유사 2차 반응속도 모형이 보다 적합하게 나타났기에, 나노영가철-커피찌꺼기에 의한 Cd2+ 흡착은 화학적 흡착으로 추정된다. 이는 Cd2+ 제거에 나노영가철의 Core-Shell 구조에 의한 표면 복합체 형성 기작이 작용한다는 기존 연구결과와 일치한다[26].
3.5. 물질 전달 메커니즘
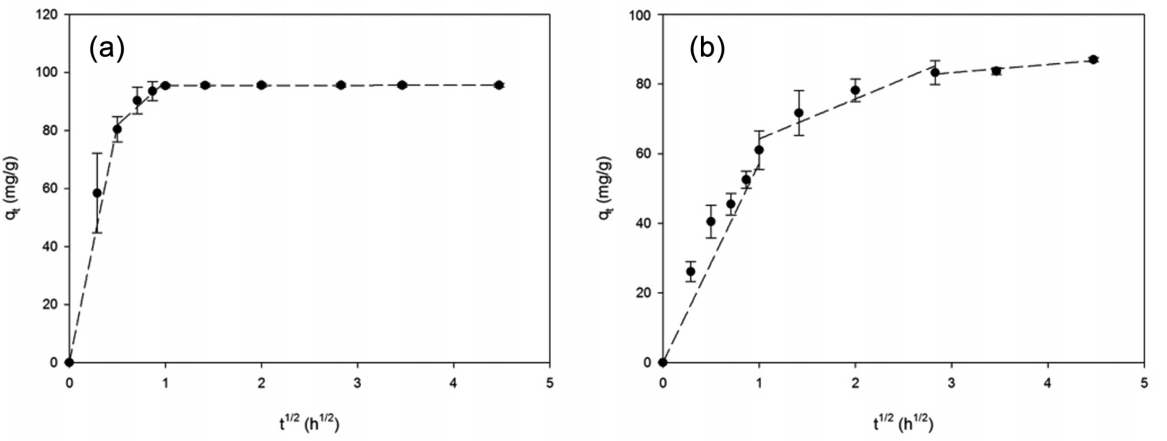
입자 내부 확산 모형을 나타내는 t0.5 - qt 그래프에서 Pb2+과 Cd2+ 두 경우 모두 세 가지 직선 구간을 갖는 것을 확인하였다. 초기의 가파른 직선은 표면 확산이 진행되는 구간을, 두 번째 완만한 곡선은 입자 또는 공극 내부로 확산되는 구간을 나타내며 마지막 수평 직선은 평형 구간을 나타낸다[22]. 두 중금속 모두 완만한 두 번째 구간을 갖는 것을 통해 속도 결정 단계는 표면 확산과 입자 내부 확산 두 가지 단계를 갖는 것을 확인하였다. 그 중 두 번째 직선에 대한 계수들을 Table 8에 정리하였다. Pb2+의 경우 0분에서 15분까지 표면 확산이 이루어진 뒤, 15분에서 60분까지 입자 내부 확산이 이루어졌으며, Cd2+의 경우 0분에서 90분까지 표면 확산이 이루어진 뒤 90분에서 8시간까지 입자 내부 확산이 이루어졌다. 두 경우 모두 표면 확산 시간이 더 짧았으며 표면 확산이 이루어질 동안 많은 양의 중금속이 제거되는 것을 확인할 수 있다(Fig. 6). Pb2+의 경우 표면 확산 및 입자 내부 확산 시간이 Cd2+에 비해 짧게 작용하였는데 이는 물질 제거 기작과 관련이 있을 것으로 추정된다. Pb2+은 공유결합지수가 높아 흡착제 내부의 표면작용기와 반응하려는 경향이 Cd2+보다 강하며, Pb2+가 Pb0(s)로 환원되며 흡착제 내부와 외부의 Pb2+의 농도차가 유지될 수 있다[2,26,27]. 그러나 Cd2+의 경우 표면 복합체 형성에 의해 제거되기에 입자 내부와 외부의 Cd2+ 농도차를 감소시키며 확산이 느려지는 것으로 추정된다.
4. 결 론
본 연구에서는 나노영가철을 커피찌꺼기에 부착시킨 재료를 합성하였고, 이 재료를 이용하여 산업폐수 중에 존재하는 대표적 중금속 이온인 Pb2+과 Cd2+을 흡착 제거하는 방안에 대해 연구하였다. 다만 현장 적용 시 pH, 온도, 이온 강도 등 다양한 요인이 영향을 미칠 수 있기에 이에 대해서는 각 현장별로 별도의 실험과 해석을 바탕으로 하는 설계가 필요할 것으로 생각된다. 흡착 평형 특성과 흡착 동력학 특성에 대해 연구한 결론은 아래와 같다.
1) 나노영가철-커피찌꺼기는 Pb2+와 Cd2+에 대해 나노영가철이나 다른 매질로 지지되는 나노영가철에 비해 높은 흡착능을 가진 것을 확인하였다. 이는 커피찌꺼기로 인해 나노영가철의 입자간 응집 현상이 억제되어 나노영가철의 표면적과 반응성이 크게 유지되었기 때문인 것으로 생각된다.
2) 나노영가철-커피찌꺼기의 Pb2+와 Cd2+ 흡착은 유사 2차 반응속도모형이 유사 1차 반응속도모형보다 더 잘 설명할 수 있는 것을 확인하였다. 이에 따라 흡착 기작이 화학적 흡착인 것으로 추론된다. 반응속도상수는 Pb2+ > Cd2+이며 흡착 평형시간은 Cd2+ > Pb2+인 것으로 나타났다. 나노영가철보다 나노영가철-커피찌꺼기의 Cd2+ 흡착 속도가 빠르기에 기존의 정화 방법보다 빠르게 Cd2+를 제거할 수 있을 것으로 기대된다.
3) 두 물질 모두 표면 확산보다 입자 내부 확산이 상대적으로 느리게 진행되었으며 표면 확산과 입자내부 확산 모두 속도결정단계로 작용하였다. 표면 확산 및 입자 내부 확산은 Cd2+보다 Pb2+에서 더 빠르게 진행되었는데, 이는 Pb2+은 공유결합지수가 높아 흡착제의 작용기에 대한 선호도가 높고, 입자 내부 확산 시 Pb2+에서 Pb0(s)으로 환원되므로 입자 내부의 Pb2+ 농도가 낮게 유지되기 때문인 것으로 추정된다.
4) 발생량이 많은 폐기물 커피찌꺼기를 활용하여 제조한 나노영가철-커피찌꺼기는 pH가 6, 온도가 20℃인 일반적인 조건에서 Pb2+와 Cd2+에 대한 흡착능이 우수하고 철 용출 등의 문제가 발생하지 않아 현장 적용 잠재력이 우수한 것으로 판단된다.
Acknowledgements
본 연구는 환경부의 폐자원에너지화 전문인력양성사업과 서울대학교 연구처의 “학부생연구지원사업”으로부터 지원을 받았습니다. 서울대학교 건설환경종합연구소의 기술 지원에도 감사합니다.