하수처리장 슬러지처리 계통에서의 인 제거 및 회수를 위한 Struvite 결정화 공정 적용성 평가
Assessment of the Struvite Crystallization Process for Phosphate Removal and Recovery from a Sludge Treatment System of a Domestic Wastewater Treatment Plant
Article information
Abstract
최근 부영양화 문제, 인광석 자원이 부족해지고 있는 국제적 상황, 하수처리장 관로 스케일 문제 등에 대응하기 위하여, Struvite 결정화 공정을 하수처리장 슬러지처리 계통의 고농도 인 제거/회수에 적용하려는 시도를 하고 있다. 본 연구는 실제 국내 하수처리장 슬러지처리 계통에 대한 Struvite 결정화 공정 적용 가능성을 평가를 목표하여, 첫째, 운영자료 및 현장측정자료 분석을 통하여 실제 하수처리장 슬러지처리 계통의 인 농도 및 물질수지를 분석하였고, 둘째, 평형화학 계산 프로그램을 활용하여 Struvite 결정화 반응 포텐셜, 이에 따른 최적 Mg2+ 주입량, pH 등에 관해 연구하였고, 셋째, 실험실규모 배치실험을 통해 실제 Struvite 결정화 반응 동역학에 대해 연구하였다. 슬러지처리 계통에서의 인 농도 및 물질수지를 분석하였을 때, Struvite 결정화 공정은 소화슬러지 및 탈리여액에 적용함이 바람직한 것으로 파악되었다. 평형화학 계산결과, 안정적인 공정 운영을 위해서는 pH 8 이상, Mg2+ 주입량은 몰비 기준 이론 요구량의 1.2배 이상을 첨가해야 하는 것으로 파악하였다. 그리고, Struvite 결정화 반응 동역학은 1차 반응속도식을 따르고, Struvite 결정화 반응이 평형상태에 도달한 경우, 모든 pH 조건에서 인산염인 제거율이 80% 이상으로 우수하게 나타났다. Struvite 결정화 반응 시 NaOH 첨가 없이 폭기만으로 CO2 탈기를 일으켜 반응 종결 후 pH 8.7 이상까지 상승했으며, Mg2+ 주입원의 경우 간수 등 저가 대체물질을 활용할 수 있으므로, 약품비에 의한 운영비 증대 없이 Struvite 결정화 공정을 적용할 수 있으리라 판단된다.
Trans Abstract
Eutrophication and shortage of phosphate ore raise the necessity of phosphate removal and recovery from wastewater treatment plants. Especially, a sludge treatment system containing highly concentrated phosphate should be targeted for phosphate removal and recovery. This study thus aimed to evaluate the capability of the struvite crystallization process for phosphate removal and recovery from a sludge treatment system of a wastewater treatment plant. Analysis on phosphate concentrations and masses in the sludge treatment system revealed that digested sludge and centrate have phosphate concentrations and masses, high enough to adopt the struvite crystallization process. Chemical equilibrium modeling indicated that the struvite crystallization reaction substantially occurred with pH higher than 8 and Mg2+ concentration 1.2 times higher than its theoretical requirement. A series of batch tests with digested sludge and centrate indicated that the phosphate removal reaction by struvite crystallization followed a first-order kinetics and reached over 80% removal efficiency at equilibrium. Aeration in the batch tests was found to purge CO2 in sludge or centrate and increase pH up to 8.7, without adding NaOH. Thus, we concluded that the struvite crystallization process could be an efficient and economical process for phosphate removal and recovery from a wastewater treatment plant.
1. 서 론
질소, 인 등 영양염류는 하천이나 호소로 유입될 경우 부영양화를 일으키는 주원인물질이기에 적절한 처리가 수질 관리 측면에서 매우 중요하다[1]. 특히 인광석에서 주로 얻어지며 식품이나 비료 등으로 널리 사용되고 있는 인 화합물들은 환경적으로 부영양화의 원인이 되며, 조류 독소를 발생시키는 오염원이 되기도 한다[2~4].
인광석은 세계 매장량의 80%가 미국, 중국, 남아공, 모로코 등에 편중되어 있고 향후 50년 이내에 고갈될 것으로 예측되어, 미국, 유럽, 일본 등 선진국에서는 하수처리장으로부터 인 처리 및 회수를 시도하고 있다[5~7]. 인 처리/회수의 가장 일반적인 방법은 하․폐수에서 화학적 침전을 통해 인삼염 결정체 형태로 고형화 처리하는 방법이지만, 이와 같이 얻어지는 슬러지는 불순물, 수분함량, 유기물질 등의 함량이 높아 재이용에는 부적합하여 대부분 매립하고 있는 실정이다[8]. 하지만 인을 전량 수입하고 있는 국내 실정과 인광석 자원이 부족해지고 있는 최근의 국제적 상황에 맞추어 우리나라에서도 하수처리장으로부터 인을 회수하고, 재활용하는 기술을 개발, 보급하는 것이 반드시 필요하다[2,3,9].
고순도 인회수를 위한 대표적인 공정은 Struvite 결정화 공정으로 알려져 있다. Struvite는 Mg2+, NH4+ , PO43-가 1:1:1의 몰비로 결합한 결정체이며 Magnesium Ammonium Phosphate (MAP)로 알려져 있다[10]. Struvite 결정화 공정은 질소와 인을 동시에 처리할 수 있고, 반응시간이 짧기 때문에 부지면적이 작게 소요되며, 생물학적 처리공정과 연계처리가 가능하여 하수처리장 전체 처리효율을 증진시킨다는 장점을 가지고 있다[11,12].
하수처리장 소화슬러지 및 소화상등액을 이송하는 관에 Struvite 결정체에 의한 스케일이 발생하는 현상은 널리 알려져 있다[10,12]. 이와 같은 관로 스케일링이 발생하면 펌프 부하 증대에 따른 운영비가 부가적으로 소요되며, 심할 경우에는 관을 교체해야 하므로 하수처리장 운영상 심각한 문제를 초래한다. 또한, 소화슬러지에 포함된 인산염 인은 고형물 사이 공극을 증대시키는 역할을 하여 탈수성을 저하시키는 것으로 알려져 있다. 따라서, Struvite 결정화 공정의 적용은 인 처리/회수 뿐 아니라, 관로 스케일링 방지, 탈수성 증대 등 다양한 하수처리장 운영상 문제를 해소할 수 있는 효과적인 방법이 될 수 있다[6,13].
본 연구에서는 Struvite 결정화 공정을 국내 하수처리장, 특히 슬러지처리 계통에 도입가능한지 그 가능성을 평가하고자 하였다. 먼저, 운영자료분석, 현장실험을 통하여 슬러지 처리 계통에서의 인 농도 및 물질수지를 평가하였고, 수질 평형화학 계산 프로그램을 활용하여 Struvite 결정화 평형화학 연구, 즉 주어진 물리화학 조건에서 Struvite 결정화 공정의 PO4 - P(인산염인) 최대제거율, Mg2+ 최적 주입량, 최적 pH 조건 등을 평가하였다. 마지막으로 실험실규모 배치실험을 수행하여 Struvite 결정화 공정 동역학(속도론)을 평가하고 하수처리장 슬러지처리 계통에 실적용이 가능한지 평가하였다.
2. 연구방법
2.1. 연구대상 하수처리장
본 실험은 struvite 결정화 공정 적용성을 평가하기 위하여 지방 광역시에 소재한 대표적인 하수처리장 슬러지처리 계통에 대하여 연구를 수행하였다. 먼저, 대상 하수처리장에 대한 2014 - 2016년 운영자료 분석을 통해, 대상 하수처리장 슬러지처리 계통 내 반류수, 소화월류수, 소화슬러지, 탈리여액에 포함된 PO4 - P 농도 및 물질수지를 파악하고, 이를 바탕으로 슬러지처리 계통 내 Struvite 결정화 공정 적용이 가능한 대상을 모색하고자 하였다.
2.2. Struvite 결정화 관련 수질화학 조성 분석
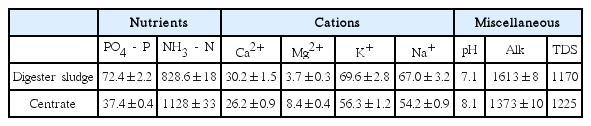
하수처리장내 Struvite 결정화 관련 수질화학 조성을 파악하기 위해 현장에서 슬러지처리 계통 각각 공정에 대한 시료를 채수하여 Mg2+, Ca2+, K+, Na+, PO43-, NH4+, Alkalinity, TDS, pH를 측정하였다. 먼저, 양이온 금속류인 Mg2+, Ca2+, K+, Na+은 0.45 µm pore-sized CA membrane filter (Hyundai Micro, Korea)에 여과 및 유기물 산화의 전처리를 거친 후 ICP-AES (Inductively Coupled Plasma-Atomic Emission Spectroscopy) (Thermo Fisher Scientific, USA)를 활용하여 측정하였다. PO43-, NH4+, Alkalinity는 각각 Standard Methods[14]에 제시된 방법에 의거하여 측정하였다. 그리고, pH 및 TDS는 IQ-40 수질측정기(Hach, USA)를 이용하여 측정하였다. 각각의 측정항목, 측정법은 Table 1에 정리하였다.
2.3. Visual MINTEQ
Visual MINTEQ (vminteq.lwr.kth.se)는 미국환경보호청(USEPA)이 보급하는 지구화학적 평형을 이루는 계의 화학종을 산출하는 모델로서 환경에서 일어나는 용해된 상태, 흡착된 상태, 기체상, 그리고 고체상 간에 이루어지는 화학 평형을 계산할 수 있다. 본 연구에서는 Struvite 결정화 공정의 PO4 - P 제거율, 최적 운전 조건 및 약품주입량을 평가하기 위해 Visual MINTEQ을 사용하였다. Visual MINTEQ 프로그램의 초기 입력자료는 Mg2+, Ca2+, K+, Na+, PO43-, NH4+, Alkalinity, pH로써 앞서 소개한 수질화학분석을 통하여 측정한 값을 이용하였다(Table 1). Struvite 결정화 반응에 비하여 화학평형, 즉 결정화에 아주 오랜 시간이 걸리는 방해석(Hydroxyapatite, Dolomite, Calcite, Magnesite 등)은 화학평형 계산에서 제외하였다[15~17]. 기타 조건으로는 온도 25℃로 설정하였고, pH 및 이온강도는 측정한 화학조성으로부터 계산되도록 설정하였다. Fig. 1은 Visual MINTEQ의 초기화면을 보여주고 있다.
2.4. Struvite 결정화 배치실험
Struvite 결정화 평형화학 이외에, 시간에 따른 결정체 형성 및 PO4 - P 제거 동역학을 평가하기 위하여, 하수처리장 슬러지처리 계통 중 Struvite 결정화 공정을 적용하기에 충분한 PO4 - P 농도를 가진 소화슬러지 및 탈리여액에 대하여 실험실규모 배치실험을 수행하였다. 모든 시료는 채수 이후 4℃ 이하로 냉장 보관하여 미생물의 반응을 최소화하였으며 실험 전 중탕하여 20 ± 1℃로 온도 조절 후 실험하였다. 먼저, 고농도 질소/인이 함유된 소화슬러지 및 탈리여액 1 L를 임호프 콘에 투여하고 에어펌프를 활용하여 폭기를 실시하였다(Fig. 2). Visual MINTEQ으로 평가된 최적 Mg2+ 주입량(PO4 - P 당량의 1.5배)을 먼저 첨가하고, NaOH를 첨가하여 pH를 조정 후 배치실험을 수행하였다. 각각의 소화조 슬러지 및 탈리여액에 대하여 1 N NaOH를 주입하여 pH 7, 8, 9로 조정하여 배치실험을 수행하였다. 배치실험이 진행되는 동안 5분, 10분, 30분, 1시간, 2시간, 3시간, 6시간 경과 후 샘플링하여 1.2 µm GFC 필터(Whatman, USA)에 1차 여과 후, 0.45 µm CA membrane 시린지 필터(Hyundai Micro, Seoul, Korea)로 여과하여 여과샘플에 대한 PO4 - P 및 NH3 - N을 측정하였다. 폭기를 통해 슬러지가 충분히 교반되어, 별도의 기계 교반은 하지 않았다.
3. 결과 및 고찰
3.1. 슬러지 처리계통 인물질 수지
운영자료 및 현장측정자료 분석을 통해 하수처리장 슬러지처리 계통에서의 Struvite 결정화 공정 제한기질인 PO4 - P 총량 및 물질흐름을 파악하고자 하였다. 이를 통하여 Struvite 결정화 공정의 안정적 적용을 위해 PO4 - P 농도가 충분히 존재하는지 파악하고, 공정 적용을 통해 제거/회수 가능한 PO4 - P 제거(회수)량을 산정하고자 하였다. 대상 하수처리장 반류수, 소화월류수, 소화슬러지, 탈리여액의 PO4 - P 농도는 각각 12.2, 85.88, 72.44, 37.4 mg/L로 나타났다(Fig. 3 (a)). 이와 더불어, 전체 반류수에 포함된 PO4 - P 총량은 343.21 kg/d으로 평가되었고, 각각의 소화월류수, 소화슬러지, 탈리여액에 포함된 PO4 - P 총량은 29.63 kg/d, 107.07 kg/d, 50.30 kg/d로 나타났다. 반류수에 포함된 PO4 - P 총량을 100%로 산정했을 때, 소화월류수, 소화슬러지, 탈리여액에 포함된 PO4 - P 분율은 각각 8.63%, 31.20%, 14.66%로 나타났다(Fig. 3(b)).

(a) PO4 - P concentrations in the return flow, anaerobic digester overflow, digester sludge, and centrate. (b) respective ratio of PO4 - P masses, compared to the total PO4 - P mass in the return flow (343kg/ d in the return flow).
반류수에 포함된 PO4 - P 총량은 크지만 상대적으로 PO4 - P 농도가 낮아 Struvite 결정화 공정 적용이 어려운 것으로 파악되었다. 소화월류수 및 소화슬러지는 PO4 - P 총량기준 약 40%를 차지하고 또한 농도가 높아 Struvite 결정화 공정 적용 시 인제거/회수에 큰 효과를 나타낼 것으로 사료된다. 또한, 소화슬러지에 Struvite 결정화 공정을 적용할 경우 탈수능 증대, 약품 주입량 감소 등 부가적인 이익을 얻을 수 있으나, Struvite 결정 분리가 어려워 회수율과 결정체 순도가 떨어질 것으로 판단된다. 이에 반하여, 탈리여액에 Struvite 결정화 공정을 적용할 경우, PO4 - P 제거 총량은 약 15%로 작지만 Struvite 결정체 순도가 높아 상업적인 가치가 높을 것으로 판단된다. 따라서, Struvite 결정화 공정 적용 시 상대적으로 인산염을 고농도로 포함하는 소화슬러지(소화월류수 포함) 및 탈리여액에 적용하는 것이 바람직한 것으로 판단된다.
3.2. Visual MINTEQ을 이용한 Struvite 결정화 평형화학 연구
Struvite 결정화 공정의 인 제거율, 최적 운전 조건 및 약품주입량을 평가하기 위해 화학 평형모델 Visual MINTEQ를 사용하였다. Table 2는 대상 하수처리장 소화슬러지 및 탈리여액의 Struvite 결정화 반응과 관련한 수질화학조성의 측정값을 나타내고, V-minteQ 입력자료로 활용되었다. 일반적으로 Struvite 결정화 공정의 결정 인자는 pH 및 Mg2+로 알려져 있는데, 소화슬러지, 탈리여액 원시료에는 Struvite 결정화 공정을 도모하기 위한 Mg2+의 농도가 매우 부족한 것으로 나타났다. 또한 원시료의 pH는 소화슬러지의 경우 7.1로 Struvite 결정화 공정을 도모하기에는 다소 낮은 것으로 나타났으며, 탈리여액의 경우 8.1로 결정화 공정을 일으킬 수 있을 정도로 비교적 높게 나타났다.
Input data used for chemical equilibrium simulation of struvite crystallization (unit: mg/L, except pH)
Visual MINTEQ 프로그램을 Struvite 결정화 시물레이션에 적용하기 앞서, Table 2에 주어진 수체 화학조성이 장시간 경과한 후 화학평형 도달 시, Struvite와 더불어 발생 가능한 여타 결정체 조성을 파악하고자 하였다. 이를 위하여, Visual MINTEQ의 전체 결정화 반응 데이터베이스를 활용하여, 소화슬러지 시료에 Struvite 결정화 반응에 필요한 당량만큼의 Mg2+를 주입한 조건으로 평형화학 시물레이션을 수행하였다. Fig. 4(a)에 나타난 바와 같이, Struvite 결정체 이 외에, Hydroxyapatite (Ca10 (PO4)6 (OH)2)가 약 0.06 ~ 0.145 mmol/L, 그리고 Dolomite (CaMg(CO3)2)가 약 0.32 ~ 0.46 mmol/L로 상당부분 발생함을 알 수 있었다. 결정화 반응을 통하여, Hydroxyapatite에 의해 5 ~ 14 mg/L의 PO4 - P가 제거됨을 파악하였고, pH 7, 7.5 조건에서는 전체 PO4 - P 제거량 중 상당부분을 차지함을 알 수 있다(Fig. 4(b)). 하지만, pH 8 이상의 경우, Hydroxyapatite에 의한 PO4 - P 제거량은 전체의 10~20% 정도로 비교적 낮게 나타났다. 이와 같이 Hydroxyapatite, Dolomite는 평형상태에서 결정체를 형성하지만, 기존 연구에 따르면 이들 결정체의 결정화 속도는 Struvite의 결정화 속도에 비하여 아주 느린 것으로 나타났다. 또한, Hydroxyapatite는 Mg2+에 의해 결정화에 방해를 받는 것으로 알려져 있다. 따라서, 본 연구에서는 Celen 등[15] 연구에서 제시된 바와 같이, Hydroxyapatite, Dolomite 등 결정화 속도가 느린 반응들은 Visual MINTEQ 데이터베이스에서 제외하고, Struvite 결정화 반응에 중점을 두어 평형화학 시물레이션을 수행하였다.
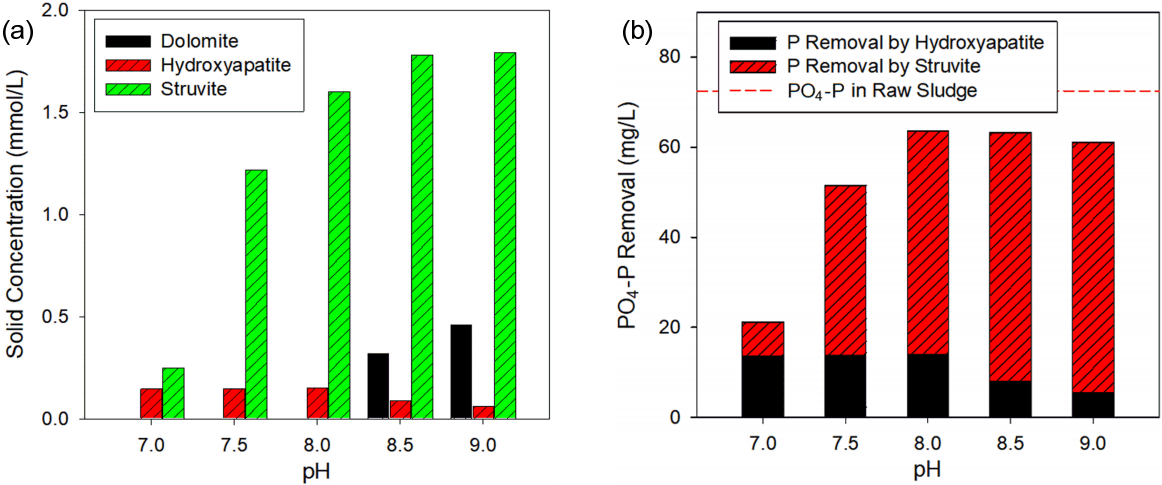
Results from Visual MINTEQ chemical equilibrium simulation for the digested sludge dosed with Mg2+. (a) solid concentration (mmol/L) formed by Struvite, Hydroxyapatite, and Dolomite crystallization and (b) PO4 - P removal (mg/L) by Struvite and Hydroxyapatite crystallization.
Struvite 결정화 반응 평형화학 시물레이션을 위하여, Visual MINTEQ 프로그램을 이용하여 소화슬러지, 탈리여액의 인 제거 포텐셜, 최적 운전 조건을 찾기 위해 Mg2+ 주입량 및 pH를 독립변수로 설정하였고, 반응 후 PO4 - P 농도를 종속 변수로써 살펴보았다. 독립변수로써 Mg2+ 주입량은 Struvite 결정화 반응 이론 요구량 기준 0배(첨가하지 않음), 1배, 1.2배, 1.5배, 2배로 설정하였고, pH는 7, 8, 8.5, 9로 변화시켜 평형화학 시물레이션을 수행하였으며, 종속변수로써 반응 후 PO4 - P 농도를 결과물로 산출하였다. 시물레이션의 결과는 Fig. 5와 같이 3차원 바 그래프로 표현하였으며, Mg2+ 주입량, pH를 각각 종속변수로써 x, y축에, 그리고 반응 후 PO4 - P 농도를 z 축으로 설정하였다.
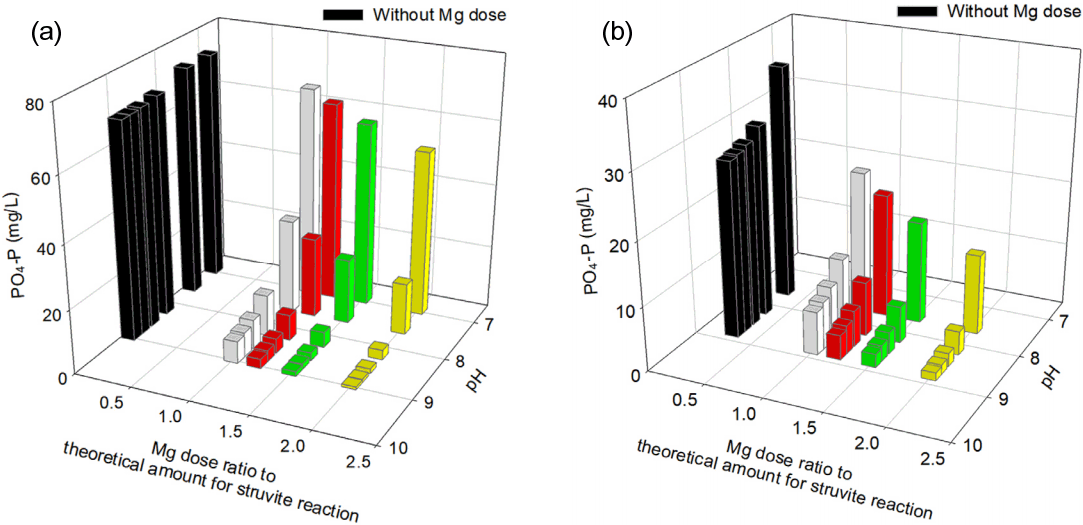
The output of the Visual MINTEQ simulation for the struvite crystalization process with (a) digested sludge and (b) centrate.
Mg2+이 주입되지 않을 때는 Struvite 결정화 반응이 거의 일어나지 않은 것으로 나타났으며, Mg2+ 주입량은 1.2배 이상일 때 PO4 - P 기준 80% 이상 제거가 되었다. 또한 pH 8이상 일 때 PO4 - P 기준 80% 이상 제거가 되며 그 이하에서는 Struvite 결정화 반응이 발생하지 않았다. Struvite 결정화 반응에서 PO43-, NH4+ , Mg2+이 1:1:1로 반응하는데 마그네슘의 양이 부족할 경우, 결정화 반응이 이루어지지 않았다. 또한 pH 7.5 이하에서의 반응은 pH 8 이상일 때와 큰 차이를 보여, pH는 Struvite 결정화에 중요한 매개변수로 파악되었다. Mg2+은 당량기준 1.5배, 2배 혹은 그 이상 주입하여도 인 제거율은 더 이상 증대되지 않는 것으로 나타났고, pH는 8 이상일 경우 인 제거율이 더 이상 증대되지 않는 것으로 파악되었다. 따라서, 하수처리장 슬러지처리 계통의 소화슬러지, 탈리여액에 대해 Struvite 결정화 공정에 적용할 경우, 공정을 안정적으로 운영하기 위해서는 Mg2+ 주입을 1.2배 이상 주입, pH를 8 이상 유지하여야 한다는 공통적인 결과를 얻을 수 있었다.
3.3. 배치실험을 통한 Struvite 결정화 동역학 연구
Fig. 6는 대상 하수처리장의 소화슬러지, 탈리여액을 재료로 수행한 Struvite 결정화 배치실험에서 측정 시간대별 PO4 - P 농도를 나타낸 것이다. 소화슬러지, 탈리여액에 대한 Struvite 결정화 동역학 실험에서 정상상태에 도달하는데 걸리는 시간은 약 3-6시간 정도로 나타났다. 또한, 기존 연구에서 보고된 바와 같이 Struvite 결정화 동역학 배치실험은 1차 반응속도식을 잘 따랐다[17~20]. 배치실험에 파악된 중요한 사실은, pH 조정을 하지 않고 폭기에 의해 반응 후 최종 pH가 약 9에 도달할 수 있는 것으로 파악되었다. 이는 폭기에 의해 소화과정에서 생성된 CO2 가스가 탈기되어 pH가 상승 된 것으로 판단된다. 만약 충분한 체류시간이 주어진다면 별도 NaOH(가성소다) 등 pH 조정 약품을 첨가하지 않아도 폭기만으로 pH를 충분히 상승시켜 Struvite 결정화 공정을 가속화할 수 있는 것으로 나타났다[7]. 하지만, Struvite 결정화 공정 적용에 있어서 폭기에 필요한 시설 및 운영(에너지) 비용이 소요될 것으로 판단되며, 향후 실 적용 시 소요 약품비용과 폭기시설에 대한 비용 평가가 면밀히 이뤄져야 할 것으로 판단된다.
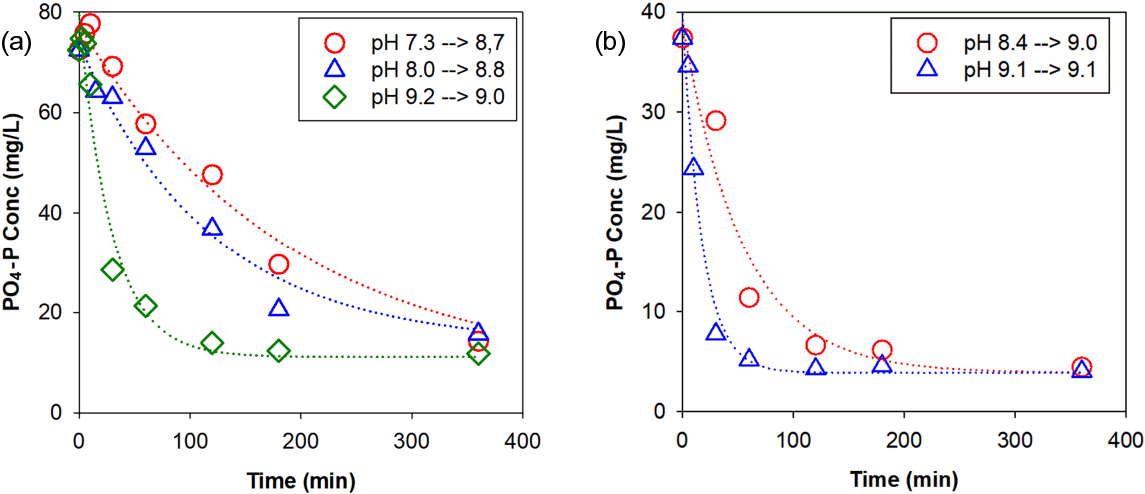
Batch test results for investigating struvite crystallization kinetics. The two sets of batch tests were performed with (a) digested sludge and (b ) centrate.
Fig. 7은 하수처리장 소화슬러지 및 탈리여액 배치실험에서 Struvite 결정화 반응 종료 후, 즉 평형 도달 후 pH 및 영양염류(PO4 - P, NH3 - N) 측정결과를 나타낸다. 앞서 소개한 바와 같이, pH의 경우 NaOH를 주입하지 않고 폭기를 통해 Co2 가스를 탈기 하더라도 8.7 이상 상승하는 것으로 파악되었다. Struvite 결정화 반응 평형 후, 소화슬러지 및 탈리여액 PO4 - P 농도는 각각 10~15, 4 mg/L로 나타났고, 이는 80% 이상의 PO4 - P 제거율을 나타낸다. 이와 더불어, NH3 - N 농도는 Struvite 결정화에 필요한 당량보다 10배 이상 제거됨을 알 수 있었는데 이는 Free Ammonium에 의한 탈기(stripping)의 영향으로 판단된다[21,22].
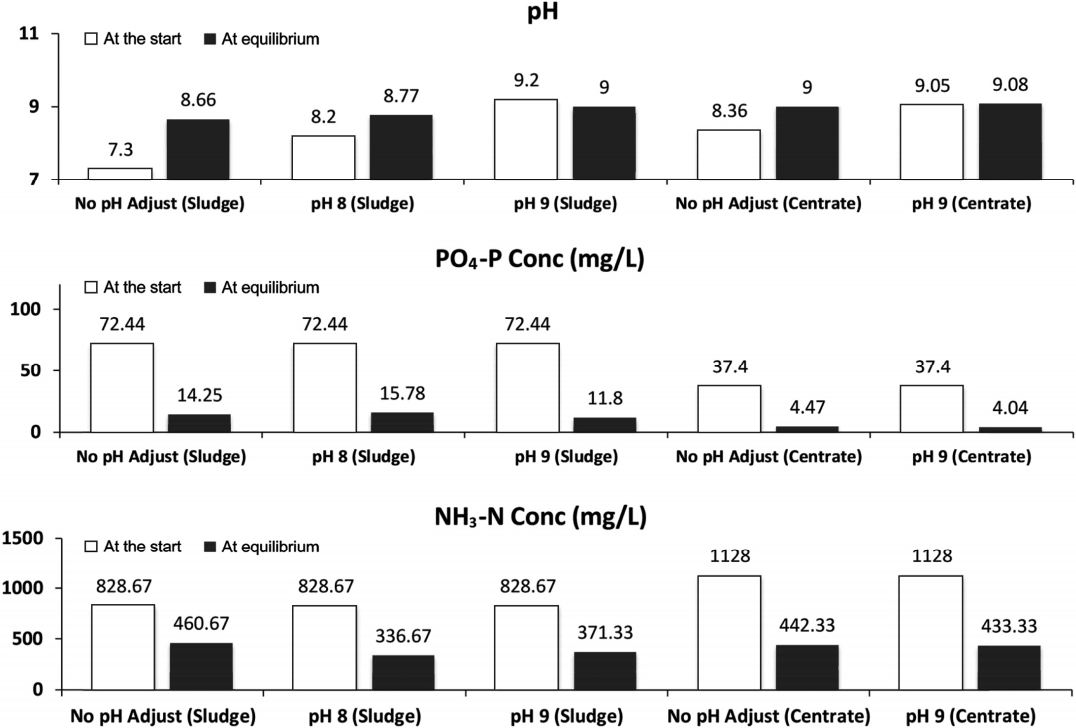
pH, PO4 - P, NH3 - N concentrations, measured at the beginning (white) and at the end (black) of the batch tests of struvite crystallization.
구미 선진국을 중심으로 Struvite 결정화 공정을 인 제거/회수에 다양하게 적용하고 있는 상황이다. 순도 높은 Struvite 결정체 회수를 통한 경제적 이윤을 창출하고자 하는 경우는 탈리여액에 Struvite 결정화 공정을 적용하고, 이에 반하여 관로 막힘 방지, 슬러지 탈수율 증대 등의 운영상의 장점을 취하고자 할 경우는 소화슬러지에 적용하고 있다. 전자에 해당하는 대표적 상용 공정으로 Ostara PearlⓇ (Ostara Nutrient Recovery Technologies Inc., Vancouver, Canada) (www.ostara.com) 공정이 있다. Ostera Pearl 공정은 상향류 흐름을 적절히 제어하여 탈리여액으로부터 Struvite 결정체를 쉽게 분리, 회수할 수 있는 핵심기술을 가진 대표적 Struvite 결정화 공정이다. 후자에 해당하는 대표적인 공정인 AirPrexTM (CNP-Technology Water and Biosolid GmbH, Schwarzenbek, Germany) (www.cnp-tec.com) 공정이 있으며, 이 공정은 Struvite 결정체를 회수하기 위해 중력분리, 세척의 방법을 적용하고 있으나 슬러지를 일부 포함하므로 결정체의 순도는 다소 낮다.
본 연구의 결과와 현재까지 Struvite 재이용 비료 사용을 금하고 있는 국내 상황을 고려한다면, 국내 하수처리장들의 경우 Struvite 결정화 공정을 소화슬러지에 적용하여 관로 막힘 방지, 슬러지 탈수율 증대 등의 운영상의 장점을 취하는 것이 바람직할 것으로 판단된다. 소화슬러지가 탈수기로 이동하기 전 약 6 ~ 12시간 정도의 짧은 체류시간을 가진 폭기조를 설치하고 마그네슘(혹은 저가의 간수)을 투여하여 Struvite 결정화를 도모하게 된다면, 관로 막힘 방지, 슬러지 탈수율 증대의 효과를 가져 올 수 있으리라 판단된다. 향후, 관계 법령의 개정으로 회수 Struvite 결정 비료의 사용이 허용된다면, 기존 포기공정을 결정체 분리/회수를 할 수 있도록 소규모 싸이클론 형태의 고액분리장치를 설치하여 Struvite를 분리/회수할 수 있으리라 판단된다.
4. 결 론
하수처리장 반류수 질소/인 회수를 위한 Struvite 결정화 공정 적용성 평가를 위해 운영자료 및 현장측정자료 분석을 통한 공정 적용성 평가, Visual MINTEQ를 활용한 struvite 결정화 평형화학 연구를 통한 최적 pH 및 약품주입량 평가, 그리고 배치실험을 통한 Struvite 결정화 동역학 연구를 수행하였다. 본 연구를 통해 얻은 결론은 다음과 같이 요약된다.
1) Struvite 결정화 공정 적용 시 PO4 - P를 고농도로 포함하는 소화슬러지 및 탈리여액에 적용하는 것이 바람직하며, 관로 스케일링 방지, 슬러지 탈수성 증대 등 운영상 문제해결을 위해서는 소화슬러지에, 고순도 Struvite 결정체 회수를 위해서는 탈리여액에 적용하는 것이 바람직하다.
2) 안정적인 Struvite 결정화 공정 운영을 위해서는 pH 8 이상, Mg2+ 주입량은 몰비 기준 이론 요구량의 1.2배 이상을 첨가하는 것이 바람직하며 pH는 최종 인 농도를 결정하는 요소일 뿐만 아니라 반응속도까지 결정하는 중요한 매개변수로 나타났다.
3) Struvite 결정화 공정 운영에 있어서, NaOH 주입없이 폭기만으로 pH가 8.7 이상 상승할 수 있고, Mg2+의 경우 바닷물, 간수 등 저가 대체물질을 활용할 수 있으므로 약품비에 의한 운영비 증대는 문제가 되지 않을 것으로 판단된다. 하지만, 실 적용시 폭기시설 설치, 운영 등에 따른 비용 검토가 필요할 것이다.
Acknowledgements
이 논문은 2016년 대구녹색환경지원센터의 연구개발사업의 재원으로 지원받아 수행된 연구입니다.