담수 퇴적물의 영양염 용출 측정 방법에 관한 고찰
A Study on the Measurement Method for Benthic Nutrient Flux in Freshwater Sediments
Article information
Abstract
퇴적물이 수층의 영양염 분포에 미치는 영향을 평가하기 위해서 퇴적물의 용출률을 정확하게 측정할 필요가 있다. 이에 본 연구에서 퇴적물 용출률 측정 방법 중 퇴적물 코어 배양법을 대상으로 용출률의 측정 조건과 실험 절차를 제시하였다. 낙동강 수계 중류에서 2015년 7월에 표층이 교란되지 않은 퇴적물 코어 시료를 채취하여, pre-incubation 시간(6, 12, 24시간), 초기 산소농도(포화도 90, 70 50%), 확산경계층의 두께(0, 0.6-0.8, 1.2-1.4 mm), 배양 온도(10, 17, 20, 25℃) 등을 여러 가지 조건으로 조성하여 측정한 영양염 용출률의 결과를 그 바탕으로 하였다. 네 가지 주요 환경 조건이 달라지면, 안정화 시간 동안 유기물 분해 및 산화 과정에 의한 화학 조성 변화, 퇴적층의 산화-환원 환경 변화에 따른 흡착 및 탈착, 퇴적물-수층 경계면에서의 수리역학적 상황 변동에 의한 물질 교환 증감, 퇴적물 내 미생물의 활성 증가 등을 야기하여 퇴적물의 영양염 용출률에 영향을 미친다. 따라서, 퇴적물 코어 배양법으로 실제 현장값과 유사한 결과를 생산하기 위해서는 현장 심수층의 수온 및 용존산소 농도, 유속을 자연 상태와 가깝게 재현하고 퇴적물 시료 채집 후 되도록 빠른 시간 안에 배양 실험을 수행해야 한다. 두 개의 반복구에 대하여 퇴적물 코어 배양법으로 영양염 용출률을 측정하였을 때 대부분의 실험 조건에서 상대 백분율차가 20% 이하였다. 측정 조건과 절차를 엄밀히 준수하여 실험하였을 때 정밀도를 확보할 수 있는 것으로 사료되며, 향후 측정 결과의 정확도를 확인하기 위하여 현장 측정법과 비교할 예정이다.
Trans Abstract
Accurate measurement of benthic nutrient fluxes (BNF) is a prerequisite for evaluating the effect of sediments on nutrient cycle in the surface water. The intact sediment cores were collected in July 2015 at the midstream of Nakdong River. We identified pre-incubation time (6, 12, 24 hr), dissolved oxygen concentration (90, 70, 50% saturation), diffusive boundary layer thickness (0, 0.6-0.8, 1.2-1.4 mm), and incubation temperature (10, 17, 20, 25℃) as the most important control factors, and measured the BNF fluctuation with the variation of these factors using the laboratory sediment core incubation method. Since the chemical composition, redox condition, hydrodynamic regimes and microbial activities at the sediment-water interface were changed as a result of the alteration of control factors, sediment core incubation should be conducted under as close to the natural conditions of study site as possible, in order to produce the results similar to actual values. Relative percentage differences between two replicates were below 20% in most control factors, which showed satisfactory precision for strict compliance with the experimental conditions and procedures. In the further studies, we will compare the results of core incubation with those of in situ measurements to confirm the accuracy of the sediment core incubation method.
1. 서 론
1.1. 하천‧호소 퇴적물에서 영양염 용출의 중요성
하천과 호소의 퇴적물은 담수 생태계를 구성하는 기본 요소 중 하나로서, 수층과 유기적으로 연결되어 있으며 그 경계면에서 끊임없이 상호작용이 일어난다. 수역 주변의 다양한 자연적‧인위적 공급원으로부터 유입되는 영양염(nutrients)과 유기물(organic materials), 미량금속(trace metals) 등은 탄소 동화, 흡착 등을 통해 침강 입자와 결합하여 퇴적물에 축적되었다가, 환경 조건이 변하면 다시 수층으로 용출될 수 있다. 즉, 퇴적물 내에서 일어나는 초기 속성작용(early diagenesis)과 퇴적물과 수층 사이의 물질 이동이 수질에 직‧간접적으로 영향을 미친다[1~3].
퇴적물로 유입되는 유기물은 대기나 육상 기원의 타지성 유기물(allochthonous organic matter)과 광합성 및 화학합성에 의해 수역 내에서 생산되는 자생성 유기물(autochthonous organic matter)로 구성된다. 외부에서 유입되거나 수층에서 생성된 유기물은 침강 입자와 결합하여 침강하며, 이때 유기물이 분해되기 시작한다. 수심이 깊은 호수나 해양 환경에서 유기물 분해 과정은 주로 수층에서 일어나지만[4,5], 하천과 같은 수심이 얕은 환경에서는 유기물 대부분은 퇴적물로 유입된다[6]. 유기물이 퇴적물에 유입되면 미생물에 의해 연속적으로 분해된다(Table 1). 수층에서 산소가 공급된다면, 호기성 미생물이 산소를 전자수용체(electron acceptor)로 이용하여 유기물을 분해한다. 호기성 호흡은 자유 에너지(Gibbs free energy) 수율이 가장 크지만, 용존 산소는 퇴적물 표층의 수 mm 내에서 고갈되기 때문에 유기물은 대부분 혐기성 환경에서 분해된다[7,8]. 혐기성 대사는 자유 에너지 크기에 따라 질산염, 망간 산화물, 철 산화물, 황산염을 전자수용체로 사용하는 미생물에 의해 순차적으로 일어나며, 이러한 전자수용체가 없을 때, 최종적으로 메탄 생성반응에 의해 유기물이 분해된다[9]. 그 결과, 전자수용체와 반응 생성물, 미생물 군집이 퇴적물 내에서 일련의 수직분포를 보이는 생지화학적 층서구조가 형성된다[10,11].

Stoichiometric organic matter decomposition reactions and the standard free energy, ΔG°. Redfield ratios for x, y and z are 106:16:1
Table 1의 유기물 분해 반응식을 보면, 유기물이 퇴적물로 더 많이 유입될수록 유기물 분해 산물(NH4+ - N, PO43- - P, H2S, CH4 등) 또한 증가한다는 것을 알 수 있다. 퇴적물 내에서 유기물 분해 과정에 의하여 새로 생성된 용존 무기 영양염은 공극수(porewater)에 축적되며, 점차 상층수(overlying water)와의 농도 차이가 발생한다. 이에 따라 분자 확산에 의해 영양염이 퇴적물에서 수층으로 이동한다. 이외에도 이류, 저서동물의 활동 등 다양한 경로를 통하여 공극수와 상층수 사이에 용존 영양염의 교환이 일어날 수 있다[6].
퇴적물에서 수층으로 공급되는 질소와 인은 일차생산에 필요한 영양염의 상당 부분을 지원한다고 알려져 있다[13,14]. 퇴적물-수층 경계면의 환경 조건에 따라서 퇴적물로부터 용출되는 영양염은 수층에 인과 질소를 공급하는 내부 공급원이 될 수 있기 때문에[15,16], 외부의 공급원을 차단해도 수층의 인과 질소의 농도가 높은 상태를 유지하는 현상이 일어날 수 있다[14,17,18]. 예로서, 오스트레일리아의 Port Phillip 만에서는 퇴적물에서 분해되어 공급되는 것이 연간 유입되는 N과 P의 63, 72%를 차지한다고 보고되었으며[19], 뉴질랜드의 Rotorua 호수에서는 퇴적물 용출에 의한 영양염의 유입이 외부 공급에 의한 유입보다 질소는 약 6-13배, 인은 10-73배 높은 것으로 측정되었다[20]. 우리나라의 낙동강 하류에서도 퇴적물 용출이 일차생산에 필요한 영양염 중 질소의 9-23%, 인의 11-22%를 지지한다는 보고가 있다[21]. 한편, 퇴적물 내에서 일어나는 탈질산화 작용이나 생물에 의한 섭취, 점토(clay)나 금속 산화물에의 흡착 등을 통해서 수층의 질소와 인이 퇴적물로 제거되기도 한다[22,23]. 이렇게 퇴적물은 환경 조건에 따라 영양염을 수층에서 제거하여 저장하는 저장소인 동시에 수층으로 방출하는 공급할 수 있는 능력을 갖추고 있으므로 수생 환경의 물질 순환에 중요한 역할을 한다[24,25].
최근에, 우리나라에서도 4대강 사업 이후 하천 퇴적물의 오염과 그로 인해 퇴적물이 수질에 미치는 영향에 대한 우려가 점차 커지고 있다. 퇴적물이 수질에 미치는 영향을 파악하는 것은 퇴적물과 수층의 경계면에서 일어나는 상호작용과 용출되는 영양염이 수 환경에 기여하는 정도를 정량화할 때 가능하다[20]. 이를 위해서는 연구 지역의 퇴적물 용출률을 정확하게 측정할 수 있어야 한다. 그러나 국내에는 현재 퇴적물의 영양염 용출률을 측정하기 위한 표준화된 방법이 설정되어 있지 않으며, 퇴적물이 수질에 미치는 영향을 평가할 합리적인 연구 방법 및 체계가 부재한 실정이다. 몇몇 연구 논문을 통해 퇴적물의 용출률 결과가 발표되었으나, 각각의 연구 논문마다 실험 방법이 상이하여 자료를 비교‧평가하기 어렵다. 따라서, 본 연구에서는 하천 및 호소의 퇴적물이 수질에 미치는 영향을 평가하기 위한 선행연구로서, 1) 국내외에서 퇴적물 용출을 측정한 기존의 연구 방법들을 비교하여 국내 담수 환경에 적용 가능한 측정 방법을 선택하고, 2) 퇴적물 용출률에 영향을 미치는 환경 조건의 변화에 따라 퇴적물 용출률을 측정한 사례 연구를 통하여 퇴적물 용출률의 측정 방법과 조건에 대한 표준화를 추진하고자 하는 데 목적이 있다.
1.2. 퇴적물 용출 측정 방법
퇴적물-수층 경계면에서 일어나는 물질 교환을 정량화하는 방법은 다양하다. 일반적으로 퇴적물 용출을 측정하는 방법은 이류-확산 모델(advection-diffusion model)을 적용하여 공극수 농도의 수직분포로부터 간접 추정하는 방법과[26], 퇴적물을 일정 시간 동안 배양하고 시간에 따른 농도 변화를 직접 측정하여 그 결과로부터 계산하는 방법이다[27~29]. 후자는 다시 현장에 저층 챔버(in situ benthic chamber)를 설치하여 측정하는 방법과 실험실에서 퇴적물 코어를 배양하여 측정하는 방법(laboratory core incubation)으로 나뉜다.
공극수 내 영양염의 수직분포로부터 용출률(Js)을 구하는 방법은 Fick의 확산 법칙(Fick’s law of diffusion)에 근거하여 계산한다(식 (1)).
여기서, ϕ는 퇴적물의 공극률이며, Ds는 퇴적물의 확산계수(whole-sediment diffusion coefficient, m2 s-1), (δC/δz)z=0는 퇴적물-수층 경계면에서의 농도의 차이(mmol L-1 m-1 or mg L-1 m-1)이다. 확산에 의한 용출률은 퇴적물 깊이에 따른 농도의 차이(gradient)에 의해 결정되기 때문에, 공극수 내 영양염의 농도 분포를 정확하게 파악해야 한다. 퇴적물 코어에서 깊이 별로 공극수를 추출하는 방법은 보통 1~2 cm 간격으로 퇴적물 코어를 잘라 원심분리 하는 것이 일반적이다. 최근에는 미세전극(microelectrode)을 이용하여 현장에서 바로 영양염의 미세분포를 측정하거나[30~32], gel probe를 이용하여 0.1 - 1 mm 단위로 공극수를 추출할 수 있어서[33,34], 퇴적물 수 mm 내에서 급격하게 변하는 영양염 농도를 뚜렷하게 관측할 수 있게 되었다. 그럼에도 불구하고, 확산에 의한 용출률 계산법은 퇴적물을 배양하여 측정하는 방법보다 용출률이 낮게 측정되는데, 이는 저서 생물의 활동에 의한 물리적 혼합과정이 포함되지 않기 때문이다[35,36].
퇴적물을 배양하여 용출률을 측정하는 현장 저층 챔버법과 실험실 코어 배양법은 현장에 챔버를 설치하여 배양하는가와 퇴적물 코어를 회수하여 실험실에서 배양하는가의 차이가 있지만, 그 측정 원리는 동일하다. 일정 면적의 표층 퇴적물과 일정 부피의 상등수를 밀폐된 상태로 배양하고, 배양 시간 동안 상등수에서 용존태(dissolved) 물질의 시간에 따른 농도 변화를 측정한다. 그 결과로부터 퇴적물에서 유출되는 양 또는 퇴적물로 유입되는 양을 계산한다(식 (2)).
즉, 퇴적물-수층 경계면에서의 용출률(Ji, mg m-2 hr-1)은 배양 시간 동안 측정한 영양염 농도의 증가율 또는 감소율(dC/dt, mg L-1 hr-1)과, 챔버 내 상등수의 부피(L or m3)와 퇴적물의 표면적(m2)의 비율(V/A)을 곱하여 단위 면적당 단위 시간당 값으로 정량화한다. 용출률이 양(+)의 값으로 계산된 경우는 상등수 내 영양염 농도가 시간에 따라 증가하여, 퇴적물에서 수층으로 영양염이 유출된다는 것을 나타낸다. 반대로, 음(-)의 값은 상등수에서 영양염의 농도가 제거되어 수층에서 퇴적물로 유입된다는 것을 의미한다.
앞서 기술한 대로, 퇴적물 용출률에 관한 표준화된 측정방법이 없기 때문에 연구자마다 사용하는 챔버의 크기나 모양, 실험 조건이 다르지만, 시간에 따른 농도 변화로부터 용출률을 정량 분석하기 위해서는 다음의 4개의 전제 조건을 고려해야 한다[37]. 첫째, 배양 실험 동안 물질 교환에 대해서 정상 상태(steady state) 조건이 유지되어야 한다. 즉, 공극수 내 농도 구배와 공극수와 저층수 사이의 농도 구배가 배양 시간 동안 일정하게 유지된다고 가정한다. 또한, 퇴적물 시료와 접하는 상등수의 부피가 충분해야 반응물(reactant)의 농도가 물질 교환을 제한하는 요인이 되지 않고 정상 상태가 유지될 수 있다[38]. 둘째, 수층에서 일어나는 생지화학적 과정은 퇴적물에서 일어나는 것에 비해 무시할 만큼 작아야 한다. 그렇지 않다면, 수층의 프로세스에 의한 변동을 따로 측정해서 용출률 계산에 참작해야 한다. 현장에서의 저층 챔버 측정법의 경우, 바닥이 막힌 챔버로 퇴적물 없이 저층수만 동시에 배양하여 수층의 고유한 프로세스가 농도 변화를 측정하는데 영향을 미치는지 확인할 수 있다[38,39]. 실험실 코어 배양법에서는 현장 측정법과 마찬가지로 저층수 대조구를 동일한 조건에서 배양하거나, 여과한 저층수를 상등수로 사용하여 수생 미생물의 영향을 최소화 한다[40,41]. 셋째, 챔버 내에 조성되는 수리역학적 조건에 의해서 퇴적물과 수층의 경계면에서 일어나는 물질 교환이 변하지 않아야 한다. 배양 실험 중에는 퇴적물이 본래의 물리적 환경과 단절되기 때문에, 챔버 내의 상등수를 인위적으로 교반해서 가능한 현장 조건을 비슷하게 재현해야한다[29,42]. 이에 많은 연구자들이 펌프, 회전날이나 패들(paddle)이 수직·수평으로 회전하는 교반기, 자력 교반기(magnetic stirrer) 등을 교반 장치로 사용하여 자연 상태의 수리역학적 환경을 챔버 내에 유사하게 조성하기 위한 연구를 수행하고 있다[43~45]. 마지막으로, 챔버 코어의 크기는 연구 지역의 퇴적층을 대표할 수 있는 면적을 포함해야 한다. 현장 측정에 적용하는 챔버 크기는 상대적으로 제한이 적기 때문에 그에 따라 결정되는 퇴적물 표면적이 넓어서 퇴적물 표면의 미세한 불균질성(micro-heterogeneity)을 최소화할 수 있다[43]. 특히, 저서 동물의 교란작용(bioturbation)과 관개활동(bioirrigation)은 퇴적물과 수층이 접촉하는 면적을 증가시키고 공극수와 상층수의 직접 교환을 촉진한다[46,47]. 이러한 생물 활동을 용출률에 반영하기 위해서는 저층 챔버를 사용하는 것이 유리하다[48]. 실험실 코어 배양법은 일반적으로 챔버 코어에 포함되는 퇴적물 면적이 작지만(0.01 m2 이하) [20], 반복구의 개수를 늘려서 측정 결과의 정확도를 확보하고 시료의 불균질성을 극복할 수 있다[49].
최근의 연구 결과를 보면, 저층 챔버로 현장에서 직접 용출률을 측정하는 방법이 다른 측정 방법에 비해 실제 용출률을 비슷하게 재현한다고 알려져 있다[50,51]. 배양 실험이 본래의 온도, 압력(특히 수심이 깊은 경우), 광도와 같은 환경 조건에서 수행되기 때문에, 실험실에서 배양할 때 퇴적물 시료를 처리하고 배양 조건을 맞추는 과정 중에 생길 수 있는 인위적인 영향을 최소화할 수 있다[20,43,51]. 수심이 얕은 환경에서는 잠수사(SCUBA diver)가 저층 챔버를 현장에 설치하고 일정 시간마다 상등수 시료를 채집한다[19,53]. 그러나, 수심이 깊은 호수나 심해 환경에서는 밴틱 랜더(benthic lander)를 이용하여 현장 관측을 수행한다[48,54,55]. 밴틱 랜더는 측정 센서, 데이터 기록 장치, 시료 채집 장치를 장착한 장비로써, 현장에 계류하여 일정 시간 연속 측정 후 회수하여, 자료를 분석하고 퇴적물의 용출률을 산출한다. 현재까지, 실제 용출률과 유사한 결과를 재현하고 현장 측정에 이상적인 챔버를 만들기 위해, 장비를 자동화하고 측정 센서를 다양하게 개발하는 등의 연구가 활발하게 진행되고 있다[37]. 하지만, 현장 측정법은 측정에 이용되는 장비가 고가이며, 현장 측정을 수행할 전문 기술 인원 및 많은 시간과 비용이 필요하다. 무엇보다, 아직까지 보편적으로 받아들일 만한 측정 방법도 없기 때문에 자료의 비교가 어렵다[56,57]. 국내에서는 저층 챔버를 이용하여 연안 해역에서 직접 퇴적물의 용출률을 측정한 연구가 보고되었으며[58~60], 벤틱 랜더를 개발하여 동해의 심해 환경(수심 1000 m 이상)에서 용출률을 측정한 연구가 진행되고 있지만[61], 담수 환경에서는 현장에서 직접 퇴적물 용출률을 측정한 사례가 드물다.
코어 배양법은 현장 측정법보다 측정 방법이 용이하고 비용이 저렴하여 다양한 환경에서 많이 연구되는 방법이다[62~64]. 코어 배양법은 퇴적물 코어를 채집하여 실험실에서 배양하기 때문에, 퇴적물 코어를 회수하면서 퇴적물 시료의 산화(oxygenation), 공극수의 변위(displacement), 저층 경계면(benthic boundary layer)의 소실, 온도의 변화 등에 의해 퇴적물의 물리, 화학, 생물학적 특성이 변할 가능성이 있으며[20] 코어 시료를 처리하고 배양 실험을 진행하는 중에 인위적인 영향을 받을 수밖에 없다[48,61,65,66]. 그럼에도, 코어 배양법을 이용한 다수의 퇴적물 용출 연구에서, 특히 수심이 얕은 환경의 경우, 현장 측정값과 비교하여 신뢰할 만한 측정 결과를 보고하였다[48,67,68]. 코어 배양법으로 실제 현장값에 가까운 결과를 얻으려면 퇴적물 시료를 가능한 교란되지 않게 채집해야 하며, 연구 대상 지역의 화학‧수리역학‧생물학적 조건과 최대한 유사하게 재현한 상태에서 배양 실험을 수행하여야 한다. 현장에서 측정할 때 배양 실험의 정확도에 영향을 미칠 수 있는 환경 조건이 역동적으로 변하는 것에 비해, 실험실에서는 더 엄밀하게 환경 조건을 조절할 수 있다는 것이 코어 배양법의 장점이다. 또한, 연구자가 원하는 구체적인 조건에 맞춰 배양 실험을 수행할 수도 있다[20]. 따라서, 실험실에서 코어 배양법을 이용한 퇴적물 용출 측정 방법은 우리나라의 수심이 얕은 담수 환경에서 퇴적물 용출률을 측정하는데 유용한 방법이 될 수 있을 것을 사료된다. 이에, 본 연구에서는 코어 배양법을 기본 측정 방법을 채택하고, 환경 조건의 변화에 따라 퇴적물 용출률이 어떻게 달라지는지 측정하였다. 그 결과를 바탕으로, 정확성과 재현성을 갖는 결과를 생산하기 위한 코어 배양법의 측정 절차와 조건을 제시하였다.
1.3. 퇴적물 용출과 관련된 주요 환경조건
퇴적물-수층 경계면에서의 영양염 용출은 다양한 환경 조건과 인자의 영향을 받는다. 퇴적물의 조성과 수층의 산소 농도, 퇴적물의 산화-환원 상태, 수온, 퇴적물 온도, 퇴적물에 도달하는 유기물의 양과 질, 저서 생물의 군집 구조, 수심, 심수층의 유속 등과 같은 물리, 화학, 생물학적 과정이 퇴적물과 수층 사이의 영양염 이동에 복합적으로 관여하고 있다[38,69~73]. 이 중, 공통적으로 유기물 유입량과 심수층 수온, 용존산소 농도, 심수층 유속이 퇴적물 용출과 유기물 분해를 조절하는 가장 주요한 환경 조건으로 확인되었다. 본 연구에서는 실험실 코어 배양법으로 퇴적물 용출률을 측정하기 위하여, 퇴적물 용출률에 영향을 미치는 4가지 주요 환경 조건과 Viollier 등[37]이 제시한 4가지 전제 조건을 고려하여 pre-incubation 시간, 초기 산소농도, 심수층 유속, 배양 온도를 주요 조건으로 정하고, 이 네 가지 배양 조건에 따라 퇴적물 용출률이 어떻게 변화하는지 측정하였다.
1.3.1. Pre-inubation 시간
Pre-incubation은 배양 실험 전에 퇴적물 내 미생물을 실험 조건에 적응시켜 본래 현장에서의 활성과 유사한 상태로 회복시키기 위해 퇴적물 코어를 안정화시키는 과정이다. 현장에서 퇴적물 코어 시료를 채취한 후 안정화를 위해 수 시간에서 수 일 동안 pre-incubation하여 실험하는 연구 논문들이 다수 보고되어 있다[67,74,75]. 이들 연구에서 pre-incubation은 대부분 현장 저층수를 채운 탱크에 퇴적물 코어를 넣고, 현장 심수층 수온을 유지시키며 자연적 또는 인공적으로 공기를 주입하여 순환시키는 조건 하에서 이루어졌다. 그러면, 처음 수 시간 내에 분해되기 쉬운 유기물부터 분해가 시작되고, 퇴적 물 내에 환원된 상태로 존재하는 화학종이 산화되기 때문에[76], pre-incubation 시간이 길면 퇴적물과 수층의 유기물 및 영양염 조성이 연구 지역의 현장 상태와 달라질 수 있다. 본 연구에서는 퇴적물 시료를 채집한 후 6시간 이내(실험실로 복귀하여 측정 조건을 맞추고 바로 실험한 경우)와 12, 24시간 동안 pre-incubation을 하고 배양 실험을 시작하여 영양염의 용출률을 측정하였다. 나머지 환경 조건의 경우, 상등수의 용존산소 농도는 포화도 90%, 챔버 내 확산경계층 두께는 0.6 - 0.8 mm로 맞추고, 배양 온도는 17℃로 배양 실험동안 일정하게 유지하여, pre-incubation 시간에 따른 용출률 차이를 관측하였다.
1.3.2. 초기 산소농도
초기 산소농도는 배양 실험을 시작할 때 챔버 코어 내 상등수의 용존산소 농도를 의미한다. 산소는 에너지 수율 측면에서 미생물이 유기물 분해에 사용할 수 있는 가장 좋은 전자수용체이다[9]. 또한, 산소 소모의 상당 부분은 환원 상태로 존재하는 유기물 분해 산물(NH4+, Mn2+, Fe2+, H2S, FeS, FeS2 등)을 재산화하는데 이용된다[77]. 즉, 수층 및 퇴적물 내 화학종의 분포는 수층의 산소 농도 변화에 따라 달라진다. 특히, 인산염 인(PO43- - P)은 산화 환경에서는 철(III) 산화물에 흡착되고, 환원 환경에서는 철(III) 산화물이 환원됨에 따라 해리되어 Fe2+과 함께 공극수에 이온 형태로 존재하는 것으로 알려져 있다[3,20]. 암모니아성 질소(NH4+ - N)와 질산성 질소(NOx- - N)의 용출률도 산소 농도와 강한 상관관계를 보인다[70]. 용존산소 농도가 낮을 때는 질산화 작용(nitrification)이 억제되어 NH4+ - N의 농도가 증가하고, 반대로 산화 환경에서는 질산화 작용이 활발하여 대부분의 NH4+ - N가 퇴적물에서 유출되기 전에 산화된다[20,70]. 이와 같이, 수층의 산소 농도에 따라서 퇴적물 내 생지화학 반응들이 영향을 받고 화학 조성이 결정되므로, 그 결과, 퇴적물과 수층 사이의 물질 교환이 달라지게 된다. 따라서, 본 연구에서는 챔버 코어 내 상등수의 초기 산소농도를 포화도 90%, 70%, 50%로 조절하여 퇴적물 용출률을 측정하였다. 이때, pre-incubation 시간은 최소화하고(6시간 이내), 챔버 내 확산경계층 두께는 0.6 - 0.8 mm, 배양 온도는 17℃로 유지하여 배양 실험을 수행하였다.
1.3.3. 확산경계층 두께
확산경계층(diffusive boundary layer, DBL)은 퇴적물 표층 바로 위에 접해 있는 얇은 수층이다. DBL 내에서의 물질의 연직 이동은 주로 분자확산(molecular diffusion)에 의해서 일어나기 때문에[77,78], DBL은 퇴적물-수층 간 용존 물질 및 기체 교환에 있어서 일종의 장벽(barrier) 역할을 한다[79]. 일반적으로 심수층의 유속이 빠르면 응력(stress)과 전단속도(shear velocity)가 커져서 DBL이 얇아지고, 유속이 느리면 DBL이 두꺼워진다[1]. Glud 등[77]은 유속에 따른 DBL 두께를 측정하여 그 상관관계를 보고하였다(식 (3)).
여기서, y는 DBL의 두께(mm), x는 심수층의 유속(cm s-1)이다. 즉, 연구 지점의 심수층 유속에 대한 정보가 있으면, 그에 상응하는 DBL 두께를 추정하여 챔버 코어 내에 구현할 수 있다. 본 연구에서는 챔버 코어 내 상등수를 교반하기 위하여 순환 펌프를 이용하였다. 펌프의 유량(mL min-1)을 조절하여 챔버 코어 내 흐름을 만들고, 그로 인해 형성된 DBL의 두께를 측정하여 연구 지점의 유속을 역으로 재현하는 방식을 사용하였다. DBL 두께는 산소미세전극으로 퇴적물-수층 경계면에서 용존산소의 미세 분포(microprofile)를 측정하여 결정하였다[80]. 본 연구에서는 DBL 두께를 0, 0.6 - 0.8, 1.2 - 1.4 mm로 조절하여 퇴적물의 용출률 차이를 관측하였다. 이때, pre-incubation 시간은 최소화하고, 초기 산소농도는 포화도 90%로 맞췄으며, 배양 온도는 17℃로 유지하여 배양 실험을 수행하였다.
1.3.4. 배양 온도
심수층의 수온이 높아지면, 퇴적물 내의 미생물의 성장과 대사 기능이 증가한다. 우선 온도 증가에 따른 유기물 분해 증가를 그 예로 들 수 있다. 유기물 분해는 다양한 미생물 군집과 관련되어 있기 때문이다(Table 1). 유기물이 더 많이 분해될수록 그 분해 산물인 영양염이 더 많이 생성되므로, NH4+ - N와 PO43- - P의 용출률이 증가할 것을 예상할 수 있다[3,70,81]. 암모늄화(ammonification)와 질산화(nitrification), 탈질산화(denitrification) 등도 생물 매개 작용이므로, 온도가 증가하면 관련된 미생물의 활성도 증가한다[81]. 따라서, 온도가 변하면 퇴적물 내의 무기 질소의 존재 형태 간의 비율이 달라질 수 있으며, 그 용출률도 영향을 받을 것이다. 또한, 용존 산소의 농도는 온도에 따라 변하므로, 산화-환원 환경에 민감하게 반응하는 PO43- - P의 용출률도 온도의 영향을 받을 것이다[3]. 즉, 퇴적물 코어 배양 시 설정하는 온도에 따라 용출률이 다르게 나타날 수 있다. 이에, 본 연구에서는 배양 온도를 10, 17, 20, 25℃로 설정하여 퇴적물 용출률을 측정하여 그 결과를 비교하였다. 이때, pre-incubation 시간은 최소화하고, 상등수의 초기 산소농도는 포화도 90%로 맞췄으며, 챔버 내 확산경계층 두께는 0.6 - 0.8 mm로 구현하여 배양 실험을 수행하여 온도에 의한 차이만 측정하였다.
2. 주요 환경조건 변화에 따른 영양염 용출률 측정 사례 연구
2.1. 퇴적물 용출률 측정을 위한 코어 배양 시스템 설계
본 연구에서 퇴적물 용출률을 측정하기 위해 만든 코어 배양 시스템은 크게 1) 표층이 교란되지 않게 퇴적물 시료를 채취하고 그 자체로 배양 챔버 역할을 하는 퇴적물 코어와 2) 챔버 코어를 넣고 온도를 일정하게 유지하여 배양할 수 있는 배양기(incubator)로 나눌 수 있다(Fig. 1). 퇴적물 용출률을 정확하게 측정하기 위해서, 챔버 코어는 외부와 교환이 일어나지 않는 밀폐된 구조에, 상등수를 혼합할 수 있는 교반 장치를 갖추어야 한다. 상등수 시료를 분석할 때 균질하게 혼합된 상태에서 채집한 시료여야 챔버 코어 내의 평균적인 상태를 반영할 수 있으며, 현장의 역학적 조건을 가능한 유사하게 재현해야 하기 때문이다[42]. 또한, 배양 실험은 온도를 일정하게 유지해야 하기 때문에 배양기에는 항온장치를 연결해야 한다.
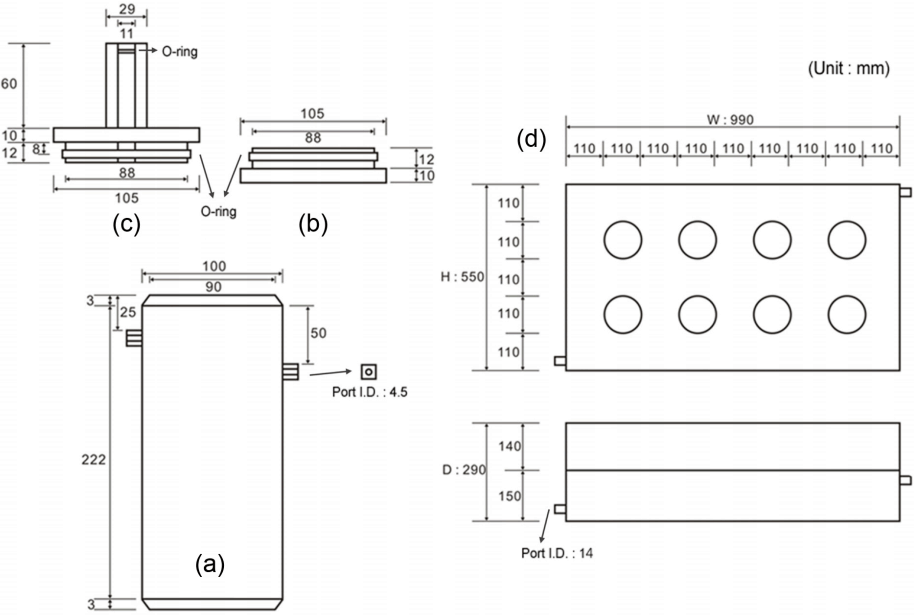
Schematic diagram of (a) body, (b) bottom lid, and (c) top lid of the chamber core, and (d) incubating water bath.
본 연구에서 사용한 챔버 코어는 실험자가 쉽게 다룰 수 있도록 단순한 구조로 제작하여 실험의 재현성과 효율성을 높이고자 하였다. 코어는 아크릴 재질의 몸통과 위‧아래 마개로 구성된다. 원통형 몸통(Fig. 1(a))은 내경 90 mm, 높이 약 220 mm이고, 양쪽 끝이 모두 열려있어서 마개로 막게 되어 있다. 위‧아래 마개(Fig. 1(b), (c))는 밀어 넣어서 닫는 형태이며, O-ring으로 마감하여 마개를 닫았을 때 챔버 내부가 완전히 밀봉되게 하였다. 위쪽 마개에는 센서(용존산소, 온도 등)를 장착하기 위한 입구가 있으며, 사용하지 않을 때는 막을 수 있다. 코어 몸통 위쪽에는 상등수를 혼합하기 위해 순환 펌프(circulation pump)와 연결되는 포트 한쌍이 있다. 퇴적물 시료를 8 - 9 cm 깊이로 코어링했을 때, 챔버 코어 내 상등수 부피(0.76 L)와 퇴적물 표면적(6.4 × 10-3 m2)의 비율은 약 120 L m-2으로, 본 연구에서 12시간 이내로 수행한 배양 실험 동안 영양염의 농도가 선형적으로 변하는 것을 뚜렷하게 관측할 수 있었다[38,82].
배양기는 가로 550 mm, 세로 990 mm, 높이 290 mm의 덮개가 없는 상자 형태이며, 빛을 차단하도록 검은 색 아크릴을 사용하였다(Fig. 1(d)). 배양기의 절반 정도 높이에 챔버 코어가 들어갈 8개의 구멍을 뚫은 판을 설치하였다. 구멍의 크기는 챔버 코어 마개의 외경보다 약간 커서, 배양 실험을 수행하는 동안 뜻밖에 충격이 가해져도 챔버 코어가 흔들리거나 쓰러지지 않게 할 수 있었다. 배양기에 순환식 항온수조(circulating water bath)를 연결하여 배양 온도를 일정하게 유지하였다. 실험 중에는 배양 시스템 전체를 차광막으로 덮어 퇴적물 코어를 암배양하였다. 본 연구의 코어 배양 시스템은 동시에 최대 8 개의 챔버 코어를 동일한 조건하에서 배양할 수 있다.
2.2. 현장 조사 및 실험 방법
2015년 7월, 낙동강 중류의 보로부터 상류 쪽으로 약 1 km 떨어진 지점에서 코어 배양 실험에 사용할 퇴적물과 수층 시료를 채집하였다. 환경 조건에 따른 용출률 차이를 극대화하기 위하여 유기물 함량이 상대적으로 높은 펄 퇴적물이 분포하는 지점을 선정하고, 심수층에 빈산소 현상이 나타나는 여름철에 현장 조사를 수행하였다(Table 2). 먼저 시료 채집 지점의 표‧저층 수온과 pH, 용존산소 농도를 다항목 측정기(YSI 650MDS & 600 sonde, YSI Inc., USA)로 측정하고, 니스킨 채수기(Niskin water sampler, General Oceanics, USA)로 저층수를 채수하였다. 퇴적물 코어 시료는 다이버가 직접 배양 실험용 챔버 코어를 가지고 잠수하여 채집하였다. 잠수하기 전에 코어 몸통의 포트는 미리 밀봉하였다. 시료의 균질성을 확보하기 위하여 가능한 인접한 위치에서 약 8 - 9 cm 깊이로 코어링 하였으며, 수중에서 위아래 마개를 닫고 선상으로 회수하였다. 표층 퇴적물의 교란이나 상등수에서 재부유가 관찰되지 않은 코어를 취하여 바로 신축성이 있는 테이프로 위‧아래 마개를 모두 고정하고 챔버 코어를 밀봉하였다. 표층 퇴적물이 교란되지 않게 주의하면서 냉장 상태(4℃ 이하)를 유지하여 퇴적물 시료와 저층수를 실험실로 운반하였다.
실험실로 복귀 후, 미리 현장의 심수층 수온으로 맞춰 놓은 배양 수조에 챔버 코어를 바로 넣었다. 퇴적물 시료의 온도를 회복시키는 동안, 챔버 코어에 퇴적물과 함께 채집된 상등수를 제거하고 GF/F 유리섬유 여과지로 여과한 저층수를 다시 채워 넣었다. 이때, 퇴적물이 재부유되지 않게 수액 세트나 연동 펌프(peristaltic pump; Masterflex L/S, Cole-Parmer, USA)를 사용하여 주입 속도를 조절하면서 저층수를 주입하였다. 새로 주입하는 저층수를 여과하여 수층의 생물 활동에 의한 영향을 사전에 배제하였다. 따라서, 배양 실험 동안 발생하는 상등수 내의 변화는 모두 퇴적물과의 상호작용에 의한 결과로 가정하였다. 참고로, 연구 지역의 심수층이 빈산소 상태라면, 챔버 코어의 상층수를 약 1 cm 정도 남겨놓고 제거하면 퇴적물이 산소에 노출되는 것을 최소화할 수 있다. 상등수를 챔버 코어에 가득 채우고, 3-way stopcock으로 코어 몸통의 포트에 순환 펌프(PQ-12, Greylor Co., USA)와 시료 채집용 주사기를 연결하였다. 상등수를 혼합하는 교반 장치로 펌프를 사용하면 혼합속도가 빠르고 저층면에 유속이 균일하여 확산경계층이 비교적 균일하게 형성된다[59]. 순환 펌프에 전원을 연결하고(유량 약 0.12 L min-1) 1.3항에 기술한 대로 각각의 환경 조건을 조절하였다. 온도, 초기산소 농도, DBL 두께 등의 실험 조건이 모두 만족되면, 기포가 생기지 않도록 주의하면서 위쪽 마개를 닫아 챔버 코어를 밀봉하였다. 배양 시스템 전체에 차광막을 덮고 배양 실험을 시작하였다. 각 실험 조건마다 두개의 반복구(replicates)로 실험하였다.
배양 시작 직후, 영양염을 분석하기 위한 상등수 시료 약 8 mL를 채집하였다. 이때, 같은 양의 여과 저층수를 챔버 코어에 다시 보충해주었다. 챔버 코어에 보충해준 여과 저층수는 챔버 코어의 배양 조건과 같은 조건에서 보관하였고, 새로 주입된 양은 전체 상등수 부피의 약 1% 미만이었기 때문에, 이로 인한 희석 효과는 없는 것으로 간주하였다[83]. 2차 오염을 최소화하기 위해서 고무 개스킷(gasket)이 없는 폴리프로필렌(PP) 재질의 주사기로 채수하고, 즉시 0.45 μm 멤브레인 주사기 여과지로 여과하여 분석 전까지 냉동 보관하였다. 상등수 시료는 배양 4시간까지 1시간 간격으로, 그 이후에는 2시간 간격으로 채집하였고 매번 같은 양을 보충하였다. 영양염 자동분석기(QuAAtro39 AutoAnalyzer, SEAL Analytical, Germany)를 이용하여 암모니아성 질소(NH4+ - N)와 질산성 질소+아질산성 질소(NOx- - N), 인산염 인(PO43- -P)을 분석하였으며, 각각의 측정값은 인증표준물질(Certified Reference Material)로 정확도를 검정하였고, 영양염의 회수율은 90-110%로 측정되었다. 영양염 용출률은 시간에 따른 농도 변화의 기울기로부터 정량화하였다(식 (4)).
여기서, BNF (benthic nutrient flux)는 단위 시간동안 단위 면적에서 용출되는 영양염의 양(mg m-2 hr-1)이며, a는 시간에 따른 영양염 농도의 증가‧감소율(μg L-1 hr-1), V는 챔버 코어 내 상등수의 부피(m3), A는 챔버 코어 내 퇴적물의 표면적(m2)이다.
본 연구에서 제시한 퇴적물의 영양염 용출률은 환경 조건을 임의로 조절하여 측정한 결과이므로, 연구 지역의 실제 영양염 용출률과 차이가 있음을 밝힌다.
2.3. 결과 및 고찰
본 연구에서 수행한 퇴적물 코어 배양 실험의 결과 중, 대표적인 예를 Fig. 2에 나타내었다. 상등수의 용존산소 포화도는 90%, 배양 온도는 17℃, 확산경계층 두께는 0.6 - 0.8 mm로 맞춰 시료 채집 후 6시간 이내에 배양 실험을 시작했을 때, 상등수 내 암모니아성 질소(NH4+ - N)의 농도는 시간에 따라 증가하였고, 질산성 질소+ 아질산성 질소(NOx- - N), 인산염 인(PO43- - P)의 농도는 감소하였다. 배양 실험을 수행한 모든 챔버 코어에서 영양염의 농도는 시간에 따라 선형적으로 증가하거나 감소하였고, 그 기울기로부터 영양염의 용출률을 계산하여 pre-incubation 시간과 용존산소의 초기 농도, 배양 온도, 확산경계층 두께의 변화에 따른 용출률의 차이를 비교하였다(Fig. 3). 각 실험 조건마다 두 반복구 사이의 상대백분율차(relative percent difference, RPD)는 0.6 - 40%였다. 두 가지 경우를 제외하면 모든 반복구의 RPD는 20% 이하로(평균 8.5%, 중앙값 4.6%), 본 연구의 코어 배양법으로 측정한 퇴적물 용출률이 적어도 정밀도는 만족시킬 수 있을 것으로 사료된다.
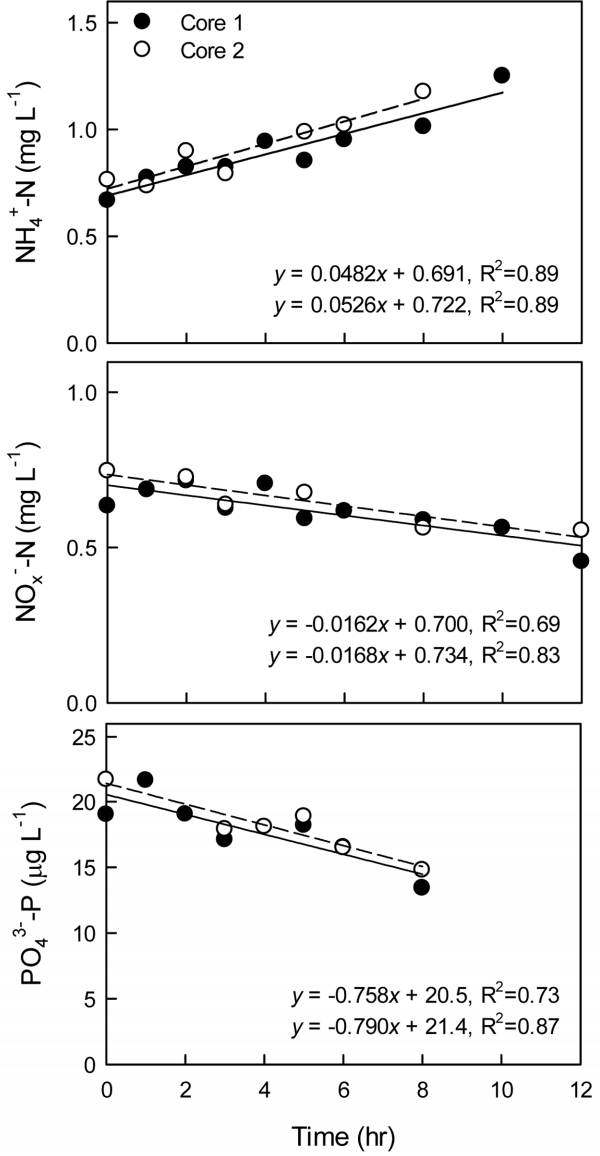
Representative time evolution of the concentration of dissolved inorganic nutrients in overlying water under the conditions of pre-incubation time within 6 hours, incubation temperature of 17℃, the 0.6-0.8 mm-thick diffusive boundary layer, and oxygen saturated water column (>90%). Benthic nutrient fluxes were calculated by multiplying the slope of each linear regression line by the height of overlying water (volume of overlying water/surface area of sediment).
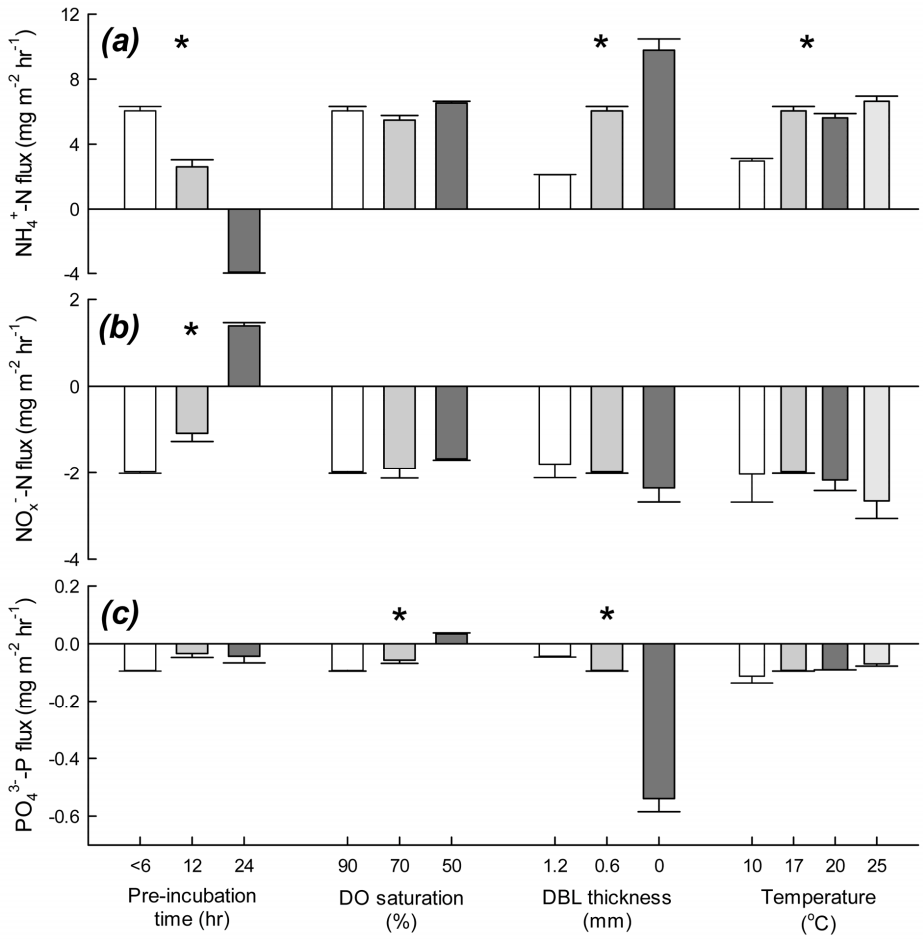
Fluxes of (a) NH4+ -N, (b) NOx- -N and (c) PO43--P across the sediment-water interface fluctuated with the variation of preincubation time, dissolved oxygen (DO) saturation level in overlying water, thickness of diffusive boundary layer (DBL) and incubation temperature. Mean and deviation of two replicates are plotted for each treatment. Positive values mean efflux from sediments and negative values indicate influx to sediments. Asterisk depicts statistically significant differences among treatment variations in each control factor (one-way ANOVA, P<0.05).
2.3.1. Pre-inubation 시간
Pre-incubation 시간에 변화를 주어 배양 실험을 수행한 결과, 용출 실험 시작 전에 퇴적물 코어 시료를 오랫동안 pre-incubation하면 영양염 용출률에 뚜렷한 차이가 있다는 것을 확인하였다(Fig. 3). 퇴적물 시료 채집하고 실험실에 복귀 후, 측정 조건을 맞춰서 바로 배양 실험을 시작한 경우(시료 채집 후 6시간 이내), 상등수의 NH4+ - N 농도는 시간에 따라 증가하여, 6.05 ± 0.26 mg m-2 hr-1로 퇴적물에서 수층으로 유출되었다(Fig. 3(a)). 배양 실험 전에 12시간 동안 pre-incubation을 했을 때, NH4+ - N의 유출률은 2.60 ± 0.44 mg m-2 hr-1로, 바로 배양 실험을 시작했을 때보다 유출률이 절반 이상 감소하였다. 반면에, 24시간 이상 안정화시키고 측정한 상등수의 NH4+ - N 농도는 시간에 따라 점차 감소하여, -3.92 ± 0.05 mg m-2 hr-1로 수층에서 제거되는 것으로 나타났다. NOx- - N의 농도 변화는 NH4+ - N와 반대의 결과를 보였다(Fig. 3(b)). 6시간 이내에 배양 실험을 시작했을 때는 -1.98 ± 0.04 mg m-2 hr-1의 비율로 수층에서 퇴적물로 유입되었다. Pre-incubation을 12시간 했을 때는 NOx- - N의 유입률이 -1.08 ± 0.19 mg m-2 hr-1로, 6시간 이내에 실험을 시작했을 때보다 감소하였다. Pre-incubation 시간을 24시간으로 늘렸을 경우, 상등수의 NOx - N의 농도는 시간에 따라 증가하였으며, 퇴적물에서 수층으로의 유출률은 1.39 ± 0.08 mg m-2 hr-1로 나타났다. 이러한 pre-incubation 시간에 따른 용출률의 차이는, 1) pre-incubation 시간 동안 챔버 내 상등수에 지속적으로 공기를 주입해줌으로 인해, 상등수와 퇴적물 표층에 산화 환경이 조성되고, 2) 안정화 시간 동안 퇴적물과 상등수의 유기물 및 무기 영양염의 조성이 변했기 때문으로 인식된다. 퇴적물-수층 경계면의 물리·화학·생물학적 환경에 따라서 암모늄화와 질산화, 탈질산화 중 활발하게 일어나는 작용이 결정되고, 그에 따라 NH4+ - N와 NOx- - N의 용출률도 영향을 받는다(Fig. 4) [70]. 일반적으로, 퇴적물 내에서 유기물이 분해되고 암모늄화로 공극수에 NH4+ - N가 축적되면, 공극수와 저층수 사이의 농도구배에 의해 NH4+ - N는 퇴적물에서 수층으로 유출된다. 반면에, 탈질산화가 활발하게 일어나서 퇴적물 내 NOx- - N가 환원되면, 상대적으로 NOx- - N의 농도가 높은 수층으로부터 확산에 의해 퇴적물로 NOx- - N가 유입된다[84]. 본 연구에서는 챔버 내에 12시간 이상 지속적으로 산소를 공급했기 때문에 퇴적물 표층에서 질산화가 활발하게 일어나서, 퇴적물 내의 NH4+ - N가 NOx- - N로 산화된 것으로 사료된다[85]. 그 결과, 공극수 내 NH4+ - N의 농도는 점차 감소하고 NOx- - N의 농도는 증가하여 공극수와 상등수 사이의 농도 차이가 줄어들게 되므로, 확산에 의해 수층으로 유출되는 NH4+ - N의 양과 퇴적물로 유입되는 NOx- - N의 양이 감소한 것으로 추정할 수 있다. 또한, 퇴적물 코어를 24시간 동안 산화 환경하에서 안정화할 경우, 상등수의 NH4+ - N도 질산화 작용으로 산화되어 상등수의 NH4+ - N 농도가 감소한 반면에, NOx- - N의 농도는 증가한 것으로 판단된다. 따라서, NH4+ - N는 수층에서 퇴적물로 유입되고, NOx- - N는 퇴적물에서 수층으로 유출된 것으로 측정되었다.

Schematic presentation of the nitrogen cycle at the sediment-water interface, modified based on Herbert[94] and Laverock[95]. ON indicates nitrogen contained in organic compounds; DON, dissolved organic nitrogen; IN, dissolved inorganic nitrogen including ammonium, nitrate and nitrite. Nitrification covers ammonia oxidation and nitrite oxidation; Denitrification covers nitrate reduction and nitrite reduction; DNRA is the acronym for dissimilatory reduction of nitrite to ammonium; Anammox denotes anaerobic ammonium oxidation. Different width of arrows across the sediment-water interface reflects the predominant flux direction of dissolved inorganic nitrogens universally accepted. Nitric oxide (NO) and nitrous oxide (N2O), not shown in the diagram, are gaseous intermediate products of both ammonia oxidation and nitrite reduction, which diffuse into the atmosphere.
Pre-incubation 하지 않고 바로 배양 실험을 했을 때, 상등수 내 PO43- - P의 농도는 시간에 따라 감소하여 -0.09 ± 0.002 mg m-2 hr-1로 수층에서 퇴적물로 유입되는 것으로 나타났다(Fig. 3(c)). Pre-incubation 시간이 12, 24시간일 때 PO43- - P의 유입률은 각각 - 0.03 ± 0.014, -0.04 ± 0.023 mg m-2 hr-1로, 바로 실험했을 때보다 감소하였다. 즉, pre-incubation 시간이 길어질수록, PO43- - P의 용출률은 실제 현장 값과 크게 달라질 수 있음을 나타낸다. PO43- - P의 용출률은 퇴적물-수층 경계면의 산화-환원 환경에 영향을 받는다고 알려져 있다[86]. PO43- - P의 용출률은 퇴적물 내에서 유기물이 분해되어 PO43- - P이 생성되는 정도와 퇴적물 표층에서 철산화물에 흡착되는 정도에 의해서 결정된다[87]. 즉, PO43- - P이 퇴적물로 유입되었다는 것은 수층의 PO43- - P도 철산화물 등에 흡착하여 수층에서 제거된다는 것을 의미한다(Fig. 5). 따라서, 챔버 내 퇴적물의 산화 환경이 유지되면 PO43- - P의 유입률도 증가할 것으로 예상할 수 있는데, 본 연구의 실험 결과는 preincubation 시간이 늘어날수록 유입률이 감소하였다. 이것은 상등수 내 PO43- - P의 농도 감소로 설명할 수 있다. Preincubation 시간이 6, 12, 24시간으로 늘어날수록 각각 배양을 시작할 때 상등수 내 PO43- - P의 농도는 20.3 ± 1.3, 8.2 ± 1.1, 1.9 ± 0.8 μg L-1으로 점차 감소하였다. 안정화 시간 동안 상등수의 PO43- - P가 금속 산화물에 흡착‧제거되었으며, 26 - 28시간이 지나면 상등수에서 완전히 고갈된다. 즉, 상등수 내의 PO43- - P의 농도 자체가 수층에서 퇴적물로 유입되는 것을 제한하는 것으로 사료된다. 한편, 안정화 시간 동안 유기물 분해에 의해 새로 생성된 PO43- - P가 공극수에 축적되었다가 퇴적물 표층에서 금속 산화물 등에 흡착되므로, 수층의 PO43- - P가 유입되는 양이 감소했을 가능성도 있다.

Schematic presentation of the phosphorus cycle at the sediment-water interface, modified based on Lehtoranta[91]. OP means phosphorus contained in organic compounds; IP, dissolved inorganic phosphorus such as phosphate. Double line between ferric oxide and IP indicates phosphate adsorption onto metal oxides.
이와 유사한 결과를 Holland 등[74]도 보고하였다. 그들은 현장에서 저층 챔버로 측정한 용출률과 실험실에서 하룻밤 동안 안정화시켜 측정한 용출률을 비교하였다. 실험실에서 코어 시료를 안정화시키는 동안, 배양 온도는 현장 수온(17℃)에 맞춰 일정하게 유지하고 공기를 주입한 현장 저층수로 상등수를 순환시켰다. 그 결과, pre-incubation하여 배양한 코어에서 NH4+ - N 용출률이 현장 측정값보다 현저히 낮았으며, NOx- - N와 PO43- - P의 용출률은 현장 측정과 비교했을 때 측정값의 차이가 나는 것은 물론, 유입·유출 방향이 반대로 바뀌는 경우도 관측되었다. 이는 배양 실험에 필요한 시간 이상으로 pre-incubation하여 영양염 용출률을 측정할 경우, 실제 현장의 값과 완전히 다른 결과가 나올 수도 있음을 나타낸다. 본 연구에서 pre-incubation 시간에 따라 영양염 용출률이 차이를 측정한 결과, 수심이 낮은 하천에서 현장의 용출률과 유사한 결과를 생산하기 위해서는 퇴적물 시료 채집 후 되도록 빠른 시간 안에 배양 실험을 시작해야 한다.
2.3.2. 초기 산소농도
챔버 코어 내 상등수의 용존산소 농도를 포화도 90, 70, 50%로 맞추고 배양 실험을 수행한 결과, NH4+ - N와 NOx- - N의 용출률은 초기 산소농도가 변해도 큰 차이를 보이지 않은 반면에(Fig. 3(a), (b), PO43- - P의 용출률은 상등수의 초기 산소 농도의 영향을 많이 받는 것으로 나타났다(Fig. 3(c)). 상등수의 용존산소 포화도가 90%일 때 NH4+ - N의 유출률은 6.05 ± 0.26 mg m-2 hr-1이었으며, 초기 산소농도가 포화도 70, 50%로 감소하였을 때 NH4+ - N의 유출률은 각각 5.84 ± 0.08, 6.53 ± 0.11 mg m-2 hr-1이었다. 초기 산소농도가 포화도 50 - 90% 범위로 변함에 따라 NH4+ - N의 유출률은 뚜렷한 차이를 보이지 않았다. 초기 산소농도가 포화도 90%일 때, NOx- - N의 유입률은 -1.98 ± 0.002 mg m-2 hr-1이었으며, 초기 산소농도의 포화도를 70, 50%로 조절하였을 때, NOx- - N의 유입률은 각각 -1.89 ± 0.24, -1.67 ± 0.03 mg m-2 hr-1이었다. NH4+ - N와 마찬가지로 NOx- - N의 유입률에 초기 산소농도가 미치는 영향이 크지 않은 것으로 사료된다. 이러한 결과는 앞서 pre-incubation 동안 챔버 내에 산화 환경을 조성했을 때의 용출률 변화와 차이가 있다. Pre-incubation 시간에 따른 용출률 변화를 보기 위해서 12시간 이상 폭기하여 안정화 시킨 경우와 달리, 초기 산소농도에 따라 용출률을 측정하였을 때는 pre-incubation 시간을 최소화하여, 용출률 측정에 필요한 준비가 끝나는 대로 즉시 배양 실험을 시작하였다. 즉, 빈산소 상태의 퇴적물에 일시적으로 산소가 유입되어 포화도가 50-90%가 되어도 산소를 이용하는 미생물이 그만큼 빠르게 반응하지 않았다는 것을 나타낸다. 퇴적물에서 유기물 분해로 새로 생성된 NH4+ - N의 일부는 수층으로 용출되기 전에 질산성 질소(NO3- - N)로 산화되는데, 이 질산화 과정은 다음의 두 단계를 거쳐 일어난다(Fig. 4) [85,88].
이때, NH4+ - N와 아질산성 질소(NO2- - N)를 산화하여 얻을 수 있는 에너지가 상대적으로 낮기 때문에, 이 반응에 관여하는 질산화 박테리아의 성장률(growth rate)은 매우 느리다. 일반적으로 생장에 적합한 최적의 조건(optimal conditions)일 때 질산화 박테리아의 세대 시간(generation time)은 약 8 - 10시간 정도로 알려져 있으며, 환경이 나빠질수록 그 시간은 더 길어진다[88,89]. 즉, 질산화 작용이 활발하게 일어나려면 어느 정도의 시간이 필요한데, 본 연구에서 측정 조건을 맞추는 준비 시간을 포함하여 전체 실험 시간이 짧았다. 이 때문에, 상등수에 산소가 충분히 공급되었음에도 미생물의 활동에 의해 퇴적물과 상등수 내의 질소계 영양염의 조성이 변할 만큼 시간이 충분하지 않았던 것으로 판단된다. 따라서, NH4+ - N와 NOx- - N의 용출률은 초기 산소농도에 따라 크게 변하지 않은 것으로 보인다. 하지만, 본 연구에서 용존산소 농도가 포화도 50%보다 낮은 경우에는 용출률을 직접 측정하지 않았다. 용존산소 농도가 낮을 때도 용출률에 큰 차이를 보이지 않는지 확인하기 위해서는 향후 저산소 또는 빈산소 환경에서의 추가 조사가 필요하다.
질소계 영양염과 달리, PO43- - P의 용출률은 초기 산소농도에 따라 뚜렷한 변화를 보였다. 초기 산소농도가 포화도 90%일 때, PO43- - P은 -0.09 ± 0.002 mg m-2 hr-1로 수층에서 퇴적물로 유입되었으나, 포화도 70%로 실험했을 때는 그 유입률이 -0.06 ± 0.011 mg m-2 hr-1로 감소하였다. 포화도 50%로 실험한 경우, 상등수 내 PO43- - P의 농도는 시간에 따라 증가하였으며, 0.03 ± 0.003 mg m-2 hr-1로 퇴적물에서 수층으로 유출되었다. 앞서 기술한 대로, 공극수 내 PO43- - P의 농도는 유기물 분해로 생성되는 정도와 퇴적물 표층에서 금속 산화물에 흡착되는 정도로 결정된다. 퇴적물에서 유기물 분해되어 PO43- - P이 공극수에 축적되면, 확산에 의해 퇴적물 표층으로 이동하게 된다(Fig. 5). 이때, 표층 퇴적물에 산소가 충분히 공급되면, 환원 상태의 Fe(II) 이온이 Fe(III)로 산화되고, 공극수 내의 PO43- - P와 결합하여 인산철(ferric phosphate) 형태로 침전한다. 이때, 이 결합의 몰 비(molar ratio)는 약 Fe : P = 2이다[90,91]. 만약 표층 퇴적물에 Fe : P 비율이 2 이상이고 산소가 충분히 공급된다면, Fe(III) 산화물은 모두 PO43- - P와 흡착‧결합할 것이고, 수층의 PO43- - P도 퇴적물 내 Fe(III) 산화물에 흡착될 수 있다. 이 경우, PO43- - P이 퇴적물에서 수층으로 유출될 가능성이 낮다. 하지만, 퇴적물 내 산화층이 축소되거나 황화물(sulfide)과의 경쟁으로 Fe : P 비율이 2보다 작다면, 금속 산화물과 결합하지 못하고 용존 상태로 존재하는 PO43- - P가 공극수 내에 축적되고, PO43- - P가 퇴적물에서 수층으로 유출될 수 있다[90]. 본 연구에서 초기 산소농도가 50%일 때 PO43- - P가 수층으로 유출된 것은 퇴적물 표층의 산화층이 환원되었기 때문인 것으로 판단된다. 낮은 산소농도로 배양을 시작하여 시간이 지날수록 점차 산소가 소모되면서 챔버 코어 내 환원 환경이 조성되었고, 그 결과, 금속 산화물과 결합하였다가 해리된 PO43- - P과 유기물 분해로 생성된 PO43- - P이 수층으로 유출되었을 것이다. 이상의 결과로 볼 때, PO43- - P의 용출은 심수층과 표층 퇴적물의 용존산소 농도에 영향을 받으므로, 배양 실험 수행 시 초기 산소농도는 현장 심수층의 산소농도로 맞춰 실험해야 실제 용출률과 유사한 결과를 얻을 수 있을 것으로 사료된다.
2.3.3. 확산경계층 두께
챔버 코어 내 확산경계층(DBL) 두께를 조절하기 위하여 순환 펌프의 유량에 변화를 주어 영양염의 용출률을 측정했을 때, NH4+ - N와 NOx- - N, PO43- - P의 용출률은 모두 DBL 두께 변화에 따라 큰 차이를 보였다(Fig. 3). 연구 지역의 현장 조사 당일 유속을 고려하여 DBL 두께가 0.6 - 0.8 mm가 되도록 챔버 내에 흐름을 형성시켰을 때, NH4+ - N의 유출률은 6.05 ± 0.26 mg m-2 hr-1이었다. 펌프의 유량을 낮춰서 DBL 두께를 1.2 - 1.4 mm로 구현했을 때 NH4+ - N의 유출률은 2.12 ± 0.01 mg m-2 hr-1로 감소하였으며, 반대로 DBL이 생기지 않도록 챔버 내 흐름을 빠르게 조절하였을 때 NH4+ - N의 유출률은 9.78 ± 0.69 mg m-2 hr-1로 증가하였다(Fig. 3(a)). DBL 두께가 0.6 - 0.8 mm로 현장 조건과 비슷했을 때, NOx- - N의 유입률은 -1.98 ± 0.04 mg m-2 hr-1이었다. 챔버 코어 내 유속이 감소하여 DBL 두께가 1.2 - 1.4 mm로 두꺼워지면 NOx- - N의 유입률은 -1.79 ± 0.33 mg m-2 hr-1로 감소하는 경향을 보였으며, DBL이 소멸됐을 때는 유입률이 -2.36 ± 0.33 mg m-2 hr-1로 증가하는 경향을 보였으나 통계적으로 유의하지 않았다(Fig. 3(b)). DBL 두께가 0.6 - 0.8 mm일 때 PO43- - P의 유입률은 -0.09 ± 0.002 mg m-2 hr-1로 나타났으며, DBL 두께를 1.2 - 1.4 mm와 0 mm로 구현했을 때 PO43- - P의 유입률은 각각 -0.04 ± 0.003, -0.54 ± 0.046 mg m-2 hr-1로, DBL 두께가 0.6 - 0.8 mm일 때의 PO43- - P의 유입률과 최대 6배 차이가 났다(Fig. 3(c)).
DBL 두께에 따른 영양염의 용출률을 측정한 결과, 퇴적물과 수층 사이의 물질 교환 속도는 DBL 두께에 반비례하는 것으로 나타났다. DBL은 퇴적물과 수층 사이에 형성되므로, 퇴적물에서 수층까지, 또는 수층에서 퇴적물까지 물질이 이동하려면 반드시 DBL을 통과해야 한다. 앞서 기술한 대로, DBL 내에서 물질의 연직 이동은 주로 분자 확산이 주도하며[77,78], 임의의 물질이 DBL을 통과하여 이동하는데 걸리는 시간은 DBL 두께에 비례하기 때문에[92], DBL 두께에 따라 영양염의 용출률이 차이를 나타낸 것으로 판단된다. 순환 펌프의 유량을 줄여 챔버 코어 내 흐름이 느려지면 DBL이 두껍게 형성되어 물질 교환이 제한되므로 영양염의 유입‧유출률이 감소할 수 있고, 반대로 유량을 늘려 흐름이 빨라지면 DBL이 얇게 형성되거나 소멸되어 물질 교환이 활발해지므로 영양염의 유입‧유출률이 증가할 수 있다. 즉, 본 연구에서 챔버 내의 DBL 두께로 재현된, 심수층의 유속에 따라 영양염의 용출률이 달라질 수 있음을 나타낸다. 따라서, DBL 두께에 따라 영양염 용출률을 측정한 결과, 정확한 용출률을 측정하기 위해서는 현장의 심수층 유속에 상응하는 DBL을 챔버 내에 재현하여 배양 실험을 수행하여야 한다.
2.3.4. 배양 온도
온도는 미생물의 성장과 대사 작용을 조절하는 역할을 하는 중요한 환경 조건이기 때문에, 생물 매개 작용에 의해 조절되는 퇴적물의 용출은 온도 변화에 영향을 받게 된다[3,81]. 배양 온도가 17℃일 때 NH4+ - N은 6.05 ± 0.26 mg m-2 hr-1로 퇴적물에서 유출되었다. 배양 온도를 10℃로 낮춰 배양하면 유출률은 2.96 ± 0.16 mg m-2 hr-1로 감소하였고, 20, 25℃로 맞춰 실험한 결과, 온도가 증가함에 따라 퇴적물에서 수층으로 유출되는 NH4+ - N의 양도 각각 5.62 ± 0.25, 6.64 ± 0.31 mg m-2 hr-1로 증가하였다(Fig. 3(a)). NOx- - N의 경우, 17℃에서 배양했을 때 수층에서 퇴적물로의 유입률은 -1.98 ± 0.04 mg m-2 hr-1이었다. 10℃일 때 유입률은 -2.03 ± 0.65 mg m-2 hr-1이었고, 온도가 증가함에 따라 유입률도 증가하는 경향을 보여 20℃에서 -2.17 ± 0.25 mg m-2 hr-1, 25℃일 때 -2.66 ± 0.41 mg m-2 hr-1였다. 퇴적물-수층 경계면에서 수온이 높아지면 퇴적물의 산소소모율이 증가하여 유기물 분해가 증가하고, 용존산소 농도가 감소하여 퇴적물 내 산화환원 전위가 낮아진다. 따라서, 암모늄화가 활발하게 일어나고 공극수에 축적되는 NH4+ - N도 증가하기 때문에, 퇴적물에서 수층으로 유출되는 NH4+ - N의 양도 증가한 것으로 판단된다. 탈질산화 작용 또한 퇴적물의 온도와 명백한 상관관계를 보이며, 온도가 높아질수록 탈질산화 작용이 활발하게 일어난다[84]. 그 결과, 공극수 내 NOx- - N의 농도가 낮아지기 때문에, 수층으로부터 퇴적물로 유입되는 NOx - N의 양도 증가한다. 따라서, 배양 온도가 높아질수록 NH4+ - N의 유출률과 NOx - N의 유입률은 증가한다. 한편, 온도 증가에 의해 퇴적물 내에 환원 환경이 조성되면 NOx- - N를 NH4+ - N로 환원시키는 DNRA (dissimilatory nitrate reduction to ammonium)에 유리한 조건이기 때문에[93], DNRA도 공극수의 NH4+ - N 농도 증가에 일부 기여했을 가능성이 있다(Fig. 4).
온도가 높아지면 NH4+ - N의 유출률과 NOx - N의 유입률은 증가한 반면에, PO43- - P의 유입률은 감소하였다(Fig. 3(c)). 배양 온도가 17℃일 때 PO43- - P는 -0.09 ± 0.002 mg m-2 hr-1로 수층에서 퇴적물로 유입되었다. 온도를 10℃까지 낮추면 유입률은 -0.11 ± 0.024 mg m-2 hr-1로 증가한 반면에, 온도가 20, 25℃일 때는 각각 - 0.09 ± 0.001, -0.07 ± 0.008 mg m-2 hr-1로 유입률이 감소하는 경향을 보였으나 통계적으로 유의하지 않았다. PO43- - P의 용출률에 온도가 미치는 영향은 철산화물과 결합한 PO43- - P가 많을수록 크다는 연구 결과가 있다[86]. PO43- - P의 용출률이 온도에 따른 산화-환원 환경 변화에 민감하다는 것을 나타낸다. 온도 증가하면 퇴적물의 산소소모율 증가로 더 많은 유기물이 분해되어 공극수 내에 PO43- - P의 농도가 증가하지만, 퇴적물 표층의 산화층이 축소된다. 그만큼 공극수와 상등수 내의 PO43- - P와 금속 산화물이 결합할 기회가 줄어들 것이며, 이미 금속 산화물에 흡착되어 있던 PO43- - P도 공극수로 해리될 수 있다. 따라서, 공극수의 PO43- - P 농도가 증가하여 수층의 PO43- - P가 퇴적물로 유입되는 양은 감소한 것으로 판단된다.
배양 온도에 따라 영양염 용출률을 측정한 결과, 온도가 변함에 따라 영양염의 용출률도 차이를 보였다. 따라서, 실제 용출률을 유사하게 재현하기 위해서는 현장 심수층 수온에 맞춰 배양 실험을 해야 한다. 한편, 본 연구 지역의 심수층 수온인 17℃와 그보다 3℃ 높은 20℃로 배양 온도를 조절하여 용출률을 측정했을 때, 각각의 용출률이 큰 차이를 보이지 않았다. 이는 배양 실험 수행 시, 현장 심수층 수온과 약 3℃ 정도의 온도차는 허용될 수 있다는 것을 의미한다. 하지만, 이 3℃의 차이가 20℃보다 더 낮거나 더 높은 수온일 때도 허용이 되는 범위인지를 파악하기 위해서는 수온과 용출률의 상관관계에 대한 연구가 더 필요한 것으로 사료된다.
3. 결 론
실험실 코어 배양법으로 pre-incubation 시간, 초기 산소농도, 확산경계층 두께, 배양 온도의 환경 조건에 따른 용출률 변화를 측정한 결과, 퇴적물-수층 경계면의 물리, 화학, 생물학적 환경 조건이 변하면 퇴적물의 용출률도 달라진다는 것을 확인하였다.
1) 산화 환경을 조성하여 12시간 이상 pre-incubation할 경우, 유기물 분해와 산화 작용으로 챔버 내 퇴적물과 상등수의 화학조성이 현장 조건과 달라진다. 그 결과, pre-incbation 시간이 길어질수록 영양염의 유출·유입률은 점차 감소하였으며, 용출의 방향이 반대로 역전되는 결과도 나타났다. 즉, 퇴적물의 영양염 용출률은 pre-incubation 시간과 조건에 영향을 받는다.
2) 암모니아성 질소와 질산성 질소+ 아질산성 질소의 용출률은 초기 산소 농도의 영향을 적게 받지만, 산화-환원 환경에 민감하게 반응하는 인산염 인은 상등수의 산소 농도가 감소하면 퇴적물로의 유입률도 감소하며, 포화도 50%일 때는 반대로 퇴적물에서 수층으로 유출되었다. 배양 실험을 시작할 때, 상등수의 용존산소 농도에 따라 영양염의 용출률의 차이가 있다.
3) 코어 배양법은 상등수를 교반시키기 때문에 교반의 강약에 따라 확산경계층 두께가 결정되고, 그에 따라 퇴적물의 영양염 용출률이 달라진다. 확산경계층의 두께가 증가할수록 암모니아성 질소의 유출률, 질산성 질소+아질산성 질소와 인산염 인의 유입률은 점차 감소하였으며, 확산경계층이 사라지면 용출률이 최대 5배까지 증가하였다. 따라서, 연구 지역의 심수층 유속에 상응하는 확산경계층을 챔버 내에 재현하지 않으면 영양염 용출률 결과가 과소평가 또는 과대평가될 수 있다.
4) 영양염 용출률은 생물 활성과 관련된 작용에 의해 조절되므로 온도 변화에 따라 용출률도 변한다. 암모니아성 질소의 유출률과 질산성 질소+ 아질산성 질소의 유입률은 온도가 증가함에 따라 증가하였다. 반면에, 인산염 인의 유입률은 온도가 증가함에 따라 감소하였다.
5) 이상의 연구 결과는 퇴적물 시료 채집 후 실험실로 복귀하여 되도록 빨리 배양 실험을 시작해야 하며, 상등수의 초기 산소농도와 챔버 내의 흐름, 배양 온도는 연구 지역의 현장 심수층의 환경 조건을 최대한 재현하여 실험해야 실제 영양염 용출률과 유사한 결과를 얻을 수 있음을 의미한다. 특히, 이 네 가지 환경 조건이 각각 용출률에 영향을 미치는 것이 아니라, 서로 유기적으로 연결되어 있는 것으로 판단된다. 따라서, 실험실에서 코어 배양법으로 영양염의 용출률을 측정할 때는 상등수의 초기 산소농도를 현장의 산소농도로 맞추고, 연구 지역에서 유속이 관측될 경우 그에 상응하는 확산경계층을 챔버 내에 구현하며, 배양 온도는 현장의 심수층 수온으로 유지하여, 퇴적물 코어 시료 채집 후 되도록 빠른 시간 내에 용출률을 측정하여야 한다. 그리고, 배양 실험 중 이 환경 조건이 유지되었는지를 항상 염두해두고 자료를 분석하고 결과를 해석해야 할 것으로 사료된다. 향후, 퇴적물 코어 배양법의 정확도 및 정밀도 기준을 도출하기 위하여 현장 측정법과 비교할 예정이다.
Acknowledgements
본 연구는 국립환경과학원 ‘퇴적물 용출측정 및 수질 영향평가 표준화-용출실험 표준화 및 수질영향평가 절차 정립(2015-01-02-076)’의 일환으로 수행되었으며, 국립환경과학원 박사후연수과정 지원사업에 의해 이루어졌습니다.