UV-LED기반 고도산화공정을 이용한 수중 마이크로시스틴-LR, 이취미 물질, 자연유기물 분해
Degradation of Microcystin-LR, Taste and Odor, and Natural Organic Matter by UV-LED Based Advanced Oxidation Processes in Synthetic and Natural Water Source
Article information
Abstract
호소, 하천 등에 다량의 영양염류의 유입과 수문학적, 지리학적, 생물학적 요소 등으로 인해 남조류가 대량 발생하게 되며 대표적 독성물질인 마이크로시스틴-LR(MC-LR)이 증가한다. MC-LR이 포함된 지표수를 적절하게 처리하기 위하여 정수처리공정에서는 고도산화공정을 적용하고 있다. 다양한 고도산화공정 중 특히 UV, UV/H2O2, UV/O3, UV/Tio2 등에 대한 연구는 꾸준히 되어왔다. 기존의 UV램프의 짧은 교체주기, 수은 폐기물 발생, 큰 열 손실 등의 단점을 보완한 UV-LED를 MC-LR제거에 적용하였다. MC-LR 초기농도 100 μg/L을 280 nm의 파장인 LED-L (0.024 mW/cm2)와 LED-H (2.18 mW/cm2)를 이용하여 산화시켰을 때 각각 최대 약 30%, 95.9%의 MC-LR 제거율을 나타냈다. LED-H를 조사 시 자연유기물 변화는 휴믹물질, UVD, SUVA가 감소하는 경향을 보였고 방향족 유기물이 지방족 유기물로 분해되어 저분자 물질이 되었다. LED-H/H2O2 (H2O2: 1, 2, 5, 10 mg/L)산화반응에 의한 MC-LR제거율은 LED-H 단독에 의한 MC-LR 제거율과 유사하였다. 남조류가 발생한 낙동강 원수를 대상으로 LED-L산화를 적용하여 수질분석을 통하여 특성변화를 확인하였다. DOC 및 TOC의 변화는 거의 없었으나 SUVA와 UV<sub>254</sub>의 감소로 인하여 유기물의 분해되었으며 조류유래물질인 용존 및 총 MC-LR, geosmin, 2-MIB농도가 시간이 지남에 따라 서서히 감소하였다.
Trans Abstract
Microcystin-LR (MC-LR) is one of most abundant microcystins, and is derived from blue-green algae bloom. Advanced oxidation processes (AOPs) are effective process when high concentrations of MC-LR are released into a drinking water treatment system from surface water. In particular, UV-based AOPs such as UV, UV/H2O2, UV/O3 and UV/Tio2 have been studied for the removal of MC-LR. In this study, UV-LED was applied for the degradation of MC-LR because UV lamps have demonstrated some weaknesses, such as frequent replacements; that generate mercury waste and high heat loss. Degradation efficiencies of the MC-LR (initial conc. = 100 μg/L) were 30% and 95.9% using LED-L (280 nm, 0.024 mW/cm2) and LED-H (280 nm, 2.18 mW/cm2), respectively. Aromatic compounds of natural organic matter changed to aliphatic compounds under the LED-H irradiation by LC-OCD analysis. For application to raw water, the Nak-dong River was sampled during summer when blue-green algae were heavy bloom in 2016. The concentration of extracellular and total MC-LR, geosmin and 2-MIB slightly decreased by increasing the LED-L irradiation; however, the removal of MC-LR by UV-LED (λ= 280 nm) was insufficient. Thus, advanced UV-LED technology or the addition of oxidants with UV-LED is required to obtain better degradation efficiency of MC-LR.
1. 서 론
남조류(blue-green-algae)는 호수, 하천, 연못 등의 다양한 수계에서 쉽게 찾아 볼 수 있다. 남조류는 다른 종류의 조류와 유사하게 영양염류 중 인과 질소가 다량 유입되어 증가하거나 수문학적, 지리학적, 생물학적인 자연적 요인과 상호작용으로 번식하기 적절해진 환경에서 지표수에 빠르게 증식하고 이는 남조류 대발생을 야기한다[1,2]. 사이아노박테리아의 대량 증식은 색도, 맛, 냄새 등의 불쾌감을 야기하거나 세포의 사멸 또는 대사작용으로 독성물질을 방출한다[3].
40여종 중 독성을 띠는 남조류가 존재하는 것이 항상 유해한 것은 아니나 대표적으로 남조류 독성물질 중 간독성물질(Hepatotoixns)인 마이크로시스틴[마이크로시스틴-LR(MC-LR), 마이크로시스틴-RR(MC-RR), 마이크로시스틴-YR(MC-YR)]이 있으며, 이 중 MC-LR의 독성이 가장 강하다[4,5]. MC-LR은 구조적 안정성이 좋아 고온의 조건, 건조한 조건, 생물분해 조건에도 그 특성을 유지한다[3,6]. 마이크로시스틴은 인간 또는 동물에게 노출되었을 경우에 급성독성으로 인한 영향도 있으며, 음용수에 의해 저농도로 지속적인 노출 역시 질병을 유발할 가능성이 있기 때문에 더 주의하고 관리해야 한다[7~9]. MC-LR 노출로 인한 사람과 동물에게 문제를 야기한 사례는 미국, 호주, 중국, 영국 등이 있으며, 1996년 브라질에서는 MC-LR에 오염된 물을 인공투석에 사용하면서 50여명이 사망하는 사례 이후에 세계보건기구(WHO)는 먹는 물 수질기준으로 1 μg/L로 설정하여 MC-LR을 관리하고 있다[3,10].
상수원에 MC-LR이 포함되어 정수처리공정으로 유입되는 경우에 먹는 물 수질기준에 적합한 물을 공급하기 위하여 침전, 여과 등을 적용하여 남조류의 세포를 제거하여 체내 MC-LR (intracellular MC-LR)을 제거하는 방법이 있다. 그러나 이러한 처리방법으로 남조류 세포에서 용출되어 지표수에 용존하는 MC-LR (Extracellular MC-LR)을 제거하기 위한 방법으로는 충분하지 않다[11~13]. 따라서 용존 상태의 MC-LR을 보다 효과적으로 제거하기 위하여 MC-LR의 구조를 파괴하는 화학적 산화처리방법을 적용해야 한다. 수처리에 적용된 대표적인 산화제에는 염소계 산화제(ClO2, HClO, Cl2), 과산화수소(H2O2), 오존(O3)등이 있으며, 보다 효과적인 고도산화처리(advanced oxidation process)가 연구되어 왔다. 대표적인 방법으로 UV, O3, UV/H2O2, UV/O3, UV/TiO2, Fenton 등으로 산화력이 높은 OH라디칼이 발생되어 MC-LR을 제거하고 있다[11~16].
일반적인 UV를 기초로 한 고도산화처리의 경우 저압수은램프 또는 고압수은램프를 사용하며 높은 전력을 소비하는 단점이 있다. 이에 반해 LED (Light Emitting Diode)는 낮은 안정시간, 긴 교체 주기, 수은 폐기물처리 문제, 높은 안정성, 취급이 용이, 열로 소실되는 에너지가 적다는 점에서 UV램프 대체품으로 적합하다[17~19]. 또한 UV램프는 8,000-10000시간 사용가능 한 것과 비교하여 UV-LED는 50,000시간 사용 가능하여 효율성이 높다[18,19]. UV-LED는 염료나, 페놀, 유기물 등의 유기 화합물을 제거하는 연구에 적용되어 왔다[20,21]. 남조류 유래 독성물질로 중 anatoxin-a 및 MC-LR 제거한 사례[21]가 있으나 그 수가 매우 부족하며, UV-LED를 이용한 다양한 고도산화기술 대한 연구가 필요하다. UV-LED의 효과는 잘 알려져 있지 않으며 기능성 UV-LED의 경우 여전히 제작단계나 활용분야에서 발전하고 있는 단계이다[22]. 따라서, 본 연구는 UV-LED를 이용한 조사강도에 따른 MC-LR의 제거특성과 자연유기물의 분해특성을 평가하는 것을 목적으로 한다. 또한, UV-LED/H2O2 공정적용 가능성 및 남조류 대발생 원수를 대상으로 자연유기물, MC-LR, 이취미물질(geosmin, 2-MIB)의 제거 가능성을 평가하여 UV-LED의 수처리 적용 가능성을 확인하고자 한다.
2. 실험재료 및 방법
2.1. 시약
MC-LR은 Enzo science (USA)에서 표준물질을 구매 후 메탄올에 용해하여 사용하였으며, 과산화수소 35%시약(OCI)은 수처리제로 등록된 것을 사용하였다. 모든 실험의 시약은 증류수(Aqua max ultra 370 series)로 제조 및 실험하였다. Ammonium formate는 Samchun사(Korea)와 formic acid는 Fluka (Germany)의 제품을 사용하여 LC-MS/MS 이동상 제조에 사용되었으며, acetonitrile (ACN)는 모두 HPLC grade로서 J. T. Baker (USA)를 사용하였다. 소의 간의 카탈라아제(2000~5000 μ/mg)는 시그마알드리치(USA)에서 구매하여 사용하였다. 스와니강의 자연유기물(natural organic matter, NOM) 표준물질을 International Humic Substances Society (IHSS)에서 구매하여 사용하였다.
2.2. UV-LED 광원 특성 및 광반응기
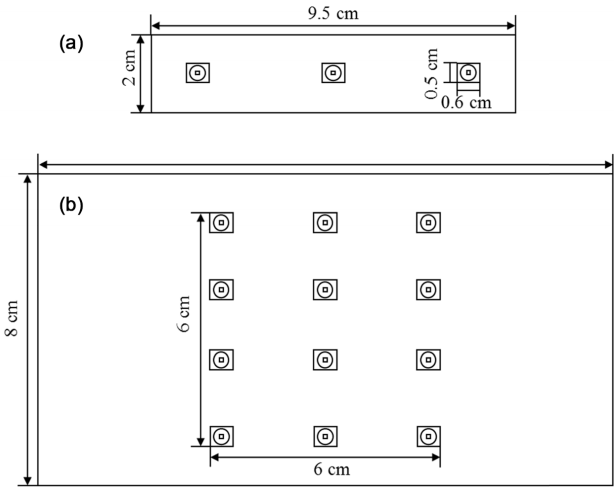
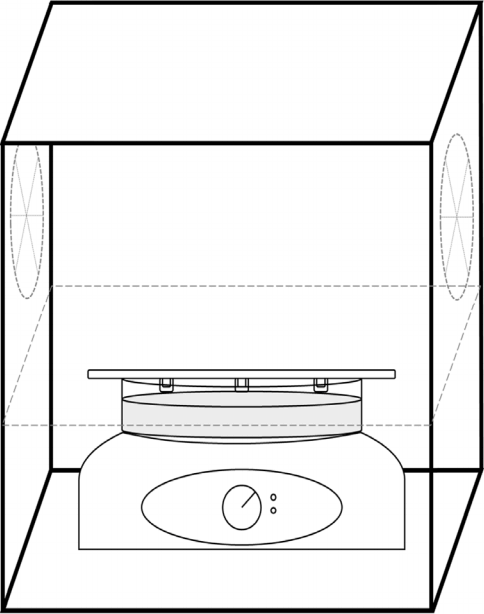
사용한 UV-LED는 (주)루멘스에서 제작한 것을 사용하였으며 두 가지 형태로 광원을 제작하였다. 280~285 nm에서 최고 파장을 나타내는 UV-LED를 3 cm를 간격으로 3개를 일렬로 배치한 이 모듈의 조사강도는 0.024 mW/cm2이었다 (LED-L) (Fig. 1(a)). 270~275 nm에서 최고 파장을 나타내는 UV-LED를 1.6 cm간격으로 3개씩 4줄로 배치한 모듈의 조사강도는 2.18 mW/cm2 이었다 (LED-H) (Fig. 1(b)). 모듈은 반응하는 수표면과 평행하게 반응하였다. UV-LED의 광원의 산화력을 확인하기 위하여 외부의 빛 유입을 차단하기 위하여 암실조건이며, 반응온도 유지를 위한 공기순환 장치가 설치되어 있는 반응기를 사용하였다(Fig. 2).
2.3. UPLC-MS/MS를 이용한 MC-LR 분석
액체크로마토그래피는 Agilent technology (CA, USA)사의 UPLC 1290 infinity (ultra-performance liquid chromatography)를 사용하였으며, 검출기는 6460 triple quadrupole mass spectrometer으로 LC/MS/MS system을 구성하여 MRM방식으로 분석하였다. 분석을 위한 칼럼은 충전 입자크기가 1.8 μm로 2.1 mm × 100 mm Zorbax Eclipse Plus C18 (Agilent technology, CA, USA)으로 칼럼온도는 40℃를 유지하여 분석하였다. 이동상으로 A는 20 mmol/L ammonium formate의 물과 B는 0.1% formic acid의 acetonitrile을 사용하였다. 이동상의 기울기 조건은 A 95%로 시작하여 9분까지 A 30%로 내렸으며 3분 동안 초기 이동상 비율을 유지하였다. 이동상의 유속은 0.45 ml/min을 사용하였으며 시료주입량은 10 μL이었다. 이와 같은 조건에서 MC-LR은 약 5.1분에 측정되었으며, 검출한계는 0.02 μg/L이다.
2.4. UV-LED를 이용한 MC-LR 및 유기물 산화제거 특성 평가
UV-LED를 이용한 MC-LR산화의 경우 petri dish에 40 mL의 시료를 지속적으로 교반하였으며, 초기 MC-LR농도는 100 μg/L로 DI조건에서 실험을 진행하였다. UV-LED는 시료와 거리를 8 mm로 조사하였다. UV-LED산화는 LED-L 및 LED-H에 대한 산화제거 특성분석을 진행하였으며, 반응시간 1, 2, 3, 4, 5, 24시간으로 샘플링하여 UPLC-MS/MS로 분석하였다. UV-LED/H2O2를 이용한 MC-LR 제거는 LED-H에 대해서만 진행되었으며, H2O2는 1, 2, 5, 10 mg/L의 농도로 실험하였다. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 24시간의 반응시간으로 샘플링을 진행하였다. UV-LED를 이용한 유기물 산화의 경우 DOC기준 10 mg/L농도로 제조하였으며, LED-H를 1, 2, 4, 24시간 조사하여 각 반응시간 별 유기물의 변화를 확인하였다. 유기물 특성변화는 LC-OCD (Liquid Chromatography-Organic Carbon Detection, DOC labor, Germany)로 분석하였다.
2.5. 남조류 발생 낙동강 원수 적용 실험
2016년 6월 30일에 채수한 낙동강 원수를 실험에 사용하였으며, 채수시기와 근접한 환경부에서 공개한 2016년 6월 27일 수질자료에는 남조류세포수와 Chl-a의 수치를 각각 1,701 cell/ml, 11.3 mg/m3으로 제시되어 있으며[23] 실험에 사용된 수질특성과 비슷할 것으로 예상되며 실험에 사용한 낙동강 원수는 남조류가 다량 증식하여 부유하는 특징을 나타냈다. 실험의 대조군으로는 일반 LED 1개를 설치한 반응조 1개와 실험군으로 LED-L를 설치한 2개의 반응조를 이용하여 실험을 진행하였다(Fig. 3). 3개의 각 반응조 실험용량은 1.85 L로 하루 1번 수질 특성분석을 진행하였다. 분석한 수질항목은 DOC (Dissolved Organic Carbon), TOC (Total Organic Matter), UV254, 탁도, 색도, pH, 전기전도도, 이취미물질(geosmin, 2-MIB), MC-LR이다. 0.45 μm PVDF (Whatman)로 여과한 시료를 DOC 및 UV254를 분석하였으며, 초음파 처리하여 TOC를 분석하였으며, 유기물농도 측정은 TOC analyzer (TOC-L, Shimadzu, Japan)를 이용하였다.

Reactor of raw water samples: (a) LED-L reactors initial condition; (b) visible light; and (c) LED-L reactor after 4days.
채수한 시료의 수중에 존재하는 것을 용존(extracellular)이라고 하며 0.45 μm실린지 필터(PVDF, Whatman)로 여과한 시료를 분석하여 용존 MC-LR, 용존 geosmin, 용존 2-MIB 농도를 구하였다. 용존(extracellular)된 것과 조류세포 내(intracellular)에 존재하는 것을 합하여 분석하는 것이 총(total)농도이며, 총 MC-LR, 총 geosmin, 총 2-MIB농도는 200 ml부피의 원수를 초음파로 5분간 처리한 후 0.2 μm 실린지 필터(Nylon, Whatman)를 이용하여 여과한 시료를 분석하였다. geosmin과 2-MIB는 Multi-Purpose Sampler (Gurstel, Germany), Gas Chromatography 7890A (Agilent technology, USA), Mass Spectrometer 5976C (Agilent technology, USA)로 분석하였다.
3. 결과 및 고찰
3.1. UV-LED 광출력에 따른 MC-LR 산화효율 평가
UV-LED의 조사시간에 따른 산화 효율을 평가하고자 실험을 진행하였으며, LED-L과 LED-H에 따른 MC-LR 제거율을 비교하였다. LED-L를 이용하여 MC-LR제거 실험을 진행한 결과 LED-L 조사시간이 증가할수록 제거율은 증가하는 경향을 보였으며, 24시간에 약 25~30%의 제거율을 나타냈다(Fig. 4(a)). LED-L의 산화효율로는 MC-LR을 충분히 산화시킬 수 없으므로 LED-L에 비하여 광출력이 높은 LED-H를 이용하여 MC-LR 제거율을 비교하였다. 특성이 다른 두 가지 광원으로 초기 1시간 반응하였을 때 LED-L은 약 10% MC-LR 제거율, LED-H은 약 30% MC-LR 제거율을 보였다. 24시간 동안 반응하였을 때 LED-L은 최대 약 30% MC-LR 제거율을 보였으며, LED-H로 MC-LR 제거율 약 95.9%을 나타냈다(Fig. 4(b)).

Removal of MC-LR (C0 = 100 µg/L) during the UV-LED photolysis processes at different UV intensities: (a) LED-L; (b) LED-H; and (c) LED-H/H2O2.
UV에 의한 MC-LR 광분해 메커니즘을 규명하기 위해서는 추가적인 연구가 필요하지만, 기존 문헌에서는 UV 조사에 의해 발생한 전자가 MC-LR 분자로부터 산소분자로 이동하면서 O2- 를 발생시키고, 최종적으로 발생된 OH라디칼의 영향으로 MC-LR이 분해된다고 설명하고 있다(식 (1)~(4))[24~26].
3.2. UV-LED를 이용한 자연유기물 산화분해반응 평가
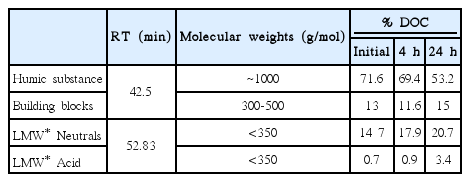
UV-LED를 수처리에 적용하였을 때 자연유기물의 분해효과를 살펴보았다. 특히 산화반응 과정을 LC-OCD분석을 통하여 DOC를 구성하는 세부 유기물 성분변화를 확인하여, DOC분자량 차이와 UV흡광의 차이를 성질에 따라서 비교하였다. HS-Diagram (Humic Substances Diagram)에서 나타난 유기물의 특성변화는 반응 전 초기상태에 비하여 4시간 LEDH산화분해한 시료는 상대적으로 저분자 물질로 분해되었으며, 24시간 LED-H산화분해한 시료는 방향족성이 감소하는 특성을 보였다(Fig. 5(a)). DOC는 9.90 mg/L로 대부분의 유기물은 용존상태로 존재한다. SUVA는 초기 5.14 L/mg-m 에서 4시간 반응 후에 4.78 L/mg-m로 24시간 반응 후에 4.09 L/mg-m 반응시간이 지날수록 감소하는 경향을 보였으며, humic substance가 차지하는 비율이 71.6%에서 53.2%로 감소하는 경향을 보였다. 이는 LED-H에 의하여 유기물의 방향족 구조를 파괴하여 지방족 구조로 변화함을 의미한다 (Fig. 5(b)) [27,28]. UVD 시그널이 시간이 흐름에 따라서 감소하는 경향을 보였으며 humic substance의 비율이 감소하면서 (Fig. 5(c)) building block의 초기와 반응 후의 양은 유사하다. 반면 초기농도에 비하여 LMW neutrals, LMW acids이 비율 및 양의 증가를 보였으며(Table 1), 고분자의 물질이 감소하여 저분자의 형태로 변한 것을 확인하였다(Fig. 5(a)).
3.3. UV-LED/H2O2를 이용한 MC-LR 산화효율 평가
UV-LED와 H2O2의 반응으로 UV-LED를 이용한 광분해를 비롯하여 OH라디칼을 발생하므로 UV-LED/H2O2를 이용하여 MC-LR를 제거하는 것에 효과적일 것이라 예상하였다. LED-H를 이용한 광분해의 경우 반응시간 1시간 기준으로 MC-LR제거율은 약 30%였으나 LED-H/H2O2의 산화반응에서 H2O2 (1, 2, 5, 10 mg/L)농도가 증가하여도 MC-LR제거율은 유사하였다. 21)에서는 UV fluence 4032 J/m2 조건에서 UV-LED 파장을 260 nm에서 anatoxin-a의 제거율이 50%였으나 파장이 280 nm로 증가하면 anatoxin-a의 제거율이 3% 로 감소하였다. UV-LED/H2O2의 경우 H2O2를 0.5 mmol/L 추가하였더니 anatoxin-a의 제거율이 97%까지 증가하였다. H2O2에서 OH라디칼을 발생에는 O-O결합을 쪼개기 위하여 큰 결합해리에너지가 필요하다. 이는 200 nm~280 nm에 해 당하는 단파장의 UVC에너지가 효과적인 OH라디칼 발생을 유도하며 [29,30], UVC 파장범위에서 양자수득률(Φ = 1)이 높아 OH라디칼의 발생량이 증가한다 [30]. 또한 H2O2는 200 nm~280 nm파장범위의 UV를 흡수하며 파장이 단파장일수록 흡수하는 양은 증가하므로 본 실험에 사용된 UV-LED의 파장은 280 nm로 파장범위가 254 nm~260 nm인 UV-LED 보다 H2O2가 흡수하는 파장범위에 적합하지 않아 OH라디칼을 효과적으로 발생시킬 수 없음을 나타낸다. 이는 선택적 분해가 아니라 모든 유기화합물을 분해하는 OH라디칼의 특성으로 인하여 진행된 실험조건에서 H2O2 농도의 증가는 광분해에 영향을 주지 않거나 OH라다칼에 의한 MC-LR제거에 저해요인으로 작용하였다(Fig. 4(c)).
3.4. 남조류 발생 낙동강 원수 적용 실험
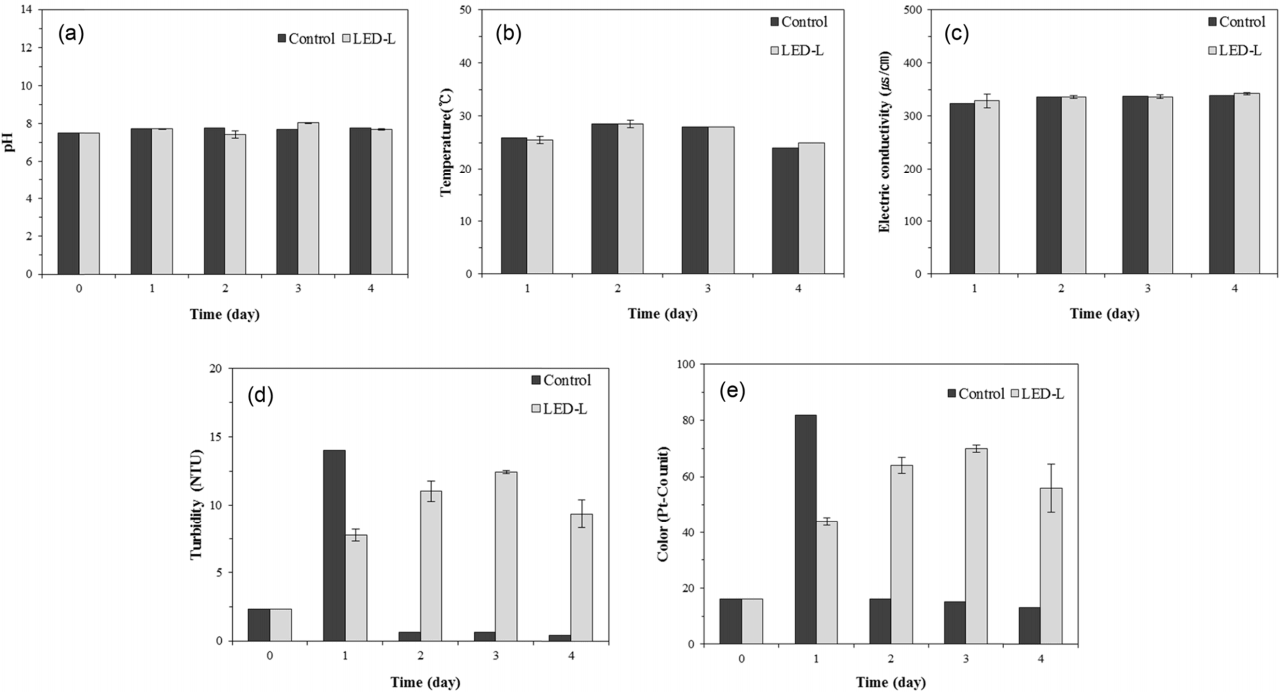
남조류가 발생한 원수를 대상으로 실험을 진행하였을 때 MC-LR 및 다른 수질항목의 분해 특성을 확인하여 수처리에 UV-LED의 적용가능성을 확인해보고자 실험을 진행하였다. 실험에 활용한 낙동강 원수의 특성 분석한 결과는 Table 2에 작성하였다. 이와 유사한 시기인 6월 동안 낙동강 원수를 주기적으로 모니터링한 결과 용존 geosmin, 용존 2-MIB, 용존 MC-LR의 6월평균 농도는 각각 35.62 ± 1.3 ng/L, 15.04 ± 0.65 ng/L, 불검출로 측정되었다. 총 geosmin, 총 2-MIB, 총 MC-LR의 6월 평균농도는 63.87 ± 18.75 ng/L, 27.87 ± 13.57 ng/L, 0.21 ± 0.16 µg/L로 측정되었다. 따라서 본 실험에서 사용한 낙동강 원수는 채수한 비슷한 원수에 비하여 용존하는 조류유래물질 및 조류입자가 많음을 시사한다. 실험에서 사용된 원수는 pH, 전기전도도, 온도는 각각 pH 7.52, 344.75 µs/cm, 26℃로 3개의 반응에서 비슷하게 측정되었 으며, 실험기간 동안 ±5% 범위에서 일정하게 유지되었다 (Fig. 6(a)~(c)). 반면 탁도와 색도는 실험 1일차 LED-L를 설치한 2개의 반응조에서 동일하게 초기에 비하여 약 2배 증가하였으며, 대조군은 초기에 비하여 약 5배 증가하였다. 2 일차부터는 대조군의 탁도는 1 NTU 이하로 급격히 낮아졌 으며, LED-L를 조사한 탁도와 색도는 실험 3일차까지 증가하여 탁도 12.4 ± 0.1 NTU, 색도 69 ± 1도로 측정되었다(Fig. 6(d), (e)). 실험1일차 이후로 색도에 영향을 주는 chl-a가 여전히 녹색을 띠고 있었으며 반응조 내에서 미생물의 용존 산소 소비로 박테리아 증식으로 인하여 탁도 및 색도 또한 증가하였다.
조류 유기물에는 extracellular organic matter (EOM)과 intracellular organic matter (IOM)로 나뉘게 된다. EOM은 대사 작용을 통하여 조류에서 배출되어 수중에 존재하며, IOM 의 경우 세포용해, 자가분해 등으로 인하여 세포가 파괴되어 내부에 존재하는 물질이 배출되어 측정된다. 이와 같은 조류에서 유래한 유기물은 자연유기물의 형태를 나타낸다 [31,32]. LED-L조사 전의 원수 TOC농도는 DOC농도에 비하여 약 2배 높아 입자성 유기물 및 조류세포가 포함된 것으로 예상하였으며 1일차에는 DOC농도가 급격하게 증가하여 TOC 농도와 매우 유사해져 것으로 보아 LED-H에 의하여 조류 세포의 파괴되어 DOC농도 증가를 확인하였다(Fig. 7(a), (b)). 반면 SUVA와 UV254는 실험1일차에서 4일차가 되면서 감소하는 경향을 보인다. 이는 포함된 유기물이 감소하는 것을 시사한다(Fig. 7(c), (d)).

Variation of control and LED-L treated samples: (a) DOC concentration; (b) TOC concentration; (c) UV254; and (d) SUVA.
초기 용존 MC-LR 농도가 매우 낮아 측정한계 이하로 불 검출이었으나 실험1일차에는 용존 MC-LR이 7 µg/L로 급격하게 증가하였으며 실험1일차의 총 MC-LR농도와 용존 MC-LR농도와 매우 유사하였다. 이는 조류가 사멸하면서 조 류세포 내의 MC-LR이 용출됨을 시사한다(Fig. 8(a)). 이취미 물질인 geosmin, 2-MIB은 MC-LR과 유사한 경향성을 보였다. 남조류가 우점하는 여름철(6월~7월)이므로 gesomin 농도가 2-MIB농도보다 월등하게 높은 특징을 보였다. 실험1 일차의 용존 geosmin은 초기농도에 비하여 약 4배가량 급격히 증가하였다가 점점 감소하였다. 총 geosmin은 실험을 진행할수록 감소하는 경향성을 보였으며, 용존 및 총 geosmin 의 제거율은 약 87%, 89%으로 나타났다(Fig. 8(b)). 반응 전 초기 총 2-MIB은 용존 2-MIB의 약 2배 더 높게 측정되었으며 실험이 진행될수록 감소하는 경향성을 확인하였다. 용존 및 총 2-MIB의 제거율은 약 90%, 92%이었다(Fig. 8(c)). 일반 LED아래 조류입자가 부유하는 특성을 보였으나(Fig. 3(b)) LED-L을 설치한 수조에서는 전체적으로 균일한 조류에 짙은 녹색의 띤 초기에 비하여(Fig. 3(a)) 반응 후에는 조류의 성장이 멈추고 전체적으로 분해가 되는 특성을 보였다(Fig. 3(c)). MC-LR, geosmin, 2-MIB, 유기물의 경향성 등을 종합하면 LED-L은 유기성 물질을 분해하고 반응조 내의 조류가 지속적으로 성장하는 기작을 저해하는 효과가 있다.
4. 결 론
MC-LR은 매우 안정적인 물질로 산화력이 높은 산화반응을 적용하여 제거하는 것이 적합하다. 본 연구에서 높은 MC-LR제거율을 달성하기 위하여 UV-LED는 UV램프에 비하여 장시간의 반응시간이 필요하지만 낮은 안정시간, 긴 교체 주기, 높은 안정성, 취급이 용이, 열로 소실되는 에너지 가 적은 장점이 있어, 수처리에 적용할 수 있는 좋은 대안이 될 수 있다. 본 연구에서 적용한 UV-LED는 MC-LR를 단시간에 높은 효율로 제거하지 못하였고, H2O2를 분해하여 OH 라디칼을 다량 발생할 수 있는 적합한 파장범위의 광원으로 서의 한계를 보였지만 현장원수에서, 조류의 성장 기작을 저해하고, 자연유기물질과 이취미 물질을 저감하는 경향을 보였다. 또한, 수처리에 적합한 UVC (254 nm)파장범위에 근접한 UV-LED의 성능 향상과 산화제와의 조합을 이용한다면 수처리 효율의 증가와 높은 적용성을 확보할 수 있을 것으로 기대한다.
Acknowledgements
본 연구는 ‘특화전문대학원 연계 학연협력 지원사업’과 환경부의 환경정책기반공공기술개발사업(과제번호: E416-00020-0606-0)에서 지원받았으며, 이에 감사드립니다.