|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesIn this study, the absorption of heavy metals in the soil from smoking areas using indoor plants and electrical grounding was investigated to increase the utility of indoor plants for soil decontamination.
MethodsSoil from plant pots in a smoking area was collected for the experimental plant pot preparations. Some of the prepared pots were connected to electrical ground via an electrode. Kidney beans (Phaseolus vulgaris) were seeded, and their growth were observed. After 30 days of the cultivation, TOC (Total Organic Carbon), and metagenomics profiles in the soil was analyzed. To estimate the behavior of the heavy metals in soil and plants, Cadmium concentrations in the samples were analyzed using ICP-MS (Inductively Coupled Plasma-Mass Spectrometry).
Results and DiscussionThe connection of the electrical ground to the plant pot induced the rapid growth of plant (48.2 ± 2.3% increase in stem growth), compare to the plant in the pot without the electrical ground. TOC analysis showed that the soil from the grounded pots showed the highest value, compared to the control soil (3.08 ± 1.22%), and the soil from the pot without ground connection (2.3 ± 0.1%). The ICP-MS analysis indicated that the plant body in the grounded pot had the highest cadmium concentration at 0.33 ± 0.018 μg/kg. Using the metagenomic analysis, biomineralization related bacterial species (Nocardioides sp., Streptomyces sp., Sphingomonas sp. etc.) were identified from the grounded soil sample. These results suggested that the indoor plant cultivation with the electrical ground connection as an electrical fertilizer enhances the cadmium absorption by plant, exudate secretion from the plant root, and bacterial flora change in the rhizosphere.
ConclusionCadmium in the soil from the smoking area was absorbed by indoor plant with the electrical ground. Therefore, the application of the electrical ground connection (earth) to the electrically insulated outdoor plant pots might enhance the plant growth rate and physiological activity. This application could be a novel soil decontamination method using plants.
요약목적본 논문에서는 중금속으로 오염된 흡연장의 토양에 실내식물과 전기적 지면 접지를 적용하여, 식물의 토양 내의 중금속 흡수를 확인하였다. 이 결과를 통하여, 중금속 등으로 오염된 각종 토양의 정화에 실내식물의 활용성을 높이고자 하였다.
방법흡연장내 조성된 화분의 토양을 채취하여 일반화분과 전기적 접지(electrical grounding)가 적용된 2종의 화분을 실내에서 구성하고, 여기에 강낭콩(Phaseolus vulgaris) 씨를 식재하였다. 식재 후 30일간, 각 화분의 식물 생장 관찰을 진행하였다. 30일간 재배 후, 재배 토양의 TOC (Total Organic Carbon) 및 metagenomics 분석을 진행하였다. 또한 재배 토양의 중금속 농도 변화를 확인하고자 ICP-MS를 사용하여 토양과 식물내부의 카드뮴 농도를 측정하였다.
결과 및 토의줄기 길이 생장 측정률을 측정한 결과, 30일 기준 전기적 지면 접지 적용 식물이 비접지 식물에 비해 48.2 ± 2.3% 높게 확인되었다. TOC 분석 결과, 접지 화분의 토양내 TOC가 대조군, 비접지 토양에 비해 각각 3.08 ± 1.22%, 2.3 ± 0.1% 높게 확인되었다. ICP-MS 분석 결과, 전기적 지면 접지를 적용한 식물내의 카드뮴 농도가 0.33 ± 0.018 μg/kg으로 가장 높았다. 또한, 대조군 토양 시료에 비해 식물이 존재하는 비접지, 접지 토양의 평균 카드뮴 농도가 각각 10 μg/kg 정도 낮게 나타났다. Metagenomics 분석 결과, 전기적 지면 접지를 적용한 토양에서 중금속에 대한 biomineralization 기능을 갖는 것으로 알려진 Nocardioides sp., Streptomyces sp., Sphingomonas sp. 등이 확인되었다. 따라서 전기적 지면 접지 적용을 통한 식물의 생육 활성도 증가는 식물 뿌리의 exudate 분비 증가를 유도하여 TOC 및 미생물 군집에 영향을 주는 것으로 보이며, 이를 통해 식물의 토양내 중금속 흡수를 촉진한 것으로 판단된다.
1. 서 론중금속은 각종 농업, 교통수단, 채광 등의 산업활동의 결과로써 우리의 환경에 축적되며, 다양한 경로로 인간의 체내에 흡수될 수 있다[1,2]. 지금까지 중금속의 독성과 환경에 미치는 영향 관련 연구는 다양하게 진행된 바 있으며, 알려진 바와 같이 납과 비소, 카드뮴 등의 중금속에 일정농도 이상 노출될 경우, 생물 기반 환경과 생태에 치명적인 결과를 나타낼 수 있다. 특히 토양내의 중금속은 생물 기반 생태계 순환에 중요한 역할을 하기 때문에 환경의 보존과 유지를 위하여 적절한 처리가 필요한 것으로 보인다[2~5].
도시 환경의 경우, 각종 흡연과정을 통한 중금속의 체내 흡수가 높은 위험성을 나타내고 있다[6]. 담배연기에는 약 4천여 종의 유해물질이 포함되어 있으며, 이 중 카드뮴은 World Health Organization (WHO)에서 규정한 공중보건을 위협하는 10대 화학물질 중 하나이다[6,7]. 카드뮴은 담배연기 및 담뱃재에 포함되어 있는 것으로 알려져 있으며, 흡연 중 발생하는 지면으로의 재털기 및 침뱉기 등으로 인하여, 흡연구역의 표층토에서 카드뮴 농도가 일반 토양에 비해 약 200% 이상 높게 나타난다[7,8]. 카드뮴은 체내에 축적될 경우 폐부종, 폐암, 골연화증, 신장 기능 장애 등 각종 만성 질환을 유발한다[9~13]. 또한, 카드뮴은 토양에서의 잔류성이 높기 때문에 적절한 기술을 통한 제거가 요구된다[14,15].
식물복원법(phytoremediation)은 친환경적인 기술을 이용하여 오염물질을 제거하는 생물복원법(bioremediation)에 속하며, 식물의 성장에 기반한 토양내의 뿌리 및 관련 미생물의 활성화를 통하여, 토양내의 중금속을 식물내로 이동 및 고정시키거나, 근권부 미생물의 생육에 기반한 토양내의 중금속을 중화하는 방법이다[5,16]. 이를 기반으로, 한 연구에서 실외에서 채취한 토양에 식물을 식재하였을 때, 화분내 토양의 중금속 농도가 감소하는 것을 확인하였다[17].
전 세계적으로 환경 오염 정화를 위해 연간 최대 500억 달러를 소비하고 있는 것으로 알려져 있으며, 식물복원법을 이용 시, 기존의 복원법보다 10배 가까이 저렴하다는 장점이 있다[18]. 따라서, 비용이 저렴하며 자연과 사람에게 노출되는 오염물질을 친환경적으로 저감할 수 있는 식물 기반의 중금속 제거방법이 최근 각광을 받고 있다[5]. 그러나 식물복원법의 경우, 식물의 생장을 최적으로 유지해야 하며, 토양의 기본 독성도 또한 고려할 필요가 있다[5].
2023년 12월부터, 과천시는 수목형 흡연부스를 설치하여, 담배연기의 유해성분을 저감하고자 시도하고 있다[19]. 또한 다른 지자체 및 단체도 유사한 형태의 흡연환경을 조성, 운영 중이다[20]. 그러나, 흡연부스 근처에 설치된 화단에는, 담배꽁초 및 담뱃재를 버리는 행위가 만연하여, 환경 보존 및 미화라는 의도와는 다르게 흡연 중 발생하는 담뱃재, 침, 꽁초 등으로 인하여, 각종 중금속 및 유해인자가 축적될 가능성이 높은 것으로 보인다. 특히 중금속 등 독성물질의 화단에 대한 유입은 화단의 식물과 관련 미생물의 생육과 유지에 해로운 영향을 주기 때문에, 식물의 생육 저해 및 사멸로 인하여, 화단을 설치한 소기의 목적 중 하나인 중금속 제거를 이루지 못할 가능성이 높다고 판단된다. 또한, 주변에서 흔히 볼 수 있는 콘크리트 지면에 위치한 흡연장 화단은 전기적으로 지면으로부터 절연되어 있기 때문에, 식물의 생육 활성도가 낮아질 수도 있다[21].
최근 연구 결과, 실내에서 생육 되는 식물이 재배되는 화분을 지면에 접지(electrical grounding) 할 경우(식물재배 토양을 지면과 전기적 연결), 실내 식물의 생육 활성도 향상이 가능하다는 것을 보여주고 있다. 이 방법은 실내 식물의 생육환경을 통상적인 자연환경에서의 토양과 전기적으로 유사한 상태로 조성하여, 실내 식물의 생육활성도를 일반 지면 토양에서의 생육환경 수준으로 향상시키는 것으로 보인다. 또한 식물에 전기적 지면 접지를 적용한 결과, 접지를 적용하지 않은 식물에 비해 H1N1 인플루엔자 A 바이러스 제거능이 20% 높게 나타났으며, 접지 적용을 통해 식물의 미세먼지 흡착력 또한 향상시킬 수 있음이 연구된 바 있다[21~23].
따라서 전기적 접지를 통해 식물의 생육과 활성을 향상시킬 경우, 식물의 오염물질 제거 능력을 높일 수 있을 것으로 판단하였다[21~23]. 이를 바탕으로, 본 연구에서는 흡연부스 근처의 화단에서 채취한 토양을 사용하여 화분을 제작한 뒤, 식물 재배 및 전기적 접지를 적용하여 토양내의 카드뮴 농도의 변화를 분석하였다. 이와 함께, 식물의 전기적 접지 적용을 통한 식물의 생장과 토양, 그리고 식물 근권부 미생물 군집에 대한 영향을 분석하기 위하여, 토양의 TOC (Total Organic Carbon) 분석[24] 및 metagenomics 분석을 진행하였다. 이와 같은 과정을 통하여 흡연장 관련 토양내의 카드뮴 등 중금속의 거동을 확인하였으며, 전기적 접지를 통한 실내 식물의 생육활성화가 중금속 제거에 적용될 수 있는지 조사하였다.
2. 실험방법(또는 재료 및 방법)2.1. 시료 채취 구역의 선정 및 시료 채취본 실험 진행에 사용할 토양을 채취하기 위해 야외 흡연구역(37° 32'29.04"N, 127° 04'44.4"E)을 선정하였다. 흡연장의 구조는 Fig. 1A에 표시하였다. 실험에 사용된 흡연장의 지면은 콘크리트로 덮여져 있었으며, 토양을 채취한 화분(가로× 세로× 높이: 150 cm × 50 cm × 50 cm)에는 사철나무(Euonymus japonicus) 20수가 식재 되어 있었다. 화분은 5 cm 길이의 나무 받침대로 지면으로부터 격리된 상태로 구성되어 있었으며, 이때 화분 토양과 주변 접지 기준점(상수도관) 사이의 전기적 접지저항을 접지저항계(TK-2040, Taekwang, Korea)로 측정한 결과 1,000 Ω을 초과하는 것으로 나타났다.
해당 흡연장에 조성된 식물 화분의 토양에 대한 중금속 오염도를 조사하기 위하여, 화분 토양 표면으로부터 깊이 10 cm까지의 토양을 채취하였다. 채취한 토양은 18 size mesh (pore size ⋍ 1 mm)로 걸러 이물질을 제거하는 전처리 과정을 거쳐 실험용 화분 제조 및 토양 시료로 사용하였다. 대조군으로 사용될 토양 시료는 -25℃에 보관하여 최초 채취 상태를 보존하였다.
2.2. 식물의 전기적 접지 적용본 실험에서, 중금속을 뿌리와 잎으로 흡수하는 것으로 알려진 강낭콩(Phaseolus vulgaris) [25]을 선정하여, 전극이 포함되지 않은 일반 화분(without ground)과 접지 화분(with ground)에 각각 파종하여 실험을 진행하였다.(Fig. 1B)
전기적 접지를 적용한 화분의 구성을 Fig. 1B에 표시하였으며, 전극으로 carbon felt와 stainless steel을 사용하였다[21]. 이때 접지 화분에 사용한 carbon felt는 실험에 사용하기 전, 잔존할 수 있는 중금속 및 유기물질 제거를 위하여, 50% methyl alcohol에 담가 1시간동안 50℃에서 가열하며 교반 후 증류수로 1시간 동안 90℃에서 가열한 뒤, 이어서 3% hydrochloric acid로 5시간 동안 90℃에서 가열하고, 최종적으로 수돗물을 이용하여 12시간 동안 세척한 뒤, 전극으로써 이용하였다. 세척과정을 거친 carbon felt (가로×세로: 6 cm × 10 cm)는 두께 0.5 mm의 스테인리스 판으로 고정한 뒤, 악어집게를 이용하여 2468 22 AWG 전선과 연결하였으며, 모든 접합부위는 납땜하여 연결하였다[22]. 악어집게의 부식을 방지하기 위해, 에폭시 레진(Devcon Epoxy, ITW Performance Polymers, USA)을 도포하여, 24시간의 건조과정을 거친 뒤 사용하였다. Multimeter (Model 189, Fluke, USA)를 사용하여 전극과 접지선의 저항(5.0 ± 0.2 Ω 이하)을 측정하여 전극과 접지선의 연결을 확인하였다.
외부의 전기적인 영향을 방지하기 위해 실험에 사용한 화분은 전기적으로 절연이 가능한 플라스틱 직육면체 화분(가로×세로×높이: 25 cm×14 cm×12.5 cm)을 사용하였다. 또한, 급수를 통한 토양 내의 중금속 배출을 방지하기 위하여, 물 구멍이 없는 화분을 사용하였다. 각 화분에 사용한 토양의 경우, 흡연장내 화분에서 토양을 채취한 뒤, 18 size mesh로 걸러낸 후, 500 g 정량을 실험에 이용하였다. 접지를 적용한 화분은 Fig. 1B에 표시한 것과 동일하게 접지선과 연결한 전극을 삽입하였다. 토양을 담은 각각의 화분에는 증류수에서 48시간 동안 침지시킨 강낭콩을 각각 3립씩 파종하였다. 전극이 삽입된 화분은 지면으로부터 30 cm 깊이로 매립된 접지판(500 mm×100 mm×5 mm)과 전선을 통하여 전기적으로 연결되었다. 이때 저항은 접지저항계(TK-2040, Taekwang, Korea)로 측정한 결과 100 Ω 미만으로 확인되었다.
제작한 화분에는 370 μmol/m2/s의 빛을 매일 16시간 동안 동일하게 조사하였고, 8시간 동안은 암조건을 유지하였다. 급수는 3일 간격으로 증류수를 300 mL씩 진행하여 carbon felt와 토양이 마르지 않게 유지하였으며, 온도는 25 ± 2℃, 습도는 40 ± 10%로 유지되는 공간에서 실험을 진행하였다.
식물의 전기적 접지 적용 유무에 따른 식물의 생육 차이를 확인하고자, 5일 간격으로 화분의 토양 표면으로부터 식물의 줄기 길이를 버니어 캘리퍼스(Model Helios, Inoxyd, USA)를 사용하여 수직으로 측정하였다[21]. 줄기 길이를 30일간 측정하였으며, 그 이후 토양과 식물을 수거하여 TOC, 중금속 및 미생물 분석 등을 진행하였다.
2.3. 토양의 총 유기물 함량 측정 및 토양과 식물내의 카드뮴 농도 분석토양 시료는 토양오염 공정시험 기준에 의거하여 조제하였다[26]. 강낭콩 재배가 끝난 화분에서 채취한 토양 시료는 18 size mesh로 걸러 이물질을 제거하였다. 식물 시료는 식물 전체를 수거한 뒤, 증류수를 사용하여 식물에 남아있는 토양을 세척하였다. 대조군으로 사용된 토양 시료는 2.1에서 최초 채취하여 보관한 흡연장 토양을 18 size mesh로 걸러 사용하였으며, 대조군으로 사용된 식물 시료는 강낭콩 씨앗으로 설정하였다.
상기의 토양 및 식물 시료는 60℃의 dry oven에서 72시간 동안 건조하였다. 건조한 시료들은 막자 및 막자사발을 이용하여 분쇄한 뒤, 100 size mesh (pore size ⋍ 150 μm)로 걸러 이물질을 제거하였다. TOC 분석과 중금속 농도 분석을 위해 토양 시료는 건조 중량 기준 1회당 10 g을 사용하였으며, 분석은 각각 3회씩 진행하였으며, 화분내 토양 1 kg을 기준으로 카드뮴 농도를 총 함량으로 환산하였다. 토양환경보전법에서 제시한 카드뮴의 토양오염우려기준은 과수원, 목장용지, 학교 용지, 공원 등에 해당하는 제1지역 기준 4 mg/kg이다[27]. 식물 시료는 수거한 식물 전체의 카드뮴 농도를 분석하였으며, 식물의 개별 건조중량 무게를 측정하여, 식물내 카드뮴 농도를 총 함량으로 환산하였다.
토양 시료내 총 유기물 함량은 토양 시료를 서울대학교 농생명 과학공동기기원(NICEM)에서 분석을 진행하였다. WalkleyBlack법을 이용하였으며, 토양 시료에 1 N의 K2Cr2O7용액과 황산을 가하여 반응한 뒤, 이어서 증류수와 ferroin solution을 넣은 후 0.5 N의 FeSO4로 적정하였다[28]. 총 유기물 함량은 아래의 식을 이용하여 계산하였다[28].
토양 시료 및 식물 시료내의 카드뮴 농도 측정은 서울 소재 한양대학교 서울공동기기원(HMCC)에서 진행하였다. Inductively Coupled Plasma-Mass Spectrometry (iCAP RQ, ThermoFisher Scientific, USA)의 기기를 사용하여 건조하여 분쇄한 시료의 카드뮴 농도를 측정하였으며, 결과 분석을 위해 통계 프로그램인 SPSS (Ver.25)를 사용하였다.
2.4 토양내의 미생물 군집 분석토양 시료의 16S rRNA gene의 variable region 염기서열 분석을 통한 시료 중 미생물 군집 종류의 비교를 위해, 16S rRNA amplicon sequencing (metagenomics) 분석을 진행하였다. 2.1에서 최초 채취하여 보관한 흡연장 토양과 재배가 끝난 강낭콩의 근권부 토양을 수거 후, 고압살균한 18 size mesh로 걸러 이물질을 제거하여 시료로 사용하였다[8]. 체 거름을 마친 토양 시료는 30 g씩 채취하여 대한민국 안양 소재의 ㈜세니젠(Korea)에 metagenomics 분석을 의뢰하였다.
미생물의 종 분석은 sequencing, denoising, taxonomy analysis, diversity analysis의 순서로 진행되었다. Sequencing은 Nextseq P1 600 cycle Sequencing kit (2X300)를 이용하였으며, demultiplexing 과정을 거친 뒤 여러 샘플을 pooling하여 한 번에 sequencing 하였다. Pooling된 데이터는 각각의 샘플로 나누는 작업을 통해 quality control을 진행하였다[29]. 이어 denoising 단계에서는 adapter trimming과 quality trimming을 진행하였고, read의 error 수정을 거쳐 chimeric sequence를 제거하였다. 그 이후 taxonomic 분석 단계에서는 classification을 진행한 뒤 mitochondrial과 chloroplast sequence를 제거하였다. 최종적으로 alignment를 진행하여 alpha와 beta의 diversity를 분석하였다. Metagenomics 결과는 SILVA 138 ribosomal rRNA database를 참조하여[30] taxonomic sequence classification을 확인하였으며, top 10 bar plot으로 미생물 분포를 시각화 하였다.
3. 결과 및 고찰3.1. 전기적 접지 적용을 통한 식물의 생육 확인전기적 접지 적용을 통한 식물의 생육 확인을 측정한 결과는 Fig. 2에 표시하였다. Fig. 2의 (A)는 7일간 배양한 일반 화분(접지 연결 없음)과, 전기적 접지가 연결된 화분 (B)의 결과를 나타내고 있으며, (C), (D)는 각각 30일 차의 일반화분과 접지가 연결된 화분의 식물 생육 결과이다.
Fig. 2와 같이 강낭콩 씨앗은 모든 화분에서 발아하였으며, 전기적 접지가 연결된 화분에서 더욱 빠르게 생장하는 것을 확인하였다. 실험 진행 후 30일 차 강낭콩의 최종 줄기 길이는 전기적으로 접지를 적용한 식물(with ground)의 경우, 비접지 식물(without ground)에 비해 48.2 ± 2.3% 더 높게 확인되었다(Fig. 2(E)). 이상의 결과, 실내식물 배양화분에 대한 전기적 접지는 실험에 사용된 식물의 생장을 촉진시키는 것으로 나타났다. 이는 실내에서 배양되는 식물의 환경이 전기적 접지를 통하여 식물의 생육에 더욱 유리하게 변화되는 것을 의미하며, 이와 같은 실내식물에 대한 전기적 접지는 식물에 대한 일종의 전자 비료(electrical fertilizer)와 같은 효과를 나타내는 것으로 볼 수 있다. 과거 연구 결과[21]에 의하면, 식물 화분에 대한 전기적 접지는 식물 생장 호르몬, 근권부 미생물군 등에 영향을 주는 것으로 나타났으며, 이들의 변화가 식물 생장의 촉진을 유도하는 것으로 나타났다. 또한 식물의 생장에 영향을 주는 요인 중 하나인 근권부 미생물의 변화는 식물 활성에 기반하는 exudate의 영향을 받는 것으로 보고된 바 있다[31]. 따라서, 식물 화분의 전기적 접지를 통한 식물의 활성 촉진이 식물 배양토양에 대한 exudate 증가를 유도하는지, 그리고 전기적 접지를 통한 생육활성유도가 토양 내의 카드뮴 흡수 및 rhizosphere의 microbial flora의 변화를 유도하는지 확인하기 위하여, TOC, ICP-MS 및 metagenomics 분석을 각각 진행하였다.
3.2. 토양내의 총 유기물 함량 분석흡연장에서 채취한 최초 토양 시료(대조군)와 강낭콩을 파종한 뒤 30일 차의 비접지 토양 시료(without ground), 전기적 지면 접지 적용 화분의 토양 시료(with ground)를 Walkley-Black 법을 사용하여 TOC 분석을 한 결과, 토양의 총 유기물 함량이 유의미하게 차이가 있음을 확인하였다. 대조군, 비접지, 접지의 토양시료의 TOC 농도는 Fig. 3에 표시하였다.
흡연장의 최초 토양(대조군)의 경우, 토양의 총 유기물 함량이 6.97 ± 0.78%로 측정되었다. 또한, 강낭콩에 전기적 접지를 적용한 화분의 경우, 토양의 총 유기물 함량이 10.05 ± 0.44%로 측정되었으며, 강낭콩만 식재한 비접지 화분의 경우, 토양의 총 유기물 함량이 7.75 ± 0.54% 로 측정되었다. 따라서, 접지를 적용한 토양의 총 유기물 함량이 대조군과 비접지에 비해 각각 3.08 ± 1.22%, 2.3 ± 0.1% 높은 것으로 나타났다.
3.3. 식물과 토양 시료의 카드뮴 농도 분석강낭콩의 토양 속 카드뮴 제거를 확인하기 위해, 실험이 완료된 후 식물과 토양 시료의 카드뮴 농도를 분석하였다. 식물 시료와 토양 시료의 카드뮴 농도를 Fig. 4에 표시하였다. 식물은 뿌리, 줄기, 잎 전체에서 카드뮴 농도를 측정하였다. 대조군은 강낭콩 씨앗을 사용하였다. 토양은 건조 및 분쇄 과정을 진행한 후, 토양 시료의 카드뮴 농도를 측정하였다. 대조군은 최초 채취한 흡연장 화분 속 토양을 사용하였다.
식물내의 평균 카드뮴 농도는 대조군 0.11 ± 0.025 μg/kg, 비접지 0.22 ± 0.03 μg/kg, 접지 0.33 ± 0.018 μg/kg으로 접지를 적용한 식물의 카드뮴 농도가 대조군과 비접지에 비해 각각 216.3 ± 90.6%, 52.5 ± 12.7% 높은 결과값을 나타내었다. 토양내의 평균 카드뮴 농도는 최초 100 ± 0.02 μg/kg에서 비접지 90 ± 0.01 μg/kg, 접지 90 ± 0.01 μg/kg로 각각 감소하였다. 최초 토양에 비해 식물을 식재한 경우 토양내의 카드뮴 농도가 감소하였다. 또한, 식물내의 카드뮴 농도가 가장 높은 접지의 경우, 토양내의 카드뮴 농도가 가장 낮게 측정된 것으로 확인하였다. 이는 접지로 인한 식물의 활성도 증가가, 토양 카드뮴의 식물내로의 흡수증가로 이어져, 토양 시료의 카드뮴 농도가 상대적으로 감소한 것으로 추측할 수 있다. 다만 분쇄, 여과 등, 시료 제조과정에서 발생하는 오차 및 적은 시료수로 인하여, 접지 유무에 따른 카드뮴의 토양에서 식물로의 전달에 관련된 구체적인 정량적 분석은 진행하지 못하였다.
일반적으로 카드뮴은 토양내에서 이온상태로 존재하여, 다양한 형태로 식물에 의해 흡수되는 것으로 알려져 있다[5]. 이러한 과정은 식물내의 조절 단백질과 식물의 대사에 의해 영향을 받기 때문에, 식물의 활성화가 중요한 역할을 한다고 볼 수 있다. 또한 각종 중금속은 식물의 근권부 미생물의 대사과정을 통해 식물에 흡수가 용이한 형태로 변환이 가능한 것으로 알려져 있다[34]. 따라서 본 연구결과, 전기적 접지를 통한 식물의 생육활성화 및 exudate의 증가는 중금속의 흡수와 관련된 식물의 활성에 긍정적인 영향을 주는 것으로 판단된다. 이러한 결과를 바탕으로, 전기적 접지의 식물 근권부 미생물에 대한 영향을 확인하기 위하여, 근권부 토양 시료에 대한 metagenomics 분석을 진행하였다.
3.4. 대조군, 비접지, 접지 토양내 미생물의 metagenomics 분석식물의 근권부 미생물의 분석을 통한 식물 생장 촉진 및 중금속 흡수 효과를 확인하기 위하여, 강낭콩 식재 30일 이후 접지, 비접지 화분의 토양과 최초 채취한 토양(대조군)의 미생물 군집 분석을 진행하였다[35]. 대조군 A, 비접지 B, 접지 C의 근권부 미생물의 metagenomics 분석을 진행하였으며, Fig. 5는 metagenomics 분석 결과, 상위 10개의 속(genus) 단계를 bar plot으로 나타낸 결과이다.
대조군 토양 A의 결과 Nocardioides sp., Rhodanobacter sp., Arachidicoccus sp. 순으로 우세하였으며, 비접지 토양 B의 결과 Rhodanobacter sp., Sphingomonas sp., WD2101 soil group sp. 순으로 나타났으며, 전기적 지면 접지 토양 C의 결과 Rhodanobacter sp., Sphingomonas sp., Nocardioides sp.순으로 우세하였다. 각 실험군에서 모두 공통적으로 우세하게 발견된 속(genus)은 Rhodanobacter sp.으로 일반적인 근권부 토양 환경에서 흔히 발견되는 식물 생장 촉진 미생물으로 알려져 있다[36~38]. 또한 공통적으로 발견된 속은 Sphingomonas sp.로 접지 토양 C에서 5.43%, 비접지 토양 B에서 3.37%, 대조군 토양 A에서 1.82% 발견되었다. Sphingomonas sp.는 중금속 농도가 높은 곳에서도 생존가능한 식물 생장 촉진 미생물로 카드뮴, 구리, 납 등의 bioremediation이 가능한 것으로 확인된 바 있다[39~42].
대조군 토양 A와 접지 토양 C에서만 발견된 Nocardioides sp.는 근권부 토양에서 주로 발견되는 식물 생장 촉진 미생물로 2,4-dinitrophenol, propoxur, atrazine, melamine, vomitoxin (DON)등 토양내의 각종 오염 물질과 생분해성 플라스틱을 분해할 수 있는 미생물로 알려져 있다[39,43~49]. Nocardioides sp.는 토양내의 카드뮴 이온을 황화 카드뮴으로 변환하여 토양의 카드뮴의 독성을 감소하는 것으로 보고된 바 있다[50]. 이와 동일하게, 대조군 토양 A와 접지 토양 C에서만 Streptomyces sp.가 발견되었다. 이는 식물의 생장에 도움을 주며 철 및 금속 이온들과 결합하여 토양 오염을 정화해주는 결합체인 siderophore을 생산하는 미생물로 알려져 있다[51~54]. 토양 중금속 제거가 가능한 미생물은 토양내의 중금속을 각종 작용기에 결합시키는 과정을 통해 독성이 낮은 형태로 전환하고 이를 흡수, 흡착, 응집 등 다양한 형태로 변환시키는 것으로 알려져 있다[50]. 이와 같이 미생물 기반 bioremediation으로 통칭되는 각종 변환 과정은 각종 유해 중금속을 식물의 흡수 또한 용이한 상태로 변환시킨다는 연구가 보고된 바 있다[5].
전기적 접지를 적용한 식물의 토양에서 우세하게 확인된 미생물 속은 Sphingomonas sp., Nocardioides sp., Streptomyces sp.와 같이 중금속 제거가 가능한 미생물과 식물 생장 촉진이 가능한 Rhodanobacter sp.으로 확인되었다[36~54]. 이러한 결과를 통하여, 전기적으로 절연된 일반적인 실내 식물 재배용 화분에 대한 전기적 접지 적용이 식물의 활성화유도, exudate의 분비, 그리고 근권부 미생물 분포 변화를 유도하는 것으로 보인다. 이와 같은 과정을 통하여 토양 내부의 카드뮴이 실내 식물내로 흡수가 촉진된 것으로 판단된다. 따라서 이와 같은 실내 식물 화분에 대한 전기적 접지 연결은, 식물에 대한 전자 비료(electrical fertilizer) 역할을 수행한 것으로 판단된다. 또한 카드뮴 등의 중금속을 토양에서 흡수한 식물은 목재 등과 같이 가공하여 사용하는 phytomining 기술을 통해 재활용이 가능한 것으로 알려져 있다[55,56].
이상의 결과를 통하여, 실내 식물 이외에도 지면과 절연되어 있으며 흡연으로 발생할 수 있는 담뱃재, 담배꽁초와 같은 오염물질에 노출되기 쉬운 흡연장 근처 화단의 식물에 전기적 접지 적용을 통하여 토양내의 중금속 독성감소를 유도할 수 있을 것으로 판단된다. 본 연구는 한정된 식물 수종으로 실험을 진행하였다는데 그 한계가 있다. 또한 중금속 및 식물의 종에 따른 반응 및 흡수 능력에는 차이가 있을 것으로 보인다. 따라서 다양한 식물 수종에 대한 접지 적용 및 생장 촉진 효과 파악, 그리고 이와 관련된 각종 오염물질 처리에 대한 추가적인 연구가 현재 진행중이다.
4. 결 론본 연구를 통하여 전기적 지면 접지 연결을 통한 전기화학적 비료의 효과로, 식물의 생육 활성화를 통한 토양내 중금속 흡수 효율 향상을 확인하였다. 전기적으로 지면과 절연된 실내 식물에 전기적 지면 접지를 적용한 결과, 식물의 생장이 촉진됨을 확인하였다. 또한, 전기적 지면 접지를 적용한 식물의 토양에서는 총 유기물 함량이 증가하였다. 이는 식물의 대사 활성화에 기인한 exudate의 방출량 변화에 그 원인이 있을 것으로 보인다. 이 결과는 근권부 미생물의 생육환경 변화를 유도한 것으로 보이며, 관련 시료의 metagenomics 분석 결과를 통하여 관련 미생물종의 변화를 확인할 수 있었다[32~34]. 본 연구의 결과, 흡연구역의 담배로 인해 발생한 오염물질인 카드뮴에 노출된 화분 속 토양의 지면과의 전기적 접지 연결을 통해, 식물의 생육 활성을 증가시키면서 동시에 식물에 의한 토양내 카드뮴의 흡수를 유도하는 것을 확인하였다.
Acknowledgments본 연구는 산림청의 산림기반 사회문제해결 실증기술개발 (R&D) 사업(과제번호: 2022431B10-2224-0802)과, 농촌진흥청의 농업정책지원기술개발사업(과제번호: PJ016185022022)의 지원에 의하여 수행되었습니다. 이에 감사드립니다.
NotesDeclaration of Competing Interest The authors declare that they have no known competing interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 1.The schematic illustrations of the smoking area and plant pots for the experiments: (A) the smoking area, (B) experimental plant pots without and with the electrical ground. 
Fig. 2.Effect of the electrical ground for the growth of plants (Phaseolus vulgaris): (A) 7 days growth without ground, (B) 7 days growth with ground, (C) 30 days growth without ground, (D) 30 days growth with ground, (E) Comparison of the stem length during the experimental period. Different letters represent significant difference among the treatments (p < 0.05). 
Fig. 3.Comparison of the total organic carbon concentration (TOC) in the soil samples used in this study. The control samples were collected at the initial stage of the experiment. Other samples (with and without the ground) were collected and analyzed after the 30 days of the experiment. Different letters represent significant difference among the treatments (p<0.05). 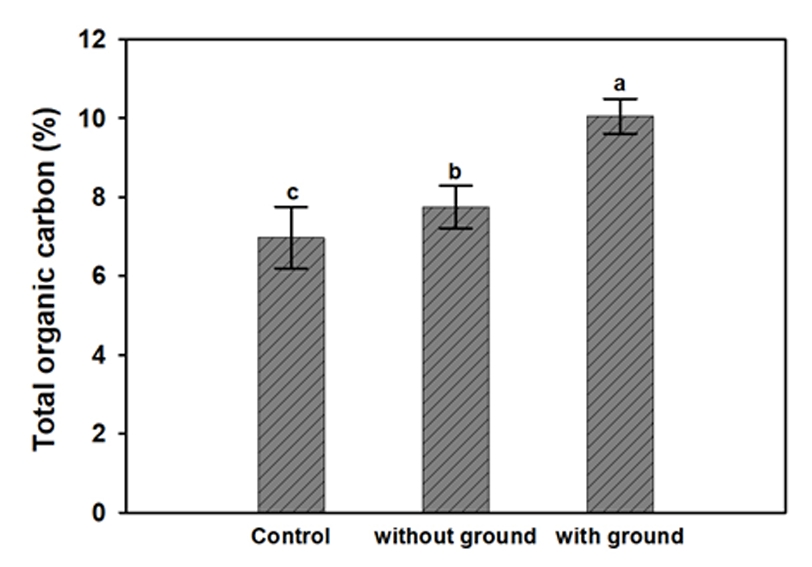
Fig. 4.Cadmium concentrations in the samples obtained from the cultivation soil and plants used in this study. The control samples were collected at the initial stage of the experiment. Other samples (with and without the ground) were collected and analyzed after the 30 days of the experiment. Different letters represent significant difference among the treatments (p < 0.05). 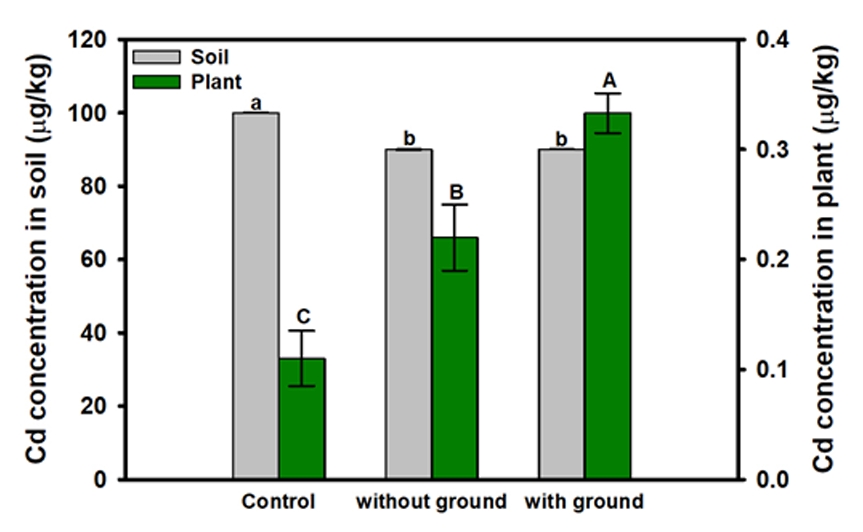
References1. J. O. Nriagu, Global inventory of natural and anthropogenic emissions of trace metals to the atmosphere, Nature., 279(5712), 409-411(1979).
2. H. M. Salem, E. A. Eweida, A. Farag, Heavy metals in drinking water and their environmental impact on human health, Int Conference on the Environ Hazards Mitigation, Cairo Univ Egypt, pp. 543-556(2000).
3. H. T. Chon, J. S. Lee, J. U. Lee, its risk assessment and bioremediation, Geosystem Engineering., 14(4), 191-206(2011).
4. D. E. Salt, M. Blaylock, N. Kumar, V. Dushenkov, B.D. Ensley, I. Chet, I. Raskin, Phytoremediation: a novel strategy for the removal of toxic metals from the environment using plants, Bio/technology., 13(5), 468-474(1995).
6. H. R. Kim, J. W. Youn, Y. Y. Kim, Effects of smoking on concentration of heavy metals in blood and clinical characteristics, Public Health Wkly. Rep., 10(29), 748-753(2017).
7. World Health Organization, Air quality guidelines: global update 2005: particulate matter, ozone, nitrogen dioxide, and sulfur dioxide World Health Organization(2006).
8. J. W. Jo, H. S. Song, S. H. Kim, E. T. Kim, H. D. Kim, J. Y. Lee, S. W. Yang, M. S. Kim, B. G. Kim, H. U. Kim, J. H. Jeong, J. H. Kim, E. B. Lee, H. J. Kim, Investigation of environmental effect of plants in smoking area through analysis of cadmium and microorganisms, KSEE., 44(12), 578-588(2022).
9. S. W. Moon, J. I. Gwak, Y. H. Park, The effect of smoking and second-hand smoking on the concentration of mercury, lead and cadmium in the blood: based on the fifth korea national health and nutrition examination survey, Korean J Fam Pract., 6(1), 44-48(2016).
10. A. Keiko, Itai-itai disease: renal tubular osteomalacia induced by environmental exposure to cadmium—historical review and perspectives, Soil Science and Plant Nutrition., 62(4), 319-326(2016).
11. L. Friberg, C. G. Elinder, T. Kjellstrom, G. F. Nordberg, Cadmium and Health: A toxicological and epidemiological appraisal, General Aspects, Effects and Response, 1, (1986).
12. J. P. Buchet, R. Lauwerys, H. Roels, A. Bernard, P. Bruaux, F. Claeys, G. Ducoffre, P. Deplaen, J. Staessen, A. Amery, P. Lijnen, L. Thijs, D. Rondia, F. Sartor, A. Saintremy, L. Nick, Renal effects of cadmium body burden of the general population, The Lancet., 336(8717), 699-702(1990).
13. S. W. Cai, Cadmium exposure and health effects among residents in irrigation area with ore dressing wastewater, Zhonghua yu Fang yi xue za zhi, [Chinese Journal of Preventive Medicine]., 23(3), 143-146(1989).
14. H. G. Kim, S. B. Lee, Effects of organic matter on cadmium adsorption in soil, J KSEE., 20(1), 1-8(1998).
15. W. X. Chen, Q. Li, Z. Wang, Z. Sun, Spatial distribution characteristics and pollution evaluation of heavy metals in arable land soil of china, Huan Jing ke Xue= Huanjing Kexue., 41(6), 2822-2833(2020).
16. M. Nie, N. Xian, X. Fu, X. Chen, B. Li, The interactive effects of petroleum-hydrocarbon spillage and plant rhizosphere on concentrations and distribution of heavy metals in sediments in the yellow river delta, China, Journal of Hazardous Materials., 174(1-3), 156-161(2010).
17. F. Wang, X. Lin, R. Yin, Heavy metal uptake by arbuscular mycorrhizas of Elsholtzia splendens and the potential for phytoremediation of contaminated soil, Plant and Soil., 269, 225-232(2005).
18. D. J. Glass, Current market trends in phytoremediation, international Journal of Phytoremediation., 1(1), 1-8(1999).
19. Gwacheon-si Home Page, https://www.gccity.go.kr/portal/bbs/view.do?bIdx=172627&ptIdx=200&mId=0301070000 (2023)
20. Seoul Metropolitan Government Home Page, https://mediahub.seoul.go.kr/archives/2007034?tr_code=snews (2023)
21. M. J. Chang, C. J. Kim, Y. K. Choi, H. J. Song, S. Y. Shim, S. H. Lee, Y. H. Yang, K. J. Kim, H. J. Kim, Effect of electrical ground connection on plant growth, Bulletin of the Korean Chemical Society., 38(12), 1491-1494(2017).
22. H. J. Song, S. W. Yang, J. W. Jo, Y. K. Choi, I. S. Lee, B. U. Lee, S. H. Lee, H. H. Kim, K. J. Kim, H. J. Kim, Submerged leaves of live indoor foliage plants adsorb H1N1 influenza virus from suspension, Plant Signaling & Behavior., 18(1), 2163869(2023).
23. H. J. Kim, H. J. Song, Y. H. Yang, C. J. Kim, W. S. Lee, T. H. Yoon, S. Y. Shim, M. J. Chang, S. H. Lee, W. Y. Jeong, Apparatus for enhancing fine particle adsorption power of plants through electrical grounding (KR. Patent NO. 1020746110000), KOREAN INTELLECTUAL PROPERTY OFFICE., doi:10.8080/1020190055856. (2020).
24. J. Wang, J. She, Y. Zhou, D. C. W. Tsang, J. Beiyuan, T. Xiao, X. Dong, Y. Chen, J. Liu, M. Yin, L. Wang, Microbial insights into the biogeochemical features of thallium occurrence: a case study from polluted river sediments, Science of the Total Environment., 739, 139957(2020).
25. F. V. Assche, C. Cardinaels, H. Clijsters, treated with zinc and cadmium, Environmental pollution., 52(2), 103-115(1988).
26. Korean Law Information Center Home Page, https://www.law.go.kr/LSW/admRulInfoP.do?admRulSeq=2100000093708, (2017)
27. Korean Law Information Center Home Page, https://www.law.go.kr/LSW/eng/engLsSc.do?menuId=2§ion=lawNm&query=SOIL+ENVIRONMENT+CONSERVATION+ACT&x=30&y=21#liBgcolor1, (2023)
28. B. D. Vos, S. Lettens, B. Muys, J. A. Deckers, limitations and uncertainty, Soil Use and Management., 23(3), 221-229(2007).
29. R. K. Patel, M. Jain, NGS QC Toolkit: a toolkit for quality control of next generation sequencing data, PloS one., 7(2), e30619(2012).
30. C. Quast, E. Pruesse, P. Yilmaz, J. Gerken, T. Schweer, P. Yarza, J. Peplies, F. O. Glöckner, The SILVA ribosom al RNA gene database project: improved data processing and web-based tools, Nucleic acids research., 41(D1), D590-D596(2012).
31. S. Timmusk, N. Grantcharova, E. G. H. Wagner, Paenibacillus polymyxa invades plant roots and forms biofilms, Applied and environmental microbiology., 71(11), 7292-7300(2005).
32. P. Dundek, L. Holík, T. Rohlík, L. Hromádko, V. Vranová, K. Rejšek, P. Formánek, Methods of plant root exudates analysis: a review, Acta universitatis agriculturae et silviculturae mendelianae brunensis., 59(3), 241-6(2011).
33. X. Zhao, P. Tian, Z. Sun, S. Liu, Q. Wang, Z. Zeng, Rhizosphere effects on soil organic carbon processes in terrestrial ecosystems: A meta-analysis, Geoderma., 412, 115739(2022).
34. K. K. Lee, S. P. Wani, K. L. Sahrawat, N. Trimurtulu, O. Ito, Nitrogen and/or phosphorus fertilization effects on organic carbon and mineral contents in the rhizosphere of field grown sorghum, Soil Science and Plant Nutrition., 43(1), 117-126(1997).
35. M. A. Halim, M. M. Rahman, M. Megharaj, R. Naidu, Cadmium immobilization in the rhizosphere and plant cellular detoxification: role of plant-growth-promoting rhizobacteria as a sustainable solution, Journal of Agricultural and Food Chemistry., 68(47), 13497-13529(2020).
36. S. J. Green, O. Prakash, P. Jasrotia, W. A. Overholt, E. Cardenas, D. Hubbard, J. M. Tiedje, D. B. Watson, C. W. Schadt, S. C. Brooks, J. E. Kostka, Denitrifying bacteria from the genus Rhodanobacter dominate bacterial communities in the highly contaminated subsurface of a nuclear legacy waste site, Applied and environmental microbiology., 78(4), 1039-1047(2012).
37. S. J. Green, O. Prakash, T. M. Gihring, D. M. Akob, P. Jasrotia, P. M. Jardine, D. B. Watson, S. D. Brown, A. V. Palumbo, J. E. Kostka, Denitrifying bacteria isolated from terrestrial subsurface sediments exposed to mixed-waste contamination, Applied and Environmental Microbiology., 76(10), 3244-3254(2010).
38. S. A. Lee, B. K. Kanth, H. S. Kim, T. W. Kim, M. K. Sang, J. Song, H. Y. Weon, Complete genome sequence of the plant growth-promoting endophytic bacterium Rhodanobacter glycinis T01E-68 isolated from tom ato (Solanum lycopersicum L.) plant roots, The Microbiological Society of Korea., 55(4), 422-424(2019).
39. W. Zhang, X. Jia, S. Chen, J. Wang, R. Ji, L. Zhao, Response of soil microbial communities to engineered nanomaterials in presence of maize (Zea mays L.) plants, Environmental Pollution., 267, 115608(2020).
40. H. Guo, M. Nasir, J. Lv, Y. Dai, J. Gao, Understanding the variation of microbial community in heavy metals contaminated soil using high throughput sequencing, Ecotoxicology and environmental safety., 144, 300-306(2017).
41. J. Tangaromsuk, P. Pokethitiyook, M. Kruatrachue, E. S. Upatham, Cadmium biosorption by Sphingomonas paucimobilis biomass, Bioresource Technology., 85(1), 103-105(2002).
42. J. Lombardino, S. Bijlani, N. K. Singh, J. M. Wood, R. Barker, S. Gilroy, C. C. C. Wang, K. Venkateswaran, Genomic characterization of potential plant growth-promoting features of Sphingomonas strains isolated from the international space station, Microbiology Spectrum., 10(1), e01994-21(2022).
43. S. Karthikeyan, J. C. Spain, Biodegradation of 2, 4-dinitroanisole (DNAN) by Nocardioides sp. JS1661 in water, soil and bioreactors, Journal of Hazardous Materials., 312, 37-44(2016).
44. H. Kim, D. U. Kim, H. Lee, J. Yun, J. O. Ka, Syntrophic biodegradation of propoxur by Pseudaminobacter sp. SP1a and Nocardioides sp. SP1b isolated from agricultural soil, International Biodeterioration & Biodegradation., 118, 1-9(2017).
45. S. Koji, Mineralization of s-triazine herbicides by a newly isolated Nocardioides species strain DN36, Applied microbiology and biotechnology., 86(5), 1585-1592(2010).
46. K. Takagi, K. Fujii, K. I. Yamazaki, N. Harada, A. Iwasaki, Biodegradation of melamine and its hydroxy derivatives by a bacterial consortium containing a novel Nocardioides species, Applied microbiology and biotechnology., 94, 1647-1656(2012).
47. Y. Ikunaga, I. Sato, S. Grond, N. Numaziri, S. Yoshida, H. Yamaya, S. Hiradate, M. Hasegawa, H. Toshima, M. Koitabashi, M. Ito, P. Karlovsky, S. Tsushima, Nocardioides sp. strain WSN05-2, isolated from a wheat field, degrades deoxynivalenol, producing the novel intermediate 3-epi-deoxynivalenol, Applied microbiology and biotechnology., 89, 419-427(2011).
48. A. N. Mistry, B. Kachenchart, A. Wongthanaroj, A. Somwangthanaroj, E. Luepromchai, Rapid biodegradation of high molecular weight semi-crystalline polylactic acid at ambient temperature via enzymatic and alkaline hydrolysis by a defined bacterial consortium, Polymer Degradation and Stability., 202, 110051(2022).
49. Y. Ma, J. Wang, Y. Liu, X. Wang, B. Zhang, W. Zhang, T. Chen, G. Liu, L. Xue, X. Cui, Nocardioides "Specialists" for hard-to-degrade pollutants in the environment, Molecules., 28(21), 7433(2023).
50. M. A. Halim, M. M. Rahman, M. Megharaj, R. Naidu, Cadmium immobilization in the rhizosphere and plant cellular detoxification: role of plant-growth-promoting rhizobacteria as a sustainable solution, Journal of Agricultural and Food Chemistry., 68(47), 13497-13529(2020).
51. C. O. Dimkpa, A. Svatoš, P. Dabrowska, A. Schmidt, W. Boland, E. Kothe, Involvement of siderophores in the reduction of metal-induced inhibition of auxin synthesis in Streptomyces spp, Chemosphere., 74(1), 19-25(2008).
52. P. Delepelaire, Bacterial ABC transporters of iron containing compounds, Research in microbiology., 170(8), 345-357(2019).
53. M. Rajkumar, N. Ae, M. N. V. Prasad, H. Freitas, Potential of siderophore-producing bacteria for improving heavy metal phytoextraction, Trends in biotechnology., 28(3), 142-149(2010).
54. H. Geng, F. Wang, C. Yan, S. Ma, Y. Zhang, Q. Qin, Z. Tian, R. Liu, H. Chen, B. Zhou, R. Yuan, Rhizosphere microbial community composition and survival strategies in oligotrophic and metal (loid) contaminated iron tailings areas, Journal of Hazardous Materials., 436, 129045(2022).
55. M. J. Blaylock, Phytoextraction of metals, Phytoremediation of toxic metals: using plants to clean up the environment pp. 53-70(2000).
56. R. L. Chaney, Y. M. Li, S. L. Brown, F. A. Homer, M. Malik, J. S. Angle, A. J. M. Baker, R. D. Reeves, M. Chin, Improving metal hyperaccumulator wild plants to develop commercial phytoextraction systems: approaches and progress, In Phytoremediation of contaminated soil and water., CRC press, 129-158(2020).
|
|
||||||||||||||||||||||||||||||||||||||||