|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesRecently, microplastics (MPs) is observed at surface water in worldwide because of massive use of plastics. Since MPs have a large specific surface area, they could provide adsorption sites to water contaminants such as Levofloxacin (LVF). LVF is one of widely used antibiotics and is detected in surface water. Therefore, the aim of this study is to evaluate adsorption trend of LVF on polypropylene (PP) and polyethylene(PE) microplastics in aqueous solution.
MethodsFor kinetic adsorption experiment, 0.02 g of PP and PE MPs were placed in glass vials and mixed with LVF solution (10 mg/L) for 1-48 hours. And the experimental data was fitted to pseudo-first order and pseudo-second order. For isotherm adsorption experiment, initial LVF concentrations were varied from 1 to 25 mg/L for 24 hours and the results were applied to Langmuir and Freundlich models. The Thermodynamic adsorption experiment was conducted in the temperature range of 298-318 K. Each cations (Na+, Ca2+, Cu2+, Cr3+, Pb3+) and LVF solution were both reacted with the MPs to determine effect of LVF adsorption when cations were coexistence.
Results and DiscussionBased on the FT-IR analysis, it was confirmed that the prepared PP and PE MPs were consisted of the respective single polymer. The kinetic experiment results showed that LVF adsorption on PP and PE MPs reached equilibrium at 24 hours with adsorption capacities of PP (0.748 mg/g) and PE (0.801 mg/g) MPs, respectively. Kinetic data of PP MPs was well fitted to the pseudo-first order (R2=0.986) model, while the data of PE MPs was described well by the pseudo-second order (R2=0.992) model. The results of the isotherm experiments were explained well by the Freundlich model (R2>0.97), indicating that multilayer adsorption occurred in both MPs. The thermodynamic experiments showed that LVF adsorptions on each MPs were exothermic reaction and physical adsorption process. Cations can inhibit the adsorption of LVF to the MPs.
요약목적최근 미세플라스틱이 지표수에서 꾸준히 관찰되고 있다. 미세플라스틱은 비표면적이 크고, 소수성이 크기때문에 수중 오염물질과 상호작용할 수 있다. 따라서 수중에서 발견되는 항생물질인 레보플록사신(LVF)을 이용하여 미세플라스틱과의 흡착 특성을 살펴보았다. 본 연구에서는 폐플라스틱 폐기물을 분쇄하여 폴리프로필렌(PP)와 폴리에틸렌(PE) 미세플라스틱을 제조하여 LVF 흡착 특성을 평가하였다.
방법모든 실험에서 미세플라스틱의 투입량은 0.02 g으로 고정하였다. 동역학적 흡착실험을 위해 PP와 PE 미세플라스틱을 유리 바이알에 넣고 1-48시간 동안 LVF 용액(초기농도: 10 mg/L) 20 mL와 혼합했다. 그리고 실험데이터는 유사-1차 모델과 유사-2차 모델에 피팅하였다. 등온흡착 실험은 초기 LVF 농도를 1-25 mg/L로 다양하게 설정하여 24시간동안 반응시킨 결과를 Langmuir와 Freundlich 등온흡착 모델에 적용하였다. 열역학적 흡착실험은 298-318 K의 온도범위에서 흡착 실험을 진행하였으며, 양이온이 존재할 때 LVF의 흡착 영향을 알아보기 위해 각각의 양이온(Na+, Ca2+, Cu2+, Cr3+, Pb3+)과 LVF 용액을 혼합하여 미세플라스틱과 반응시켰다.
결과 및 토의: FT-IR 분석 결과, 제조된 PP와 PE 미세플라스틱은 단일 폴리머 재질임을 확인하였다. 동역학적 흡착 실험에서는 PP와 PE에 대한 LVF 흡착이 24시간에 평형에 도달하였다. 이때 PP와 PE의 흡착능은 각각 0.748 mg/g과 0.801 mg/g으로 계산되었다. 그리고 PP는 유사-1차모델에(R2=0.986), PE는 유사-2차모델에(R2=0.992) 각각 잘 피팅되었다. 등온흡착 실험결과는 PP와 PE에서 모두 Freundlich 식에 적절히 모사되어(R2>0.97) 다층 흡착이 일어나는 것으로 판단된다. 열역학적 흡착실험을 통해 흡착은 발열반응이며, 주로 물리학적 흡착 과정인 것으로 보였고, 양이온 경쟁실험 결과로 양이온이 미세플라스틱에 대해 LVF의 흡착을 저해할 수 있다는 것을 확인하였다.
1. 서 론플라스틱은 대량 생산이 수월하고 사용하기에 편리하여 소비가 꾸준히 증가하는 추세이다. 하지만 과도한 사용으로 인하여 매해 버려지는 플라스틱의 양이 많아져 다양한 환경문제를 일으키고 있다. 플라스틱은 풍화(weathering), 광산화반응(photooxidation), 가수분해(hydrolysis) 등의 과정을 통해 미세플라스틱으로 작게 분해될 수 있다[1]. 미세플라스틱의 일반적인 정의는 5 mm 미만의 플라스틱으로, 특수한 사용 목적에 의해 제작된 1차 미세플라스틱과 물리 화학적인 요인으로 파쇄 및 분해된 2차 미세플라스틱으로 구분할 수 있다. 최근에는 많은 양의 미세플라스틱이 하수처리장에서 처리되지 않고 유출되어 지표수와 바다에서 널리 발견되고 있다[2,3]. 최근 국내의 연구에서 해수와 담수에서 발견되는 대표적인 미세플라스틱은 폴리프로필렌(Polypropylene, PP)과 폴리에틸렌(Polyethylene, PE)계열이었으며, Cho 등[4]에 따르면 해수에서 발견되는 미세플라스틱 중 PP와 PE가 차지하는 비율이 약 46%이었고, Choi 등[5]의 연구결과에서는 하천수로부터 검출된 미세플라스틱 중 PP와 PE 재질을 합한 비율이 약 73% 이상이었다. 미세플라스틱의 대표적인 특징인 강한 소수성과 큰 비표면적 때문에 유기오염물질 및 중금속 등 다양한 환경에 있는 화학물질을 흡착할 수 있으며[6], 오염물질이 흡착된 미세플라스틱을 생물들이 섭취한다면 다양한 독성을 나타낼 수 있다고 알려져 있다[7].
최근에 의약물질과 개인위생물질(pharmaceutical and personal care products; PPCPs)의 사용이 증가하면서 지하수, 지표수, 하수 및 정수에서조차 ng/L - μg/L 농도의 PPCPs가 빈번하게 검출되고 있다는 보고가 있다[8]. 특히, 항생제는 사람이나 가축에게 투여된 후에 체내에서 완전히 대사되지 않고 그 일부가 체외로 배출되어[9] 하수처리장과 방류수뿐만 아니라 하천수, 음용수에서 검출된다[10]. 항생제는 미생물의 성장을 저해하고 유전독성을 일으킬 수 있어 수생태에 유출되면 환경오염을 유발하고 생태 균형을 깨뜨릴 수 있다. 그리고 항생제 잔류물은 항생제 내성세균 및 항생제 내성 유전자를 생성하고 내분비계 교란을 유발할 수 있기에 인간의 건강에도 심각한 위협이 되어 사회적으로 관심이 높아지는 추세다[11]. 레보플록사신(Levofloxacin, LVF)은 폐렴, 세균성 질병 치료 등에 사용하는 대표적인 퀴놀론계 항생물질이다[12]. LVF는 전세계적으로 막대한 양이 사용되는 만큼 다양한 수 환경에서 약 0.5 부터 200 μg/L까지 빈번히 관찰되는 항생물질이다[13,14]. 그러므로, 수 환경에서 미세플라스틱과 LVF이 상호작용하여 미세플라스틱에 LVF가 흡착된다면 LVF가 환경에 잔류할 가능성이 높아지고, 미세플라스틱이 운반체 역할을 하여 LVF와 함께 더 멀리 이동될 수 있다[15]. 또한, LVF가 흡착된 미세플라스틱이 수생생물 체내에 섭취될 경우에는 먹이사슬을 통해 생태계에 악영향을 미칠 수 있다[16]. 이처럼 사람과 수생 환경에 위험성을 가지고 있으나 아직까지 미세플라스틱과 항생물질 LVF의 흡착 관련 연구는 매우 미비한 실정이다.
따라서 본 연구를 통해 일상 생활에서 흔히 사용하는 PE와 PP 미세플라스틱에 대한 수중에서의 LVF의 흡착 특성을 살펴보려고 한다. 대상 미세플라스틱은 식품을 운반한 후에 버려지는 플라스틱 폐기물을 파쇄하여 실험재료로 사용하였으며, LVF의 흡착에 대한 시간, 초기 LVF의 농도, 온도, 경쟁 양이온의 영향을 종합적으로 평가하였다.
2. 실험방법(또는 재료 및 방법)2.1. 미세플라스틱 준비미세플라스틱은 서울환경연합의 플라스틱 방앗간에서 파쇄된 PP와 PE를 제공받아 사용하였다. 제공받은 플라스틱은 추가적으로 분쇄하고 체가름(메쉬크기: 1 mm)한 후 에탄올에 세척하여 불순물을 제거한 뒤 여과지(공극 크기: 0.5 μm)를 사용하여 감압여과하고 65℃에서 건조하여 실험에 사용될 PP와 PE 미세플라스틱의 크기 범위를 0.5 μm-1 mm으로 조정하였다. 건조를 마친 미세플라스틱은 실험 전까지 데시케이터에 보관하였다. 특성 분석을 위해 전계방사형 주사전자현미경(FE-SEM; S-4800, Hitachi, Japan), Fourier transform infrared spectroscopy(Vertex 80V FT-IR Spectrometer, Bruker, USA), 제타전위분석기(Zetasizer Nano ZSP, Malvern Panalytical, UK)를 이용하였다.
2.2. 미세플라스틱에 대한 LVF 흡착실험준비된 PP와 PE 미세플라스틱을 각각 0.02 g씩 유리 바이알에 투입한 후에 LVF(28266-10G-F, Sigma Aldrich, USA) 용액(초 기농도 10 mg/L) 20 mL을 담고 유리뚜껑으로 닫아 밀봉하였다. 동역학적 흡착실험은 쉐이킹 인큐베이터(DH.WIS00210, 대한 과학, 대한민국)에서 180 rpm, 298 K의 조건에서 반응시켰다. 정해진 반응시간(1, 2, 4, 8, 24, 48h)에 시린지여과하여 고액분리 후 분리된 LVF 용액을 분광광도계(DR6000, HACH, USA)를 이용하여 289 nm에서 흡광도를 측정하여 농도를 측정하였다. 시간 t에서 g당 흡착량을 나타내는 qt는
식 (1)을 이용하여 계산하였다. 여기서 C0 (mg/L)는 흡착 전 LVF의 초기농도, Ct (mg/L)는 흡착 t 시간일 때의 LVF의 농도이다. V (L)와 M (g)은 각각 첨가된 LVF 용액의 부피와 미세플라스틱의 질량이다.
등온흡착실험은 LVF 용액의 초기농도를 1, 2, 5, 10, 15, 25 mg/L으로 다양하게 설정하여 쉐이킹 인큐베이터에 298 K, 180 rpm 조건에서 24시간 동안 반응시킨 후 동역학적 흡착실험과 동일한 방법으로 LVF의 농도를 구하였다. 열역학적 흡착실험은 LVF 용액의 초기농도를 10 mg/L로 고정하고 0.02 g의 PP, PE 미세플라스틱과 반응시켰다. 이때의 반응온도는 293 K, 298 K, 303 K, 318 K로 쉐이킹 인큐베이터내에서 유지되었다. 양이온의 미세플라스틱에 대한 LVF의 경쟁 흡착 영향을 알아보기 위하여 다양한 종류의 양이온을 첨가하여 흡착실험을 진행하였다. LVF 10 mg/L에 각각 0.1 mM NaNO3, Ca(NO3)2 ∙4H2O, Pb(NO3)2, Cu(NO3)2 ∙3H2O, Cr(NO3)3 ∙9H2O이 되도록 실험용액을 각각 제조하였다. 그리고 실험에서 반응 전후의 수용액 내 양이온 농도는 Inductively coupled plasma optical emission spectrometer (5900 ICP-OES, Agilent, USA)를 이용하여 분석하였다.
2.3. 흡착모델 적용식실험 결과는 아래의 식 (2)~(5)을 이용하여 흡착 파라미터 값을 도출하였다. 식 (2)과 (3)는 동역학적 흡착 실험결과를 피팅하는데 이용하였으며, 각각 유사 1차 반응속도 모델, 유사 2차 반응속도 모델이다. 식 (4)과 (5)는 등온흡착 실험결과를 분석하는 식으로 각각 Langmuir, Freundlich 등온흡착 모델식을 나타낸다.
여기서 qe(mg/g)와 qt(mg/g)는 각각 평형 흡착량과 t시간에서 g당 흡착량을 나타내고, qm(mg/g)는 이론적 최대 흡착능을 의미한다. k1(/h)과 k2(g/(mg·h))는 각 유사 1차 모델과 유사 2차 모델의 반응속도상수를 나타낸다. Ce(mg/L)은 흡착 후의 평형 농도이고, KF(L/g)는 Freundlich 등온흡착 모델의 상수이며, b와 n은 각각 흡착친화도와 관련된 상수와 흡착강도와 관련된 상수이다.
열역학적 파라미터로 깁스 자유에너지(△G0), 엔트로피(△S0), 엔탈피(△H0)를 계산하여 흡착이 일어나는 반응의 자발성을 판단하였다. 이를 구하기 위한 식은 식 (6)~(8)에 나타내었다.
Kd는 분배계수로 흡착평형상태에서 미세플라스틱의 단위중량당 흡착된 LVF의 양을 흡착 후 수용액 내의 남은 LVF의 농도의 비로 나타낸 것이다. R은 기체상수(8.314 J/mol·K)이고 T는 온도(K)를 의미한다.
3. 결과 및 고찰3.1. 미세플라스틱(PP, PE)의 특성분석흡착실험에 앞서 미세플라스틱의 형상을 살펴보기 위해 FE-SEM 이미지를 측정하였다(Fig. 1). PP와 PE 미세플라스 틱은 대체로 균일한 크기를 가지고 있는 것으로 보이며 인위 적으로 분쇄하여 미세플라스틱화하여 실험에 사용하였기 때 문에 거친 절단면을 지닌 것을 확인할 수 있었다. 또한, PE 미세플라스틱의 표면이 PP 미세플라스틱의 표면보다 상대적으로 매끄러운 것을 관찰하였다.
미세플라스틱들의 작용기를 확인하기 위하여 FT-IR 분석을 통해 PP와 PE 미세플라스틱에 대한 LVF의 흡착 전후 스펙트럼을 Fig. 2(a), (b)에 각각 나타냈다. Fig. 2(a)에서 나타난 주된 피크는 974 cm-1, 1375 cm-1, 1454 cm-1, 2918 cm-1으로 보인다. 이 피크들은 각각 isotactic PP bending, symmetric CH3 deformation, deformation CH2과 CH stretch를 나타낸다[17]. Fig. 2(b)에서 볼 수 있는 PE의 주된 피크들은 717 cm-1, 1464 cm-1과 2840-2920 cm-1 사이의 더블 피크이다. 이는 각각 CH2 rocking, CH2 bending, -CH2과 C-H의 stretching vibrations을 의미한다[18,19]. 본 분석결과에서 PP와 PE 미세플라스틱에 대해 모두 각 폴리머의 특징적인 피크들이 나타났기 때문에 실험에 사용한 미세플라스틱이 단일 폴리머 물질이라는 것을 확인할 수 있었다. Fig. 2(c)에는 LVF의 FT-IR 스펙트럼과 주된 피크들을 나타냈다. 선행연구[20]와 전체적으로 유사하게 피크들이 나타난 것을 확인하였고, 이는 837 cm-1(C-F), 1050, 3270 cm-1(카복실기의 단량체 결합), 1620, 2850 cm-1(방향족 고리), 1720 cm-1(C=O 카복실기의 stretching vibration)를 나타낸다. 상대적으로 적은 양이 LVF이 흡착되므로 PE와 PP에서 LVF 흡착 전과 후 피크의 급격한 변화를 관찰하지 못하였다. 그러나 PP와 LVF을 반응시킨 후의 FT-IR 결과(Fig. 2(a))를 보면 720~805 cm-1와 980~1100 cm-1의 범위 사이의 피크가 완만해진 것을 확인하였다. 이는 PP의 표면에 LVF이 흡착되어 LVF의 작용기인 카복실기가 나타난 것으로 판단된다.
3.2. 시간에 따른 LVF의 미세플라스틱 흡착 영향동역학적 흡착실험은 흡착제 내에서 흡착질 수송과 관련된 메커니즘에 대해 알 수 있는 실험이다[21]. PP와 PE 미세플라스틱에 대한 LVF의 흡착속도를 알아보기 위하여 48시간까지 반응시켰다(Fig. 3). 실험결과를 유사-1차 반응속도 모델식(2)과 유사-2차 반응속도 모델식(3)에 각각 피팅하여 파라미터값을 Table 1에 제시하였다. Table 1의 상관계수를 비교하였을 때, PP는 유사-1차모델이 실험결과를 더 잘 모사하였고(R2=0.986), PE에서는 유사-2차모델에 실험데이터를 적용하는 것이 반응속도를 얻기에 더 적합한 것으로(R2=0.992) 확인하였다. 반응 시작부터 4시간까지 PP와 PE 미세플라스틱에서 모두 흡착이 빠르게 진행되어 대부분의 흡착이 일어난 것으로 보이며, PP보다 PE 미세플라스틱에서의 흡착이 더 빨랐다. 그리고 반응시간이 증가하면서 흡착증가율은 점차 줄어들어 24시간에 흡착평형에 도달하였다. 이때의 흡착능은 PP와 PE 미세플라스틱에서 각각 0.748 mg/g, 0.801 mg/g이었다.
플라스틱에는 결정영역과 비결정영역이 존재하는데 화학물질은 비결정영역에 우선적으로 흡착된다[22]. 앞선 FT-IR결과를 보면 본 연구에 사용한 PP는 isotactic 형태이기 때문에 높은 결정성을 띈다. 반면, PE는 비결정영역의 비율이 높은 전형적인 반결정질 폴리머이다[23]. 이러한 PP와 PE의 폴리머적 특성 차이 때문에 PE 미세플라스틱의 흡착이 PP 미세플라스틱에서보다 더 빠르게 일어난 것으로 판단된다. 유사하게 Wang & Wang [24]의 연구에서도 PE, PS, PVC를 대상으로 Pyrene의 흡착특성을 평가한 결과, 흡착속도가 PE가 가장 빨랐으며, 이는 PVC와 PS가 PE에 비해 결정질 영역 비율이 높은 중합체이기 때문이었다.
3.3. 등온흡착 실험등온흡착 실험은 LVF의 농도변화에 따른 흡착특성을 알아보기 위해 LVF의 초기농도를 변화하며 수행되었다. 반응시간은 앞선 동역학적 흡착실험을 통해 알 수 있었던 평형에 도달한 시간인 24시간으로 설정하였다. 그리고 실험 데이터를 Langmuir와 Freundlich 등온흡착 모델에 피팅하여 Fig. 4과 Table 2에 나타냈다.
앞선 동역학적 흡착실험 결과를 통해 얻은 흡착 평형에서의 LVF 초기농도 10 mg/L일 때의 흡착능은 PE 미세플라스틱(0.801 mg/g)이 PP 미세플라스틱(0.748 mg/g)보다 상대적으로 조금 높았으나, 고농도의 LVF 용액(15, 25 mg/L)에서는 PP 미세플라스틱의 LVF흡착능이 PE 미세플라스틱 보다 큰것으로 관찰되었다. PE와 PP에 대한 LVF 흡착 실험데이터가 Langmuir 식보다 Freundlich 식에 상대적으로 더 잘 맞는 것을 확인하였다(R2>0.97). 즉, LVF의 흡착은 분쇄된 PP와 PE의 불균질한 흡착 표면에 따라 흡착능에 영향을 받을 수 있으며, 다층 흡착이 이루어질 것으로 보인다[25]. KF 값은 PP와 PE 미세플라스틱이 각각 0.246 L/g, 0.346 L/g 으로 나타났다. 또한, 흡착 동력의 크기와 관련된 1/n 값은 PP와 PE에서 각각 0.592, 0.427으로 산출되어 PE에 대한 LVF의 흡착이 PP에서 보다 상대적으로 쉽게 일어난다고 보인다[26].
3.4. 열역학적 흡착실험298-318 K 범위의 온도에서 수행된 본 실험을 통해 열역학적 파라미터를 구하여 Table 3에 나타냈다. 이를 통해 흡착과정의 자발성과 흡열 또는 발열성을 판단할 수 있다. Fig. 5는 온도조건의 변화에 따른 PP와 PE 미세플라스틱에 대한 LVF의 흡착능 변화를 보여준다.
PP와 PE 미세플라스틱의 흡착능은 유사하게 온도가 높아질수록 대체로 감소하는 추세를 보였으며, 깁스 자유에너지는 모두 양의 값으로 도출되었다(Table 3). 온도 증가에 따라 깁스 자유에너지 값이 점차 증가하는 것으로 보아, 해당 흡착반응은 비자발적으로 보였다. 또한 엔탈피가 음수로 나타났으며, 이는 흡착과정이 발열반응이라는 것을 나타낸다[27]. 그리고 엔트로피가 PP와 PE에서 모두 음수로 계산된 것은 흡착이 진행되는 과정에서 흡착질인 LVF의 자유도 감소가 일어나는 즉, 미세플라스틱과 LVF 용액의 계면에서 LVF의 농도 감소를 의미한다[27]. 엔탈피는 PP와 PE에서 각각 -21.71 kJ/mol, -13.57 kJ/mol로 계산되었고, 이 값들이 42 kJ/mol 미만이기 때문에 화학적 흡착 공정보다 물리적 흡착이 더 우세하다고 볼 수 있다[28)]. 일반적으로 물리적 흡착공정은 발열반응으로 진행된다고 알려져 있으며, PVC에 대한 LVF 흡착특성을 연구한 결과에서도 유사한 결과가 도출되었다[16].
3.5. 양이온 경쟁에 따른 흡착영향실제 수환경에서는 다양한 이온들이 존재하며, 선행연구 결과 일부 양이온들의 경우 항생물질이나 잔류성유기오염물질의 흡착을 억제하거나 오히려 증진시키기도 하였다[16,29]. 때문에 다양한 양이온들이 함께 존재했을 경우 PP와 PE 미세플라스틱에 대한 LVF의 흡착영향을 살펴보고자 본 실험을 수행하였다. 양이온에 따른 흡착 영향은 Fig. 6에 나타냈다.
양이온이 함께 수중에 존재할 때 종류와 전하에 관계없이 전반적으로 미세플라스틱에 대한 LVF의 흡착능이 억제되는 것을 확인할 수 있었다. 이는 실험 pH 조건에서 LVF의 경우 pKa1이 6.02, pKa2이 8.15로[30] 양이온 또는 양쪽성 이온(zwitterion)의 형태로 존재하고, 미세플라스틱 PE(-25.4 mV at pH 5.9)와 PP(-22.6 mV at pH 5.7)는 음전하를 띄고 있는바 양이온들의 존재는 전기이중층의 두께를 약화시켜 정전기적 상호작용을 방해하여 LVF의 흡착이 억제된 것으로 판단된다. LVF의 흡착은 Na+와 Ca2+이 존재하는 경우 보다는 중금속인 Cr3+, Cu2+, Pb3+ 이 존재할 때 흡착이 더 억제되는 것을 확인할 수 있었으며, 흡착 영향 정도는 PP와 PE 모두 Cr3+ > Cu2+ > Pb3+ 순으로 나타났다. 이는 Na+와 Ca2+의 경우 미세플라스틱에 흡착되지 않았으나 중금속 이온들의 경우 흡착 후 농도가 다소 감소하는 것을 확인한 바 Cr3+, Cu2+, Pb3+ 의 경우 LVF과 미세플라스틱 표면 흡착 사이트를 경쟁하는 것이라 판단되었다. 중금속의 미세플라스틱에 대한 흡착가능성은 이미 몇몇의 선행 연구에서도 확인된다. Zou et al. [31]은 PE 미세플라스틱이 Cu2+, Pb2+, Cd2+를 흡착할 수 있음을 밝혔다. Eom 등[32]은 PP에 Cd2+가 흡착될 수 있고 주요 메커니즘은 물리적인 흡착으로 판단하였다. 중금속 중 Cr3+이 LVF 흡착을 가장 크게 방해하는 이유는 다른 용액들의 실험 pH 조건이 5.8~6.5 인데 반해 pH가 4.3으로 LVF가 양이온으로 존재하는 비율이 크므로 흡착 저해를 더 크게 받은 것으로 판단된다.
4. 결 론일상생활에서 흔히 사용되고 버려지는 플라스틱들은 자연계를 순환하며 미세플라스틱으로 분해되고, 수계에 유입되어 다른 수질오염물질과 상호작용하여 운반체의 역할을 할 수 있다. 이에 본 연구에서는 대표적으로 수계에서 많이 관찰되는 PP와 PE 미세플라스틱에 대해 항생물질인 LVF의 흡착특성을 확인하고자 하였다. 연구 결과를 통해 PP와 PE 미세플라스틱에 LVF의 흡착이 일어날 수 있으며, 미세플라스틱의 폴리머적 특성과 반응시간, LVF의 초기농도, 반응온도, 경쟁 양이온의 존재 등에 따라 그 흡착능이 달라질 수 있음을 확인하였다. 본 연구결과를 통해 항생물질과 같은 미량오염물질들이 미세플라스틱에 흡착되어 수생 생물에게 섭취된다면, 수중보다 고농도로 체내에 유입될 수 있음을 시사한다. 전세계적으로 해수와 담수에서 미세플라스틱이 지속적으로 발견되고 있고, 항생물질의 사용량도 막대히 증가하는 만큼, 향후 먹이사슬을 통한 항생물질의 체내 농축 및 수생태 독성에 관련된 연구들이 수행되어야 할 것으로 생각된다.
NotesDeclaration of Competing Interest The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper. Fig. 2.FT-IR spectra before and after adsorption of LVF on (a)PP and (b)PE microplastics and (c)LVF. 
Fig. 3.Pseudo-first and Pseudo-second order kinetics model fit for the adsorption LVF on PP and PE microplastics. 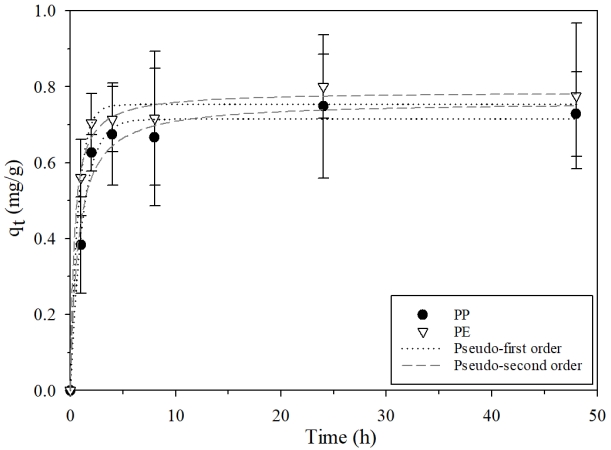
Fig. 4.Langmuir and Freundlich isotherm model fit for the adsorption LVF on PP and PE microplastics. 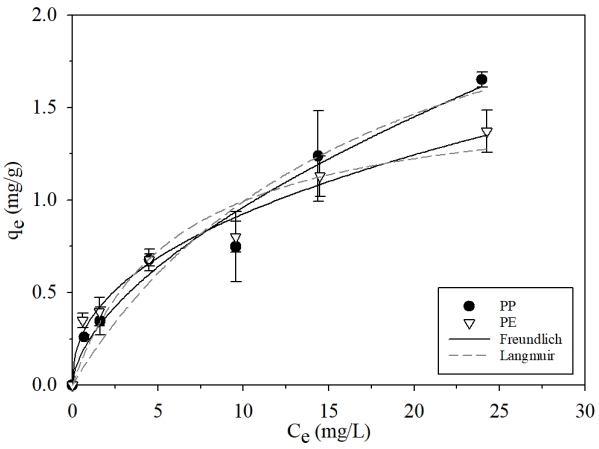
Fig. 6.Effect of cations (C0=0.1 mM) to the adsorption of LVF (C0=10 mg/L) on PP and PE microplastics. 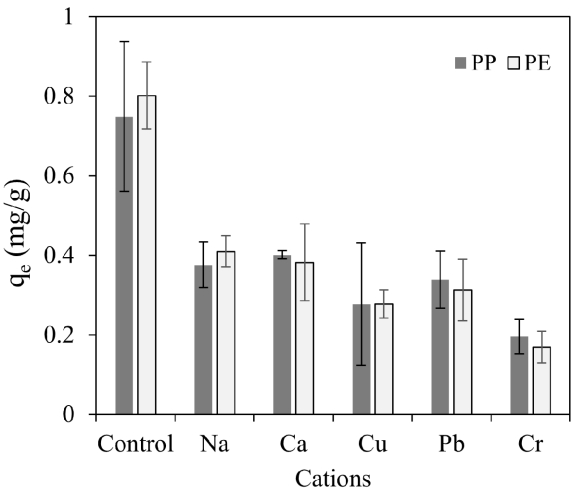
Table 1.Kinetic parameters for the adsorption of LVF(C0=10 mg/L) on PP and PE microplastics.
References1. B. Kwon, S. Lee, H. Rah, J. Paek, K. Kim, Categorization and definition of microplastics in the water environment, J. Korean Soc. Water Wastewater., 33(6), 429-436(2019).
2. F. Murphy, C. Ewins, F. Carbonnier, B. Quinn, Wastewater treatment works (WwTW) as a s ource of microplastics in the aquatic environment, Environ. Sci. Technol., 50(11), 5800-5808(2016).
3. D. Yang, H. Shi, L. Li, J. Li, K. Jabeen, P. Kolandhasamy, Microplastic pollution in table salts from China, Environ. Sci. Technol., 49(22), 13622-13627(2015).
4. Y. Cho, W. J. Shim, M. Jang, G. M. Han, S. H. Hong, Nationwide monitoring of microplastics in bivalves from the coastal environment of Korea, Environ. Pollut., 270, 116175(2021).
5. H. Choi, H. Kim, H. Jung, J. Park, S. Cho, M. Lee, Analysis of microplastics in surface water of urban river, in Proceedings of the Annual Meeting of Korean Society of Environmental Engineers KSEE, Jeju, pp. 581(2020).
6. M. Barletta, A. R. A. Lima, M. F. Cos ta, Dis tribution, sources and consequences of nutrients, persistent organic pollutants, metals and microplastics in South American estuaries, Sci. Total Environ., 651, 1199-1218(2019).
7. F. A. Monikh, M. G. Vijver, Z. Guo, P. Zhang, G. K. Darbha, W. J. G. M. Peijeneburg, Metal sorption onto nanoscale plastic debris and trojan horse effects in Daphnia magna: Role of dissolved organic matter, Water Res., 186, 116410(2020).
8. G. Dai, B. Wang, J. Huang, R. Dong, S. Deng, G. Yu, Occurrence and source apportionment of pharmaceuticals and personal care products in the Beiyun River of Beijing, China, Chemosphere., 119, 1033-1039(2015).
9. R. Zhang, J. Pei, R. Zhang, S. Wang, W. Zeng, D. Huang, Y. Wang, Y. Zhang, Y. Wang, K. Yu, Occurrence and distribution of antibiotics in mariculture farms, estuaries and the coast of the Beibu Gulf, China: Bioconcentration and diet safety of seafood, Ecotox. Environ. Safe., 154, 27-35(2018).
10. H. J. Son, S. H. Jang, Occurrence of residual pharmaceuticals and fate, residue and toxic effect in drinking water resources, J. Korean Soc. Environ. Eng., 33(6), 453-479(2011).
11. M. G. Ronquilo, J. C. A. Hernandez, Antibiotic and synthetic growth promoters in animal diets: Review of impact and analytical method, Food Control., 72, 255-267(2017).
12. S. M. Wimer, L. Schoonover, M. W. Garrison, Levofloxacin: a therapeutic review, Clin. Ther., 20(6), 1049-1070(1998).
13. M. Yasojima, N. Nakada, K. Komori, Y. Suzuki, H. Tanaka, Occurrence of levofloxacin, clarithromycin and azithromycin in wastewater treatment plant in Japan, Water Sci. Technol., 53(11), 227-233(2006).
14. S. Mohapatra, C-H. Huang, S. Mukherji, L. P. Padhye, Occurrence and fate of pharmaceuticals in WWTPs in India and comparison with a similar study in the United States, Chemosphere., 159, 526-535(2016).
15. J. Li, K. Zhang, H. Zhang, Adsorption of antibiotics on microplastics, Environ. Pollut., 237, 460-467(2018).
16. F. Yu, Y. Li, G. Huang, C. Yang, C. Chen, T. Zhou, Y. Zhao, J. Ma, Adsorption behavior of the antibiotic levofloxacin on microplastics in the presence of different heavy metals in an aqueous solution, Chemosphere., 260, 127650(2020).
17. J. Prabowo, J. N. Pratama, M. Chalid, The effect of modified ijuk fibers to crystallinity of polypropylene composite, Mater. Sci. Eng., 223(1), 012020(2017).
18. E. Hu, H. Yuan, Y. Du, X. Chen, LDPE and HDPE microplastics differently affect the transport of tetracycline in saturated porous media, Materials., 14(7), 1757(2021).
19. J. Fang, L. Zhang, D. Sutton, X. Wang, T. Lin, Needleless melt-electrospinning of polypropylene nanofibres, J. Nanomater., 2012, 382639(2012).
20. M. I. Mouzam, M. H. G. Dehghan, S. Asif, T. Sahuji, P. Chudiwal, Preparation of a novel floating ring capsule-type dosage form for stomach specific delivery, Saudi Pharm. J., 19(2), 85-93(2011).
21. S. Azizian, Kinetic models of sorption: a theoretical analysis, J. Colloid Interface Sci., 276(1), 47-52(2004).
22. S. Endo, A. A. Koelmans, Sorption of Hydrophobic organic compounds to plastics in the marine environment: equilibrium, Hazardous Chemicals Associated with Plastics in the Marine Environment, H. Takada, H. K. Karapanagioti (Eds.), Springer international publishing, pp. 185-204(2016).
23. X. Guo, X. Wang, X. Zhou, X. Kong, S. Tao, B. Xing, Sorption of four hydrophobic organic compounds by three chemically distinct polymers: role of chemical and physical composition, Environ. Sci. Technol., 46(13), 7252-7259(2012).
24. W. Wang, J. Wang, Comparative evaluation of sorption kinetics and isotherms of pyrene onto microplastics, Chemosphere., 193, 567-573(2018).
25. J. J. Lee, Analysis for adsorption equilibrium, kinetic and thermodynamic parameters of aniline blue using activated carbon, Korean Chem. Eng. Res., 57(5), 679-686(2019).
26. J. J. Lee, Study on isotherm, Appl. Chem. Eng., 30(2), 190-197(2019).
27. T. Sheela, Y. A. Nayaka, R. Viswanatha, S. Basavanna, T. G. Venkatesha, Kinetics and thermodynamics studies on the adsorption of Zn(II), Cd(II) and Hg(II) from aqueous solution using zinc oxide nanoparticles, Powder Technol., 217, 163-170(2012).
28. J. H. Lee, D. H. Suh, Entropy, enthalpy, and gibbs free energy variations of 133Cs via CO2- activated carbon filter and ferric ferrocyanide hybrid composites, Nucl. Eng. Technol., 53(11), 3711-3716(2021).
29. F. Wang, K. M. Shih, X. Y. Li, The partition behavior of perfluorooctanesulfonate (PFOS) and perfluorooctanesulfonamide (FOSA) on microplastics, Chemosphere., 119, 841-847(2015).
30. B. Yan, C. H. Niu, Modeling and site energy distribution analysis of levofloxacin sorption by biosorbents, Chem. Eng. J., 307, 631-642(2017).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||