|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesIn this study, we analyzed 56 individual organic compounds in PM2.5 in Seosan, where the large complex emission sources are closely located, to characterize organic compounds distributions in this site.
MethodsThe sampling of PM2.5 in Seoul was also simultaneously carried out to compare the concentrations and distributions of organic compounds in PM2.5 measured in Seosan.
Results and DiscussionThe overall concentration of organic compounds (OCs) in Seosan was 383±165 ng/m3 , which was twice as high as the concentration in Seoul (189±67 ng/m3 ). PAHs and levoglucosan concentrations were higher in Seosan than in Seoul, attributing mostly to emissions from fossil fuel combustion and biomass burning. The ratio of Levoglucosan/Mannosan(Levo/Manno) and Levo/K+ plot showed that the type of biomass in the biomass burning at two areas might be different. In addition, the concentrations of 1,3,5-triphenylbenzne and tere-phthalic acid, which are indicators of plastic burning, in Seosan were 2~9 times higher than Seoul, respectively.
요약방법23시간 포집한 필터로부터 PM2.5 내 유기성분을 추출하여 가스 크로마토그래피/질량분석기(GC/MS)를 이용하여 분석해 서산 지역에 PM2.5 내 유기성분들의 농도 및 분포를 서울과 비교하였다.
결과 및 토의서산의 ∑OCs 총농도는 383±165 ng/m3 로 서울(189±67 ng/m3)의 두 배 수준이었다. 주로 화석연료 연소와 바이오매스 연소로 배출되는 PAHs와 Levoglucosan 농도는 서산이 서울보다 높았다. Levoglucosan/Mannosan(Levo/Manno)의 비율은 두 지역에서 바이오매스 연소 중 바이오매스의 종류가 다를 수 있음을 보여주었다. 서산의 경우 플라스틱 연소 지표인 1,3,5-triphenylbenzne과 tere-phthalic acid의 농도가 각각 서울보다 2~9배 높았다. 혼합 출처 지표(Manno, Levo, K+ , Cl- , TriPhe, tere-PhA, ΣPAHs and OC)는 서울보다 서산지역에서 큰 상관관계를 보였다.
1. 서 론초미세먼지(PM2.5: particulate matter with aerodynamic diameters less than or equal to 2.5 micrometer)는 인체건강에 폐렴과 전신 염증, 동맥경화 가속화 등 악영향을 미치고, 태양 에너지 반사와 흡수, 구름 응축 핵으로서 지역과 전구 기후변화에 직・간접적으로 영향을 미치기 때문에 PM2.5의 기원과 생성 메커니즘을 이해하기 위하여 성분들의 분포 특성을 파악하는 연구들은 계속으로 수행되고 있다[1-5].
PM2.5의 주요 구성 성분인 유기 에어로졸(OA: Organic aerosol)은 1,000여 종이 넘는 개별 유기 성분으로 구성되어 있다[6]. 이러한 유기 성분은 다양한 배출원에서 직접 발생하는 1차 유기 에어로졸(POA: primary organic aerosol)이거나 대기 중산화 과정을 통해서 생성되는 2차 유기 에어로졸(SOA: Secondary organic aerosol)으로 구분할 수 있다. 1990년대부터 대기 에어로졸 중에 유기 성분은 특정 배출원 규명에 관련 연구를 진행하기 시작했고[7-9], 현재까지 에어로졸 중에 유기 성분은 배출원 추정하는 마커로 활용되고 있다[10].
서산이 위치한 충청남도는 대형 사업장들이 밀집되어 있다. 전국 61기의 석탄화력발전소 중 절반인 30기가 충청남도에 위치해 있으며, 전국 석탄 화력 발전량의 약 50%를 담당한다. 또한 석유화학단지, 대형 제철소 등 대규모 오염물질 배출원들이 많은 지역이다. 때문에 충남 서산 지역은 대형 사업장에서 발생하는 일차 대기오염물질들의 영향이 지배적이라고 평가되고 있다[11-12]. Ju et al.(2020) [12]에 따르면 충남 서산에 위치한 충청권대기환경연구소에서 2019년 10월에 측정한 유기탄소(OC: Organic Carbon)의 평균 농도는 6.3 μg/m3으로 이는 20.8 μg/m3 농도를 보인 PM2.5의 약 30%를 차지하는 비율이다. 반면, 같은 기간 서울에 위치한 수도권 대기 환경 연구소에서 측정된 OC의 평균 농도는 3.0 μg/m3로 이는 서산의 OC 농도의 1/2수준이였다. 이때, 서울의 PM2.5 농도는 21.5 μg/m3로, 서산과 비슷한 수준이었다. 즉, 서산은 서울에 비해 PM2.5 내 OC의 비중이 2배 정도 높았다. 따라서, 서산 지역의 PM2.5 농도 관리를 효과적으로 하기위해서는 PM2.5를 구성하는 OC의 발생 특성을 이해하고, 이를 관리하는 것이 중요하다고 판단된다.
이에 본 연구에서는 서산 대기 중 PM2.5 내 유기 성분을 서울지역과 비교분석하여 서산지역에서 OC의 농도가 높은 원인을 규명하고자 하였다. 이를 위해 본 연구에서는 서울과 서산에서 동시에 채취한 PM2.5 시료에서 5개 그룹 Polycyclic Aromatic Hydrocarbons(PAHs), n-Alkanes, Fatty acid, Dicarboxylic acids(DCAs), Sugars의 총 56종의 유기성분들을 정성, 정량 분석하였다.
2. 측정 및 분석2.1. PM2.5 시료 채취PM2.5 시료는 전형적인 도시지역을 대표하는 서울과 대규모 복합 배출원이 있는 산업 지역인 충남의 서산 지역에서 채취되었다. 서울은 은평구 불광동에 위치한 수도권대기환경연구소(37.61°N, 126.933°E)에서 시료 채취를 수행하였고, 서산에서는 충청남도 서산시 수석동에 위치한 충청권 대기환경연구소(36.771°N, 126.494°E)에서 시료 채취를 진행하였다(Fig. 1). 서울 시료는 2019년 10월 1일부터 10월 31일까지 총 29개의 시료가 포집되었고, 서산의 경우 2019년 10월 1일부터 11월 4일까지 총 34개의 시료가 포집되었다.
모든 시료는 PM2.5 임팩터가 장착된 고유량 공기 채취기(HV-RW, SIBATA Sci Tech)를 이용해 석영 필터(Tissuquartz air monitoring filter, Pall 7204, 2500 QAT-UP, 10 inches x 8 inch)에 포집하였다. 포집 전 모든 여과지들은 여과지에 존재하는 유기물과 오염물질들을 제거하기 위해 550℃에서 12시간동안 가열 과정을 거쳤다. 시료는 샘플링 후 분석 전까지 -20℃에서 냉동 보관하였다.
2.2. 시료 전처리 및 유기성분 분석포집된 여과지는 절반을 잘라 대체표준물질 12종을 주입한 후, dichloromethane and methanol (3:1, v/v) 용액 50 mL에 담가 20℃에서 30분 동안 초음파 추출하였다. 이 과정을 2회 반복한 후 추출액을 질소농축기(Turbo Vap II, Caliper Life Sciences, USA)를 이용해 10 mL까지 1차 농축하였다. 1차 농축액을 0.45 μm 크기 디스크 필터(Acrodisc Syringe Filters With PTFE Membrane, PALL Life Science, USA)로 여과한 후 다시 질소농축기(Biofere, USA)를 이용하여 1 mL로 2차 농축하였다. 2차 농축액은 다시 니들 질소농축기(Reacti-Vap Evaporator, Thermo Fisher Scientific, USA)로 옮겨 최종 0.5 mL로 농축하였다.
극성 유기성분들(Fatty acids, DCAs, Sugars)을 분석하기 위해 추가적인 유도체화 과정을 진행하였다. 최종 농축액 50 μL을 바이알에 넣고 40℃에서 휘발시킨 후, Pyridine 50 μL과 N, O-Bistrifluoroacetamide(BSTFA) 50 μL을 주입하여 히팅 블록에 75℃에서 90분 동안 반응시켰다(REACTI-THERM # 18822 Heating module, USA).
무극성 유기성분, 극성 유기성분들 모두 GC-MS(Aglient, USA)를 통해 각각 분석하였고, 이때 사용된 GC-MS 분석 조건은 Table 1에 정리하였다.
2.3. 정도관리(QA/QC: Quality assurance and quality control)실험 과정 및 분석 대상 물질들에 대한 QA/QC는 환경시험・검사 QA/QC 핸드북(국립환경과학원, 2011)에 준하여 진행하였다. 바탕시료에 대한 분석, 회수율 평가, 방법 검출 한계(MDL) 실험을 통하여 수행되었다. MDL 방법은 환경시험・검사 QA/QC 핸드북 중에 기술되는 미국 환경보호청(EPA)의 청정수법(Clean Water Act)의 제시하는 방법검출한계 방법으로 진행했다. 검출이 가능한 최저 농도로 시료를 7번 찍어서, 7개 시료의 상대표준편차와 자유도 n-1의 t 분포 값 3.143을 곱해 MDL값을 산출했다. PAHs 그룹의 17종의 성분에 대한 평균 회수율은 84.6%, 상대표준편차 18.4%로 나타났다. n-Alkane 그룹의 17종에 대한 회수율은 평균 88.1%, 상대표준편차 9.2%로 나타났으며, Fatty acids 그룹의 9종에 대해 평균 71.3%, 상대표준편차 11.0% DCAs 그룹 11종은 평균 75.7%, 상대표준편차 15.5%, Sugars 그룹 2종은 평균 80.5%, 상대표준편차 4.9%를 나타냈다.
3. 결과 및 고찰3.1. 서울과 서산지역의 PM2.5와 OC, 총 유기성분(Σ OCs: total organic compounds) 분포 특성
Fig.2는 본 연구가 진행된 기간인 2019년 10월에 서산과 서울에서의 평균 PM2.5 농도와 OC 농도, ΣOCs 농도를 나타낸다. 서울의 PM2.5와 OC 농도 자료는 수도권 대기환경연구소에서 측정한 1시간 단위의 실시간 결과이고, 서산의 자료는 PM2.5의 경우는 충청권 대기환경연구소에 가장 근접한 도시대기측정망(동문동)의 PM2.5 농도자료이다. 서산에서의 OC농도는 Ju et al.(2020) [12]에서 보고한 본 연구에서 사용한 동일 PM2.5의 시료에서 분석한 결과이다. OC농도의 경우 두 지역 모두에서 측정에 사용된 고용량 채취기에는 탄소 함침 디누더가 설치되어 있지 않아서 분석된 OC의 농도는 실제보다 다소 과대평가되었을 것을 고려하여야 한다[13]. 본 연구기간 동안 서산의 PM2.5 농도(22.8 μg/m3)는 서울의 평균 PM2.5 농도(21.3 μg/m3)와 유사하였다. 하지만 OC와 ΣOCs의 농도는 서울에 비해 서산이 약 2배 높은 농도를 보였다. Fig. 3에서 측정된 10월 한 달간 PM2.5, OC, EC, ΣOCs의 일별 증감 추세를 보았을 때 서울과 서산 모두에서 PM2.5의 농도가 증가할 때 OC와 EC, ΣOCs도 동시에 증가함을 확인하였고, 전체적으로 PM2.5와 OC, EC, ΣOCs의 일별 추이가 유사함을 확인하였다. 이를 통해 OC 또는 ΣOCs의 농도 증가가 PM2.5의 농도 증가와 관련 요인임을 확인할 수 있었다. Table 2에서는 서울과 서산에서의 ΣOCs와 PM2.5, OC, EC 간의 상관성을 파악하기 위해 상관 분석을 진행한 결과를 나타냈다. 두 지역 모두에서 PM2.5와 OC의 상관성이 높았고, ΣOCs와 OC와의 상관성이 높게 나타남을 확인하였다(r > 0.7). 특히 서울에 비해 서산에서 OC와 ΣOCs의 상관계수 r이 0.898로 매우 높았다. 또한, ΣOCs와 PM2.5간의 상관성도 서울에 비해 서산이 더 높음(r = 0.554)을 확인하였다. 따라서, 서산 지역의 ΣOCs의 농도 분포 특성은 OC의 농도 분포와 유사함을 알 수 있었고, 서산 지역에서 ΣOCs의 농도 분포 특성을 이해함으로써 서산에서 OC 농도의 비율이 높은 원인을 설명할 수 있을 것으로 판단하였다.
3.2. 서울과 서산에서의 PM2.5 내 유기성분들의 농도분포본 연구에서는 서울과 서산의 PM2.5 내 개별 유기 성분 56종을 5그룹의 결과를 Table 3에 나타냈다. 서울 ΣOCs의 농도는 최소 77.2 ng/m3부터 최대 330 ng/m3이었고, 평균 189 ng/m3을 나타냈다. 서산에서는 최소 67.1 ng/m3에서 최대 671 ng/m3으로 평균 350 ng/m3이었다. Fig. 4에서 보듯이, 서울에서는 DCAs 그룹이 38%로 가장 높은 비율을 차지하였고, 다음으로 Fatty acids 그룹이 30%, Sugars 그룹이 23%를 차지하였다. 반면, 서산에서는 서울과 다르게 Sugars 그룹이 45%로 가장 큰 비중을 차지하였고, 다음으로 DCAs 27%, Fatty acids 21% 순이었다.
일반적으로 대기 중 OC의 생성 원인은 유기물질의 연소와 생물들의 자연적 배출, VOCs의 대기 중 화학반응에 의한 이차생성으로 구분할 수 있다[14]. 유기성분들 중 연소에 의한 배출 영향이 두드러지는 성분들로는 화석연료의 연소에서 발생하는 PAHs 성분들이다. Sugars그룹의 Levo와 Manno는 나무나 볏짚 등의 바이오매스 연소에서 다량 배출되는 것으로 보고되고 있다[9]. 반면, n-Alkanes과 Fatty acids 경우는 유기물질의 연소뿐만 아니라 생물에 의한 발생 영향도 포함한다[8]. 대기 중 DCAs는 OC 내 이차유기에어로졸의 생성의 지표 물질로 활용되고 있다[15].
Fig. 4에서 보듯이 이차 생성의 영향을 확인할 수 있는 DCAs 그룹의 농도 분포는 서산과 서울이 비슷한 수준이었고, 생물의 자연적 배출 영향을 포함하는 Fatty acids와 n-Alkanes 그룹의 농도도 큰 차이를 보이지 않았다. 두 지역에서 뚜렷한 농도 차이를 보인 성분들은 화석연료 및 바이오매스 연소에서 기인하는 PAHs와 Levo을 포함한 Sugars성분들이었다. 따라서 서산지역에서 OC 및 ΣOCs의 농도가 서울에 비해 높게 나타나는 원인은 서산의 PAHs와 Sugars그룹에 의한 영향이 크기 때문으로 판단되었다.
3.2.1. 서울 서산의 Levo와 Manno 농도 및 특성두 지역에서 바이오매스 연소 영향을 파악하기 위해 측정된 Levo와 Manno를 이용한 추가적인 분석을 진행하였다. 서산에서 측정된 Sugar 성분들(Levo와 Manno)의 평균 농도는 177±111 ng/m3이며, 서울지역의 평균 농도(91.8±41.8 ng/m3)보다 약 2배 이상 높았다. Levo의 경우 바이오매스 연소에 의한 Celluose 연소 시 생성되는 성분이며, 대기에서 높은 농도와 안정적인 물리화학적 특성을 갖고 있어 바이오매스 연소 추적에 적합한 성분이다[9]. Manno의 경우 Hemicelluose 연소 시 생성되는 성분으로 이를 통해 바이오매스연소 발생 여부를 확인할 수 있다[16]. Fig. 5에 OC, EC와 Levo, Manno와의 선형회귀 결과를 나타냈다. 서산에서 발생한 Levo와 Manno의 경우 OC, EC 모두와 높은 상관성을 나타냈다. 반면 서울의 경우 모두 R2값이 0.1 이하로 낮은 상관성을 나타냈다. 이를 통해 서산의 높은 OC, EC 농도는 현지에서 발생하는 바이오매스연소에서 기원하였음을 확인할 수 있었다.
3.2.2 서울 서산의 PAHs 농도 및 특성연소기원 성분인 PAHs에서 바이오매스연소의 영향을 보다 자세히 평가하고자, Mao et al.(2018) [17]에서 제안한 PAHs 중 바이오매스 연소에 해당하는 PAHs의 비율을 계산하는 방법을 본 연구결과에 적용하였다. 본 연구에서는 Mao et al. (2018) [17]에서 Levo와 PAHs의 분해 속도를 기반으로 예측된 PAHs 중 바이오매스연소에 의한 기여도 상수를 식 (1)와 같이 서울과 서산에 적용하였고, 이 결과를 Fig. 6에 제시하였다. 서울과 서산의 PAHs 농도 중 바이오매스연소에 의한 PAHs 농도는 서산은 약 1.70 ng/m3 으로써, 서울 0.42 ng/m3 보다 약 4.00배 정도 높았고, 총 PAHs 농도 내 비율로는 서산은 약 61.5%로, 서울 51.3%에 비해 약 1.20배 정도 높았다. 이를 통해 서산 지역에서 발생한 고체 연소의 경우 바이오매스의 영향이 큰 것을 재확인할 수 있었다.
3.3. 노천소각에 의한 유기오염물질의 발생 영향 파악앞 절에서 설명한 바와 같이 서산에서의 OC농도가 높은 주요 원인으로는 바이오매스를 포함한 고체연료의 연소임을 확인하였다. 이에 따라, 본 연구에서는 이러한 고체연료의 연소가 노천에서의 폐기물 소각과 관련성이 있는지를 파악하기 위하여 유기 성분들 중 플라스틱 연소 시 생성되는 TriPhe과 DCAs 중 한 성분인 tere-PhA 농도를 확인하였다[18-19]. Triphe는 쇼핑백 등 Polyethylene (PE)와 페트병 등 Polyethylene terephthalate (PET) 연소 마커이고[20], Tere-PhA는 PET 분해의 산물이다[21]. Fig. 7에 서울과 서산에서의 이 두 성분에 대한 농도 값을 나타내었다. TriPhe의 경우 서울 지역에서 측정된 10월 평균 농도는 서울이 0.10 ng/m3, 서산이 0.92 ng/m3으로, 서울에 비해 서산지역에서 약 9배 높은 농도를 보였고, tere-PhA 성분의 농도는 서산에서는 15.1 ng/m3으로 서울 (6.59 ng/m3)에 비해 약 2배 이상 높았다. 두 성분 간 상관계수(r)를 살펴본 결과, 서울은 0.48인데 비해, 서산 0.68로 서산지역에서 두 성분 간의 상관성이 더 높음을 확인하였다.
Fig. 8에 TriPhe과 tere-PhA의 일별 농도 변화를 OC와 함께 나타냈다. 서울과 서산의 OC-TriPhe의 상관계수는 0.41, 0.73으로 서산이 더 높은 상관관계를 나타냈다. 반면 OC-tere-PhA와의 상관계수는 0.73, 0.67으로 두 지역 모두 높은 상관관계를 나타냈다. Fig. 8(a)과 (b)에서 보듯이 서산에서는 TriPhe와 tere-PhA가 OC와 함께 유사한 증감 추이를 보이는 반면에, 서울에서는 OC와 TriPhe, tere-PhA의 유사한 일별 변화를 관찰하기 어려웠다. 이를 통해 서산지역에서는 바이오매스 연소에 의한 영향과 더불어 PET과 PE 연소에 의한 OC의 발생이 서산 지역의 OC 농도에 영향을 줄 것으로 판단되었고, 또한, Ju et al.(2020) [12]에서 측정소 주변에 빈번하게 바이오매스의 노천소각이 발생하는 것을 보고하기 때문에 바이오매스 연소 및 PET와 PE 연소는 노천소각과 같은 활동에 의한 것으로 예상된다.
서산지역에서 발생 가능성이 있는 노천 소각에 대해 보다 구체적으로 파악하고자 바이오매스 연소 및 노천소각에서 발생할 수 있는 성분들 간 상관 분석 결과를 Fig. 9에 제시하였다(Manno, Levo, K+, Cl-, TriPhe, tere-PhA, ΣPAHs, OC). 이 중 K+, Cl-는 농업 잔재물로 바이오매스 연소 시 많이 배출되기 때문에 Manno, Levo 같이 바이오매스 연소 지표로 상관분석을 진행했다. Fig. 9에서 보듯이, 서울에서는 이 성분 간의 유의미한 상관관계를 찾기 어려웠으나, 서산에서는 노천 소각과 관련된 모든 성분 간의 높은 상관성이 뚜렷하게 관찰되었다. 이를 통해 2019년 10월 동안 측정한 서산의 높은 OC 농도는 노천 소각에 의한 영향이 클 것으로 추정된다.
4. 결 론본 연구에서는 서산 지역의 PM2.5 내 유기성 분들의 농도 수준과 분포 특성을 파악하기 위하여 5그룹으로 구분되는 56종의 유기성분들을 분석하였고, 동일 기간에 측정한 서울의 PM2.5 내 유기성분들의 농도와 비교 분석하였다. 서울과 서산지역에서의 PM2.5 농도는 비슷한 수준이었지만, PM2.5 내 OC와 ∑OCs의 농도는 서산이 서울에 비해 약 2배 이상의 농도를 나타냈음을 확인하였다. 분석된 유기 성분들 중 서산 지역이 서울에 비해 두드러지게 높은 농도를 보이는 성분들은 PAHs와 Sugar 그룹의 성분들로, 이 두 그룹의 공통점은 화석 연료 연소 영향이 크며, 그중 바이오매스 연소의 영향이 큰 성분들이었다. Levo/Manno와 OCbb 등을 계산한 결과, 서산지역에서 바이오매스 연소의 영향이 서울에 비해 약 3.6배 정도 높았다. 또한 노천 소각에 의한 영향을 파악하기 위하여 PE, PET 연소의 지표 성분인 triPhe, tere-PhA의 농도 분포 및 이들의 상관성을 파악하였고, 서산은 이들 성분 간의 상관성이 뚜렷하게 관찰되는 반면, 서울은 상관성이 낮았다. 이를 통해 서산지역에서는 PE, PET 재질인 플라스틱 연소와 같은 노천 소각이 OC의 주요 발생원임을 확인하였다. 서울은 2017년 대기환경개선을 위한 석탄, 코크스, 땔나무 등의 고체연료 사용금지 강화에 따라 고체연료 사용 제한 지역에 포함되는 지역이다. 반면, 서산시의 경우 고체연료 사용 제한 지역에 포함되지 않는 지역으로 인근 지역에서 노천 소각 등의 고체연료 사용에 대한 규제가 이루어지지 않는다. 이러한 차이가 두 지역의 연소 기원의 유기성분들의 농도 차이와 더불어 바이오매스 연소의 유형의 차이를 가져올 수 있을 것으로 추정된다.
Acknowledgments이 논문은 2020년 및 2022년도 과학기술정보통신부의 재원으로 한국연구재단-기후변화대응기술개발사업(No. 2019M1A2A2103953)과 한국연구재단-동북아-지역 연계 초미세먼지 대응 기술개발 사업(과제번호: 2020M3G1A1114537) 지원을 받아 수행된 연구임.
Fig. 3.Temporal variation of PM2.5, OC, EC and ∑OCs concentrations in (a) Seoul and (b) Seosan during October 2019. 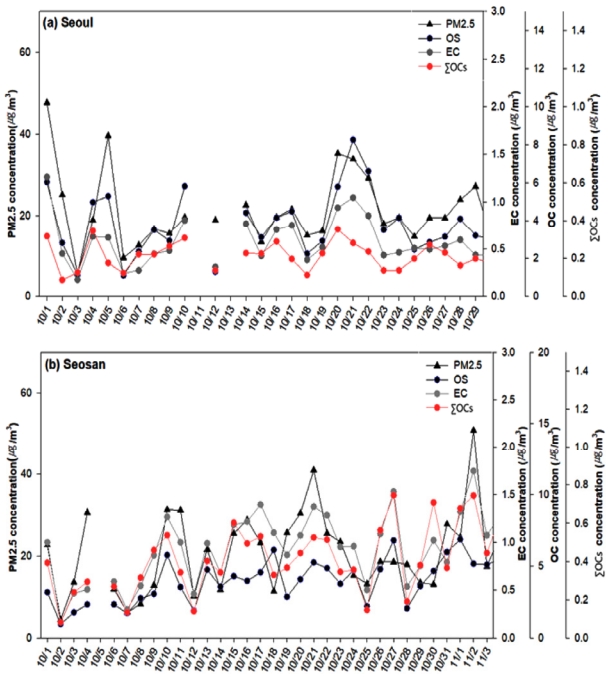
Fig. 5.Regression of levoglucosan with (a) OC and (b) EC, and mannosan with (c) OC and (b) EC in Seoul and Seosan. 
Fig. 6.(a) The estimated concentration and (b) ratios of PAHs from biomass burning and other sources at Seoul and Seosan. 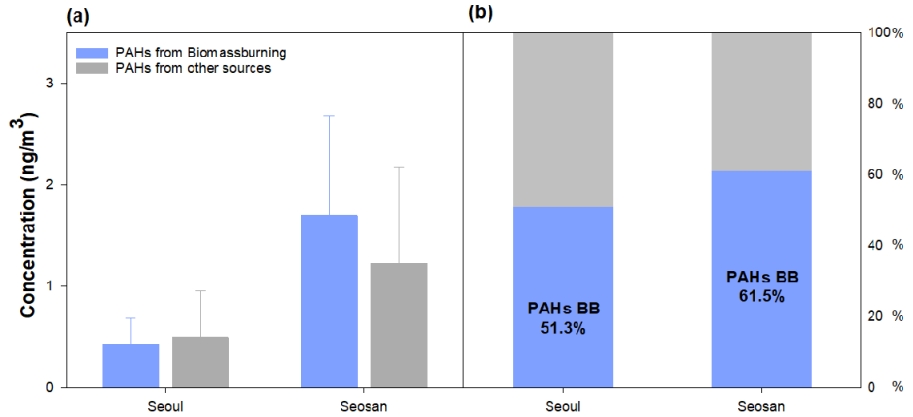
Fig. 9.The pearson correlation coefficients of mixed sources indicators (Manno, Levo, K+, Cl-, TriPhe, tere-PhA, ΣPAHs and OC). 
Table 1.GC/MS operating condition. Table 2.Pearson correlation coefficient of ΣOCs with PM2.5, OC, EC in Seoul and Seosan, 2019.
Table 3.Concentration of measured compounds in Seoul and Seosan. References1. C. A. Pope III, R. T. Burnett, G. D.Thurston, M. J. Thun, E. E. Calle, D. Krewski, J. J. Godleski, Cardiovascular mortality and long-term exposure to particulate air pollution: epidemiological evidence of general pathophysiological pathways of disease, Circulation., 109(1), 71-77(2004).
2. C. A. Pope III, M. Ezzati, D. W. Dockery, Fine-particulate air pollution and life expectancy in the United States, N. Engl. J. Med., 360(4), 376-386(2009).
3. H. L ee, Y. H ond a, M. Hashizume, Y. L. G uo, C .-F. W u, H. Kan, K. Jung, Y.-H. Lim, S. Yi, H. Kim, Short-term exposure to fine and coarse particles and mortality: a multicity time-series study in East Asia, Environ. Pollut., 207, 43-51(2015).
4. Y. J. Kaufman, D. Tanre, O. Boucher, A satellite view of aerosols in the climate system, Nature., 419(6903), 215-223(2002).
5. G. Chen, Y. Zhang, W. Zhang, S. Li, G. Williams, G. B. Marks, B. Jalaludin, M. J. Abramson, F. Luo, D. Yang, Attributable risks of emergency hospital visits due to air pollutants in China: A multi-city study, Environ. Pollut., 228, 43-49(2017).
6. S.P. Lee, H.B. Lim, Y.P. Kim, Seasonal variation of concentrations and sources for n-alkanes in PM10 measured in Seoul, J. Kor. Soc. Environ. Anal., 18(2), 93-100(2015).
7. J. J. Schauer, W. F. Rogge, L. M. Hildemann, M. A. Mazurek, G. R. Cass, B. R. Simoneit, Source apportionment of airborne particulate matter using organic compounds as tracers, Atmos. Environ., 30(22), 3837-3855(1996).
8. W. F.Rogge, L. M. Hildemann, M. A. Mazurek, G. R. Cass, B. R. Simoneit, Sources of fine organic aerosol. 4. Particulate abrasion products from leaf surfaces of urban plants, Environ. Sci. Technol., 27(13), 2700-2711(1993).
9. B. R. Simoneit, J. J. Schauer, C. Nolte, D. R. Oros, V. O. Elias, M. Fraser, W. Rogge, G. R. Cass, Levoglucosan, a tracer for cellulose in biomass burning and atmospheric particles, Atmos. Environ., 3(2), 173-182(1999).
10. R. Li, Q. Wang, X. He, S. Zhu, K. Zhang, Y. Duan, Q. Fu, L. Qiao, Y. Wang, L. Huang, L. Li, J. Z. Yu, Source apportionment of PM2.5 in Shanghai based on hourly organic molecular markers and other source tracers, Atmos. Chem. Phys., 20(20), 12047-12061(2020).
11. S. C. Son, S. Park, M. Bae, S. Kim, A study on characteristics of High PM2.5 pollution observed around large-scale stationary sources in Chungcheongnam-do Province, J. Kor. Soc. Atmos. Envrion., 36(5), 669-687(2020).
12. S.Y. Ju, G.H. Yu, S.S. Park, S.L. Lee, J. B. Jee, K.Y. Lee, M.D. Lee, Pollution characteristics of PM2.5 measured during fall at a Seosan Site in Chungcheong Province, J. Kor. Soc. Atmos. Envrion., 36(3), 329-345(2020).
13. G.H. Yu, S.S. Park, S.A. Jung, M.R. Jo, S.I. Lee, A comparison of carbonaceous components between semi-continuous and filter-based measurements using thermal-optical transmittance method, J. Kor. Soc. Atmos. Envrion., 35(3), 395-403(2019).
14. D. R. Gentner, G. Isaacman, D. R. Worton, A. W. Chan, T. R., L. Davis, S. Liu, A. D. Douglas, L. M. Russell, R. K. W. Wilson, R. Weber, A. Guha, R. A. Harley, A. H. Goldstein, Elucidating secondary organic aerosol from diesel and gasoline vehicles through detailed characterization of organic carbon emissions, PNAS., 109(45), 18318-18323(2012).
15. S. Liu, D. Day, J. Shields, L. Russell, Ozone-driven daytime formation of secondary organic aerosol containing carboxylic acid groups and alkane groups, Atmos. Chem. Phys., 11(16), 8321-8341(2011).
16. C. S. Zhu, J. J. Cao, C. J. Tsai, Z. S. Zhang, J. Tao, Biomass burning tracers in rural and urban ultrafine particles in Xi'an, Atmos. Pollut. Res., 8(4), 614-618(2017).
17. S. Mao, J. Li, Z. Cheng, G. Zhong, K. Li, X. Liu, G. Zhang, Contribution of biomass burning to ambient particulate polycyclic aromatic hydrocarbons at a regional background site in East China, Environ. Sci. Technol. Lett., 5(2), 56-61(2018).
18. P. Furman, K. Styszko, A. Skiba, D. Zieba, M. Zimnoch, M. Kistler, A. K. Giebl, S. Gilardoni, Seasonal variability of PM10 chemical composition including 1, 3, 5-triphenylbenzene, marker of plastic combustion and toxicity in Wadowice, South Poland, Aerosol Air Qual. Res., 21(3), 200223(2021).
19. R. Agarwal, K. Shukla, S. Kumar, S. G. Aggarwal, K. Kawamura, Chemical composition of waste burning organic aerosols at landfill and urban sites in Delhi, Atmos. Pollut. Res., 11(3), 554-565(2020).
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||