The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
제올라이트와 황화철(FeS) 여재의 중금속 흡착 특성
Abstract
Objectives
Adsorption characteristics in aqueous solution were investigated to effectively remove heavy metals by the crystallization of FeS and reaction kinetics were analyzed to compare with heavy metal adsorption characteristics of zeolite.
Methods
The adsorption characteristics of each media were analyzed using Langmuir adsorption isotherm, and the adsorption reaction kinetics of heavy metals (Pb, Cu, Zn) on zeolite and FeS media were analyzed by a pseudo-first or pseudo-second order reaction kinetics.
Results and Discussion
The maximum adsorption capacity of zeolite was highest in Pb, and the adsorption preference was in the order of Pb>Cu>Zn. In the case of FeS media, Cu was found to have a higher adsorption capacity than Pb or Zn, and the adsorption preference was observed to be Cu>Pb>Zn. It was found that the adsorption mechanism is based on chemical adsorption (chemisorption) because adsorption of each heavy metal onto zeolite or FeS media is more suitable for pseudo-second order kinetics.
Conclusions
It was found that the removal of heavy metals through FeS media has a different pattern from zeolite, and when comparing the adsorption capacity of each media, it was found that FeS media is more effective for Zn or Cu except Pb.
Key words: Heavy Metal Adsorption, Zeolite, FeS Media, Langmuir Adsorption Isotherm
요약
목적
FeS를 결정화하여 수중에서 효과적으로 중금속을 제거하기 위해 흡착 특성을 살펴보고, 화학적 반응기작을 해석하여 제올라이트의 중금속 흡착 특성과 비교 검토하였다.
방법
Langmuir adsorption isotherm을 이용하여 각 여재별 흡착특성을 해석하고 유사-일차 또는 유사-이차 반응식에 적용하여 제올라이트와 FeS 여재의 중금속(Pb, Cu, Zn) 흡착 반응기작을 해석하였다.
결과 및 토의
제올라이트의 최대 흡착능은 Pb에서 가장 높게 나타났으며, 흡착선호도는 Pb> Cu> Zn 순으로 나타났다. FeS 여재의 경우 Cu가 Pb이나 Zn에 비하여 높은 흡착능을 가지는 것으로 나타났으며 흡착선호도는 Cu> Pb> Zn으로 관찰되었다. 제올라이트 또는 FeS 여재에 각 중금속의 흡착은 유사-이차반응(pseudo-second order kinetics)에 적합하여 흡착기작은 화학적 흡착(chemisorption)에 의한다는 것을 알 수 있었다.
결론
FeS 여재를 통한 중금속 제거는 제올라이트와 다른 양상을 가진다는 것을 알 수 있었으며 각 여재의 흡착능을 비교하였을 때 Pb를 제외한 Zn이나 Cu의 경우 FeS 여재가 더 효과적이라는 것을 알 수 있었다.
주제어: 중금속 흡착, 제올라이트, FeS 여재, Langmuir 등온흡착식
1. 서 론
금속류 물질은 자연적으로 지질형성과정에서 발생하는 무기물질로 일부 금속은 인체에 필수적이고, 지표수나 지하수에서도 금속에 포함되어 있다. 이 중 식수에 포함될 경우 만성이나 급성독성을 일으키기도 하는 중금속은 자연발생 및 인위적 활동에 의해 오염된다[ 1, 2]. 중금속 오염은 주로 산업, 광업 및 농업이나 배출되는 폐기물에 의해 일어나고 특히 전기도금, 금속제련, 화학 산업 및 제조공정에서 많이 발생된다[ 3, 4]. 또한 일련의 제조기술의 고도화는 수중의 중금속 오염이라는 결과를 가지고 오고 있으며 종종 World Health Organization (WHO)나 Environmental Protection Agency (EPA)에서 제한하는 농도를 상회하는 농도의 중금속이 지표수나 식수에서 관측되고 있다[ 5]. 중금속은 섭취하였을 때 인체에 심각한 부작용을 일으킬 수 있으며 인체 중독에 많이 관련되어 있는 중금속은 철, 카드뮴, 구리, 아연, 크롬 등이다. 이들이 인체에 미치는 영향은 정신 및 중추신경기능이 손상되거나 혈액 성분의 불규칙성을 초래하여 신장이나 간과 같은 중요한 부분에 악영향을 미친다[ 6]. 구리는 필수적인 미량원소지만 과도한 섭취 시 독성을 일으킬 수 있고, 카드뮴은 저농도에서도 독성을 지니며 생물체와 생태계에 생물 축적을 일으키며 10년에서 33년의 생물학적 반감기를 가지고 있다. 망간, 철, 니켈과 같은 중금속은 효소 활동에 필요하지만, 중금속이 노출되거나 대량 섭취되는 경우 사람에게 큰 악영향을 끼치고 인체는 섭취, 흡수 및 흡입경로로 중금속에 노출된다[ 7]. 중금속 노출 경로는 흡수, 흡입 및 마지막으로 섭취이며 따라서 식수의 섭취가 중금속 노출의 주원인이 된다. 수중의 중금속을 제거하는 방법 중 가장 일반적인 방식이 침전에 의한 방법이다. 보편적으로 쓰이는 침전 방식은 하이드록시 침전(hydroxide precipitation) 방식이나 응집(coagulation/flocculation) 침전의 형태가 쓰이고 있으며 이중 하이드록시 침전 방식이 운전의 용이성이나 경제성, 적정 처리효율을 확보할 수 있는 적합한 대안으로 인식되고 있다[ 8]. 그러나 침전처리 기술이 가지는 단점은 높은 효율의 처리가 어렵고 많은 양의 독성 슬러지가 생성되므로 이를 위한 추가적인 처리가 필요하다는 단점이 있다[ 9]. 따라서 침전 처리방식 외 이온교환법이나 역삼투압법, 전기응집 또는 흡착제를 이용한 처리방법 등 다양한 처리방법에 대한 연구가 많이 진행되고 있다. 그러나 흡착제를 이용한 처리를 제외하고 연구되고 있는 다른 공정들은 침전법보다 중금속의 효율적인 제거라는 측면에서는 성과를 만족하지만 경제성 평가에 있어서 효율적인 제거 방법이라고 판단하기가 어렵다고 보고 있다[ 10- 12]. 흡착제를 이용한 중금속 제거에서는 제올라이트나 활성탄 등 공극이 있는 여재를 이용한 중금속 처리가 주로 이용되었으나 최근 연구에서는 dithiocarbamate를 이용한 금속리간드 형성기작을 이용하여 흡착능을 개선하거나 활성탄 표면을 sodium dithiocarbamate를 고정화하여 소수성 조건을 조성함으로서 중금속의 표면 흡착능을 더욱 가속화 시키는 연구가 수행되고 있다[ 13- 17]. 이러한 흡착제의 표면 개질과 같은 방법은 수중 중금속의 흡착반응을 더욱 가속화하는 결과를 제공하였다. 현재까지 중금속의 고도처리를 위한 여러 가지의 접근방법이 연구되고 있음에도 현장에서의 접근 방법은 복합적 처리방법의 적용이 불가피한 것은 개별 중금속의 물리화학적 특성이 다양하고 개별적 처리공법의 장점과 단점이 복합적으로 상존하기 때문이다[ 18]. 따라서 최근에는 제올라이트나 활성탄의 표면개질과 다른 형태의 흡착제로 입자상 FeS와 같은 광물흡착제를 이용한 중금속 흡착능에 대한 연구가 진행되고 있으며, 이는 황화철에 포함된 황이온을 이용한 중금속의 불용화 기작을 중심으로 연구가 진행되고 있다. 본 연구에서는 FeS를 결정화하여 수중에서 중금속의 흡착특성을 살펴보고자 하였으며, 그 방법으로 화학적 반응차수의 결정과 적정 등온흡착식을 산정하여 보았다. 반응차수는 유사-일차반응(Pseudo-first order equation)과 유사-이차반응(Pseudo-second order equation)으로 해석하여 보았으며, 흡착특성은 Langmuir adsorption isotherm을 사용하여 분석하였다. FeS 여재의 흡착특성은 많이 사용되고 있는 제올라이트의 중금속 흡착 결과와 비교함으로서 수중의 중금속 제거에 제올라이트 대체제로서 FeS 여재의 사용 가능성을 확인하였으며, 대표적인 중금속으로는 아연과 납, 그리고 구리를 채택하여 실험하였다.
2. 실험방법
2.1. 실험재료
실험에 사용된 제올라이트는 (주)금양소재산업에서 공급되는 재료로 실험하였으며 평균 직경은 약 3 mm이고, 밀도 2.48 g/cm 3, 공극률 26.79%, 비표면적은 23.67 m 2/g이였다. 실험실에서 제작된 FeS 입상여재는 FeS 13.7 g, CaCO 3 4 g, 그리고 Sodium Silicate 9 g을 증류수 9 mL에 넣어 잘 혼합한 후 5 mm 구형 여재 성형틀에 넣어 105℃에서 24시간 건조 후 사용하였다. FeS 입상여재의 평균입경은 약 4 mm이고, 비표면적은 2.26 m 2/g, 공극률은 10.88%이였다. FeS, PbCO 3, CuCl 2, ZnCl 2 등 시약은 특급으로 사용하였으며, 실험에 사용된 제올라이트와 FeS 입상여재는 Fig. 1에 나타내었다. 실험은 각각의 중금속(Pb, Cu, Zn)을 넣은 250 mL 세럼병에 약 200 mL의 증류수와 여재로 채운 후 125 rpm의 회전하는 항온조에서 반응하도록 하였으며, 시간에 따라 시료를 채취하였다. 항온조의 온도는 25℃로 유지하였으며 초기 pH는 약 Cu의 경우 6으로, Pb과 Zn의 경우 6.5로 조정하여 실험을 진행하였다.
2.2. 등온흡착실험
Langmuir adsorption isotherm은 단일 지점에 흡착하며 흡수제에 대하여 동일한 친화도를 가진다고 가정한다. 본 실험에서는 Pb, Cu, Zn에 대한 평형상태에서 Langmuir adsorption isotherm의 흡착능은 Eq. (1)을 이용하여 분석하였다[ 19]. 여기서 Ce는 평형농도(mg/L)이고, qm은 최대 흡착량(mg/g)이다. b는 결합에너지와 연관된 Langmuir adsorption coefficient (L/mg)이다. qe는 평형일 때 여재당 흡착량(x/M, mg/g)이다.
투입된 입상여재의 중금속에 대한 흡착기작 특성을 알아보기 위해 각기 입상여재의 투여량을 달리하여 흡착실험을 수행하였다. 각 입상여재의 흡착 기작은 유사-일차반응( Eq. (2)와 (3))과 유사-이차반응( Eq. (4)와 (5))으로 해석하였으며[ 20], 각 식에 대한 회귀분석을 위하여 SigmaPlot (ver. 10, Systat, USA)을 이용하였다. 여기서, qt와 qe는 일정시간 또는 평형일 때의 흡착능(mg/g)이다. Ks1 (L/min)은 유사-일차 방정식의 상수이고, Ks2 (g/mg・min)는 유사-이차 방정식의 상수이다.
2.3. 중금속 분석
중금속 분석기기는 Atomic Absorption Spectrophotometer (AAS, Perkin Elmer, USA)를 이용하였다. 먹는 물 수질공정시험기준[ 21]과 US EPA Method 7000A [ 22]에 따라 시료의 채수는 약 10 mL로 하고, Syringe membrane filter (0.45 µm) 여과한 후 약 60% 질산 1 mL를 넣어 polyethylene 용기에 넣어 냉장 보관하였다.
3. 결과 및 고찰
3.1. 제올라이트와 FeS 여재에 따른 중금속의 흡착등온곡선
제올라이트와 FeS 여재의 중금속 흡착특성을 살펴보기 위해 일정량의 제올라이트와 FeS 여재에 각기 다른 농도의 중금속을 넣은 후 흡착양상을 해석해 보았다. 제올라이트의 경우 70 mg/L의 Pb, 30 mg/L의 Cu, 그리고 30 mg/L의 Zn을 초기농도로 하고 제올라이트의 양은 Pb의 경우 0.5, 1, 2, 3 g, Cu의 경우 1, 4, 5 g, 그리고 Zn의 경우 2, 4, 8 g을 넣어 주었다. Fig. 2에 제올라이트 투입량에 따른 각 중금속의 농도변화 양상을 나타내었다. FeS 여재에 의한 중금속들의 흡착은 70 mg/L Pb, 30 mg/L 의 Cu, 그리고 30 mg/L의 Zn을 초기농도로 하여 시간에 따른 각 중금속의 흡착량을 측정하였다. 이때 사용된 FeS 여재의 양은 Pb의 경우 2, 3, 4, 5 g, Cu와 Zn의 경우 각각 1, 2, 3, 4, 5 g을 넣어 주었다. Fig. 3에 FeS 투입량에 따른 각 중금속의 농도변화 양상을 나타내었다. 제올라이트와 FeS 여재의 중금속 흡착특성은 Eq. (1)에서 제시된 Langmuir adsorption isotherm을 이용하여 분석하였다. Langmuir 방정식은 최대 흡착이 흡착제 표면에 있는 포화 흡착제 분자 단일 층에 해당하고 흡착 에너지가 일정하며 표면의 평면에서 흡착물의 전환이 없다는 가정을 기반으로 한다. Eq. (1)을 선형방정식으로 전환하여 산출한 Langmuir 상수 값들과 기존의 연구에서 보고된 최대흡착량과 Langmuir 상수 값을 Table 1에 나타내었다. Langmuir adsorption isotherm의 흡착 선호도를 비교하기 위해 R L=1/(1+b・C 0)을 이용할 수 있으며, 이 식의 C 0는 초기 중금속 농도이다[ 28]. Langmuir adsorption isotherm을 따르는 단층 흡착의 경우 R L > 1이면 비선호적, 0 < R L < 1이면 선호적, R L = 0이면 비가역적으로 정의되는데, 제올라이트의 경우 Pb, Cu, 그리고 Zn 에 따라 0 < R L < 1이므로 (Pb = 0.099, Cu = 0.323, Zn = 0.110) 단층 흡착에 선호적인 것으로 사료된다. FeS 여재에서 Pb, Cu, 그리고 Zn의 R L값도 0 < R L < 1사이로(Pb = 0.099, Cu = 0.074, Zn = 0.0015) 나타나 두 여재 모두 단층흡착을 선호하는 것으로 조사되었다.
Table 1에서 나타난 바와 같이 제올라이트의 경우 중금속의 최대흡착량은 제올라이트의 종류에 따라 편차가 있는 것으로 나타났는데, 이는 사용된 제올라이트의 성상이 균일하지 않고(비표면적: 15.13~45.87 m 2/g), 중금속의 흡착에 기여할 것으로 판단되는 양이온교환용량 역시 중금속의 흡착과 비례하지 않는 특성에 기인하는 것으로 판단된다[ 23]. 제올라이트의 형성과정에서 흡착선호도가 높은 교환성 양이온(K의 함유도)의 유무가 흡착량에 영향을 줄 수 있다고 보고되는 것과 같이 형성과정에서 천연 제올라이트의 성분은 중금속의 흡착에 매우 큰 영향을 주는 것으로 판단되었다. 본 실험을 포함한 제올라이트의 중금속 최대 흡착량의 범위는 Pb의 경우 최대 15.13~45.87 mg/g, Cu의 경우 1.10~26.09 mg/g, 그리고 Zn의 경우 0.43~55.02 mg/g으로 나타났으며, 이는 이전 연구에서 보고된 fly ash나 char coal의 최대흡착량보다 제올라이트가 높은 흡착 특성을 가진다는 것을 보여준다.
흡착 선호도에 있어서 본 실험에서 사용한 제올라이트의 경우 Zn이나 Cu에 비하여 높은 Pb에 의한 최대 흡착량(q m of Pb = 16.86 mg/g; q m of Cu = 1.10 mg/g; q m of Zn = 0.43 mg/g)을 보였으며, 흡착선호도는 Pb > Cu > Zn 순으로 나타났다. 이러한 천연 제올라이트의 Pb의 월등한 흡착선호도는 기존의 연구에서도 보고된 바 있다[ 23, 29]. FeS 여재의 경우 Cu가 Pb이나 Zn에 비하여 높은 최대 흡착량(q m of Pb = 2.35 mg/g; q m of Cu = 4.01 mg/g; q m of Zn = 1.25 mg/g)을 가지는 것으로 나타났으며, 따라서 FeS 여재에 의한 흡착선호도가 Cu > Pb > Zn이라는 것을 알 수 있었다. FeS에 의한 중금속(M 2+)의 대표적 제거기작은 Eq. (6) ~ Eq. (8)과 같이 화학적 침전(chemical precipitation)으로 진행되기도 하고, 이외에도 이온교환이나 표면 착화합물의 형성, 표면 흡착 등의 다양한 기작으로 제거될 수 있다고 보고된 바 있다[ 30]. 본 실험에서 PbS, CuS, 그리고 ZnS의 용해도적(K sp) 값이 각각 1 × 10 -28, 1 × 10 -36, 그리고 1 × 10 -23임을 고려하였을 때, FeS에 의한 흡착선호도는 중금속의 용해도적 값이 작을수록 흡착선호도가 크다는 것을 추론할 수 있다. 따라서 이온교환이나 표면 흡착 등이 주 제거기작인 제올라이트의 흡착기작은 FeS 여재의 중금속 흡착기작과 상이하고, 따라서 흡착선호도도 동일하지 않다는 것을 알 수 있었다.
3.2. 제올라이트와 FeS 여재의 흡착 동역학 실험
흡착반응은 흡착제와 중금속과의 흡수, 흡착, 이온교환, 침전, 그리고 표면상의 착이온결합 등 다양한 물리화학적 반응에 의해 진행된다. 따라서 흡착현상에 대한 해석은 많은 연구자들에 의해 시도되어 왔으며, 특히 반응차수에 대한 해석은 용액상 오염물질 흡착처리 반응을 이해하고 반응장치 설계의 매우 중요한 과정으로 인식되어 왔다. 초기의 흡착제와 중금속의 흡착반응은 고체상과 용액 계면상의 평형에 대한 가역반응으로 이해되었으며 여러 연구결과가 이에 따라 해석되었다[ 22]. 이후 흡착반응은 이온교환 흡착반응으로 인식이 되며 유사-일차반응의 적용이 타당하다고 판단되었으나 최근 화학적 흡착(chemisorption) 반응을 주반응으로 하는 유사-이차반응에 대한 해석이 시도되면서 기존의 반응 차수의 적용이 적절하지 않을 수 있음이 지적되기도 하였다[ 20, 31]. 제올라이트와 FeS 여재의 흡착현상을 살펴보기 위해 실험결과를 Eq. (2)과 Eq. (5)에 적용하여 살펴보았다. 제올라이트에 의한 흡착 동역학 해석을 위해 20 g의 제올라이트를 사용하였으며, Pb의 경우 50, 70 mg/L의 초기 농도를 설정하였다. Cu와 Zn의 경우 10 mg/L와 30 mg/L의 초기농도를 사용하였다. Fig. 4에 나타난 바와 같이 제올라이트에 의한 각 중금속의 흡착동역학 특성은 유사-일차반응보다는 유사-이차반응으로 더욱 잘 묘사되었다. 제올라이트 흡착 동역학 실험과 동일하게 20 g의 FeS 여재를 사용하여 반응차수를 해석하였다. Pb의 경우 50, 70 mg/L로 초기 농도를 설정하였으며 Cu와 Zn의 경우 10, 30 mg/L의 초기농도를 사용하였다. FeS 여재에 의한 각 중금속의 초기농도에 따른 흡착양상을 회귀분석하여 Fig. 5에 도식하였다.
Table 2에 나타난 바와 같이 제올라이트 또는 FeS 여재에 의한 유사-일차반응식 회귀분석 값이(0.665 < R 2 of zeolite <0.994, 0.655< R 2 of FeS <0.966) 유사-이차반응으로 회귀분석된 결과보다(0.996 < R 2 of zeolite <1.000, 0.987< R 2 of FeS <0.999) 낮게 나왔음을 알 수 있었다. 이는 제올라이트나 FeS 여재에 의한 각 중금속의 흡착동역학은 유사-이차반응으로 더욱 적절히 묘사될 수 있다는 것을 의미하는 것으로, 이는 제올라이트와 FeS 여재의 흡착 반응이 화학적 흡착(chemisorption)에 의한다는 것을 의미한다.
유사-이차반응식의 반응상수(K s2) 값은 평형상태에서 흡착량(q e)에 도달하는 속도의 관계로 정의하였을 때, Table 2에 나타나는 중금속 흡착반응의 경향은 낮은 농도에서 반응상수 값이 크게 나타나고, 이는 낮은 농도에서 평형 흡착량에 도달하는 속도가 빠르다는 것을 의미한다. 이러한 반응상수 값을 가지는 중금속의 흡착양상은 기존의 연구에서도 나타난 바 있다[ 20]. 본 실험에 사용된 여재와 기존에 연구된 여재의 흡착특성을 비교하기 위해 흡착제의 종류에 따라 흡착반응의 반응차수를 Table 3에 나타내어 보았다. Kaolinitic clay, wollastonite, 또는 phillipsite와 같은 점토성 입자에서는 용액상 막의 확산이나 내부 입자의 확산이 반응제한요소가 되는 유사-일차반응이 적합하게 적용되는 것으로 보고되었다[ 32, 33, 35]. 제올라이트의 경우 유사-일차반응이나 유사-이차반응으로 반응차수가의 적합도가 다양하게 나타날 수 있는데, 이는 천연 제올라이트의 생성 과정의 다양성이 흡착반응의 반응형태를 다양하게 나타내는 것이라고 판단하였다. 따라서 천연 제올라이트의 실적용에 있어서 반응차수의 해석은 선행되어져야하는 과정으로 이해되었다. FeS 여재를 이용한 중금속 흡착 반응은 유사-이차반응으로 해석되었으며, 이에 대한 기존의 연구결과는 보고된 바 없어 본 실험에서 제시하는 반응의 형태는 타 연구자들이 중금속의 FeS 여재의 흡착반응을 이해하는데 도움을 줄 수 있을 것으로 판단되었다. 또한 경제적 측면에서 제올라이트 Kg당 가격이 4,000원(**산업, 경남 김해시) 정도이고 공업용 FeS의 가격이 500원(**케미컬, 부산시 사상구) 정도인 점을 고려하면 FeS의 제올라이트의 대체재로서 활용은 경제성이 충분하다고 판단하였다. 더욱이 철강 슬래그와 같은 산업부산물을 제올라이트 대체제로 활용하는 것은 보다 친환경적이고, 경제성 있는 대체제의 확보라는 측면에서 추후 후속 연구로 진행되는 것이 바람직할 것으로 판단된다.
4. 결 론
본 연구에서 제올라이트와 FeS 여재를 이용하여 수중에서 중금속(Pb, Cu, Zn)의 흡착 특성을 살펴보았다. Langmuir 등온흡착식과 유사-일차반응식 또는 유사-이차반응식을 이용하여 흡착특성을 해석하였을 때 도출된 결과를 아래에 요약하였다.
1) 제올라이트와 FeS 여재에 흡착은 단층흡착을 나타내는 Langmuir adsorption isotherm으로 흡착형태를 적절하게 해석할 수 있었으며(0.922 < R2 of zeolite< 0.997, 0.878 < R2 of FeS 여재 < 0.965), 제올라이트의 경우 RL값은 Pb, Cu, Zn에서 0.099, 0.323, 그리고 0.110으로 산출되었으며, FeS 여재에서는 0.099, 0.074, 그리고 0.0015로 나타나 본 실험에서 사용된 제올라이트와 FeS 여재의 흡착은 단층흡착을 선호하는 것으로 조사되었다.
2)제올라이트의 최대 흡착능은 Pb에서 가장 높게 나타났으며(qm of Pb = 16.86 mg/g; qm of Cu = 1.10 mg/g; qm of Zn = 0.51 mg/g), 흡착선호도는 Pb>Cu>Zn 순으로 나타났다. FeS 여재의 경우 Cu가 Pb이나 Zn에 비하여 높은 최대 흡착능(qm of Pb = 2.35 mg/g; qm of Cu = 4.01 mg/g; qm of Zn = 1.25 mg/g)을 가지는 것으로 나타났으며 흡착선호도는 Cu>Pb>Zn으로 관찰되었다. 최대 흡착량(qm)으로 제올라이트와 FeS 여재의 흡착능을 비교하였을 때 Pb를 제외한 Zn이나 Cu의 경우 FeS 여재가 더 효과적이라는 것을 알 수 있었다.
3) 유사-일차반응식 또는 유사-이차반응으로 회귀분석된 결과로 보았을 때 제올라이트에 의한 유사-일차반응식 회귀분석의 R2 값이(0.665<R2<0.994) 유사-이차반응으로 회귀분석된 결과보다(0.988<R2<1.000) 낮게 나왔음을 알 수 있었다. FeS 여재 역시 유사-일차반응식 회귀분석의 R2 값이(0.655<R2<0.966) 유사-이차반응으로 회귀분석된 결과보다(0.987<R2<1.000) 낮게 나왔음을 알 수 있었다. 이는 제올라이트 또는 FeS 여재에 각 중금속의 흡착은 화학적 흡착(chemisorption)에 의한다는 것을 알 수 있었다.
Acknowledgments
본 연구는 서울과학기술대학교 학술연구비의 지원으로 수행되었습니다(과제번호: 2020-0372). 이에 감사드립니다.
Fig. 1.
Shape of the granule type media. (a) zeolite, (b) FeS 
Fig. 2.
Variation of heavy metal concentration in the presence of zeolite; (a) C0=70 mg/L of Pb; (b) C0=30 mg/L of Cu; and (c) C0=30 mg/L of Zn. 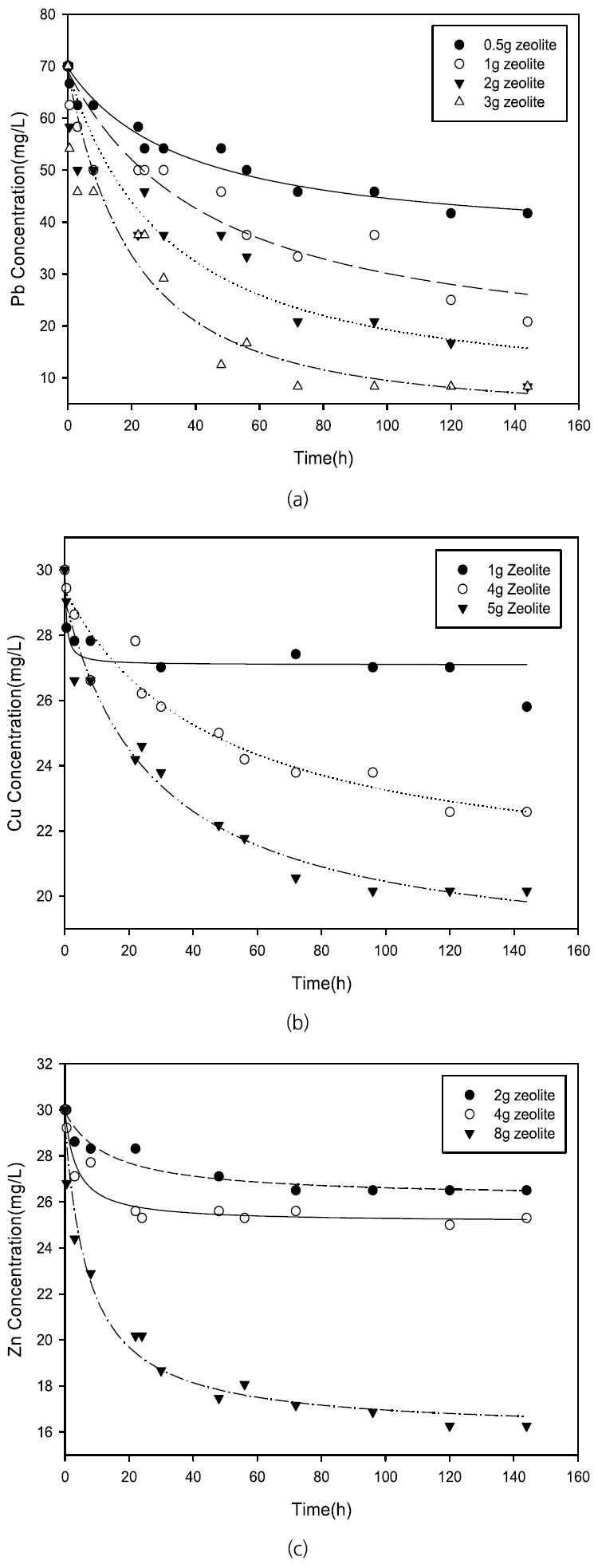
Fig. 3.
Variation of heavy metal concentration in the presence of FeS media; (a) C0=70 mg/L of Pb; (b) C0=30 mg/L of Cu; and (c) C0=30 mg/L of Zn. 
Fig. 4.
Linearization of pseudo-first and second order reaction of (a) Pb, (b) Cu, and (c) Zn absorption in the presence of zeolite. 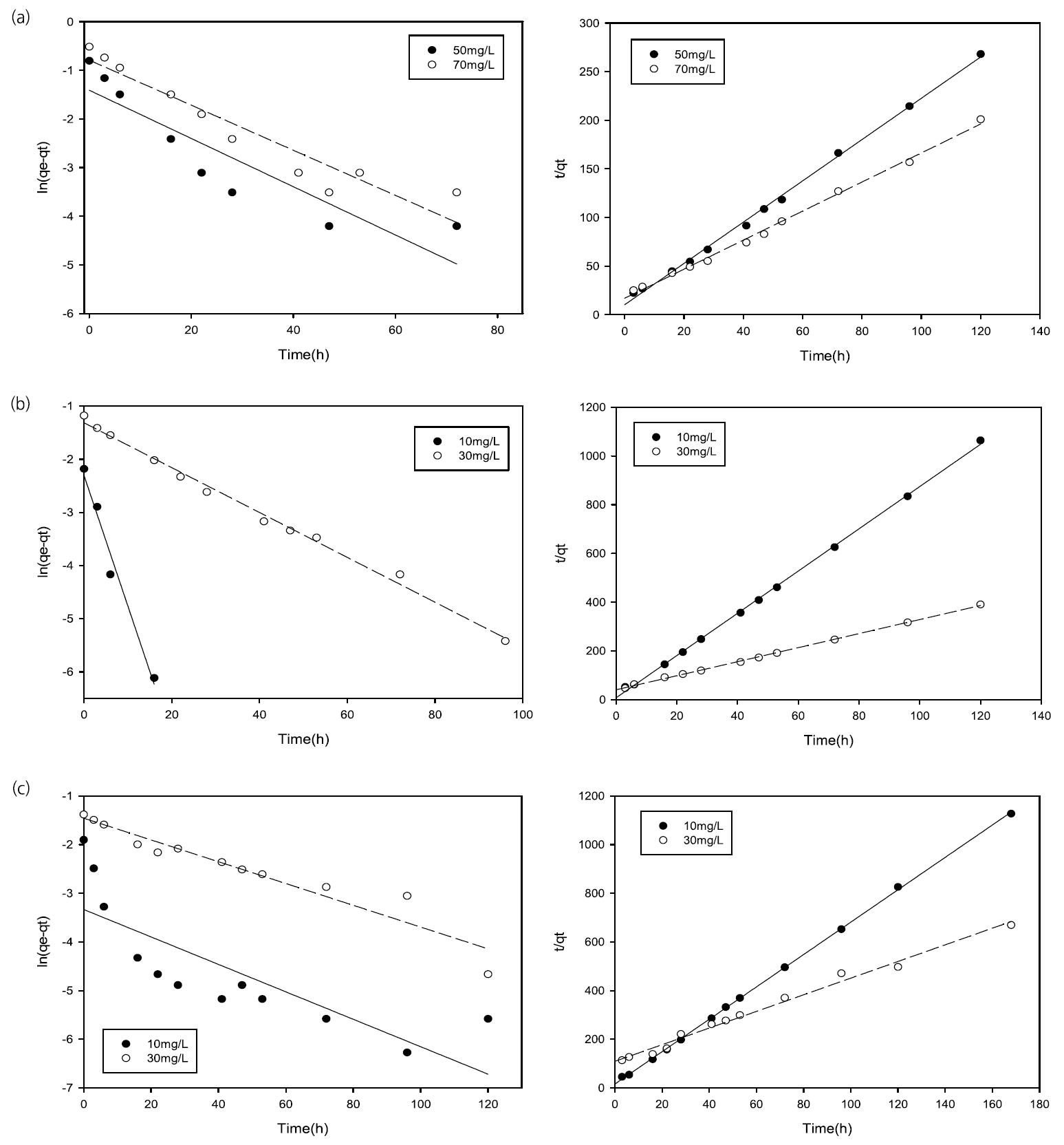
Fig. 5.
Linearization of pseudo-first and second order reaction of (a) Pb, (b) Cu, and (c) Zn absorption in the presence of FeS media. 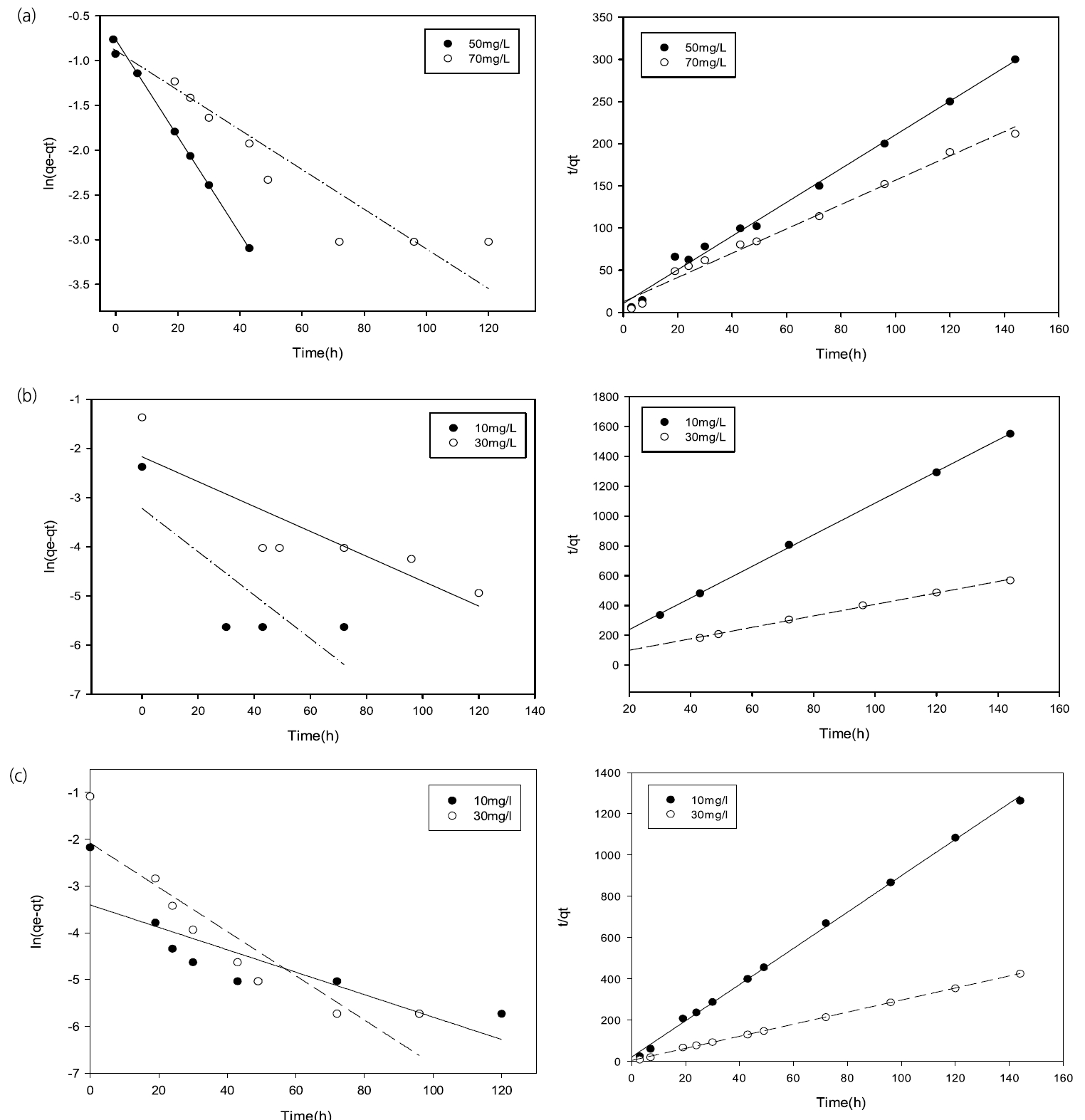
Table 1.
Langmuir adsorption isotherm fitting parameters for zeolite and FeS media absorption of Pb, Cu, and Zn.
Pb
|
Cu
|
Zn
|
Media |
R2
|
Reference |
|
qm (mg/g) |
b (L/mg) |
qm (mg/g) |
b (L/mg) |
qm (mg/g) |
b (L/mg) |
|
25.38 |
0.04 |
2.58 |
0.11 |
2.41 |
0.08 |
Sediment |
0.980-0.990 |
[23] |
|
45.87 |
0.004 |
|
|
8.63 |
0.003 |
Zeolite |
0.880-0.900 |
[24] |
|
|
1.12 |
8.66 |
1.32 |
1.7 |
Zeolite |
0.967-0.978 |
[25] |
|
|
0.18 |
21.12 |
0.18 |
7.0 |
Fly ash |
0.978-0.990 |
[25] |
|
|
0.35 |
4.07 |
0.37 |
1.99 |
Char oal |
0.967-0.985 |
[25] |
|
15.13 |
0.02 |
12.64 |
0.03 |
|
|
Zeolite |
0.948-0.967 |
[26] |
|
|
25.25 |
115.82 |
17.48 |
75.82 |
Zeolite |
0.979-0.995 |
[27] |
|
|
16.99 |
37.2 |
17.83 |
22.05 |
Zeolite |
0.945-0.994 |
[27] |
|
|
26.09 |
81.2 |
55.02 |
76.66 |
Zeolite |
0.961-0.990 |
[27] |
|
16.86 |
0.13 |
1.10 |
0.04 |
0.43 |
0.27 |
Zeolite |
0.922-0.997 |
This study |
|
2.35 |
5.57 |
4.01 |
0.42 |
1.25 |
0.21 |
FeS media |
0.878-0.965 |
This study |
Table 2.
Adsorption kinetics rate constants and R2 values of Pb, Cu, and Zn using zeolite and FeS media.
|
C0 (mg/L) |
Pseudo-first order reaction
|
Pseudo-second order reaction
|
|
Ks1 (h-1) |
R2
|
Ks2 (g/(mg・h)) |
R2
|
|
Zeolite |
Pb |
50 |
0.050 |
0.820 |
0.442 |
0.998 |
|
70 |
0.046 |
0.909 |
0.132 |
0.996 |
|
Cu |
10 |
0.245 |
0.977 |
10.14 |
0.999 |
|
30 |
0.042 |
0.994 |
0.205 |
0.999 |
|
Zn |
10 |
0.028 |
0.665 |
2.790 |
1.000 |
|
30 |
0.022 |
0.919 |
0.107 |
0.988 |
|
FeS Media |
Pb |
50 |
0.054 |
0.966 |
0.381 |
0.993 |
|
70 |
0.022 |
0.861 |
0.166 |
0.987 |
|
Cu |
10 |
0.044 |
0.655 |
4.173 |
0.999 |
|
30 |
0.025 |
0.762 |
0.639 |
0.999 |
|
Zn |
10 |
0.024 |
0.713 |
3.694 |
0.999 |
|
30 |
0.047 |
0.842 |
1.707 |
0.999 |
Table 3.
Comparison of sorption process mechanism according to the adsorbents.
|
Sorbent |
Solute |
Model |
Reference |
|
Activated carbon |
Cr, Ni, Zn |
Pseudo-second order |
[31] |
|
Kaolinitic clay |
Pb(II) |
First order |
[32] |
|
Wollastonite |
Ni(II) |
Pseudo-first order |
[33] |
|
Zeolite |
Cd, Cu, Mn, Ni, Pb, Zn |
Pseudo-second order |
[34] |
|
Rod-shaped phillipsite |
Ni |
Pseudo-first order |
[35] |
|
Zeolite |
Cd, Ni |
Pseudo-first order |
[36] |
|
FeS |
Pb, Cu, Zn |
Pseudo-second order |
This study |
|
Zeolite |
Pb, Cu, Zn |
Pseudo-second order |
This study |
References
1. S. Khan, M. Shahnaz, N. Jehan, S. Rehman, M. T. Shah, I. Din, Drinking water quality and human health risk in Charsadda district, Pakistan, J. Clean. Prod., 60, 93-101(2013).  2. J. He, L. Charlet, A review of arsenic presence in China drinking water, J. Hydrol., 492, 79-88(2013).  3. K. Kadirvelu, K. Thamaraiselvi, C. Namasivayam, Removal of heavy metals from industrial wastewaters by adsorption onto activated carbon prepared from an agricultural solid waste, Bioresour. Technol., 76, 63-65(2001).  4. A. R. Yeddou, S. Chergui, A. Chergui, F. Halet, A. Hamza, B. Nadjemi, A. Ould-Dris, J. Belkouch, Removal of cyanide in aqueous solution by oxidation with hydrogen peroxide in presence of copper-impregnated activated carbon, Miner. Eng., 24, 788-793(2011).  5. A. Celik, A. Demirbas, Removal of heavy metal ions from aqueous solutions via adsorption onto modified lignin from pulping wastes, Energ. Source., 27, 1167-1177(2005).  6. V. C. Mohod, D. Jayashree, Review of heavy metals in drinking water and their effect on human health, Inter. J. Innov. Res. Sci., 7, 2292-2296(2013).
7. Y. N. Jolly, A. Islam, S. Akbar, Transfer of metals from soil to vegetables and possible health risk assessment, SpringerPlus, 2(1), 385(2013).  8. N. Kuyucak, A. Akcil, Cyanide and removal options from effluents in gold mining and metallurgical processes, Miner. Eng., 50, 13-29(2013).  9. H. A. Aziz, M. N. Adlan, K. S. Ariffin, Heavy metals (Cd, Pb, Zn, Ni, Cu and Cr(III)) removal from water in Malaysia: post treatment by high quality limestone, Bioresour. Technol., 99, 1578-1583(2008).  10. S. Tangjuank, N. Insuk, J. Tontrakoon, V. Udeye, Adsorption of lead(II) and cadmium(II) ions from aqueous solutions by adsorption on activated carbon prepared from cashew nut shells, World Acad. Sci. Eng. Technol., 52, 110-116(2009).
11. S. E. Bailey, T. J. Olin, R. M. Bricka, D. D. Adrian, A review of potentially low-cost sorbents for heavy metals, Water Res., 33(11), 2469-2479(1999).  12. R. Ahmad, I. Hasan, Efficient remediation of an aquatic environment contaminated by Cr(VI) and 2,4-dinitrophenol by XG-g-polyaniline@ZnO nanocomposite, J. Chem. Eng. Data., 62, 1594-1607(2017).  13. R. Say, E. Birlik, A. Denizli, A. Ersoz, Removal of heavy metal ions by dithiocarbamate-anchored polymer/organosmectite composites, Appl. Clay Sci., 31, 298-305(2006).  14. F. Fu, H. Zeng, Q. Cai, R. Qiu, J. Yu, Y. Xiong, Effective removal of coordinated copper from wastewater using a new dithiocarbamate-type supramolecular heavy metal precipitant, Chemosphere, 69, 1783-1789(2007).  15. L. Bai, H. Hu, W. Fu, J. Wan, X. Cheng, L. Zhuge, L. Xiong, Q. Chen, Synthesis of a novel silica-supported dithiocarbamate adsorbent and its properties for the removal of heavy metal ions, J. Hazard. Mater., 195, 261-275(2011).  16. R. Abu-El-Halawa, S. A. Zabin, Removal efficiency of Pb, Cd, Cu and Zn from polluted water using dithiocarbamate ligands, J. Taibah Univ. Sci., 11, 57-65(2017).  17. L. Monser, N. Adhoum, Modified activated carbon for the removal of copper, zinc, chromium and cyanide from wastewater, Separ. Purif. Technol., 26, 137-146(2002).  18. C. F. Carolin, P. A. Kumar, A. Saravanana, G. J. Joshiba, M. Naushad, Efficient techniques for the removal of toxic heavy metals from aquatic environment: a review, J. Environ. Chem. Eng., 5(3), 2782-2799(2017).  19. A. S. Thajeel, Isotherm, kinetic and thermodynamic of adsorption of heavy metal ions onto local activated carbon, Aquat. Sci. Technol., 1, 53-77(2013).  20. Y. S. Ho, G. McKay, Pseudo-second order model for sorption processes, Process Biochem., 34(5), 451-465(1999).  21. Test for Quality of Drinking Water, Ministry of Environment, Notification No 2007-146, Republic of Korea(2007).
22. United States Environmental Protection Agency, Metals by AA (Atomic Absorption Methods), ctntes.arpa.piemonte.it(1992).
23. J. H. Noh, Study of utilization of natural zeolite as functional materials for water purification (II): adsorption properties of heavy metal ions by domestic zeolites, J. Miner. Soc. Korea., 16(3), 201-213(2003).
24. P. S. Kwon, S. Patrick, S. Rahim, J. B. Park, Assessment of zeolite soil mixture as adsorptive fill material at industrial zones, J. Kor. Soc. Civil. Eng., 39(1), 203-209(2019).
25. O. E. A. Salam, N. A. Reiad, M. M. ElShafei, A study of the removal characteristics of heavy metals from wastewater by low-cost adsorbents, J. Adv. Res., 2(4), 297-303(2011).  26. E. C. Shin, J. J. Park, C. G. Jeong, S. H. Kim, Adsorption characteristics evaluation of natural zeolite for heavy-metal contaminated material remediation, J. Kor. Geosynth. Soc., 13(2), 59-67(2014).  27. K. Kang, W. H. Shin, S. G. Hong, Y. K. Kim, S. J. Park, Applicability of natural zeolite with different cation exchange capacity as in-situ capping materials for adsorbing heavy metals, J. Korean Soc. Environ. Eng., 39(2), 51-58(2017).  28. G. Alagumuthu, V. Veeraputhiran, R. Venkataraman, Adsorption isotherms on fluoride removal: batch techniques, Arch. Appl. Sci. Res., 2(4), 170-185(2010).
29. D. C. Seo, K. Yu, R. D. DeLaune, Comparison of monometal and multimetal adsorption in Mississippi River alluvial wetland sediment: batch and column experiments, Chemosphere, 73(11), 1757-1764(2008).  30. Y. Gong, J. Tang, D. Zhao, Application of iron sulfide particles for groundwater and soil remediation: a review, Water Res., 89, 309-320(2016).  31. T. K. Kim, T. Kim, W. S. Choe, M. K. Kim, Y. J. Jung, K. D. Zoh, Removal of heavy metals in electroplating wastewater by powdered activated carbon (PAC) and sodium diethyldithiocarbamate-modified PAC, Environ. Eng. Res., 23(3), 301-308(2018).  32. F. F. Orumwense, Removal of lead from water by adsorption on a kaolinitic clay, J. Chem. Technol. Biotechnol., 65(4), 363-369(1996).  33. Y. C. Sharma, G. S. Gupta, G. Prasad, D. C. Rupainwar, Use of wollastonite in the removal of Ni (II) from aqueous solutions, Water Air Soil Pollut., 49(1-2), 69-79(1990).  34. Q. Qiu, X. Jiang, G. Lv, Z. Chen, S. Lu, M. Ni, J. Yan, X. Deng, Adsorption of heavy metal ions using zeolite materials of municipal solid waste incineration fly ash modified by microwave-assisted hydrothermal treatment, Powder Technol., 335, 156-163(2018).  35. P. Y. He, Y. J. Zhang, H. Chen, Z. C. Han, L. C. Liu, One-step synthesis of rod-shaped phillipsite using circulating fluidized bed fly ash and its application for removal heavy metal, Ferroelectrics, 547(1), 51-58(2019).  36. K. He, Y. Chen, Z. Tang, Y. Hu, Removal of heavy metal ions from aqueous solution by zeolite synthesized from fly ash, Environ. Sci. Pollut. Res., 23(3), 2778-2788(2016). 
|
|















