The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
PVA/Alginate 담체를 충진한 아질산화조에서 부분 아질산화 효율에 영향을 미치는 주요 운전 인자
Abstract
Objectives
The purpose of this study was to investigate key operating parameters for partial nitritation in the nitritation reactor packed with PVA (polyvinyl alcohol)/alginate carrier.
Methods
Partial nitritation was conducted in a 2 L reactor packed with PVA/alginate carrier of 30%. Dissolved oxygen (DO) concentration was considered as the main operating parameters. Raw reject water was used as the influent, and the ammonium concentration of the influent was adjusted with dilution at the beginning of operation. The DO concentration in the reactor was maintained at 3~4 mg O2/L. The activity test of ammonia oxidizing bacteria (AOB) and nitrite oxidizing bacteria (NOB) was conducted periodically. The effect of the operating parameters applied in this study was verified through analysis of microbial community.
Results and Discussion
The stable performance for partial nitritation was achieved at operation time of 17 days. Thereafter, the reject water containing 683.6±73.5 mg NH4+-N/L was introduced without dilution. Although the DO concentration was maintained at 3~4 mg O2/L, stable partial nitritation was achieved for a long time, resulting in effluent NO2-N/NH4+-N of 0.94±0.07 and maximum nitrite production rate of 2.24 kgN/m3/d. This was confirmed to be due to DO diffusion limitation inside PVA/alginate carrier, whereby the NOB activity could be effectively inhibited. Microbial community analysis also showed that NOB fraction inside the carrier was reduced to 0.09%. It indicated that partial nitritation using the PVA/alginate carrier was effective for selective inhibition of the NOB.
Conclusions
In the case of using the whole cell entrapment technique, effective inhibition of NOB was possible by keeping the DO concentration inside the carrier low despite the fluctuation of DO in the reactor. The results of these findings may help improve the stability of the process in the field.
Key words: Ammonia Oxidizing Bacteria, Nitrite Oxidizing Bacteria, Partial Nitritation, PVA/Alginate, Whole Cell Entrapment
요약
목적
본 연구에서는 PVA/alginate 담체가 충진된 반응조에서 안정적인 부분 아질산화를 위한 주요 운전 인자에 대해 조사하였다.
방법
30%의 PVA/alginate 담체가 충진된 2 L의 반응조에서 부분 아질산화 연구를 수행하였으며, 반응조 내 DO 농도는 주요 운전 인자로 고려되었다. 유입수는 실제 반류수를 사용하였으며, 운전 초기 유입수 내 질소 농도는 희석을 통하여 조절하였다. 반응조 내 DO 농도는 3~4 mg O2/L로 유지되었다. 암모늄 산화 미생물과 아질산염 산화 미생물의 활성은 주기적으로 측정하였고, 미생물 군집 분석을 통하여 운전 효율에 따른 미생물 군집 특성은 조사하였다.
결과 및 토의
운전 17일부터 안정적인 부분 아질산화는 달성될 수 있었다. 이후 유입수는 희석 없이 683.6±73.5 mg NH4+-N/L를 포함하는 실제 반류수를 유입수로 사용하였다. 반응조 내 DO 농도가 3~4 mg O2/L로 유지되었음에도 불구하고 유입 암모늄은 장기간 안정적으로 부분 아질산화되었고, 이때 유출 NO2-N/NH4+-N비와 최대 NPR (nitrite production rate)는 각각 0.94±0.07, 2.24 kgN/m3/d로 나타났다. 이러한 연구 결과는 PVA/alginate 담체 내부에서의 DO 투과 실험 조사 결과로부터 담체 내부에서의 DO 확산 제한 효과에 의한 것으로 나타났다. 담체 내부 NOB 비율은 0.09%까지 감소하였고, 이는 NOB의 선택적 저해에 포괄 고정화 기술의 장점이 효과적으로 작용하였다는 것을 의미한다.
결론
포괄 고정화 기술을 적용할 경우 반응조 내 DO 농도가 변동되더라도 담체 내부의 DO 농도를 낮게 유지함으로써 NOB의 효과적인 저해가 가능하였다. 이러한 연구 결과는 다양한 운전 인자가 변동되는 현장 조건에서 효과적으로 적용될 수 있을 것이다.
주제어: 암모늄 산화 미생물, 아질산염 산화 미생물, 부분 아질산화, PVA/alginate, 포괄 고정화
1. 서 론
혐기성 암모늄 산화(ANaerobic, AMMonium OXidation, ANAMMOX) 미생물은 혐기성 조건에서 암모늄을 산화시킬 수 있는 특이한 질소 제거 경로를 지니고 있으며, 이때 아질산염은 전자 수용체로 사용된다[ 1, 2]. ANAMMOX 미생물의 화학양론식에 의하면 1 mol의 암모늄을 산화시키기 위하여 1.32 mol의 아질산염이 요구되며, 부산물로써 0.26 mol의 질산염이 생성된다. ANAMMOX 미생물을 이용한 공정은 유입 암모늄을 부분 아질산화시키기 위한 전처리 공정과 결합되어 사용되며, 소화 슬러지 탈리액, 음폐수, 매립지 침출수 등 고농도의 질소 화합물을 함유하고 있는 폐수들을 대상으로 주로 적용되었다[ 3- 5]. 아질산염은 ANAMMOX 미생물의 기질이면서도, 강한 저해제로 고려된다. 다양한 연구를 통하여 아질산염에 대한 ANAMMOX 미생물의 독성 영향은 보고되었다[ 6]. 따라서 아나목스 공정의 안정성을 향상시키기 위해서는 전처리 단계인 부분 아질산화 공정에서의 안정적인 질소 전환 효율은 동반되어야만 할 것이다[ 7, 8]. 질산화 미생물은 크게 암모늄을 아질산염으로 산화시키는 AOB (ammonia oxidizing bacteria)와 아질산염을 질산염으로 산화시키는 NOB (nitrite oxidizing bacteria)로 분류되며, 부분 아질산화 반응을 위하여 NOB의 활성은 선택적으로 저해되어야만 한다. 이를 위한 다양한 운전 인자는 연구되어 왔다; 1) AOB보다 NOB에 강하게 적용되는 FA (freaa ammonia), FNA (free nitrous acid)에 독성 영향을 이용한 부분 아질산화 전략, 2) AOB와 NOB의 산소 친화도 차이를 이용한 1.0 mg O 2/L 이하의 낮은 DO 농도 조절 전략, 3) AOB의 성장 속도가 NOB보다 높게 유지되는 35℃ 이상의 수온 조건에의 짧은 SRT 조절 전략이 대표적인 부분 아질산화 제어 인자로써 고려되고 있다[ 9, 10]. 하지만 주목할 점은 많은 연구자들이 이러한 제어인자를 통하여 성공적인 부분 아질산화 반응을 달성하였음에도 불구하고 반응기 내 NOB 미생물은 사멸 또는 wash-out되지 않고 지속적으로 존재하고 있다는 점이다. SNAD 공법으로 매립지 침출수를 처리하는 SBBR에서 Nitrobacter sp.과 Nitrospira spp.는 지속적으로 발견되었다고 보고하였다[ 11]. 이러한 현상은 whole cell entrapment technique를 적용할 경우 더욱 명백하게 드러난다. Polyvinyl alcohol (PVA) or polyethylene (PEG) 담체를 이용한 부분 아질산화 반응조에서는 AOB뿐만 아니라 NOB가 항상 공존하는 것으로 보고되었다[ 12, 13]. 운전 초기 NOB 활성도는 높은 FA농도로 인하여 암모늄의 65%가 아질산염으로 축적되었지만 일정한 FA농도에서 장기간 노출될 경우 NOB의 순응으로 인하여 질산염이 축적되기 시작하였다고 보고되었다[ 14]. 부분 아질산화 제어 인자로 온도를 사용할 경우 일반적인 하・폐수의 온도가 25℃ 이하이기 때문에 물의 온도를 높이기 위한 에너지를 고려하면 혐기성 소화 탈리액과 같은 특정한 폐수에만 적용이 가능한 단점이 존재한다[ 15]. 또한 성장속도가 느린 ANAMMOX 미생물과 함께 단일반응기에서 운전될 경우 높은 온도와 짧은 SRT를 요구하는 SHARON 시스템은 적용될 수 없을 뿐만 아니라 미생물 고정화 방법을 이용한 공법에서는 NOB의 wash-out을 인위적으로 유도하기 어려워 안정적인 부분 아질산화 반응을 달성하는데 어려움이 있다[ 16]. 합성 폴리머를 이용한 미생물 포괄 고정화 기법은 운전 초기 활성도가 높은 미생물을 반응기 내에 효과적으로 보유 가능하게 하며 시운전 기간을 단축시킬 수 있는 장점이 있으며, 미생물이 고정화된 담체를 제작하는데 비교적 짧은 시간이 요구되는 장점이 있다. 생물 반응 시스템에 적용되는 합성 폴리머는 urethane, polyethylene glycol (PEG), polyvinyl alcohol (PVA)물질이 대표적으로 사용되고 있으나, PVA는 다른 폴리머에 비해 비교적 경제적이면서도 미생물에 독성을 나타내지 않는 친수성 합성수지로 보고되고 있다[ 6, 17]. 고농도 질소 함유 폐수를 처리하는 과정에서 부분 아질산화를 위한 가장 대표적인 운전 인자로 DO 농도 조절 전략이 사용되고 있다. NOB의 선택적 저해를 위하여 1.0 mg O 2/L 이하의 낮은 DO 농도는 적용되고 있으며, 이는 AOB와 NOB의 산소 친화도 차이를 고려한 운전 인자이다[ 18]. 하지만 실험실 규모가 아닌 대규모 반응조를 이용할 경우 다양한 변수(운전 조건 변화, 유입수 성상 변화 등)에 의하여 반응조 내 DO 농도를 일정하게 유지하기 어렵다[ 19]. 이는 부분 아질산화 운전 효율에 큰 영향을 미치는 문제이므로, 결국 ANAMMOX 공정에 의한 질소 제거능을 악화시키는 요인으로 작용하게 될 것이다. 본 연구에서는 이를 극복하기 위하여 실제 혐기성 소화 탈리액을 대상으로 PVA에 고정화된 미생물을 이용한 부분 아질산화 시스템을 적용하여, NOB의 선택적 저해를 위한 운전 인자에 대하여 조사하였다. 또한 실험 조건별 미생물 군집 특성을 분석하여 적용된 운전인자가 AOB와 NOB의 군집특성에 미치는 영향을 조사하였다.
2. 실험방법
2.1. 미생물 포괄 고정화
Auto clave에서 120℃에서 20분 동안 열을 가하여 PVA polymer (100% saponification, 2000 polymerization, Wako Co., Ltd, Japan)와 sodium alginate (DAEJUNG Co., Ltd, Korea)가 용해된 혼합액을 제조하였고, 실험실 온도까지 냉각한 후 채취된 미생물을 1:1 비율로 혼합하였다. 채취된 미생물은 경산 폐수처리장에서 운영중인 A2/O반응조로부터 채취되었으며, 혼합 당시 미생물 농도는 19.9 gVSS/L였다. 제조된 혼합물은 H3BO3 (55 g/L)과 CaCl2 (10 g/L)혼합 용액에 미량펌프를 이용하여 천천히 떨어뜨려 둥근 모양의 겔을 형성하였으며 기계적인 강도를 높이기 위하여 실험실 온도(25℃)에서 하루 동안 교반하였다. 이후 증류수로 세척한 다음 본 실험에 사용하였다. 제조된 겔의 PVA, sodium alginate, 미생물의 최종 농도는 각각 7.5%, 1%, 1% (w/v)였으며, 3.6±0.5 mm 크기로 제조된 겔 최종 부피는 300 mL였다.
2.2. 반응조 운전 조건
CSTR (continuous stirred tank reactor)형태로 운전된 실험실 규모의 반응기는 높이와 부피가 각각 255 mm와 2 L로 제작되었으며, working volume은 1.5 L이었다. PVA/alginate 담체는 반응조에 30% 충진되었으며, 반응조로부터 유실을 제어하기 위하여 반응조 유출 라인에 2 mm의 hole size의 스크린이 설치되었다. 유입수는 경산 하수처리장에서 채취된 혐기성 소화 탈리액을 이용하였으며, 성상은 Table 1에 나타내었다. DO 농도는 air flow rate를 4 L/min으로 조절하여, 3~4 mg O 2/L로 유지되었다. 유입수 내 암모늄 산화를 위한 충분한 알칼리도는 함유되어 있어 pH는 조절되지 않았으며, 온도에 따른 미생물 활성 변화를 최소화하기 위하여 모든 실험은 30℃를 유지하는 항온조에서 수행되었다.
2.3. PVA/alginate DO 투과도 조사
PVA/alginate 담체 내부의 DO 농도는 micromanipulator (USMC-232, Denmark Unisense)를 이용하여 측정하였으며, 사용된 oxygen microsensor는 Denmark Unisense사의 USOX-50 model을 이용하였다. DO penetration 깊이는 제조된 담체의 직경이 평균 3,000 µm인 것을 고려하여 1,500 µm까지 측정하였고, 담체 외곽부터 50 µm 단위로 측정하였다. DO를 측정하는 동안 AOB의 활성을 유지하기 위하여 100 mg NH4+-N/L, 436 mg HCO3-/L로 제조된 배지에서 실험을 수행하였다.
2.4. OUR (oxygen uptake rate)
OUR 측정은 300 mL의 부피를 가진 BOD병에서 수행되었으며, YSI model 58 dissolved oxygen meter에 연결된 YSI 5905 BOD probe를 이용하여 DO를 측정하였다. 제조된 culture 배지 조성은 100 mg NH 4+-N/L, 100 mg NaHCO 3-C/L, 6 mg KH 2PO 4-P/L, 12 mg MgSO 4・7H 2O-Mg/L, 4 mg CaCl 2-Ca/L이었으며, trace element solution Ⅰ, Ⅱ는 각각 1 mL/L씩 주입하였다[ 20]. 제조된 배지에 산소가 충분히 포화될 때까지 폭기하였고, pH는 7.5로 조절되었다. 이후에 30℃가 유지되는 항온조에서 채취된 100개의 beads를 이용하여 10초 단위로 10분 동안 산소 소모율을 측정하였다. 회분식 실험 당시 반응조 운전 조건은 Table 2에 나타내었다.
2.5. Real-Time Quantitative PCR
시료에 존재하는 모든 DNA는 Power Soil TM DNA kit (Mo Bio Laboratories, Carlsbad, CA, USA)를 이용하여 추출되었다. q-PCR을 위해 사용된 primer의 정보는 Table 3에 요약하였다. 각각의 q-PCR반응에서 AOB 정량 실험의 경우, Brilliant III Ultra-Fast QPCR Master Mix (Applied Biosystems, USA) (10 µl), 최종 농도를 300 nM로 한 forward primer (0.6 µl)와 reverse primer (0.6 µl), 최종농도를 250 nM로 한 probe (0.25 µl), template DNA (1 µl)로 하여 총 20 µl로 구성하였다. AOB의 Forward primer의 경우, CTO 189fA/B : CTO 189fC를 2 : 1 비율로 섞어 사용하였다. NOB 정량 실험의 경우, Brilliant III Ultra-Fast QPCR Master Mix (Applied Biosystems, USA) (10 µl), 최종 농도를 600 nM로 한 forward primer (1.2 µl)와 reverse primer (1.2 µl), 최종농도를 250 nM로 한 probe (2.5 µl), template DNA (1 µl)로 하여 총 20 µl로 구성하였다. PCR thermal cycling은 다음과 같은 조건들로 구성되었다: 1 cycle of 3 min at 95℃, 50 cycle of 5 s at 95℃ and 10 s at 60℃ for AOB, 1 cycle of 2 min at 95℃, 40 cycle of 20 s at 95℃ and 40 s at 60℃ for NOB. 정량 실험은 같은 시료를 3번 반복 수행하였다.
3. 결과 및 고찰
3.1. 부분 아질산화능 평가
Fig. 1(A)와 Fig. 1(B)에는 유입 및 유출 질소 화합물의 농도 분포와 전반적인 부분 아질산화능을 나타내었다. 실험 초기에는 유입 암모늄 농도의 희석을 통하여 시운전 기간을 단축시키고자 하였다. HRT 12 h일 때 유입 암모늄의 농도는 200, 400 mg/L으로 희석되었고, 이후에는 혐기성 소화 탈리액의 희석 없이 HRT는 3 h까지 단축되었다.
반응 시작 17일 이후 아질산염은 안정적으로 축적되기 시작하였다. 이때 유입 NLR (nitrogen loading rate)은 0.43 kgN/m3/d이었으며, NPR (nitrite production rate)과 NAR (nitrite to ammonium ratio)는 각각 0.21 kgN/m3/d, 0.99±0.1이 달성되었다. 이후 HRT는 3시간으로 급격히 감소되었다. 하지만 암모늄의 산화 효율이 30.4±4.4%로 감소되어 유출 NAR은 0.38±0.1까지 감소하는 것으로 나타났다. 부분 아질산화 효율을 증가시키기 위하여 운전 93부터 HRT는 5시간으로 조절되었으며, 이후 약 200일 동안 암모늄 산화 효율 49.5±5.2%와 함께 안정적인 부분 아질산화 반응은 달성될 수 있었다(유출 NO2-/NH4+ = 0.94±0.07). 운전 기간 동안 달성된 최대 NPR 2.24 kgN/m3/d이었다. 또한 전체 운전 구간에서 NO3--N농도는 평균 1.6±1.4 mg NO3--N/L를 나타내어 NOB 활성은 운전 기간 내내 효과적으로 억제되는 것으로 나타났다.
본 연구에서는 반응조 내 DO 농도가 평균 3~4 mg O 2/L로 유지되었음에도 불구하고 안정적인 아질산화 효율을 달성할 수 있었다. 이러한 조건은 일반적으로 적용되는 DO 농도 대비 상당히 높은 운전 조건이다. DO 농도 범위 5.5에서 0.5 mg/L까지 변화시켜 아질산염 축적 효율과 DO 농도와의 상관관계를 분석한 결과, 0.7 mg O 2/L 이하에서 아질산염이 안정적으로 축적된 반면, 1.7 mg O 2/L 이상의 높은 DO에서는 완전한 질산화 반응이 우점하는 것으로 보고되었다[ 21]. 이처럼 대부분의 연구에서는 본 연구 결과와 달리 NOB의 활성을 억제하기 위하여 대부분 낮은 DO 농도를 주요 운전 인자로 고려하였다[ 22].
3.2. PVA/alginate 담체 내부 DO 투과효율 조사
Fig. 2에는 bulk solution에서 DO 농도 변화에 따른 PVA/alginate 담체 내에서의 DO 농도 분포를 나타내었다. DO 농도가 8.2 mg O 2/L 조건에서 담체 내부 DO는 1500 µm 깊이에서도 2.7 mg O 2/L를 나타내었다. 반면 bulk solution에서의 DO 농도 5.5 mg O 2/L 이하 조건에서는 담체 깊이에 따라 DO 농도는 급격히 감소하여 투과 깊이 850 µm부터 DO 농도는 1 mg O 2/L 이하로 나타났다. Bulk solution에서 DO 농도가 4 mg O 2/L와 2.1 mg O 2/L일 때에는 각각 150 µm, 50 µm 깊이에서 DO 농도는 0.5 mg/L 이하를 나타내었다.
이러한 연구 결과는 3 mg O 2/L 이상의 높은 DO 조건에서도 NOB활성이 효과적으로 저해된 그 근거를 설명하고 있다. 실제로 보고된 실험 결과와 비교할 경우 whole cell entrapment (immobilized in polyvinyl alcohol and polyethylene glycol) 부분 아질산화를 위하여 적용된 DO 농도 범위가 2~4 mg O 2/L으로 나타난 반면, biofilm, granular sludge, membrane bioreactor를 이용한 부분 아질산화 연구에서는 대개 0.8 mgO 2/L 이하의 DO조건이 운전 인자로 적용되는 것으로 나타났다( Table 4). 실제 현장에서 대규모의 반응조를 운전할 경우 유입수 성상 및 운전 조건 변화로 인하여 일정한 산소 공급량이 유지되더라도 반응조 내 DO 농도의 변화는 야기될 수 있다. 이는 결국 부분 아질산화의 안정성을 약화시키는 요인이 될 것이다. 본 연구에서는 PVA/alginate를 이용한 포괄 고정과 기법을 활용하여 보다 넓은 DO 농도 범위에서 안정적인 아질산화 반응을 위한 운전 인자는 제시되었다. 이는 실제 폐수를 처리하는 대규모 반응조에 보다 적합한 운전 인자로 적용될 수 있을 것이다.
3.3. 미생물 활성 조사 결과
OUR 실험은 부분 아질산화 반응을 달성한 4개 구간에서 AOB의 및 NOB의 활성을 조사하기 위하여 수행되었으며, 그 결과는 Fig. 3에 나타내었다; Step 1은 유입수 암모늄 농도가 200 mg/L로 희석된 구간(운전 17일), step 2는 유입 암모늄 농도가 400 mg/L로 희석된 구간(운전 50일), step 3는 유입수 희석 없이 HRT가 12시간으로 조절된 구간(운전 112일), step 4는 유입수 희석 없이 HRT가 6시간으로 조절된 구간이다(운전 181일). Step 1에서 측정된 AOB의 활성도(0.0014 mg O 2/L/sec)는 step 4까지 NPR (1.26 kgN/m 3/d)이 증가함에 따라 지속적으로 증가하여 최대 0.0062 mg O 2/L/sec를 나타내었다. 반면 반응조 내 질산염은 거의 축적되지 않았음에도 불구하고 NOB의 활성은 지속적으로 나타났다. Step 1부터 step 4까지 측정된 NOB의 OUR값은 지속적으로 증가하여 최대 0.0055 mg O 2/L/sec를 나타내었다. 이처럼 안정적인 부분 아질산화 반응이 장기간 달성된 조건에서의 NOB의 활성은 다른 연구자들에 의해서도 확인되었다[ 23, 24]. 이는 NOB 성장을 위한 조건이 갖춰진다면 질산염이 축적될 수 있음을 의미하고 나아가서는 연계 공정인 ANAMMOX 공정의 안정성을 약화시키는 요인으로 작용하게 될 것이다.
3.4. 질산화 미생물의 군집 변화
운전 17일 이후부터 질산화 미생물 중 AOB의 비율은 89% 이상으로 조사되었다( Fig. 4). 유사 연구에서는 PVA/alginate 담체를 이용한 부분 아질산화 반응기에서 AOB의 비율이 전체 미생물 중 93.2%로 조사되어 본 연구 결과와 유사한 결과는 도출되었다[ 25]. 또한 시간이 지남에 따라 담체 내 총 미생물은 DNA copies numbers 기준으로 평균 15.6×10 9로 증가되었으며, 질산화 미생물 중 AOB 미생물의 성장 효율이 가장 높은 것으로 나타났다.
Nitrobacter sp.와 Nitrospira sp.는 많은 연구를 통해 가장 흔한 NOB species으로 분류되고 있다. 질산화 미생물 중 NOB의 비율은 0.28 ~ 1.6%로 실험기간 동안 매우 낮게 정량되었다. 본 연구에서 우점하는 NOB 우점종은 Nitrospira sp.로 조사되었으며, 그 비율은 step 1에서는 0.25%였지만 step 4에서는 0.09%까지 감소하는 것으로 나타났다.
일반적으로 Nitrospira sp.는 낮은 DO 및 질소 농도를 선호하는 종으로 분류되며, 이와는 반대로 Nitrobacter sp.는 높은 DO 및 질소 농도를 선호하는 종으로 분류된다[ 26]. 본 연구에서는 높은 질소 농도가 유입되는 운전 조건임에도 불구하고 Nitrobacter sp.보다는 Nitrospira sp.가 우점하는 것으로 나타났다. Okabe 등[ 27]은 낮은 DO 농도에서 NOB 중 Nitrospira sp.가 우점하였다고 보고하였고, Schramm 등[ 28]은 높은 DO 농도에서는 Nitrospira sp.보다 Nitrobacter sp.가 biofilm system에서 우점하였다고 보고하였다. 하지만 본 연구에서 우점한 NOB 종은 Nitrospira sp.였음에도 불구하고 낮은 DO 조건에서 안정적인 부분 아질산화는 달성되었다. 이는 혐기성 소화 탈리액 내 고농도 질소 농도에 의해 야기된 높은 FA 및 FNA에 의해 NOB가 효과적으로 저해되었기 때문으로 판단된다. 운전 기간 동안 산정된 FA 및 FNA 농도 범위는 각각 12.1±16.1 mg NH 3/L, 0.12±0.08 mg NO 2/L로 NOB가 저해되는 농도 범위를 초과하는 것으로 나타났다.
4. 결 론
본 연구에서는 PVA/alginate에 포괄 고정화된 미생물을 이용하여 안정적인 부분 아질산화 반응을 구현하기 위한 운전 인자에 대하여 다음과 같은 결과를 도출하였다. 운전 기간 동안 반응조 내 DO 농도는 3~4 mg O2/L로 유지되었음에도 불구하고 소화 슬러지 탈리액을 이용하여 약 200일 동안 안정적인 부분 아질산화 반응을 달성하였다. 전체 실험 구간에서 발생한 질산염 농도는 1.6±1.4 mg NO3--N/L로 조사되어 효과적으로 NOB 활성은 효과적으로 저해되었다. PVA/alginate를 이용한 포괄 고정화 담체는 낮은 DO 투과도로 인하여 안정적인 부분 아질산화에 매우 효과적으로 적용될 수 있었다.
Acknowledgments
본 연구는 환경부 “글로벌탐 환경기술개발사업”으로 지원받은 과제임(과제번호: 2019002190001).
Fig. 1.
Performance of partial nitritation reactor packed with PVA/alginate carriers. (A) Influent and effluent nitrogen species, (B) NLR (nitrogen loading rate) and NPR (nitrite production rate), (C) DO (dissolved oxygen) concentration and hydraulic retention time (HRT). 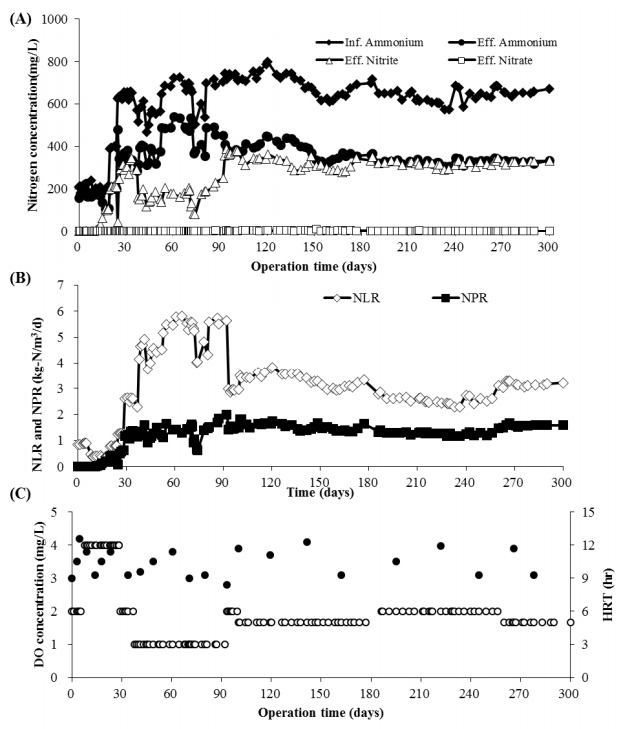
Fig. 2.
DO penetration experiments in PVA/alginate carrier according to DO concentration in bulk solution. 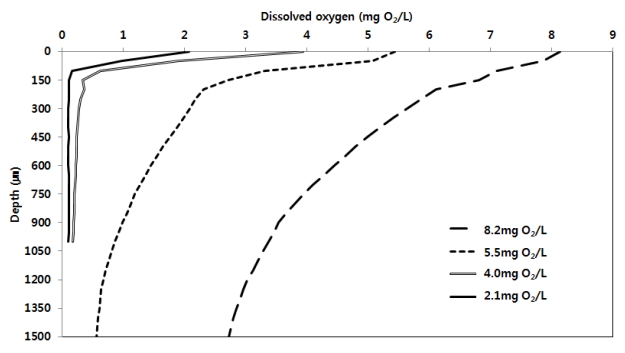
Fig. 3.
Distribution of specific activities for AOB and NOB over operation time. 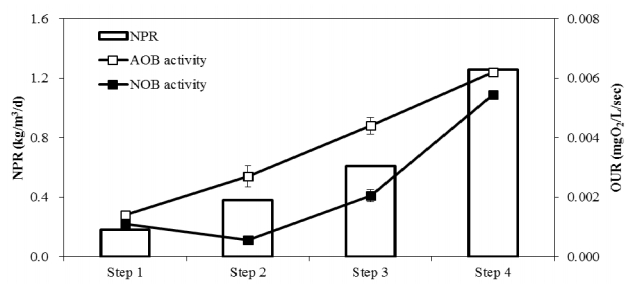
Fig. 4.
The 16S rRNA gene concentration of AOB and NOB (Nts and Ntb). 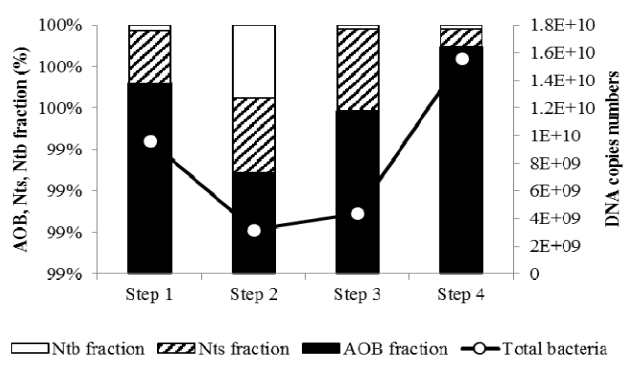
Table 1.
Characteristics of reject water.
|
Contents |
Concentration |
|
NH4+-N (mg/L) |
683.6 ± 73.5 |
|
NO2--N (mg/L) |
0 - 6 |
|
NO3--N (mg/L) |
0 - 0.64 |
|
Alkalinity (CaCO3 mg/L) |
2,420 ± 630 |
|
HCO3-/NH4+-N ratio |
0.99 |
|
Chemical oxygen demand (mg O2/L) |
406.4 ± 106.7 |
|
pH |
7.46 ± 0.34 |
Table 2.
Operating condition of partial nitritation reactor at the time of each OUR (oxygen uptake rate) test.
|
Operating time (days) |
Inf. NH4+ (mg/L) |
HRT (h) |
NLR (kg/m3・d) |
NPR (kg/m3・d) |
|
Step 1 |
17 |
209.7±15.2 |
12 |
0.41±0.01 |
0.21±0.01 |
|
Step 2 |
24 |
396.3±4.9 |
12 |
0.79±0.01 |
0.42±0.01 |
|
Step 3 |
29 |
629.2±5.3 |
12 |
1.26±0.01 |
0.58±0.06 |
|
Step 4 |
38 |
648.3±15.6 |
6 |
2.54±0.06 |
1.22±0.12 |
Table 3.
Experimental conditions for microbial community analysis.
|
Target |
Type |
Name |
Sequence |
Reference |
|
AOB |
Forward |
CTO 189fA/B |
5'-GGAGRAAAGCAGGGGATCG-3' |
[29] |
|
Forward |
CTO 189fC |
5'-GGAGGAAAGTAGGGGATCG-3' |
|
Taqman |
TMP1 |
5'-CAACTAGCTAATCAGRCATCRGCCGCTC-3' |
|
Reverse |
RT1r |
5'-CGTCCTCTCAGACCARCTACTG-3' |
|
NOB (Nts) |
Forward |
Nspra-675f |
5'-GCGGTGAAATGCGTAGAKATCG-3' |
[30,31] |
|
Taqman |
Nspra-723Taq |
5'-CGCCGCCTTCGCCACCG-3' |
|
Reverse |
Nspra-746r |
5'-TCAGCGTCAGRWAYGTTCCAGAG-3' |
|
NOB (Ntb) |
Forward |
Nitro-1198f |
5'-ACCCCTAGCAAATCTCAAAAAACCG-3' |
|
Taqman |
Nitro-1374Taq |
5'-AACCCGCAAGGAGGCAGCCGACC-3' |
|
Reverse |
Nitro-1423r |
5'-CTTCACCCCAGTCGCTGACC-3' |
Table 4.
Comparison with operating parameters for partial nitritation.
|
Rectors |
Wastewater |
N conversion rate (kg-N/m3/d) |
DO (mg O2/L) |
Reference |
|
Whole cell entrapment |
PEG carriers |
Digester supernatant |
1.7 |
4.0 |
[32] |
|
PVA sponge-cubes |
Synthetic |
3.1 |
0.5 |
[7] |
|
PEG carriers |
Digester liquor |
2.1 |
2.5-6.5 |
[19] |
|
PVA carrier |
Reject water |
2.0 |
3.0-4.0 |
This study |
|
The others |
Biofilm |
Synthetic |
0.5 |
0.5-0.8 |
[33] |
|
Granular sludge |
Synthetic |
0.8 |
0.3-0.5 |
[34] |
|
Membrane bioreactor |
Synthetic |
1.2 |
0.3-0.5 |
[35] |
References
1. M. Strous, E. Van Gerven, P. Zheng, J. G. Kuenen, M. S. M. Jetten, Ammonium removal from concentrated waste streams with the anaerobic ammonium oxidation (anammox) process in different reactor configurations, Water Res., 31(8), 1955-1962(1997).  2. D. Choi, M. H. Khan, J. Jung, Crosslinking of PVA/alginate carriers by glutaraldehyde with improved mechanical strength and enhanced inhibition of deammonification sludge, Int. Biodeterior. Biodegrad., 145, 104788(2019).  3. D. Choi, S. Cho, J. Jung, Key operating parameters affecting nitrogen removal rate in single-stage deammonification, Chemosphere., 207, 357-364(2018).  4. D. Choi, K. Cho, J. Jung, Optimization of nitrogen removal performance in a single-stage SBR based on partial nitritation and anammox, Water Res., 162, 105-114(2019).  5. D. Choi, D. Lee, W. Yun, J. Jung, Addition of a foaming agent to improve N2 gas permeability of PVA/alginate carriers for deammonification process, Int. J. Hydrogen Energy., 42(45), 27812-27819(2017).  6. T. Lotti, W. R. L. van der Star, R. Kleerebezem, C. Lubello, M. C. M. van Loosdrecht, The effect of nitrite inhibition on the anammox process, Water Res., 46(8), 2559-2569(2012).  7. H. Bae, H. Yang, Y.-C. Chung, Y. J. Yoo, S. Lee, High-rate partial nitritation using porous poly (vinyl alcohol) sponge, Bioprocess Biosyst. Eng., 37, 1115-1125(2014).  8. S. Lackner, E. M. Gilbert, S. E. Vlaeminck, A. Joss, H. Horn, M. C. M. van Loosdrecht, Full-scale partial nitritation/anammox experiences–an application survey, Water Res., 55, 292-303(2014).  9. S. Wyffels, S. W. H. Van Hulle, P. Boeckx, E. I. P. Volcke, O. Van Cleemput, P. A. Vanrolleghem, W. Verstraete, Modeling and simulation of oxygen‐limited partial nitritation in a membrane‐assisted bioreactor (MBR), Biotechnol. Bioeng., 86(5), 531-542(2004).  10. E. I. P. Volcke, Modelling, analysis and control of partial nitritation in a SHARON reactor, Ph.D. thesis, Ghent University, Belgium, 300(2006).
11. Y. Xiao, G. M. Zeng, Z. H. Yang, Y. S. Liu, Y. H. Ma, L. Yang, R. J. Wang, Z. Y. Xu, Coexistence of nitrifiers, denitrifiers and anammox bacteria in a sequencing batch biofilm reactor as revealed by PCR‐DGGE, J. Appl. Microbiol., 106(2), 496-505(2009).  12. K. Isaka, T. Sumino, S. Tsuneda, Novel nitritation process using heat-shocked nitrifying bacteria entrapped in gel carriers, Process Biochem., 43(3), 265-270(2008).  13. C. Rongsayamanont, T. Limpiyakorn, B. Law, E. Khan, Relationship between respirometric activity and community of entrapped nitrifying bacteria: implications for partial nitrification, Enzyme Microb. Technol., 46(3-4), 229-236(2010).  14. S. Villaverde, F. Fdz-Polanco, P. A. Garcıa, Nitrifying biofilm acclimation to free ammonia in submerged biofilters. start-up influence, Water Res., 34(2), 602-610(2000).  15. J. P. Voets, H. Vanstaen, W. Verstraete, Removal of nitrogen from highly nitrogenous wastewaters, Journal (Water Pollution Control Federation)., 47(2), 394-398(1975).
16. A. Gali, J. Dosta, S. Macé, J. Mata-Alvarez, Comparison of reject water treatment with nitrification/denitrification via nitrite in SBR and SHARON chemostat process, Environ. Technol., 28(2), 173-176(2007).  17. M. H. Khan, D. Choi, K. Cho, J. Jung, Long-term efficient deammonification operation with PVA/alginate carrier modified by foaming agent, Int. Biodeterior. Biodegrad., 129, 148-155(2018).  18. R. Blackburne, Z. Yuan, J. Keller, Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection factor, Biodegradation., 19, 303-312(2008).  19. S. Qiao, T. Yamamoto, M. Misaka, K. Isaka, T. Sumino, Z. Bhatti, K. Furukawa, High-rate nitrogen removal from livestock manure digester liquor by combined partial nitritation–anammox process, Biodegradation., 21, 11(2010).  20. A. A. van de Graaf, P. de Bruijn, L. A. Robertson, M. S. M. Jetten, J. G. Kuenen, Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor, Microbiology., 142(8), 2187-2196(1996).  21. G. Ruiz, D. Jeison, R. Chamy, Nitrification with high nitrite accumulation for the treatment of wastewater with high ammonia concentration, Water Res., 37(6), 1371-1377(2003).  22. E. M. Gilbert, S. Agrawal, S. M. Karst, H. Horn, P. H. Nielsen, S. Lackner, Low temperature partial nitritation/anammox in a moving bed biofilm reactor treating low strength wastewater, Environ. Sci. Technol., 48(15), 8784-8792(2014).  23. J. Yang, L. Zhang, H. Daisuke, S. Takahiro, Y. Ma, Z. Li, K. Furukawa, High rate partial nitrification treatment of reject wastewater, J. Biosci. Bioeng., 110(4), 436-440(2010).  24. J. Yang, J. Trela, M. Zubrowska-Sudol, E. Plaza, Intermittent aeration in one-stage partial nitritation/anammox process, Ecol. Eng., 75, 413-420(2015).  25. W. Liu, D. Yang, Evaluating the feasibility of ratio control strategy for achieving partial nitritation in a continuous floccular sludge reactor: experimental demonstration, Bioresour. Technol., 224, 94-100(2017).  26. M. A. Dytczak, K. L. Londry, J. A. Oleszkiewicz, Activated sludge operational regime has significant impact on the type of nitrifying community and its nitrification rates, Water Res., 42(8-9), 2320-2328(2008).  27. S. Okabe, T. Kindaichi, T. Ito, H. Satoh, Analysis of size distribution and areal cell density of ammonia‐oxidizing bacterial microcolonies in relation to substrate microprofiles in biofilms, Biotechnol. Bioeng., 85(1), 86-95(2004).  28. A. Schramm, D. de Beer, M. Wagner, R. Amann, Identification and activities in situ of nitrosospira and nitrospira spp. as dominant populations in a nitrifying fluidized bed reactor, Appl. Environ. Microbiol., 64(9), 3480-3485(1998).  29. A. Hermansson, P.-E. Lindgren, Quantification of ammonia-oxidizing bacteria in arable soil by real-time PCR, Appl. Environ. Microbiol., 67(2), 972-976(2001).  30. D. W. Graham, C. W. Knapp, E. S. Van Vleck, K. Bloor, T. B. Lane, C. E. Graham, Experimental demonstration of chaotic instability in biological nitrification, ISME J., 1, 385-393(2007).  31. Z. Huang, P. B. Gedalanga, P. Asvapathanagul, B. H. Olson, Influence of physicochemical and operational parameters on nitrobacter and nitrospira communities in an aerobic activated sludge bioreactor, Water Res., 44(15), 4351-4358(2010).  32. K. Isaka, H. Itokawa, Y. Kimura, K. Noto, T. Murakami, Novel autotrophic nitrogen removal system using gel entrapment technology, Bioresour. Technol., 102(17), 7720-7726(2011).  33. Z. Liang, Z. Han, S. Yang, X. Liang, P. Du, G. Liu, Y. Yang, A control strategy of partial nitritation in a fixed bed bioflim reactor, Bioresour. Technol., 102(2), 710-715(2011).  34. B. Sinha, A. P. Annachhatre, Assessment of partial nitrification reactor performance through microbial population shift using quinone profile, Bioresour. Technol., 98(18), 3602-3610(2007).  35. Y. Xue, F. Yang, S. Liu, Z. Fu, The influence of controlling factors on the start-up and operation for partial nitrification in membrane bioreactor, Bioresour. Technol., 100(3), 1055-1060(2009). 
|
|














