The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
정밀여과를 이용한 물재이용 공정의 산화전처리가 수질 및 막여과 성능에 미치는 영향
Abstract
Objective
This study investigated the effects of ozone, chlorine dioxide, and chlorine pretreatment on water quality and microfiltration characteristics in the water reclamation facility.
Methods
Ozone (0.5-2.5 mg/L), chlorine dioxide (1-5 mg/L) and chlorine (1-5 mg/L) were injected as an pre-oxidizing agent, and membrane fouling and surface damage during microfiltration (PVDF) were assessed.
Results and Discussion
The hydrophobic substances were decomposed as the dosages of ozone and chlorine injected increased. However, chlorine dioxide could not effectively decompose hydrophobic organic matters in the range of 1-5 mg/L. In the case of pretreatment with chlorine, the microfiltration operation time was longer than in the case of pretreatment with ozone and chlorine dioxide. As the concentration of chlorine injection increased, the membrane filtration time before backwash gradually increased. Regardless of the type and concentration of the oxidizing agent, the membrane damage rate by the oxidizing agent was less than 1% within 28 days, and no surface damage was observed.
Conclusions
Chlorine was considered to be the most efficient pre-oxidizer for microfiltration process with a PVDF membrane to reuse biologically treated wastewater in the wastewater treatment plant.
Key words: Oxidant, Microfiltration, Membrane Fouling, Membrane Damage, Water Reclamation
요약
목적
본 연구는 막을 이용한 하수재이용 시설에서 오존, 이산화염소, 염소 전처리가 수질과 정밀여과 특성에 미치는 영향을 파악하였다.
방법
오존(0.5~2.5 mg/L), 이산화염소(1~5 mg/L), 염소(1~5 mg/L)를 정밀막여과(PVDF) 공정 전처리 산화제로 주입하고 수질 변화와 이에 따른 막오염 저감 및 막표면 손상을 평가하였다.
결과 및 토의
오존과 염소의 주입량이 증가할수록 소수성 물질의 분해가 증가하였으나 이산화염소는 본 실험에 사용된 주입량(1~5 mg/L) 범위에서 소수성 유기물을 잘 분해하지 못했다. 염소로 전처리한 경우 막 여과 운전시간이 오존과 이산화염소로 전처리한 경우에 비하여 길었다. 염소 주입농도(1~5 mg/L)가 증가할수록 역세척 전 막여과시간도 점차적으로 길어졌다. 산화제 종류 및 농도(오존 10 mg/L 이하, 이산화염소 20 mg/L 이하, 염소 40 mg/L 이하)에 관계없이 28일 이내는 산화제에 의한 막 손상률이 1% 이하였으며 막의 표면 손상도 발견되지 않았다.
결론
A하수처리장의 생물학적처리수를 재이용수로 활용하기 위해 PVDF 재질 막으로 정밀여과시 염소가 가장 효율적인 전처리 산화제로 판단된다.
주제어: 산화제, 정밀여과, 막 오염, 막 손상, 물재이용
1. 서 론
우리나라는 급속한 산업화로 발생하는 하・폐수의 수질이 악화되고 양도 증가하고 있어 효율적인 처리 및 수자원 관리가 필요하다. 이에 따라 수질에 대한 규제가 강화되고 있고, 하・폐수의 수계 방류를 줄일 수 있는 물 재이용에 대한 관심 및 수요도 증가하고 있다. 하・폐수의 고도처리 및 재이용을 위해 다양한 공정이 연구・개발되고 있는데, 이 중 막여과 공정에 관한 연구・개발이 가장 활발하다[ 1- 3]. 막여과 공정은 공극의 크기에 따라 입자성 물질, 유기물질, 무기염 등의 제거가 가능하고 안정적인 수질의 물을 생산할 수 있어 다양하게 활용되는 기술이다[ 4, 5]. 하・폐수 처리 및 재이용 공정에는 일반적으로 막(Membrane)이 생물반응기 안에 있는 MBR (Membrane Bioreactor) 공정과 생물반응 후에 막여과를 분리해서 처리하는 방식이 사용되는데, 막(Membrane)으로는 주로 정밀여과(Microfiltration) 막이 사용된다[ 4, 6]. 막여과 기술의 많은 장점에도 불구하고 막여과 공정은 운전시간 경과에 따른 여과효율 감소, 즉 막오염(Membrane Fouling) 현상이 발생하여 막여과 기술의 도입에 주요 문제점으로 고려되고 있다[ 4, 6- 9]. 막오염 현상은 막의 표면이나 막의 공극에서 입자나 용질의 부착・흡착에 의하여 발생되며 투과 플럭스(flux) 감소의 원인이 된다. 막오염은 가역적인 오염과 비가역적인 오염으로 구분되는데, 막분리 공정에서 수리학적(물리적 세척)으로 완전히 회복이 되지 않는 비가역적인 오염이 더 큰 문제가 된다[ 6- 9]. 비가역적 막오염은 수중에 존재하는 다양한 유・무기물질에 의하여 발생되고 유기물에 의한 막오염은 유기물의 특성에 의하여 주로 결정된다. 이에 유기물의 물리・화학적 특성에 따른 막오염 현상을 파악하는 연구와 막오염을 유발시키는 유기물 제거를 통하여 막오염 현상을 방지하는 연구가 활발히 진행되고 있다[ 8- 11]. 생물학적처리가 된 하・폐수를 재이용수로 활용하기 위해서 막여과 공정으로 다시 처리할 경우 막여과 공정의 전처리로 응집이나 활성탄 흡착 기술을 이용하여 유기물을 제거할 수 있다[ 8, 1- 13]. 그러나 전처리로 응집과 흡착공정을 두기 위해서는 부가적인 시설이 필요하고 운영비도 증가하게 된다. 이에 반해 산화제를 막여과 공정의 전단에 투입하는 것은 비교적 적은 비용으로 처리가 가능하다[ 14, 15]. 다만, 하・폐수 처리수의 막여과를 위한 전처리로 산화제를 활용한 국내의 연구는 미흡한 실정이다. 따라서 본 연구를 통해 하・폐수 재이용을 위한 막여과 공정의 전처리로 산화제를 주입할 경우 유기물질의 특성변화와 막여과 성능에 미치는 영향을 파악하고자 한다.
2. 재료 및 방법
2.1. 대상 시료
실험에 사용한 원수는 A하수처리시설에서 채수하였다. 조사대상 하수처리시설의 유입수는 평균적으로 공장폐수 70%와 생활하수 30%가 혼합되어 있고 BOD 및 COD의 처리효율은 97% 이상이었다. 주된 생물학적 처리공법은 A2O (Anaerobic/Anoxic/Oxic)이고, 생물학적처리 후에 총인처리시설로 응집과 여과공정이 추가되어 있다. 막여과를 위해 본 실험에 사용된 시료는 응집공정 처리수이다. 응집공정 처리수(원수, raw water)의 수질특성은 Table 1에 정리되어 있다.
2.2. 산화 및 막여과 실험
막여과 전처리로 주입된 산화제는 총 3종으로 오존(O 3), 이산화염소(ClO 2), 염소(HOCl/OCl -)이다. 오존(O 3), 이산화염소(ClO 2), 염소(HOCl/OCl -)의 산화력(oxidation potential)은 2.07, 1.15, 1.49/0.90 volts이다[ 16]. HOCl의 pKa가 7.53이고 원수의 pH가 7.3인 점을 고려하여 오존(O 3), 이산화염소(ClO 2), 염소(HOCl/OCl -)의 주입 비율은 대략적으로 동일한 산화력을 갖도록 O 3:ClO 2:HOCl/OCl - = 1:2:2로 주입하였다. 오존의 주입농도는 0.5, 1, 2.5 mg/L이었고 이산화염소와 염소의 주입농도는 1, 2, 5 mg/L이었다. 오존은 오존발생기(LAB-Ⅱ, Ozone Tech, Korea)로 생성시킨 오존을 농축시킨 오존수를 만들고 희석하여 사용하였다. 농도는 Standard Methods 4500-O 3의 인디고 발색법을 이용하여 측정하였다[ 17]. 이산화염소는 Sodium chlorite (NaClO 2) 24% (DAEJUNG)을, 염소는 Sodium hypochlorite (NaOCl) 9~11% (ILDONG)을 각각 희석하여 사용하였다. 막여과 실험은 하수처리시설에서 채수한 원수를 저수조(400 L)에 채우고 각 산화제(오존, 이산화염소, 염소)를 일정 농도로 주입 후 각 농도별로 Lab-scale 정밀여과장치를 이용하여 실험을 실시하였다. 장치는 원수조, 원수펌프, 정밀여과장치, 역세조, 역세펌프, PC 등으로 구성되었고, 막여과 시간에 따른 압력변화는 전자압력계에서 신호를 받아 PC에 자동 기록되었다. 실험에 사용된 정밀여과 막은 PVDF (Polyvinylidene fluoride) 재질로 외경 1.2 mm, 공극 0.1 µm, 유효막 길이 250 mm이었다. 막 모듈 내의 막 면적은 0.457 m2이고 적정 유효플럭스 1.5 m/d를 기준으로 유량을 설정하였다. 막여과 실험은 초기압에서 1.3배 상승할 때까지 걸리는 시간을 측정하였으며 여과 후에는 여과 유량의 3배로 역세하였다. 여과압이 초기압 기준 1.3배 상승할 때까지 걸리는 시간이 길수록 막의 오염률이 낮다고 할 수 있다.
2.3. 막 손상도 분석
산화제 조건에서 막의 장시간 사용가능성을 판단하기 위해서 오존(0.5, 1, 2.5, 10 mg/L), 이산화염소(1, 2, 5, 20 mg/L), 염소(1, 2, 5, 40 mg/L)의 농도 조건으로 28일간 손상시험을 하였다. 각기 다른 산화제 농도조건의 갈색병에 일정 양(1 g)의 막(여과실험 막과 동일한 막) 파이버(Fiber)를 넣고 밀봉하여 초기 막 파이버의 무게와 산화제에 접촉한 시간 경과에 따른 막 파이버의 무게를 측정하여 산화제에 의한 막 Fiber의 손실을 확인하고자 하였다. 측정 주기는 1일, 2일, 7일, 14일, 21일, 28일로 하였다. 막의 건조무게를 측정하기 위해 산화조건 병에서 꺼낸 막 시료는 50℃ 오븐에 12시간 건조하고 수분을 제거한 뒤 분석하였다. 손상률은 다음 식으로 계산하였다: 손상률(%) = (초기무게-최종무게) / 초기무게×100.
2.4. 수질 및 막 특성 분석
탁도(Turbidity), 수소이온농도(pH), 전기전도도(EC)는 각각의 측정기(Thermo Fisher Scientific, USA)로 사용 전 보정하여 분석하였다. 254 nm 파장에서의 자외선 흡광도(UVA at 254 nm: UVA254)는 시료를 GF/C 여과지(Wattman, USA)로 여과시킨 후 Spectrophotometer (HACH DR6000, USA)를 이용하여 분석하였다. 용존유기탄소(DOC)는 TOC Analyzer (TOC-VCPH, Shimadzu, Japan)를 사용하여 680℃ 연소촉매산화방식으로 측정하였다. Fluorescence는 Spectroflurophotometer (Shimadzu RF-5301, Japan)를 사용하여 측정하였고, 적외선분광기(Fourier Transform-Infrared Spectrometer: FTIR)는 Hyperion 2000 (Bruker, USA)를 사용하였다. 산화제에 의한 막의 표면변화 등은 SEM-EDS (Scanning Electron Microscope-Energy Dispersive X-Ray Spectroscopy, JSM-6500F, JEOL, Japan)로 분석하였다.
3. 결과 및 고찰
3.1. 수질 특성 평가
막 여과수의 수질 특성에 따라 막의 여과특성에 미치는 영향 또는 결과가 다르게 나타날 수 있다. 하수 응집처리수를 원수(Raw water)로 하고 원수에 오존, 이산화염소, 염소를 주입한 후 수질특성의 변화를 분석하였다. 또한 각각의 산화제를 주입한 물의 정밀여과 후 수질특성의 변화도 조사하였다. Table 1은 오존 1 mg/L, 이산화염소 2 mg/L, 염소 2 mg/L 주입시 정밀여과실험(3회) 전후의 수질분석 결과이다. 다른 두 가지 경우의 산화제 주입률에서도 정밀여과 전후의 수질특성은 비슷한 경향을 보였다. 산화제 주입에 따른 탁도의 변화를 보면 오존과 이산화염소의 경우 각각 탁도를 18%, 37% 감소시켰으나 염소는 탁도 변화에 영향을 주지 않았다. 이산화염소와 염소를 주입한 물은 정밀여과를 통해 탁도가 90% 이상 제거되었다. 이는 산화제를 주입하지 않은 정밀여과의 탁도 물질 제거율과 유사하다. 그러나 오존을 주입한 경우 탁도 물질 제거율은 77%로 낮게 나타났다. 본 실험에서는 입도분석을 하지 않아 단정 지을 수 없으나 이전 연구결과를 바탕으로 평가하면 다른 산화제를 사용한 경우보다 오존산화에 의해 상대적으로 작은 입자물질들이 생성되어 정밀여과막을 통과하는 비율이 높았기 때문으로 판단된다[ 18, 19]. 전기전도도는 산화제주입 여부와 정밀여과 투과 전후에 관계없이 유사한 값을 보였다. 소수성 유기물의 척도로 사용되는 UVA 254는 오존 주입시 15% 감소하였으나, 이산화염소와 염소 주입시는 감소율이 7% 이하로 낮았다. 산화제 주입에 따른 용존성 유기물 함량(DOC)은 산화제의 종류에 관계없이 원수와 비교해 큰 변화가 없었고, 이는 정밀여과된 물에서도 유사하게 나타났다. 이것은 오존이 소수성특성을 나타내는 방향족(aromatic) 화합물들을 쪼개어 UVA 254가 낮아지고 이로 인해 SUVA가 낮아졌기 때문이다[ 20]. 정밀막여과를 통한 전체 유기물 함량(DOC) 제거율은 산화제 주입률에 관계없이 낮은 제거율(6~7%)로 유사한 경향을 보였다. 산화제 주입이 유기물의 정성적인 특성에 미치는 영향을 파악하기 위하여 Chen 등이 제시한 방법[ 21]에 따라 Fluorescence excitation-emission matrix (FEEM) spectra 분석을 하였다. Fig. 1은 오존 주입량에 따른 FEEM의 변화를 나타낸다. 원수는 하수의 특성을 잘 나타내는 tyrosine-like proteins 부분과 soluble microbial products 부분에서 peak를 보였으며 fulvic acid-like substances와 humic acid-like substances 부분도 높은 peak를 나타냈다. 다만, tryptophan-like proteins 부분의 유기물은 적은 것으로 나타났다. 오존 주입량이 증가할수록 모든 영역에서 감소가 일어났고 특히 소수성 특성을 나타내는 humic acid-like와 fulvic acid-like 부분의 감소율이 가장 크게 나타났다. 염소 주입시에도 유사한 경향을 나타내어 산화제 주입량이 증가할수록 소수성 물질의 분해가 크게 나타났다. 그러나 이산화염소 처리수의 FEEM spectra는 주입량과 상관없이 원수와 비슷하게 나타났다. 이것은 Table 1의 원수와 이산화염소 처리수의 SUVA 값이 유사한 것과 같은 결과로 해석될 수 있다. 따라서 이산화염소는 본 실험에 사용된 주입량(1~5 mg/L) 범위에서 수성 유기물의 분해에 미치는 영향이 적다고 할 수 있다.
3.2. 막 오염도 평가
산화제로 전처리된 물을 정밀여과로 처리할 때 종합적인 막 오염도를 파악하기 위해서 막 간에 걸리는 초기압력 대비 투과압력이 1.3배가 되는 시간을 척도로 하였다. Table 2는 산화제 종류별, 주입 농도별 초기압(P 0) 대비 투과압력(P)이 1.3배가 되는 시간을 정리한 것이다. 염소로 전처리한 경우 막 여과 운전시간이 오존과 이산화염소로 전처리한 경우에 비하여 길었다. 염소 주입농도가 1 mg/L에서 5 mg/L로 증가할수록 1.3배 압력기준 막 여과시간도 점차적으로 증가하였다. 이는 전처리로 주입한 염소가 막 오염을 저감시켰기 때문으로 판단된다[ 22, 23]. 그러나, 오존과 이산화염소의 경우 산화제를 주입하지 않은 원수보다 1.3배 압력기준 막 여과시간이 짧게 나타났다. 특히 오존의 경우 오히려 막오염이 증가하는 경향을 나타냈는데 이것은 오존에 의해 분해된 작은 입자들이 막 공극에 흡착되거나 막혀서 막오염을 오히려 심화시켰기 때문으로 판단된다[ 23, 24]. 오존을 처리하여 막 오염을 저감시킬 수도 있으나 정밀막여과의 경우 오히려 악화되는 경우도 발생할 수 있다[ 23, 24]. 막 오염 평가를 위한 여과실험을 마친 후 막의 표면분석을 진행하였다. Fig. 2는 각 산화제를 처리한 후 여과한 분리막과 파울링 케이크(Cake) 층의 단면 사진이다. 원수를 여과한 막 위의 케이크 층은 2~4 µm이었다. 염소 처리한 물을 여과한 막의 케이크 층 두께는 7~10 µm로 두꺼우나 조밀하지 않게 나타났고, 이산화염소로 전처리한 물을 여과한 막의 경우는 케이크 층이 1.5~3 µm로 얇으나 조밀한 형태를 나타내었다. 오존 처리한 물을 여과한 막의 케이크 층의 두께가 1.1~2.5 µm로 가장 얇고 압축되어 조밀한 형태를 나타내었다. 이러한 결과는 염소 처리된 물을 막 여과한 경우 일정 압력에 도달하기까지 여과시간이 가장 길고 오존 처리된 물을 막 여과한 경우 여과시간이 가장 짧았던 결과를 설명해 준다. 다만, 본 실험은 한 달 이내의 운전결과에 근거한 결과로 장기운전의 경우 다른 결과를 나타낼 수 있다. 또한 처리수에 철이나 망간 등 무기물 함량이 높은 경우 염소산화가 무기결정체에 의한 막 오염을 증가시킬 가능성도 있다[ 23]. 막 표면 케이크의 특성을 파악하기 위해서 FTIR로 분석한 결과 전처리된 산화제와 관계없이 1660, 820 cm -1의 피크가 높게 나타났다. 1660 cm -1 피크는 C=C 소수성(Hydrophobic) 분율에 기인하고 820 cm -1 피크는 방향족(Aromatic) 분율에 기인한다[ 25- 27]. 이를 통해 막 표면 케이크의 주성분은 소수성 및 방향족 유기물이고, 막 표면의 케이크를 구성하는 물질의 특성은 큰 차이가 없음을 알 수 있었다.
3.3. 막 손상도 평가
산화제에 정밀여과 막이 장시간 노출되었을 때 막의 손상도를 평가하기 위하여 산화제별 시간경과에 따른 막 손상률을 측정하였다( Table 3). 산화제 종류, 농도, 접촉시간에 관계없이 28일 이내 실험결과로는 1% 이하의 손상률을 나타냈다. 염소를 고농도(40 mg/L)로 적용한 경우와 이산화염소를 고농도(20 mg/L)로 적용한 경우는 1%에 가까운 손상률을 나타내었으나, 이 농도는 실제 산화제를 전처리로 적용시 사용되지 않는 높은 농도이다. 막 표면의 손상도를 더욱 명확히 확인하기 위해 막의 표면을 SEM으로 촬영하고 손상된 부분이 없음을 확인하였다. SEM-EDS 분석결과를 통해 산화제에 28일간 접촉했던 막과 새 막(virgin membrane)의 무게 백분율 및 몰수비 백분율이 통계적으로 차이가 없음을 확인하였다( Table 4). 따라서 본 실험에 사용된 농도 범위 내에서는 산화제를 PVDF 재질 정밀여과막의 전처리로 사용하여도 막의 손상에 영향이 없다는 것을 알 수 있다. 다만, 폴리아미드(polyamide)를 사용한 다른 연구[ 28, 29]의 경우 염소가 막 표면의 특성을 변화시킬 수 있다는 결과가 있으므로 산화 전처리를 적용할 막의 재질에 따라 주의가 필요하다.
4. 결 론
하・폐수 재이용을 위한 정밀여과 공정의 전처리로 오존, 이산화염소, 염소 등의 산화제를 주입한 경우 유기물질의 특성변화와 막여과 성능에 미치는 영향에 대한 연구를 통해 다음과 같은 결론을 도출하였다.
1) 오존과 염소의 주입량이 증가할수록 소수성 물질의 분해가 증가하였으나 이산화염소는 본 실험에 사용된 주입량(1~5 mg/L) 범위에서 소수성 유기물을 잘 분해하지 못했다.
2) 염소로 전처리한 경우 막 여과 운전시간이 오존과 이산화염소로 전처리한 경우에 비하여 길었다. 염소 주입농도(1~5 mg/L)가 증가할수록 역세척 전 막여과시간도 점차적으로 길어졌다. 오존의 경우 막오염이 오히려 증가하는 경향을 나타냈는데 이것은 오존에 의해 분해된 작은 입자들이 막 공극을 막거나 공극에 흡착되었기 때문으로 판단된다.
3) 산화제 종류 및 농도(오존 10 mg/L 이하, 이산화염소 20 mg/L 이하, 염소 40 mg/L 이하)에 관계없이 28일 이내는 산화제에 의한 막 손상률이 1% 이하였으며, 막의 표면 손상도 발견되지 않았다. 본 실험에 사용된 농도 범위 내에서는 산화제를 PVDF 재질 정밀여과막의 전처리로 사용하여도 막의 손상에 영향이 없었다.
4) A하수처리장의 생물학적처리수를 재이용수로 활용하기 위해 PVDF 재질 막으로 정밀여과시 가장 효율적인 산화제는 염소이었다. 다만, 본 실험은 한 달 이내의 운전결과에 근거한 결과로 장기운전의 경우 다른 결과를 나타낼 수도 있다. 또한 처리수에 철이나 망간 등 무기물 함량이 높은 경우 염소산화가 무기결정체에 의한 막 오염을 증가시킬 가능성도 있다는 점에 유의해야 한다.
Acknowledgments
이 연구는 금오공과대학교 학술연구비로 지원되었음(2017-104-078).
Fig. 1.
FEEM spectra for (a) raw water and ozonated water with (b) 0.5 mg/L O3, (c) 1.0 mg/L O3, (d) 2.5 mg/L O3. 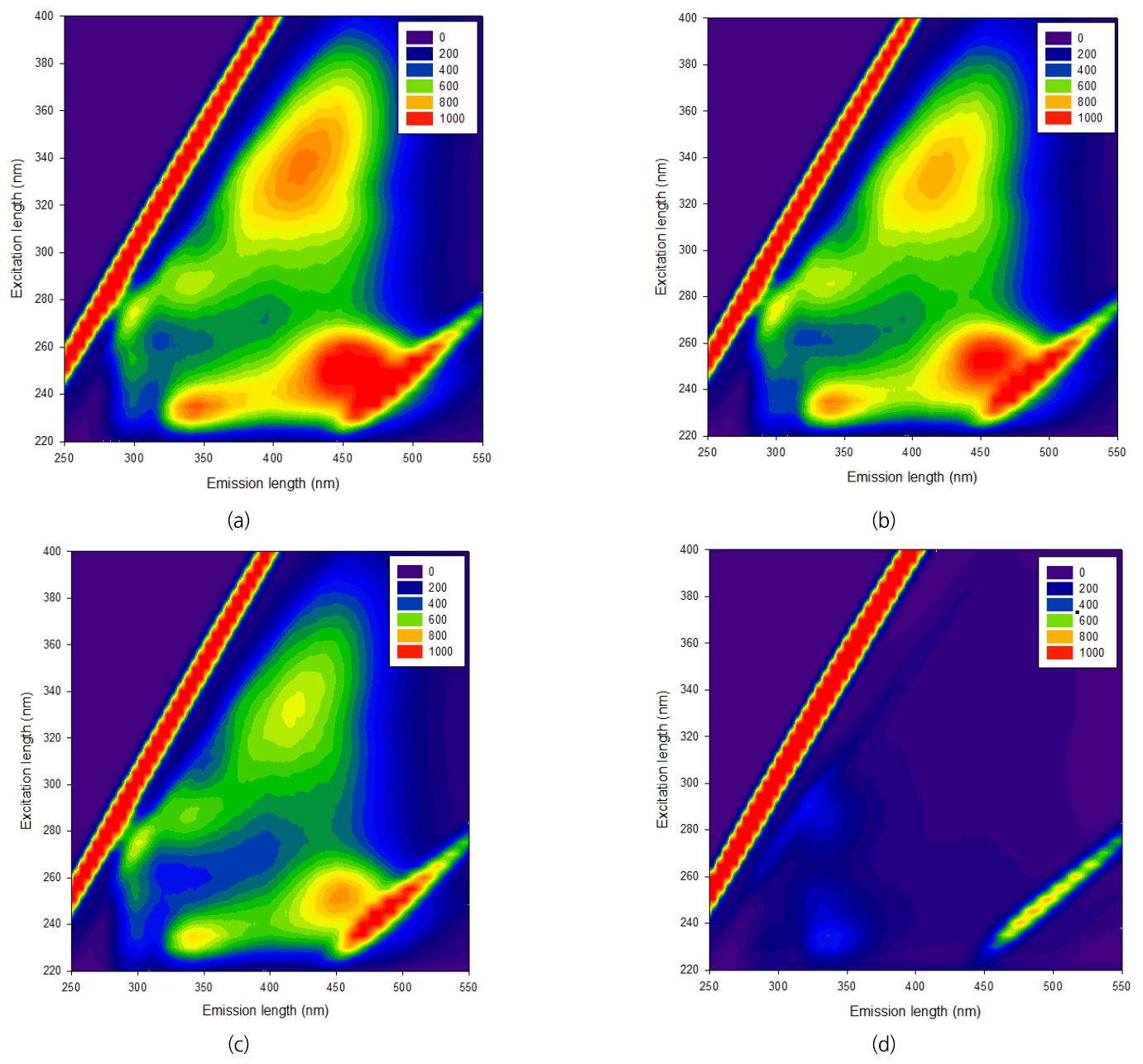
Fig. 2.
Cross sections for membranes and cake layers after microfiltration of (a) O3-treated water, (b) ClO2-treated water, and (c) Cl2-treated water. 
Table 1.
Comparison of water quality upon oxidant addition before and after microfiltration.
|
Parameter (unit) |
Before microfiltration
|
After microfiltration
|
|
Raw water |
O3 1 mg/L |
ClO2 2 mg/L |
Cl2 2 mg/L |
Raw water |
O3 1 mg/L |
ClO2 2 mg/L |
Cl2 2 mg/L |
|
Turbidity (NTU) |
1.67 ±0.69*
|
1.37 ±0.52 |
1.06 ±0.20 |
1.74 ±0.66 |
0.20 ±0.03 |
0.32 ±0.03 |
0.08 ±0.03 |
0.06 ±0.01 |
|
Conductivity (µS/cm) |
2512 ±230 |
2484 ±259 |
2544 ±320 |
2538 ±233 |
2498 ±251 |
2460 ±261 |
2539 ±316 |
2552 ±297 |
|
UVA254 (cm-1) |
0.070 ±0.003 |
0.059 ±0.002 |
0.069 ±0.003 |
0.065 ±0.001 |
0.065 ±0.003 |
0.055 ±0.001 |
0.064 ±0.003 |
0.061 ±0.003 |
|
DOC (mg/L) |
4.09 ±0.03 |
3.97 ±0.05 |
3.97 ±0.05 |
3.97 ±0.18 |
3.79 ±0.01 |
3.68 ±0.08 |
3.73 ±0.14 |
3.70 ±0.12 |
|
SUVA (L/mgㆍm) |
1.72 ±0.08 |
1.50 ±0.04 |
1.73 ±0.06 |
1.64 ±0.06 |
1.71 ±0.07 |
1.51 ±0.05 |
1.71 ±0.06 |
1.64 ±0.10 |
Table 2.
Increase in pressure during microfiltration of waters treated with various oxidants.
|
Oxidant addition |
Initial pressure (P0) (bar) |
Time (sec) to reach P/P0 = 1.3 |
|
Raw water |
0.249 |
7,100 |
|
O3
|
0.5 mg/L |
0.220 |
3,474 |
|
1 mg/L |
0.244 |
3,685 |
|
2.5 mg/L |
0.230 |
2,475 |
|
ClO2
|
1 mg/L |
0.224 |
6,200 |
|
2 mg/L |
0.238 |
5,665 |
|
5 mg/L |
0.202 |
5,060 |
|
Cl2
|
1 mg/L |
0.201 |
9,290 |
|
2 mg/L |
0.226 |
9,555 |
|
5 mg/L |
0.243 |
10,015 |
Table 3.
Average damage rate (%) of membranes in oxidant solutions.
|
Duration (d) |
O3 (mg/L)
|
ClO2 (mg/L)
|
Cl2 (mg/L)
|
|
0.5 |
1 |
2.5 |
10 |
1 |
2 |
5 |
20 |
1 |
2 |
5 |
40 |
|
1 |
0.21 |
0.02 |
0.11 |
0.08 |
0.65 |
0.72 |
0.56 |
0.92 |
0.26 |
0.43 |
0.65 |
0.56 |
|
2 |
0.16 |
0.33 |
0.25 |
0.08 |
0.43 |
0.44 |
0.34 |
0.43 |
0.43 |
0.23 |
0.96 |
0.61 |
|
7 |
0.11 |
0.05 |
0.36 |
0.27 |
0.70 |
0.14 |
0.53 |
0.34 |
0.48 |
0.64 |
0.71 |
0.75 |
|
14 |
0.38 |
0.54 |
0.27 |
0.28 |
0.59 |
0.49 |
0.26 |
0.36 |
0.56 |
0.69 |
0.57 |
0.48 |
|
21 |
0.33 |
0.42 |
0.10 |
0.14 |
0.86 |
0.70 |
0.77 |
0.78 |
0.50 |
0.39 |
0.34 |
0.41 |
|
28 |
0.64 |
0.62 |
0.64 |
0.39 |
0.48 |
0.68 |
0.36 |
0.81 |
0.39 |
0.69 |
0.46 |
0.98 |
Table 4.
SEM-EDS results of membranes soaked in oxidants for 28 days.
|
Element |
Virgin membrane
|
O3-contact membrane
|
ClO2-contact membrane
|
Cl2-contact membrane
|
|
Weight % |
Atomic % |
Weight % |
Atomic % |
Weight % |
Atomic % |
Weight % |
Atomic % |
|
C |
42.11 |
53.42 |
43.85 |
55.18 |
45.24 |
56.56 |
44.33 |
55.66 |
|
O |
1.10 |
1.05 |
0.98 |
0.98 |
1.11 |
1.04 |
0.97 |
0.92 |
|
F |
56.78 |
45.53 |
55.16 |
43.89 |
53.65 |
42.40 |
54.70 |
43.42 |
|
Total |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
References
1. J. S. Kim, Y. L. Kuk, J. Y. Park, Y. J. Jang, C. H. Park, A study on membrane fouling control by immobilized microbial media for nitrification in membrane bioreactor, J. Korean Soc. Environ. Eng., 41(5), 272-277(2019).  2. Korean Intellectual Property Office, Technology Report: Membrane Filtration pp. 9-54(2002).
3. B. G. Ko, J. H. Na, D. H. Nam, K. H. Kang, C. Y. Lee, Fouling mitigation for pressurized membrane of side-stream MBR process at abnormal operation condition, J. Korean Soc. Environ. Eng., 38(6), 323-328(2016).  4. J. Hoinkis, S. A. Deowan, V. Panten, A. Figoli, R. R. Huang, E. Drioli, Membrane bioreactor (MBR) technology–a promising approach for industrial water reuse, Procedia Eng., 33, 234-241(2012).  5. M. Al-Ahmad, F. A. Aleem, A. Mutiri, A. Ubaisy, Biofouling in RO membrane systems Part 1: fundamentals and control, Desalination., 132, 173-179(2000).  6. M. Aslam, A. Charfi, G. Lesage, M. Heran, J. H. Kim, Membrane bioreactors for wastewater treatment: a review of mechanical cleaning by scouring agents to control membrane fouling, J. Chem. Eng., 307, 897-913(2017).  7. W. Lee, S. Kang, H. Shin, Sludge characteristics and their contribution to microfiltration in submerged membrane bioreactors, J. Membrane Sci., 216(1-2), 217-227(2003).  8. Y. Ahn, S. Kang, B. Bae, C. Lee, W. Lee, Direct measurement of cake fouling potentials by powdered activated carbon during microfiltration of surface water, Desalin. Water Treat., 57(16), 7449-7455(2016).  9. A. Drews, Membrane fouling in membrane bioreactors - characterisation, contradictions, cause and cures, J. Membrane Sci., 363(1-2), 1-28(2010).  10. N. J. Jang, Y. H. Yeo, M. H. Hwang, S. Vigneswaran, J. W. Cho, I. S. Kim, The effect of air bubbles from dissolved gases on the membrane fouling in the hollow fiber submerged membrane bio-reactor (SMBR), Environ. Eng. Res., 11(2), 91-98(2006).  11. H. Jang, W. Lee, Removal characteristics of organic matter during pretreatment for membrane-based food processing wastewater reclamation, Membr. Water Treat., 9(4), 205-210(2018).
12. S. H. Kim, S. Y. Moon, C. H. Yoon, S. K. Yim, J. W. Cho, Role of coagulation in membrane filtration of wastewater for reuse, Desalination., 173(3), 301-307(2005).  13. C. Park, S. W. Hong, T. H. Chung, Y. S. Choi, Performance evaluation of pretreatment processes in integrated membrane system for wastewater reuse, Desalination., 250(2), 673-676(2010).  14. H. Huang, K. Schwab, J. G. Jacangelo, Pretreatment for low pressure membranes in water treatment: A review, Environ. Sci. Technol., 43(9), 3011-3019(2009).  15. C. Genz, U. Miehe, R. Gnirss, M. Jekel, The effect of pre-ozonation and subsequent coagulation on the filtration of WWTP effluent with low-pressure membranes, Water Sci. Technol., 64(6), 1270-1276(2011).  16. P. Bajpai, Pulp and paper industry: Chemicals, Elsevier, Amsterdam, Netherlands, pp. 69(2015).
17. Standard Methods for the Examination of Water and Wastewater, American Public Health Association, American Water Works Association, Water Environment Federation(2018).
18. H. Zhu, X. Wen, X. Huang, Membrane organic fouling and the effect of pre-ozonation in microfiltration of secondary effluent organic matter, J. Membrane Sci., 352(1-2), 213-221(2010).  19. H. T. Zhu, X. H. Wen, X. Huang, Huang, Pre-ozonation for dead-end microfiltration of the secondary effluent: suspended particles and membrane fouling, Desalination., 231(1-3), 166-174(2008).  20. J. Wenk, M. Aeschbacher, E. Salhi, S. Canonica, U. V. Gunten, M. Sander, Chemical oxidation of dissolved organic matter by chlorine dioxide, chlorine, and ozone: effects on its optical and antioxidant properties, Environ. Sci. Technol., 47(19), 11147-11156(2013).  21. W. Chen, P. Westerhoff, J. A. Leenheer, K. Booksh, Fluorescence excitation-emission matrix Regional integration to quantify spectra for dissolved organic matter, Environ. Sci. Technol., 37(24), 5701-5710(2003).  22. W. Yu, L. Xu, N. Graham, J. Qu, Pre-treatment for ultrafiltration: effect of pre-chlorination on membrane fouling, Sci. Rep., 4, 6513(2015).  23. K. Li, G. Wen, S. Li, H. Chang, S. Shao, T. Huang, G. Li, H. Liang, Effect of pre-oxidation on low pressure membrane (LPM) for water and wastewater treatment: A review, Chemosphere., 231, 287-300(2019).  24. J. Song, Z. Zhang, S. Tang, Y. Tan, X. Zhang, Does pre-ozonation or in-situ ozonation really mitigate the protein-based ceramic membrane fouling in the integrated process of ozonation coupled with ceramic membrane filtration?, J. Membr. Sci., 548, 254-262(2018).  25. N. Her, G. Amy, H. Park, M. Song, Characterizing algogenic organic matter (AOM) and evaluating associated NF membrane fouling, Water Res., 38(6), 1427-1438(2004).  26. H. C. Kim, J. H. Hong, S. H. Lee, The fouling of ultrafiltration membranes by natural organic matter after chemical coagulation treatment with different initial mixing conditions, Water Sci. Technol.: Water Supply., 6(4), 117-124(2006).  27. M. Koh, M. M. Clark, K. P. Ishida, Adsorptive fouling of a polypropylene microfiltration membrane with dissolved natural organic matter: do membranes posses an adsorption capacity?, Water Sci. Technol.: Water Supply., 6(2), 25-30(2006).  28. Y. Kwon, J. O. Leckie, Hypochlorite degradation of crosslinked polyamide membranes: I. Changes in chemical/morphological properties, J. Membr. Sci., 283(1-2), 21-26(2006).  29. H. Shemer, R. Semiat, Impact of halogen based disinfectants in seawater on polyamide RO membranes, Desalination., 273(1), 179-183(2011). 
|
|












