The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
국내 자생종 유글레나 분포현황 및 생태독성 연구사례 분석
Abstract
To improve the limitation of physicochemical analysis for water pollutants, there were attempts for ecotoxicity assessment and ecotoxicological risk assessment using various ecotoxicity test species. Especially, study on ecotoxicity using Korean native species as well as Korean non-native species was performed. Class Euglena was presented as a candidate list of Korean native organisms for aquatic ecotoxicity testing. Euglena is a protozoa lived in freshwater, and play a important ecological role as food source for upper trophic level and morphological specificity. It is needed to analyze the previous ecotoxicity study using Euglena and grasp the list of Korean native Euglena, because there were no international standard methods for ecotoxicity using Euglena. In this study, we investigated the biological property, distribution, and ecotoxicity literatures for Euglena. Forty five literatures were collected and most of test species was E. gracilis. Some of literatures presented E. agilis and E. viridis as test species. Toxicity effects of Euglena were assessed by growth, photosynthesis, morphology, composition, motility, oxidative stress, or accumulation of test chemicals. Korean native Euglena was 54 species, and included E. gracilis, E. agilis, and E. viridis used as test species in previous ecotoxicity literatures. There were only three species for assessing Euglena aquatic toxicity. Therefore, it is needed to establish ecotoxicity test methods using various Korean native Euglena.
Key words: Domestic species, Ecotoxicity, Euglena, Freshwater, Native organisms
요약
물환경 내 오염물질에 대한 물리・화학적 평가의 한계를 개선하기 위해, 다양한 생태독성시험종을 활용한 생태독성평가 및 생태위해성평가가 시도된 바 있다. 특히 국외종 뿐 아니라 국내 자생생물종을 이용한 생태독성연구가 진행되었으며, 수서생태독성시험을 위한 국내 자생생물 후보 목록 중 유글레나강이 제시된 바 있다. 유글레나는 담수 환경에서 관찰되는 원생생물로, 상위 영양단계의 주요 영양공급원이자 형태학적 특이성으로 생태학적으로 중요한 위치를 차지하고 있다. 현재까지 유글레나에 관한 국제 생태독성 표준시험법은 제시된 바 없으므로, 기존 생태독성 연구사례를 분석할 필요가 있으며, 생태독성시험종으로서 국내 자생생물종인 유글레나종을 파악할 필요가 있다. 본 연구에서는 유글레나의 생태독성 연구동향을 분석하기 위해, 유글레나의 생물학적 특성, 국내 분포, 생태독성 연구사례를 분석하였다. 현재까지 유글레나 생태독성 연구는 국내외적으로 41건으로, 대부분의 독성시험종은 E. gracilis로 확인되었으며, E. agilis, E. viridis도 일부 사용된 것으로 확인되었다. 유글레나의 독성종말점은 성장, 광합성, 세포형태(예. 세포 크기, 세포막, 핵, 엽록체, 피레노이드 등) 및 구성성분(예. 단백질, 총지질, DNA 등), 운동성, 산화스트레스, 생체 내 시험물질 축적 등 다양하게 평가되었다. 국외 유글레나는 총 52종, 국내 자생생물 유글레나는 총 38종으로, 그 중 E. gracilis, E. agilis, E. viridis도 포함되었다. 따라서 국내외 학술 논문을 통해 유글레나 3종의 생태독성평가가 제한적으로 수행되었으므로, 다양한 국내 자생 유글레나를 활용하여 체계적인 유글레나 생태독성 평가기법이 마련될 필요가 있다.
주제어: 국내종, 담수, 생태독성, 유글레나, 자생종
1. 서 론
물환경 내 오염물질에 대한 물리・화학적 평가는 수질오염물질의 개별농도를 측정할 수 있으나, 분해과정을 거쳐 생성된 다양한 가변성 화학종까지 평가하는데 한계가 있다[ 1]. 2000년대 초부터 정책적으로 생태독성평가 및 생태위해성평가를 도입하기 위해, 다양한 생태독성시험종을 활용한 생태독성평가 및 생태위해성평가가 시도된 바 있으며[ 2~ 5], 현재까지 국외종 뿐 아니라 국내 자생생물종을 이용한 생태독성연구가 진행되고 있다[ 6]. 특히 다양한 국내 자생생물종을 개발하기 위한 문헌 및 실험 연구가 지속적으로 보고되었으며[ 2, 7~ 14], 최근 동물계 연갑강, 소악강, 환대강, 이매패강, 와충강, 히드라충강, 식물계 윤조강, 물이끼강, 우산이끼강, 양치식물강, 원생생물계 유글레나강 등 11개 강이 수서생태독성시험을 위한 국내 자생생물 후보 목록으로 제시된 바 있다[ 14]. 원생생물인 유글레나는 담수 환경에서 흔하게 관찰되는 생물종으로[ 15, 16], 물환경 내 필수 영양단계인 조류와 마찬가지로 상위 영양단계의 주요 영양공급원으로 생태학적으로 중요한 위치를 차지하고 있다[ 17]. 특히 유글레나는 세포벽이 없어 세포 내 영양분에 대한 상위 영양단계의 생물이용성이 높으며[ 17], 식물의 광합성 및 동물의 유영성을 보유하고 있어 오염물질에 대한 식물적・동물적 독성 영향을 동시에 파악할 수 있다[ 18]. 그러나 현재까지 유글레나에 관한 국제 생태독성 표준시험법은 제시된 바 없으며, 유글레나와 유사한 독성시험법인 녹조류 2종, 규조류 1종, 남조류 2종을 이용한 성장저해 표준시험법이 유일하다[ 18~ 24]. 생태위해성평가 시 활용되는 생태독성자료는 신뢰성 있는 생태독성 표준시험법에 따른 결과만 활용해야하므로[ 25], 유글레나를 생태독성시험종으로 활용하기 위해 유글레나를 이용한 생태독성 평가기법이 마련될 필요가 있다. 따라서 유글레나 생태독성 평가기법을 마련하기 위해 유글레나를 이용한 기존 생태독성 연구사례를 분석할 필요가 있으며, 생태독성시험종으로서 유글레나종을 파악할 필요가 있다. 본 연구에서는 유글레나의 생물학적 특성, 국내 분포, 생태독성 연구사례를 수집하였으며, 특히 유글레나 관련 생태독성 연구사례는 시험종, 시험물질, 노출배지, 노출기간, 노출온도 등의 실험방법, 독성 종말점 등의 세부 사항을 중심으로 비교 분석하였다.
2. 유글레나의 특성 연구
2.1. 유글레나의 생물학적 특성 분석
유글레나는 원생동물계(Kingdom Protozoa) 유글레나문(Phylum Euglenophycota) 유글레나강(Class Euglenphyceae) 유글레나목(Order Euglenales) 유글레나과(Family Euglenaceae) 유글레나속(Genus Euglena)에 속하는 생물로[ 26], 연못, 저수지, 습지 등의 담수 환경에 서식하는 것으로 알려져 있다[ 15, 16]. 유글레나의 세포 크기는 15~530 µm로, 가늘고 긴 유선형 모양이나 세포벽 없이 펠리클 구조의 단백질막으로 형성되어 있어 자유로운 변형이 가능하며[ 27, 28], 핵, 안점, 수축포, 엽록체, 편모 등의 세포소기관으로 구성되어 있다[ 29]. 핵은 핵막이 뚜렷하게 형성된 유전정보를 보유한 기관이며[ 29], 붉은 안점은 카로티노이드가 풍부한 과립형으로 빛을 감지하는 역할을 한다[ 30]. 수축포는 원형질 내 노폐물이 유입된 부속 액포가 융합하여 형성되며, 팽만 시 수축 및 배출함으로써 삼투압을 조절하는 역할을 한다[ 31]. 엽록체는 클로로필 a, b, 카로틴, 잔토필과 같은 광합성 색소를 보유하고 있으며, 식물과 같이 광합성 작용을 통한 독립 영양 또는 광영양 역할을 한다[ 16, 32, 33]. 종마다 개수가 상이하나 운동기관으로서 편모가 형성되어 있으며[ 31], β-1, 3 글루칸으로 구성된 불용성 탄수화물인 파라밀론을 보유하고 있어 신규 식품원으로 각광받고 있다[ 32]. 유글레나는 빛과 무기탄소원인 이산화탄소를 이용하여 독립 영양 또는 광영양을 통해 증식하여 녹색을 띄나, 포도당, 젖산, 아세트산, 글루탐산, 말산염, 에탄올과 같은 유기탄소원 존재 시 종속 영양을 통해 증식하여 무색을 띄므로[ 34~ 36], 식물 및 동물의 특성을 동시에 지닌 것으로 알려져 있다[ 16, 33], 유글레나는 무성생식을 통한 종분열을 하며, 이분법으로 증식하는 것으로 보고된 바 있다[ 29, 37, 38].
2.2. 유글레나의 분포 현황
전 세계적으로 유글레나속은 2017년 기준 52종으로 보고되었으며[ 39], 국내 유글레나속은 Table 1과 같이 2018년 및 2019년 기준 54종이 보고된 바 있다[ 40, 41]. 54종 중 Euglena acus, E. texta, E. deses, E. stellata, E. geniculata, E. cantabrica, E. ehrenbergii, E. agilis, E. oxyuis, E. charkoviensis 순으로 개체수가 많은 것으로 보고되었으며, 충청도, 전라도, 경상도, 제주도, 강원도, 경기도 등 전국적으로 분포하며, Fig. 1과 같이 충청남도 정산, 청양, 전라북도 태인, 반월, 전라남도 몽탄, 영산포, 경상북도 다인, 하양, 자인, 경상남도 대합, 제주도 고산, 한림, 무룡, 위미 지역의 표본수가 높은 것으로 확인되었다[ 41].
3. 유글레나를 이용한 생태독성 연구사례
현재까지 보고된 유글레나를 이용한 생태독성 연구사례는 총 41건으로, 주로 E. gracilis를 독성 시험종으로 활용하였고, E. agilis, E. viridis 등 E. gracilis 이외 유글레나를 이용한 생태독성 연구사례는 제한적이었으며, 자세한 내용은 다음과 같다( Fig. 2).
3.1. Euglena gracilis를 이용한 생태독성 연구사례
E. gracilis는 성장속도가 빠르고 실험실 배양이 용이하여[ 16], 1970년대 초부터 현재까지 생태독성 연구에서 지속적으로 활용되고 있으며, 현재까지 36건의 생태독성 연구사례가 발표되어 유글레나속 중 독성 시험종으로서 가장 많이 사용된 것으로 확인되었다. E. gracilis의 생태독성평가를 위한 시험물질은 아연, 카드뮴, 구리, 수은, 니켈, 납, 크롬, 비소 등의 중금속류 및 아트라진, 카보퓨란, 말라티온 등의 농약류가 주로 적용되었으며, 금나노물질, 은나노물질 등 나노물질 연구 또한 진행된 것으로 확인되었다. E. gracilis의 생태독성연구는 3분-120일 동안 노출되었고, 주로 Mineral medium, Koren-Hunter medium를 사용하였으며, 성장, 광합성, 세포형태(예. 세포 크기, 세포막, 핵, 엽록체, 피레노이드 등) 및 구성성분(예. 단백질, 총지질, DNA 등), 운동성, 산화스트레스, 생체 내 시험물질 축적 등이 독성 종말점으로 평가되었다( Table 2).
Fasulo et al. [ 42]은 6일 동안 26℃에서 6가 크롬의 독성 영향을 평가하였으며, 6가 크롬에 의한 세포 수 및 클로로필 함량 감소, 산소발생속도 및 호흡속도 저하, 핵 및 미토콘드리아 확장, 세포질 내 파라밀론 또는 액포 축적 등의 현상이 나타났다. Einicker-Lamas et al. [ 35]은 실온에서 구리 및 아연 독성 영향을 평가하였고, 4일 노출 후 성장 저해 현상이 나타났으며, 3일 노출 후 단백질 및 총 지질 함량 증가 현상이 나타났다. 특히 구리 축적에 의한 액포 내 다양한 형태 및 크기의 과립 형성 현상을 확인하였으며, 이를 액포에 의한 무독화 작용으로 제시하였다. Azizullah et al. [ 43]은 시중 세탁 세제의 독성 영향을 평가하였으며, 7일 동안 노출시킨 결과 세포 밀도 감소, 전자전달속도 rETR, 양자수율 관련 광합성활성 저해, 운동성 및 운동속도 감소, 클로로필 a 및 총 카로테노이드 함량 감소 현상이 나타났다. Li et al. [ 44]은 47 nm 은나노물질 및 은이온 노출 후 광합성, 세포 형태, 세포 내 은 축적 관련 독성 영향을 평가하였다. 2시간 노출 결과, 노출농도에 따른 광합성수율 저해 현상이 나타났으며, 은이온 > 은나노물질 순으로 독성민감도가 나타났다. 1시간 노출 결과, 은나노물질 및 은이온에 노출된 E. gracilis의 세포 부피는 증가하였으며, 세포 내 은 축적 역시 증가한 것으로 나타났다. Xiao et al. [ 45]은 4시간 동안 오염물질의 매개체인 부유입자의 독성 영향을 평가하였으며, 공후만에서 채취한 지름 1 µm 미만의 부유입자 대비 지름 1 µm 이상의 부유입자 처리군에서 세포 수 감소, 산화 스트레스 증가, DNA 손상 증가 현상이 나타나 공후만에서 채취한 지름 1 µm 미만의 부유입자가 지름 1 µm 이상의 부유입자보다 독성이 강한 것으로 나타났다.
3.2. 그 외 Euglena 종을 이용한 생태독성 연구사례
현재까지 보고된 E. agilis, E. viridis 등 E. gracilis 이외 유글레나를 이용한 생태독성 연구사례는 Colemans et al. [ 46], Kottuparambil et al. [ 33], Lee et al. [ 18, 47], Lee and Park [ 48]의 5건이 있다( Table 3). Colemans et al. [ 46]은 E. viridis를 이용하여 아연, 코발트 등 중금속 독성 영향을 보고하였다. Bold basal medium으로 희석된 아연 및 코발트에 3주 동안 21±2℃에서 노출시킨 결과, 대조군 대비 노출군에서 건중량 감소, 생체 내 아연 및 코발트 축적 증가 현상이 나타났다. Kottuparambil et al. [ 33]은 E. agilis를 이용하여 페놀 독성 영향을 평가하였다. Mineral medium으로 희석된 페놀에 1시간 동안 25℃에서 노출시킨 결과, 대조군 대비 전 노출군에서 최대양자수율 Fv/Fm, 전자전달속도 rETR 관련 광합성활성, 세포 길이 대비 폭 compactness, 운동성 및 운동속도 모두 감소하는 것으로 나타났으며, 최소 형광 Fo, 최대 형광 Fm, 비광화학적 소멸 NPQ 관련 광합성활성은 대조군 대비 저농도 노출군에서 증가하다 고농도 노출군에서 감소하는 것으로 나타났다. Lee et al. [ 18]은 4일 동안 Mineral medium으로 희석된 유기용매 5종(아세톤, 클로로포름, 디메틸설폭사이드, 에탄올, 메탄올)에 24±1℃로 노출시킨 E. agilis의 독성 영향을 보고한 바 있다. 4일 노출 후 대조군 대비 유기용매 5종의 노출군 모두 세포밀도가 감소하였으며, 유기용매 간 독성민감도는 클로로포름 > 아세톤 > 에탄올 > 메탄올 > 디메틸설폭사이드 순으로 나타났다. 또한 E. agilis에 대한 독성민감도가 가장 높은 것으로 나타난 클로로포름에 2분간 노출시킨 결과, 운동성 및 운동속도, 세포 compactness가 감소하는 것으로 확인되었다. Lee et al. [ 47]은 2분 동안 24±1℃에서 폐수(예. 축산폐수, 도금폐수) 및 중금속 8종(비소, 카드뮴, 크롬, 구리, 수은, 니켈, 납, 아연)에 노출시킨 E. agilis의 운동속도, 운동성, 세포 길이 대비 폭 compactness 관련 독성 영향을 평가하였으며, 대조군 대비 중금속 8종 처리군 및 도금폐수 처리군에서 3가지 독성 종말점 모두 감소하는 것으로 나타났다. 마지막으로 Lee and Park [ 48]은 도금폐수 1차 처리수와 방류수를 대상으로 2분 간 노출시킨 E. agilis의 운동속도 영향을 평가한 결과, 대조군 대비 모든 처리군에서 운동속도가 감소하는 것으로 나타났다.
4. 결 론
본 연구에서는 생태독성시험종으로서 유글레나가 적합한지 평가하기 위하여 생물학적 특성 및 국내 분포 현황을 조사하였으며, 유글레나 관련 생태독성 연구사례를 수집하여 시험종, 시험물질, 노출배지, 노출기간, 노출온도 등의 실험방법, 독성 종말점 등의 세부 사항을 중심으로 분석하였다. 현재까지 보고된 유글레나 생태독성 연구는 총 41건으로, 이 중 대부분의 시험종은 E. gracilis로 확인되었으며, E. agilis, E. viridis도 일부 사용되었다. 유글레나의 독성종말점은 성장, 광합성, 세포형태(예. 세포 크기, 세포막, 핵, 엽록체, 피레노이드 등) 및 구성성분(예. 단백질, 총지질, DNA 등), 운동성, 산화스트레스, 생체 내 시험물질 축적 등 다양하게 평가된 것으로 나타났으며, 시험물질의 종류 및 노출농도에 따라 차이는 있으나 대체로 독성 영향이 나타나는 것으로 확인되었다. 국내 자생생물 유글레나는 총 54종으로 국내에 광범위하게 분포하는 것으로 나타났으며, 이 중 기존 생태독성연구에서 사용된 E. gracilis, E. agilis, E. viridis도 포함된 것으로 나타났다. 이와 같이 유글레나의 특성, 분포 및 독성연구사례를 조사한 결과, 유글레나종이 수서 생태독성평가에 잠재적 활용 가능성이 있을 것으로 판단된다. 하지만 유글레나의 국제적인 생태독성 표준시험법은 제시되어 있지 않아 보고된 독성평가 연구의 시험기간, 시험방법 및 독성종말점 등이 모두 다르게 측정되었으므로, 국내 생물종을 이용한 수서 생태독성평가 기법 개발 연구(녹조류, 물벼룩, 어류) 사례를 기반으로 현재 파악된 국내 자생 유글레나를 활용하여 체계적인 유글레나 생태독성 평가기법이 마련될 필요가 있다. 또한 국내외 학술 논문을 통해 유글레나 3종의 생태독성평가가 제한적으로 수행되었으므로, 독성평가시험종으로써 활용을 위하여 유글레나 종에 따른 생태학적 특성과 함께 배양기법, 실험 용이성 등의 후속적인 실험연구가 요구된다.
Acknowledgments
본 연구는 정부(환경부)의 재원으로 국립생물자원관의 지원을 받아 수행하였음(NIBR201830201). This research was supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Science, ICT and future planning (2016R1A2B3010445), and as part of Konkuk University’s research support program for its faculty on sabbatical leave in 2019. This study was also funded by the Ministry of Environment as the Graduate School of Specialization for managing information of chemical risk.
Fig. 1.
Geological distributions of Korean native Genus Euglena in Korea (NIBR [ 40]). Blue squares mean the number of specimens. 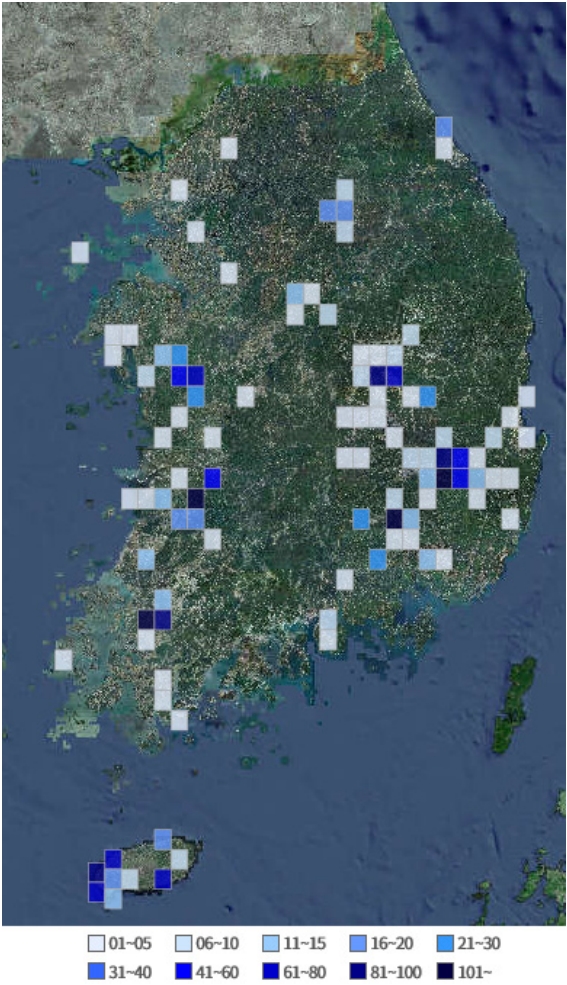
Fig. 2.
Classification of Euglena sp. studies, test endpoints and test duration. Parenthesis indicates the number of studies. 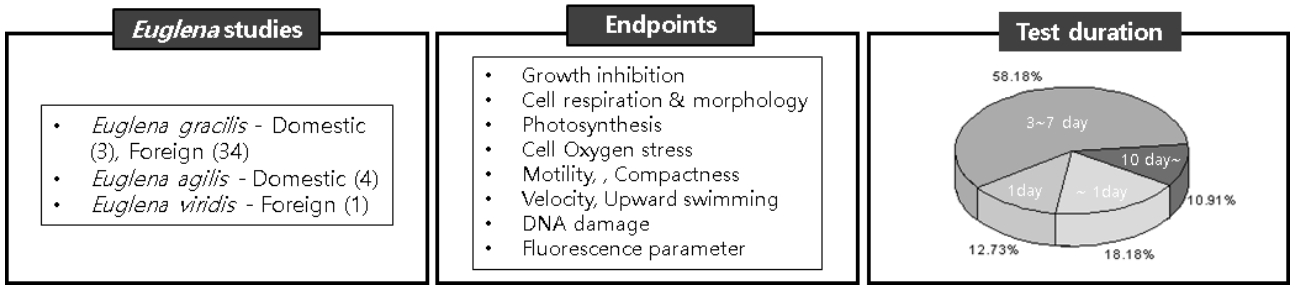
Table 1.
List of Euglena in Korean Native Organisms (NIBR [ 40, 41]).
|
Korean native Genus Euglena (54 species) |
|
Euglena acus
|
Euglena geniculata
|
Euglena pseudostellata
|
|
Euglena adhaerens
|
Euglena gracilis
|
Euglena retronata
|
|
Euglena agilis
|
Euglena granulata
|
Euglena rubra
|
|
Euglena allorgei
|
Euglena grisolii
|
Euglena sanguinea
|
|
Euglena anabaena
|
Euglena guntheri
|
Euglena spirogyra
|
|
Euglena archaeoplastidiata
|
Euglena gymnodinioides
|
Euglena splendens
|
|
Euglena cantabrica
|
Euglena helicoideus
|
Euglena stellata
|
|
Euglena caudata
|
Euglena hemichromata
|
Euglena synchlora
|
|
Euglena chadefaudii
|
Euglena laciniata
|
Euglena texta
|
|
Euglena charkoviensis
|
Euglena limnophila
|
Euglena tripteris
|
|
Euglena chlamydophora
|
Euglena minuta
|
Euglena tristella
|
|
Euglena clara
|
Euglena mutabilis
|
Euglena truncata
|
|
Euglena clavata
|
Euglena oblonga
|
Euglena variabilis
|
|
Euglena communis
|
Euglena obtusa
|
Euglena vagans
|
|
Euglena deses
|
Euglena oxyuris
|
Euglena variabilis
|
|
Euglena ehrenbergii
|
Euglena pascheri
|
Euglena velata
|
|
Euglena exilis
|
Euglena pisciformis
|
Euglena viridis
|
|
Euglena gaumei
|
Euglena proxima
|
Euglena zakrysiae
|
Table 2.
Toxicity data using Euglena gracilis.
|
Test Chemicals |
Test methods |
Toxicity endpoints |
References |
|
Zinc, cadmium, mercury |
∙ Exposure temp.: 25℃ |
Photosynthesis |
Filippis et al. [49] |
|
∙ Exposure duration: 10 days |
|
Chromium (VI) |
∙ Exposure temp.: 26℃ |
Growth inhibition, respiration, photosynthesis, and morphology |
Fasulo et al. [42] |
|
∙ Exposure duration: 6 days |
|
Copper, mercury, cadmium, and lead |
∙ Test medium: mineral medium |
Absorption, motility, and velocity |
Stallwitz et al. [50] |
|
∙ Exposure temp.: 23℃ |
|
∙ Exposure duration: 11 days |
|
Cadmium and pentachlorophenol |
∙ Test medium: mineral medium |
Growth inhibition and mortality |
Barque et al. [51] |
|
∙ Exposure duration: 7 days |
|
Mercury, cadmium, and chrome |
∙ Test medium: tris-acetate-phosphate・medium |
Cell growth |
Gajdosova et al. [52] |
|
∙ Exposure temp.: 26±2℃ |
|
∙ Exposure duration: 5 days |
|
Mercury, cadmium, and lead |
∙ Test medium: Hutner acidic organotrophic medium and lactic medium |
Growth inhibition, cell structure, respiration, chlorophyll content, photosynthesis, and metal uptake |
Navarro et al. [53] |
|
∙ Exposure temp.: 20-25℃ |
|
∙ Exposure duration: 6 days |
|
Mercury, cadmium, and lead |
∙ Test medium: Hutner acidic organotrophic medium and lactic medium |
Growth inhibition, metal uptake, chlorophyll content, oxygen change, and acid-soluble thiols |
Devars et al. [54] |
|
∙ Exposure temp.: 22-27℃ |
|
∙ Exposure duration: 9-10 days |
|
Wastewater |
∙ Test medium: mineral medium |
Motility, velocity, compactness, upward swimming, and alignment |
Tahedl et al. [55] |
|
∙ Exposure temp.: 19℃ |
|
∙ Exposure duration: 3 minutes |
|
Copper and zinc |
∙ Exposure duration: 3, 4 days |
Growth inhibition, protein, total lipid, and morphology |
Einicker-Lamas et al. [35] |
|
Methylviologen, UV-A, and UV-B |
∙ Test medium: Koren-Hunter medium |
Growth inhibition, viability, and morphology |
Palmer et al. [56] |
|
∙ Exposure temp.: 29±1℃ |
|
∙ Exposure duration: 3 days |
|
∙ UV Exposure duration: 2 hours/day for 3 days |
|
Cadmium |
∙ Test medium: Koren-Hunter medium |
Oxygen stress, DNA damage, and fluorescence intensity |
Watanabe et al. [57] |
|
∙ Exposure duration: 1 hour, 5 days |
|
Cadmium |
∙ Test medium: Koren-Hunter medium |
Oxygen stress, DNA damage, and fluorescence intensity |
Watanabe et al. [37] |
|
∙ Exposure temp.: 28℃ |
|
∙ Exposure duration: 5 days |
|
∙ Test medium: Koren-Hunter medium |
Metal uptake |
Watanabe et al. [37] |
|
∙ Exposure temp.: 28℃ |
|
∙ Exposure duration: 1 day |
|
Copper and aluminum |
∙ Test medium: Taub and Dollar’s salt solution |
Cell density |
Fuma et al. [58] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 120 days |
|
Atrazine |
∙ Test medium: soil water extracts |
Cell growth and chlorophyll content |
Lockert et al. [59] |
|
∙ Exposure temp.: 21℃ |
|
∙ Exposure duration: 5 days |
|
Herbicides (Roundup and Avans) |
∙ Test medium: mineral medium |
Motility, velocity, and upward swimming |
Pettersson et al. [60] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 60 seconds, 7 days |
|
Chromium and copper |
∙ Test medium: mineral medium |
Cell growth, chlorophyll fluorescence kinetics, and oxygen stress |
Rocchetta et al. [61] |
|
∙ Exposure temp.: 26±1℃ |
|
∙ Exposure duration: 7 days |
|
Chromium (VI) |
∙ Test medium: modified acidic-saline Hunter medium |
Growth inhibition, photosynthesis, metal uptake, and metal accumulation |
García-García et al. [36] |
|
∙ Exposure temp.: 22-25℃ |
|
∙ Exposure duration: 5 days |
|
Nickel and cadmium |
∙ Test medium: mineral medium |
Photosynthesis, motility, velocity, and upward swimming |
Ahmed et al. [62] |
|
∙ Exposure temp.: 22℃ |
|
∙ Exposure duration: 1, 7 days |
|
∙ Test medium: mineral medium |
Growth inhibition |
Ahmed et al. [62] |
|
∙ Exposure temp.: 22℃ |
|
∙ Exposure duration: 1 day |
|
Chromium (VI) Chromium (III) |
∙ Test medium: Greenblatt and Schiff medium |
Growth inhibition and oxygen uptake |
Jasso-Chávez et al. [63] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 6 days |
|
Copper |
∙ Test medium: mineral medium |
Photosynthesis |
Ahmed et al. [64] |
|
∙ Exposure temp.: 22℃ |
|
∙ Exposure duration: 5 days |
|
∙ Test medium: mineral medium |
Motility and upward swimming |
Ahmed et al. [64] |
|
∙ Exposure temp.: 22℃ |
|
∙ Exposure duration: 1 day |
|
Carbofuran and malathion |
∙ Test medium: mineral medium |
Growth rate, |
Azizullah et al. [16] |
|
∙ Exposure temp.: 20℃ |
motility, velocity, |
|
∙ Exposure duration: 3, 7 days |
upward swimming, photosynthesis, and chlorophyll content |
|
Laundry detergent Ariel (Procter and Gamble GmbH, Germany) |
∙ Test medium: mineral・medium |
Motility, velocity, upward swimming, photosynthesis, chlorophyll content, and fluorescence parameter |
Azizullah et al. [65] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 3 days |
|
Laundry detergent Ariel (Procter and Gamble GmbH, Germany) |
∙ Test medium: mineral medium |
Growth inhibition, motility, velocity, upward swimming, photosynthesis, chlorophyll content, and fluorescence parameter |
Azizullah et al. [43] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 7 days |
|
Benzene |
∙ Test medium: Koren-Hunter medium |
Growth inhibition, morphology, and chlorophyll content |
Peng et al. [66] |
|
∙ Exposure temp.: 28℃ |
|
∙ Exposure duration: 3, 5 days |
|
Gold |
∙ Test medium: tris-acetate-phosphate medium |
Growth inhibition |
Nam et al. [67] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 3 days |
|
Gold nanoparticles |
∙ Test medium: tris-acetate-phosphate medium |
Growth inhibition |
Nam et al. [68] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 3 days |
|
Benzene, toluene, ethylbenzene, and xylene |
∙ Test medium: Koren-Hunter medium |
Growth inhibition, morphology, and chlorophyll content |
Peng et al. [69] |
|
∙ Exposure temp.: 28℃ |
|
∙ Exposure duration: 1, 5 days |
|
Graphene oxide |
∙ Test medium: mineral medium |
Growth inhibition, morphology, shading ratio, and oxygen stress (MDA, CAT, and SOD) |
Hu et al. [70] |
|
∙ Exposure temp.: 25±2℃ |
|
∙ Exposure duration: 10 days |
|
Silver nanoparticles and silver |
∙ Test medium: synthetic medium Talaquil |
Growth inhibition photosynthesis, and morphology |
Li et al. [44] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 1, 2 hours |
|
Industrial waste water |
∙ Test medium: mineral medium |
Fluorescence parameter |
Azizullah et al. [71] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 1, 7 days |
|
Potassium sorbate |
∙ Test medium: mineral medium snf organic medium |
Motility, velocity, upward swimming, and florescence parameter |
Engel et al. [72] |
|
∙ Exposure temp.: 18℃ |
|
∙ Exposure duration: 1 days |
|
Copper and silver |
∙ Test medium: mineral medium |
Photosynthesis and fluorescence parameter |
Strauch et al. [73] |
|
∙ Exposure temp.: 20℃ |
|
∙ Exposure duration: 3 hours |
|
PVP-coated Gold nanoparticles |
∙ Test medium: tris-acetate-phosphate medium |
Growth inhibition |
Kwak et al. [74] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 3 days |
|
Nickel |
∙ Test medium: modified acidic-saline Hunter medium |
Photosynthesis, chlorophyll content, oxygen stress (APX), and metal uptake |
García-García et al. [75] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 3 days |
|
∙ Test medium: modified acidic-saline Hunter medium |
Growth inhibition |
García-García et al. [75] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 5 days |
|
Natural suspended particles (GB and ERA sampling) |
∙ Test medium: mineral medium |
Growth inhibition, photosynthetic, oxygen stress (SOD), and DNA damage |
Xiao et al. [45] |
|
∙ Exposure temp.: 25±1℃ |
|
∙ Exposure duration: 4 days |
|
Arsenic (Ⅲ) |
∙ Test medium: organic medium |
Cell growth, motility, oxygen stress (ROS), photosynthesis, and biochemical parameter |
Tahira et al. [76] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 7 days |
Table 3.
Toxicity data using other Euglena.
|
Test species |
Test Chemicals |
Test methods |
Toxicity endpoints |
References |
|
Euglena viridis
|
Zinc and cobalt |
∙ Test medium: Bold’s basal medium |
Cell growth and metal uptake |
Colemans et al. [46] |
|
∙ Exposure temp.: 21±2℃ |
|
∙ Exposure duration: 3 weeks |
|
Euglena agilis
|
Phenol |
∙ Test medium: mineral medium |
Motility, velocity, and photosynthetic activity |
Kottuparambil et al. [33] |
|
∙ Exposure temp.: 25℃ |
|
∙ Exposure duration: 1 hour |
|
Acetone, chloroform, dimethylsulfoxide, ethanol, and methanol |
∙ Test medium: mineral medium |
Growth inhibition |
Lee et al. [18] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 4 days |
|
Chloroform |
∙ Test medium: mineral medium |
Motility, velocity, and cell compactness |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 2 minutes |
|
Wastewater and metals (Ag, Cd, Cr6+, Cu, Hg, Ni, Pb, and Zn) |
∙ Test medium: mineral medium with sodium acetate |
Motility and velocity |
Lee et al. [47] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 2 minutes |
|
Metal plating wastewater |
∙ Test medium: mineral medium with sodium acetate |
Velocity |
Lee and Park [48] |
|
∙ Exposure temp.: 24±1℃ |
|
∙ Exposure duration: 2 minutes |
References
1. Y.-J.. An, S.-H.. Nam, J.-K.. Lee, Domestic test species for aquatic toxicity assessment in Korea, Korean. J. Environ. Biol., 40(1), 1-13(2007).
2. Ministry of Environment and National Institute of Environmental Research, Development of integrated methodology for evaluation of water environment Ⅲ, (2006).
3. National Institute of Environmental Research, Study on chemical ranking and scoring methodology for surface water to protect human health and aquatic ecosystem, (2010).
4. National Institute of Environmental Research, Assessment of environmental exposure of nanomaterials in aqueous phase, (2014).
5. Ministry of Environment, Development of water quality criteria for aquatic life III, (2017).
6. T.-J.. Park, J.-H.. Lee, M.-S.. Lee, C.-H.. Park, C.-H.. Lee, S.-D.. Moon, J.. Chung, R.. Cui, Y.-J.. An, D.-H.. Yeom, S.-H.. Lee, J.-K.. Lee, K.-D.. Zoh, Development of water quality criteria of ammonia for protecting aquatic life in freshwater using species sensitivity distribution method, Sci. Total Environ. 634, 934-940(2018).  7. S. W.. Kim, J. I.. Kwak, J. Y.. Yoon, S.-W.. Jeong, Y.-J.. An, Selection of domestic test species suitable for Korean soil ecological risk assessment, J. Korean Soc. Environ. Eng., 36(5), 359-366(2014).  8. Y.-J.. An, S.-H.. Nam, W.-M.. Lee, Fundamentals of ecotoxicity evaluation methods using domestic aquatic organisms in Korea: (II) Water Flea, Korean. J. Environ. Biol., 40(3), 357-369(2007).
9. Y.-J.. An, S.-H.. Nam, Y.-W.. and Baek, Fundamentals of ecotoxicity evaluation methods using domestic aquatic organisms in Korea: (III) Green Algae, Korean. J. Environ. Biol., 41(2), 117-127(2008).
10. S.-H.. Nam, C.-Y.. Yang, Y.-J.. An, J.-K.. Lee, Fundamentals of ecotoxicity evaluation methods using domestic aquatic organisms in Korea: (I) Fish, Korean. J. Environ. Biol., 40(2), 173-183(2007).
11. Y.-J.. An, S. W.. Kim, J. M.. Moon, S.-W.. Jeong, R.-Y.. Kim, J.-K.. Yoon, T.-S.. Kim, An introductory research for devolopment of soil ecological risk assessment in Korea, J. Korean Soc. Environ. Eng., 39(6), 348-355(2017).  12. S.-H.. Nam, Y.-J.. An, Investigation of korean native organisms for development of ecotoxicity test: (1) Aquatic test Species, J. Korean Soc. Environ. Eng., 40(1), 34-47(2018).  13. S-H.. Nam, Y-J.. An, Investigation of korean native organisms for development of ecotoxicity test: (2) Soil test Species, J. Korean Soc. Environ. Eng., 40(1), 48-57(2018).  14. S.-H.. Nam, M.. Kim, Y.-J.. An, Deriving candidate list of korean native organisms for ecotoxicity testing: (1) Aquatic test species, J. Korean Soc. Environ. Eng., 41(1), 10-23(2019).  15. W.. Shin, S. M.. Boo, I.. Inouye, Ultrastructure of Euglena anabaena var. minor (Euglenophyceae), Phycological Res., 48(1), 19-25(2000).  16. A.. Azizullah, P.. Richter, D.-P.. Hӓder, Comparative toxicity of the pesticides carbofuran and malathion to the freshwater flagellate Euglena gracilis, Ecotoxicology., 20(6), 1442-1454(2011).  17. M.. Zeng, W.. Hao, Y.. Zou, M.. Shi, Y.. Jiang, P.. Xiao, A.. Lei, Z.. Hu, W.. Zhang, L.. Zhao, J.. Wang, Fatty acid and metabolomic profiling approaches differentiate heterotrophic and mixotrophic culture conditions in a microalgal food supplement ‘Euglena’, BMC Biotechnol., 16(1), 1-8(2016).  18. J.. Lee, S.-W.. Chang, J.-T. Kim, D.-W.. Kim, Toxic effects of 5 organic solvents on Euglena gracilis, Korean. J. Environ. Biol., 33(1), 45-52(2015).  19. Organization for Economic Cooperation and Development (OECD), TG No. 201. Freshwater alga and cyanobacteria, growth inhibition test(2011).
20. European Community (EC), C.3. Algal inhibition test(1992).
21. American Society for Testing and Materials (ASTM), D3978-04 Standard practice for algal growth potential testing with Pseudokirchneriella subcapitata(2004).
22. American Society for Testing and Materials (ASTM), E1218-04 Standard guide for conducting static toxicity tests with microalgae(2004).
23. International Organization for Standardization (ISO), ISO 14442 Water quality-Guidelines for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waste water(2006).
24. International Organization for Standardization (ISO), ISO 8692 Water quality–Fresh water algal growth inhibition test with unicellular green algae(2012).
25. H. J.. Klimisch, M.. Andreae, U.. Tillmann, A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data, Regul. Toxicol. Pharmacol., 25(1), 1-5(1997).  27. G. F.. Leedale, Pellicle structure in Euglena, British Phycological Bulletin., 2(5), 291-306(1964).  28. J. R.. Sommer, The ultrastructure of the pellicle complex of Euglena gracilis, J. Cell. Biol., 24(2), 253-257(1965).  29. M.. Gojdics, The cell morphology and division of Euglena deses Ehrbg, Trans. Am Microsc. Soc., 53(4), 299-310(1934).  30. N. J.. Colley, D.-E.. Nillson, Photoreception in phytoplankton, Integr. Comp. Biol., 56(5), 764-775(2016).  31. G. F.. Leedale, B. J. D.. Meeuse, E. G.. Pringsheim, Structure and Physiology of Euglena spirogyra. Ⅰand Ⅱ, Arch. Mikrobiol., 50(1), 68-102(1965).  32. J.. Ueda, K.. Miyamoto, T.. Sato, Y.. Momotani, Identification of jasmonic acid from Euglena gracilis Z as a plant growth regulator, Agri. Biol. Chem., 55(1), 275-276(1991).  33. S.. Kottuparambil, Y.-J.. Kim, H.. Choi, M.-S.. Kim, A.. Park, J.. Park, W.. Shin, T.. Han, A rapid phenol toxicity test based on photosynthesis and movement of the freshwater flagellate, Euglena agilis Carter, Aquat. Toxicol., 155, 9-14(2014).  34. J. C.. Ogbonna, S.. Tomiyama, H.. Tanaka, Heterotrophic cultivation of Euglena gracilis Z for efficient production of α-tocopherol, J. Appl. Psychol., 10(67), 67-74(1998).
35. E.-L.. Marcelo, A. M.. Gustavo, B. F.. Thiago, L. S. S.. Fabio, G.. Flávio, M.. Kildare, A.. Marcia, M. O.. Mecia, Euglena gracilis as a model for the study of Cu 2+ and Zn 2+ toxicity and accumulation in eukaryotic cells, Environ. Pollut., 120(3), 779-786(2002).  36. D. G.-G.. Jorge, S. R.-Z.. José, J.-C.. Ricardo, M.-C.. David, M.-S.. Rafael, Chromium uptake, retention and reduction in photosynthetic Euglena gracilis, Arch. Microbiol., 191(5), 431-440(2009).  37. W.. Masumi, H.. Kenji, O.. Ken'ichi, S.. Tetsuya, Cadmium-dependent generation of reactive oxygen species and mitochondrial DNA breaks in photosynthetic and non-photosynthetic strains of Euglena gracilis, Comp. Biochem. Physiol., 134(2), 227-234(2003).
38. G. W.. Tannreuther, Nutrition and Reproduction in Euglena, Arch. Entwicklmech. Org., 52(3-4), 367-383(1923).  40. National Institute of Biological Resources (NIBR), National list of species of Korea, 2017(2018).
42. M. P.. Fasulo, M.. Bassi, A.. Donini, Cytotoxic effects of hexavalent chromium in Euglena gracilis. Ⅱ. Physiological and ultrastructural studies, Protoplasma., 114(1-2), 35-43(1983).  43. A.. Azizullah, P.. Richter, M.. Jamil, D-P.. Häder, Chronic toxicity of a laundry detergent to the freshwater flagellate Euglena gracilis, Ecotoxicology., 21(7), 1957-1964(2012).  44. X.. Li, K.. Schirmer, L.. Bernard, L.. Sigg, S.. Pillai, R.. Behra, Silver nanoparticle toxicity and association with the alga Euglena gracilis, Environ. Sci. Nano., 2(6), 594-602(2015).  45. Y.. Xiao, P.. Zhao, Y.. Yang, M.. Li, Ecotoxicity evaluation of natural suspended particles using the microalga, Euglena gracilis, Chemosphere., 206, 802-808(2018).  46. R. D.. Coleman, R. L.. Coleman, E. L.. Rice, Zinc and cobalt bioconcentration and toxicity in selected algal species, Bot. Gaz., 132(2), 102-109(1971).  47. J.. Lee, K. N.. Kim, D. K.. Park, Ecotoxicity test using E. agilis biomonitoring system, Korean. J. Environ. Biol., 34(2), 124-131(2016).  48. J.. Lee, D. K.. Park, Toxic effects of metal plating wastewater on Daphnia magna and Euglena agilis, Korean. J. Environ. Biol., 34(2), 116-123(2016).  49. L. F. D.. Filippis, R.. Hampp, H.. Ziegler, The effects of sublethal concentrations of zinc, cadmium and mercury on Euglena, Arch. Microbiol., 128(4), 407-411(1981).  50. E.. Stallwitz, D.-P.. Häder, Effects of heavy metals on motility and gravitactic orientation of the flagellate, Euglena gracilis, Europ. J. Protistol., 30(1), 18-24(1994).  51. J. P.. Barque, A.. Abahamid, Y.. Bourezgui, H.. Chacun, J.. Bonaly, Growth responses of achlorophyllous Euglena gracilis to selected concentrations of cadmium and pentachlorophenol, Arch. Environ. Contam. Toxicol., 28(1), 8-12(1995).  52. J.. Gajdosova, E.. Reichrtova, Different growth response of Euglena gracilis to Hg, Cd, Cr and Ni compounds, Fresenius. J. Anal. Chem., 354(5-6), 641-642(1996).  53. L.. Navarro, M. E.. Torres-Márquez, S.. González-Moreno, S.. Devars, R.. Hernández, R.. Moreno-Sánchez, Comparison of physiological changes in Euglena gracilis during exposure to heavy metals of heterotrophic and autotrophic Cells, Comp. Biochem. Physiol. C Pharmacol. Toxicol. Endocrinol., 116(3), 265-272(1997).  54. S.. Devars, R.. Hernández, R.. Moreno-Sánchez, Enhanced heavy metal tolerance in two strains of photosynthetic Euglena gracilis by preexposure to mercury or cadmium, Arch. Environ. Contam. Toxicol., 34(2), 128-135(1998).  55. H.. Tahedl, D.-P.. Hӓder, Automated biomonitoring using real time movement analysis of Euglena gracilis, Ecotoxicol. Environ. Saf., 48(2), 161-169(2001).  56. H.. Palmer, M.. Ohta, M.. Watanabe, T.. Suzuki, Oxidative stress-induced cellular damage caused by UV and methyl viologen in Euglena gracilis and its suppression with rutin, J. Photochem. Photobiol. B, Biol., 67(2), 116-129(2002).  57. M.. Watanabe, T.. Suzuki, Involvement of reactive oxygen stress in cadmium-induced cellular damage in Euglena gracilis, Comp. Biochem. Physiol. C Pharmacol. Toxicol. Endocrinol., 131(4), 491-500(2002).  58. S.. Fuma, N.. Ishii, H.. Takeda, K.. Miyamoto, K.. Yanagisawa, Y.. Ichimasa, M.. Saito, Z.. Kawabata, G. G.. Polikarpov, Ecological effects of various toxic agents on the aquatic microcosm in comparison with acute ionizing radiation, J. Environ. Radioact., 67(1), 1-14(2003).  59. C. K.. Lockert, K. D.. Hoagland, B. D.. Siegfried, Comparative sensitivity of freshwater algae to Atrazine, Bull. Environ. Contam. Toxicol., 76(1), 73-79(2006).  60. M.. Pettersson, N. G. A.. Ekelund, Effects of the herbicides roundup and avans on Euglena gracilis, Arch. Envrion. Contam. Toxicol., 50(2), 175-181(2006).  61. I.. Rocchetta, H.. and Küpper, Chromium and copper‐induced inhibition of photosynthesis in Euglena gracilis analysed on the single-cell level by fluorescence kinetic microscopy, New Phytol., 182(2), 405-420(2009).  62. H.. Ahmed, D.-P.. Häder, Rapid ecotoxicological bioassay of nickel and cadmium using motility and photosynthetic parameters of Euglena gracilis, Environ. Exp. Bot., 69(1), 68-75(2010).  63. P.-R.. Angélica, L.. Elizabeth, C. G. P.. Juan, G.. Noemi, M.-S.. Rafael, Toxic effects of Cr(VI) and Cr(III) on energy metabolism of heterotrophic Euglena gracilis, Aquat. Toxicol., 100(4), 329-338(2010).  64. H.. Ahmed, D.-P.. Häder, A fast algal bioassay for assessment of copper toxicity in water using Euglena gracilis, J. Appl. Phycol., 22(6), 785-792(2010).  65. A.. Azizullah, P.. Richter, D.-P.. Häder, Toxicity assessment of a common laundry detergent using the freshwater flagellate Euglena gracilis, Chemosphere., 84(10), 1392-1400(2011).  66. C.. Peng, D. M.. Arthur, H. T.. Sichani, Q.. Xia, J. C.. Ng, Assessing benzene-induced toxicity on wild type Euglena gracilis Z and its mutant strain SMZ, Chemosphere., 93(10), 2381-2389(2013).  67. S.-H.. Nam, W.-M.. Lee, Y.-J.. Shin, S.-J.. Yoon, S.-W.. Kim, J. I.. Kwak, Y.-J.. An, Derivation of guideline values for gold(Ⅲ) ion toxicity limits to protect aquatic ecosystems, Water. Res., 48, 126-136(2014).  68. S.-H.. Nam, Y.-J.. Shin, W.-M.. Lee, S.-W.. Kim, J. I.. Kwak, S.-J.. Yoon, Y.-J.. An, Conducting a battery of bioassays for gold nanoparticles to derive guideline value for the protection of aquatic ecosystems, Nanotoxicology., 9(3), 326-335(2015).  69. C.. Peng, J.-W.. Lee, H. T. Sichani, J. C.. Ng, Toxic effects of individual and combined effects of BTEX on Euglena gracilis, J. Hazard. Mater., 284, 10-18(2015).  70. C.. Hu, Q.. Wang, H.. Zhao, L.. Wang, S.. Guo, X.. Li, Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilis, Chemosphere., 128, 184-190(2015).  71. A.. Azizullah, P.. Richter, D.-P.. Häder, Effects of long-term exposure to industrial wastewater on photosynthetic performance of Euglena gracilis measured through chlorophyll fluorescence, J. Appl. Phycol., 27(1), 303-310(2015).  72. F.. Engel, L. H.. Pinto, L. F. D.. Ciampo, L.. Lorenzi, C. D. T.. Heyder, D. T.. Häder, G. S.. Erzinger, Comparative toxicity of physiological and biochemical parameters in Euglena gracilis to short-term exposure to potassium sorbate, Ecotoxicology., 24, 153-162(2015).  73. S. M.. Strauch, P. R.. Richter, F. W. M.. Haag, M.. Krüger, J.. Krüger, A.. Azizullah, R.. Breiter, M.. Lebert, Delayed fluorescence, steady state fluorescence, photosystem II quantum yield as endpoints for toxicity evaluation of Cu 2+ and Ag+, Environ. Exp. Bot., 130, 174-180(2016).  74. J. I.. Kwak, R.. Cui, S.-H.. Nam, S. W.. Kim, Y.. Chae, Y.-J.. An, Multispecies toxicity test for silver nanoparticles to derive hazardous concentration based on species sensitivity distribution for the protection of aquatic ecosystems, Nanotoxicology., 10(5), 521-530(2016).  75. J. D.. García-García, K. A.. Peña-Sanabria, R.. Sánchez-Thomas, R.. Moreno-Sánchez, Nickel accumulation by the green algae-like Euglena gracilis, J. Hazard. Mater., 343, 10-18(2018).  76. S.. Tahira, S.. Khan, S.. Samrana, L.. Shahi, I.. Ali, W.. Murad, Z. U.. Rehman, A.. Azizullah, Bio-assessment and remediation of arsenic (arsenite As-III) in water by Euglena gracilis, J. Appl. Psychol., 31(1), 423-433(2019). 
|
|












