The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
고체상 추출법(SPE: Solid Phase Extration)을 이용한 과불화화합물 분석 특성
Abstract
In the past, SPE using HLB (Hydrophilic Lipophilic Balanced) cartridges was widely used to analyze PFCs (perfluorinated compounds) in multi-media, but recently the trend goes to using WAX (Weak Anion-eXchange) cartridges. HLB and WAX cartridges were used for studying the extraction characteristics of PFCs. In order to investigate the influence of storage materials on PFCAs, the SPE extracted samples were stored in glass and pp vials and concentration change was measured over time. PFCAs (perfluoroalkycarboxylic acids), PFSAs (perfluoroalkansulfonate) and precursors were analyzed. Analysis using WAX cartridges showed that some of the PFCAs, PFSAs and precursors were higher than those of HLB cartridges, while some of them were low. The PFBA (C4) and PFPeA (C5) of the PFCAs show higher efficiency in the WAX cartridge with increasing sample concentration. Over time, in PFCAs less than C11 (PFUnDA) and PFSAs, no large concentration was observed on both glass and pp materials. But in the case of the PFCAs higher than C13 (PFTrDA), the concentration was gradually decreased. The concentration of PFOA and PFOS did not change much after 144 hours regardless of storage materials. As a result of decrease in ΣPFCs (22 species) concentration, it is thought that PFCs (22 species) were converted into another PFCs that were not analyzed.
Key words: PFCs (Perfluorinated Compounds), PFOA, PFOS, SPE (Solid Phase Extration)
요약
과불화화합물은 여러 매체에서 분석하고 있지만 대부분의 매체에서 고체상 추출(Solid Phase Extration, SPE) 방법으로 분석을 하고 있다. 과거에는 SPE에서 HLB (Hydrophilic Lipophilic Balanced) 카트리지를 범용적으로 사용하였으나, 최근에는 WAX (Weak Anion-eXchange) 카트리지를 사용하여 추세이다. HLB와 WAX 카트리지를 사용하여 과불화화합물의 추출 특성 및 유리와 PP 재질에 보관하여 시간이 경과함에 따라 재질에 흡착되는 과불화화합물의 농도 변화에 대한 실험을 진행하였다. 분석 항목은 PFOA를 포함한 PFCAs (perfluoroalkycarboxylic acids : 13종), PFOS를 포함한 PFSAs (perfluoroalkansulfonates : 4종), precursors (5종)를 분석하였다. WAX 카트리지를 사용하여 분석한 결과 PFCAs, PFSAs, precursors의 일부 항목은 HLB 카트리지를 사용하였을 때보다 높게 나오는 반면, 일부 항목은 낮게 나오는 현상을 확인하였다. PFCAs의 PFBA (C4), PFPeA (C5)는 시료의 농도가 높을수록 Intensity ratio가 점차 증가되는 결과로 WAX 카트리지의 효율이 우세한 것으로 보여진다. 시간이 경과함에 따라 유리와 PP 재질에 보관하여 분석한 결과 PFCAs 계열에서는 탄소 개수가 C11 (PFUnDA)이하와 PFSAs의 계열은 큰 농도 변화를 보이지 않지만, PFCAs의 탄소 개수가 C13 (PFTrDA) 이상의 항목에서는 농도가 점차 감소하는 동일한 현상을 보였다. 보관 재질에 상관없이 시료가 144시간이 경과한 후에 PFOA, PFOS의 농도는 큰 변화를 보이지 않지만, ΣPFCs 농도는 감소하는 결과로 분석한 과불화화합물 (22종)외 다른 과불화화합물로 전환된 것으로 판단된다.
주제어: 과불화화합물, 과불화옥탄산, 과불화옥탄술폰산, 고체상 추출
1. 서 론
Perfluorinated compounds (PFCs)는 반세기 동안 기하급수적으로 제조되었다. PFCs는 물과 기름을 방수하는 독특한 성질 때문에 카펫, 가죽, 직물, 실내 장식품, 종이, 식품 용기, 소화거품 및 살충제와 같은 다양한 용도로 사용되었다[ 1]. PFCs는 고에너지의 탄소와 불소의 결합으로 되어있으며 가수분해, 광분해, 미생물 분해 및 척추동물의 신진대사에 내성을 가지며, 안정성이 높아 분자끼리 인력이 낮고, 소수성(hydrophobicity)과 친유성(lipophobicity)을 가지고 있다[ 2, 3]. PFCs는 perfluoroalkyl에 carboxylates가 결합한 Perfluoroalkycarboxylic acids (PFCAs)와, sulfonates가 결합한 Perfluoroalkansulfonates (PFSAs)로 구분되며, 전구체로 telomer alcohols가 결합한 Fluorinated Telomer Alcohols (FTOHs), sulfonamide가 결합한 Perfluorooctanesulfonamides (FOSAs), sulfonamidoacetic acid가 결합한 Perfluorooctanesulfonamidoacetic acids (FOSSAs) 등이 있다.
완전한 이동경로는 밝혀지지 않았지만, 전구체인 FOSAs 및 FTOHs과 같은 과불화화합물은 대기 중 장거리 이동의 가능성을 가지고 있다고 보고 있으며, 오염원이 없는 극지방의 환경시료에서 주요 화합물인 PFOA와 PFOS 뿐만 아니라 C2~C12의 다양한 사슬길이를 가지는 성분들이 검출이 되었다[ 4, 5]. 국내에서는 주로 4대강 수계, 해수, 산업단지, 해양수, 토양, 퇴적물, 어류, 생체시료 등의 모니터링이 진행되고 있으며[ 6~ 15], 국외의 경우 강, 지표수, 매립지 침출수, 음용수, 해양수, 토양, 퇴적물, 어류 등 여러 매체에서 모니터링을 하고 있다[ 16~ 23]. 국내뿐만 아니라 국외에서도 매체가 수질, 토양 및 퇴적물인 경우 과불화화합물을 분석하기 위한 전처리는 고체상 추출(Solid phase extraction, SPE)을 사용하고 있으며, 어류는 초음파추출, 생체시료는 액체-액체추출(Liquid-liquid extraction, LLE), 이온쌍 추출법(Ion Pairing Extraction, IPE), 고체상 추출(SPE) 등으로 분석을 하고 있다. 국내 문헌에서 SPE를 사용한 경우 대부분 HLB 카트리지를 사용하였으며, 국외 문헌의 경우는 WAX 카트리지를 사용하기도 하였지만, 대부분 HLB 카트리지를 사용하여 과불화화합물을 분석하였다. 하지만 최근 2016년도 이후의 국외 문헌의 경우 과거의 자료보다 더 많은 과불화화합물과 전구체를 분석을 하고 있으며, HLB 카트리지보다는 WAX 카트리지를 사용하는 추세이다.
PFOS와 그 염 화합물은 스톡홀름 협약에서 부속서 B(제한적 사용만 허용되는 물질)로 등록이 되었으며, 국내에서도 잔류성 유기오염물질 관리법에 따라 규제하는 대상으로 되어있다. 이로 인해 PFOS의 사용이 제한적이기 때문에 대체물질로 탄소개수가 다른 과불화화합물이 사용되고 있어, 기존의 모니터링과는 다른 더 넓은 범위의 탄소개수의 과불화화합물을 분석해야 하는 상황이다.
또한 기존의 문헌에서 수질, 토양 등 매체의 종류에 상관없이 과불화화합물의 유리에 흡착되는 특성을 배제하기 위해 PP 재질로 된 실험기구 및 채수병으로만 시료채취 및 분석을 하고 있다.
따라서 본 연구는 보다 넓은 탄소개수의 과불화화합물을 분석하기 위하여 SPE 방법으로 HLB와 WAX 카트리지를 사용하여 추출되는 과불화화합물의 물질 특성과 시간이 경과함에 따라 PP재질과 유리재질에 흡착되는 과불화화합물 농도 변화의 특성을 파악하고자 실험을 수행하였다.
2. 실험재료 및 실험방법
2.1. 실험재료
실험에 사용된 표준물질은 Wellington 사에서 판매하는 과불화화합물 17종(PFAC-MXB), 전구체 5종(FOUEA, FOSA, FOSAA, N-MeFOSAA, N-EtFOSAA)과 과불화화합물의 내부표준물질 11종(MPFBA, MPFPeA, MPFHxA, MPFHpA, MPFOA, MPFNA, MPFDA, MPFUdA, MPFDoA, MPFHxS, MPFOS) 전구체의 내부표준물질 3종(d3-N-MeFOSAA, d5-N-EtFOSAA, MFOUEA)을 사용하였다. 이동상과 SPE 추출에 사용되는 Methanol, Water, Acetonitrile은 J.T.Baker사의 HPLC grade를 사용하였다. NH4OH, Acetic acid, Ammonium acetate는 Sigma-aldrich사의 GR grade, SPE에 사용되는 카트리지는 Oasis사의 HLB 카트리지(200 mg, 6 cc), WAX 카트리지(150 mg, 6 cc)를 사용하였다.
2.2. 실험방법
실험은 잔류성유기오염물질 공정시험기준 중 하천수/호소수에 해당하는 시험법(ES10374.1)을 기준으로 실험을 하였으며, 시료는 HPLC용 Water 500 mL에 PFCs (17종), 전구체(5종), 내부표준물질(14종)을 첨가하여 시험법에 따라 HLB 카트리지와 WAX 카트리지로 각각 추출을 하였다. 추출이 완료된 시료는 PP 재질의 바이알(SUN-SRI, USA)과 유리 재질의 바이알(Agilent, USA)에 각각 보관하여 분석하였다.
HLB 카트리지는 메탄올 4 mL, 증류수 4 mL 순서로 활성화 한 후에 시료 500 mL를 10 ~ 15 mL/min의 속도로 카트리지를 통과시켰으며, 증류수 12 mL, 메탄올(20%) 6 mL 순서로 세척 후 10분간 진공상태로 건조시켰다. 0.1% NH4OH (in MeOH) 용액 10 mL로 용출한 후에 질소농축기(Organomation Associates inc, N-EVAP 112, USA)로 0.5 mL까지 농축하여 분석하였다.
WAX 카트리지는 0.1% NH 4OH (in MeOH) 용액 4 mL, 메탄올 4 mL, 증류수 4 mL 순서로 활성화 한 후에 시료 500 mL를 3 ~ 6 mL/min의 속도로 카트리지를 통과시켰으며, 30초간 진공상태로 건조하였다. 이후 0.025 M Acetate buffer 용액 4 mL로 세척 후 메탄올 4 mL, 0.1% NH 4OH (in MeOH) 용액 4 mL 순서로 용출한 후에 질소농축기로 0.5 mL까지 농축하여 분석하였다.
2.3. 과불화화합물 분석
과불화화합물의 정량은 ESI (Electrospray Ionization) 모드와 Precursor Ion, Product Ion 값을 이용하여 과불화화합물을 정량하였으며, 각 항목에 대한 Ion 값은 Table 1에 나타내었다. 내부표준물질은 가능한 분석하고자 하는 항목에 맞는 Internal standard (ISTD)를 사용하였으며, 판매하지 않거나 내부표준물질이 없는 항목은 같은 계열에서 Ion 값이 가장 가까운 물질로 내부표준물질을 사용하였다. 이에 해당하는 물질은 PFTrDA, PFTeDA, PFHxDA, PFODA은 MPFDoA를, PFBS는 MPFHxS를, PFDS는 MPFOS를, FOSA와 FOSAA는 d3-N-MeFOSAA를 내부표준물질로 사용하여 정량하였다.
2.4. 실험내용
실험은 과불화화합물의 물질에 따른 HLB 카트리지와 WAX 카트리지의 Intensity 비교 및 SPE 추출 후 시료를 보관시 시간이 경과함에 따라 과불화화합물의 물질별 농도 변화에 관한 실험을 진행하였다.
첫 번째로 카트리지의 Intensity 비교 실험에서는 과불화화합물을 0.1 μg/L의 농도로 제조한 시료를 HLB와 WAX 카트리지로 7개씩 각각 전처리를 하여 바로 분석을 진행하였으며, 두 번째로 시간이 경과함에 따라 과불화화합물의 농도 변화 실험에서도 과불화화합물을 0.1 μg/L의 농도로 제조한 시료를 HLB와 WAX 카트리지로 각각 전처리 한 후 추출된 용액을 PP 재질의 바이알과 유리 재질의 바이알에 각각 7개씩 분할하여 보관 후 24시간 간격으로 6일간 분석하였으며, 바이알 재질에 대한 변수만 주기 위하여 바이알캡은 전부 동일한 PP 재질을 사용하여 실험하였다.
3. 실험결과
3.1. HLB, WAX 카트리지 비교
과불화화합물의 검정곡선은 0.02, 0.05, 0.1, 0.25, 0.5 μg/L로 제조하여 분석을 하였으며, PFCAs (13종), PFSAs (4종), precursors (5종)의 카트리지별 R 2 값은 0.99 이상이었다. 계열별 대표적인 물질의 검정곡선은 Fig. 2에 나타내었다. 방법검출한계(Method detection limits, MDL)와 정량한계(Limit of quantification, LOQ)는 HPLC용 Water 500 mL에 과불화화합물의 표준물질(22종)의 농도가 0.02 μg/L, 내부 표준물질(14종)의 농도가 0.1 μg/L가 되도록 7개를 제조하여 HLB와 WAX 카트리지로 각각 SPE 추출하여 분석하였다. MDL과 LOQ는 t-분포값에 따라 표준편차에 3.14와 10을 곱하여 각각 계산하다. 그 결과 HLB 카트리지의 MDL은 0.005 ~ 0.032 μg/L, LOQ는 0.017 ~ 0.101 μg/L, WAX 카트리지의 MDL은 0.006 ~ 0.026 μg/L, LOQ는 0.019 ~ 0.082 μg/L의 수준이며, 항목별 MDL, LOQ의 값은 Table 3, 4에 정리하였다.
Fig. 3은 PFCAs의 PFBA (C4), PFPeA (C5)와 해당되는 내부표준물질인 MPFBA, MPFPeA를 Intensity ratio로 계산한 그림이다. Intensity ratio는 식 (1)을 통해 계산하였다.
PFBA의 경우에는 0.02 μg/L에서 Intensity ratio가 8.16의 수치를 나타냈지만, 농도가 점차 증가하면서 0.5 μg/L에서는 102.60으로 Intensity의 차이가 크게 나타났으며, PFPeA의 경우 0.02 μg/L에서 Intensity ratio가 2.33의 수치를 나타내다 0.5 μg/L에서 4.52의 수치를 나타냈다. PFCAs의 다른 항목들은 PFPeA와 비슷한 패턴으로 대부분 Intensity ratio가 1 ~ 3으로 분포하는 결과를 얻을 수 있었다.
Fig. 4는 PFSAs 4종에 대한 Intensity ratio를 나타낸 그림이다. PFBS (C4)는 0.02 μg/L에서 0.63의 비율을 보였지만 0.5 μg/L에서 1.22로 점차 조금씩 증가하였다. PFHxS (C6)는 0.05 μg/L까지 증가하다가 점차 감소하는 경향을 나타냈으며, PFOS와 PFDS는 0.6 ~ 0.8의 수치를 나타냈다.
Fig. 5는 precursors 5종에 대한 Intensity ratio를 나타낸 그림이다. N-MeFOSAA, N-EtFOSAA, FOUEA는 0.02 μg/L에서 0.5 μg/L까지 각각 1.19에서 1.55로, 0.97에서 1.76으로, 0.77에서 1.55로 각각 증가하였으며, FOSA, FOSAA는 평균적으로 0.95, 0.84의 수치를 유지하였다.
PFCAs, PFSAs, precursors의 종합적인 결과를 보았을 때 WAX 카트리지를 사용하였을 때 일부 항목은 높게 나오는 반면, 일부 항목은 오히려 HLB 카트리지를 사용하였을 때보다 낮게 나오는 경향을 보였다. 하지만 뚜렷하게 PFCAs의 PFBA (C4), PFPeA (C5), MPFBA, MPFPeA의 항목이 HLB 카트리지를 사용하였을 때 보다 WAX 카트리지를 사용하였을 때 시료의 농도가 증가함에 따라 추출되어 분석되는 Intensity의 차이가 점차 증가되는 특성을 보인다.
WAX 카트리지와 HLB 카트리지를 사용한 회수율을 비교 실험한 Taniyasu 등[ 26]의 결과로 HLB 카트리지를 사용하였을 때보다 WAX 카트리지를 사용하였을 때 PFBA (C4), PFPeA (C5), PFHxA (C6)의 탄소가 낮은 계열에서 회수율은 약 80% 이상 높은 결과와 PFCAs, PFSAs, precursor의 항목에서 WAX 카트리지를 사용하였을 때 일부 항목은 회수율이 높게 나오는 반면에 일부 항목은 HLB 카트리지보다 회수율이 낮게 나오는 결과가 보고된 바 있으며, 본 연구와 비교하였을 때 유사한 결론을 얻을 수 있었다.
3.2. 시간에 따른 과불화화합물 변화
과불화화합물을 0.1 μg/L로 조제한 시료를 WAX 카트리지로 추출하여 7개의 PP 재질과 유리 재질의 바이알에 각각 분취하여 24시간 간격으로 144시간(6일)까지 분석하였다. Fig. 6, 7은 WAX 카트리지로 추출한 시료를 PP 재질과 유리 재질의 바이알에 보관하여 분석한 결과 중 PFCAs의 농도이다. PP 재질 바이알의 분석결과 PFHxA는 0.09 μg/L (0시간)에서 0.18 μg/L (72시간)까지 증가 후 0.12 μg/L (144시간)까지 감소하는 패턴이며, PFHpA는 0.09 μg/L (0시간)에서 0.061 μg/L (144시간)으로 감소하였으며, PFNA는 0.092 μg/L (0시간)에서 0.103 μg/L (144시간)으로 증가하였다. PFTrDA, PFTeDA, PFHxDA는 각각 0시간에서 144시간까지 0.093 μg/L에서 0.049 μg/L, 0.072 μg/L에서 0.015 μg/L, 0.099 μg/L에서 0.049 μg/L으로 감소하는 동일한 패턴을 보였다. PFOcDA는 0.096 μg/L (0시간)에서 0.111 μg/L (72시간)까지 증가하다가 0.05 μg/L (144시간)까지 감소하는 형태를 나타냈다. 이외 PFCAs의 PFBA, PFPeA, PFOA, PFDA, PFUnDA, PFDoDA는 평균 0.1 μg/L으로 미량으로 증가 감소하는 반복적 형태로 큰 변화를 보이지 않았다.
유리 재질 바이알의 분석결과로 PFHxA는 0.087 μg/L (0시간)에서 0.12 μg/L (48시간)까지 증가 후 0.1 μg/L (144시간)으로 감소하는 패턴이며, PFHpA는 0.091 μg/L (0시간)에서 0.076 μg/L (144시간)로 감소하였으며, PFNA는 0.09 μg/L (0시간)에서 0.126 μg/L (144시간)으로 증가하였다. PFDoDA, PFTrDA, PFTeDA, PFHxDA는 각각 0시간에서 144시간까지 0.105 μg/L에서 0.091 μg/L, 0.101 μg/L에서 0.038 μg/L, 0.094 μg/L에서 0.023 μg/L, 0.122 μg/L에서 0.04 μg/L으로 감소하는 동일한 패턴을 보였다. PFOcDA는 0.11 μg/L (0시간)에서 0.06 μg/L (48시간)까지 감소하다가 0.13 μg/L (96시간)까지 증가 후 다시 0.05 μg/L (144시간)으로 감소하는 형태를 나타냈다. 이외 PFCAs의 PFBA, PFPeA, PFOA, PFDA, PFUnDA, PFDoDA는 평균 0.1 μg/L으로 미량으로 증가⋅감소하는 반복적 형태로 큰 변화를 보이지 않았다. PP 재질과 유리 재질 바이알의 분석결과를 비교하면 증가 또는 감소하는 패턴은 전부 동일하나 다른 차이점이 있다면 유리 재질 바이알에서만 PFDoDA가 감소하는 차이점이 있었다. PFSAs (4종)은 바이알의 재질과 보관한 시간에 상관없이 비교적 동일한 농도를 유지하는 패턴을 보였다.
Fig. 8, 9는 WAX 카트리지로 추출한 시료를 PP 재질과 유리 재질의 바이알에 보관하여 분석한 결과 중 precursors의 농도이다.
PP 재질 바이알에서 보관하여 분석한 결과로 FOSA, NMeFOSAA, N-EtFOSAA, FOUEA는 0시간에서 144시간까지 0.102 μg/L에서 0.126 μg/L, 0.088 μg/L에서 0.092 μg/L, 0.089 μg/L에서 0.133 μg/L, 0.087 μg/L에서 0.097 μg/L으로 각각 증가하였으나, FOSAA의 경우는 0.103 μg/L에서 0.051 μg/L으로 감소하는 경향을 나타냈다.
유리 재질 바이알에서 보관한 시료의 결과 역시 FOSA, N-MeFOSAA, N-EtFOSAA, FOUEA는 0시간에서 144시간까지 0.077 μg/L에서 0.133 μg/L, 0.086 μg/L에서 0.121 μg/L, 0.080 μg/L에서 0.121 μg/L, 0.089 μg/L에서 0.098 μg/L으로 각각 증가하였으나, FOSAA의 경우는 0.081 μg/L에서 0.064 μg/L으로 감소하는 동일한 경향을 보였다.
기존의 문헌에서 과불화화합물이 유리에 흡착되는 특징으로 인하여 PP 재질을 사용한다고 보고되고 있지만, 유리 재질과 PP 재질에 추출된 시료를 보관하여 비교 분석한 결과 시간이 경과함에 따라 재질에 상관없이 PFCAs의 계열에서는 144시간이 경과 후에도 PFUnDA (C11) 이하의 물질에서는 큰 변동없이 유지되었으나, PFTrDA (C13) 이상의 물질에서는 시간이 경과함에 따라 농도가 감소하는 동일한 현상을 보였다. PFSAs의 계열에서는 시간이 경과함에도 큰 변화없이 농도를 유지하였으며, precursors는 경과함에 따라 FOSA, N-MeFOSAA, N-EtFOSAA의 농도는 증가하였으며, 반대로 FOSAA의 농도는 시간이 경과함에 따라 감소하는 동일한 현상을 보였다.
Fig. 10을 보면 시간이 경과함에 따라 PFOS와 PFOA의 농도는 큰 변화없이 비슷하게 유지되나, ΣPFCs의 농도로 보았을 때 PP 재질과 유리 재질 바이알에서 보관한 시료는 시간이 경과함에 따라 농도가 감소되는 동일한 경향을 보인다. Fig. 6, 7, 8, 9의 내용에서 일부 물질은 시간이 경과함에 따라 농도가 증가 또는 감소가 되나, Fig. 10의 ΣPFCs 농도는 초기(0시간) 농도보다 시간이 경과함(144시간)에 다소 감소되는 경향으로 일부는 재질에 흡착되었을 수도 있지만, PP와 유리 재질에서 동일한 형태로 감소되는 것으로 보아 ΣPFCs의 감소의 원인은 재질의 흡착에 대한 요인보다는 분석하였던 과불화화합물(22종) 이외의 분석하지 못한 다른 과불화화합물로 변환되어 ΣPFCs의 농도가 감소되었을 것으로 판단된다.
4. 결 론
과불화화합물은 다양한 매체에서 HLB 카트리지를 사용하여 SPE 방법으로 분석을 하고 있었지만, 최근에는 WAX 카트리지를 사용하는 추세이다. 따라서 본 연구에서는 HLB와 WAX 카트리지를 사용하여 과불화화합물의 추출에 대한 특성과 SPE로 추출된 시료를 유리와 PP 재질에 보관하여 과불화화합물의 농도 변화에 대한 실험을 진행한 결론은 다음과 같다.
1) WAX 카트리지를 사용하여 분석한 결과 PFCAs (perfluoroalkycarboxylic acids : 13종), PFSAs (perfluoroalkansulfonates : 4종), precursors (5종)의 일부 항목은 HLB 카트리지를 사용하였을 때보다 높게 나오는 반면, 일부 항목은 낮게 나오는 현상을 확인하였다.
2) WAX 카트리지를 사용하였을 때 뚜렷하게 PFCAs의 PFBA (C4), PFPeA (C5)는 시료의 농도가 높을수록 Intensity ratio가 점차 증가되는 결과로 C5 이하의 물질은 HLB 카트리지보다 WAX 카트리지의 효율이 우세한 것으로 확인하였다.
3) 유리와 PP 재질에 보관하여 24시간 간격으로 6일간 분석한 결과 보관 재질에 상관없이 PFCAs 계열에서는 탄소 개수가 C11 (PFUnDA) 이하의 항목과 PFSAs의 계열은 큰 농도 변화를 보이지 않지만, PFCAs의 탄소 개수가 C13 (PFTrDA) 이상의 항목에서는 농도가 점차 감소하는 동일한 현상을 보였다.
4) 보관 재질에 상관없이 시료가 144시간이 경과한 후에 PFOA, PFOS의 농도는 큰 변화를 보이지 않지만, ΣPFCs의 농도는 감소하는 결과를 보아 일부는 보관 재질에 흡착될 수도 있지만, PP와 유리 재질에서 동일한 형태로 감소되는 결과로 ΣPFCs의 감소 원인은 재질의 흡착에 대한 요인보다는 분석한 과불화화합물(22종)외 다른 과불화화합물로 전환되었을 것으로 판단된다.
Fig. 1.
Flow chart of HLB, WAX cartridge. 
Fig. 2.
Calibration curve of PFOA, PFOS, FOUEA. 
Fig. 3.
Intensity ratio of PFBA, PFPeA, MPFBA, MPFPeA. 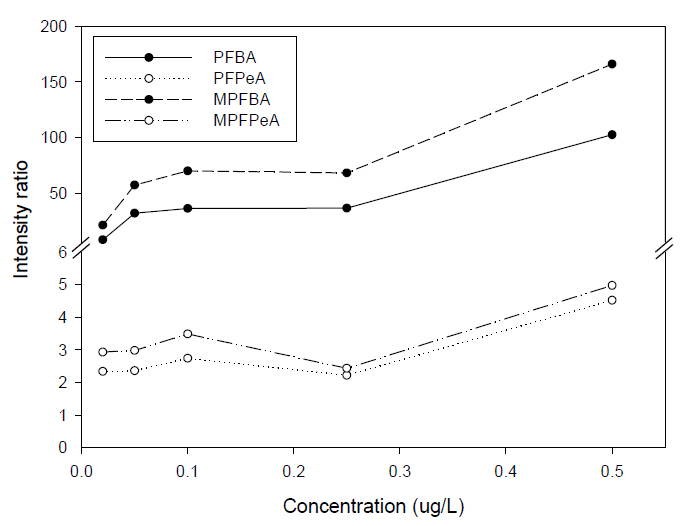
Fig. 4.
Intensity ratio of PFSAs. 
Fig. 5.
Intensity ratio of precursors. 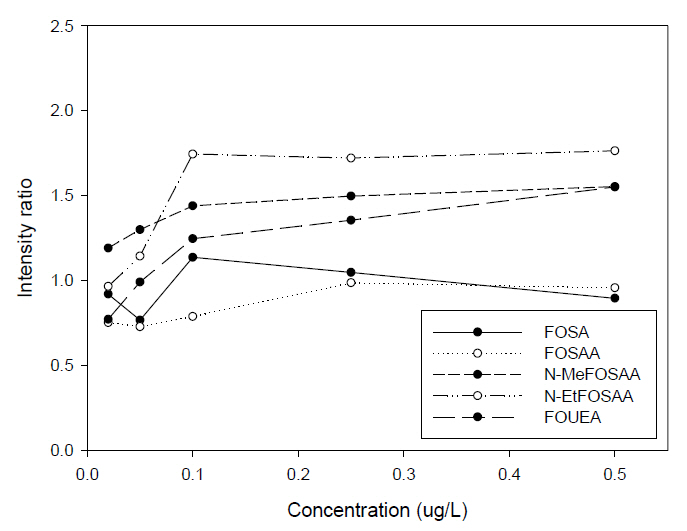
Fig. 6.
Effect of time on the PFCAs concentration (pp vial). 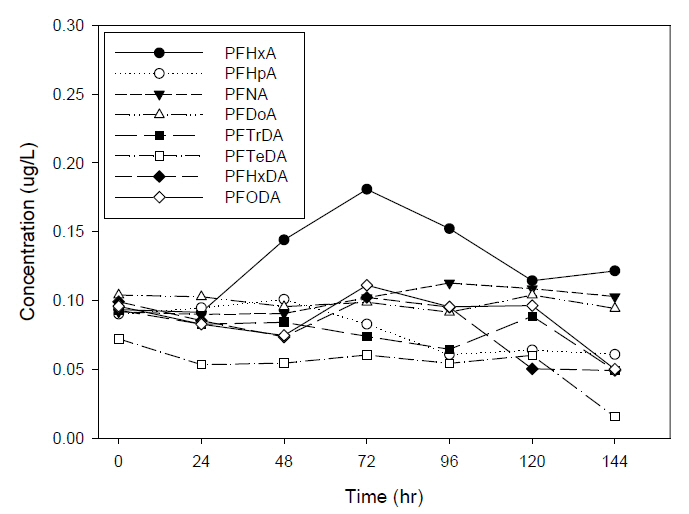
Fig. 7.
Effect of time on the PFCAs concentration (glass vial). 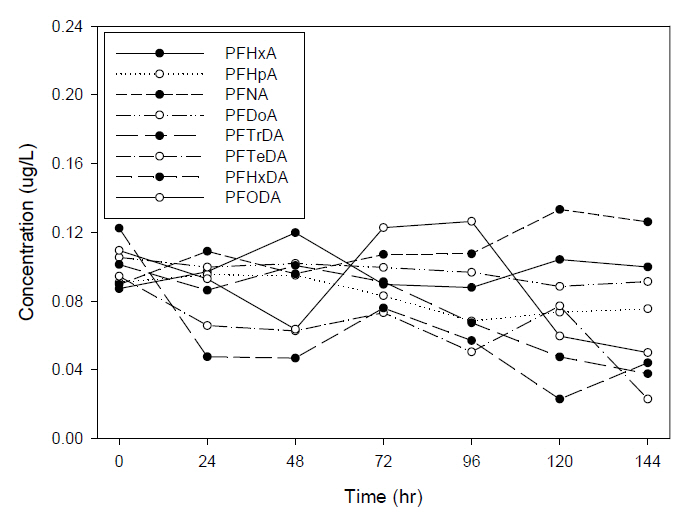
Fig. 8.
Effect of time on the precursors concentration (pp vial). 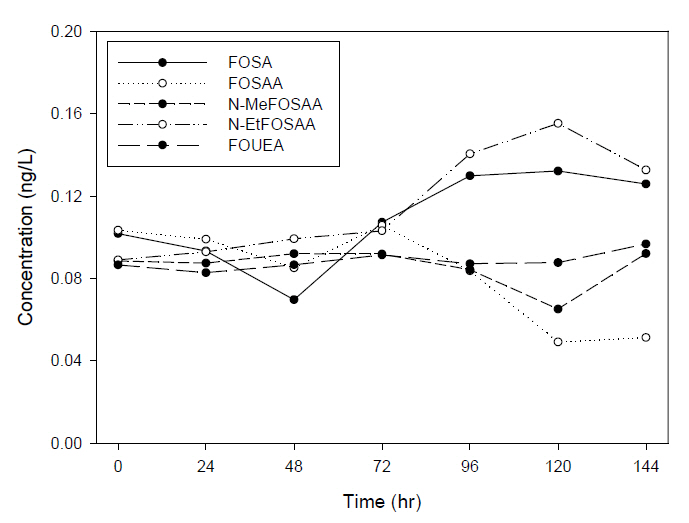
Fig. 9.
Effect of time on the precursors concentration (glass vial). 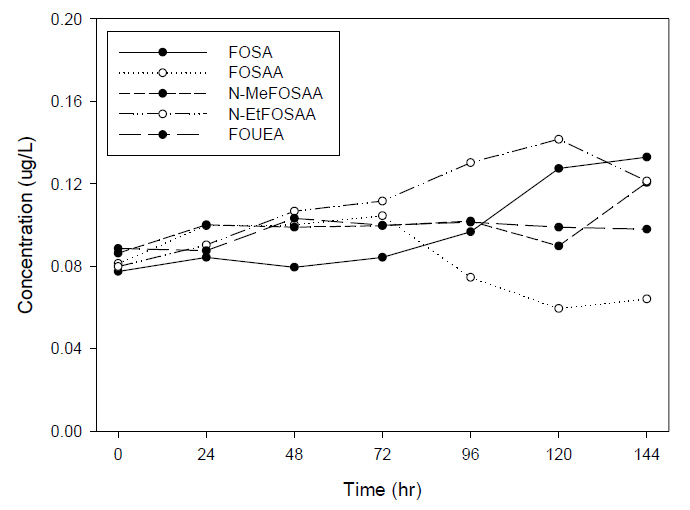
Fig. 10.
Effect of time on the PFCs concentration. 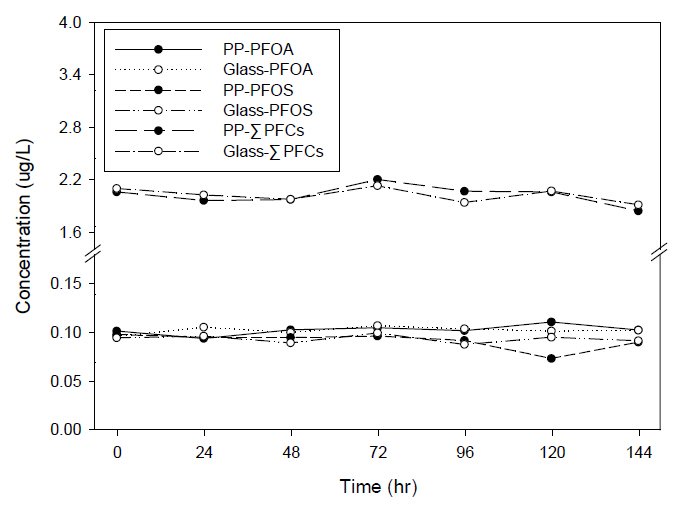
Table 1.
Multiple reaction monitoring ion for analysis of PFCs and ISTD
|
Compound |
Precursor ion (m/z) |
Product ion (m/z) |
ISTD |
Compound |
Precursorion (m/z) |
Production (m/z) |
|
PFBA |
213 |
169 |
#1 |
MPFBA |
217 |
172 |
|
PFPeA |
263 |
219 |
#2 |
MPFPeA |
268 |
223 |
|
PFHxA |
313 |
269 |
#3 |
MPFHxA |
315 |
270 |
|
PFHpA |
363 |
319 |
#4 |
MPFHpA |
367 |
322 |
|
PFOA |
413 |
369 |
#5 |
MPFOA |
417 |
372 |
|
PFNA |
463 |
419 |
#6 |
MPFNA |
468 |
423 |
|
PFDA |
513 |
469 |
#7 |
MPFDA |
515 |
470 |
|
PFUdA |
563 |
519 |
#8 |
MPFUdA |
565 |
520 |
|
PFDoA |
613 |
569 |
#9 |
MPFDoA |
615 |
570 |
|
PFTrDA |
663 |
619 |
|
PFTeDA |
713 |
669 |
|
PFHxDA |
813 |
769 |
|
PFODA |
913 |
869 |
|
PFBS |
299 |
99 |
#10 |
MPFHxS |
403 |
103 |
|
PFHxS |
399 |
99 |
|
PFOS |
499 |
99 |
#11 |
MPFOS |
503 |
99 |
|
PFDS |
599 |
99 |
|
FOSA |
498 |
78 |
#12 |
d3-N-MeFOSAA |
573 |
419 |
|
FOSAA |
556 |
498 |
|
N-MeFOSAA |
570 |
419 |
|
N-EtFOSAA |
584 |
419 |
#13 |
d5-N-EtFOSAA |
589 |
419 |
|
FOUEA |
457 |
393 |
#14 |
MFOUEA |
459 |
394 |
Table 2.
Analytical conditions of LC/MS/MS
|
Descriptions |
Analytical condition |
|
Mode |
ESI, Negative |
|
Column type |
Betasil C18, 2.1*100 mm, 5 µm |
|
Mobile phase |
A : 2 mM Ammonium acetate |
|
B : Acetonitrile |
|
Gradient |
Time (min) |
0 |
2 |
6 |
15 |
15.1 |
20 |
|
A % |
100 |
30 |
0 |
0 |
100 |
100 |
|
B % |
0 |
70 |
100 |
100 |
0 |
0 |
|
Flow rate |
200 uL/min |
|
Injection volume |
10 uL |
|
Ion spray voltage |
- 4.0 kV |
Table 3.
MDL, LOQ of HLB cartridge
|
(µg/L) |
PFBA |
PFPeA |
PFHxA |
PFHpA |
PFOA |
PFNA |
PFDA |
PFUdA |
PFDoA |
PFTrDA |
PFTeDA |
PFHxDA |
PFOcDA |
|
MDL |
0.005 |
0.005 |
0.009 |
0.009 |
0.017 |
0.023 |
0.019 |
0.013 |
0.013 |
0.021 |
0.015 |
0.027 |
0.032 |
|
LOQ |
0.017 |
0.017 |
0.030 |
0.028 |
0.056 |
0.072 |
0.060 |
0.041 |
0.043 |
0.066 |
0.049 |
0.086 |
0.101 |
|
(µg/L) |
PFBS |
PFHxS |
PFOS |
PFDS |
FOSA |
FOSAA |
N-MeFOSAA |
N-EtFOSAA |
FOUEA |
|
MDL |
0.026 |
0.020 |
0.006 |
0.018 |
0.021 |
0.024 |
0.023 |
0.027 |
0.027 |
|
LOQ |
0.084 |
0.065 |
0.020 |
0.057 |
0.065 |
0.077 |
0.073 |
0.087 |
0.086 |
Table 4.
MDL, LOQ of WAX cartridge
|
(µg/L) |
PFBA |
PFPeA |
PFHxA |
PFHpA |
PFOA |
PFNA |
PFDA |
PFUdA |
PFDoA |
PFTrDA |
PFTeDA |
PFHxDA |
PFOcDA |
|
MDL |
0.012 |
0.018 |
0.006 |
0.015 |
0.024 |
0.020 |
0.015 |
0.024 |
0.019 |
0.026 |
0.016 |
0.014 |
0.007 |
|
LOQ |
0.038 |
0.058 |
0.019 |
0.048 |
0.077 |
0.065 |
0.048 |
0.075 |
0.060 |
0.082 |
0.052 |
0.045 |
0.023 |
|
(µg/L) |
PFBS |
PFHxS |
PFOS |
PFDS |
FOSA |
FOSAA |
N-MeFOSAA |
N-EtFOSAA |
FOUEA |
|
MDL |
0.008 |
0.021 |
0.024 |
0.021 |
0.007 |
0.022 |
0.018 |
0.020 |
0.012 |
|
LOQ |
0.026 |
0.066 |
0.078 |
0.066 |
0.022 |
0.070 |
0.057 |
0.064 |
0.037 |
References
1. W. C.. Liu, W.. He, N.. Qin, X. Z.. Kong, Q. S.. He, B.. Yang, C.. Yang, S. E.. Jorgensen, F. L.. Xu, Temporal-spatial distributions and ecological risks of perfluoroalkyl acids (PFAAs) in the surface water from the fifth-largest freshwater lake in china (Lake Chaohu), Environ. Pollut. 200, 24-34(2015).  2. J. P.. Giesy, K.. Kannan, Perfluorochemical surfactants in the environment, Environ. Sci. Technol. 36(7), 146A-152A(2002).  3. R.. Ma, K.. Shih, Perfluorochemicals in wastewater treatment plants and sediments in Hong Kong, Environ. Pollut. 158, 1354-1362(2010).  4. D.. Skutlarek, M.. Exner, H.. Farber, Perfluorinated surfactants in surface and drinking waters, Environ. Sci. Pollut. Res. Int. 13(5), 299-307(2006).  5. R.. Kallenborn, U.. Berger, U.. Jarnber, Perfluorinated alkylated substances (PFAS) in the Nordic environment Nordic Council of Ministers, Denmark, pp. 1-107(2004).
6. B. G.. Kwon, C. S.. Lim, S. H.. Na, J. E.. Kwon, S. Y.. Chung, Monitoring of Perfluorinated Compounds (PFCs) in the Yeongsan River Water System, J. Korean Soc. Environ. Eng. 37(5), 303-311(2015).  7. H. J.. Son, S. Y.. Hwang, H. S.. Yoom, J. T.. Choi, K. W.. Kwon, Detection of Perfluorinated Compounds (PFCs) in Nakdong River Basin, J. Korean Soc. Environ. Eng. 35(2), 84-93(2013).  8. M. Y.. Shin, J. K.. Im, Y. L.. Kho, K. S.. Choi, K. D.. Zoh, Quantitative Determination of PFOA and PFOS in the Effluent of Sewage Treatment Plants and in Han River, J. Environ. Health Sci. 35(4), 334-342(2009).  9. C. R.. Cho, I. C.. Eom, E. J.. Kim, S. J.. Kim, K. H.. Choi, H. S.. Cho, J. H.. Yoon, Evaluation of the Level of PFOS and PFOA in Environmental Media from Industrial Area and Four Major River Basin, J. Korean Soc. Environ. Anal. 12(4), 296-306(2009).
10. B. C.. Paik, T. R.. Kim, S. K.. Kam, Distribution of Perfluorinated Compounds (PFCs) in Sumjin River and Southern Coastal Area of Korea, J. Korean Soc. Urban Environ. 14(2), 87-99(2014).
11. S. J.. Hong, J. S.. Khim, J. S.. Park, M. H.. Kim, W. K.. Kim, J. H.. Jung, S. H.. Hyun, J. G.. Kim, H. S.. Lee, G.. Codling, J. P.. Giesy, In situ fate and partitioning of waterborne perfluoroalkyl acids (PFAAs) in the Youngsan and Nakdong River Estuaries of South Korea, Sci. Total Environ. 445-446, 136-145(2013).  12. J. H.. Son, S. Y.. Chung, B. G.. Kwon, Monitoring of Perfluorinated Compounds (PFCs) in the Seawater of the East and West Coast in Korea, J. Korea Geo-Environ. Soc., 18(11), 5-12(2017).  13. N. H.. Lam, C. R.. Cho, J. S.. Lee, H. Y.. Soh, B. C.. Lee, J. A.. Lee, N.. Tatarozako, K.. Sasaki, N.. Saito, K.. Iwabuch, K.. Kannan, H. S.. Cho, Perfluorinated alkyl substances in water, sediment, plankton and fish from Korean rivers and lakes : A nationwide survey, Sci. Total Environ. 491-492, 154-162(2014).  14. E. S.. Lee, H. Y.. Kim, W. J.. Sim, J. H.. Lee, J. E.. Oh, H. S.. Kim, Evaluation of Pretreatment Method for Analysis of Perfluorinated ompounds in Human Bloodand Breast Milk Samples, J. Korean Soc. Environ. Anal. 14(1), 45-54(2011).
15. S. H.. Jang, C. K.. Lee, D. H.. Kim, K. B.. Kim, J. H.. Ahn, H. D.. Kim, C. H.. Lee, J. H.. Kim, J. T.. Lee, Lifestyle and Work related Factors Associated with Serum PFOA among Workers at Manufacturing Companies, Korean J. Occup. Environ. Med. 20(3), 233-244(2008).
16. H. T.. Duong, K.. Kadokami, H.. Shirasaka, R.. Hidaka, H. T. C.. Chau, L.. Kong, T. Q.. Nguyen, T. T.. Nguyen, Occurrence of perfluoroalkyl acids in environmental waters in Vietnam, Chemosphere., 122, 115-124(2015).  17. H.. Yan, I. T.. Cousins, C.. Zhang, Q.. Zhou, Perfluoroalkyl acids in municipal landfill leachates from China : Occurrence, fate during leachate treatment and potential impact on groundwater, Sci. Total Environ. 524-525, 23-31(2015).  18. S.. Castiglioni, S.. Valsecchi, S.. Polesello, M.. Rusconi, M.. Melis, M.. Palmiotto, A.. Manenti, E.. Davoli, E.. Zuccato, Sources and fate of perfluorinated compounds in the aqueous environment and in drinking water of a highly urbanized and industrialized area in Italy, J. Hazard. Mater. 282, 51-60(2015).  19. N.. Yanashita, K.. Kannan, S.. Taniyasu, Y.. Horii, T.. Okazawa, G.. Petrick, T.. Gamo, Analysis of Perfluorinated Acids at Parts-Per-Quadrillion Levels in Seawater Using Liquid Chromatography-Tandem Mass Spectrometry, Environ. Sci. Technol. 38, 5522-5528(2004).  20. G.. Pan, Q.. Zhou, X.. Luan, Q. S.. Fu, Distribution of perfluorinated compounds in Lake Taihu (China) : Impact to human health and water standards, Sci. Total Environ. 487, 778-784(2014).  21. F.. Li, H.. Huang, Z.. Xu, H.. Ni, H.. Yan, R.. Chen, Y.. Luo, W.. Pan, J.. Long, X.. Ye, X.. Qian, G.. Yu, Investigation of Perfluoroalkyl Substances (PFASs) in sediments from the Urban Lakes of Anqing City, Anhui Province, China, Bull. Environ. Contam. Toxicol. 99, 760-764(2017).  22. R.. Loos, S.. Tavazzi, G.. Mariani, G.. Suurkuusk, B.. Paracchini, G.. Umlauf, Analysis of emerging organic contaminants in water, fish and suspended particulate matter (SPM) in the Joint Danube Survey using solid-phase extraction followed by UHPLC-MS-MS and GC–MS analysis, Sci. Total Environ. 607-608, 1201-1212(2017).  23. V.. Paiano, E.. Fattore, A.. Carra, C.. Generoso, R.. Fanelli, R. J.. Bagnati, Liquid Chromatography-Tandem Mass Spectrometry Analysis of Perfluorooctane Sulfonate and Perfluorooctanoic Acid in Fish Fillet Samples, Anal. Methods Chem. 2012, 1-5(2012).  24. S.. Chen, X. C.. Jiao, N.. Gai, X. J.. Li, X. C.. Wang, G. H.. Lu, H. T.. Piao, Z.. Rao, Y. L.. Yang, Perfluorinated compounds in soil, surface water, and groundwater from rural areas in eastern China, Environ. Pollut. 211, 124-131(2016).  25. Y.. Qi, S.. Huo, B.. Xi, S.. Hu, J.. Zhang, Z.. He, Spatial distribution and source apportionment of PFASs in surface sediments from five lake regions, China, Sci. Rep. 6, 1-11(2016).  26. S.. Taniyasu, K.. Kannan, M. K.. So, A.. Gulkowska, E.. Sinclair, T.. Okazawa, N.. Yamashita, Analysis of fluorotelomer alcohols, fluorotelomer acids, and short-and long-chain perfluorinated acids in water and biota, J. Chromatogr. A. 1093, 89-97(2005). 
|
|




















