The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
산화아연 나노입자의 환경 거동 및 영향 연구
Abstract
ZnO nanoparticles (ZnO NPs) are mainly used in semiconductors, solar cells, biosensors, and cosmetics (sunscreen). In this study, we investigated the behavior of ZnO NPs in aquatic and soil environments and their effects on plants (Artemisia annua L.) in hydroponic cultivation. It was confirmed that the ZnO NPs size increased and their dissolution decreased with increasing in pH. Leaching distance of ZnO NPs was less than 2.5 cm, indicating that ZnO NPs had a little potential to leach into deeper soil layers. When ZnO NPs were exposed to plant, the total weights of plants decreased. The effects on the length of root and shoot were not observed. In addition large amount of ZnO NPs were adsorbed on the surface of plant root and didn’t translocate into shoot. These results suggest that ZnO NPs block the pores of the root cell wall and decrease the bioavailability of plant nutrients. Therefore it can be speculated that the particles increase in size and settle down in the water environment and may adversely affect the plant growth by firmly adhering to the root surface when the ZnO NPs are exposed to the environment.
Key words: ZnO Nanoparticles, Aggregation, Dissolution, Plant
요약
산화아연 나노입자(ZnO nanoparticles, ZnO NPs)는 반도체, 태양전지, 바이오센서 및 화장품 (자외선 차단제) 등에 주로 쓰이며 해마다 사용량이 증가하여 환경에 노출될 가능성이 높아졌다. 이에 본 연구에서는 수환경과 토양환경 내 산화아연 나노입자의 거동 및 수경재배 방식으로 식물에 미치는 영향을 평가하였다. 수환경 조건 pH 7 이상 (pH =7-10)에서는 산화아연 나노입자의 입자크기가 증가하였고, 용해된 아연이 감소하는 것을 확인하였다. 또한 산화아연 나노입자는 토양 내에서 2.5cm 까지 이동하여, 하부로의 이동이 매우 미비함을 확인하였다. 한편, 산화아연 나노입자를 식물에 노출시킬 경우 총무게가 감소하였고, 뿌리 및 줄기의 길이에는 영향을 주지 않았다. 또한 뿌리 표면에 흡착하거나 세포내로 이동한 산화아연 나노입자를 관찰할 수 있었으며, 줄기로의 이동은 미비함을 확인하였다. 이러한 결과는 식물의 뿌리 및 줄기로 이동하여 세포벽을 파괴하는 아연 이온과는 달리, 산화아연 나노입자는 식물 뿌리에 흡착하여 체내로 영양분이 공급되는 것을 방해함으로써 식물 성장에 영향을 주는 것을 의미한다. 따라서 산화아연 나노입자가 환경 중에 노출될 경우 수환경에서는 입자크기가 증가하여 침전 현상이 일어나고, 식물 뿌리에 흡착하여 식물 성장에 영향을 미치는 것으로 판단된다.
주제어: 산화아연 나노입자, 응집, 용해, 식물
1. 서 론
나노물질은 차원의 외형치수 중 최소 1차원 이상이 나노크기(1 - 100 nm)인 1차 입자 또는 비표면적이 60 m 2/cm 3 이상인 의도적으로 제조된 것[ 1]으로 크게 탄소계, 금속 및 산화금속계, 고분자계 및 기타 무기물 4가지로 분류된다[ 2]. 2014년도까지 조사된 바로는 32개국에서 1814종의 나노 제품이 개발되어 전자, 통신, 의료, 소재, 바이오 등 다양한 분야에 사용되고 있으며 그 양은 점점 증가하고 있는 추세이다[ 3]. 그 중 산화아연 나노입자는 반도체, 태양전지, 바이오센서 및 화장품(자외선 차단제) 등에 주로 쓰이며 해마다 사용량이 증가하여 환경에 노출될 가능성이 높아졌다. 실제로 산화아연 나노입자는 주로 정화과정에서 발생하는 폐수와 슬러지에 의해 수계와 토양으로 노출되고 있으며[ 4], 광산, 매연, 기타 활동(도금된 건축물이나 도로용출) 등에 의해서도 환경 중에 배출되는 것으로 나타났다[ 5]. 일반적으로 환경 중에 노출된 나노물질은 다양한 환경변수 및 조건(이온강도, pH, 자연유기물 등)에 의해 거동이 달라진다고 알려져 있다[ 6]. 이전 연구결과에 따르면 산화아연 나노입자는 이온강도가 높거나 pH가 높은 수환경 조건에서 수화반경(hydrodynamic diameter, HDD)이 증가하고 용해도가 감소하는 경향을 보인 반면[ 7] 자연유기물(citric acid, humic acid 등)이 존재하는 환경 조건에서는 산화아연 나노입자의 분산성이 안정되고 용해도가 증가하는 것으로 나타났다[ 8, 9]. 최근에는 산화아연 나노입자의 독성에 관한 연구도 활발히 진행되고 있다. 수계에서는 조류, 물벼룩, 어류 등을 이용하여 산화아연 나노입자의 독성 영향을 연구하고 있으며, 토양에서는 지렁이, 쥐며느리, 톡토기, 식물 등을 이용하여 독성 메커니즘을 규명하고 있다. 특히 산화아연 나노입자의 독성은 나노입자에서 용해된 아연 이온에 의한 것으로 아연 이온이 생체내로 침투되어 세포벽을 허물고 생장 속도를 낮추어 다양한 생물종에 영향을 미치는 것으로 알려져 있다[ 10~ 12]. 예외적으로, 식물 중에는 중금속을 체내에 지속적으로 축적하며 독성 영향을 비교적 적게 받는 종이 있으며, 이를 고축적 식물종(hyperaccumulator species)이라한다. 주로 식물 체내로부터 배출되는 유기산과 중금속 축적을 가능하게 해주는 효소 등에 의해 위와 같은 특성이 있는 것으로 알려져 토양식물정화(phytoremediation)에 사용되고 있다[ 13, 14]. 고축적 식물종이 될 수 있는 기준 농도는 중금속 종류에 따라 다르며, 아연의 경우 식물 건중량(g) 대비 아연을 1% 이상을 축적하여야 한다[ 15]. 해외에서는 Thlaspi caerulescens, Arabidopsis halleri 등이 아연 고축적 종으로 잘 알려져 있으며[ 16], 국내에서는 쑥이 대표적인 종으로 폐광산 지역이나 공장지역 도로변 등에서 자생하며 아연을 체내에 고축적하는 것으로 알려져 있다[ 17~ 19]. 현재까지 산화아연 나노입자와 같은 입자형태의 오염물질을 쑥에 노출시켜 독성영향을 연구한 결과는 거의 없으며, 특히 나노물질이 노출되는 수환경 및 토양환경에서의 거동을 총체적으로 연구한 결과는 존재하지 않는다. 이에 본 연구에서는 수환경 및 토양환경에서 산화아연 나노입자의 이동특성을 살펴보았으며, 쑥을 이용하여 산화아연 나노입자가 식물에 미치는 영향 및 식물체 내 거동현상을 관찰하였다. 이를 통해 산화아연 나노입자의 다양한 환경매체 중 거동특성을 규명하는데 도움이 되고자 하였다.
2. 연구방법
2.1. 실험재료
산화아연 나노입자는 US Research Nanomaterials Inc.에서 구매한 것으로 순도 99% 이상인 10 - 30 nm 크기를 이용하였으며, X선 회절 분석기(X-ray diffractometer, XRD, D8 Advance, Bruker, USA)와 투과전자현미경(Transmission electron microscope, TEM, JEM2010, Jeol, USA)을 이용하여 기본 결정구조 및 형태를 분석하였다. 수환경 실험에 사용된 배지는 염화나트륨(NaCl, Sigma-Aldrich, USA)로 제조하였고, pH 적정을 위해 염산(HCl, SAMCHUN, Korea) 및 수산화나트륨(NaOH, DAEJUNG, Korea)을 사용하였다. 토양 환경 실험에는 염화칼슘(CaCl2, Sigma-Aldrich, USA)로 인공강우를 제조하였고, 토양은 진주 남강에서 채취한 것을 사용하였다. 식물 실험은 쑥(Artemisia annua L.)을 이용하였으며, 식물 체내 아연 농도를 측정하기 위해 60 - 70% 질산(HNO3, SAMCHUN, Korea)으로 산분해를 하였다. 산화아연 나노입자의 독성 영향 외에도 아연 이온에 대한 영향을 보기 위해 염화아연(ZnCl2, JUNSEI, Japan)을 추가로 사용하였다.
2.2. 수환경 내 산화아연 나노입자의 거동특성
산화아연 나노입자를 3차 증류수에 200 mg/L가 되도록 주입한 후, probe sonicator (VCX-750 Ultrasonic Processor, Sonics & Materials, INC., USA)를 이용하여 53 W 출력으로 30분간 분산시켜 모액을 만들었다. 산화아연 나노입자의 분산 안정성을 확인하기 위해 모액을 10 mM 염화나트륨 용액을 이용하여 0, 1, 10, 50, 100 mg/L 농도로 희석한 후 정해진 시간(0, 1, 4, 8, 12, 24, 48시간)에 상층액을 채취하여 총농도 및 용해된 아연 이온의 농도를 측정하였다. 총농도는 5% 질산으로 산처리하여 상등액 내에 존재하는 아연(산화아연 나노입자 및 아연 이온)의 농도를 분석하였으며, 용해된 아연 이온 농도는 3 k Amicon Ultra-4 Centrifugal Filter (5000 rpm으로 30분간 원심분리)를 이용하여 분리된 아연농도를 분석하였다. 또한 pH에 따른 산화아연 나노입자의 입자 특성 및 용해 변화를 살펴보기 위해 염산과 수산화나트륨을 이용하여 시료의 pH를 6 - 10까지 적정하였다. 입자의 특성은 표면전하, 입자크기 등을 살펴보았으며, Zetasizer Nano (Nano ZS 90, Malvern instruments, UK)를 이용하여 제타전위(Zeta potential)와 수화반경(Hydrodynamic diameter)을 측정하였다.
2.3. 토양환경 내 산화아연 나노입자의 거동특성
토양 표층에서부터 산화아연 나노입자의 이동 현상을 관찰하기 위해 토양 컬럼을 이용하여 용출실험(leaching test)을 수행하였다. OECD test guideline 312 [ 20]를 참고하여 실험을 진행하였으며, 염화아연을 이용하여 아연 이온의 이동 경향과 비교하였다. 실험에 사용한 토양의 토성은 loamy sand (sand 72.8%, silt 27.0%, clay 0.2%, organic carbon 3%)로 35 ± 5 mg/kg(배경농도)의 아연이 존재하였다. 용출 실험을 위해 내경 4 cm, 높이 30 cm인 테플론 재질의 컬럼을 사용하였으며, 풍건 후 체질하여 입자크기가 2 mm 이하인 토양을 더 이상 아래로 내려가지 않을 때까지 plunger로 압축하였다. 실험 하루 전, 인공강우(10 mM 염화칼슘)를 컬럼 내 토양에 주입하여 토양 공극을 포화시켰으며, 인공강우는 1.45 uL/sec (250 mL/48 hr)의 속도로 흘려주었다. 공극의 포화가 완료되면 실험군 컬럼 상층에 100 mg의 산화아연 나노입자 및 염화아연이 섞인 토양 20 g을 균일하게 도포하였으며, 공극(공극률 약 52 %)을 포화시킨 속도와 동일한 속도로 48시간 동안 인공강우를 주입하였다. 이 때 인공강우가 토양 내로 균일하게 흐르도록 하기 위해 여과지를 토양 위에 올려둔 상태에서 흘려주었다. 48시간 후 토양 내 인공강우를 1일 동안 배출하였고 침출수(leachate)와 토양 내 아연 농도를 분석하였다. 이 때 토양은 컬럼을 5 cm 간격으로 분리한 후 토양오염공정시험법의 중금속 전함량 분석법에 따라 왕수로 아연을 추출하여 유도결합플라즈마 분광분석기 (ICP-OES, Optima 7000DV, Perkin Elmer, USA)로 분석하였다.
2.4. 식물체 내 산화아연 나노입자의 거동 및 영향
식물은 길가, 공터, 강가 등지에서 흔히 서식하며 아연을 높은 농도로 축적하는 쑥( Artemisia annua L.)으로 선정하였다. 실험은 토양환경 중에서 발생하는 미생물이나 유기물에 의한 영향을 배제하여 산화아연 나노입자와 아연 이온이 식물 내부로 축적되는 경로를 쉽게 파악하고, 실험물질이 균일하게 분포하는 상태에서 식물을 노출시키기 위해 수경재배 방법을 이용하였다. 10% dicotyledonous nutrient solution (Sigma-Aldrich, USA) [ 21]배지에 아연농도가 0, 20, 50, 100 mg/L가 되도록 제조하였으며 24시간마다 배지를 교체해 주었다( Table 1). 실험기간 동안 광주기는 12시간/12시간(명/암)으로 유지하였으며, 온도는 24℃, 습도는 60%, 광세기는 4000 lux로 유지하였다. 2주간 산화아연 나노입자와 아연 이온의 축적 정도를 비교하였으며, 노출기간이 끝난 후 식물 전체 무게, 줄기(shoot)와 뿌리(root)의 길이를 측정하여 성장정도를 관찰하였다. 식물 체내에 축적된 아연의 농도는 식물을 줄기와 뿌리로 분리한 후 70℃에서 24시간 건조시키고 60 - 70% 질산으로 산분해하여 ICP-OES로 분석하였다. 또한 식물 부위별 세포변화 및 산화아연 나노입자의 식물 체내 침투여부를 검증하기위해 TEM-EDS (Transmission electron microscope Energy Dispersive x-ray Spectroscopy)를 사용하였다.
2.5. 통계분석
통계처리는 one-way ANOVA를 이용하였으며 95% 유의수준(p < 0.05, *)으로 나타내었다.
3. 결과 및 고찰
3.1. 산화아연 나노입자의 기본물성
TEM 이미지를 통해 확인한 산화아연 나노입자는 구형에 가까웠으며, 결정구조는 육방정계의 Zincite 형태를 가지는 것을 XRD (Ref. PDF 01-071-6424)를 통해 확인하였다( Fig. 1).
3.2. 수환경 내 산화아연 나노입자의 거동특성
시간에 따른 산화아연 나노입자의 농도 변화를 Fig. 2(a)에 나타내었다. 전반적으로 시간이 지남에 따라 아연의 총농도가 감소하였다. 이는 산화아연 나노입자가 시간이 지남에 따라 바닥으로 침전한다는 것을 의미하며, 특히 100 mg/L 고농도의 경우에 다른 농도에 비해 빠른 침전현상을 관찰할 수 있었으며, 전반적으로 시간이 지남에 따라 침전속도는 감소하는 경향을 보였다. 이에 반해 산화아연 나노입자의 용해 농도는 서서히 증가하는 것으로 나타났다( Fig. 2(b)). 전체적으로 주입 농도가 증가할수록 용해되는 아연의 농도는 증가하였으나, 주입농도 대비 용해비(%)는 낮을수록 높게 나타났다[ 22]. pH에 따른 산화아연 나노입자의 입자 특성을 관찰하기 위해 다양한 pH 조건에서 입자의 수화반경과 표면전하를 분석하였다( Fig. 3(a), (b)). pH가 7에서 10으로 증가할 때 입자의 수화반경이 증가하였고 제타전위가 감소하였으며, 표면전하가 0이 되는 등점전하(pH pnzc)가 pH 9.8 ± 0.3으로 확인되었다. 이는 pH가 증가함에 따라 산화아연 나노입자의 표면전하가 OH- 이온에 의해 양전하에서 0에 가까워져 입자간의 전기적 반발력이 감소하여 응집이 일어났기 때문이다[ 23]. 또한 pH에 따른 산화아연 나노입자의 용해 변화를 살펴보기 위해 48시간 후 용해된 아연의 농도를 분석하였다( Fig. 3(c), (d)). pH 6일 때는 모든 농도의 산화아연 나노입자에서 80% 이상이 용해되었으며, pH 7에서는 60%, pH 8이상(8 - 10)에서는 10% 미만이 이온으로 존재했다. 이는 pH가 산화아연 나노입자의 수환경내 거동에 매우 중요한 변수임을 의미한다. 또한 기존 문헌에 의하면, 낮은 pH에서는 H + 이온이 나노입자의 표면을 직접적으로 공격하여 용해가 되며, 높은 pH에서는 OH - 이온에 의해 산화아연 나노입자 표면에 Zn(OH) 2(S)가 형성되어 용해가 감소되는 것으로 보고되어지고 있다[ 24, 30]. 이러한 산화아연 나노입자의 용해 양상은 bulk 크기의 입자일 때도 유사하였으나 나노입자가 크기가 작고 반응 표면적이 넓은 특성에 의해 용해되는 속도가 빨랐다[ 25, 31].
3.3. 토양환경 내 산화아연 나노입자의 거동특성
토양환경 중 산화아연 나노입자와 아연 이온의 거동 양상을 조사한 결과는 다음과 같다. 토양오염공정시험법에 따라 토양 내 아연을 추출하여 분석한 결과, 회수율은 산화아연 나노입자 108 ± 2%, 아연 이온 102 ± 4%였고, 농도는 Fig. 4와 같이 나타났다. 산화아연 나노입자의 경우 표층(2.5 cm)에서 주입량(100 mg)의 약 90% 이상이 검출되었고, 7.5 cm 이상의 깊이에서는 주입한 아연의 0.5% 미만 수준으로 나타났다. 이는 배경농도(대조군)와 유사한 수준이었다. 반면 아연 이온의 경우, 7.5 cm 깊이에서 가장 높은 농도의 아연이 검출되었으며, 주입한 시험물질의 0.5% 이상이 검출되는 용탈 거리가 12.5 cm로 확인되었다. 용출수(leachate)에서는 산화아연 나노입자와 아연 이온을 처리한 토양 컬럼 모두에서 아연이 검출되지 않았다. 산화아연 나노입자와 아연 이온의 이동성을 비교하기 위하여 동일한 토성의 토양에서 용탈 실험을 수행한 Atrazine(표준물질)의 용탈거리(22.5 cm) [ 26]를 이용하여 상대이동지수(Relative Mobility Factor, RMF, 시험물질 용탈거리/표준물질 용탈거리)를 구하였다. 그 결과, 산화아연 나노입자의 상대이동지수는 0.1(I-immobile), 아연 이온의 상대이동지수는 0.7 (II-slightly mobile)로 산화아연 나노입자가 아연 이온보다 이동성이 적은 것으로 확인되었다( Table 2). 이는 중성 환경에서 음전하를 띠는 것으로 알려진 토양 입자에 반대 전하를 가진 산화아연 나노입자가 흡착되면서 하부로 이동하지 못한 것으로 사료된다[ 27].
3.4. 식물체 내 산화아연 나노입자의 거동 및 영향
산화아연 나노입자와 아연 이온을 처리한 후 식물의 무게 및 줄기와 뿌리의 길이를 노출 전(0 d)에 대비하여 변화 정도를 나타내었다. Fig. 5(a)와 같이 대조군에서는 14일 후 식물의 무게가 증가하였으나, 산화아연 나노입자와 아연 이온을 처리한 시험군에서는 감소하였다. 아연 이온의 노출 농도가 증가할수록 식물의 무게가 지속적으로 감소한 반면 산화아연 나노입자를 처리한 식물의 무게는 농도와 상관없이 일정하게 나타났다. 14일 후 식물의 길이를 측정한 결과, 대조군은 줄기와 뿌리모두에서 노출 전과 유사한 수준으로 측정되어 길이 변화가 거의 나타나지 않았다( Fig. 5(b), (c)). 아연에 의한 식물 내부 영향을 TEM-EDS로 관찰한 결과이다. 산화아연 나노입자와 아연 이온에 노출된 식물 줄기에서는 대조군과 유사한 형태로 관찰되어 특이적인 현상은 발견되지 않았다( Fig. 6(a- c)). 하지만 뿌리 내부를 관찰한 결과에서는 산화아연 나노입자와 아연 이온이 다르게 나타났다. 산화아연 나노입자에 노출된 뿌리에서는 세포 내부로 나노입자가 침투되었고( Fig. 6(f)), 아연 이온에 노출된 뿌리에서는 세포벽이 파괴된 모습을 발견하였다( Fig. 6(e)). 특히 산화아연 나노입자의 경우 뿌리 표면에 상당히 많은 양의 나노입자가 흡착되어 있는 것을 육안으로 확인하였다( Fig. 7). 따라서 산화아연 나노입자는 식물 뿌리에 흡착하여 체내로 영양분과 수분이 공급되는 것을 방해하여 식물 성장에 영향을 준 것으로 판단되며, 아연 이온은 기존의 연구결과[ 28]와 같이 이온의 독성에 의해 뿌리의 세포벽이 파괴되어 식물의 성장에 영향을 미친 것으로 사료된다. 식물이 14일 동안 줄기와 뿌리에 축적한 아연 농도를 분석한 결과를 Fig. 8에 나타내었다. 아연 이온을 처리한 식물의 줄기에서는 노출 농도가 증가할수록 아연 함량이 증가하였으며, 100 mg/L의 아연 이온을 처리한 식물에서 최고 농도(약 4 mg/g)가 검출되었다. 반면 산화아연 나노입자를 처리한 식물의 줄기에서는 노출 농도와 상관없이 약 0.25 mg/g의 아연이 검출되었으며, 이는 아연 이온이 산화아연 나노입자 보다 식물 줄기로 더 잘 이동함을 보여주는 결과이다( Fig. 8(a)). 뿌리에서는 산화아연 나노입자와 아연 이온 모두 노출 농도가 증가할수록 축적된 아연의 함량이 증가하였으며, 50 mg/L 이상의 노출농도에서는 산화아연 나노입자에 노출된 식물 뿌리가 아연 이온에 노출된 뿌리보다 아연 농도가 높게 검출되었다( Fig. 8(b)). 이는 뿌리 표면에 강하게 흡착되어 세척이 되지 않은 산화아연 나노입자에 의한 오차로 보여졌으나, Zhou [ 29]의 연구결과를 통해 식물 뿌리에 농축된 나노입자의 양이 세척여부에 따라 크게 달라지지 않음을 확인하였다. 이를 통해 식물 뿌리와 나노입자의 강한 흡착력이 식물이 아연을 체내 축적하는 것에 영향을 미칠 수 있음을 확인하였다.
4. 결 론
1) 수환경 실험결과 pH 6 - 7인 조건에서 산화아연 나노입자의 60 - 80%가 용해되어 이온형태로 존재하는 것을 확인하였다. 따라서 실제 수생태계에 산화아연 나노입자가 노출될 경우 나노입자보다는 아연 이온의 형태로 존재할 가능성이 클 것으로 사료된다.
2) 토양 컬럼 용출실험을 통해 산화아연 나노입자가 아연 이온에 비해 토양 상부에서 하부로 이동할 가능성이 적은 것을 확인하였다. 따라서 실제 토양환경에 산화아연 나노입자가 노출될 경우 지하수로 이동할 가능성이 적으며 대부분 토양 표층에 존재할 것으로 판단된다.
3) 산화아연 나노입자와 아연 이온을 식물(쑥)에 노출시킨 결과, 줄기보다 뿌리에 아연이 많이 축적되었고, 산화아연 나노입자에서 더 고농도로 나타난 반면 줄기에서는 아연 이온이 더 많이 검출되어 이온형태가 식물 내부에서의 이동성이 큰 것으로 나타났다. 뿌리 세포에서 산화아연 나노입자가 발견되었고, 아연 이온에서는 세포벽이 괴사된 모습이 관찰되어 기존의 다른 연구와 마찬가지로 이온에 의한 독성 영향을 받은 것으로 나타났다.
Acknowledgments
본 연구는 안전성평가연구소의 “제조나노물질 환경위해성 평가기술 구축(KK-1708-01)” 사업으로부터 지원을 받았습니다.
Fig. 1.
Structural characterization of ZnO NPs purchased from US Research Nanomaterials Inc. TEM image (a) and XRD pattern (b) of ZnO NPs. 
Fig. 2.
Total Zn concentration (a) and dissolved Zn concentration (b) of ZnO NPs over time. 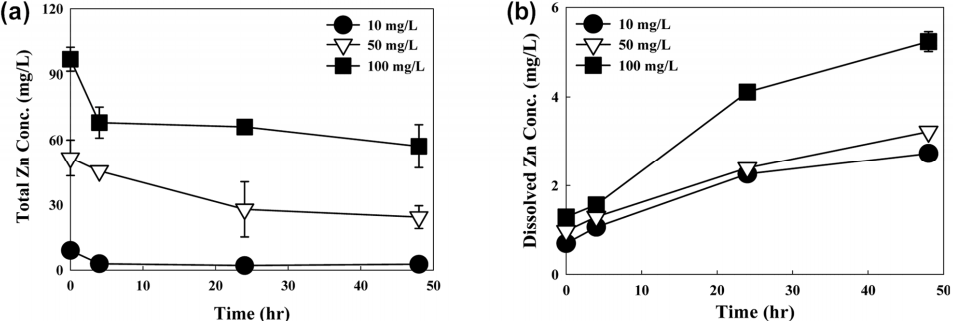
Fig. 3.
Hydrodynamic diameter (a), zeta potential (b), dissolved Zn concentration (c), and dissolved Zn ratio (d) of ZnO NPs at different pH values. 
Fig. 4.
Distribution of Zn (ZnO NPs and Zn ion) concentration (a) and pH (b) via leaching distance in soil. 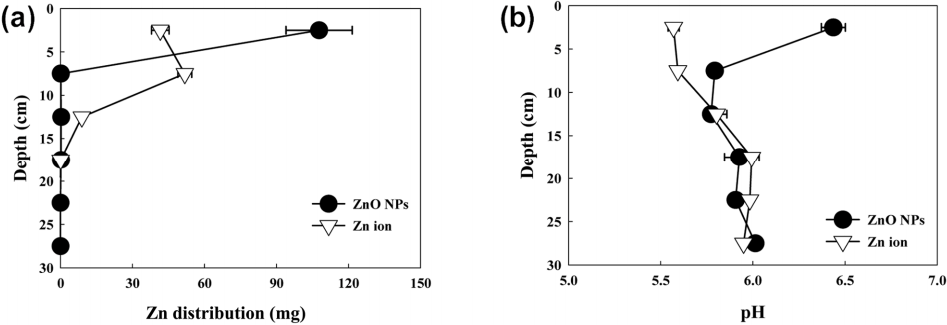
Fig. 5.
Effect of Zn (ZnO NP s and Zn ion) on growth and development of plants. Weight of total fresh biomass of plants growing on medium with and without Zn (a), Length of shoot of plants growing on medium with and without Zn (b), Length of root of plants growing on medium with and without Zn (c). The values are given as mean ± one standard deviation of 5 samples. *: Denotes significant differences (p<0.05) from the unexposed control. 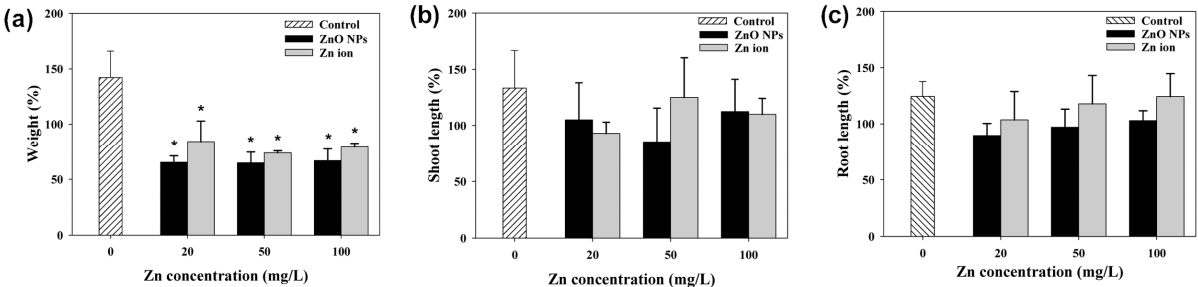
Fig. 6.
Plants exposed to 100 mg/L of Zn (ZnO NPs and Zn ion) after 14 d. TEM image of the top : control (a), Zn ion (b), and ZnO NP s (c) in the shoots, bottom : control (d), Zn ion (e), and ZnO NP s with EDS analysis at red point (f) in the roots. 
Fig. 7.
Root of plant exposed to 100 mg/L ZnO after 14 d Photo (a), TEM images of ZnO NPs adsorbed on root (b), and EDS analysis (c). 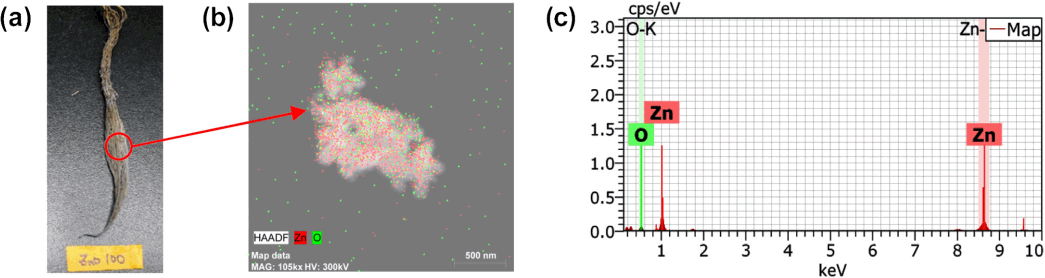
Fig. 8.
Plants exposed to various concentrations of Zn (ZnO NPs and Zn ion) after 14 d. The concentration of shoots on medium with and without Zn (a). Zn concentration of roots on medium with and without Zn (b). The values are given as mean ± one standard deviation of 5 samples. *: Denotes significant differences (p<0.05) from the unexposed control. 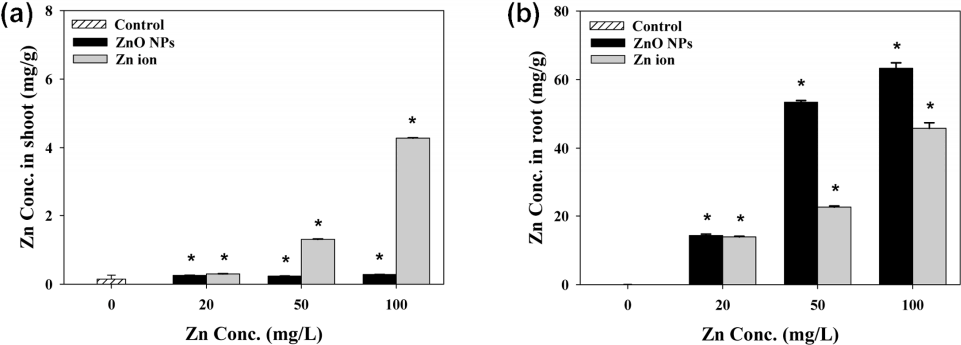
Table 1.
The composition of dicotyledonous nutrient solution
|
Chemical |
Conc. (mM) |
Chemical |
Conc. (mM) |
|
K2SO4
|
0.75 |
MnSO4*H2O |
0.001 |
|
Ca(NO3)2*4H2O |
2 |
CuSO4*5H2O |
1*10-4
|
|
MgSO4*7H2O |
0.65 |
ZnSO4*7H2O |
0.001 |
|
KH2PO4
|
0.25 |
(NH4)6Mo7O24
|
5*10-5
|
|
KCl |
0.1 |
Fe-EDTA |
0.1 |
|
H3BO3
|
0.01 |
|
|
Table 2.
Examples of relative mobility factors (RMF) for a variety of crop protection substances and corresponding mobility classes [ 20]
|
RMF-Range Compound (RMF) |
Mobility |
Class |
|
≤0.15 |
Parathion (< 0.15), Flurodifen (0.15) |
I-immobile |
|
0.15 - 0.8 |
Profenophos (0.18), Propiconazole (0.23), Diazinon (0.28), Diuron (0.38), Terbuthylazine (0.52), Methidathion (0.56), Prometryn (0.59), Propazine (0.64), Alachlor (0.66), Metolachlor (0.68) |
II-slightly mobile |
|
0.8 - 1.3 |
Monuron (1.00), Atrazine (1.03), Simazine (1.04), Fluometuron (1.18) |
III-moderately mobile |
|
1.3 - 2.5 |
Prometon(1.67), Cyanazine (1.85), Bromacil (1.91), Karbutilate (1.98) |
IV-fairly mobile |
|
2.5 - 5.0 |
Carbofuran (3.00), Dioxacarb (4.33) |
V-mobile |
|
> 5.0 |
Monocrotophos (> 5.0), Dicrotophos (> 5.0) |
VI-very mobile |
References
1. NIER-SP2015-340, “Research on the discharge characteristics and their proper management plan for nano-waste(I),” National Institute of Environmental Research(2015).
2. E. J.. Kim, Risk Assessment of Nanomaterials: Issues and Perspectives, Seoul Nat. Univ., 49, (2010).
3. M. E.. Vance, T.. Kuiken, E. P.. Vejerano, S. P.. McGinnis, D.. Rejeski, M. S.. Hull, Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory, Beilstein J. Nanotechnol., 6, 1769-1780(2015).  4. T.. Sakallioglu, M.. Bakirdoven, I.. Temizel, B.. Demirel, N. K.. Copty, T. T.. Onay, C. S.. Uyguner Demirel, T.. Karanfil, Leaching of nano-ZnO in municipal solid waste, J. Hazard. Mater., 317, 319-326(2016).  5. A.. Voegelin, S.. Pfister, A. C.. Scheinost, M. A.. Marcus, R.. Kretzschmar, Changes in Zinc Specipitation in Field Soil after Contamination with Zinc Oxide, Environ. Sci. Technol., 39, 6616-6623(2005).  6. D.. Zhou, A. A.. Keller, Role of morphology in the aggregation kinetics of ZnO nanoparticles, Water Res., 44, 2948-2956(2010).  7. I. A.. Mudunkotuwa, T.. Rupasinghe, C. M.. Wu, V. H.. Grassian, Dissolution of ZnO Nanoparticles at Circumneutral pH: A Study of Size Effects in the Presence and Absence of Citric Acid, Langmuir., 28, 396-403(2010).  8. S. W.. Bian, I. A.. Mudunkotuwa, T.. Rupasinghe, V. H.. Grassian, Aggregation and Dissolution of 4 nm ZnO Nanoparticles in Aqueous Environments: Influence of pH, Ionic Strength, Size, and Adsorption of Humic Acid, Langmuir., 27, 6059-6068(2011).  9. P. S.. Tourinho, C. A. M. V.. Gestel, S.. Lofts, C.. Svendsen, A. M. V. M.. Soares, S.. Loureiro, Metal-based nanoparticles in soil: Fate, behavior, and effects on soil invertbrates, Environ. Toxicol. and Chem., 31(8), 1679-1692(2012).  10. D.. Lin, B.. Xing, Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth, Environ. Pollut., 150, 243-250(2007).  11. Y.. Sohng, Y. N.. Nam, I. S.. Lee, Phytotoxicity and Bioavailability of Zinc, Zinc Oxide Nanoparticles to the Cucumis sativus, J. Korean Soc. Environ. Eng., 31(7), 467-472(2009).
12. X.. Yanga, Y.. Feng, Z.. Hea, P. J.. Stoffella, Molecular mechanisms of heavy metal hyperaccumulation and phytoremediation, J. Trace Elements in Medicine and Biol., 18, 339-353(2005).  13. N.. Verbruggen, C.. Hermans, H.. Schat, Molecular mechanisms of metal hyperaccumulation in plants, New Phytologist., 181, 759-776(2009).  14. M. R.. Broadley, P. J.. White, J. P.. Hammond, I.. Zelko, A.. Lux, Zinc in plants, New Phytologist., 173, 677-702(2007).  15. S. P.. McGrath, E.. Lombi, N.. Gray, C. W. Caille, S. J.. Dunham, F. J.. Zhao, Field evaluation of Cd and Zn phytoextraction potential by the hyperaccumulators Thlaspi caerulescens and Arabidopsis halleri, Environ. Pollut., 141, 115-125(2006).  16. Ministry of Environment, Eco-friendly and Long-term Phytoremediation of Heavy Metal Contaminated Soil Using Indigenous Plants, (2007).
17. Y. J.. Choi, J. S.. Lee, Heavy Metal Accumulation in Wild Plants on the Roadside of Industrial Areas, J. Korean Environ. Res. & Reveg. Tech., 8(5), 39-46(2005).
18. S. H.. Park, S. I.. Choi, J. B.. Park, H. K.. Han, S. D.. Bae, I. J.. Song, E. R.. Park, Phytoremediation on the Heavy Metal Contaminated Soil by Hyperaccumulators in the Greenhouse, J. Soil & Groundwater Environ., 16(5), 1-8(2011).  19. S. M.. Han, S. W.. Kang, H. J.. Kim, D. H.. Kim, A Study on the Characters of Heavy Metals of Soils and plants in the Abandoned Mines and the Landfills of Busan, Health & Environ., 22(1), 201-215(2012).
20. OECD Guidelines for the testing of chemicals 312, “Leaching in soil columns,” (2004).
21. Z.. Wang, L.. Xu, J.. Zhao, X.. Wang, J. C.. White, B.. Xing, CuO Nanoparticle Interaction with Arabidopsis thaliana: Toxicity, Parent-Progeny Transfer, and Gene Expression, Environ. Sci. Technol., 50(11), 6008-6016(2016).  22. NIER-SP2015-208, “Transformation and toxicity of nanomaterials in the environment,” National Institute of Environmental Research(2015).
23. A.. Degen, M.. Kosec, Effect of pH and impurities on the surface charge of zinc oxide in aqueous solution, J. the European Ceramic Soc., 20, 667-673(2000).  24. S. W.. Bian, I. A.. Mudunkotuwa, T.. Rupasinghe, V. H.. Grassian, Aggregation and Dissolution of 4 nm ZnO Nanoparticles in Aqueous Environments: Influence of pH, Ionic Strength, Size, and Adsorption of Humic Acid, Langmuir., 27(10), 6059-6068(2011).  25. C. A.. David, J.. Galceran, C.. Rey-Castro, J.. Puy, E.. Companys, J.. Salvador, J.. Monné, R.. Wallace, A.. Vakourov, Dissolution Kinetics and Solubility of ZnO Nanoparticles Followed by AGNES, J. Phys. Chem. C., 116, 11758-11767(2012).  26. MOTIE, Development of Safety Assessment and Certification System for Nano ProductsMinistry of Trade, Industry and Energy2011.
27. T. K.. Darlington, A. M.. Neigh, M. T.. Spencer, O. T.. Nguyen, S. J.. Oldenburg, Nanoparticle characteristics affecting environmental fate and transport through soil, Environ. Toxicol. and Chem., 28(6), 1191-1199(2009).  28. D.. Lin, A.. Xing, Root Uptake and Phytotoxicity of ZnO Nanoparticles, Environ. Sci. Technol., 42, 5580-5585(2008).  29. D.. Zhou, S.. Jin, L.. Li, Y.. Wang, N.. Weng, Quantifying the adsorption and uptake of CuO nanoparticles by wheat root based on chemical extractions, J. Environ. Sci., 23(11), 1852-1857(2011).  30. A.. Degen, M.. Kosec, Effect of pH and impurities on the surface charge of zinc oxide in aqueous solution, J. European Ceramic Soc., 20, 667-673(2000).  31. N.M.. Franklin, N. J.. Rogers, S. C.. Apte, G. E.. Batley, G. E.. Gadd, P. S.. Casey, Comparative Toxicity of Nanoparticulate ZnO, Bulk ZnO, and ZnCl 2 to a Freshwater Microalga (Pseudokirchneriella subcapitata): The Importance of Particle Solubility, Environ. Sci. Technol., 41, 8484-8490(2007). 
|
|


















