무심천의 시·공간적 수질, 어류 생태길드 및 종적연결성 변화 분석
Spatiotemporal Variation Analyses of Water Quality, Fish Ecological Guilds, and the Longitudinal Connectivity in Musim Stream
Article information
Abstract
본 연구에서는 미호강 지류하천인 무심천을 대상으로 44개 지점에서 어류조사, 인공구조물 분석 및 3개 지점에서 이화학적 수질 분석을 통해 하천의 종적연결성 분석을 수행하였다. 봄과 가을에 어류를 채집하여, 지점간 섭식길드, 생태길드 및 어류평가지수를 분석하였으며, 총 33종이 출현하였다. 우점종은 피라미(Zacco platypus)와 긴몰개(Squalidus qracilis majimae)로 나타났다. 이화학적 수질 분석 결과, 유기물 오염 지표인 생물학적 산소 요구량과 화학적 산소 요구량의 평균 값은 봄철(장마전)에 가장 높았고, 가을철(장마후)에 가장 낮게 나타났다. 또한 총인과 총유기탄소의 경우 BOD와 COD의 값과 유사한 경향을 보인 것으로 나타났다. 지점별 어류 조성에 기반한 계층적 군집분석 결과 3개의 그룹(상류, 중류, 하류)으로 구분되었다. 어류 상대풍부도에 기반한 지점별 NMDS분석결과, S1-S5지점간 유사도가 높게 나와 계층적군집분석 결과와 일치하였다. 어류 생태길드의 경우, 상류지점의 경우 충식종과 민감종과 유사도가 높은 것으로 나타났으며, 중류와 하류 지점의 경우 잡식종과 중간종과의 유사도가 높은 것으로 나타났다. 보의 수리학적 특성에 따른 종적 연결성 평가 결과, 봄철의 S15지점을 제외한 모든 보가 단절된 것으로 나타났다. FAI값에 기반한 하천 생태 건강도는 상단수심과 유의한 (p < 0.05, n=37) 관계를 갖는 것으로 나타났다. 보의 수리학적 특성에 기반한 수생태계 종적 연속성을 평가한 결과, 봄철 S15 지점을 제외한 전 지점에서 단절로 평가되었으며, 각 지점별 인공구조물의 특성과 어류평가지수(Fish Assessment Index)와의 상관관계를 분석한 결과 Hu1(Sp)에서 통계적으로 유의한 양의 상관관계가 나타났다. 종합적으로, 이 연구는 어류의 유영 능력 및 도약 능력에 기초한 종적 연결성이 보 구조 때문에 단절되었다는 것을 나타내며, 이러한 결과는 하천 건강을 평가하고, 하천 관리 방안을 확보하며, 종적 연결성을 확보하기 위한 기초 데이터로 활용될 수 있을 것으로 사료된다.
Trans Abstract
The main objectives of this study were to analyze the spatiotemporal variations of water quality, fish ecological guilds and longitudinal connectivity in the weirs of Musim Stream. Fish were collected at 44 sites during spring and fall seasons for the analysis of trophic guilds, tolerance guilds, and the ecological stream health, based on FAI model. Total 33 species were observed in the stream and the dominant species were Zacco platypus and Squalidus qracilis majimae. Mean values of BOD and COD, as an indicator of organic matter pollution, showed high in the drought spring and low in fall (post-monsoon season). Also, TP showed same pattern with the BOD and COD pattern. The hierarchical clustering, based on the fish compositions, classified as three groups (up-stream, mid-stream and the down-stream). Based on the NMDS (Non-metric Multidimensional Scaling) analysis of fish abundance, high similarity was observed between S1-S5 sites, which were consistent with the results of hierarchical cluster analysis. Fish ecological guilds in the upper stream showed a high similarity between the insectivore and sensitive species, while in the middle and lower reaches, high similarity was found between the omnivore and intermediate species. Evaluations of longitudinal connectivity, based on the structural and hydrological characteristics of the weir, indicated all disconnections by the weirs, except for S15, in the spring. Stream ecological health, based on the FAI model, was significantly (p < 0.05, n=37) influenced by the height of overflow (Hu1). Overall, our study suggests that the longitudinal connectivity, based on the weir structures, flow regime and fish swimming capacity, were blocked off by the weirs in the stream. The results provide valuable insights for securing river management strategies and served as the fundamental data for stream restoration in the future.
1. 서 론
하천의 종적연속성은 상류와 하류 사이에 물질순환과 생물이동이 자연스러운 상태를 말하며, 하천은 상류부터 하류까지 연속적으로 이어져, 하천 수생태계 시스템의 생태학적 및 생물학적 상호작용에 중요한 영향을 주는 것으로 알려져 있다[1]. 외적 요인에 의한 단절이 일어나지 않은 하천의 경우, 상류에서 하류로 갈수록 물리적, 화학적, 생물학적 특성은 River Continuum Concept(RCC)의 개념에 따른다[2]. 한편 하천의 연속성이 단절될 경우, 자연적인 흐름이 방해되어 수생태계에 악영향 일으킬 수 있으며, 이수 및 치수를 위해 건설된 구조물들은 상하류간 생물 이동을 단절시키며, 수질 악화 및 서식환경의 변화를 초래한다[3]. 우리나라의 경우 여름철 비가 집중되는 계절적 몬순 강우의 특징을 보여[4], 농번기에는 용수 확보가 용이하지 않은 실정이며, 이러한 이유로 수자원 확보를 위해 다양한 형태의 중소형 보가 건설되었고, 현재 우리나라의 하천에 약 34,000개의 보 구조물이 있는 것으로 보고되어 있는데, 이들은 하천의 종적연결성에 악영향을 미치는 것으로 보고된 바 있다[5].
하천에서 어류는 수생태 최상위 포식자로서, 하천의 환경적 변화에 영향을 받으며, 수생태 건강성을 평가하는데 중요한 지표로 이용되고 있으며, 하천에 설치된 인공구조물은 유속, 수심, 하상 등 서식환경의 변화를 일으켜 어류상의 변화나 회유성 어종의 이동 제한 등 수생태계에 영향을 미치고 있다[6]. 이러한 결과 어류의 개체수 감소, 더 나아가서는 종 다양성 감소 등의 영향을 받게 된다[7,8]. 또한 대부분의 보에는 어도가 설치되어 있지 않고, 구조상의 문제 및 보 상류의 침전 등으로 인해 어종이 이동하기에 유량이 부족한 상태로 연속성의 확보가 어려운 실정이다[9]. 국내의 경우 연곡천의 보와 어도의 개선을 통해 연속성을 확보하여 회유성 어종 및 종 다양성이 증가한 것을 확인하였으며, 이를 통해 수생태계를 복원하고자 하였다[9]. 따라서 보가 하천에 미치는 종합적인 영향을 평가하여, 그에 따른 보의 개선을 통한 종적연결성을 확보하는 것이 필요하며, 이는 생물다양성 확보와 수생태계 건강성을 확보하는 측면에서 매우 중요한 요소라고 할 수 있다[10,11].
본 연구에서는 미호강의 지류하천인 무심천에서 44지점의 보(weir)를 대상으로 어류 종 조성을 분석하였고, 섭식 길드와 내성도 길드를 분석을 실시하였으며, 추가적으로 수질분석은 3개 지점(W1, W2, W3)에서 수행되었다. 또한 인공구조물의 특성을 조사하여 무심천의 종적연결성을 평가함으로써 향후 하천의 어류상 및 수생태계 연속성의 기초 자료로 사용될 수 있을 것이다.
2. 재료 및 방법
2.1. 조사 지점
본 연구 대상 지점은 미호강의 지류하천 중 하나인 무심천으로 무심천 최하류 지점부터 최상류에 위치한 보까지 총 44개 지점(S1~S44)을 어류 조사 및 인공구조물조사 지점으로 지정하였다. 또한 이·화학적 수질자료 분석을 위해 환경부에서 제공하는 물환경정보시스템의 월별 수질 자료를 이용하였고, 무심천에 존재하는 수질측정망지점은 총 3지점(W1~W3)을 지정하였다(Fig. 1).
2.2. 조사 기간 및 방법
무심천의 44개 지점의 종적연결성을 평가하기 위해, 2022년 가을, 2023년 봄 지점별로 두번씩 어류 어류채집을 실시하였고, 같은 기간동안 인공구조물의 높이, 길이 등 물리적 특성과 하단수심, 상단수심, 낙차, 유속 등 수리학적 특성을 조사하였다. 현장조사 방법은 국립환경과학원에서 제시한 수생태계 연속성 조사 및 평가 방법 등에 관한 지침에[12] 의거하여 인공구조물 조사와 함께 하류 100m 구간에 서식하는 어류를 대상으로 채집하였다. 무심천의 이・화학적 수질 자료를 분석하기 위해 2017년 1월부터 2023년 5월까지 3개 지점에서 측정된 환경부의 월별 자료를 이용하였다. 자료 분석을 위해 사용된 수질 변수는 생물학적 산소요구량(BOD), 총인(TP), 총유기탄소(TOC), 부유물질(SS), 화학적 산소요구량(COD)으로 총 5개의 수질 변수를 이용하여 장기간의 지점별 수질의 변화를 분석하였다. 어류 조사 지점별 고도와 경사도는 구글에서 제공하는 입체지도 서비스인 구글어스를 이용하여 이용하였다.
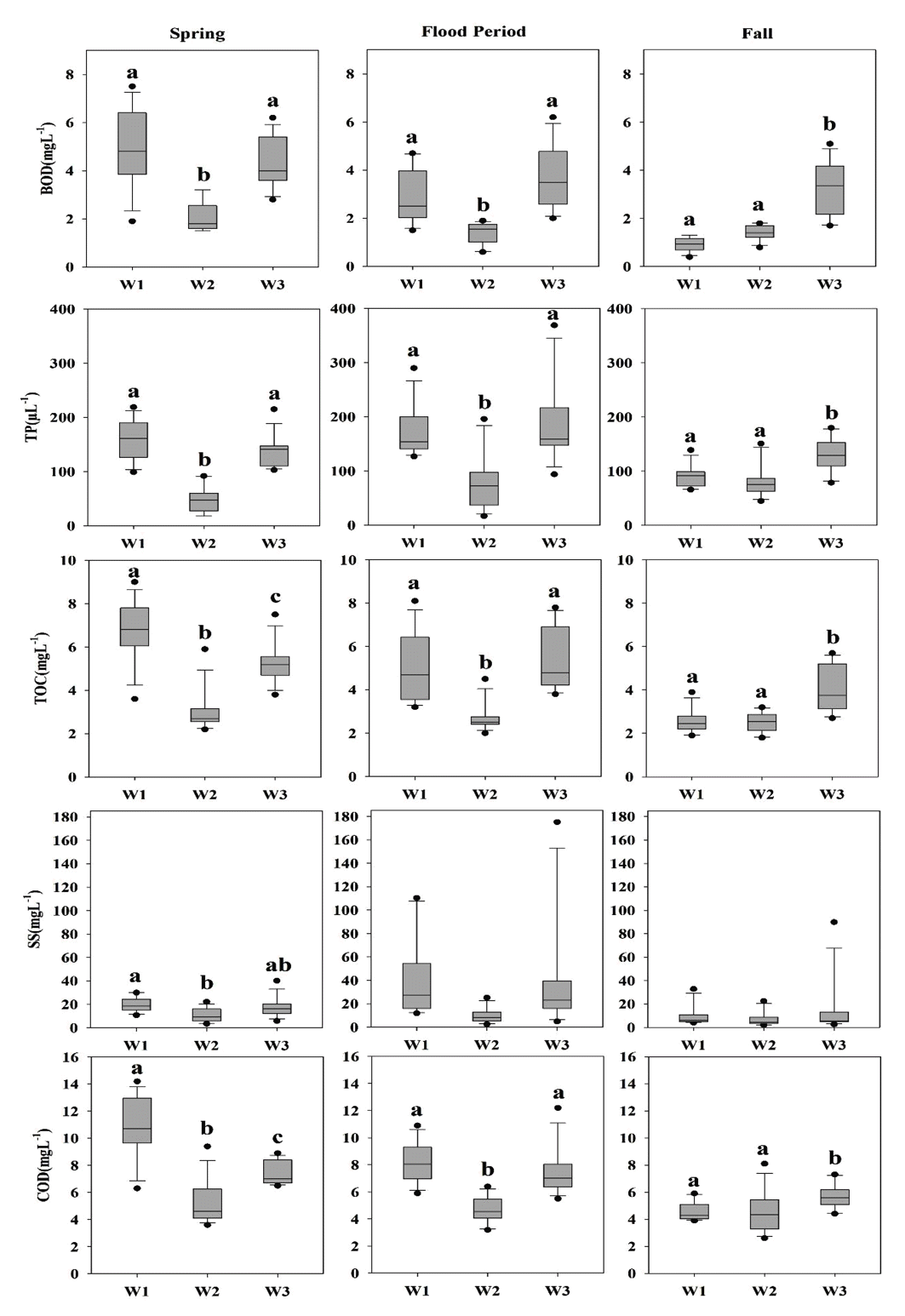
Spatial variations of water quality parameters based on monthly value of 2017~2023 in the sampling sites (W1, W2, W3). Letters (a,b,c) indicate statistically different groups(p<0.05). BOD (biochemical oxygen demand), TP (total phosphorus), TOC (total organic carbon), SS (suspended solids), COD (chemical oxygen demand).
2.3. 종적연결성 평가
하천의 종적연결성을 평가하기 위해 수생태계 연속성 조사 및 평가 방법 등에 관한 지침에[12] 의거하여 조사를 실시하였다. 먼저, 보 구조물의 수리학적 특성을 조사하기 위해, 경사(α), 유속(U), 하단수심(Hd), 상단수심(Hu), 낙차(DH)를 측정하였으며, 경사에 따라 경사형(56°이하), 수직형(56°초과) 또는 복합형(경사형-경사형, 경사형-수직형, 수직형-수직형)으로 구분하였다. 유속의 경우 Flowatch 유속계를 사용하여 측정하였으며, 눈금자를 이용하여 하단수심과 상단수심을 측정하였다. 어도가 존재하는 보의 경우 어도의 입구부, 중앙부, 출구부로 구획화 하여, 각 지점에서 유속, 하단수심, 상단수심, 낙차를 측정하였으며, 경사의 경우 대표지점으로 선정된 중앙부 측면에서 측정하였다. 어류 이동률의 경우, 어류의 이동특성에 기반하여, 최대유영속도(fUmax), 최대도약높이(fHmax), 최소유영수심(fHumin), 최소준비수심(fHdmin)을 보의 수리학적 특성에 적용하여 이동률을 판단하였다. 낙차가 존재하는 보 혹은 어도의 경우, 도약종을 대상으로 통과 가능 여부를 판단하였다.
보 구조물의 수리학적특성과 어류의 이동특성에 기반하여 수생태계 연속성 평가를 실시하였으며, 이를 통해 종적연결성을 평가하였다. 구조물 단위 평가의 경우 채집된 어류 종수 대비 구조물 통과가 가능한 어류의 종수의 비율을 계산하여 어류 이동률 (%)로 평가하였다. 구조물 단위 평가는 연속(어류 이동률≥50%), 훼손(0%<어류 이동률 < 50%), 단절(어류 이동률=0%)3가지로 평가하였으며, 이를 기반으로 하천단위 평가를 실시하였다. 하천단위 평가의 경우 하천 종점으로부터 어류 소상이 가능한 구간을 하천 연장 대비 비율로 나타냈으며, 연속(연속성 확보 구간≥ 50%), 훼손(10% < 연속성 확보구간 < 50%), 단절(연속성 확보 구간≤10%)로 평가하였다.
2.4. 통계적 분석 방법
본 연구에서 이・화학적 수질특성은 우리나라의 강우 특성 및 조사시기를 고려하여 봄철(5~6월), 장마기(7~8월), 가을철(9~10월)로 구분하여 지점에 따른 수질의 변화 양상을 분석하였다. 어류의 생태길드 분석을 위해 환경부의 생물측정망 조사 및 평가지침[13]의 내용을 참고하였으며, 지점별 유사성 분석을 위해 봄철과 가을철에 채집된 어류를 합산한 뒤 각 지점에서 채집된 어류의 상대풍부도를 이용하여 계층적 군집 분석(Hierarchical Clustering)을 실시하였다. 분석을 위해 R의 cluster package [14]에 포함된 daisy 함수를 사용하였으며, 거리 산출은 유클리드 방법을 사용하였다. 산출된 높이를 바탕으로 한 지점간 거리는 Ward [15]방법을 이용하여 분류하였다. 어류의 생태길드에 기반한 지점별 유사성 분석은 NMDS (Non-metric multidimensional scaling, NMDS)를 이용하였으며[16], NMDS분석은 vegan package [17]의 metaMDS 함수를 이용, Bray-Curtis 방식[18]에 따라 지점별 유사도를 산출하였다. 수질자료의 통계분석은 Sigmaplot (ver. 14, Systat Software, Inc.) 및 R program (ver 4.3.1)을 이용하였다.
3. 결과 및 고찰
3.1. 화학적 수질특성
무심천의 시・공간적 수질변화를 알아보기 위해 최근 7년간의 수질 자료를 분석하였다. BOD, TOC 및 COD의 경우 전 지점에서 봄철에 가장 높은 값을 보였고 가을철에 가장 낮은 값을 보였다. TP와 SS는, 장마기간 동안 전 지점에서 가장 높은 것을 알 수 있었는데, 이는 강우로 인한 토사나 유기물의 유입 때문으로 사료된다[16]. 환경부의 하천수 수질환경 기준에 따르면, BOD 농도는 봄철에 1.5 ~ 7.5mg L-1로 Ib (좋음) ~ IV (약간나쁨), 장마기간동안 0.6~6.2 mg L-1로 Ia (매우좋음) ~ IV (약간나쁨), 가을철에 0.4~5.1 mg L-1로 Ia (매우좋음) ~ IV (약간나쁨)으로 가을철에 수질이 가장 양호한 것으로 나타났다. 또한, TP, TOC 및 COD 또한 BOD와 유사한 경향을 보인 것을 알 수 있었다. W1과 W3의 경우 W2에 비해 수질이 악화된 것으로 나타났으며, 이는 주변 농경지로부터 토사 및 영양염류의 유입 때문으로 사료된다. W2 지점의 경우, 봄철과 장마기간동안 BOD, TP에서 통계적으로 유의하게 다른 것을 보이는데, 비해 대부분 지표에서 낮은 값을 보이는데, 이는 도심지역에 위치한 지점으로 하천 주변 정비사업으로 외부 오염원 및 토사의 유입이 적었기 때문인 것으로 사료된다.
3.2. 어류 종 조성 및 생태길드 분석
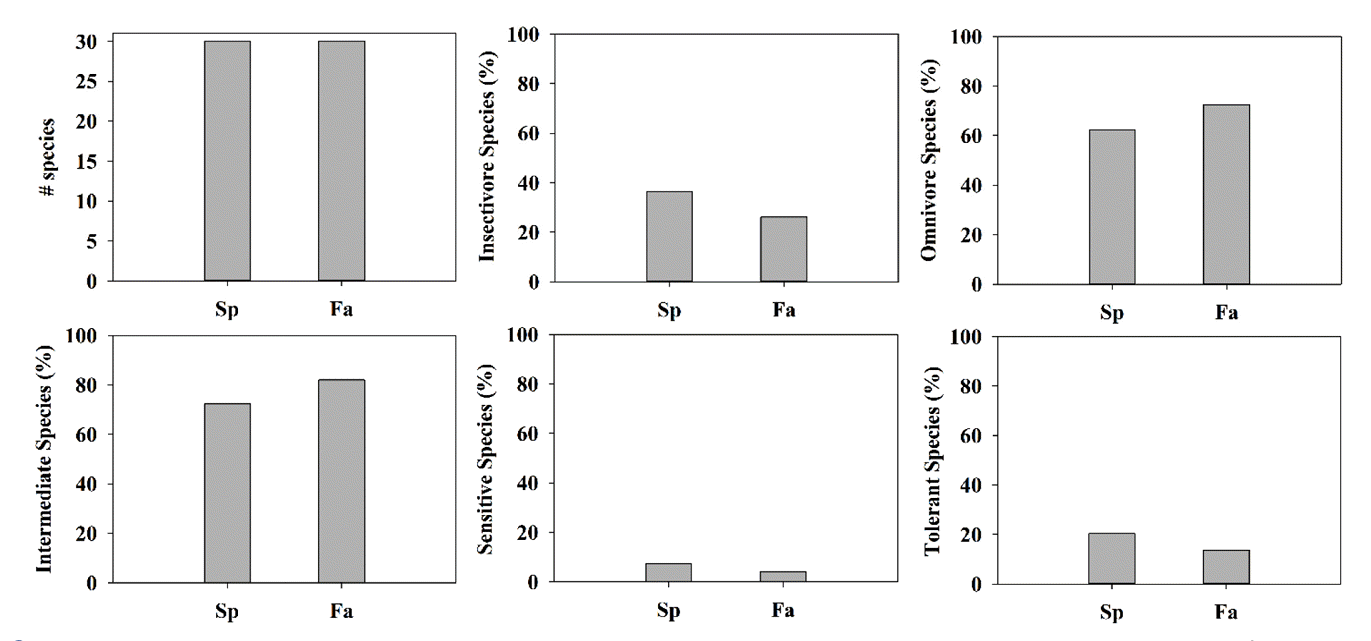
조사기간 동안 채집된 어류는 총 7과 33종, 11,521개체로, 봄철의 경우 총 6과 30종, 2,964개체, 가을철의 경우 총 5과 30종, 8,557개체가 채집되었다. 이 중 잉어과(Cyprinidae) 어류가 24종으로 가장 많았고, 미꾸리과(Cobitidae), 검정우럭과(Centrarchidae), 망둑어과(Gobiidae)가 2종, 꺽지과(Percichthyidae), 종개과(Nemacheilidae), 동사리과(Odontobutidae)가 각각 1종씩 나타났다. 봄철조사와 가을철 조사 모두 피라미(Zacco platypus)가 우점종으로 나타났으며, 외래종의 경우 봄철 조사에서는 2지점(S26, S44)에서 배스가 출현하였고, S28에서 블루길이 출현하였다. 가을철 조사에서는 11지점(S26, S27, S28, S30, S34, S35~38, S43, S44)에서 배스가 출현하였고, 3지점(S28~30, S37)지점에서 블루길이 출현하였다(Table 1). 봄철에 비해 가을철에 전체 어종과 외래종의 개체수가 더 많은 것을 보여주는데 이는 상대적으로 수온이 높았던 가을철에 어류의 활동성이 증가된 것으로 사료된다[19]. 어류 내성도 길드 및 섭식 길드 비교 결과, 봄철의 경우 충식종(Insectivore)은 1,078개체(36.4%), 잡식종(Omnivore)은 1844개체(62.2%)가 출현하였고, 육식종(Carnivore)의 경우 2% 미만으로 출현하였다. 가을철의 경우 경우 충식종은 2,238개체(26.2%), 잡식종은 6,204개체(72.5%)가 출현하였고, 육식종의 경우 봄철과 마찬가지로 2% 미만으로 출현하였다(Fig. 3).
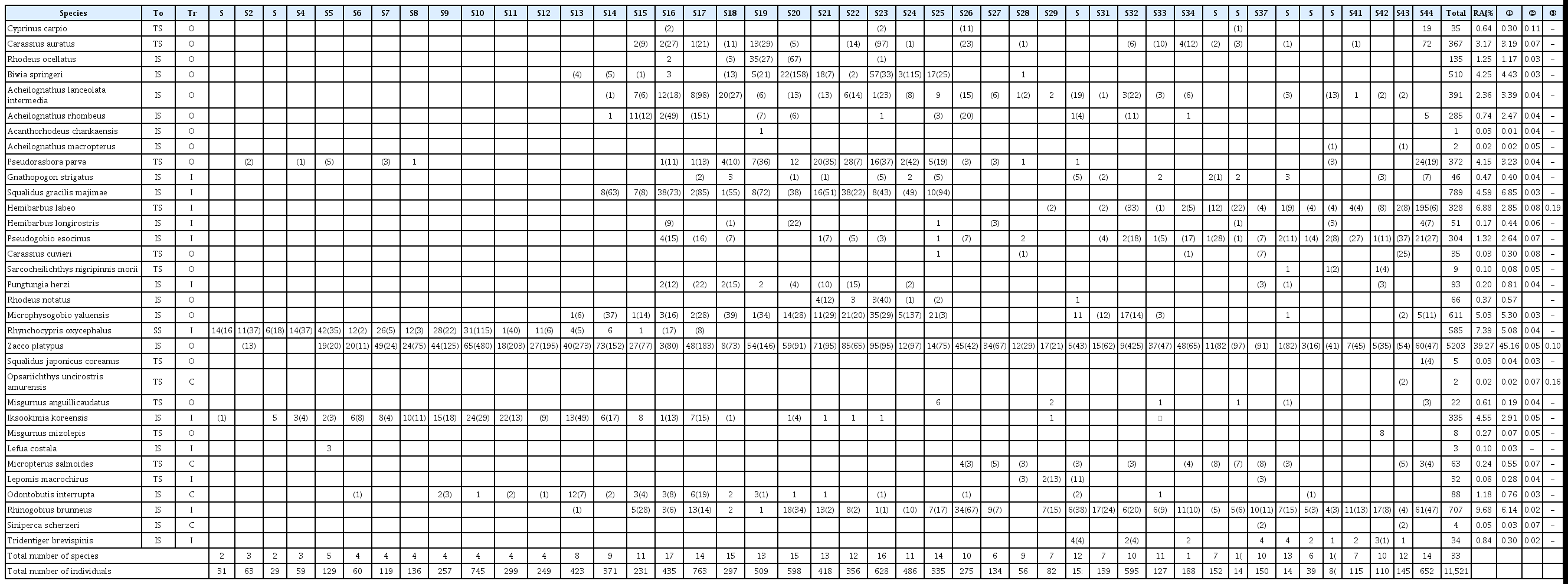
Fish fauna and tolerance guilds, trophic guilds in the sampling sites of Musim Stream (Front number indicate spring sample and parenthesis indicate fall sample).
3.3. 군집분석 및 어류길드 기반의 NMDS분석
계층적 군집분석 결과, 3개의 그룹으로 나누어졌으며, 각각 Group-I (S1~S14), Group-II (S15~S26), Group-III (S27~S44)으로 나눌수 있었다(Fig. 4). 이러한 결과를 바탕으로 Group-I을 Up(Up-stream), Group-II를 Mid(Mid-stream), Group-III를 Down(Down-stream)으로 결정하였다.
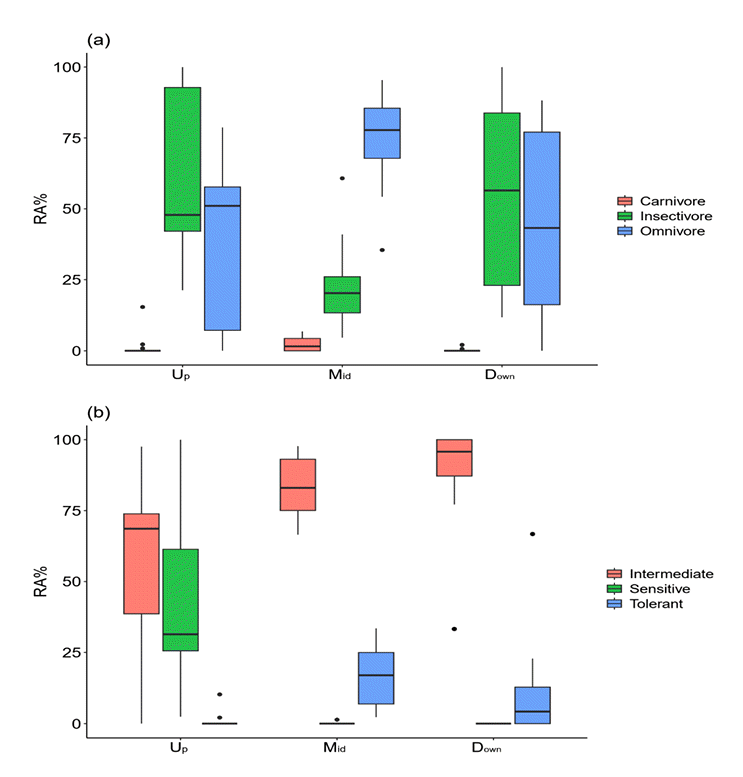
지점별 어종의 생태길드에 따른 상대부도를 이용하여 2차원 NMDS 분석을 실시한 결과 스트레스(stress)함수 값이 각각 0.008, 0.01로 설명력이 높은 것 으로 나타났다(Fig. 5). 어류의 섭식 길드와 지점사이의 유사도를 분석한 결과, 상류 쪽에 위치한 S2, S5 지점과 충식종의 유사도가 높은 것을 알 수 있는데, 이는 상류역의 경우 버들치(Rhynchocypris oxycephalus), 피라미(Zacco platypus), 참종개(Iksookimia koreensis)등 충식종의 출현비율이 높기 때문인 것으로 사료된다(Fig. 5(a)). 어류의 내성도 길드와 지점사이의 유사도를 분석한 결과, S1~S5와 민감종간의 유사성이 높은 것으로 나타나, 계층적 군집분석의 결과와 일치하는 것으로 나타났다(Fig. 5(b)). 이는 상기 지점의 경우 모두 상류역의 특성을 보이는 지점으로 버들치가 우점하기 때문인 것으로 사료되며[20], 최하류 지점(S44)의 경우 내성종(TS)와의 유사도가 높은 것으로 나타났는데, 이는 누치(Hemibarbus labeo), 참붕어(Pseudorasbora parva)등 내성종이 우점하기 때문인 것으로 사료된다[21,22].
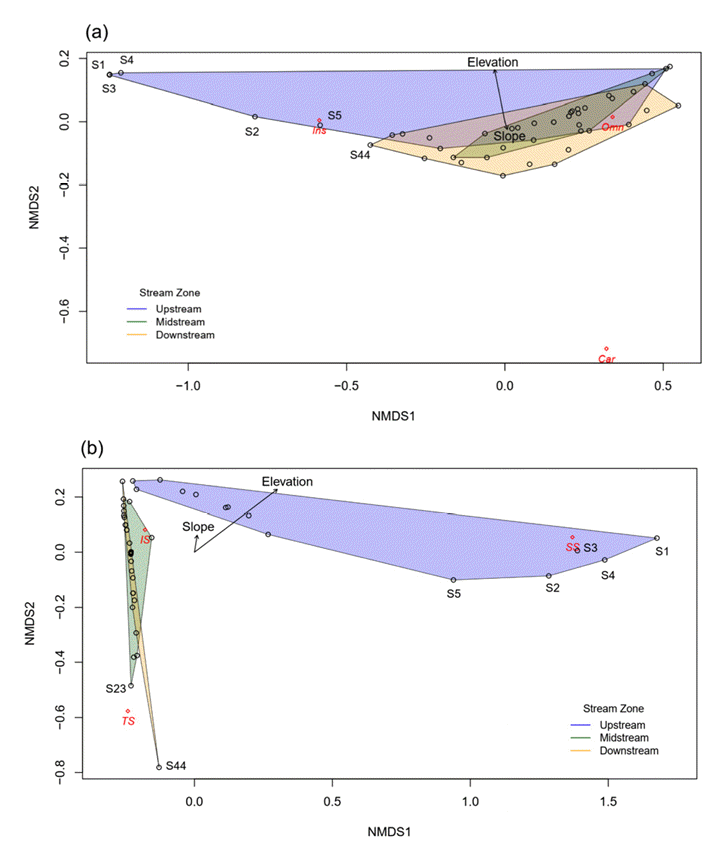
Ordination biplot of non-metric multidimensional scaling (NMDS) based on the fish relative abundance in sampling sites, trophic guilds, tolerant guilds, slope and elevation. Different color convex hull derived from cluster dendrogram in Fig.5. (a) NMDS analysis of fish trophic guilds and their relationships with sampling sites(stress: 0.008). (b) NMDS analysis of fish tolerance guilds and their relationships with Elevation, Slope and sampling sites (stress: 0.01). (SS: Sensitive specises, IS: Intermediate species, TS: Tolerant species, Omn: Omnivore species, Ins: Insectivore species, Car: Carnivore species).
3.4. 어류 생태길드에 기반한 Group 분석
Group-I (Up), Group-II (Mid), Group-III (Down) 세 그룹내 지점간 어종의 섭식 길드에 기반한 상대풍부도를 Box Plot으로 나타낸 결과 상류역을 나타내는 Group-I에서 충식종의 상대풍부도의 평균은 49.2%, 잡식종의 경우 50.1%로 잡식종이 더 많이 출현한 것으로 나타났으나, Group-I에서 지점별 유사성이 높은 S1~S5지점은 따로 구분하여 추가적으로 분석하여 보았을 때, 충식종의 비율이 88.1%로 매우 높은 값을 보였다 (Fig. 6(a)). 이는 최상류 지점의 경우 버들치와 피라미가 우점하며, 내성종 및 잡식종의 경우 거의 출현하지 않았기 때문인 것으로 사료된다(Table 1). 내성도 길드에 기반한 결과 Group-I의 경우 중간종과 민감종이 주로 출현하였으며, Group-II 와 Group-III의 경우 민감종이 출현하지 않고. 중간종과 내성종이 주로 출현한 것으로 나타나 NMDS 결과와 일치하는 것으로 나타났다(Fig. 6(b)).
3.5. 보의 구조물 특성 및 어류 기반의 생태건강도(FAI) 분석
인공구조물의 제원 및 수리학적 특성 의 경우, 보는 수직형(v), 경사형(s), 복합형(c) 3가지 형태로 분류하였으며, 상단수심(Hu), 하단수심(Hd), 낙차(DH), 유속(U) 4가지의 수리학적 특성을 분석하였다. 보의 형태를 조사한 결과 수직형 2개, 경사형 4개, 복합형은 38개로 나타났다(Table 2).
어종이 보를 통과하기 위해서는 어종의 유영능력을 충족하는 유량 및 높이가 형성되어야 하는데[23], 이를 알아보기 위해 보의 수리학적 특성과 어종의 유영능력을 대조하여 봄철과 가을철 수생태계 연속성 평가를 실시하였다. 연속성 평가 결과, 봄철 S15 지점을 제외한 전 지점에서 단절로 평가되어 일부 어종(피라미)을 제외한 대부분의 어종의 구조물 통과가 불가능한 것으로 나타났다. 또한 보의 어떤 수리학적 특성이 어류의 생태건강도와 상관성이 있는지 알아보기 위해, 각 지점별 인공구조물의 특성과 그 상류 지점의 어류평가지수(Fish Assessment Index)와의 상관관계를 분석한 결과 Hu1 (Sp)에서 통계적으로 유의한 양의 상관관계가 나타났다(Table 3). 이를 통해 보 상단수심의 적절한 유량 확보가 어종이 보를 통과할 수 있는 조건이 될 수 있는 것으로 보여 지나, 실제 어종이 보를 통과하여 연속성을 확보하기 위해서는 보의 다른 수리학적 특성(하단수심, 낙차, 유속) 또한 어종이 통과할 수 있는 조건이 되어야 할 것으로 사료된다.
4. 결론
본 연구에서 무심천의 시・공간에 따른 수질의 변화를 분석한 결과, 하천생활환경기준으로 보았을때, Ib(좋음)~ IV(약간나쁨)으로 나타났으며, 가을철의 경우 수질이 가장 양호한 것으로 나타났다. W1 과 W3지점의 경우 W2에 비해 수질이 악화된 것으로 나타났는데, 이는 상류로부터 많은 부유물과 함께 영양염류가 주변 농경지로부터 유입되었기 때문인 것으로 판단되며[24], 반면에 도심지에 위치한 W2 지점의 경우 다른 두 지점에 비해 적은 변화를 보였는데 이는 하천 정비공사로 인해 부유물 및 토사유입이 적기 때문인 것으로 판단된다. 지점별 어류의 상대풍부도에 기반한 군집 분석 결과 3개의 그룹으로 나누어 졌다. 어류생태 길드에 기반한 그룹별 상대풍부도 분석 결과 NMDS결과와 일치하는 것을 보였는데, 이는 Group-I의 경우 버들치가 주로 출현하는 상류 하천의 특징을 보였으며, Group-II 와 Group-III의 경우 주로 하천 중・하류에서 출현하는 돌마자(Microphysogobio yaluensis), 긴몰개, 붕어 등이 주로 우점하였기 때문인 것으로 사료된다. 무심천의 수생태계 연속성을 평가한 결과 봄철 S15를 제외한 전 지점에서 단절된 것으로 평가되어, 하천의 종적연결성의 훼손이 심각한 것으로 나타났다. 인공구조물의 특성과 각 구조물의 상류지점의 FAI와의 상관관계를 분석한 결과 상단수심과의 관계가 유의한 것을 보였다. 하지만 인공구조물의 특성에는 낙차, 하단수심, 유속 등 어종이 구조물을 통과하기 위해서는 여러 조건이 어종의 유영능력에 맞게 형성되어야 하는 만큼, 유량 확보와 어도의 설치 및 개선 등 종적연결성을 확보하기 위한 관리가 필요할 것으로 사료된다. 무심천에서 보의 구조물 개선 및 생태 복원이 이루어질 경우, 종 다양성 증진, 법정보호종의 증가 및 회유성 어종 이동에 도움이 될 것으로 사료된다.
Acknowledgements
본 연구는 환경부의 재원으로 한국환경산업기술원 수생태계 건강성 확보 기술개발사업 (과제번호: 2020003050004) 및 대전녹색환경지원센터(yr. 2022)의 지원을 받아 수행되었습니다. 이에 감사드립니다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing interests or personal relationships that could have appeared to influence the work reported in this paper.