수 환경 속 미세플라스틱의 다양한 오염물질 흡착 거동 및 생태독성
Adsorption Behavior of Microplastics as a Carrier of Various Contaminants and Their Ecotoxicity in Aquatic Environment
Article information
Abstract
목적
미세플라스틱은 다양한 경로를 통해 수 환경으로 유입되어 생물에게 독성을 유발한다. 미세플라스틱의 위험성에 대한 대중의 관심이 증가함에 따라 수 환경 속 미세플라스틱 거동에 관한 연구도 활발히 진행되고 있다. 실제 환경 속 미세플라스틱은 쉽게 분해되지 않고 주변의 다양한 오염물질과 상호작용한다. 오염물질과 상호작용하는 미세플라스틱은 플라스틱 입자 단독보다 생태독성이 더욱 심해질 뿐 아니라 해당 물질을 이동시키는 매개체로 작용할 가능성 또한 제기되고 있다. 본 논문에서는 미세플라스틱이 수 환경 속 다양한 오염물질의 매개체로 작용하는 주요 기작과 그에 따른 생태독성에 대해 알아보고자 하였다.
방법
본 논문에서는 미세플라스틱의 환경오염물질 흡착 거동을 흡착 기작에 따라 구분하였고 미세플라스틱과 오염물질의 동시 노출에 따른 복합생태독성을 2003년 10월부터 2023년 8월 사이의 논문을 참고해 작성하였다.
결과 및 토의
미세플라스틱의 오염물질 흡착은 주로 소수성 상호작용, 정전기적 상호작용, 수소 결합, 반데르발스 힘에 의해 일어난다는 것을 알 수 있었다. 수 환경에 존재하는 오염물질과 미세플라스틱의 동시노출은 생물의 생존율 및 생식능력 저하, 산화 스트레스 유발, 엽록소 양 및 광합성 활성 저하와 오염물질의 생물농축과 같은 생태독성을 유발한다고 알려져 있으나, 일부 연구에서는 독성이 오히려 완화된다고 보고하였다.
결론
본 논문은 미세플라스틱과 오염물질의 상호작용 및 두 물질의 복합적인 생태독성에 대한 기초 정보를 포함하고 있다. 이는 수생 환경 속 미세플라스틱이 오염물질의 매개체로 작용할 가능성 및 향후 나타날 생물학적 위험성을 이해하는데 도움이 될 것으로 기대된다.
Trans Abstract
Objectives
Microplastics are released into the aquatic environment through multiple pathways including runoff, atmospheric sedimentation, aquaculture, and fishing and pose a hazard to organisms. Public concerns regarding microplastics are raising as microplastic pollution increases. A lot of studies have been evaluated the behavior of microplastics in the environment, suggesting that microplastics remain a prolonged period in the environment due to their persistence and can interact with other contaminants. Microplastics as carriers of coexisting contaminants may pose a more severe toxicity to organisms than microplastics alone. In this study, we investigated the behavior of microplastics as carriers of environmental contaminants and introduced a potential ecotoxicity of microplastics carrying other contaminants.
Methods
The behavior of microplastics as carriers of contaminants were classified as adsorption mechanisms. Research literature regarding ecological risk of microplastics carrying contaminants was reviewed in papers published between October 2003 and August 2023.
Results and Discussion
Adsorption of contaminants onto microplastics are mainly involved in hydrophobic interaction, electrostatic interaction, hydrogen bond, and Van der Waals forces. The co-exposure of microplastics with contaminants to organisms can induce oxidative stress and bioaccumulation and reduce the survival and reproduction rates, chlorophyll content, and photosynthetic efficiency. On the other hand, a few studies reported that the co-exposure of microplastics with contaminants can decrease the toxicity to organisms.
Conclusion
This paper provides basic information regarding the adsorption interactions of microplastics with diverse contaminants and their ecological effects on organisms. The contents will help to understand a potential function of microplastics as a carrier of coexisting contaminants in aquatic environment and their biological risk.
1. 서 론
1.1. 미세플라스틱이 수생 환경에 미치는 영향
미세플라스틱은 크기가 5 mm 미만인 플라스틱 입자로 생성 과정에 따라 1차 미세플라스틱과 2차 미세플라스틱으로 정의되며 토양, 대기 및 수 환경 전반에 걸쳐 분포하고 있다[1]. 이 중 수 환경에 가장 많은 미세플라스틱이 존재하는 것으로 알려져 있는데, 우리나라의 진해만에서 측정된 미세플라스틱 농도를 바탕으로 해수면의 미세플라스틱 양을 추정한 결과, 해양에는 단위부피(m3) 당 6000~23,000개의 미세플라스틱이 존재할 것으로 예상되었다[2]. 다양한 경로를 통해 생성된 미세플라스틱은 먹이 사슬을 통해 간접적으로 혹은 직접적으로 인간에게 노출될 수 있기에, 최근 이에 대한 대중의 관심이 증가하는 추세이다.
미세플라스틱은 생물에 다양한 영향을 미치는 것으로 알려져 있는데, 동물의 경우 미세플라스틱 노출 시 산화 스트레스 유발, 장 손상 및 섭식 장애와 행동 패턴 변화가 관찰되었고, 식물은 엽록소의 양 변화, 광합성 효율의 감소가 나타났다[1]. 미세플라스틱에는 품질개량, 안정성 유지 등의 목적으로 가소제, 안정제, 난연제, 산화방지제, 색소 등의 다양한 첨가제가 포함되어 있으며[3,4], 이들은 미세플라스틱이 풍화 및 분해되는 과정에서 주변 환경으로 침출되어 생물에게 암, 돌연변이 및 생식독성을 유발할 가능성이 높다[3,4]. 더불어 미세플라스틱은 생분해가 잘 되지 않는 잔류성 오염물질로 환경에 장기간 지속적으로 존재할 수 있다[5]. 이는 곧 미세플라스틱이 환경에 잔류하는 다양한 오염물질과 상호작용할 수 있음을 시사한다[6]. 수생 환경에 존재하는 미세플라스틱은 다른 오염물질의 이동을 돕는 매개체로 작용할 수 있어 미세플라스틱 입자가 단독으로 존재할 때보다 생물에 더욱 심각한 문제를 일으킬 것으로 생각된다[7,8].
현재 대부분의 연구는 미세플라스틱이 단독으로 존재할 시 나타나는 생태독성에 집중되어 있기에 저자들 또한 미세플라스틱의 자체 독성에 관한 총설을 2022년 8월 대한환경공학회지에 게재하였다. 그러나 실제 환경에서의 미세플라스틱은 여러 오염물질과 상호작용하여 복합적인 생태독성을 나타낼 가능성이 높다. 문헌조사 결과, 미세플라스틱의 자체 독성에 관한 연구는 지속적으로 이루어지고 있으나 미세플라스틱이 매개체로 작용될 때 나타나는 복합적 생태 독성에 관한 연구는 상대적으로 부족한 실정이다. 따라서 본 논문에서는 매개체로써 미세플라스틱의 다양한 오염 물질과의 상호작용과 그에 따른 복합 생태독성에 대해 논하고자 한다.
2. 본 론
2.1. 매개체로써 미세플라스틱의 환경오염물질 흡착 거동
2.1.1. 미세플라스틱과 오염물질의 상호작용
환경에 존재하는 오염물질에는 소수성 유기화합물, 중금속, 항생제, 독소 및 병원균 등이 있으며 이들은 수생 환경에 유입된 미세플라스틱과 상호작용할 수 있다(Fig. 1). 이러한 환경 오염물질은 소수성 상호작용, 정전기적 상호작용, 수소 결합 및 반데르발스 힘 등을 통해 미세플라스틱 표면에 흡착되는 것으로 알려져 있다[9-12]. 본문에서는 흡착 기작에 따른 미세플라스틱과 오염물질의 상호작용에 대해 알아보고자 한다.
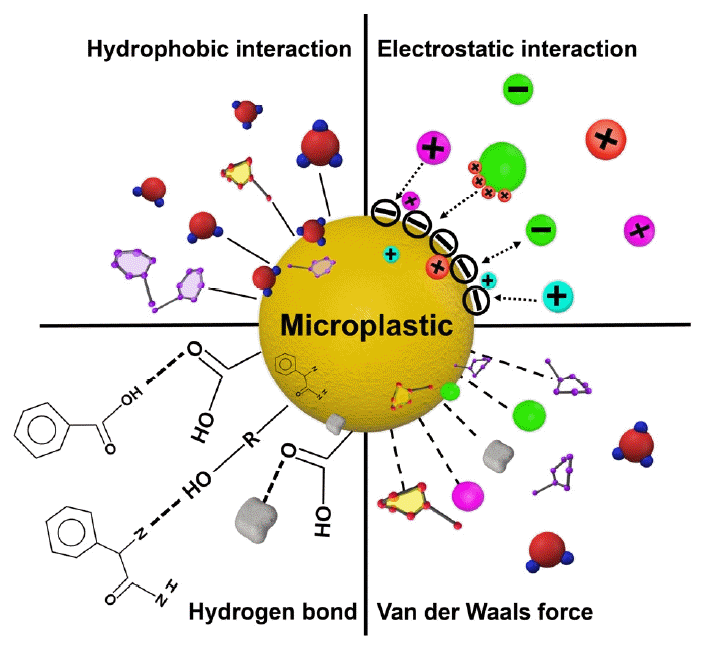
Schematics of microplastics as a carrier of environmental contaminants and their adsorption mechanisms.
2.1.1.1. 소수성 상호작용
소수성 상호작용은 수성 용매에서 비극성 분자가 비극성 물질의 표면에 응집하는 현상으로 소수성 물질 사이에서 발생한다(Tabel 1) [12]. 수생 환경에서 흔히 발견되는 소수성 미세플라스틱으로는 폴리스타이렌(Polystyrene, PS), 폴리에틸렌(Polyethylene, PE), 폴리에틸렌 테레프탈레이트(Polyethylene terephthalate, PET), 폴리염화비닐(Polyvinyl chloride, PVC) 등이 있으며 비극성을 띠는 오염물질의 경우 소수성 상호작용을 통해 미세플라스틱 표면에 흡착될 수 있다[10,12]. 물질의 소수성과 친수성은 옥탄올-물 분배계수인 LogKow (Octanol-water partition coefficient, LogKow) 값에 따라 구분될 수 있는 데[13], 일반적으로 LogKow 값이 높을수록 소수성이 강하기 때문에 LogKow 값이 높은 오염물질은 소수성 미세플라스틱 표면에 더욱 쉽게 흡착될 수 있다[10]. 한 예로, 비스페놀 A와 4가지 유사체(Analogue) 비스페놀 S, F, B, A F의 LogKow 값은 각각 3.32, 1.62, 2.92, 4.13, 4.47로 모두 폴리염화비닐 미세플라스틱에 흡착되었고, 흡착율은 비스페놀 AF(70.82%), B(68.12%), A(60.02%), F(45.12%), S(43.55%) 순으로 소수성이 강한 비스페놀 AF가 폴리염화비닐 미세플라스틱에 가장 잘 흡착되었다[14]. 또한 살균제인 헥사코나졸(Hexaconazole, HEX), 마이클로뷰타닐(Myclobutanil, MYC) 및 트라이아다이메놀(Triadimenol, TRI)의 LogKow 값은 각각 4.01, 3.58, 2.91로 이들 물질을 폴리스타이렌 미세플라스틱과 반응시켰을때 41.56 μg/g (HEX), 18.94 μg/g (MYC), 10.48 μg/g (TRI)의 흡착량을 보였으며, 흡착량은 각 물질의 LogKow 값과 양의 상관관계를 가짐을 알 수 있다[15].
2.1.1.2. 정전기적 상호작용
정전기적 상호작용(Electrostatic interaction)은 인접한 거리에 있는 전하를 갖는 분자들 사이에 발생하는 인력 또는 반발력으로 발생하며, 전하를 띠는 오염물질은 미세플라스틱의 극성 또는 전하를 띤 부분과 정전기적 상호작용을 통해 흡착될 수 있다(Table 2) [9,16]. Zou et al. (2020)은 염소화 폴리에틸렌의 표면에 납(Lead, Pb2+)이 흡착됨을 확인하였는데, 납의 염소화 폴리에틸렌 미세플라스틱 흡착은 정전기적 상호작용에 의해 조절되었다[16]. 용액 속 pH가 증가할수록 염소화 폴리에틸렌 표면의 작용기들이 탈양성자화되면서 표면의 전기음성도가 높아졌는데, 이로 인해 염소화 폴리에틸렌의 Pb2+ 흡착량이 증가하였다[16]. 설포나마이드계(Sulfonamide) 항생제 또한 pH에 따라 극성 정도가 변하면서 정전기적 상호작용에 의해 미세플라스틱에 흡착되는 것이 보고되었는데, Guo et al. (2019)에 따르면 폴리아마이드(Polyamide, PA) 미세플라스틱의 설파메타진(Sulfamethazine, SMT) 흡착은 알칼리성 조건(pH 8-9) 보다 산성 조건(pH 3-6.7)에서 높게 나타났다[17]. SMT는 2개의 pKa 값(pKa1 = 2.28, pKa2 = 7.42)을 가지는데, 주로 pH 3-6.7 범위 내에서 중성 형태로 존재하며 pH 8-9 범위 내에서는 음이온으로 변환된다[17]. 이에 반해 폴리아마이드 미세플라스틱은 pH가 증가할수록 표면 전기음성도가 커진다. 따라서 알칼리성 환경에서 SMT와 폴리아마이드 간 정전기적 반발력이 증가하게 되고, 이는 SMT의 흡착 감소로 이어졌다[17].
2.1.1.3. 수소 결합
수소 결합이란 전기 음성도가 큰 산소(O), 질소(N), 플루오린(F) 등의 원자와 공유 결합하고 있는 수소가 다른 전기 음성도가 큰 원자와 상호작용으로 발생하는 인력을 말한다. 이러한 수소 결합 또한 오염물질의 미세플라스틱 흡착에 관여하는 기작으로 알려져 있는데, Liu et al. (2019)의 연구에 따르면 폴리스타이렌의 퀴놀론계(Quinolone) 항생제인 시프로플록사신(Ciprofloxacin, CIP) 흡착은 수소 결합에 의해 발생하는 것으로 나타났다(Table 3) [11]. CIP 흡착 전과 후에 폴리스타이렌 미세플라스틱을 퓨리에 변환 적외선 분광법(Fourier-transform infrared spectroscopy, FT-IR)으로 분석한 결과, CIP 흡착 후 폴리스타이렌 미세플라스틱은 3500 cm-1 부근에서 신규의 피크가 발견되었다[11]. 이는 두 물질 사이의 하이드록실기(-OH) 또는 카복실기(C(=O)OH)에 수소 결합이 형성되었음을 의미하고, 수소 결합이 폴리스타이렌 미세플라스틱의 CIP 흡착에 관여하고 있음을 시사한다[11]. 그밖에, 비스페놀 A도 양친매성(Amphiphilic) 폴리머인 폴리프로필렌(Polypropylene, PP)에 수소 결합을 통해 흡착되었는데[18], 폴리프로필렌을 비스페놀 A 흡착 전・후 FT-IR로 분석한 결과 3412 cm-1(N–H, O–H)의 피크가 흡착 후 3360 cm-1로 이동한 것이 확인되었고[18], 이는 비스페놀 A의 하이드록실기와 폴리프로필렌의 아미노기 사이의 수소 결합이 흡착에 관여함을 시사한다[18].
2.1.1.4. 반데르발스 힘(Van der Waals forces)
반데르발스 힘은 분자들 사이의 공유결합 또는 이온결합을 수반하지 않는 약한 비특이적 상호작용으로[10], 전기적으로 중성인 분자 사이의 극히 근거리에서만 작용하는 약한 인력을 의미하며 일반적으로 지방족 중합체 사이에서 형성된다. 따라서 표면에 특정한 작용기가 없는 폴리에틸렌, 폴리프로필렌과 같은 비극성 지방족 중합체는 반데르발스 힘에 의해 다양한 오염물질과 상호작용할 수 있다(Table 3) [12]. 현재 반데르발스 힘을 알아보기 위해 FT-IR이 널리 사용되고 있으며 새로운 적외선 흡수 피크가 없거나 파수(Wavenumber)의 이동이 분명하지 않을 경우 반데르발스 상호작용에 의한 흡착으로 간주한다[12]. Chen et al. (2021)에 따르면 테트라사이클린계 항생제인 테트라사이클린(Tetracylcline hydrochloride, TC), 옥시테트라사이클린(Oxytetracycline hydrochloride, OTC) 및 클로르테트라사이클린(Chlortetracycline hydrochloride, CTC)을 지방족 중합체인 폴리에틸렌 미세플라스틱에 흡착시켰을 때, 흡착량이 각각 53.32 μg/g (TC), 64.4 μg/g (OTC), 63.36 μg/g (CTC) 이었다[19]. 그러나 FT-IR 분석 결과 각 항생제가 흡착된 폴리에틸렌 미세플라스틱에서는 새로운 피크가 나타나지 않았고[19], 이는 흡착과정에서 공유결합이 형성되지 않았다는 것을 시사하며 앞서 설명한 바와 같이 반데르발스 힘에 의해 흡착이 진행되었음을 의미한다[19]. 또한 전세계적으로 사용되는 카바메이트계(Carbamates) 살충제인 카보퓨란(Carbofuran, CBF)과 카벤다짐(Carbendazim, CBD)을 폴리에틸렌, 폴리프로필렌 미세플라스틱과 반응시킨 결과, 살충제가 흡착된 두 종류의 미세플라스틱 모두 새로운 적외선 흡수 피크가 관찰되지 않아 분자간 상호작용인 반데르발스 힘이 주요 흡착 기작으로 작용했을 것으로 생각된다[20].
이외에도 미세플라스틱과 오염물질의 상호작용에 영향을 주는 요인으로는 미세플라스틱 입자 크기, 비표면적, 노화도(Aging degree), 결정도 등이 있으며 오염물질 각각의 특성과 pH, 온도, 이온강도의 변화 또한 포함된다[10]. 더불어 미세플라스틱과 오염물질 사이의 흡착에는 둘 이상의 상호작용이 복합적으로 관여할 수 있다.
2.2. 미세플라스틱과 오염물질 상호작용에 따른 생태독성
미세플라스틱과 오염물질은 수생 환경에 장기간 잔류하며 상호작용할 수 있기에 본문에서는 두 물질이 수 환경에 공존할 시 나타날 수 있는 생태독성에 대해 알아보았다.
2.2.1. 오염물질별 생태독성
2.2.1.1. 소수성 유기화합물
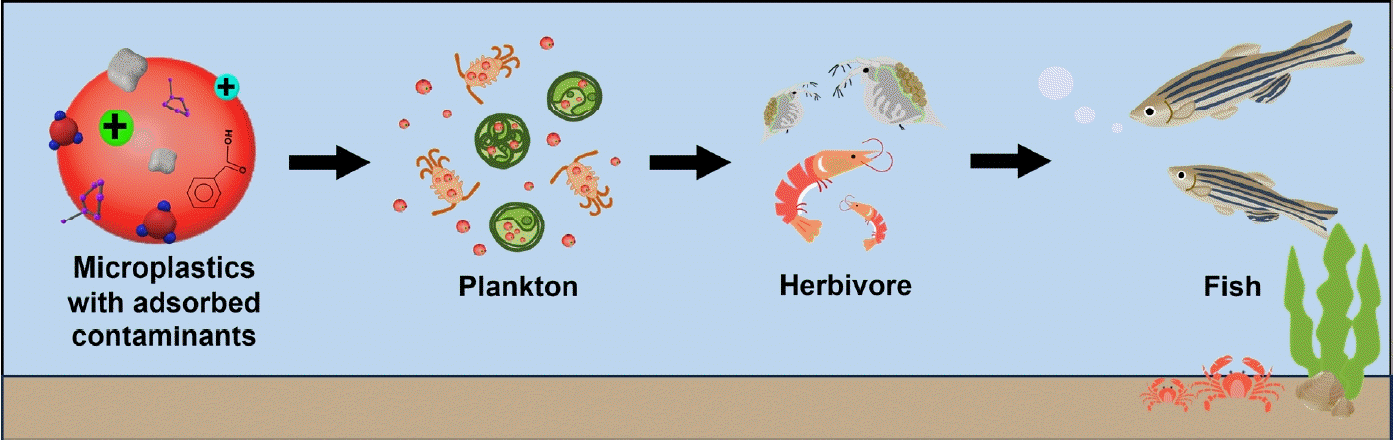
소수성 유기화합물은 생물학적, 화학적 분해에 저항성을 가지며 물에 잘 녹지 않기에 환경에 지속적으로 존재하며 미세플라스틱과 상호작용을 통해 생물축적 및 독성을 나타낼 수 있다(Table 4) [21,22]. 실제로 다양한 미세플라스틱과 소수성 유기화합물을 대상으로 실험한 결과, 전반적으로 수생 동물의 생존율과 생식능력이 저하되었으며 오염물질의 생물농축(Bioaccumulation)이 증가하였다(Fig. 2) [23-25]. 또한 산화 스트레스가 유발되는 등 독성이 증가하였고, 광합성 생물의 경우 엽록소 양과 광합성 활성에도 영향을 미쳤다[23-26]. 그러나 생물 및 오염물질의 종류에 따라 생태독성이 완화되는 결과도 일부 보고되었고[25,26], 동일한 오염물질이라도 고농도에서는 독성이 강화되었지만 저농도에서는 오히려 완화되는 사례도 관찰되었다[25].
농약의 일종인 클로피리포스(Chlorpyrifos, CPF)가 흡착된 폴리에틸렌을 0.1, 1, 10 μg/L 농도로 요각류인 아카르디아 톤사(Acartia tonsa)에 노출시켰을 때 대조군(아무것도 처리하지 않은 조건)에 비해 생존율이 각각 47, 86, 100% 감소하였으며 1, 10 μg/L에서는 아카르디아 톤사의 먹이 섭취가 관찰되지 않았다[24]. 1 μ g/L 노출 조건에서 아카르디아 톤사의 산란수는 대조군 대비 94% 감소하였고 가장 높은 농도인 10 μg/L에서는 알 부화도 영향을 받았다[24]. 단일 폴리에틸렌 단독 노출의 경우 아카르디아 톤사에 유의미한 독성 영향이 관찰되지 않은 반면, CPF가 흡착된 폴리에틸렌을 노출시켰을때 CPF 단독 노출에 비해 1.5-5배 높은 독성을 보였다[24]. 그 밖에, 미세 조류인 Chaetoceros muelleri에 벤조에이피렌(Benzo[a]pyrene, BaP)과 폴리스타이렌, 폴리에틸렌 미세플라스틱을 혼합 처리하였을때[25], 150 μg/L BaP에서의 저해율은 55.18%(PS+BaP)와 52.66%(PE+BaP)으로, 미세플라스틱(PS 1.26%, PE 4.36%)과 BaP(40.34%)의 단독 노출 조건에 비해 높은 저해율을 보였다[25]. BaP가 고농도로 존재하는 조건에서는 독성이 강해졌으나 저농도인 10 μg/L BaP에서는 독성이 오히려 완화되는 효과가 나타났으며 이를 통해 미세플라스틱과 BaP의 상호작용은 BaP의 농도와 밀접하게 연관되어 있음을 확인할 수 있다[25].
2.2.1.2. 중금속
중금속은 금속 제련, 살충제 사용 및 화석 연료 연소 등 인간 활동에 의해 방출되어 빗물과 함께 수생 환경으로 흘러 들어간다[27]. 이처럼 다양한 경로를 통해 유입된 중금속은 분해되지 않고 장기간 존재하며 미세플라스틱과 상호작용할 수 있다. 제브라피쉬와 물벼룩은 미세플라스틱과 중금속이 공존하는 조건에서 산화 스트레스와 염증이 유발되었고, 오염물질 생물축적과 같은 독성이 공통적으로 관찰되었다(Table 5) [28-30]. 번식, 생존, 체장(Body length), 영양수준 등에 영향을 미치는 만성독성도 확인되었고[30] 광합성 생물의 경우, 엽록소 양과 광합성 속도가 감소하는 결과가 나타났으나, 저농도의 중금속에서는 독성이 완화되는 결과도 일부 관찰되었다[31,32].
Lu et al. (2018)에 따르면 제브라피쉬(Danio rerio)에 폴리스타이렌 미세플라스틱과 카드뮴(Cadmium, Cd)을 함께 노출시켰을 때 제브라피쉬에 산화 스트레스와 염증이 유발되었고[29], Cd 단독 노출 조건에 비해 제브라피쉬의 간, 장, 아가미 조직에 Cd이 더 많이 축적되었다[29]. 또한 항산화제인 글루타티온(Glutathione, GSH)과 항산화효소인 슈퍼옥시드 디스무타아제(Superoxide dismutase, SOD)의 양이 유의하게 감소했으며, 항산화 방어 시스템 조절에 관여하는 nfe212, sod1, sod2 유전자 발현이 억제되었다[29]. 제브라피쉬 체내에서 중금속 독성 보호 물질인 메탈로싸이오닌(Metallothionein, MT)의 양과 중금속 해독과 관련된 mt1, mt2 유전자 발현이 유의하게 증가했다[29]. 폴리스타이렌 미세플라스틱과 Cd 동시 노출이 제브라피쉬 체내의 항산화 방어 시스템 불균형을 초래하였고 이로 인해 산화 스트레스가 유발된 것으로 보인다[29]. 녹조류인 Chlamydomonas reinhardtii에 폴리스타이렌 미세플라스틱과 비소(Arsenic, As(III)) 150 mg/L 농도를 혼합처리 했을 때 녹조의 성장률과 광합성 속도가 대조군에 비해 유의하게 감소했고, 항산화효소인 글루타티온 S-전달효소(Glutathione S-transferase, GST), SOD, 카탈레이스(Catalase, CAT)의 활성 또한 감소했음을 확인했다[31]. 이러한 항산화효소의 활성저하로 인해 세포 내 활성산소종이 축적되면서 산화 스트레스가 유발된 것으로 보인다[31]. 하지만 150 mg/L 미만의 As(III) 농도에서는 항산화효소 활성이 오히려 증가하였는데, 미세플라스틱과 동시에 노출시킨 중금속 농도에 따라 생태독성 정도가 달라질 수 있음이 확인되었다[31].
2.2.1.3. 항생제
항생제는 인간의 건강과 가축 사육에 중요한 역할을 하는 물질로 분뇨, 병원 폐수, 하수처리장, 농업 유출수 등을 통해 수생 환경으로 유입된다[33]. 항생제의 과도한 사용과 잘못된 관리로 인한 지속적인 유입은 환경에 잔류하는 미세플라스틱과 공존하면서 생물에게 영향을 미치는 것으로 알려져 있다[33]. 미세플라스틱과 항생제를 동시 노출시켰을 때 수생 동물 독성을 조사한 결과, 산화 스트레스 유발, 신경독성 등의 독성영향과 항생제 생물농축이 관찰되었고, 광합성 생물의 경우 건조 중량과 엽록소 양이 감소되었다(Table 6) [34-37]. 그러나 일부 연구에서는 생물 독성이 오히려 완화되었다고 보고하였다[36,38].
빨간 틸라피아(Oreochromis niloticus)에 마크롤라이드계(Macrolide) 항생제 록시스로마이신(Roxithromycin, ROX)과 폴리스타이렌 미세플라스틱을 혼합 노출시켰을때, 기형이나 사망과 같은 급성독성은 나타나지 않았으나 내장, 아가미, 뇌 및 간에서 미세플라스틱과 ROX의 축적이 관찰되었다[36]. ROX는 아세틸콜린을 콜린신경계에 축적시켜 신경독성을 유발하는 것으로 알려져 있는데 빨간 틸라피아 뇌 속 아세틸콜린 에스테라아제(Acetylcholine esterase, AChE)는 아세틸콜린을 분해하여 뇌 축적을 감소시키는 역할을 한다[36]. ROX 단독 조건에 비해 ROX와 미세플라스틱 혼합 처리 조건에서 아세틸콜린 에스테라아제의 활성이 유의미하게 증가하였고 이는 틸라피아 뇌의 아세틸콜린 축적을 감소시켜 독성이 완화되는 결과로 이어졌다[36]. 그밖에 혼합 처리 조건에서 항산화효소인 SOD의 활성은 증가했으며 활성산소량을 의미하는 말론디알데하이드(Malondialdehyde, Malondialdehyde)는 감소하였다[36]. 단독조건에 비해 두 물질이 공존하였을때 빨간 틸라피아의 항산화효소 시스템이 유도되었고, 결과적으로 산화적 손상이 완화되었다[36]. 마크롤라이드계(Macrolide) 항생제 아지트로마이신(Azithromycin, AZI)과 클라리트로마이신(Clarithromycin, CLA)을 각각 0.00270, 0.00487 mg/g 농도로 흡착시킨 폴리스타이렌 미세플라스틱을 남세균인 Anabaena sp.에 노출시킨 결과[34], 폴리스타이렌 단독 조건에 비해 건조중량과 엽록소 a의 양이 유의미하게 감소하였다[34]. 위 결과는 미세플라스틱과 항생제가 흡착된 형태로 노출될 시 Anabaena sp.의 성장이 억제될 수 있음을 보여준다[34].
2.2.1.4. 기타 오염물질
앞서 언급한 오염물질 외에도 독소 및 병원균과 같은 오염물질 또한 미세플라스틱과 상호작용하여 독성을 나타낼 가능성이 제기되고 있다. 남세균 독소인 마이크로시스틴(Microcystin-LR, MC-LR)과 미세플라스틱을 동시에 제브라피쉬에 노출시켰을때, 생물축적 및 생식 내분비장애, 유생 발달 저해와 같은 독성이 공통적으로 나타났다(Table 6) [39,40]. 제브라피쉬에 폴리스타이렌 미세플라스틱과 MC-LR을 혼합 처리하였을때, MC-LR 단독 처리 조건에 비해 제브라피쉬의 생식선에 MC-LR이 더 많이 축적되고 혈장 내 E2 호르몬과 T 호르몬의 양이 유의하게 증가했으며 생식선에서 심각한 조직 병리학적 손상이 관찰되었다[39]. 폴리스타이렌이 MC-LR 독소와 상호작용하여 제브라피쉬의 성 호르몬 불균형을 초래하여 생식 내분비 장애를 유발한 것으로 추측된다[39]. Zuo et al. (2021)은 MC-LR과 폴리스타이렌이 함께 존재하는 환경에서 제브라피쉬의 유생 발달이 저해되었다고 보고하였는데, MC-LR과 폴리스타이렌을 혼합처리 했을 때 유생의 부화율과 체장이 MC-LR 단독 노출 조건보다 감소했으며 사망률은 증가하는 결과가 나타났다[40].
항생제 내성 유전자는 수평적 유전자 이동(Horizontal gene transfer, Horizontal gene transfer)을 통해 미생물 간 이동하게 되는데, 미세플라스틱은 항생제 내성 유전자가 주변환경으로 퍼져 나가도록 매개체로 작용하여 유전적 오염(Genetic pollution)을 유발하기도 한다[41]. 이는 새로운 항생제 내성 미생물의 창궐 및 확산을 초래하게 된다. 중국 푸젠 성(Fujian Province) 수산양식장에 존재하는 항생제 내성 유전자(tetB, tetG, tetX, sul1, sul2, ermF, ermT, qnrA, qnrB, qnrS)를 정량 분석한 결과, 양식수에서 발견된 내성 유전자는 3.24 × 105-7.83 × 105 copies/mL인 반면 양식장 내 미세플라스틱에 흡착된 내성 유전자는 1.59 × 109-1.83 × 109 copies/g이었다[42]. 이는 수생 환경에 존재하는 미세플라스틱이 항생제 내성 유전자의 주요한 저장소로 작용될 수 있음을 시사한다[42]. 또한 항생제 내성 유전자가 흡착된 미세플라스틱은 먹이 사슬을 통해 이동하면서 최종적으로 인간에까지 도달할 수 있기에 체내 항생제 내성 유전자 축적으로 인한 건강의 위협 가능성이 제기되고 있다(Fig. 3) [41].
본 논문에서는 수 환경 속 다양한 오염물질과 미세플라스틱이 공존할 시 생물에게 유해한 영향을 끼칠 가능성이 있음을 확인하였으며, 공통적으로 생물의 산화 스트레스 유발, 성장과 생식 저해, 광합성 활성 저해, 오염물질의 생물농축 등의 생태독성이 관찰되었다. 일부 연구에서는 오염물질 단독 조건 대비 미세플라스틱과의 공존 조건에서 독성이 감소하는 경향을 보였는데, 이는 오염물질의 생물이용성과 관련이 있는 것으로 생각된다. Sleight et al. (2017)은 phenanthrene과 17α -ethinylestradiol이 미세플라스틱에 흡착되었을 때 생물이용성이 각각 33, 48% 감소하는 것을 확인하였다[43]. 오염물질이 미세플라스틱에 흡착되면 오염물질이 단독으로 존재할 때보다 생물이용성이 낮아져 생물에게 노출되는 농도가 감소할 것으로 추측되고 이는 결국 독성 저감의 효과로 이어질 것으로 보인다. 하지만 현재 이를 뒷받침할 결과가 부족한 상황으로, 향후 미세플라스틱에 흡착된 오염물질의 생물이용성에 관한 연구가 활발히 진행될 필요가 있다.
2.3. 오염물질이 흡착된 미세플라스틱 처리
오염물질은 미세플라스틱과 공존하며 다양한 상호작용을 통해 미세플라스틱 표면에 흡착되는데, 현재 이러한 흡착 거동을 고려한 오염물질의 처리 방법은 거의 알려진 바가 없으며, 일반적인 수처리 기술을 통해 제거될 것으로 생각된다. 미세플라스틱은 기존의 하수처리공법인 여과, 침전, 생물반응기, 응집 등을 통해 제거되고, 3차처리까지 진행한 경우 평균 94%의 미세플라스틱이 하수처리공정을 통해 제거된다고 알려져 있다[44]. Murphy et al. (2016)은 하수처리공정을 통해 폐수 속 미세플라스틱의 98.41%가 제거되지만 처리수의 양을 고려하였을 때 매일 6,500 만개의 미세플라스틱이 방류되고 있음을 보고하였다[45]. 또한 1 μm 이하 크기의 미세플라스틱의 경우, 기존의 하수처리공정을 통해 잘 제거되지 않는다는 한계를 가지고 있어 수생 환경에 잔존할 가능성이 높아 이를 처리하기 위한 연구가 활발히 진행 중에 있다[46-51]. 오염물질이 흡착된 미세플라스틱의 경우 표면의 물리화학적 특성이 달라져 흡착 제거 효율 및 특성 등이 달라질 수 있기에, 흡착 특성 등을 고려한 신규의 제거방안을 고안할 필요가 있다.
3. 결 론
미세플라스틱은 환경에 잔류하는 오염물질과 상호작용하여 오염물질의 이동 매개체로써 작용할 수 있다. 이는 국지적으로 발생한 오염물질이 전지구적으로 확산될 수 있음을 의미하며, 오염물질 처리의 어려움 뿐 아니라 생태계에 미치는 영향 또한 가중될 것으로 예상된다. 잔류하는 오염물질은 소수성 상호작용, 정전기적 상호작용. 수소결합, 반데르발스 힘 등을 통해 미세플라스틱 표면에 흡착된다. 오염물질이 흡착된 미세플라스틱은 생물의 성장 저해, 산화 스트레스 유발 등 부정적인 결과를 초래한다고 알려져 있으나, 일부에서는 미세플라스틱이 오염물질의 생물이용성(Bioavailability) 등을 감소시켜 생태독성이 오히려 저하되는 긍정적인 결과도 보고되고 있다. 대부분의 연구는 동물을 대상으로 진행되었으며 식물과 미생물에 미치는 영향을 조사한 연구는 상대적으로 부족하다. 현재까지 진행된 연구의 대부분은 중금속, 소수성 유기화합물 및 항생제를 대상으로 주로 이루어져왔는데, 환경에 존재하는 오염물질의 다양성을 고려한다면 연구 대상 오염물질의 확장과 복합적인 생태독성에 관한 연구가 필요할 것으로 보인다. 본 논문에서는 미세플라스틱과 오염물질의 상호작용 기작과 그에 따른 생태독성 연구동향을 살펴보았고, 이는 여러 오염 물질이 공존하는 실제 환경에서 미세플라스틱의 매개체로써 역할과 거동을 이해하는데 도움을 줄 것으로 기대된다.
Acknowledgements
이 과제는 부산대학교 기본연구지원사업(2년)에 의하여 연구되었음.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing interests or personal relationships that could have appeared to influence the work reported in this paper.