규산마그네슘 복합화를 통한 할로이사이트 기반 튜브형 담체의 메틸렌 블루 및 중금속 흡착능 향상 연구
Halloysite-Magnesium Silicate Composites as Adsorbent for Removal of Methylene Blue and Heavy Metals from Aqueous Solution
Article information
Abstract
목적
본 연구는 향상된 메틸렌 블루 및 중금속 이온 제거 흡착능을 지닌 규산마그네슘-할로이사이트 복합 담체 제조를 위해 소재 및 담체의 열적 안정성 및 흡착 거동을 평가하였다. 규산마그네슘-할로이사이트 복합 담체를 제조하여 수용액으로부터 메틸렌 블루 및 중금속 이온 제거를 위한 흡착제로 활용하기 위해 소재의 열적 안정성 및 흡착능을 평가하였다.
방법
메틸렌블루 및 중금속에 대해 높은 흡착능을 지닌 할로이사이트/규산마그네슘 관형 복합 담체가 압출 및 소성 공정을 통해 제조되었다. 미세구조 및 흡착 평형 분석을 통해 할로이사이트 및 규산마그네슘의 열적 안정성을 평가하였으며, 결과를 통해 관형 담체의 소성 온도를 결정하였다.
결과 및 토의
규산마그네슘은 750℃ 소성 시 결정화가 진행되었으며, 비표면적은 소성 온도가 증가함에 따라 저감되었다. 저감된 규산마그네슘의 흡착능은 500℃ 소성까지는 유의미한 변화가 없었으나, 600℃, 700℃ 및 750℃ 열처리 시 각각 6.9%P, 27.3%P, 및 91.2%P 감소되었다. 열처리와 무관하게, 할로이사이트 및 규산마그네슘의 등온 흡착 데이터는 Langmuir 등온흡착식에 가장 잘 맞았다. 600℃소성된 할로이사이트-30 wt% 규산마그네슘 복합 관형 담체는 115m2g-1의 높은 비표면적 및 43.5%의 기공율을 나타내었으며, 168시간 메틸렌블루 흡착능이 29.8 mg g-1을 나타내었다. 이는 할로이사이트 관형 담체 대비 3배 이상 증가한 값이며, Cr(III), Cu(II), 및 Zn(II)의 흡착능도 모두 4.8배 이상 향상되었다.
결론
미세구조 및 흡착능의 관점에서 흡착제로서의 규산마그네슘의 열적 안정성이 평가되었다. 600℃열처리 후에도 규산마그네슘은 할로이사이트 대비 높은 비표면적 및 흡착능을 보여주었으며, 흡착은 Langmuir 거동을 보였다. 할로이사이트 담체의 규산마그네슘 복합화를 통해 메틸렌 블루 및 Cr(III), Cu(II), and Zn(II)흡착능이 대폭 향상되었다.
Trans Abstract
Objectives
The thermal stability of halloysite and magnesium silicate is discussed in terms of microstructural change and adsorption behavior to optimize their composite as an absorbent for methylene blue (MB) and heavy metal ions removal from an aqueous solution.
Methods
Halloysite-magnesium silicate tubular composites with high adsorption capacity of methylene blue and heavy metal ions were prepared with extrusion and consequent firing. To define the firing temperature of the tubular media, the microstructure and the adsorption equilibrium characterized the thermal stability of halloysite and magnesium silicate
Results and Discussion
The magnesium silicate used in this study shows broad peaks in x-ray diffraction; however, the treatment of 750℃ induces its crystallization. The specific surface area of the magnesium silicate is also gradually decreased along with the firing temperature increase. No significant degradation in methylene blue adsorption capacity for magnesium silicate is observed until 500℃-treatment. However, the higher firing temperature reduces the capacity: 6.9%P, 27.3%P, and 91.2%P decrease for 600℃, 700℃, and 750℃, respectively. Regardless of heat treatment, the Langmuir isotherm equation represents the adsorption equilibria well compared to the Freundlich model. The tubular media of the halloysite – 30 wt% of magnesium silicate fired at 600℃ exhibits a high specific surface area of 115 m2 g-1 and a relative porosity of 43.5%. Compared to the halloysite-only tubular media, the adsorption capacity of the composites is significantly improved with the incorporation of magnesium silicate. The adsorption capacity of 168h for methylene blue is more than tripled, 29.8 mg g-1, and the adsorption capacity of Cr(III), Cu(II), and Zn(II) is also greatly enhanced by more than 4.8 times.
Conclusion
The thermal stability of magnesium silicate is investigated for use as an additive adsorbent in terms of the microstructure and the adsorption capacity. Even at 600℃ of the firing temperature, magnesium silicate shows a higher specific surface area and higher adsorption capacity of MB compared to those of the halloysite; the adsorption fits well into Langmuir behavior. The addition of magnesium silicate into the halloysite media significantly enhances its adsorption capacity for MB and heavy metal ions such as Cr(III), Cu(II), and Zn(II).
1. 서 론
할로이사이트(Al2Si2O5(OH)4・nH2O)는 연간 생산량이 수천 톤을 초과하는 규산알루미늄계 점토 세라믹 물질 중 하나로, 카올리나이트와 화학적으로 유사하나, 실록세인(Si-O) 사면체-알루미놀(Al-O) 팔면체가 산소 원자를 공유하며 1:1로 불일치 결합된 단위층들이 결정수로 인해 분리된 다층벽 나노 튜브 형상의 미세구조를 갖는다[1-3]. 이로 인해 타 점토 소재 대비 높은 비표면적(약 22-81m2 g-1)을 구현할 수 있으며, 결정 내층 및 외층이 부분적으로 대전되어 수처리용 흡착 소재로 연구되어왔다[2,4,5]. 수화된 할로이사이트는 산화층 사이에 존재하는 결정수층을 따라 결정면의 슬립이 용이, 활성탄 등의 비점토 소재 대비 성형성이 우수하며 상대적으로 높은 열적 구조 안정성을 보유하기에 담체(adsorption media)화에 유리하다. 담체를 활용한 수처리 공정은 슬러지 발생 및 이로 인한 관막음 현상을 완화할 수 있어 폐수 처리 비용의 저감이 가능하다[2,4-9].
할로이사이트의 염료 및 중금속 흡착능 향상을 위해 산처리 등 pH 제어를 통한 표면 개질[2,10-13], 수열합성을 통한 카본층 및 작용기의 형성4), 환원 열처리를 통한 제타포텐셜 증가[14,15] 등의 다양한 연구가 시도되어 왔다. 담체 제조 시 고흡착능 구현이 가능한 소재와의 복합화도 검토될 수 있으나, 활성탄 등의 탄소 기반 고비표면적 소재는 산화 소성 시 화학적 안정성 확보에 난점이 있다. 규산마그네슘은 알칼리토금속 기반 규산염 중 하나로, 환경 친화적이며 높은 비표면적 및 표면활성도를 지닌, 안정적이고 저단가인 산화물로 보고되었다[16-22]. 규산마그네슘 결정은 실록세인 사면체 프레임워크에 마그네슘 이온이 산소 이온과의 약한 정전기적 인력으로 결합된 구조로, 마그네슘 이온이 쉽게 움직이거나 다른 양이온들과 쉽게 교환되는 특징이 있다[19,20]. 또한, 규산마그네슘의 표면에는 Si-O 및 Mg-O 결합, 그리고 -OH 작용기가 존재하여 메틸렌블루 또는 중금속 흡착에 유리하다고 알려져 있다[21]. 하지만, 저자들이 알고 있는 범위에서는 할로이사이트 등 점토 소재와의 복합화 연구에 대해서는 충분한 연구가 보고되지 않았다.
본 연구는 규산마그네슘 및 할로이사이트의 열적 안정성을 X-선 회절, 질소 등온흡탈착 및 메틸렌블루 흡착 평형을 통해 분석하였으며, 분석 결과를 바탕으로 소성 온도를 결정하여 할로이사이트-규산마그네슘 복합 담체를 제조, 기존의 할로이사이트 단일 담체 대비 메틸렌블루 염료 흡착 및 Cu(II), Cr(III), Zn(II) 등의 중금속 흡착 거동을 평가하였다.
2. 실험 방법
2.1. 실험 소재 및 구조 분석
흡착 무기 소재로 할로이사이트 (Halloysite, Hal., PB급, 풍산광업㈜, 경상남도 산청, 대한민국) 및 규산마그네슘 (Magnesium silicate, MS, Magnesol®, 2MgO·~5SiO2, Dallas group, USA)이 사용되었으며, 열적 안정성 평가를 위해 각 분말은 100~750℃ 대기 분위기 하에서 열처리를 수행하였다. 열처리 시 승온 및 강온 속도는 3℃ min-1 이며, 목표 온도에서의 정지 시간은 모두 3 h로 고정하였다. 소재의 결정상은 X-선 회절계(X-ray diffractometer, XRD, MiniFlex 600, Rigaku, Japan)로 분석하였으며, 미세구조 분석은 투과전자현미경(Transmission Electron Microscope, TEM, Talos L120C 및 Themis Z, FEI, ThermoFisher Scientific, USA) 및 주사전자현미경(Scanning Electron Microscope, SEM, MIRA LM, TESCAN, CZ)을 활용하였으며, 미세구조 내 원소 분포는 EDS (Energy-dispersive X-ray Spectrometry)로 평가하였다. 비표면적은 비표면적/세공크기 분포 측정장치(ASAP2020, Micromeritics, USA)를 사용하여 평가하였다. 담체의 상대 밀도는 측정 전 70℃ 열풍식 오븐에서 24h 이상 건조 후 아르키메데스 침지법으로 분석하였으며, 포수 시편을 만들기 위해 증류수에 담체를 침지 후 오일리스 펌프로 진공을 형성하여 탈포하였다. 측정 중 증류수에 의한 결정수 변화는 고려하지 않았다.
2.2. 담체 성형 및 소성
할로이사이트 기반 관형 흡착 담체의 제조는 기존에 보고된 압출 제조 공정을 활용하였다[15]. 압출기의 오리피스는 담체의 표면적 증대를 위하여 외부를 요철 구조로 설계하였으며, 오리피스 중앙부에 심을 사용하여 관형(Macaroni, M형)의 담체를 성형하였다. 압출용 소지(dough)는 할로이사이트 단독으로 사용하거나 30wt% 규산마그네슘-할로이사이트를 건식 혼합한 후, 증류수와 질량비 1:1로 균일 혼합하였다. 할로이사이트 복합 소재는 할로이사이트 단독으로 사용하였을 때 대비 성형성이 충분하지 않아 5wt%의 바인더(YB-132A, Yuken, Japan)를 추가로 사용하였으며, 사용한 바인더의 완전 연소 온도는 500℃ 이하이다. 성형체는 응달에서 1차 건조 후 60℃의 열풍식 오븐에서 2차 건조하였으며, 이후 할로이사이트 관형 담체(M-H) 및 30wt% 규산마그네슘-할로이사이트 복합 관형 담체(M-HM3)는 각각 750℃ 및 600℃ 대기 분위기 하에서 소성하였다. 열처리 시 승온 및 강온 속도는 3℃ min-1 이며, 정지 시간은 3 h로 고정하였다.
2.3. 소재 흡착능 평가
소재의 흡착능은 삼각 플라스크 기반의 배치형 교반기(MaXshake OB2, Daehan Scientific, 대한민국)를 활용, 실온(21~24℃)에서 100~200 rpm의 속도로 교반하여 수득하였다. 물질 1g 당 수용액의 부피는 150mL로 설정하였다. 교반 후 잔류 용액을 13,500 rpm (1.4mL, 10 min) 조건의 원심 분리로 수득하였고, 메틸렌 블루 용액은 UV-vis 흡수분광계(Ubi-490, Microdigital, 대한민국)를 활용, 670 nm의 흡광도를 잔류 염료 농도로 환산하여 흡착능을 산출하였다. 흡광도의 농도 환산은 기존 보고된 방법을 활용하였다[15]. 메틸렌 블루 (Methylene blue trihydrate, MB, >97.0%, 삼전순약공업㈜, 대한민국)의 건조 감량을 평가하기 위해 105℃ 대류식 오븐에서 4 h 건조 후 칭량하였다. 평가에 사용한 MB 수용액은 전처리 없이 건조 후 상대 질량(86.14%)을 반영하여 1,500mgL-1 (1,500 ppm)의 농도로 제조하였으며, 이후 목표 농도로 증류수를 사용, 희석하여 평가에 활용하였다. 제조된 용액은 알루미늄 호일로 광차폐된 유리병에 보관하였다. 흡착 소재의 시간별 흡착량(qt)은 Equation (1)을 이용해 계산되었다. Equation (1)에서 qt는 해당 시간 t (h)에서의 흡착제 질량 당 흡착량(mg g-1)이며, Co, Ct는 각각 용액의 초기농도와 시간 t (h)에서의 농도(mg L-1), V는 용액의 부피(L)이며 W는 흡착제의 질량(g)이다.
열처리 온도에 따른 규산마그네슘의 MB 흡착능 거동을 검토하기 위해 1,500 mg L-1 제조 용액을 사용하였으며, 1 h, 100 rpm 교반 후 평가하였다. 등온 흡착 실험은 초기 농도 200 mg L-1의 MB 수용액 50mL에 600℃ 열처리 전, 후의 할로이사이트를 50~400 mg 범위에서 각각 다르게 첨가하여 24~26℃에서 200 rpm, 6 h 동안 흡착시킨 후 평형을 이룬 용액의 농도를 분석하였다. 600℃ 열처리 전, 후의 규산마그네슘의 등온 흡착 실험은 초기 농도를 1,100~1,200 mg L-1의 MB 수용액을 활용하여 동일한 조건에서 평가하였다.
2.4. 담체의 메틸렌 블루 및 중금속 흡착능 평가
담체의 메틸렌 블루 흡착능 평가는 소재의 흡착능 평가 방법에 준하여 진행되었다. 14개의 삼각 플라스크에 각각 담체 6개씩 소분하여 담체 1g 당 150 mL의 200 mg L-1의 MB 용액을 투입, 24~26℃, 200 rpm, 24~168 h 교반 하였으며, 잔류 용액의 농도는 전술한 바와 같은 방법으로 평가하였다. 중금속 흡착능 평가에 사용된 Cu(II), Cr(III), 및 Zn(II) 용액은 500 mL 증류수 당 Cu(NO3)2·3H2O (CAS No. 7789-02-8, 대정화금㈜, 대한민국) 0.095g, Cr(NO3)3·9H2O (CAS No. 10031-43-3, 대정화금㈜, 대한민국) 0.193g, Zn(NO3)2·6H2O (CAS No. 10196-18-6, 삼전순약공업㈜, 대한민국) 0.114g을 각각 용해하여 제조하였다. 삼각플라스크 당 담체를 6개씩 소분, 담체 1g 당 150mL의 중금속 용액을 투입, 200 rpm, 168 h 교반 후 잔류 중금속 이온 농도를 평가 전 용액과 함께 ICP-OES (Inductively Coupled Plasma Optical Emission Spectroscopy, ICP-OES, OPTIMA 8300, PerkinElmer, USA)로 분석하였다.
3. 결과 및 고찰
3.1. 규산마그네슘의 열처리 온도에 따른 메틸렌 블루 흡착능 평가
할로이사이트-규산마그네슘 복합 담체의 소성 온도 최적화를 위하여, 소성 온도에 따른 규산마그네슘 분말의 1 h MB 흡착량을 평가하였다(Fig. 1). 500℃에서의 흡착량은 193 mg g-1으로, 500℃ 이하의 소성 온도에서는 주목할 만한 변화가 없으나 600℃ 및 700℃ 소성 온도에서는 규산마그네슘의 흡착량이 각각 180 mg g-1 및 140 mg g-1로, 소성 온도의 증가에 따라 500℃ 흡착능 대비 6.9%P 및 27.3%P 감소하였다. 750℃ 샘플은 급격히 91.2%P 감소한 16.9 mg g-1의 흡착능을 보이며 기존에 보고된 동일온도에서 소성된 할로이사이트의 MB 흡착능(18.5mg g-1)15) 보다도 낮은 값을 나타냈다. 500℃에서 소성한 할로이사이트 담체는 사용에 적합한 기계적 내구성 확보에 난점이 있어, 소성 목표 온도를 600~700℃로 구체화하였다.
3.2. 흡착 소재의 열적 구조 안정성 평가
할로이사이트의 열적 안정성에 대해서는 500℃ 이상의 소성 온도에서 실리카(SiO2)에 의한 패턴을 제외하고는 결정성이 저하되는 경향을 보이나(Fig. 2), 나노튜브형의 미세 구조는 600℃ 에서도 유지된다는 결과가 보고된 바 있다[14]. 또한 multiple-point Brunauer-Emmett-Teller (BET) method 로 평가된 비표면적(SBET)도 750℃ 열처리 전후로 2% 미만의 비표면적 변화가 보고되었으므로[15], 본 연구에서는 규산마그네슘의 열적 안정성을 중점적으로 분석하였다. Fig. 3(a)는 규산마그네슘의 소성 온도에 따른 X선 회절 패턴을 보여준다. 열처리 전 상태(As-prepared)의 규산마그네슘은 나노미터 규모의 작은 결정크기 또는 높지 않은 결정도로 인한 폭넓은 패턴을 나타내며, 2θ 기준 20o 및 35o 근처에서 관찰되는 폭넓은 주 픽들은 규산마그네슘(3MgO·4SiO2·2H2O, JCPDF No. 03-0174)의 (020), (200) 및 (i31)과 대응된다[19]. 700℃ 열처리 까지는 유의미한 변화가 관찰되지 않았으나, 750℃ 열처리 시 넓은 폭의 픽들은 축소되며 결정상 패턴이 추가로 관찰되었다. 이 결과는 700℃에서 규산마그네슘의 결정상이 증가하고 750℃에서 명확히 광폭의 픽이 소멸하는 기존의 결과에 부합한다[23]. 또한, 이러한 결정상의 성장은 Fig. 1에서 나타난 750℃에서 발생한 급격한 흡착능 저하와 연관이 있다고 추정된다. Fig. 3(b)는 할로이사이트 분말(Hal.), 규산마그네슘 분말(MS), 및 30 wt% 규산마그네슘-할로이사이트 복합 담체(M-HM3)의 X-선 회절 결과이며, 모든 샘플은 600℃, 3 h 열처리되었다. 복합 담체의 회절 패턴은 대체적으로 할로이사이트와 규산마그네슘의 패턴에 대응되나, 2θ=27.9°의 픽을 포함한 낮은 강도의 미확인 픽들이 관찰되는 것으로 보아 할로이사이트-규산마그네슘 간 부반응이 있을 것으로 예상된다.

X-ray diffraction patterns of (a) magnesium silicate (MS) powders fired at various temperature and (b) the halloysite powder (Hal.), the (MS) powder and the 30wt% magnesium silicate-halloysite tubular media (M-HM3). All the samples were fired at 600oC for 3 h.
Fig. 4은 열처리 온도에 따른 규산마그네슘의 미세구조를 TEM으로 분석한 결과이다. 열처리 전 규산마그네슘은 수 nm 급의 일차입자들로 구성되어 있음을 확인할 수 있는데, 600℃-규산마그네슘의 경우 일부 결정 성장이 관찰되며, 750℃ 열처리 시 수십 nm 이상으로 결정 성장한 결과를 관찰할 수 있다. Fig. 1의 결과에 비추어 볼 때, 규산마그네슘의 반응 면적 감소가 흡착능의 열화에 기여했다고 판단할 수 있다.

TEM images of the magnesium silicates: (a) as-prepared (b,c) fired at 600oC and 750oC, respectively. (bar = 50 nm)
소성 온도에 따른 흡착 소재 및 담체의 비표면적(SBET) 변화를 질소 등온 흡탈착 결과를 통하여 분석하였다(Fig. 5). 규산마그네슘의 등온 흡착 곡선들은 낮은 상대 분압에서 무릎형이 관찰되며, 중간 영역의 영역에서 흡착량이 점진적으로 증가하며, 흡탈착의 이력 곡선이 약 >0.4의 상대 분압에서 관찰되는 점으로 보아 IUPAC 기준[24] Type IV의 패턴으로 분류될 수 있다(Fig. 5(a)). 즉, 규산마그네슘은 메조 기공(2-50 nm)을 가진 물질로 추정할 수 있으며, 무릎형의 흡착 패턴이 보여주는 흡착량이 전체 흡착량 대비 상대적으로 높은 비중을 차지하는 것으로 보아 단흡착층에 의한 흡착이 유용할 것으로 추정할 수 있다. 규산마그네슘의 SBET는 515m2g-1이며, 600℃ 및 700℃ 열처리 시 각각 319m2 g-1 및 204 m2 g-1으로 감소한다. 600℃ 및 700℃ 열처리된 규산마그네슘의 낮은 상대 분압 (p po-1 =0.01)에서의 흡착량이 열처리 전 샘플의 흡착량 대비 각각 60% 및 38% 수준임을 고려하면, 열처리 온도에 따라 감소하는 규산마그네슘의 질소 흡착량이 주로 단흡착층에 의한 흡착량 저감에 기인한다고 분석할 수 있으며, 따라서 염료 및 중금속 흡착능이 600℃ 이상의 온도에서 온도가 증가함에 따라 큰 폭으로 감소할 것으로 예측할 수 있다. 그러나, Fig. 5(b)에서 확인할 수 있듯 규산마그네슘은 600℃의 열처리에도 불구하고 할로이사이트의 단층 흡착에 비해 우수한 흡착능을 나타내며, 결과적으로 M-HM3 복합 담체는 할로이사이트 분말(47m2 g-1) 대비 2.4배 이상 넓은 비표면적 (115 m2 g-1)을 확보하였으며, 이에 따른 흡착능 향상을 기대할 수 있다.
3.3. 흡착 소재의 소성 온도에 따른 MB 등온 흡착 평형
무기 소재의 등온 흡착 평형 거동을 규명하기 위하여 Langmuir 모델 (Equation (2)) 및 Freundlich 모델 (Equation (3))을 사용하였다. Langmuir 모델은 흡착 소재의 표면이 에너지적으로 균일하며, 흡착질은 흡착질 간 유의미한 상호작용이 없으며 유한한 흡착 소재 표면에 단층으로 흡착이 일어난다고 가정한다[25,26]. 반면, Freundlich 모델은 흡착제 표면이 불균등한 에너지 분포를 가지며, 흡착질은 상호 작용이 있으며 흡착 소재 표면에 불균일한 다층 형태로 흡착되며 흡착제 간 상호 작용을 가정한다[26,27].
qe는 평형 상태에서 흡착 소재의 질량 당 흡착량(mg g-1), Ce는 평형 상태에서 용액의 흡착질 농도(mg L-1)이며 b는 흡착의 친화도를 나타내는 상수(L-1 mg), Q0는 흡착 소재의 단위 질량당 최대 흡착량(mg g-1)을 나타내는 Langmuir 상수이다. 또한 KF와 n-1은 Freundlich 모델에서 흡착용량과 흡착강도를 나타내는 상수이다.
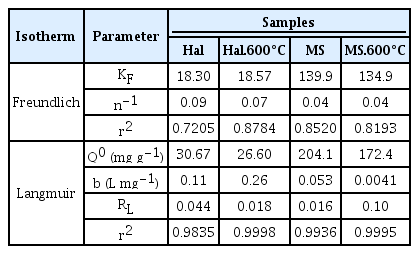
소성 온도 및 흡착 소재에 따른 등온 MB 흡착 평형 결과를 Fig. 6에 나타내었으며, 실험 결과를 Langmuir 및 Freundlich 모델로 해석하여 얻은 변수들을 Table 1에 정리하였다. 식에 대한 일치도(r2)는 홉착 소재의 종류와 열처리 온도와 무관하게 Freundlich 모델(0.7205<r2<0.7874) 대비 비교적 큰 차이로 Langmuir 모델이 높았다(0.9835<r2 < 0.9998). Fig. 7는 평형농도에 따른 소재의 평형흡착량을 도시한 결과로, Langmuir 모델이 확보된 데이터를 더욱 잘 모사함을 판단할 수 있다. 이 결과는 할로이사이트 및 규산마그네슘 모두 MB와의 흡착이 일정한 흡착 에너지를 갖고 발생하며, MB는 흡착 소재 위 단분자층을 형성하여 흡착된다고 판단할 수 있다. 할로이사이트의 경우, Langmuir 모델로 분석한 결과 최대 흡착량은 열처리 전 30.67 mg g-1에서 600℃ 열처리 후 26.60 mg g-1으로 약 13.3% 감소하였다. 규산마그네슘의 최대 흡착량은 204.1 mg g-1로 산출되었다. 보고된 규산마그네슘 중공 구형체의 흡착능(180 mg g-1) [17] 및 규산마그네슘 중공 나노파이버의 흡착능(197 mg g-1) [19]과 유사하며, 수열합성으로 보고된 규산마그네슘(526 mg g-1) [21] 또는 규산마그네슘 나노튜브(299 mg g-1) [20] 대비 작은 값이다. 600℃ 열처리 시 최대 흡착량은 172.4 mg g-1로 15.5% 감소하였으며, 결과값 및 경향은 Fig. 1의 결과에 부합한다. 할로이사이트 대비 높은 최대흡착능을 나타내므로, 규산마그네슘 또한, 분리 계수(RL)를 Equation (4)를 통해 산출하여 흡착의 적절성을 예상해 볼 수 있다[26,28)]. Equation (4)에서 C0는 가장 높은 흡착질 농도를 나타낸다. 일반적으로 RL이 1보다 작은 경우 흡착이 선호된다고 판단할 수 있는데, 본 실험에서는 모든 흡착 소재가 1보다 작은 값을 나타내므로, 할로이사이트 및 규산마그네슘을 사용한 흡착이 적절하게 수행될 수 있음을 예상할 수 있다.
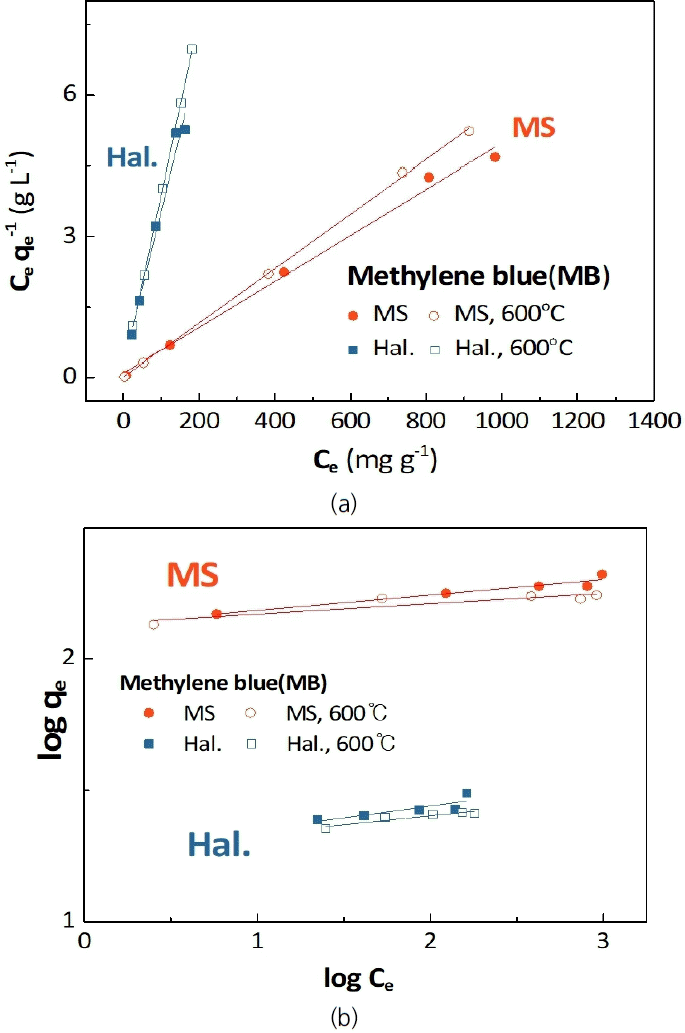
(a) Langmuir isotherms and (b) Freundlich isotherms for MB adsorption of halloysites and magnesium silicates.

Langmuir and Freundlich isotherms for MB adsorption on the halloysites (Hal.) and magnesium silicates (MS).
Freundlich 모델에서 n-1이 작을 수록 높은 흡착 강도를 나타내는데, 규산마그네슘은 할로이사이트 대비 높은 흡착 강도를 가지고 있음을 알 수 있다. 결과적으로 600℃ 열처리는 할로이사이트 및 규산마그네슘의 최대흡착량을 다소 저감시키나, Langmuir 흡착 거동이 변경되지는 않음을 알 수 있다. 또한, 규산마그네슘의 최대흡착량은 할로이사이트 대비 약 6배 이상의 값을 나타내며 높은 흡착 강도를 나타낸다. 이 결과는 전술한 바와 같이 Mg-O의 약한 정전기적 인력으로 가능한 이온 교환, 실록세인 층으로 인해 부분적으로 음전하로 대전된 표면, 수계에서 형상된 -OH 등의 작용기에 기인할 수 있다[19-21]. Fig. 3(b)에서 확인된 부반응의 영향이 크지 않다면 규산마그네슘의 복합화는 할로이사이트 기반 담체의 흡착능 향상에 기여할 수 있을 것이라 판단한다.
3.4. 할로이사이트 기반 관형 담체 제조 및 흡착능 평가
규산마그네슘 복합화에 따른 담체 흡착능 개선을 검토하고자 할로이사이트 관형 담체(M-H)및 30wt% 규산마그네슘-할로이사이트 관형 복합 담체(M-HM3)를 압출 공정을 통해 성형 후 소성하였으며, 할로이사이트 관형 담체(M-H)는 기존 보고된 공정과 동일하게 제조되었다[15]. 복합 담체 내 30wt%의 규산마그네슘의 비율은 소재의 연결도를 고려하여 선정되었다.
Fig. 8은 M-HM3 담체의 사진, 미세구조 및 조성 분포를 나타낸다. 관형 담체의 지름 및 길이는 모두 0.5 cm 급으로 제조되었으며, 담체의 표면은 유체와의 접촉 면적을 증가시키기 위해 요철 구조로 성형하였다. 관형 담체의 돌출부의 두께는 약 0.9 mm, 벽 두께는 약 0.6 mm로 M-H 담체의 규격과 유사하며, EDS 분석 결과에 따르면 규산마그네슘에서 유래한 Mg 분포와 할로이사이트에서 유래한 Al 분포가, 양 물질 모두에서 기인하는 Si 분포와 대부분 일치한다. 즉, 담체 내부에서 규산마그네슘과 할로이사이트가 균일하게 혼합되었음을 알 수 있다. 제조된 담체의 기공율은 아르키메데스 침지법으로 평가되었으며, 측정된 건조 질량(mdry), 포수(water-saturated) 질량(msat) 및 포수 샘플의 수중 질량(msub)을 Table 2에 정리하였다.
M-H 및 M-HM3 담체의 기공율은 각각 38.01% 및 43.55%이다. 할로이사이트의 열적 안정성을 고려할 때 복합화된 규산마그네슘은 입자 간 네킹(knecking)을 저해할 수는 있으나 소성으로 인한 수축 지연을 유발하지는 않을 것이라 추정할 수 있다. 일차입자의 형상 차이로 인한 입체효과로 차이가 발생할 수는 있으나, SEM 이미지로는 유의미한 다공성 구조의 차이가 확인되지 않았다(Fig. 9).

Cross-sectional SEM images of tubular composites of (a,b) halloysite and (c,d) 30 wt% magnesium silicatehalloysite.
Fig. 10은 흡착 시간에 따른 할로이사이트 기반 관형 담체의 MB 흡착능 변화를 나타낸다. 할로이사이트 단독 활용 담체(M-H)의 168 h 흡착량은 분말에서 평가된 최대흡착량 대비 약 30% 수준인데, 이는 담체화를 통해 MB 용액과의 접근성 및 확산이 저감되기 때문으로 여겨진다. 30wt% 규산마그네슘 복합화(M-HM3)는 기존 할로이사이트 단독 활용 담체(M-H) 대비 전 시간 영역에서 높은 MB 흡착능을 보여주었으며, 168 h 흡착량은 29.8 mg g-1으로 동일 조건 하 M-H 담체 흡착량의 3.2배 향상되었다. 또한, M-H 담체는 측정 시간 동안 지속적으로 흡착량이 증가한 반면, M-HM3는 72 h까지 빠른 흡착량 증가를 보이며, 168 h 흡착량의 92.3%를 달성하였다. M-H대비 약 5% 높은 M-HM3의 기공율이 빠른 흡착 거동의 원인이 될 수 있겠으나, 유사한 담체 형상 규격을 가지며 168h 흡착량의 90% 달성에 소요하는 시간을 절반으로 단축, 2배 이상의 168 h 흡착량의 향상을 설명하기에는 충분하지 않다. 따라서, 규산마그네슘의 상대적으로 높은 메틸렌 블루 최대 흡착량 및 높은 흡착강도에 의해 담체의 염료 흡착이 가속되며 최대 흡착량이 증가했다고 볼 수 있다.

Adsorption capacities of MB for the halloysite-based media with or without 30 wt% of magnesium silicate.
담체의 중금속 흡착능을 평가하기 위해 제조된 Cr(III), Cu(II) 및 Zn(II) 용액의 이온 농도를 ICP-OES로 분석한 결과 73.0 mg L-1, 38.7 mg L-1, 및 44.4 mg L-1 였다. Fig. 11은 제조된 용액을 활용한 M-HM3 담체 및 M-H 담체의 Cr(III), Cu(II) 및 Zn(II) 168 h 흡착능을 도시하였다. 30wt% 규산마그네슘 복합화 담체(M-HM3)의 168h Cr(III), Cu(II) 및 Zn(II) 흡착량은 각각 10.9 mg g-1, 5.73 mg g-1 및 6.52 mg g-1 이다. 이는 할로이사이트 단독 활용 담체(M-H) 대비 각각 4.8배, 8.1배, 및 5.6배 증가한 결과로, 메틸렌 블루 흡착량의 향상 비율보다 높은 결과이다. 이 결과는 양이온성 염료인 메틸렌 블루와 Cr(III), Cu(II) 및 Zn(II) 이온의 흡착 모두 규산마그네슘 복합화를 통해 향상됨을 알 수 있다. 또한, 할로이사이트 담체를 위한 규산마그네슘 복합화는 메틸렌 블루 대비 보다 금속 이온에 상대적으로 강한 흡착 활성을 나타내고 있음을 알 수 있다. 본 연구에서 제조한 규산마그네슘-할로이사이트 복합 담체는 염료 또는 중금속 등을 포함한 폐수처리 공정에 적용 가능성이 높다고 판단된다. 가령, 염색폐수는 다양한 염료 물질 및 중금속을 함유하고 있어, 규산마그네슘-할로이사이트 복합 담체를 이용한 고도처리 단위공정 적용의 효용이 높을 것으로 예상된다[29]. 후속 연구에서는 흡착공정의 최적화 및 연속식 실험을 통한 흡착능 평가를 통해 규산마그네슘-할로이사이트 복합 담체의 실폐수처리 공정 적용 가능성을 보다 면밀하게 제시할 수 있을 것이다.
4. 결론
본 연구에서는 할로이사이트 담체의 흡착능 향상을 위해 규산마그네슘을 30wt% 비율로 복합화하였다. 담체의 최적 소성 온도를 검토하기 위해 규산마그네슘의 열처리 온도에 따른 메틸렌 블루 및 중금속 흡착특성을 결정상 및 미세구조의 변화와 함께 검토한 결과 다음과 같은 결론을 얻을 수 있었다.
1) 규산마그네슘은 500℃ 이하의 열처리 조건에서는 유의미한 메틸렌 블루 흡착능의 변화를 나타내지 않았으나, 600℃ 및 700℃ 열처리 시 500℃ 흡착능 대비 6.90%P 및 27.3%P 감소하였다. 750℃ 소성 시에는 500℃ 흡착능 대비 약 8.8% 수준으로 저감되므로, 담체의 소성 온도는 700℃ 이하로 최적화될 수 있다.
2) 500℃ 에서는 담체 활용 시 내구도 확보에 어려움이 있어 600℃ 및 700℃ 열처리 시 규산마그네슘의 비표면적 변화를 관찰하였다. 열처리 전 규산마그네슘의 BET 비표면적은 515 m2 g-1으로, 소성 온도의 증가에 따라 600℃ 및 700℃ 열처리 시 각각 319 m2 g-1 및 204 m2 g-1 으로 감소했다. 감소분은 단층 흡착 및 MB 흡착 저감량과 상관관계가 있다.
3) 600℃ 열처리된 할로이사이트 및 규산마그네슘의 MB 등온 흡착 평형은 열처리 여부 및 소재의 종류와 무관하게 Langmuir 모델로 적절하게 설명될 수 있으며, 600℃-할로이사이트 및 규산마그네슘의 최대 메틸렌 블루 흡착량은 각각 26.60 mg g-1 및 172.4 mg g-1 로 규산마그네슘 복합화를 통해 담체의 흡착능 증대를 도모할 수 있다.
4) 600℃에서 소성된 30wt% 규산마그네슘-할로이사이트 관형 복합 담체는 할로이사이트 단독 담체 대비 168 h 메틸렌 블루 흡착능이 29.8 mg g-1로 3.2배 증가하였으며, 168 h 흡착량의 90%는 72 h 이내에 달성, 단독 담체 대비 절반 이하의 시간이 소요되었다. 또한, 복합 담체의 168h Cr(III), Cu(II) 및 Zn(II) 흡착량은 각각 10.9 mg g-1, 5.73 mg g-1 및 6.52 mg g-1 로 단독 담체 대비 각각 4.8배, 8.1배, 및 5.6배 증가되었다. 할로이사이트 담체 제조 시에 규산마그네슘을 복합화함으로써 염료 및 중금속 흡착 성능이 우수한 흡착 담체를 제조할 수 있음을 보여준다.
Acknowledgements
본 연구는 환경부와 한국환경산업기술원의 생태모방 기반 환경오염관리 기술개발 사업(2019002790004)의 지원을 받았습니다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.