육상, 대기, 수생환경의 미세플라스틱 발생 및 유입경로와 생물에 미치는 영향
Source and Route of Microplastics in Terrestrial, Atmospheric, and Aquatic Environments, and Effects of Microplastics on Organisms
Article information
Abstract
목적
미세플라스틱이란 크기가 5 mm 미만인 폴리머 입자를 말하며 인위적으로 작게 제조되거나 큰 플라스틱이 자연적으로 잘게 분해되면서 생성된다. 미세플라스틱은 육지나 물에 축적되는 잔류성 입자이기 때문에 완전히 분해되기까지 상당한 시간이 소요된다. 생성된 미세플라스틱은 생태계로 유입되어 여러 문제를 일으키며 먹이사슬을 통해 상위 단계로 이동하여 생태계와 인간 건강을 위협하고 있다. 미세플라스틱은 생태계 뿐 아니라 인간에게도 직접적인 영향을 끼칠 수 있기에 최근 미세플라스틱 오염은 주요 환경 문제로 주목받고 있다. 본 논문에서는 미세플라스틱이 생성된 후 주변 생태계로 유입되는 경로 및 여러 생물에 미치는 영향에 대해 알아보고자 하였다.
방법
본 내용은 생태계를 크게 육상, 대기, 수생환경으로 구분하여 동물, 식물, 그리고 미생물에 미치는 미세플라스틱의 영향을 2010년대부터 2022년 6월 사이의 논문을 참고해 작성하였다.
결과 및 토의
미세플라스틱은 다양한 인간 활동을 통해 주변 생태계로 유입되며 육상, 대기, 수생환경을 순환하며 존재한다는 것을 알 수 있었다. 미세플라스틱은 동물에게 산화 스트레스 유발, 장 세포 손상, 개체 크기 감소 등의 문제를 일으키며 식물의 경우 미세플라스틱 노출 시 뿌리 길이, 생체량, 엽록소 양 등의 감소가 관찰되었다. 또한, 미세조류의 엽록소 양을 감소시켜 성장을 억제시키고 산화 스트레스를 유발하였다.
결론
본 논문은 미세플라스틱의 발생, 유입경로와 생물에게 미치는 영향의 기초 정보를 포함하고 있고 이는 미세플라스틱의 거동 이해 및 향후 진행될 미세플라스틱 생태 연구의 단초가 될 것으로 기대된다.
Trans Abstract
Objectives
Microplastics, known as pieces of polymer debris less than 5 mm, result from plastic particles originally manufactured to small size or fragmentation from larger plastic items. Due to the persistence, microplastics can remain and accumulate in land and ocean for a prolonged period. Microplastics enter ecosystems and cause various problems. Trophic transfer of microplastics can be occurred in food chain, accordingly humans also can ingest microplastics. The accumulation of microplastics raises concerns regarding impacts on human health and terrestrial and aquatic ecosystems. Here, we discuss the source and route of microplastics found in environments, and ecological effects of microplastics on organisms.
Methods
We explore how microplastics enter terrestrial, atmospheric, and aquatic environments and influence individual animals, plants, and microorganisms living in diverse ecosystems. Research literature is reviewed microplastics in terms of ecological risk published between 2010s and June 2022.
Results and Discussion
Diverse human activities (e.g., industrial and agricultural activity) accelerate the production of microplastics and result in a release of microplastics to surrounding ecosystems. The microplastics can circulate among the terrestrial, atmospheric, and aquatic environments. The exposure of microplastics can induce oxidative stress, damage of intestinal cells, and reduce the body size in animals. In plants, length of root, biomass, and chlorophyll content are decreased upon exposure to microplastics. In addition, microplastics inhibit the growth of microalgae by reducing algal chlorophyll contents and cause oxidative stress.
Conclusion
This paper includes basic information regarding the occurrence and accumulation of microplastics and their ecological effects on organisms. The contents will help to understand behavior of microplastics in diverse environments and to further evaluate ecological impacts of microplastics.
1. 서 론
1.1. 플라스틱이란?
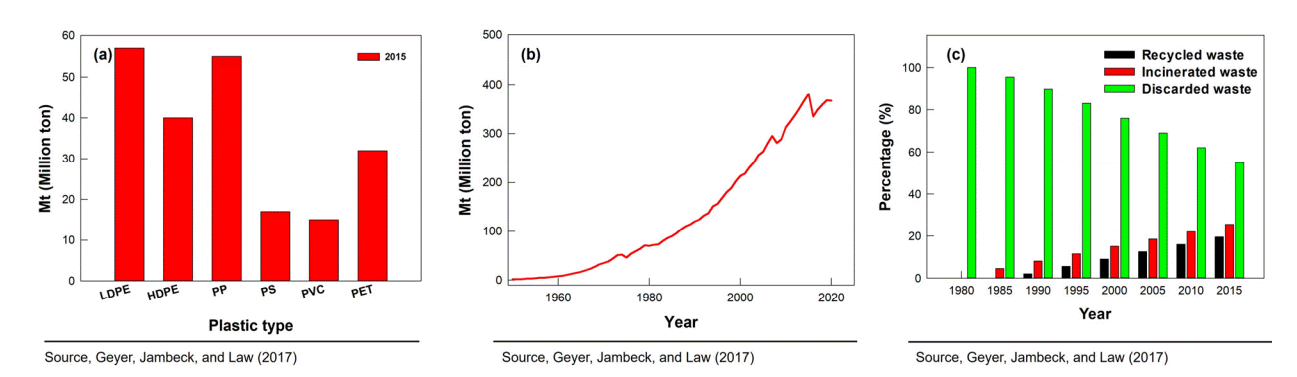
플라스틱이란 열이나 압력을 가해 원하는 형태로 모양을 만들 수 있는 고분자 화합물로 가공이 편리하고 내구성이 좋으며 가볍다는 특징이 있어 일상생활에서 광범위하게 사용되고 있다. 플라스틱은 구성 단위체에 따라 폴리에틸렌(polyethylene, PE), 폴리프로필렌(polypropylene, PP), 폴리에틸렌 테레프탈레이트(polyethylene terephthalate, PET), 폴리스타이렌(polystyrene, PS), 폴리염화비닐(polyvinyl chloride, PVC) 등으로 구분되며 이 5종류의 폴리머가 총 플라스틱 수요의 약 90%를 차지한다(Fig. 1a) [1]. 플라스틱은 생산되기 시작한 이래로 사용량이 매년 급격히 증가하고 있으며, 최근 코로나 19로 인해 마스크나 일회용품과 같은 플라스틱 제품을 더 많이 소비하고 있다[2]. 전 세계 플라스틱 생산량은 1950년 2Mt(Million ton)에서 2015년 380 Mt에 이르고 연평균 증가율은 8.4%로 가파른 상승세를 보이고 있다(Fig. 1b) [3]. 1950년부터 2015년까지의 누적 플라스틱 생산량은 7,800 Mt으로 이 중 절반인 3,900 Mt은 2002년 이후로 생성되었다[3]. 이러한 추세라면 2050년에는 플라스틱 생산량이 34,000 Mt에 이를 것으로 예측되고 있다[3]. 많은 생산량에도 불구하고 제대로 설계된 플라스틱 처리 방안은 아직 마련되지 않고 있고, 실제 조사에서도 플라스틱 폐기물 중 재활용되는 비율은 9%로 생산량에 비해 미미한 수준이다[3]. 재활용되지 않는 플라스틱 폐기물의 대부분은 소각(incinerated waste), 매립 등의 방법으로 처리되거나 폐기 (discarded waste)를 통해 자연환경으로 유입된다(Fig. 1c) [3]. 플라스틱 제품은 많은 경우 일회용으로 사용되는데, 플라스틱은 육지나 물에 축적되는 잔류성 입자이기 때문에 자연환경에 노출된다면 분해되기까지 오랜 시간이 소요된다[4]. 현재 전 세계 해양에는 플라스틱 섬(plastic island)으로 불리는 플라스틱 쓰레기 더미가 광범위하게 발견되고 있으며 “Plastisphere”라는 새로운 용어가 등장할 정도로 플라스틱 오염이 만연해 있다[5].
1.2. 미세플라스틱이란?
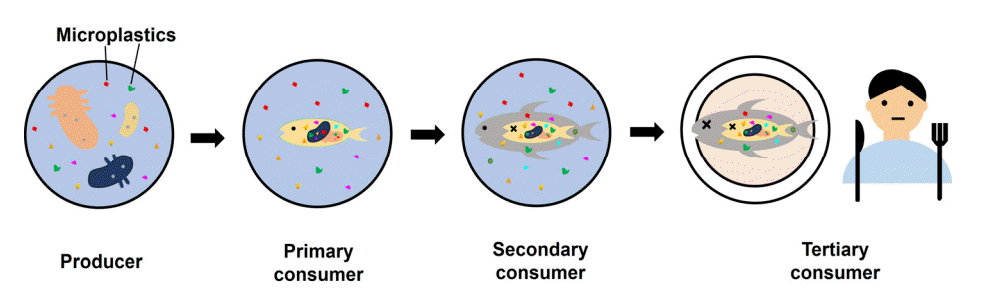
플라스틱은 크기에 따라 대형플라스틱(≥ 20 cm, macroplastic), 중형플라스틱(0.5-20 cm, mesoplastic), 미세플라스틱(1 μm-0.5 cm, microplastic), 초미세플라스틱(≤1 μm, nanoplastic)으로 구분된다[4,6]. 이중 미세플라스틱은 생성 과정에 따라 1차 미세플라스틱과 2차 미세플라스틱으로 나뉜다. 1차 미세플라스틱은 처음 생성될 때부터 작은 크기로 만들어진 입자로 치약, 세정제, 화장품 등에 존재하는 마이크로 비드(microbead)나 옷 제조 시 사용되는 합성 섬유 등이 포함된다[7]. 2차 미세플라스틱은 큰 크기의 플라스틱이 파도나 자외선 등에 의한 물리화학적 분해 혹은 미생물에 의한 생물학적 분해를 거쳐 잘게 쪼개져 형성된다(Fig. 2) [4]. 이렇게 생성된 미세플라스틱은 생태계로 유입되어 여러 문제를 일으키며[8], 먹이사슬을 통해 상위 단계로 이동하여 최종적으로 인간에게 유입되는 등 생태계와 인간 건강을 위협하고 있다(Fig. 3) [9]. 실제로 인간 세포를 대상으로 한 실험에서 미세플라스틱이 세포 독성, 면역 억제, 염증 유발 등을 일으킴을 확인했다[10]. 미세플라스틱은 생태계 뿐 아니라 인간에게도 직접적인 영향을 끼칠 수 있기에 최근 미세플라스틱으로 인한 환경 오염이 중요한 문제로 대두되고 있다.
2. 미세플라스틱의 발생 및 유입과 환경 분포
2.1. 육상환경
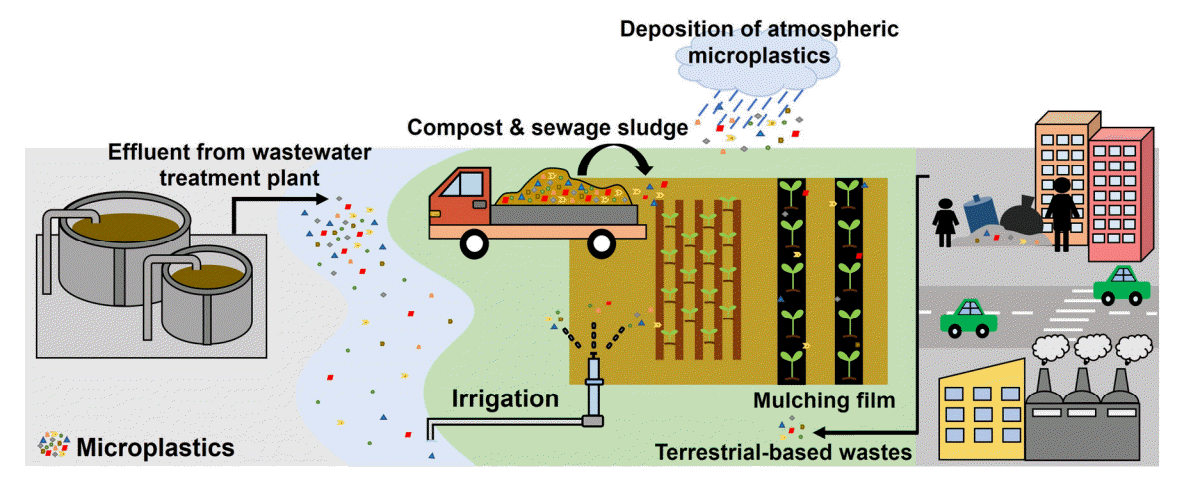
육상에 존재하는 미세플라스틱은 농업, 산업 및 다양한 인간 활동을 통해 토양으로 유입된다. 도로 주변에 버려진 쓰레기나 마모된 타이어 조각들이 빗물에 씻기면서 토양 속으로 들어가거나[11] 대기 중에 존재하는 미세플라스틱이 강우와 함께 침적되어 토양 속으로 유입된다[12]. 대기 중 미세플라스틱은 기상 환경에 따라 먼 거리까지 이동할 수 있으므로 도시에서 발생한 미세플라스틱이 교외 지역의 들판과 식물 잎 등에 퇴적된다[12]. 2020년 8월까지 동아시아, 유럽, 미국, 중동, 호주 지역에서 총 223개 지역의 토양을 대상으로 미세플라스틱을 분석한 결과, 평균적으로 농경지에서 1,200 particles/kg, 산업지역에서 148,000 particles/kg, 도심지에서 1,275 particles/kg의 미세플라스틱이 발견되었다[13]. 이를 통해 농업이 육상 미세플라스틱의 유입에 한 축을 담당하고 있다는 것을 알 수 있으며 Boots et al. (2019)에 따르면 토양 생태계 중 특히 농경지는 미세플라스틱의 주요 축적지로 인식된다[14]. 현재 육상으로 유입되는 미세플라스틱의 경로는 농업 위주로 연구되었으며 그 경로 또한 명확하기에 본 내용에서는 농업 활동을 중심으로 기술하였다.
2.1.1. 농업활동과 관련한 미세플라스틱의 육상 환경 유입 과정
2.1.1.1. 멀칭 필름
멀칭(mulching)이란 농작물 재배 시 토양을 덮어주는 작업으로, 토양 속 수분 및 열 유지, 토양 온도 조절, 비료 유출 방지, 잡초와 병원균 억제 등의 효과를 얻기 위해 사용되는 농업 기술이다. 멀칭은 작물 성장에 맞는 조건을 제공하여 농작물의 생산량을 증가시키고 품질을 향상시켜 경제적 이득을 가져다준다[15,16]. 토양을 덮는데 사용되는 재료를 멀치(mulch)라 하며, 예전에는 볏짚이나 목초를 많이 사용했으나 최근 들어서는 비닐과 같은 플라스틱 필름을 주로 사용하는 추세다[17]. 현재 전 세계적으로 대략 2천만 헥타르(ha)의 농지에서 플라스틱 필름을 사용하고 있으며 중국이 플라스틱 필름 사용량의 90%를 차지하고 있다[18]. 2016년 기준 전 세계 농업용 플라스틱 필름 사용량은 4백만 톤에 달했으며 2030년까지 매년 5.6%씩 증가할 것으로 예상된다[18,19]. 높은 사용량에 비해 사용 후 처리가 적절히 이루어지지 않고 있는데[18], 필름 제거에 시간과 노동력이 많이 든다는 이유로 사용 후 필름을 수거하지 않고 그대로 방치하는 경우가 대부분이다[18]. 실제로 매년 농사에 사용된 필름의 25-33%가 제대로 수거되지 않고 토양에 남아있는 것으로 추정된다(Fig. 4) [20]. 이렇게 남겨진 필름은 바람이나 자외선에 의한 물리・화학적 분해 또는 생물학적 분해 등으로 인해 잘게 쪼개지면서 미세플라스틱화 되어 토양으로 유입된다[21]. 실제 중국 신장 위구르 자치구(Xinjiang Uygur Autonomous Region) 목화밭에서 5년간 지속적으로 멀칭 필름을 사용했을 때 80.3±49.3 particles/kg의 미세플라스틱이 검출되었고, 멀칭 필름을 15년, 24년 사용했을 때는 각각 308±138.1 particles/kg과 1075.6±346.8 particles/kg의 미세플라스틱이 검출되었다[18].
2.1.1.2. 비료
퇴비는 짚이나 동물 배설물 등의 재료를 발효시켜 만든 천연 비료로 농사에 흔히 사용된다. 퇴비에는 유기물과 영양분이 많아서 토양의 물리 화학적 성질을 향상시키고 토양 영양 상태를 높여 작물 생산량을 증가시킨다[21]. 퇴비의 원료로 사용되는 생분해성 폐기물(예, 음식물 쓰레기)에는 미세플라스틱이 포함된 경우가 많으며 이러한 미세플라스틱은 전처리 과정에서 미처 제거되지 못한 채 퇴비에 남아 있게 된다[22]. 한 예로, 폐기된 식품의 퇴비화 과정 중 용기에 포장된 식품이 포함된 경우, 처리 과정에서 플라스틱 용기가 분해되어 미세플라스틱이 생성되고 이는 퇴비에 남게 된다[23]. 조사에 따르면 퇴비화 과정에서 발견되는 대부분의 미세플라스틱은 포장에 사용되는 스타이렌 기반 폴리머 또는 폴리에틸렌인 것으로 밝혀졌으며[23], 실제 네덜란드 노르도스트폴더르(Noordoostpolder) 농장에서 퇴비를 비료로 사용한 토양에는 평균 2,026 particles/kg의 미세플라스틱이 검출되었다[24]. 이는 플라스틱으로 오염된 퇴비를 비료로 사용함으로써 토양으로 미세플라스틱이 유입됨을 보여준다.
하수 슬러지 역시 토양의 비옥도를 높이기 위한 비료로 사용되기도 하는데[25] 유럽과 미국의 경우 하수 슬러지의 50% 정도를 농업용 비료로 사용하고 있다[26]. 문제는 가정 및 산업활동으로 인해 발생한 다양한 미세플라스틱이 하수 처리장으로 흘러 들어가면서 슬러지 속에도 많은 양의 미세플라스틱이 존재하게 된다는 점이다[27]. 하수에 유입되는 미세플라스틱의 97-99%가 수처리 과정에서 제거되지만, 제거된 플라스틱은 더 이상 분해되지 않고 침전되어 슬러지 속에 남아있게 된다[25]. 실제 조사 결과, 하수 슬러지를 비료로 사용하여 매년 호주 7,170톤, 중국 78,930톤, 유럽 151,137톤, 미국 122,780톤, 캐나다 8,770톤의 미세플라스틱이 토양으로 들어가는 것으로 추정된다[28]. 결과적으로 플라스틱이 포함된 슬러지를 비료로 사용하게 되면 토양에 미세플라스틱이 축적되고 이는 토양의 미세플라스틱 오염을 유발한다(Fig. 4).
2.1.1.3. 관개
농사 시 농작물에 대한 물 수요는 강수량만으로 충족되지 않기 때문에 인위적으로 토양에 물을 공급하는 작업이 필수적이다. 이때 필요한 양만큼의 물을 대주는 작업을 관개라 하며 주로 하천, 호수, 저수지, 지하수 등의 물을 사용한다[29]. 하수 처리 과정에서 제거되지 않은 마이크로 비드나 미세 섬유 등과 같은 미세플라스틱이 방류수와 함께 배출되면 주변의 지표수나 지하수를 오염시키고[30], 미세플라스틱으로 오염된 지표수 또는 지하수를 관개에 사용하게 되면 물에 포함된 미세플라스틱이 토양으로 흘러 들어가게 된다(Fig. 4)[31]. 개발도상국의 경우 물 부족 현상이 극심해지면서 깨끗이 정화되지 않은 하수 및 폐수를 관개에 사용하는 일이 빈번하게 발생하고 있다[32]. 실제 스페인 푸에르테벤투라 섬(Fuerteventura Island)에 위치한 Pozo Negro 농장을 조사한 결과, 재활용 폐수를 관개에 사용한 토양에서 총 238.3±478.1 particles/kg의 미세플라스틱이 검출되었다[33]. 토양에서 검출된 미세플라스틱은 모두 310-4,069 μm 크기의 섬유 형태로 관개에 사용한 재활용 폐수에 존재하는 미세플라스틱과 일치했다[33]. 이는 플라스틱으로 오염된 물을 농사에 사용함으로써 토양에 미세플라스틱이 축적되고 토양의 미세플라스틱 오염을 유발하였음을 시사한다.
2.2. 대기환경
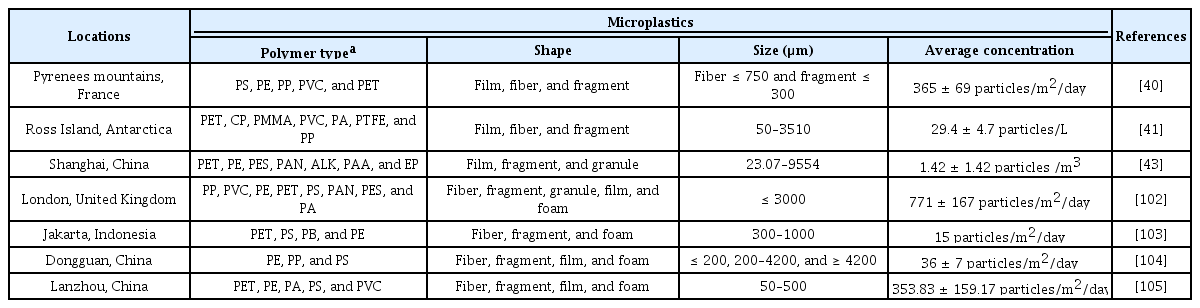
최근 미세플라스틱에 관한 연구가 활발히 진행되고 있으나 대부분은 수생환경과 관련된 것으로 대기 속 미세플라스틱 연구는 상대적으로 저조하다 [34,35]. 2015년 대기 미세플라스틱에 대한 첫 모니터링 이후 대기 중에 미세플라스틱이 존재한다는 사실이 확인되었다[36]. 대기 중에 떠다니는 입자성 물질(예, 미세먼지)과 유사하게 미세플라스틱 또한 대기 중에서 상승, 하강 등의 움직임을 보이는데[36], 미세플라스틱은 작은 크기와 낮은 밀도로 바람을 통해 장거리로 이동할 수 있다[37,38]. 실제로 미세플라스틱은 도시, 교외 뿐 아니라 오지에서도 발견되고 있다(Table 1)[39]. 플라스틱 주사용지가 아닌 외딴 지역에서도 미세플라스틱이 발견되는 것은 미세플라스틱이 대기를 통해 전 세계로 이동할 수 있음을 의미한다[39]. 최근 발표된 연구에 따르면 산업활동이 일어나지 않는 피레네 산맥(프랑스)에서도 미세플라스틱이 검출되었다(Table 1) [40]. 5개월의 모니터링 기간 동안 섬유, 필름, 조각 형태의 플라스틱이 발견되었으며, 폴리스타이렌이 전체 미세플라스틱의 50%를 차지했고 평균 퇴적 미세플라스틱은 365±69 particles/day/m2 이었다[40]. 극한 환경조건으로 인간 활동이 거의 없다고 여겨지는 남극에서도 미세플라스틱이 발견되었다[41]. 로스 섬(Ross Island, 남극) 표면 눈을 분석한 결과 폴리스타이렌, 폴리에틸렌 테레프탈레이트, 폴리에틸렌, 폴리프로필렌 등이 검출되었고, 79%가 폴리에틸렌 테레프탈레이트로 주로 섬유나 조각 형태를 보였다(Table 1) [41]. 이는 대기 중에 다양한 종류, 형태, 크기를 갖는 미세플라스틱이 존재하며 기상 현상에 의해 장거리 이동이 가능함을 의미한다[40].
2.2.1. 미세플라스틱이 대기환경으로 유입되는 과정
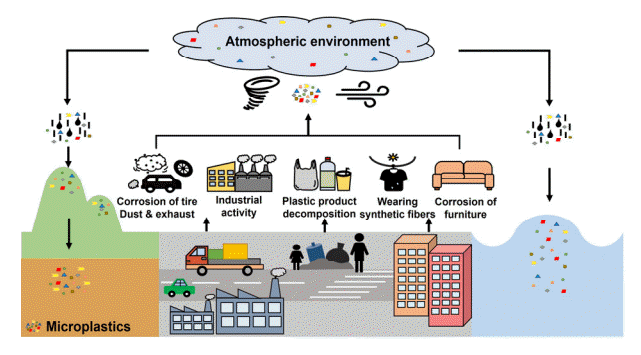
대기에서 발견되는 미세플라스틱의 종류는 대부분 폴리에스터(polyester, PES), 폴리에틸렌, 폴리프로필렌으로 나타났다[38]. 미세플라스틱은 플라스틱 제품의 분해, 합성 섬유의 마모, 합성 고무 타이어의 부식, 가구, 도시 먼지, 하수 슬러지, 건설 자재, 매립지, 폐기물 소각 등을 통해 대기로 유입된다(Fig. 5) [35,37,42,43]. 대기 중 미세플라스틱의 주된 유입은 합성 섬유에 의한 것으로[37] 옷이나 침구 등을 야외 햇빛에서 말릴 때 합성 섬유가 대기 중으로 유입된다[43]. 자외선에 노출된 합성 섬유는 미세 섬유(microfiber)로 분해되어[44] 대기 중 미세플라스틱의 농도를 증가시킨다[37]. 그밖에 기상환경은 미세플라스틱의 거동에 영향을 주는 중요한 매개체로 간주된다[39]. 폭풍은 거리의 먼지나 쓰레기 처리장의 미세플라스틱을 대기로 이동시킬 수 있다[45]. 즉, 다양한 경로에서 생성된 미세플라스틱이 바람, 강우 등의 기상환경을 통해 대기로 유입되는 것이다(Fig. 5).
2.3. 수생환경
미세플라스틱은 바다, 해안, 강 등 다양한 수생환경에서 검출되고 있다[46]. 우리나라의 경우, 진해만에서 1 L 당 33-38개의 미세플라스틱 입자가 발견되었다[47]. 미세플라스틱은 해양과 담수환경에서 점점 더 많이 검출되고 있으며, 이에 따라 미세플라스틱의 수생생물군 또는 인체에 미칠 잠재적 영향에 대한 우려가 커지고 있다[48].
2.3.1. 미세플라스틱이 수생환경으로 유입되는 과정
수생환경에서 발견되는 미세플라스틱은 주로 폴리프로필렌, 폴리에틸렌, 폴리염화비닐, 폴리스타이렌으로[49] 특히 인구밀도가 높은 지역과 도심에 인접한 지역에서 많이 발견되고 있는데[50], 현재 생성된 플라스틱의 10%가 매년 해양으로 유입되는 것으로 추정된다[51]. 플라스틱은 주로 육지에서 생성되고 사용되지만 미세플라스틱을 포함한 많은 양의 플라스틱 폐기물은 궁극적으로 수생 생태계로 유입된다(Fig. 6) [46].
2.3.1.1. 담수환경 유입 경로
1) 육지 기반의 폐기물
담수환경에 존재하는 미세플라스틱은 일회용 포장재, 합성 섬유 및 일상환경에서 유출된 플라스틱 쓰레기와 같은 거대플라스틱에서 분해된 2차 미세플라스틱이 대부분을 차지한다[4]. 육지에서 버려진 쓰레기나 폐기물 처리장에서 제대로 관리되지 않은 채 나온 플라스틱 폐기물, 수거되지 않은 농업 용품 등이 주변 도로나 강가, 들판에 버려지고[11], 버려진 플라 스틱 폐기물은 빗물이나 폭풍우 등을 통해 육상환경에서 강이나 하천 등의 담수환경으로 유입된다(Fig. 6) [52].
2) 하수 처리장
미세플라스틱은 작은 크기로 인해 수처리장에서 완전히 제거되지 않고 수생환경으로 들어가게 된다[27]. 마이크로 비드나 미세 섬유는 가정용 배수구를 통해 하수 처리장으로 이동하고 수처리 과정을 거친 후에 방류되는데, 특히 1 μm 이하 크기의 미세플라스틱은 기존 하수 처리 과정에서 완전히 제거되지 않고 최종 방류수에 잔존한다[53]. 영국 Glasgow의 하수 처리장 유입수에는 1 L 당 평균 15.70±5.23개의 미세플라스틱이 존재하며 처리가 끝난 뒤 약 98.41% 감소된 0.25±0.04개의 미세플라스틱이 존재했다[54]. 그러나 98.41%라는 높은 제거율에도 불구하고 하루에 배출되는 방류수에는 6,500만 개의 미세플라스틱이 여전히 남아있다고 한다[54]. 따라서, 하수 처리장은 미세플라스틱이 수생환경으로 유입되는 주된 경로라 할 수 있다(Fig. 6).
2.3.1.2. 해양환경 유입 경로
1) 선박 운송 및 관광
선박에서 버려진 플라스틱 폐기물은 해양 미세플라스틱 유입의 큰 부분을 차지한다[55]. 2005년에는 약 500만 톤의 플라스틱 폐기물이 선박 운송 과정 중 해양에 유입되었다[56]. 선박표면의 페인트는 바다의 파도나 자외선에 의해 미세플라스틱으로 잘게 쪼개지는데[57], 웨들해(Weddell Sea)에서 채집한 바닷물에서 검출된 미세플라스틱의 51.2%는 선박 페인트에서 유래된 것으로 밝혀졌다[58]. 또한, 관광 산업도 플라스틱 폐기물의 수생 생태계 유입에 기여한다. 관광객들의 가방, 병, 음식 포장 봉투 등 많은 플라스틱 제품이 해안이나 해변, 바다로 버려지고[55,59], 햇빛, 온도 변화, 해수에 의한 침식은 플라스틱 제품을 미세플라스틱으로 분해하여 궁극적으로 해양환경으로 유입시킨다(Fig. 6) [56].
2) 산업 활동
플라스틱 제품은 어업이나 양식 활동에 있어 필수적으로[56] 해양에 존재하는 미세플라스틱의 약 18%는 어업이나 양식 활동을 통해 유입된다(Fig. 6) [60]. 어망, 낚싯줄, 양동이와 같은 대부분의 낚시도구는 주로 폴리스타이렌, 폴리염화비닐, 고밀도 폴리에틸렌(high-density polyethylene, HDPE), 폴리프로필렌, 나일론(nylon)의 플라스틱으로 만들어지거나 이러한 플라스틱 성분을 포함하고 있다[61]. 노르웨이의 상업적 어업활동 지역에서는 2016년 4,000 톤 이상의 낚시 도구들이 분실되거나 버려졌다[62]. 양식 활동에서도 어망, 끈, 부 표 등의 플라스틱 제품이 사용되며[56] 이들은 장시간 물속에 있으면서 침식, 마모, 충돌 등의 과정을 통해 미세플라스틱을 생성한다[56].
3. 미세플라스틱이 생물에게 미치는 영향
3.1. 동물
3.1.1. 산화 스트레스 및 염증 유발
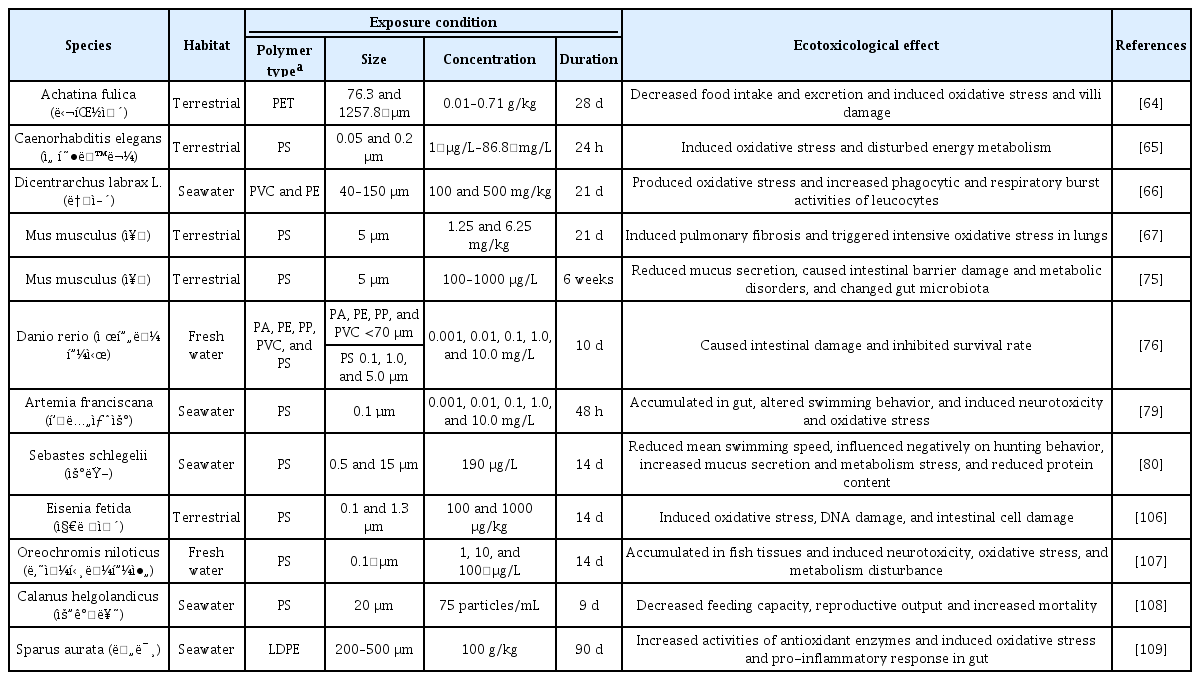
미세플라스틱은 육상 및 수환경에 존재하는 다양한 동물에게 영향을 미친다고 알려져 있는데[63], 첫번째로, 동물들이 먹이를 섭취하는 과정에서 먹이와 함께 들어온 미세플라스틱은 체내에 축적되면서 세포의 산화 스트레스를 유발한다[63]. 토양 속 달팽이(Achatina fulica)에 0.71 g/kg의 폴리에틸렌 테레프탈레이트 미세섬유를 섭취시켰을 때, 항산화제의 일종인 글루타티온(glutathione)의 양과 총 항산화량(total antioxidant capacity, T-AOC)이 감소하였다(Table 2) [64]. 이는 미세플라스틱이 달팽이에게 스트레스로 작용해 체내 항산화 작용을 억제했음을 의미한다[64]. 이와 유사하게 토양에 서식하는 선형동물(Caenorhabditis elegans)에 0.05 μm 크기의 폴리스타이렌을 86.6 mg/L의 농도로 24시간 노출시켰을 때, 세포 내 활성산소종(reactive oxygen species, ROS) 수준이 대조군에 비해 유의미하게 증가하였다(Table 2) [65]. 해양에 서식하는 농어(Dicentrarchus labrax L.)에 40-150 μm 크기의 폴리에틸렌을 100, 500 mg/kg의 농도로 90일간 섭취시켰을 때, 항산화 효소인 슈퍼옥시드 디스무타아제(superoxide dismutase, SOD)와 과산화수소분해효소(catalase, CAT)의 활성이 대조군 대비 감소하였다(Table 2) [66]. 또한, 6.25 mg/kg 농도의 폴리스타이렌 현탁액을 쥐의 기도 내로 투약한 결과, 항산화 작용을 하는 슈퍼옥시드 디스무타아제와 글루타티온 과산화효소(glutathione peroxidase, GSH-px)의 발현이 감소했으며 이는 쥐의 폐에서 심각한 산화 스트레스가 유발되었음을 의미한다[67]. 결과적으로 미세플라스틱이 항산화 효소 활성을 억제함으로써 활성산소종과 항산화 작용 사이에 불균형을 일으키고, 동물의 산화 스트레스를 유발한 것으로 보인다[68].
3.1.2. 장 손상 및 섭식 장애
두번째로, 미세플라스틱은 동물의 장내 면역 시스템을 교란하고 섭식 장애를 일으키며 비정상적인 유전자 발현을 유도하는 것으로 알려져 있다[69]. 생물들은 체내로 들어간 미세플라스틱 조각에 의해 포만감을 느끼고 식욕이 저하되는데[70,71], 식욕 저하로 인해 지속적인 섭식이 불가능해지면 체중 감소, 성장 억제, 이동성 감소, 생식 기관 손상, 생존율 감소 등의 문제가 발생한다[71-74]. 더불어 체내에 축적된 미세플라스틱은 소화관을 막아 장 폐색, 융모 균열, 장 세포 분열 등의 장 손상을 일으키기도 한다[74]. 100, 1000 μg/L 폴리스타이렌을 쥐에게 투여한 결과 점액 분비와 관련된 Muc1, Muc2, Klf4, Retnlb 유전자의 mRNA 발현 양이 감소하였다(Table 2) [75]. 점액 생성 감소는 장벽 보호의 기능을 떨어뜨려 감염 또는 질병 발생 확률을 높일 수 있음을 시사한다[75]. 담수 생물인 제브라 피시(Danio rerio)에 70 μm 이하 크기의 폴리아마이드(polyamide, PA), 폴리에틸렌, 폴리프로필렌, 폴리염화비닐 1 mg/L를 노출하였을 때 제브라 피시의 73.3-86.7%에서 심각한 장 손상이 관찰되었다[76]. 제브라 피시의 장 속에 존재하는 미세플라스틱은 장 염증을 유발하고 장내 미생물 다양성을 변화시켜 장내 미생물 불균형을 초래하였다[77]. 상업적으로 이용되는 해양 생물을 대상으로 한 연구에서, 15 μm 폴리스타이렌 190 μg/L를 우럭(Sebastes schlegelii)에게 14일간 노출했을 때 우럭의 담즙 색이 검게 변하고 간이 충혈되었으며 장의 내강이 확장된 것을 확인할 수 있었다(Table 2).
3.1.3. 행동패턴 변화
세번째로, 미세플라스틱은 수생 생물에 스트레스를 유발해 행동 패턴에 변화를 주기도 한다(Table 2) [74,78]. Gambardella et al. (2017)에 따르면 0.1 μm 폴리스타이렌에 노출된 아르테미아 프란시스카나(Artemia franciscana)의 수영 속도가 20% 가량 감소했다는 보고가 있다[79]. 또한 앞서 언급한 해양 생물인 우럭(Sebastes schlegelii)에게도 다양한 행동변화가 관찰되었는데[80], 0.5와 1.5 μm 크기의 폴리스타이렌에 노출된 우럭들은 개체 간의 공간 유지 거리가 줄었으며 15 μm 크기의 폴리스타이렌에 노출된 우럭은 수영속도가 감소하고 움직이는 범위가 줄어들었다(Table 2) [80]. 이러한 결과는 아가미 또는 피부 표면에 부착된 미세플라스틱이 호흡 스트레스를 유발해 우럭의 행동에 영향을 미친 것으로 추측된다[80]. 이처럼 미세플라스틱에 의한 행동 패턴 변화는 수생 동물들의 먹이 활동과 포식자를 피하는 능력을 감소시켜 번식 능력 감소 및 사망률 증가 등의 결과를 초래한다[74].
3.2. 식물
3.2.1. 발아 저하 및 뿌리 손상
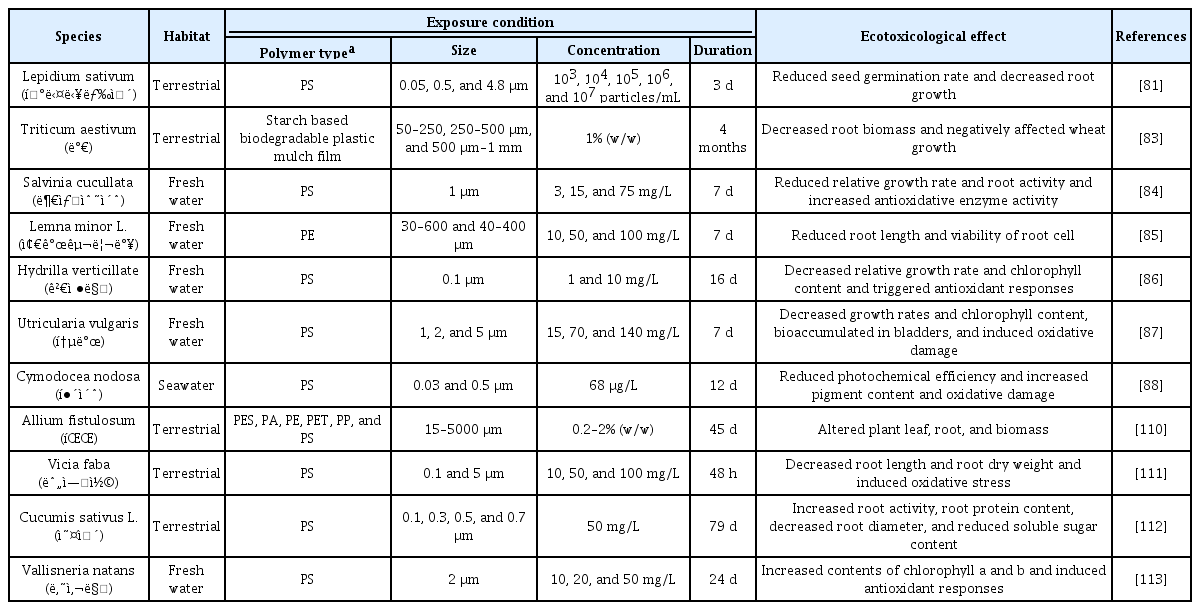
미세플라스틱은 식물 발아 저하, 생장 억제, 수확량 감소, 뿌리 변형 등의 문제를 일으키는데, 미세플라스틱이 식물 뿌리 근처에 축적되면 식물 뿌리의 물 흡수와 영양분 교환이 방해된다[81,82]. 실제로 산과 들에 서식하는 큰다닥냉이(Lepidium Sativum L.)에 4.8 μm 폴리스타이렌을 처리한 결과 폴리스타이렌이 씨앗의 바깥 껍질과 발아한 식물의 뿌리털 주위에 축적되었고(Table 3) [81], 이로 인해 식물이 물을 원활하게 흡수하지 못하면서 씨앗 발아가 저하되었다[81]. 0.05, 0.5, 4.8 μm 폴리스타이렌 107 particles/mL를 큰다닥냉이에 노출시켰을 때, 씨앗 발아율이 각각 56, 46, 21% 수준으로 떨어졌고, 이는 미세플라스틱의 크기가 클수록 씨앗 껍질에 많이 축적되어 발아가 저하되었기 때문으로 보인다[81]. 1 mm 이하의 생분해 플라스틱을 밀(Triticum aestivum)에 처리한 결과 식물 길이가 감소하였으며 밀의 수확 시기가 2주 지연되었다[83]. 또한, 밀 열매 양과 뿌리 생체량도 감소하였다(Table 3) [83]. 담수에 서식하는 부상수초(Salvinia cucullate)에 1 μm 폴리스타이렌 15, 75 mg/L를 노출했을 때 부상수초의 성장 속도가 감소했으며 활성산소종의 수준이 증가하였다(Table 3) [84]. 3, 15, 75 mg/L의 폴리스타이렌을 처리한 부상수초의 경우 모든 농도조건에서 뿌리 활동이 감소하고 항산화효소의 활성이 증가하였는데[84], 수초의 항산화효소 활성 증가는 미세플라스틱이 유발한 스트레스에 대한 방어작용으로 해석된다[84]. 또 다른 담수 식물인 개구리밥(Lemna minor L.)에 30-600 μm 폴리에틸렌 10, 50, 100 mg/L를 처리한 결과, 모든 농도에서 개구리밥의 뿌리 길이가 감소하고 뿌리가 손상되었다(Table 3) [85]. 이러한 결과들은 미세플라스틱이 식물의 발아에서부터 생장 및 수확에 이르기까지 식물의 전 과정에 영향을 줄 수 있음을 의미한다.
3.2.2. 엽록소 양 변화 및 광합성 효율 감소
미세플라스틱은 종류와 크기, 농도에 따라 식물 엽록소 양과 광합성 효율에 영향을 미치는 것으로 알려져 있는데, (Table 3) 담수 식물인 검정말(Hydrilla verticillate)에 0.1 μm 폴리스타이렌 10 mg/L를 8일 동안 노출한 결과, 광합성 효율이 대조군에 비해 4.28% 감소하였다(Table 3) [86]. 1 mg/L의 폴리스타이렌에 16일 동안 노출된 검정말 또한 엽록소 양이 감소했는데 이는 미세플라스틱이 엽록체를 파괴하거나 엽록소 합성을 저해해 나타난 결과로 추측된다[86]. 다른 예로, 뿌리가 없는 담수 식물인 통발(Utricularia vulgaris)에 1, 2, 5 μm 폴리스타이렌을 15, 70, 140 mg/mL의 농도로 7일동안 노출시켰을 때, 폴리스타이렌 농도가 높아질수록 엽록소 a와 엽록소 b의 양이 감소했다(Table 3) [87]. 이는 높은 농도의 미세플라스틱이 통발의 잎과 주머니에 흡착 및 축적되어 광합성 색소의 조성을 변화시킴으로써 엽록소 양의 감소를 유발한 것으로 보인다[87]. 해양에 서식하는 식물인 해초(Cymodocea nodosa)의 경우, 0.5 μm 크기의 폴리스타이렌을 2일 노출시켰을 때, 광합성 효율은 감소하였고 전체 엽록소의 양은 증가하였다[88]. 미세플라스틱이 수생 식물에 미치는 영향은 대부분 담수에 서식하는 식물에 집중되어 있다[89]. 해양에 서식하는 해조류와 해초 등의 표면에도 미세플라스틱이 존재한다는 보고가 있으나 미세플라스틱이 해양 식물에 미치는 영향에 관한 연구는 상대적으로 부족하며 이에 관한 연구를 지속적으로 수행할 필요가 있다[89-91].
3.3. 미생물
3.3.1. 생리학적·생화학적 특성 변화
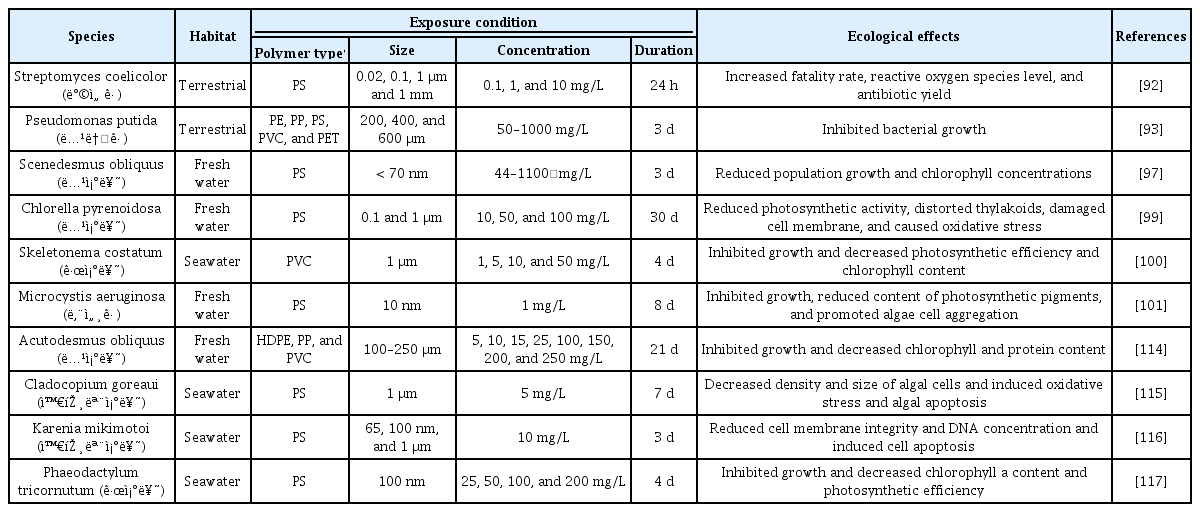
미세플라스틱은 미생물의 생존율과 생리학적, 생화학적 특성에도 영향을 끼친다고 알려져 있다[92]. 방선균의 일종인 Streptomyces coelicolor에 20 nm의 폴리스타이렌을 10 mg/L의 농도로 노출시킨 결과, 미생물의 생존율은 35.2%로 감소하였으며 활성산소종의 수준이 대조군 대비 2.7배 증가하였다(Table 4) [92]. 활성산소종의 증가는 세포 손상을 일으키고 세포 막 투과성을 변화시킨다고 알려져 있다[92]. Streptomyces coelicolor가 분비하는 항생물질인 actinorhodin과 undecylprodigiosin의 양은 각각 최대 6.7, 5.3 mg/L로 대조군에 비해 5.4, 3.6배 증가하였는데[92], 이는 미세플라스틱으로 발생된 세포 손상을 견디기 위한 것으로 추정된다[92]. 토양 세균인 녹농균(Pseudomonas putida)에 200 μm 폴리에틸렌, 폴리스타이렌, 폴리염화비닐 1000 mg/L를 처리했을 때 균 생장이 각각 12.35, 14.74, 11.89% 감소하였다(Table 4) [93]. 그 밖에, 담수에 서식하는 녹조류인 Chlorella vulgaris에 20 nm 폴리스타이렌을 250 mg/L의 농도로 노출시킨 결과, 젖산 탈수소효소(lactate dehydrogenase, LDH)의 농도가 대조군에 비해 유의하게 증가하였다[94]. 젖산탈수소효소는 일반적으로 세포 내 일정한 수준으로 존재하다가 세포막이 손상되었을 때 급격히 방출된다고 알려져 있다[95]. 미세플라스틱이 녹조류의 세포막에 심각한 손상을 가해 젖산 탈수소효소의 농도가 증가한 것으로 추정된다[94].
3.3.2. 미생물 성장 및 광합성 저해
여러 경로를 통해 수생 환경으로 유입된 미세플라스틱은 미세조류 및 남세균과 상호작용하면서 미생물의 성장과 광합성에 영향을 미친다[96-98]. 담수에 서식하는 녹조류인 Chlorella pyrenoidosa에 0.1과 1 μm 폴리스타이렌 100 mg/L를 노출했을 때 녹조류의 성장이 각각 38.5, 38.1% 감소되었고 광합성 효율 또한 폴리스타이렌을 처리하지 않았을 때에 비해 각각 93.5, 90.4% 수준으로 줄어들었다(Table 4) [99]. 해양에 서식하는 규조류인 Skeletonema costatum에 평균 직경이 1 μm인 폴리염화비닐을 1, 5, 10, 50 mg/L의 농도로 4일간 노출시켰을 때, 처리 농도가 높을수록 규조류의 밀도가 감소한다는 사실을 확인했다(Table 4) [100]. 더불어 50 mg/L의 농도에서 최대 성장 저해율(inhibition ratio, IR)이 39.7%로 가장 높게 나타났으며 엽록소의 양과 광합성 효율 또한 대조군에 비해 각각 20, 32% 감소했다[100]. 담수에 서식하는 남세균인 Microcystis aeruginosa에 10 nm 폴리스타이렌 1 mg/L를 노출했을 때 남 세균의 성장이 억제되고 엽록소의 양이 감소하였고, 폴리스타이렌과 남세균이 결합해 응집체를 형성한 모습이 관찰되었다 (Table 4) [101].
4. 결 론
미세플라스틱에 대한 대중의 관심이 높아짐에 따라 미세플라스틱의 잠재적 위험성에 대한 관심도 증가하고 있다. 다양한 종류의 미세플라스틱은 인간 활동을 통해 생성되며 육상, 대기, 수생환경을 순환하며 존재하고 있다. 미세플라스틱에 관한 연구는 수생환경에 집중되어 있으며 대기에 미세플라스틱이 존재한다는 것이 밝혀진 이후부터 미세플라스틱의 거동에 대한 관심이 증가하고 있지만 관련 연구는 여전히 부족한 실정이다.
미세플라스틱이 생물에게 미치는 영향은 동물을 대상으로 가장 많이 진행되었으며 미생물에 관한 연구는 상대적으로 저조하다. 또한, 미세플라스틱이 생태계에 미치는 영향은 대부분 단일 생물을 대상으로 수행되었다. 그러나 실제 생태계에는 다양한 생물이 존재하며 서로 간의 상호작용을 통해 살아간다. 따라서, 여러 종류의 생물이 존재할 때 미세플라스틱과 어떻게 상호작용하는 지에 관한 연구가 필요하다. 미세플라스틱은 동물, 식물, 미생물 뿐 아니라 인간에게도 부정적인 영향을 끼칠 가능성이 높다. 생물들이 섭취한 미세플라스틱은 대부분 몸 밖으로 쉽게 배출되지 못하고 체내에 축적되기 때문에 먹이사슬을 통해 상위 단계로 이동되어, 먹이사슬의 최상위층인 인간에게도 전달될 가능성이 높다. 그러나 미세플라스틱이 먹이사슬을 통해 인체로 전달되는 방법과 미치는 영향에 관한 구체적인 연구는 현재 부족한 실정으로 이에 대한 연구가 필요하다. 본 논문은 미세플라스틱의 유입경로와 생물에 미치는 영향의 기본 정보를 제공하고 있고 이는 미세플라스틱의 생태 거동을 이해하는데 도움을 줄 것으로 기대된다.
Acknowledgements
본 연구는 2021학년도 부산대학교 4단계 BK21 대학원혁신지원사업과 한국연구재단 중견연구자지원사업(NRF-2019R1A2C1088541)의 지원으로 수행되었다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.