궁극의 그린수소 생산을 위한 미생물 전기분해 전지 기술의 동향과 전망
Trends and perspectives of microbial electrolysis cell technology for ultimate green hydrogen production
Article information
Abstract
현재 그레이 수소나 블루 수소가 재생 에너지로 널리 인식되고 있으나, 실상은 모두 화석연료로 만들어지고 있다. 수소기반사회의 달성을 위해 가장 핵심적인 과제는 바로 시장 경제성 있는 그린 수소 생산 기술의 개발이다. 미생물 전기분해 전지(MEC)은 친환경 자원인 유기성 하폐수를 처리함과 동시에 궁극의 그린 수소를 생산하는 차세대 에너지 생산형 하폐수처리 기술이다. MFC의 수소 생산을 위해, MEC에 전기 에너지의 투입이 필요하다. 하지만, 그 에너지는 MEC에서 생산되는 에너지로 모두 충당된다. 그러므로 MEC의 수소는 궁극의 그린 수소로 정의될 수 있다. 본 총설 논문은 MEC 기술의 원리와 타당성, MEC의 구성과 형태, 전극 재료, 다양한 하폐수 성상에 따른 실제 적용 사례에 대해서 심층적인 요약과 분석을 담고 있다. 더 나아가 파일럿 규모에서 다른 환경 시스템과의 결합성 및 확장성을 검토하였다. 이를 바탕으로 MEC의 기술적 한계를 진단하였고 MEC 기술 실용화를 위한 향후 연구 방향을 제안하였다.
Trans Abstract
Currently, gray hydrogen and blue hydrogen are widely recognized as renewable energy, but in reality, they are made from fossil fuels. The most important task to achieve the hydrogen-based society is the development of economic green hydrogen production technology. Microbial electrolysis cell (MEC) is a next-generation energy-producing wastewater treatment technology that treats renewable organic wastewater and simultaneously produces the ultimate green hydrogen. For hydrogen production in MFC, it is necessary to input electrical energy into MEC. However, that energy is all covered by the energy produced by the MEC. Therefore, hydrogen production in MEC can be defined as the ultimate green hydrogen. This review contains an in-depth summary and analysis of the principles and feasibility of MEC technology, the composition and shape of MEC, electrode materials, and practical application cases in various types of wastewaters. Furthermore, compatibility and scalability with other environmental systems were reviewed at the pilot scale. Based on this, the technical limitations of MEC were diagnosed and future research directions for the practical application of MEC technology were suggested.
1. 서 론
급격한 에너지와 기후 위기가 심화되는 가운데, 세계 에너지 소비의 70% 이상은 여전히 지속 불가능한 화석연료(천연 가스, 석유, 석탄, 셰일오일)에 의존하고 있다[1]. 바이오매스가 연소될 때 이산화탄소가 배출되지만 바이오매스는 지구의 최근의 탄소로부터 만들어졌으므로 탄소중립으로 분류되고 있다. 하지만 화석연료 연소시 발생하는 탄소는 지구의 내부에 아주 오랜 시간 저장된 탄소에 비롯한다. 그러므로 현재의 대기중 이산화탄소 농도를 높여 지구온난화를 가속화시킬 수 있는 것이다.
에너지 자원만큼이나 인류의 생활에 필요한 필수적인 요소는 물 자원이다. 전 세계 약 80억 명 이상이 사는 지구상에는 엄청난 양의 유기성 폐수가 날마다 버려지는데, 한국만 하더라도 버려지는 폐수 속에는 6.5 GW 수준의 에너지를 함유하고 있다. 이 폐수를 처리하기 위해 한국의 폐수처리장에서는 0.6 GW의 에너지를 사용한다. 폐수를 최소 40%의 에너지 효율로 에너지화 한다면 3.2 GW를 회수하여 폐수처리 시설의 완전한 에너지 자립을 달성하고도 남는다[2]. 결국 폐수는 더 이상 단순한 폐기물이 아닌 지속적으로 공급되는 바이오매스 자원으로 인식의 전환이 이루어지고 있다. 에너지가 함유된 폐수로부터 재생에너지를 생산하며 수처리를 한다면, 이것이 진정 궁극의 물-에너지 연계(Water-energy nexus) 기술일 것이다.
수소 가스는 화석연료에 대한 미래의 대안으로 여겨지고 있다. 수소 에너지는 넓은 우주에 많은 양이 존재한다. 수소 가스는 144 MJ/Kg 수준의 높은 발열량을 가지고 있고, 수소가 연소되면 수증기만 생성되기 때문에, 깨끗하고 지속 가능한 에너지원으로 여겨지고 있다[3,4]. 하지만 에너지가 저장된 형태인 수소 가스는 이수소(dihydrogen, H2)로서, 매우 작고 가볍고 자연계에서 쉽게 산화되어 지구상에는 자연계에 극히 미량으로 존재한다. 수소 가스의 이런 특성으로 인해, 대기압의 약 700배에 해당하는 압력으로 저장 및 운반해야 하는 어려움이 있다[5].
현재 가장 대중적인 수소 에너지원은 부생수소이다. 부생수소는 공업의 공정의 부산물로서 생산되는 수소를 말한다. 부산물이므로 반드시 정제를 해야 사용할 수 있는 폐가스이다. 부생수소의 에너지원은 기존 화석연료로서, 화석연료로부터 수소에너지를 생산할 경우 1 kg의 수소 당 약 4-19 kg의 이산화탄소를 발생시킨다[2]. 또한 그 양이 미미하여 궁극적인 수소 사회의 대안이 될 수 없다. 상업용 수소는 대부분 수전해에 의해 생산되는데, 수전해에 쓰이는 전기 또한 현재 대부분 화석연료에 의해 생산된다.
유럽연합(EU)에서는 수소 생산 방식에 따라 Green 수소, Grey 수소, Blue 수소로 구분하여 수소에너지의 친환경성을 인증한다. Green 수소는 재생에너지에서 생성된 전기로 물을 전기분해하여 생산되는 수소이며, 가장 친환경적인 수소이다. Grey 수소는 천연가스나 석탄과 같은 화석연료를 증기로 개질하여 생산된 수소이다. 또한 물의 전기분해를 위해 화석연료 및 재생 불가능한 에너지원의 전기를 사용하여 생성된 수소이다. Blue 수소는 천연가스와 이산화탄소 포집설비를 이용해 생산한 수소로, 수소 생산 과정에서 Grey 수소처럼 이산화탄소를 배출하지만, 발생한 이산화탄소를 포집 및 저장하여 탄소배출을 줄인 방식이다. 결국, 한국에서 현재에 널리 쓰이는 수소 가스는 대부분 Grey 수소라 할 수 있다[6].
미생물 전기분해 전지(Microbial electrolysis cell, MEC)는 하폐수의 유기물을 제거함과 동시에 바이오가스를 생성하는 차세대 에너지 생산형 폐수처리 시스템이다[7-12]. 산화전극(anode)에서는 전자를 체외로 방출하는 전자방출균이 유기물을 산화하여 전자를 전극 표면으로 방출하고[13-17], 환원전극(cathode)에서는 방출된 전자와 양이온이 반응하여 수소가스를 생성한다. 해당 반응은 비자발적이라 외부 전력 공급을 필요로 하지만, 최대 400% 수준에 달하는 높은 에너지효율[18]을 갖는다. MEC에서 생성된 전기 에너지로 MEC에 공급하는 전기 에너지를 모두 충당할 수 있기에, MEC는 궁극의 그린 수소 에너지 생산 기술이라 할 수 있다[6]. 현시점에서 매우 중요하게 개발되어야할 재생에너지 생산 기술이자 하폐수처리 기술임에 틀림없다[19-23].
이런 배경에서, 본 총설에서는 MEC의 기본적인 메커니즘과 주요 구성요소 및 시스템 적용 사례에 대해 조사하였다. 이를 통해 MEC 기술의 가능성과 한계, 그리고 기술의 발전을 위한 연구 방향들을 제시하였고, MEC 기술의 최종 목표인 산업 규모의 시스템 발전을 위한 국내 기술의 발전 단계를 평가했다.
2. MEC 메커니즘과 열역학
2.1. MEC 매커니즘
MEC의 산화전극 표면에 부착된 전자방출균 (exoelectrogen)은 하폐수의 유기물을 산화하여 전자(e-)와 양성자(H+)를 형성한다[24-29]. 이는 MFC의 산화전극과 동일한 기작이지만 방출된 전자는 미생물연료전지 (Microbial fuel cell, MFC)와 같이 전기를 생성하지 않고[30], 환원전극 표면에서 양성자와 결합하여 최종 생성물로 수소가스를 생성한다.
산화전극과 환원전극에서 발생하는 전기화학적 반응은 다음 식(Eq. 1)으로 설명할 수 있다[31-33].
Anode oxidation reaction:
Cathode hydrogen evolution:
Overall reaction:
여기서, 아세테이트는 기질로 사용되었다. 이 반응에서 셀 전압은 음의 값(-0.114 V)이기 때문에 비자발적 반응이다. 따라서 MEC 시스템은 수소 생산을 위해 자발적으로 반응을 수행하기 위해 추가로 전압을 인가해야 한다. 인가전압은 Nernst 방정식(Eq.2, 3)으로 계산할 수 있다.
아세테이트 산화반응에 있어 산화전극 전위(Ean)는 다음과 같이 계산된다.
여기서
수소 생산을 위한 환원전극 전위(Ecat)는 다음과 같다.
여기서
MEC 셀전압 (Ecell)에 대한 방정식은 다음과 같다[35].
따라서 MEC에서 수소 가스를 생성하는데 필요한 셀전압(Ecell)은 이론상 0.114 V이다. 결국 환원전극에서 수소생성반응 (Hydrogen evolution reaction, HER)을 유도하기위해 0.114 V보다 높은 전위가 인가 되어야한다. 하지만 MEC 반응기 구성, 박테리아 활성, 전극 특성, 교환막 선택 및 폐수 용액의 유기 기질 농도와 같은 MEC 시스템의 다양한 조건 때문에 이론값 보다 높은 0.4 – 1.0 V 수준의 인가전압을 사용한다.
2.2 미생물 전기분해 vs. 물 전기분해
가장 대표적인 수소생산 기술은 물을 전기 분해하여 수소가스를 생산하는 수전해 (water electrolysis)이다. 수전해는 물분자가 산화전극에서 전기 분해되어 산소가스(O2)와 양이온(H+)과 전자(e-)가 형성되고, 환원전극에서 HER이 발생하여 수소 가스가 생산된다. 전세계적으로 수전해 시장의 규모는 2020년 기준 연간 300 MW 수준이며, 2023년 1.5-2 GW까지 증가할 것으로 예상되며, 연간 20-30억 달러 규모의 시장이 형성될 것으로 예상된다[36]. 수전해 기술은 수소생산 성능을 향상시키기 위해 고도하고 정밀한 전극기술을 필요로 하며, 수소생산을 위해 최소 1.23 V의 인가전압 및 고온의 운전 조건(40-100℃)으로 인한 에너지 소모가 크다. 또한, 산화전극에서 발생하는 산소가스로 인한 폭발의 위험성이 있어 별도의 설비를 통한 안정성을 확보해야 한다[37].
이러한 수전해 기술과 대비해 MEC는 여러 가지 측면에서 혁신적인 장점을 갖는다[2]. MEC의 산화전극에 형성된 전기적 활성을 띤 생물막은 폐수속의 유기물을 자발적으로 산화시킨다. 결과적으로, 전자와 양성자를 형성하는 생물-산화전극은 비생물적 촉매층처럼 정교한 전극을 필요로 하지 않으며, 일부 탄소 기반 재료와 같은 저렴한 전극 재료를 사용할 수 있다. 전기적 활성을 띤 생물막은 일정 기질 농도 및 조건에서 스스로 유지가 가능하여 장기간 MEC 작동이 가능한 반영구적 촉매이다[38]. 그리고 MEC의 작동을 위한 에너지원인 폐수는 늘 발생하기 때문에 별도의 기질 생산을 위한 비용이 발생하지 않는다. 또한, MEC의 수소생산을 위한 최소 전압은 0.114 V이며, 고온의 운전 조건을 필요로 하지 않기 최대 400%에 달하는 높은 에너지효율은 갖는다[18]. 마지막으로 MEC는 산소와 수소가 동시에 발생하지 않기 때문에 폭발로부터 안정적이며, 수소가스 수율에 대한 교차오염의 가능성이 낮은 안정적인 시스템이다[6].
3. MEC의 주요 구성요소
3.1. 반응기 구조
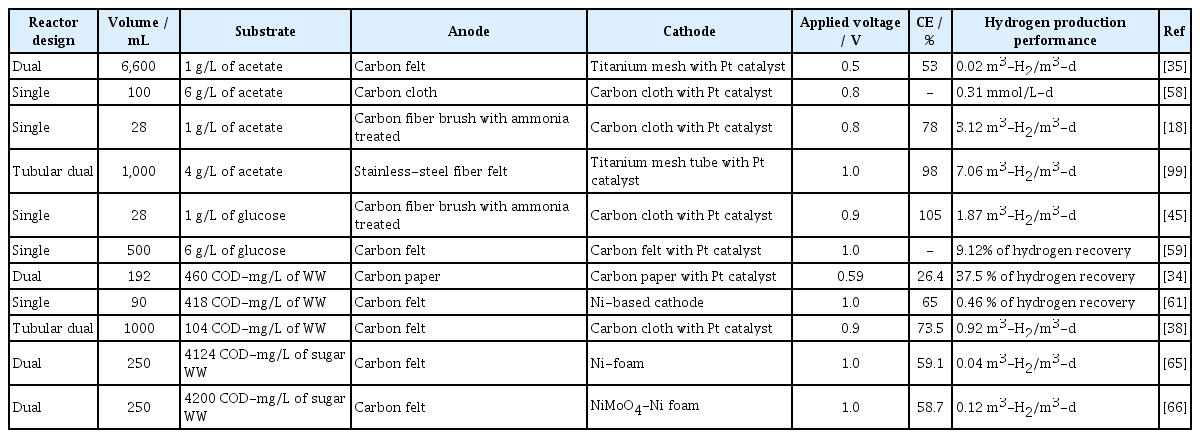
MEC의 주요 성능 지표인의 전류 밀도와 수소가스 생산 수율은 반응기의 설계에 크게 영향을 받는다. MEC 반응기는 막(membrane)의 유무에 따라 이실형(dual-chamber)과 일실형(single-chamber)으로 분류한다(Table 1) [39]. Dual-chamber는 산화전극과 환원전극을 분리함과 동시에 수소가스의 순도를 높인다[40,41].
3.1.1. 이실형 MEC (Dual-chamber MEC)
이실형 MEC는 가장 대중적으로 사용되는 반응기 형태이다[42]. 이실형 반응기는 교환막과 함께 산화전극과 환원전극을 포함하는 두 개의 챔버로 구성된다(Fig. 1). 이실형 반응기는교환막 사용으로 수소가스의 순도를 높이고, 미생물의 수소가스 재소비를 차단하여 MEC의 성능을 향상시키는 장점이 있다[43]. 다양한 유형의 교환막이 MEC에 사용되는데, 자유양성자만 통과시킬 수 있는 양성자 교환막(Proton exchange membrane, PEM) [41,44,45], 양이온을 수송하는 양이온 교환막(Cation exchange membrane, CEM), 음이온을 수송하는 음이온 교환막(Anion exchange membrane, AEM)이 사용된다. 반응기의 형태는 이중 챔버 디스크 모양[31], 직사각형 형태[46,47], H-형태[40] 및 큐브 또는 원통형[48]과 같이 다양하게 구성된다.
H-형태의 이실형 MEC 연구에서는 탄소 천 전극을 사용하고 PEM에 의해 분리된 이실형 반응기로 구성되었다. 이실형 MEC의 쿨롱효율은 78%이고, 수소생산속도는 0.37 m3-H2/m3-d를 달성했다[40]. 해당 연구는 최초의 이실형 반응기 연구라는 의미는 있었지만, 반응기에서 전극 간의 거리가 멀고, 이온 수송을 위한 막 면적이 매우 적어서(15 cm2) 효과적인 성능을 나타내지는 못했다.
최근 이실형 MEC는 카세트 형태 반응기로 구성되었다. 카세트 형태의 이실형 반응기는 전극의 작업면적(projected area)를 극대화하고, 최소 전극 분리 거리를 제공하는 장점을 보였다. 그 결과 0.7 V 인가 전압에서 0.2 m3-H2/m3-d의 최대 수소생산속도와 90%의 에너지 효율을 달성했다[49].
하지만, CEM의 사용은 양이온의 전하 이동 속도가 막을 통한 양성자(Na+, Ca+, K+ 및 NH4+)에 비해 매우 빠르기 때문에 환원전극 챔버의 pH는 증가하는 반면 산화전극 챔버의 pH 는 감소하는데, 이러한 산화전극 챔버의 산성화는 미생물 활성을 제한한다[50]. 또한 교환막은 가격이 비싸고, 미생물에 의한 파울링(fouling)으로 인한 주기적인 교체를 필요로 하기 때문에 시스템의 가격경쟁력을 낮춘다[48,51]. 그리고 교환막 사용은 시스템 내부 저항을 증가시킨다. 대표적인 교환막으로 사용되는 Nafion 막은 이실형 MEC의 내부 저항을 최대 86% 증가시켜 MEC의 성능을 제한했다[52].
3.1.2. 일실형 MEC (Single-chamber MEC)
MEC의 수소생산 성능을 개선하고 반응기 설계를 단순화하기 위해 일실형 MEC가 고안되었다[18]. MEC는 MFC와 비교할 때 시스템 내부 조건이 혐기성이므로 교환막을 제거해도 산화 전극으로 산소가 공급되지 않기 때문에 산소에 의한 시스템의 성능에는 영향이 없다. 일실형 MEC의 반응기는 입구가 넓은 유리병[51-53], 유리관[54], 큐브 형태[18] 등 이실형 반응기보다 다양한 형태의 반응기 구성이 가능하다.
교환막이 없는 일실형 MEC 설계는 암모니아 처리된 양극, 높은 표면적을 갖는 흑연 브러시 양극, 짧은 전극 거리와 같은 다양한 특성을 활용하여 최초로 제안되었다[18]. 전극 사이에 막이 없음에도 불구하고 0.3-0.8 V의 인가 전압과 7.5 mS/cm의 용액 전도도에서 MEC에서 78%-96%의 수소 회수율을 얻었고, 수소 생산 속도는 인가 전압 0.8V에서 최대 3.12 m3-H2/m3-d였다.
일실형 MEC는 교환막의 저항으로 인해 발생하는 손실을 방지하여 궁극적으로 전류 밀도와 수소 생산 속도를 증가시킬 수 있다. 교환막 제거는 내부 저항, 에너지 손실[55], 시스템 비용[18] 및 pH 구배[45] 등의 문제점 해소가 가능하고 수소 생산 및 에너지 회수율의 증가 시킨다[51]. 그러나, 일실형 MEC는 교환막이 없기 때문에 생성된 바이오가스를 산화전극의 미생물 군집이 기질로 재사용하는 현상이 발생하여 수소생산 수율을 감소시킨다[49].
3.2. 기질 (Substrate)
MEC 수소생산에 사용되는 기질은 기질의 농도, 공급 속도 및 기질 공급 유형은 반응 과정과 수소 수율을 조절하기 때문에 중요한 요소이다[48]. 특정 기질의 사용은 미생물 군집을 변화시켜 MEC의 성능을 조절한다. MEC에 사용된 아세테이트, 포도당 및 폐수 기질에 따른 최대 수소생산속도 및 쿨롱효율을 비교하였다(Table 1).
3.2.1. 아세테이트 (acetate)
아세테이트는 암 발효(dark-fermentation)의 부산물로 쉽게 생성되어 MEC에 가장 대중적으로 사용되는 기질이다. 아세테이트를 기질로 사용한 미생물막은 대표적인 전자방출균인 G.sulfurreducens의 개체수가 증가하고, 미생물의 다양성이 감소하여 전기화학 시스템에 적합한 미생물 군집구조를 갖는 것을 밝혔다[56,57]. 아세테이트를 기질로 사용한 MEC의 첫 번째 연구에서는 6.6 L의 dual-chamber 반응기에 탄소 펠트 산화전극을 사용하였고, 0.5 V의 전압을 인가했다. 그 결과 최대 0.02 m3-H2/m3-d의 속도로 수소를 생산했고, 53%의 쿨롱효율을 얻었다[35]. 고농도의 아세테이트 사용은 MEC의 성능을 향상시켰다. 6 g/L의 아세테이트를 주입하고 탄소 천 산화전극을 사용한 single-chamber 연구에서는 인가전압 0.8 V에서 0.31 mmol/L-d의 높은 수준의 수소생산 성능을 보였다[58].
3.2.2. 포도당 (Glucose)
포도당는 아세테이트와 함께 MEC의 수소생산을 위한 기질로 주로 사용된다. 실험실규모의 28 mL single-chamber 반응기에서 포도당 기질의 성능을 평가한 결과 0.9 V 인가전압에서 105%의 쿨롱효율을 얻었고, 1.87 m3-H2/m3-d의 속도로 수소를 생산했다[45]. 아세테이트와는 다르게 고농도의 포도당 사용은 MEC의 성능 향상에 효과적이지 못했다. 500 mL의 single-chamber 반응기에 6 g/L의 포도당을 기질로 주입한 연구에서는 1.0 V의 인가전압에서 9.12%의 수소효율(Hydrogen recovery)를 얻었다[59]. 포도당은 VFA(휘발성 지방산)을 생성할 수 있고, 생성된 VFA 역시 기질로 사용될 수 있다고 알려졌지만[60], 아세테이트 대비 낮은 수소생산 성능과 쿨롱효율을 개선하기 위한 추가적인 연구들이 필요하다.
3.2.3. 생활 폐수
생활 폐수를 MEC 기질로 사용하여 수질 오염을 처리하고, 수소를 생산하여 지속 가능한 시스템을 개발하는 것은 가장 실제적이고 효과적일 수 있다. 생활폐수를 기질로 사용한 초기 연구에서는 256 mL의 dual-chamber 반응기에서 회분식(batch mode)으로 작동되었다. 그 결과 초기 COD 204 mg/L, 0.59 V의 인가전압 조건에서 26.4%의 쿨롱효율을 얻었고, 37.5%의 수소효율을 보였다[34]. 회분식 운전과는 달리, 연속흐름식(continuous flow mode) 운전에서 가정용 폐수를 사용한 MEC의 성능 또한 평가되었다. 90 mL의 single-chamber 반응기는 초기 COD 3 21 mg/L, 1.0 V의 인가전압 조건에서 65%의 쿨롱효율을 보였고, 0.462 m3-H2/m3-d의 속도로 수소를 생산하였다[61]. 최신 연구에서는 가정용 폐수 기질을 사용해 73.5%의 쿨롱효율과 0.9 V의 인가 전압에서 0.92 m3-H2/m3-d의 속도로 수소를 생산함이 보고되었다[62]. 가정용 폐수와 양조장 폐수를 기질로 사용한 MEC의 미생물 군집이 비교 분석되었다[63]. 가정용 폐수를 사용한 MEC의 미생물 군집은 G.metallireducens, G.sulfurreducens, Geobacter lovleyi 및 Geobacter uraniireducens를 포함한 4개의 Geobacter 균주 그룹(군집의 52.6%)이 지배했다. 반면에 양조장 폐수를 사용한 MEC는 각각 44% 및 14%의 균주 그룹을 구성하는 G.sulfurreducens와 Roseivivax가 지배했고, 가정용 폐수에서의 미생물 군집은 Geobacter 균주 그룹의 우점종과 미생물 다양성을 가져 양조장 폐수보다 적합한 MEC 기질임을 보였다[63]. 하지만, 생활 폐수는 낮은 유기물 농도, 낮은 이온 전도도에 의해 낮은 수준의 MEC 성능을 갖기 때문에, 이를 해결하기 위해 이온전도도 향상을 위한 염 첨가, 완충용액 첨가, 전극 구조 최적화 등에 대한 후속 연구들이 수행되어야 한다.
3.2.4. 산업 폐수
설탕산업 폐수
설탕산업 폐수는 고농도의 유기물(5,000~6,000 mg/L)과 다양한 유기화합물들을 함유한다. 이러한 기질의 특징적인 조건은 MEC에 사용되기에 적합하다. 고농도의 유기물을 빠르게처리하여 시스템 성능을 극대화하기 위한 전극 개질 연구가 활발하다[64]. 서로 다른 세 종류의 cathode 재료(니켈 폼, 니켈 플레이트, 스테인리스 스틸 망)를 설탕산업 폐수를 이용해 dual-chamber MEC의 수소 생산에 가장 적합한 재료를 조사했다. 니켈 폼은 1.0 V의 인가 전압에서 1.59 mmol/L-d의 가장 빠른 속도로 수소를 생산했고, 59.1%의 쿨롱효율을 얻었다[65]. NiO·rGO와 같은 나노 물질을 Nickel 환원전극에 코팅한 연구에서는 1.0 V의 인가 전압에서 4.38 mmol/L-d의 속도로 수소를 생산하였으며, 65.6%의 쿨롱효율을 얻었다[64]. 뿐만 아니라 NiMoO4 나노 촉매를 니켈폼에 코팅한 연구에서는 초기 COD 4,200 mg/L인 설탕산업 폐수 기질을 사용하여 쿨롱효율 58.2%, 0.12 L-H2/L-d의 수소생산속도를 얻었다[66].
산업 폐수
MEC를 보다 효율적이고 지속 가능하게 만들기 위해 산업 폐수를 기질로 사용하는 MEC에 대해 많은 연구가 진행 중이다. 감자공장 폐수를 기질로 사용한 연구에서 산화전극은 탄소 섬유 브러쉬, 백금 촉매가 코팅된 cathode를 사용했고, 내부용량은 28 mL였다[56]. 감자공장 폐수는 0.9 V의 인가전압조건에서 0.74 m3-H2/m3-d 속도로 수소를 생산했다. 동일한 연구에서 유제품 분뇨를 기질로 이용하였지만, MEC의 전류가 생산되지 않는다고 보고되었다[56]. 바이오수소 생산에 적합한 산업폐수를 조사하기 위해 5개의 다른 산업 폐수가 MEC에서 사용되었다. 과일 주스, 치즈, 설탕, 종이, 증류주 처리 폐수는 400 mL의 dual-chamber MEC에서 조사되었으며, MEC에 공급되기전에 대사 활동을 촉진하기 위해 별도의 챔버에서 암 발효 (dark-fermentation)하였다[67]. 그 결과 인가전압 0.2 V에서 치즈공장 폐수가 1,609 mL-H2/g-COD의 속도로 가장 빠르게 수소를 생산하였으며 COD를 79% 제거하였다.
뿐만 아니라 메탄올이 풍부한 산업폐수와 식품 가공폐수[68] 등 다양한 유형의 기질들에 MEC에서 사용되었고, 그에 따른 수소생산속도, 쿨롱효율, 미생물 군집 변화 등이 연구되었다. 하지만 기질 농도, 성분 및 복잡한 기질의 사용이 미생물 군집, 개체군 및 종 경쟁력에 미치는 영향에 대한 추가적인 조사들이 필요하다[69].
3.3. 산화전극 재료
MEC의 산화전극 재료는 미생물전기화학 시스템에서 일반적으로 사용되는 재료와 유사하다. 이상적인 양극 재료는 넓은 표면적, 박테리아 부착 성장을 촉진하는 우수한 생체 적합성, 적절한 내부식성, 환경친화적이며 높은 전자 전도성을 가져야 한다. 일반적으로 탄소 망(Carbon mesh), 탄소 천 (Carbon cloth), 탄소 종이(Carbon paper), 탄소 펠트(Carbon felt), 탄소 막대(Carbon rod) 및 탄소 섬유 브러시(Carbon fiber brush) 등과 같은 탄소 재료가 anode 재료로 사용된다[70-72].
탄소 천은 MEC 운전 조건에서 내구성이 높아 산화전극으로 사용되었다. 탄소 천 산화전극은 최대 0.31 mmol/L-d의 속도로 수소를 생산하였지만, 다른 탄소 재료들에 비해 상대적으로 가격이 비싸다[58]. 상대적으로 탄소종이는 가격이 저렴하지만, 강성이 낮아 생물막 형성이 원활하지 않다.
탄소섬유 브러시는 탄소 섬유의 넓은 표면적, 낮은 전기 저항, 제작의 용이성 때문에 가장 대중적인 전극 재료이다[73-75]. 탄소섬유를 티타늄 막대에 꼬아 브러시 형태로 사용한 최초의 연구에서는 인가전압 0.6 V에서 1.7 m3-H2/m3-d의 최대 수소 생산속도 및 78%의 쿨롱 효율을 얻었다[76].
탄소 펠트는 3차원 구조를 갖고 있기 때문에 미생물 부착성이 뛰어나 anode 재료로 대중적으로 사용된다[77]. 하지만, 탄소 펠트는 내부의 전기적 저항이 높기 때문에 전처리를 통한 내부저항 감소가 필요하다. 최근의 탄소 펠트 연구는 전처리 된 탄소 펠트를 사용하여 쿨롱 효율 75%, 0.44 mmol/L-d의 수소 생산 속도를 얻었다[78].
탄소계열 전극 외에도 전도성, 내부식성, 다공성이 뛰어난 니켈 폼(Nickel foam), 스테인리스강 망(Stainless-steel mesh) 및 티타늄 망(titanium mesh)과 같은 금속 재료들이 산화전극으로 사용된다[18,61,76]. 하지만, 금속재료들이 단독으로 사용될 경우, 전극표면 부식에 의한 성능 저하를 유발할 수 있기 때문에, 탄소 기반 전극에 전기전도도를 향상시키는 전류포집체 역할로 사용되기도 한다[79].
3.4. 환원전극 촉매
환원전극의 지지 재료와 촉매는 MEC의 성능에 큰 영향을 미친다. 환원전극은 탄소계열이나 니켈과 같은 금속 계열이 주로 사용된다. 촉매 없이 전극 단독으로 사용될 경우 매우 낮은 HER 속도로 인해 높은 과전위(overpotential)를 필요로 하기 때문에 촉매를 이용해 과전위를 낮춰야 한다.
3.4.1. 백금 촉매 (Pt catalyst)
백금(platinum)은 HER에 대한 낮은 과전위(15 Am2 at 0.05 V)를 갖기 때문에 HER의 촉매로 자주 사용된다[46]. 28 mL의 single-chamber MEC에서 탄소천에 백금 촉매가 코팅되어 HER 촉매로 사용되었다. 그 결과 0.8 V의 인가전압에서 3.12 m3-H2/m3-d의 속도로 수소를 생산하였고, 96%의 높은 수소효율, 그리고 75%의 에너지효율을 얻었다[18]. 이처럼 백금 촉매는 HER의 이상적인 성능에 근접한 우수한 촉매이지만, 희귀 금속으로 인한 비용 문제로 인해 지속적이고 대량 사용에 제한된다[80]. 결국 MEC 시스템의 상용화를 위한 백금 촉매의 대안을 찾은 것은 중요한 일이다.
3.4.2. 니켈 촉매 (Ni catalyst)
니켈 (Nickel)은 백금 촉매에 비해 비용이 저렴하고, 지구상에 풍부하게 분포해 있으며, 높은 HER 촉매 활성을 갖는 금속촉매이다. 니켈 촉매는 분말, 폼(foam), 망(mesh), 합금 등의다양한 형태로 연구되었다[45,81]. 니켈 분말(Ni-210)을 촉매로 사용하기 위해 Nafion 접착제를 사용한 연구에서는 0.6 V의 인가전압에서 1.3 m3-H2/m3-d의 속도로 수소를 생산하여 백금촉매에 근접한 수소생산 성능을 보였다. 하지만, 고가의 Nafion 접착제를 사용하면 cathode 제작 비용이 상승하고, 내부저항이 증가하고, 내구성이 감소한다[45]. 이를 해결하기 위하여 니켈이 주성분으로 구성된 니켈 폼 자체를 환원전극으로 사용되었다. 니켈 폼은 비표면적이 높고, 전류포집체(current collector)에 니켈 입자를 직접 사용하며 고가의 접착제를 사용하지 않는 장점이 있었으며, 1.1 m3-H2/m3-d의 속도로 수소를 생산했다[82]. 하지만, 니켈 폼은 부식에 대한 안정성이 낮아 촉매의 내구성이 낮기 때문에, Ni-Mo, Ni-W, Ni-Cr 등 합금 구조를 형성해 내구성을 증가시켜 MEC 촉매로 사용된다[83].
3.4.3. 합금 촉매 (Alloy catalyst)
스테인리스강(stainless-steel)과 같은 상용화된 합금은 니켈 함량이 높고 부식에 대해 안정적이며, HER 촉매력을 효과적으로 향상시킨다[84]. 예를 들어 스테인리스섬유 브러시(stainless-steel fiber brush) cathode는 1.7 m3-H2/m3-d의 속도로 수소를 생성하였고, 84%의 수소 효율을 보여 single-chamber MEC에서 백금 촉매와 유사한 성능을 보였다[76]. 또한 합금 제품에 니켈 함량의 증가는 MEC의 성능을 향상시켰다. 니켈 함량이 가장 높은 스테인리스강 (A286, Ni: 24-27%)은 46%의 수소 효율 및 1.5 m3-H2/m3-d의 수소생산 속도를 보여 백금 촉매보다 우수한 성능을 가졌다[85]. 또한, 스테인리스스틸 망은 기공 크기에 따른 성능이 평가되었다. 가장 높은 성능을 보인 망은 60-mesh로, 망의 기공에 따라 비표면적의 변화, 수소 기포의 탈착 방해와 같은 현상들이 논의되었다[86]. 스테인리스강 촉매는 사용될수록 성능이 향상됨이 보였는데, 이는 부식으로 인한 비표면적 증가와 금속 간의 결합구조 및 금속 함량의 변화때문이다[83,87].
실험실에서 합성된 합금은 배율의 최적화를 통해 HER 촉매의 성능을 개선하였다[46]. 전착(electrodeposition)을 통한 합금 제조는 금속 원자 사이에 정밀한 결합을 유도하여 효과적인 수소생산용 촉매를 개발할 수 있다. 전착을 통해 제조한 Ni-Mo 합금은 백금 촉매와 동일한 수소생산 성능(1.6 m3-H2/m3-d) 을 보였다[54]. 전착을 통한 합금 생성은 전착용 전해질(electrodeposition-bath)의 구성과 인가 전류 세기에 따라 합금의 배율이 조절되며, 해당 연구에서의 최적의 전착 조건은 전해질에서 0.65 Mo/Ni 질량비, 인가 전류 밀도 50 mA/cm2, 전착 시간 10분이고, 형성된 합금의 조성은 Ni6MoO3였다.
3.4.4. 탄소 기반 촉매 (Carbon-based catalyst)
탄소재료는 높은 비표면적을 갖기 때문에 HER의 반응 지점을 향상시킬 수 있고 가격이 저렴한 장점이 있지만, 일반적으로 과전압이 높아 단독으로 HER 촉매로 사용되기에는 적합하지 않다. 예를 들어 탄소 나노 튜브(carbon nanotube)를 단독으로 MEC 촉매로 사용한 연구에서는 백금 촉매 보다 14% 낮은 수소생산 속도를 보였다[88]. 이를 개선하기 위해 탄소 재료에 질소, 인, 황과 같은 Hetero-atom을 도핑하여 수소생산 성능을 향상시켰지만[39,89], 백금 촉매에는 미치지 못해 보다 개선된 촉매 개발이 필요하다.
이를 해결하기 위해, 탄소 기반 촉매에 전이금속을 결합하는 탄소-금속 촉매들이 연구되었다. 탄소-금속 촉매는 탄소와 금속 촉매의 장점들을 결합하여 부식에 강하며 높은 전기전도성을 보였다. 활성탄에 니켈 파우더를 결합한 촉매개발 연구에서는 수소생산속도 1.88 m3-H2/m3-d, 수소 순도 97.5%의 매우 높은 성능을 보였다[81]. 또한 그래핀에 마그네슘을 결합해 Mg(OH)2/graphene 촉매를 개발한 연구는 백금 촉매보다 22% 높은 수소생산 성능을 달성했다[90]. 특히, 탄소기반 촉매는 다른 촉매 대비 저렴한 가격으로 인해 많은 양을 촉매로 사용할 수 있기 때문에, MEC 연구의 규모 향상 연구에 매우 적합한 촉매재료로 각광받는다.
3.4.5. 생물 촉매 (Biocatalyst)
앞서 논의된 비생물적 HER 촉매는 결국 내구성의 한계가 있고, 주기적인 전극 교체로 인한 운전 비용이 발생하게 된다. 이러한 문제에 대해 생물 촉매는 직접적이고 효과적인 대안이 될 수 있다. MFC에서 사용하던 산화전극을 생물 환원전극으로 사용한 최초의 연구에서는 0.63 m3-H2/m3-d의 속도로 수소를 생산하여 생물 촉매의 가능성을 보였다[47]. 특히 해당 연구에서는 생물 촉매 전극이 1,000시간 이상 안정적으로 수소를 생산하였으며, 별도의 촉매, 전극 교체 및 전자 매개체를 사용할 필요가 없음을 보였다.
생물 촉매의 사용은 효율적이고, 저렴한 비용으로 수소를 생산하기에 매우 적합하다. 또한 안정적인 전극 성능 및 내구성으로 인해 회분식 뿐만 아니라 연속식 운전에도 적합하여 MEC 연구의 규모 향상에 유용하다[91,92]. 하지만 생물 촉매의 접종 방법, 사용 균주에 대한 최적화, 사용 기질에 따른 생산물, 미생물의 메커니즘에 대한 정교한 후속 연구들이 필요하다.
4. MEC 적용
4.1. 메탄생성을 위한 MEC
MEC에서 생성된 수소는 메탄생성 기작에 사용되기도 한다. MEC에서 생성되는 메탄가스는 직접적인 경로로는 메탄생성균에 의해 생성되기도 하지만, 대부분 biocathode 또는 내부 용액에 존재하는 수소영양 메탄생성균(Hydrogenotrophic Methanogens)에 의해 간접적으로 생성된다[93,94]. Methanobac terium, Methanobrevibacter 등과 같은 수소영양메탄생성균은 MEC에서 발생한 수소가스와 CO2를 CH4로 환원시켜주는 주요 미생물 군집으로 밝혀졌다[95-97]. 수소생산 효율 측면에서 수소영양 메탄생성균은 성능을 저하시키는 요소이지만 도시 하수 처리, MEC-혐기성소화조 결합시스템과 같은 MEC 기술의 변형 시스템에서는 메탄생성을 목적으로 하는 연구들이 진행되고 있다.
4.2. 도시하수 처리를 위한 MEC
파일럿 규모(100 L 이상)의 연구들은 MEC가 도시하수 처리 공정에 적용 가능함을 입증했다. 최초의 파일럿 규모 MEC 연구에서는 120 L의 반응기에서 0.015 m3-H2/m3-d의 속도로 고순도(99%)의 수소를 생성했고, 12개월동안 장기간 운전되어 안정적인 수소생산 성능(0.007 m3-H2/m3-d)을 보였다[98].
대부분의 파일럿 규모의 MEC는 평면 구조이고 전극 부분을 구성하기에 용이한 스테인리스스틸 망을 환원전극으로 사용했다. 이를 통해 전극 표면적 대 반응기 부피 비율 및 반응기 구성에 대한 최적화 연구들이 진행되었으며, 전극 표면적 대 반응기 부피가 증가할수록 시스템의 효율이 향상됨을 밝혔다[99]. 또한, 도시하수에 대해 연구한 모든 파일럿 규모의 MEC는 dual-chamber로 구성되었다. Single-chamber를 사용하면 초기 비용 및 운영비용을 절감할 수 있지만, 생성된 수소를 영양물질로 삼아 메탄가스를 생성하는 수소영양 메탄생성균에 의해 수소수율이 감소한다[100]. 이를 방지하기위해 소수성 교환막을 사용하여 수소가스의 재사용을 방지하고, 효과적으로 수소가스를 안정적으로 포집한다[101].
최근에는 수소영양 메탄생성균를 제거하는 것이 아닌, 메탄 생성을 촉진시켜 MEC의 생성물로 메탄가스를 생성하는 파일럿 규모의 연구도 진행되었다. 양조장 폐수를 처리하는 1,000 L 규모의 Single-chamber MEC는 고순도 (86%)의 메탄가스를 0.19 m3-CH4/m3-d의 속도로 생성하였다[102]. 단위 질량당 메탄가스의 에너지함량은 수소가스보다 낮기 때문에 수소를 회수하는 것이 에너지 효율 측면에서는 더 효과적이지만, 생성된 메탄가스는 저장, 운송 및 연소에 있어서 수소가스보다 용이하고 안전하기 때문에[103], 메탄생성 MEC 또한 지속적으로 연구되고 있다.
파일럿 규모의 도시하수 처리용 MEC는 안정적인 성능과 함께 적용 가능성을 보였지만, 낮은 쿨롱 효율, 낮은 COD 제거율, 질소와 인 잔류 및 발생된 수소가스의 재사용으로 인한 수소수율 하락 등의 문제들은 시스템의 실용화를 위해 극복되어야한다. 최근에는 MEC의 방류수 품질 개선 및 문제 해결들을 위해 막여과 장치, ANAMMOX 공정, 혐기성소화조와의 결합 등이 연구 중이다[104].
4.3. MEC-혐기성소화조 결합 시스템
전통적인 혐기성 소화는 주요 4가지 공정인 가수분해, 산생성, 아세테이트 생성 및 메탄 생성을 포함한다. 혐기성 소화는 다양한 미생물의 작용에 의해 유기기질이 메탄과 수소의 형태로 전환된다[99]. 오염물질 속의 유기물을 분해하고 바이오 가스를 생산하기 위한 혐기성소화의 적용은 성공적이지만 시스템의 불안정성, 낮은 기질 분해율 및 낮은 바이오가스 생성과 같은 한계를 갖는다[105]. 특히 다양한 기질분해에 의해 생성되는 VFA는 내부의 pH를 급격히 감소시켜 메탄 생성을 억제한다[106]. 또한 35℃의 온도 조건에서 가장 안정적인 성능을 갖기 때문에 외부 환경에 대해 민감하며 수리학적 체류시간이 길다[107]. 이러한 문제들을 해결하기 위해 MEC와 혐기성 소화조의 결합 시스템(MEC-AD)이 제안되었다.
MEC-AD 결합은 시스템 안정성을 향상시킨다. 난분해성 화합물 분해율이 높고, COD 제거율이 높고, VFA 분해를 가속화하여 급격한 pH의 변화를 방지한다. MEC-AD의 가장 대표적인 장점은 메탄가스 생성 및 가스 순도의 향상이다. 다양한 연구에서 폐기물 활성 슬러지 처리를 위해 MEC-AD 시스템 사용이 연구되었다. 스테인리스강으로 구성된 single-chamber 반응기를 이용한 MEC-AD 시스템은 기존 혐기성소화 공법 대비 메탄가스 수율이 2.3배 증가했다[108]. 또한, MEC-AD 시스템에서 폐기물 활성 슬러지로부터 메탄가스를 생성하는 데 있어서 산화전극 생물막에 우점종 된 수소영양 메탄생성균들의 군집이 보고되었다[109].
또한 MEC-AD 시스템은 인가 전압에 따른 성능 차이가 연구되었다. MEC-AD 시스템은 기존 혐기성소화조 대비 22% 증가한 메탄 생성율과 11% 증가한 활성슬러지 분해율을 보였다[110]. 구체적으로 MEC-AD 시스템에 0.3 V와 0.6 V의 전압을 인가했을 때, 0.3 V에서의 메탄 생성율은 0.6 V 대비 9% 이상 향상되었으며, 수소영양 메탄생성균 군집은 17배 이상 증가했다[111]. 이는 높은 인가전압은 cathode의 반응을 촉진시켜 수소이온 (H+)을 과하게 사용하여 pH를 증가시켰고, 이로 인해 수소메탄 생성균의 활성이 억제되기 때문이다[112].
MEC-AD 시스템은 혐기성소화조 대비 짧은 운전시간을 갖는다[113]. 0.3 V의 전압을 인가한 MEC-AD의 수리학적 체류시간은 20일이였고, 안정적인 메탄 생성 성능을 보였다. 이는 혐기성소화조 대비 1.7배 이상 빠른 속도이다[114].
한편, MEC의 미생물 군집 구성 및 구조는 기질에 따라 다르며 MEC-AD 동안 미생물 군집의 변화는 명확하지 않다. 게다가, MEC-AD 시스템의 처리시간은 혐기성소화조 대비 빠른 처리시간을 갖지만, 여전히 긴 수준의 처리시간을 필요로 한다.
5. 요약과 전망
MEC기술의 발전은 실제 폐수를 처리하면서 수소에너지를 생성하고, 폐수처리 과정에서 에너지를 소비하는 것이 아닌, 에너지를 공급하는 차세대 수소생산형 폐수처리시스템에 대한 가능성을 보였다. 시스템 실용화라는 목표에 도달하기 위해 실험실 규모에서의 연구 결과와 성과들이 산업 규모까지적용되어야 하지만, 시스템 규모 향상에 따른 다양한 요인에 의한 성능 저하 문제들이 발생한다.
MEC 반응기의 부피가 커질수록 전극간 거리 증가에 의한 내부 저항이 증가하기 때문에, 전극간의 거리를 최소화하는 전극 배치, 반응기 모양 등에 대해 연구 되어야한다[115]. 또한, dual-chamber 반응기의 규모 향상에 따라 교환막 크기 또한 증가하게 되는데, 교환막 제작 및 교체에 대한 비용도 함께 증가하게 된다. 보다 효과적으로 이온교환을 하며 비용이 절감되는 기술 개발이 필요하다. 실험실 규모에서의 산화전극 재료는 미생물 부착성이 우수하고, 표면적이 넓은 탄소 섬유 브러쉬가 가장 많이 사용된다. 그렇지만, 반응기 규모 증가와 형태의 유연성 측면에서는 탄소 섬유 브러쉬보다 탄소 펠트와 같은 평평하고 유연한 재료들이 사용된다. Scale-up 반응기의 부피와 구조가 최적화된다면, 그에 적합한 전극 재료 및 구조에 대한 최적화 역시 필요하다. 환원전극 재료는 수소생산반응 성능에 의존한다. 가격이 비싼 백금 촉매를 대체할 수 있는 모든 수소생산용 촉매를 적용 가능하다. 하지만 촉매를 적용할 때, Nafion과 같은 접착제를 사용한다면 비용상승과 내부저항 상승으로 인한 성능 감소, 그리고 전극 내구성 감소 등의 문제를 야기할 수 있기 때문에 스테인리스강 망과 같은 평평하고 유연한 재료에 대해 물리・화학적 처리를 통해 성능을 크게 향상시키거나[116,117], 내구성이 뛰어나고 지속 가능한 생물 촉매 등에 대한 연구들이 추가적으로 필요하다. MEC의 기질로는 아세테이트가 가장 적합한 흐름이다. 글리세롤 및 포도당과 같은 다른 유기물들을 기질로 사용했지만, 아세테이트 대비 획기적이지 못해 선택되지 못하고 있다. 또한 MEC는 설탕산업폐수, 식품가공폐수, 도시폐수, 산업폐수 등을 기질로 사용할 수 있는 확장성을 갖는다. 하지만, 기질의 변화는 산화전극의 미생물군집을 변화시키기 때문에 다양한 폐수를 기질로 적용할 때에 그에 따른 미생물 군집 연구 및 최적 성장 조건 구현 등의 연구들이 구체적으로 수행되어야한다. MEC는 도시하수 처리에 적용되었지만, 도시하수의 넓은 범용성으로 인해 낮은 성능을 보였다. 따라서 도시하수 처리 등과 같은 주류(main-stream) 폐수 처리 시스템보다는 MEC-AD 시스템과 같은 부류(side-stream) 폐수처리에 적용되는 것이 유리하다.
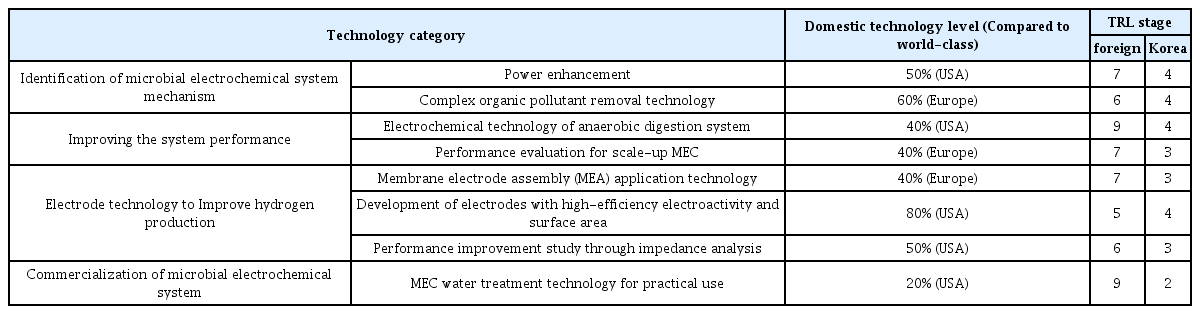
MEC 기술의 최종 목표는 바이오 에너지 생산과 함께 산업 규모의 폐수 처리이다. 이를 달성하기 위해 4개의 기술분야, 8개의 세부 기술분야로 분류하여 기술성숙도(Technology readiness level, TRL)를 국내외 수준에 따라 평가했다(Table 2) [6].
해외에서 가장 성숙된 TRL 9단계를 보이는 기술분야는 혐기성 소화 시스템의 전기화학적 기술 분야와 실용화를 위한 MEC 수처리 기술 분야이며, 대부분의 기술분야에서 6단계 (시작품 단계) 및 7단계 (제품화단계) 수준의 기술 연구를 보였다. 국내의 기술들은 대부분의 기술분야에서 3-4단계인 실험실 규모의 단계를 실험 단계이며, 실용화를 통한 MEC 수처리기술 분야는 2단계로 기초연구 수준의 기술을 보였다.
미생물 전기분해 셀 기술에 대한 해외 기술 대비 국내 기술의 수준은 40-60% 수준이다. 전 세계적으로 해당 기술에 대한 수준이 최대수준에 아직 미치지 못한 만큼, 원천기술 개발에 대한 과감한 투자를 통한 시스템 경쟁력을 확보해야 한다. 특히 해외 기술 대비 국내에서는 시스템 실용화 연구에 대한 가장 낮은 기술 수준이기 때문에, TRL 9단계 사업화까지 이어질 수 잇는 중·장기적인 연구와 투자가 진행되어야 할 것이다.
Acknowledgements
이 연구는 대한민국 과학기술정보통신부의 재원으로 한국연구재단 중견연구자지원사업의 지원을 받아 수행되었습니다(NRF-2021R1A2C1013989).
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper