반연속식 황산화미생물 반응조를 이용한 중금속 개별 및 복합독성평가
Evaluation of Individual and Mixture Toxicity of Heavy Metals using Semi-continuous Type Sulfur Oxidizing Bacteria (SOB) Bioreactor
Article information
Abstract
목적:
본 연구는 황산화미생물의 활성 변화를 기반으로 한 반연속식 반응조를 이용하여 중금속(Hg2+, Cr6+, Cd2+)의 개별독성평가를 수행하고 이를 바탕으로 복합독성평가 및 독성 예측 모델링을 통해 중금속의 독성 상호작용을 평가하는 것을 목적으로 한다.
방법:
황산화미생물이 도포된 황입자를 반응조에 분취 후 최적화된 조건으로 배양액과 중금속 함유 배양액을 한 시간 간격으로 자동 주입시켰다. 전기전도도 변화를 바탕으로 도출된 각 중금속의 개별 EC50 값을 기준으로 복합독성평가용 중금속 혼합 배양액을 제조하여 시험하였다. 복합독성평가의 결과를 기반으로 하여 복합독성 예측모델인 CA, IA 그리고 CI모델을 구현하여 실제 실험 값과 대조 후, MDR 지표를 통해서 모델과의 유사성을 검증하고 CI value로 상호작용의 종류(상승작용, 길항작용)를 평가하였다.
결과 및 토의:
:개별독성평가 실험결과, 각 중금속의 개별 EC50은 강한 독성 순서로 Hg2+ 0.71mg/L, Cr6+ 1.02mg/L, Cd2+ 8.82mg/L로 도출되었다. 개별 EC50를 바탕으로 복합독성평가 수행결과, Hg2+ + Cd2+의 조합에서 IA모델과 강한 유사관계를 보여 독성 상호작용이 발현되지 않았다고 판단하였지만 나머지 모든 조합에서는 CI모델과 유사관계를 보여 독성 상호작용의 존재를 판단할 수 있었다. CI value를 분석한 결과 상호작용이 존재하는 모든 조합에서 상승작용이 나타났고 이 결과를 바탕으로 Cr6+가 독성의 상호작용을 유발하는 인자로 판단할 수 있었다.
결론:
본 연구를 통해 황산화미생물의 실시간 독성 모니터링 시스템으로써의 기능과 non-essential metals에 대한 민감한 독성 탐지를 검증할 수 있었다. 또한 대부분의 중금속 조합에서 독성 상호작용 중 상승작용이 발생하여 본 연구에서 사용한 중금속 이외의 중금속류 또는 유기오염물질에 대해서 추가적인 연구를 수행한다면 더욱 체계적인 생태독성 모니터링 시스템을 구축할 수 있을 것이라고 기대된다.
Trans Abstract
Objectives
In this research, individual toxicity evaluation of heavy metals (Hg2+, Cr6+, Cd2+) was performed using a semi-continuous type bioreactor based on changes in the activity of sulfur oxidizing bacteria(SOB), and the purpose is to evaluate the toxic interaction of heavy metals through mixture toxicity evaluation and prediction modeling based on individual toxicity evaluation.
Methods
SOB were separated into a reactor, and then the culture medium and heavy metal influent were automatically injected at 1-hour intervals under the optimized conditions. Heavy metal mixture influent for composite toxicity evaluation was produced and tested based on the individual EC50 value of each heavy metal based on the change in electrical conductivity(EC). Based on the results of the mixture toxicity evaluation, the CA, IA, and CI models are implemented, and after comparison with the actual experimental values, similarity with the model was verified through the MDR index. And the type of interaction (synergism, antagonism) was evaluated by CI value.
Results and Discussion
In case of individual toxicity evaluation experiments, the individual EC50 of each heavy metal was derived at Hg2+ 0.71mg/L, Cr6+ 1.02 mg/L, and Cd2+ 8.82 mg/L in the order of strong toxicity. As a result of performing a combined toxicity evaluation based on individual EC50 values, it was judged that the combination of Hg2++Cd2+ showed a strong similarity with the IA model and no toxic interaction was developed, but all the remaining combinations were with the CI model. A similar relationship was shown and the existence of toxic interactions could be determined. As a result of analyzing the CI value, synergistic effects appeared in all combinations in which the interaction existed, and based on this result, it was possible to determine that Cr6+ is a factor that induces the toxic interaction.
Conclusion
This study allowed a real-time toxicity monitoring system for SOB to verify sensitive toxicity detection for functional and non-essential metals. In addition, most heavy metal combinations generate synergistic effects during toxic interactions, and additional research on heavy metals and organic pollutants other than heavy metals used in this study will result in a more systematic ecotoxicity monitoring system.
1. 서 론
중금속에 의한 환경오염과 생태계 교란은 각종 산업과 중공업의 발전으로 더욱 가속화되고 여러 문제를 일으키고 있다. 수계로 유입된 중금속은 퇴적물에 축적되거나 수중생물에 의해 흡수되는데, 중금속은 일반적으로 독성이 높아 체내에 흡수될 경우 배출이 잘 이루어지지 않아 중금속에 노출될 경우 어류의 집단폐사 및 수계 정화에 천문학적인 비용이 소비되며, 미량의 중금속에 장기간 노출이 되었을 시에 생물농축 현상으로 야기되어 인류에게 직・간접적인 악영향을 미치게 된다[1,2]. 현재 대부분의 중금속 생태독성평가 연구의 경우, 물질 하나에 대한 개별 독성평가 위주로 연구되고 있다[3]. 그러나 생태계로 배출되는 오염수는 한 가지 중금속 단일물질보다는 여러 중금속이 다양하게 혼합되어 있는 경우가 대부분이고 lab-scale 수준의 연구에서 다양한 중금속으로 제조한 오염수를 시험생물에게 노출시킨 결과, 구성 조합과 비율에 따라 상승작용(synergism)과 길항작용(antagonism)이 발생한 연구결과들이 존재한다[4,5]. 때문에 중금속의 복합 독성평가 연구를 통해 독성의 상호작용을 파악하는 것은 생태독성평가 방법 및 모니터링 장치 개발에 있어서 중요한 요소이다.
기존의 독성분석방법은 크로마토그래피, AAS 등 분석화학적 방법으로 실제 방류되고 있는 여러 하∙폐수에 신속하게 대응하기 어렵고 생물에게 미치는 위해성뿐만 아니라 복합독성에 의한 상호작용을 판단할 수 없기 때문에 현재 생태독성 관리제도를 통해 이를 개선 및 방지하고 있다[6]. 생태독성 관리제도는 오염수 혹은 오염이 예상되는 시료를 시험생물종에게 노출시켜 그에 따른 생물 저해도를 분석하여 독성의 정도를 판별하는 방법으로 우리나라뿐만 아니라 전 세계적으로 물벼룩(Daphnia magna), 발광박테리아(Vibro fischeri)를 이용한 급성독성시험법이 널리 사용되고 있다[7]. 하지만 물벼룩 시험법의 경우 최소 24시간의 노출시간이 필요하고 물벼룩 배양액의 경도와 알칼리도, 조도를 알맞게 설정해줘야 하기 때문에 상대적으로 까다로운 시험법이다. 또한, 현장측정용 실시간 모니터링 장치의 경우 물벼룩의 움직임을 관찰하는 첨단 장비가 필요하여 상대적으로 고가의 시험법에 속한다[8,9]. 발광박테리아 시험법은 평가시간이 짧고 독성에 민감한 반면, 생물 발광을 측정하기 때문에 시료의 탁도와 색도에 민감할 뿐만 아니라 해양미생물이기 때문에 배양액의 염분과 삼투압을 추가로 조절해야 해서 까다로운 시험법이라는 공통된 단점을 공유하고 있다[10,11].
본 연구에 사용한 황산화미생물(Sulfur oxidizing bacteria, SOB) 생태독성시험법은 위 시험법의 단점이 보완된 방법으로 실시간 독성 모니터링 장치로서 기능 역시 여러 선행연구를 통해 유효성이 증명된 시험법이다. 황산화미생물은 호기성 조건에서 황 화합물을 산화시켜 에너지를 얻는 화학합성 독립영양미생물로 산소를 전자 수용체로 이용하여 황산염(SO42-)을 생성하고 이로 인해 생성된 황산염과 정비례하게 전기전도도(EC)가 증가한다[12,13].
위의 반응식(1)을 통하여 전기전도도를 측정함으로써 황산화미생물의 활성도를 파악할 수 있고, 반대로 독성에 의해 황산화미생물의 활성이 저하되면 황산염 생성이 줄어들어 전기전도도의 증가율이 감소하게 된다. 이 원리로 전기전도도의 증가율을 비교하여 간단한 방법으로 평가가 가능한 것이 황산화미생물 시험법의 장점이다. 또한, 황산화미생물은 화학합성 독립영양생물이기 때문에 유기탄소가 필요하지 않고 저렴한 황입자에 비교적 쉽게 배양이 가능하기 때문에 생태독성시험 생물종으로 적합한 생물이다[14].
본 연구에서는 중금속 3종(Hg2+, Cr6+, Cd2+)의 개별 및 복합 독성에 대한 상호작용을 황산화미생물 반응조와 실시간 측정 및 자동화 시스템을 결합한 반연속식 모니터링 방법으로 평가하였다. 복합 독성 평가의 경우 개별 독성평가를 기반으로 현재 세계적으로 널리 이용되고 있는 여러 예측모델을 적용하여 중금속 간의 상승작용과 길항작용을 평가함으로써 중금속의 환경생태학적인 영향을 파악해 보았다.
2. 재료 및 방법
2.1. 황산화미생물 획득 및 배양
황산화미생물 master culture reactor(MCR)의 접종원으로 춘천시 하수종말처리장에서 채취한 반송 슬러지를 사용하였다. 배양액의 경우 nutrient mineral buffer(NMB)용액, trace minerals(TM) 용액을 증류수 1L에 각각 100, 200배 희석한 후 NaHCO3 200 mg/L, yeast extract 20 mg/L가 되게 추가한 용액을 배양액으로 사용하였고 이 배양액을 독성시험에도 동일하게 사용하였다. NMB 용액의 구성은 NaH2PO4 4.22 g/L, Na2HPO4 2.75g/L, NH4Cl 3.1 g/L, KCl 1.3 g/L이며 TM용액의 구성은 CaCl·2H2O 7.34 mg/L, FeSO4·7H2O 5mg/L, MnCl2·4H2O 2.5 mg/L, ZnSO4·7H2O 2.5mg/L, (NH4)6Mo7O24·4H2O 0.5 mg/L, CoCl2·6H2O 0.5mg/L, CuSO4·5H2O 0.2mg/L로 구성되어 있다. 직경 0.05~2mm의 황입자 500 g을 황 공급원으로 하였으며 3시간 간격으로 3분간 배양액 400 mL를 자동 주입하였다. 배양액의 자동주입과 실시간 전기전도도 측정은 auto-feeding system이 적용된 소형 컴퓨터의 메인보드에 배양액 공급용 펌프와 전기전도도 전극을 연결하여 컴퓨터에서 배양액의 주입유량과 반응시간, 그리고 실시간 전기전도도 측정 등 전체 시스템을 제어할 수 있게 하였다. MCR은 38℃가 유지되는 항온조 내부에서 운전하였고 공기펌프를 연결하여 호기 조건을 갖추어 주었다. 최종적으로 전기전도도의 증가율이 일정한 상태가 유지되었을 때 실험에 사용하였다.
2.2. 황산화미생물 반연속식 반응조 구성 및 최적화
실험에 사용한 반연속식 반응조는 MCR과 같이 황산화미생물에 의해 내부 pH가 약 1.0까지 낮아지기 때문에 MCR과 동일한 재료인 아크릴을 이용하여 제작되었다. 반응조는 전기전도도 전극이 포함된 측정부, 유출부, 공기 주입라인, 배양액 및 중금속 시험수 주입라인으로 구성되어 있고 3회 반복실험을 고려하여 3개의 반응조를 38℃가 유지되는 인큐베이터 내부에 세팅하였다(Fig. 1). 반응조에 공기펌프를 연결하여 시험기간동안 공기를 200 mL/min의 유량으로 공급하였고 반응조 시험 역시 황산화미생물 MCR 운전과 동일한 소형 컴퓨터를 이용한 자동화 시스템을 적용하여 수행하였다.

Experimental setup for semi-continuous toxicity test (a) semi-continuous type SOB bioreactor, (b) installed real-time toxicity monitoring test set.
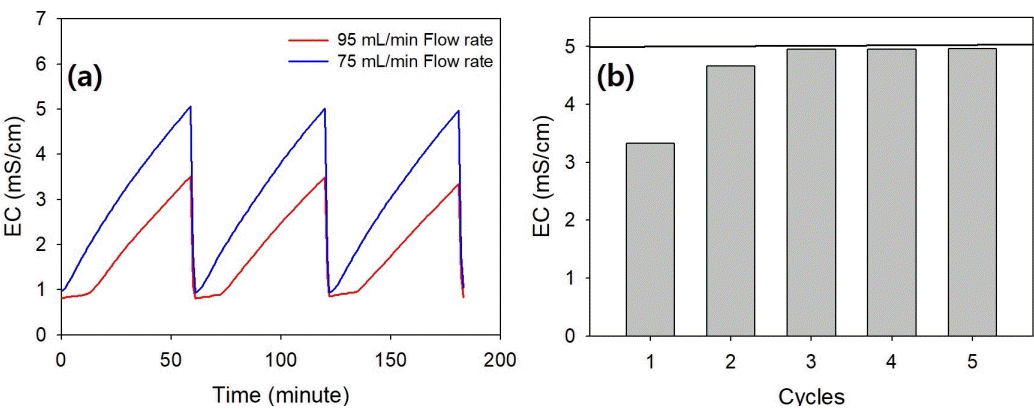
반연속식 반응조의 최적 운전조건 결정을 위하여 배양액 및 중금속 시험수 유입유량을 달리하여 최적 주입조건을 결정하였다. 미생물 주입량은 MCR로부터 황산화미생물이 표면에 부착 성장된 황 입자 50 g을 반응조에 분취하였고 3개의 반응조에 75 mL/min의 유량으로 1분간 동시 주입 후 한 시간 간격으로 총 3회 반응을 관찰하였으며 동일한 방법으로 95 mL/min의 유량으로 설정하여 두 유량조건의 차이를 비교 관찰하였다. 중금속 시험수 주입 시 이전에 반응조로 주입된 독성이 없는 배양액과의 희석으로 인한 목표 농도의 저하를 고려하여 KCl trace test를 수행하였다. KCl trace test는 potassium chloride (KCl, 대정화금)을 이용하여 제조한 5.0 mS/cm의 전기전도도를 갖는 용액을 최적화된 유량조건으로 부착 미생물이 없는 일반 황입자와 증류수로 채운 반응조에 주입과 동시에 실시간 전기전도도를 측정하여 5.0 mS/cm에 도달하는 주입 횟수를 파악한 후 본 실험에 적용하였다.
2.3. 시험 중금속 선정
시험 중금속은 non-essential metals인 수은(Hg2+), 6가 크롬(Cr6+), 카드뮴(Cd2+)으로 선정하였으며 각각 mercury chloride (HgCl2, Sigma-Aldrich), potassium dichromate(K2Cr2O7, Sigma- Aldrich), 그리고 cadmium sulfate 8/3-hydrate(3CdSO4•8H2O, Sigma-Aldrich)를 증류수에 녹여 1,000 mg/L 표준원액을 제조해 실험에 사용하였다.
2.4. 개별독성 평가
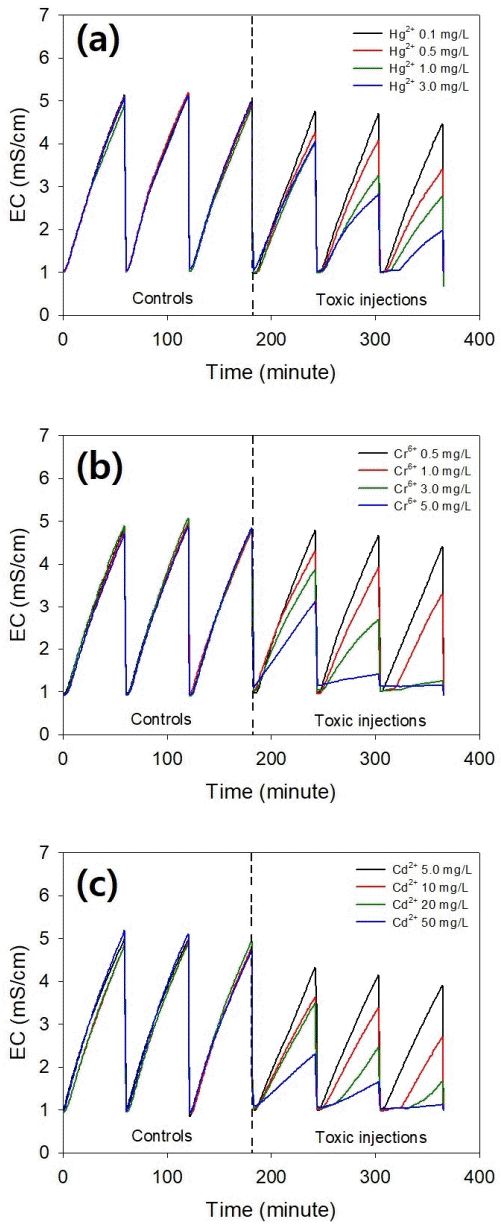
중금속 개별독성 평가는 본 실험 전 예비실험을 통해 실험 농도를 결정하였고 모든 실험에 대조군을 포함하여 실험하였다. Hg2+의 경우 0.1, 0.5, 1, 3 mg/L, Cr6+의 경우 0.5, 1, 3, 5mg/L 그리고 Cd2+의 경우 5, 10, 20, 50mg/L로 하여 실험하였다. 실험 기간 동안의 전기전도도 증가를 바탕으로 중금속에 대한 저해도를 계산하였고 계산식은 식(2)와 같다.
황산화미생물에 대한 각 중금속 농도 별 저해도를 바탕으로 dose-response curve(용량-반응 곡선)를 산출하여 EC50 값을 결정하였고 용량-반응곡선은 CompuSyn 프로그램(ComboSyn Inc, Paramus, NJ, USA; Chou and Martin, 2005)을 이용하여 산출하였다. 모든 실험은 3회 반복 실험으로 진행하였고 ANOVA 분석을 통하여 결과 값 간의 통계적 유의성을 평가하였으며 p-value가 0.05 미만인 값을 결과로 사용하였다.
2.5. 복합독성 평가 및 독성 상호작용 예측
중금속 복합독성 평가는 개별독성 평가의 결과를 바탕으로 수행되었다. 각 중금속의 개별 EC50 값을 기준으로 ∑0.25 EC50, ∑0.5 EC50, ∑1.0 EC50, 그리고 ∑2.0 EC50의 조합으로 binary test(A+B), ternary test(A+B+C)를 수행하였고, 개별독성 평가와 마찬가지로 실험 결과를 바탕으로 중금속 혼합물의 EC50 값을 산출하였다.
중금속의 복합독성 간의 상호작용을 예측하기 위해서 concentration addition(CA)모델, independent action(IA)모델, 그리고 combination index(CI)모델을 사용하였고 예측 모델과 시험 결과와의 유사성 검증은 model deviation ratio(MDR) 지표를 통해서 평가하였다. CA모델은 독성간의 상호작용이 없는 전제의 모델(additive model)로 실험 결과가 CA모델과 유사성을 보일 경우 해당 혼합물은 독성 간의 상호작용이 없으며 혼합물을 구성하는 독성의 작용기작(mode of action)이 같음을 의미한다. CA모델의 방정식과 구성요소는 식(3)과 같다[15].
ECx,mix는 x %의 저해를 유발하는 혼합물의 예상 농도를 나타낸다. ECx,i는 x %의 저해를 유발하는 성분 i의 농도를 나타내며 pi는 혼합물을 구성하는 성분 i의 비율이다.
IA모델은 CA모델과 동일한 독성간의 상호작용이 없는 전제의 모델로 실험 결과가 IA모델과 유사성을 보일 경우, 해당 혼합물은 독성간의 상호작용이 없지만 혼합물을 구성하는 독성의 작용기작이 각기 다른 것을 의미한다. IA모델의 방정식과 구성요소는 식(4)와 같다[16].
E(Cmix)는 혼합물이 농도의 예측 저해도를 나타낸다. Ci 혼합물을 구성하는 성분 i의 농도이며 E(Ci)는 혼합물을 구성하는 성분 i의 개별 저해도이다.
CI모델은 CA, IA모델과는 다르게 독성간의 상호작용을 전제로 하는 모델(interaction model)로 실험 결과가 CI모델과 유사성을 보일 경우, 해당 혼합물은 독성간의 상호작용이 존재하는 것을 의미한다. 상호작용 중 상승작용, 길항작용의 평가 기준은 CI value를 통해서 결정된다. CI value가 0.9 보다 작을 경우 독성간의 상승작용을 의미하고 1.1 보다 크면 길항작용, 그리고 0.9와 1.1 사이의 값이면 첨가작용을 의미한다. CI value는 CompuSyn 프로그램을 통해서 도출하였고 CI모델의 방정식과 구성요소는 식(5)와 같다[17,18].
ECx,mix는 x %의 저해를 유발하는 혼합물의 예상 농도를 나타낸다. ECx,i는 x %의 저해를 유발하는 성분 i의 농도를 나타내며 pi는 혼합물을 구성하는 성분 i의 비율이다. CIx comp는 혼합물이 x %의 저해를 보일 때의 CI 값이다.
MDR 지표는 예측모델과 실제 실험 결과와의 유사성을 평가하는 지표로 MDR 값이 0.5≤MDR≤2.0 일 때 실제 실험 값이 예측모델과 유사하다는 것을 의미하고, 그 값이 1.0과 가까울수록 예측모델과 높은 유사성을 갖는다고 평가한다. MDR 지표의 값은 모델 예측 값을 실제 실험 결과 값으로 나누어 계산하며 MDR 지표의 계산식은 식(6)과 같다[19].
3. 결과 및 고찰
3.1 실험조건 최적화
Fig. 2(a)는 유입 유량에 따른 전기전도도 증가 양상이고 이는 곧 황산화미생물의 활성도를 나타낸다. 75 mL/min의 유량으로 주입하였을 때, 주입이 종료됨과 동시에 전기전도도의 증가를 보였다. 시간당 평균 전기전도도 증가량은 4.07±0.03 mS/cm가 매 주입 마다 일정하게 증가하였다. 반면에 95 mL/min의 유량으로 주입한 경우, 주입 후 초기 약 5분간의 유도기(lag phase)를 보였고 시간당 평균 전기전도도 증가량은 2.62±0.1 mS/cm로 최초 주입 이후부터 전기전도도 증가량이 서서히 감소하는 경향을 보였다. 이는 황입자를 포함한 반응조 내부 부피보다 과량으로 주입된 배양액으로 인해 황 입자 표면에 부착된 미생물이 pH 등 변화된 내부 환경 적응 때문이라고 판단된다. 이 결과를 바탕으로 매 주입마다 안정적이고 일정하게 대조군의 상태를 유지할 수 있는 75 mL/min을 실험 유량으로 결정 후 KCl trace test를 진행하였다. KCl trace test 결과는 Fig. 2(b)로 나타내었다. 최초 주입 후 목표 전기전도도의 66.6%까지 도달하였고 두 번째 주입 후에 93.2%, 그 이후 99.8 %까지 목표 농도에 도달하였다. 세 번째 주입과 그 이후의 주입에서는 동일한 결과를 보였기 때문에 독성 종말점은 세 번째 주입을 기준으로 결정하여 독성평가에 적용하였다.
3.2. 중금속 개별 독성평가
각 중금속의 농도 별 전기전도도 변화는 Fig. 3과 같고 저해도 결과는 Fig. 4와 같다. 중금속의 농도가 높아질수록 황산화미생물이 저해를 받아 황산염 생성이 줄어들어 전기전도도 증가율이 감소하였고 독성 종말점인 세번째 주입에서 최대 저해를 보였으며 용량-반응 곡선과 실제 결과의 결정계수(R2)가 모두 0.99 이상의 높은 상관관계를 보였다. 개별 중금속의 EC50은 각각 Hg2+ 0.71 mg/L, Cr6+ 1.02 mg/L, 그리고 Cd2+ 8.82 mg/L로 타 생물종보다 상대적으로 짧은 측정시간 대비 높은 독성 민감도를 보였다[20],[21],[22] 모든 실험에서 중금속 함유 배양액 주입 후에 유도기가 관찰되었으며 중금속 농도가 높아질수록 유도기의 시간이 길어지거나 Cr6+과 Cd2+의 경우 전기전도도가 거의 증가하지 않는 현상을 보였다. 이러한 각 중금속의 개별독성평가 결과인 EC50 값을 바탕으로 복합독성평가를 수행하였다.
3.3. 중금속 복합독성평가 및 상호작용 예측
중금속 개별 독성평가의 결과를 바탕으로 수행한 복합 독성평가 결과를 개별 독성평가와 마찬가지로 실시간 전기전도도 변화를 Fig. 5와 같이 나타내었고 용량-반응곡선을 통해 EC50 값으로 도출하였다(Fig. 6). Hg2++Cd2+조합의 혼합물을 제외한 나머지 조합은 모두 최대 농도에서 80% 이상의 저해를 보였다. 복합 독성평가 결과 역시 용량-반응곡선과 실제 결과의 결정계수가 모두 0.98 이상의 값으로 높은 상관관계를 보였기 때문에 이 결과를 바탕으로 예측모델 방정식의 각 변수를 도출하여 예측모델을 구현하였다.

Changes in EC according to heavy metal mixture concentrations (a) Hg2++Cr6+, (b) Hg2++Cd2+, (c) Cr6++Cd2+, (d) Hg2++Cr6++Cd2+.

Dose-response curves and respective EC50 values for mixture toxicity tests (a) Hg2++Cr6+, (b) Hg2++Cd2+, (c) Cr6++Cd2+, (d) Hg2++Cr6++Cd2+.
Fig. 7은 중금속 3종에 대한 개별 및 복합독성평가 결과를 바탕으로 도출한 예측 모델의 예측 결과이며, 이를 바탕으로 계산한 MDR 지표는 Table 1와 같다. 모든 조합의 중금속 혼합물에서 binary test인 Hg2++Cd2+ 조합을 제외한 나머지 조합 모두 CI 모델과 유사성을 보여 중금속 간 상호작용을 보였다. Hg2++Cd2+ 조합은 MDR 상에서 IA 모델과 강한 유사성을 보였는데, 이는 수은과 카드뮴의 독성 작용기작이 다름을 시사한다. 여러 연구결과에 따르면, 수은은 생물에 대해서 주로 단백질 합성과 효소 활성 기작에 저해를 주는 것으로 알려져 있고[23], 카드뮴의 경우 수은과 마찬가지로 여러 효소의 활성에 저해를 주지만, 주로 세포 내∙외부에 산화 스트레스를 주거나 유전자에 데미지를 주어 DNA 손상을 유발하는 것으로 알려져 있다[24]. 그렇기 때문에 수은과 카드뮴은 각각 다른 기작으로 황산화미생물에 저해를 주었지만 두 중금속이 독성 상호작용을 일으키지는 않았다고 판단된다. 반면 수은과 카드뮴 조합을 제외한 모든 조합의 혼합물 시험결과는 CI모델과 유사성을 보여 중금속 간의 독성 상호작용이 존재함을 유추할 수 있었다. Fig. 8은 각 조합의 상호작용 형태와 정도를 파악하기 위해 도출된 저해도에 따른 CI value 변화 그래프이다. Hg2++Cd2+ 조합을 제외한 나머지 모든 조합에서 대부분의 CI value가 0.9 보다 낮아 상승작용이 예측됐고 Hg2++Cr6+ 조합의 경우 혼합물의 농도가 높아질수록 CI value가 0.5 밑으로 하락하는 강력한 상승작용이 나타났다. 반대로 Cr6++Cd2+의 조합에서는 저농도의 혼합물에서 강한 상승작용이 나타났고 농도가 높아질수록 상승작용이 약해지면서 첨가반응을 거쳐 길항작용 효과가 나타나는 경향을 보였다. MDR 지표 상에서도 Hg2++Cr6+ 조합은 오로지 CI모델과 유사성을 갖는 반면, Cr6++Cd2+ 조합은 고농도의 혼합물에 의해 저해도가 높아질수록 CA모델과도 유사성을 갖는다. 이는 6가 크롬과 카드뮴이 산화 스트레스를 통한 DNA 손상을 유발하는 동일한 독성 작용기작을 갖고 있고[25], 이를 바탕으로 저농도에서 동일한 작용지점과 기작으로 황산화미생물에게 작용하여 강한 상승작용을 일으켰지만 혼합물의 농도가 높아질수록 한 가지 물질이 다른 물질보다 강하고 작용지점에 더 적극적으로 작용하여 독성이 우점 된 것으로 판단된다. Ternary test 결과 역시 CI value가 모두 상승작용을 나타냈지만 다른 조합들과는 달리 혼합물의 농도가 증가하여도 CI value가 더 낮아지거나 상승하지 않고 일정한 수준을 유지하였다. MDR 지표 역시 CI모델과 가장 높은 유사성을 보였지만 CA와 IA모델과도 범위 안에서 약한 유사성을 보였는데, 이는 Hg2++Cd2+ 조합이 IA모델과 가장 높은 유사성을 보였지만 CA모델, CI모델과도 MDR 지표 상에서 약한 유사성을 갖는 것과 비슷한 양상이다. 이 두 조합의 차이점은 혼합물에 6가 크롬의 존재 유무이고 6가 크롬이 함유된 모든 조합의 혼합물에서 강한 상승작용이 발현되었으며 오직 수은과 카드뮴 조합에서만 additive 모델인 IA모델과 강한 유사성을 갖는 것을 종합하였을 때, 6가 크롬이 독성 상호작용과 상승작용을 유발하는 요인으로 판단된다.

Comparisons of dose-response curves obtained from predicted mixture toxicity effects of concentration addition (CA), independent action (IA), and combination index (CI) models with observed effect from the mixture toxicity tests (a) Hg2++Cr6+, (b) Hg2++Cd2+, (c) Cr6++Cd2+, (d) Hg2++Cr6++Cd2+.

Model deviation ratio (MDR) values for heavy metals mixtures at different inhibitory levels(bold text indicates MDR values within a factor of two(0.5≤MDR≤2.0)).
4. 결론
Non-essential metals인 수은, 6가 크롬, 카드뮴에 대한 반연속식 황산화미생물 반응조 시험 결과, 다른 생물종의 연구결과와 비교하여도 보다 신속하고 민감하게 중금속의 독성을 탐지하는 것이 가능하였다. 또한, 위 세 가지 중금속들이 여러 경우의 수로 혼합이 되어있을 때 대부분의 경우에서 황산화미생물에게 독성 상호작용이 발생하였고 그 중에서도 독성으로 인한 저해효과가 증폭되는 상승작용이 주된 상호작용이였다. 복합독성평가 시험결과와 예측모델 분석을 통해서 유일하게 6가 크롬이 포함되지 않은 조합인 수은과 카드뮴 조합만이 독성 상호작용이 없는 IA모델에 강한 유사성을 보였고, 세 가지 중금속이 모두 혼합된 ternary test가 상호작용과 상승작용이 있었지만 MDR 지표의 경향이 수은과 카드뮴 조합과 유사한 결과를 보인 것으로 보았을 때 6가 크롬이 상호작용을 유발하는 인자라고 판단할 수 있었다. 본 연구에서 수행한 중금속 외의 구리, 아연 등 essential metals 또는 여러 유기오염물질을 대상으로 가능한 모든 조합에 대하여 추가적인 연구를 수행한다면 독성 상호작용을 유발하는 물질을 더욱 정확하게 특정 지을 수 있을 것이라 판단한다. 뿐만 아니라 여러 중금속 상호작용에 대한 연구결과를 바탕으로 더욱 다양한 관점에서 신뢰도가 높은 생태독성 모니터링 시스템을 구축할 수 있으며 실제 현장에 배치하여 중금속 오염수에 의한 환경오염을 더 효과적으로 예방할 수 있을 것이라고 기대한다.
Acknowledgements
본 연구는 환경부 공동연구사업의 지원으로 수행되었습니다(과제번호: 2018002270001). 이에 감사드립니다.
Notes
Declaration of Competing Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.