M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, Dy) 촉매상에서 메탄의 부분산화반응에 의한 청정에너지인 수소 제조
Hydrogen Production of Clean Energy by Partial Oxidation of Methane over M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, and Dy) Catalysts
Article information
Abstract
목적:
우리는 지구의 온실효과의 원인 환경문제를 해결하기 위하여 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu 및 Dy) 촉매상에서 천연가스의 주성분인 메탄의 부분 산화 반응(POM)을 수행하여 수소를 제조하고, Ni(5)/SBA-15 촉매에 조촉매인 란타늄(Tb, Pr, Eu 및 Dy)를 1wt% 추가하는 효과를 평가하고 XPS, FETEM, EDS 등의 기기를 사용하여 촉매의 활성점을 규명하고자 한다.
방법:
촉매의 활성은 고정층 상압 유통식 반응기를 사용하여 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu 및 Dy) 촉매상에서 메탄의 부분산화 반응(POM)을 수행하여 조사하였다. 촉매의 활성점은 XPS, FETEM 및 EDS 등의 기기 분석을 통하여 확인되었다.
결과 및 토의:
:XPS 결과는 Ni(5)/SBA-15 촉매에 Eu를 1wt% 첨가하면 Ni2p3/2의 원자 백분율이 0.12%에서 0.15%로 증가하고, 격자 산소와 산소 결함를 포함하는 산소 원자수는 Ni(5)/SBA-15 촉매에 비해 1.32배 증가한다. 또한, O1s 특성 피크는 더 낮은 결합 에너지 쪽으로 화학적으로 이동한다. FETEM 이미지는 Ni와 Eu의 나노입자가 환원된 Eu(1)-Ni(5)/SBA-15 촉매의 표면에 균일하게 분포되어 있음을 보여준다. EDS 매핑으로 Eu, Ni, O 및 Si의 원소 분포의 양을 확인하였다. 이러한 현상은 생성된 산소 결함이 산소의 이동도를 증가시켜 촉매 표면에 Ni0 나노 입자의 분산을 증가시켜 촉매의 활성을 향상시킨 것으로 판단된다. 또한, Eu3+, Ni2+ 및 SBA-15 담체 사이의 강한 금속 지지체 상호작용(SMSI) 효과에 의해 Ni 입자의 소결이 방지되어 촉매의 안정성이 유지되는 것으로 생각된다. Ni(5)/SBA-15 촉매의 메탄의 전화율은 12h의 반응 후에 빠르게 비활성화되는 반면 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu 및 Dy) 촉매는 12h~50h의 반응에서 일정하고 안정적인 촉매 활성을 보여준다. 촉매의 수소 수율은 Eu (1)-Ni(5)/SBA-15(57.2%, 25h)>>Dy(1)-Ni(5)/SBA-15(49%, 14h)>Pr(1)-Ni(5)/SBA-15(43.1%, 29h)>Tb(1)-Ni(5)/ SBA-15(42.8%, 25h) 순이었다.
결론:
Ni(5)/SBA-15 촉매는 12h의 반응 후에 메탄의 전화율이 빠르게 감소되는 반면에 조촉매인 란타늄(Tb, Pr, Eu 및 Dy)을 Ni(5)/SBA-15 촉매에 1wt%를 추가한 M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, Dy) 촉매는 산소 결함을 만들어 산소의 이동도를 증가시켜 촉매 표면상에 Ni0의 나노입자의 분산을 증가시켜 12h ~ 50h의 반응에서 일정하고 안정적인 메탄의 전화율 과 수소의 수율을 보여주었다. 또한, M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, Dy) 촉매의 강한 금속 지지체 상호작용(SMSI) 효과는 촉매 표면상의 Ni0 나노입자의 소결을 예방한다.
Trans Abstract
Objectives
In order to solve the environmental problem that is the cause of the global greenhouse effect, We want to evaluate the effects of 1wt% of lanthanum (Tb, Pr, Eu, and Dy) as a promoter added to Ni(5)/SBA-15 catalyst by performing the partial oxidation of methane, the main component of natural gas, to hydrogen over M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu and Dy) catalyst and to identify the active site of the catalyst by means of instrumentation such as XPS, FETEM, and EDS.
Methods
The catalytic activities of the partial oxidation of methane (POM) to hydrogen as a clean energy over M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, and Dy) catalysts are investigated using a fixed bed flow reactor under atmospheric pressure. The active sites of the catalyst are verified through instrumental analysis with XPS, FETEM, and EDS.
Results and Discussion
The XPS results show that when 1wt% of Eu is added to the Ni(5)/SBA-15 catalyst, the atomic percent of Ni2p3/2 is increased from 0.12% to 0.15%, and the oxygen atomic number including lattice oxygen and oxygen vacancies is increased 1.32 times compared to that of the Ni(5)/SBA-15 catalyst. Further, the O1s characteristic peak is chemically shifted toward the lower binding energy. The FETEM images show that the nanoparticles of Ni and Eu are uniformly distributed on the surface of a reduced Eu(1)-Ni(5)/SBA-15 catalyst. The EDS mappings of Eu, Ni, O, and Si are confirmed. It is believed that the activity of the catalyst was improved by increasing the dispersion of nanoparticles of Ni0 on the surface of the catalyst due to the increased mobility of oxygen by creating oxygen vacancies. Methane conversion of Ni(5)/SBA-15 catalyst was deactivated rapidly after the reaction time of 12h whereas M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, and Dy) catalyst showed constant and stable catalyst activity until 12h ~ 50h. It is also considered to be the case that the sintering of Ni particles is prevented by the strong metal support interaction (SMSI) effect between Eu3+, Ni2+, and the SBA-15 carrier, and the stability of the catalyst is thereby maintained. The hydrogen yield of catalyst was in the order of Eu(1)-Ni(5)/SBA-15(57.2%, 25h) >> Dy(1)-Ni(5)/SBA-15 (49%, 14h) > Pr(1)-Ni(5)/SBA-15 (43.1%, 29h) > Tb(1)-Ni(5)/SBA-15 (42.8%, 25h).
Conclusion
The Ni(5)/SBA-15 catalyst was showed that the conversion of methane was rapidly reduced after a reaction time of 12h, while when 1wt% of lanthanum (Tb, Pr, Eu and Dy) as a promoter was added to the Ni(5)/SBA-15 catalyst, the conversion of methane and yields of hydrogen were showed constant and stable catalytic activity in the reaction time of 12h to 50h. It is believed that the conversion of methane was improved by increasing the dispersion of nanoparticles of Ni0 on the surface of the catalyst due to the increased mobility of oxygen by creating oxygen vacancies. Moreover, sintering of Ni0 nanoparticles on the surface of M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, Dy) catalyst is prevented by strong metal support interaction (SMSI) effect.
1. 서 론
메탄의 부분산화 반응(POM)은 지구 온난화로 인한 환경 문제에 대응하여 전 세계적으로 수소 에너지에 대한 수요가 증가함에 따라 현재 큰 관심을 받고 있다[1-3]. 천연 가스의 주요 성분인 메탄은 연료 및 화학 합성을 위한 중요한 탄화수소 공급원료이다. 그러나 메탄의 C-H 결합 에너지는 413 kJmol-1이기 때문에 메탄에서 수소로의 전환에는 많은 에너지가 필요하다. 대부분의 수소는 메탄 수증기 개질 반응(1) [4-6]을 사용하여 얻는다. 메탄 건식 개질 반응(2)도 수소를 생산하는 데 사용할 수 있다. 이러한 반응은 에너지 및 자본 비용이 많이 들 뿐만 아니라 흡열 반응이다. 한편, POM(3) [7-9]은 발열 반응이고 에너지를 절약하며 작은 반응기만 필요하다. 메탄 수증기 개질 반응, 메탄 건식 개질 반응 및 POM은 반응 중에 모두 수성 가스 이동 반응(4) [10-12]을 동반한다.
Rh, Pd, Ru, Ir, Pt와 같은 귀금속 촉매는 POM에서 수소[13-15] 및 합성가스[16-18]를 생산하는데 코크스 저항성이 크며 활성이 높고 안정한 촉매이지만 소량 생산하는데 비용이 많이 든다. Fe, Co, Ni와 같은 전이금속은 POM에서 좋은 촉매 활성을 가지며 귀금속 촉매보다 훨씬 저렴하여 POM 연구에 널리 사용되고 있다. 이 중 Ni 촉매[19-21]는 증가된 촉매 활성, 안정성 및 저렴한 비용으로 인해 POM에서 특히 관심이 많다. 그러나 Ni 촉매는 초기 활성은 양호하나 메탄 분해(5) 및 CO 불균등화(6) 반응으로 촉매 표면상에 많은 탄소를 침적시켜 촉매의 활성을 급격히 감소시킨다.
또한, 낮은 Tammann 온도에 의한 니켈 입자의 소결 및 핫스팟 형성으로 인해 촉매의 급속한 비활성화가 발생한다[22]. 따라서 POM에서 Ni 촉매의 활성과 안정성을 향상시키기 위해서는 촉매 담체와 조촉매를 적절히 선택하는 것이 매우 중요하다. N. Tsubaki 등[23]은 Ni 촉매의 알칼리 및 알칼리 토금속과 희토류 금속이 촉매 표면의 탄소 침적을 예방하고 촉매 안정성을 향상시킨다고 보고했다. 희토류 금속은 산소 저장 능력, 산소 결함 형성, 알루미나 담체의 열 안정성 및 활성 종의 분산을 증진시키는데 기여하는 것으로 제안했다[24,25]. O. U. Sazuwa과 S. Z. Abidin [26]는 란탄족 계열과 결합된 다양한 촉매가 CH4 개질 공정에서 활성 금속 부위에서 탄소를 효과적으로 제거하는 데 사용되었음을 검토했다. S. K. Bhargava 등[27]은 란타나이드(Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm)으로 촉진된 Ni/γ-Al2O3 촉매가 촉진되지 않은 촉매인 Ni/γ-Al2O3와 비교하여 60h의 반응 동안 뚜렷한 효율을 보였다고 보고했다. 이러한 중요한 관찰은 주로 촉진되지 않은 촉매상에 침적된 탄소 양에 비해 촉진된 Ni/γ-Al2O3 촉매의 표면상에 침적된 비정질 코크스의 양이 적기 때문이다. 란탄족 산화물은 촉매의 염기도에 영향을 미치는 f 궤도 전자 배열을 갖는 것으로 알려져 있다[28]. J. Gong 등[29]은 La로 개질된 Ni계 규칙인 중기공성 촉매가 POM에서 강한 금속 지지체 상호작용(SMSI) 효과를 나타내고 촉매상에 탄소 침적을 방지하며 촉매의 염기성을 향상시킨다고 보고하였다. 란탄족 촉진제가 SMSI 효과로 인해 담체와 Ni 간의 화학 결합을 감소시킨다는 많은 연구가 있다[30-35]. Tb, Pr, Eu, Dy와 같은 란탄 금속은 Ni 촉매를 촉진해서 높은 촉매 활성과 열적 안정성을 유지하고 탄소 침착을 방지하는 역할을 할 수 있는 화학적 성질을 갖는 것으로 생각된다. 촉매 담체로는 고온에서의 열안정성과 중기공성이 우수한 SBA-15 [36-38]를 사용하였다. 우리는 M(1)- Ni(5)/SBA-15(M=Tb, Pr, Eu 및 Dy) 촉매상에서 메탄의 부분 산화 반응(POM)을 수행하여 수소를 제조하고, Ni(5)/SBA-15 촉매에 조촉매인 란타늄(Tb, Pr, Eu 및 Dy)를 1wt% 추가하는 효과를 평가하고 XPS, FETEM, EDS 등의 기기를 사용하여 촉매의 활성점을 규명하고자 한다.
2. 실험 방법
2.1. 촉매제조
M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, Dy) 촉매는 담지법을 사용하여 다음과 같이 제조하였다. 괄호 안의 숫자는 담지된 무게 퍼센트를 의미한다. Ni(NO3)2・6H2O (0.025 g), Dy(NO3)3・6H2O (0.003g), Eu(NO3)3·6H2O (0.003 g), Pr(NO3)3·6H2O (0.003 g), and Tb(NO3)3·6H2O (0.003 g)과 착화제인 구연산/(M+Ni)=1.5M을 에탄올에 용해시킨 후 SBA-15(Aldrich) 담체 0.1g을 반응기에 넣고 5h 동안 교반기로 균일하게 혼합하였다. 얻어진 침전물은 여과후 100℃의 건조기에서 24h 동안 건조시켰다. 건조된 샘플은 전기로(Eyela, TMF-1000, Eyela, Japan)에서 773K에서 5h 소성 공정 과정을 거쳐 M(1)- Ni(5)/ SBA-15 (M=Tb, Pr, Eu, Dy) 촉매를 만든 후 150에서 200 메시로 분쇄하여 사용하였다.
2.2. 촉매 특성화
XPS 스펙트럼은 1×10-9 mbar 및 1.75keV의 운전 조건에서 HP-X-선 광전자 분광계(Thermo Scientific K-Al-pha+)를 사용하여 Alkα X-선으로 얻었다. FETEM 이미지는 200 kV의 가속전압에서 Jeol Jem-2100F를 사용하여 얻었으며, EDS (X-MaxNT, 80T model, UK)를 사용하여 촉매의 각 원소에 대한 K 또는 L 시리즈 이미지로 층상 이미지를 얻었다.
2.3. 촉매 활성도 실험
촉매반응은 고정층 유통식 반응기를 사용하여 상압에서 수행된다. 내경이 10mm인 석영반응기를 사용하여 반응기 내의 석영솜 위에 0.05g의 분말 촉매를 넣는다. 공정변수인 반응온도, 압력, CH4/O2 몰비, GHSV(Gas Hourly Space Velocity)는 각각 973K, 1atm, 2, 1.08×105 ml/gCat.·h 이었다. 반응기의 온도는 K형 열전대를 반응기 내의 촉매상에 위치시키고 PID 제어기를 사용하여 원하는 온도를 ±1K의 범위 내에서 제어한다. 반응물의 조성은 각각의 실린더에 부착된 압력계를 사용하여 반응물을 퍼지한 후 질량유량계를 사용하여 제어한다. 생성물은 Porapak Q와 Molecular sieve 5A의 컬럼을 GC (Shimadzu Co., Model 14B, 일본)에 병렬로 연결하고 TCD로 분석한다. 촉매는 반응하기 전에 수소를 773K에서 5h 동안 20 ml/min의 유속으로 보내 환원시킨 후 283K/min의 속도로 반응 온도를 증가시켜 사용하였다.
3. 결과 및 고찰
3.1. 촉매 특성화
Table 1은 XPS에 의한 반응 전 환원된 Eu(1)-Ni(5)/SBA-15 및 Ni(5)/SBA-15 촉매에 대한 핵심 전자 준위의 원자 백분율을 나타낸다. 1wt%의 Eu가 Ni(5)/SBA-15 촉매에 첨가될 때, Ni2p3/2의 원자 백분율는 0.12%에서 0.15%로 증가한다.
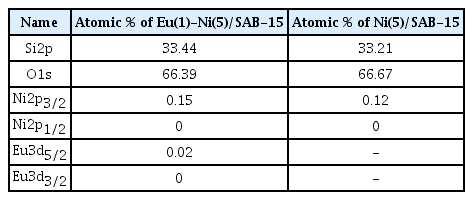
Atomic % of core electron levels for reduced Eu(1)- Ni(5)/SAB-15 and Ni(5)/SBA-15 before reaction according to XPS analysis.
Table 2는 XPS 분석에 따른 반응 전 환원된 Eu(1)- Ni(5)/ SBA-15 촉매와 Ni(5)/SBA-15 촉매의 핵심 전자 준위의 원자비를 나타낸다. Ni(5)/SBA-15 촉매에 대한 환원된 Eu(1)- Ni(5)/SBA-15 촉매의 Si2p, O1s 및 Ni2p3/2 원자의 비율은 각각 1.298, 1.284 및 1.508이다. 이러한 현상은 SiO2 격자의 Si4+ 일부 이온이 Ni2+ 또는 Eu3+ 이온으로 대체하여 격자에 산소 결함[39,40]을 만들어 Ni2p3/2 원자의 분산을 증가시키는 것으로 사료된다.

Atomic ratio of core electron levels for reduced Eu(1)-Ni(5)/SBA-15 to Ni(5)/SBA-15 before reaction according to XPS analysis.
Fig. 1은 반응 전 환원된 Eu(1)-Ni(5)/SBA-15 촉매의 Si2p, O1s, Ni2p3/2, Ni2p1/2, Eu3d5/2, Eu3d3/2에 대한 XPS 스펙트럼의 조사를 보여준다.
Fig. 2는 환원된 Eu(1)-Ni(5)/SBA-15 및 Ni(5)/SBA-15 촉매의 O1s 핵심 전자 준위의 화학적 이동의 XPS 스펙트럼을 보여준다. Eu(1)-Ni(5)/SBA-15 촉매의 O1s의 특성 피크는 533.1 및 533.9 eV에서 나타났고, Ni(5)/SBA-15 촉매에서는 533.3 및 534.3 eV에서 나타났다. 이러한 특성 피크는 각각 격자 산소(O2-)와 산소 결함(O-)이었다. Eu(1)-Ni(5)/SBA15 촉매의 격자 산소 및 산소 결함을 포함하는 산소 원자 수는 Ni(5)/ SBA-15 촉매 보다 1.32배 더 많았다. Ni(5)/SBA-15 촉매에 Eu를 1wt%를 첨가하면 환원된 Eu(1)-Ni(5)/SBA-15 촉매의 O1s 핵심 전자 준위의 특성 피크가 533.3 eV에서 533.1 eV으로 더 낮은 결합 에너지로 화학적 이동을 하였다. 이러한 현상은 서로 다른 이온 반경을 가진 Eu3+(185 pm), Ni2+(135 pm), Si4+(110 pm)가 상호 치환되어 격자 상수의 변화를 가져와 산소 결함을 가진 부분적으로 환원된 담체의 SiOx에서 촉매 표면상의 Ni 나 Eu로 전자가 이동되어 금속 나노 입자의 전자 밀도를 증가시켜 O1s의 결합에너지가 작아진 것으로 사료된다.
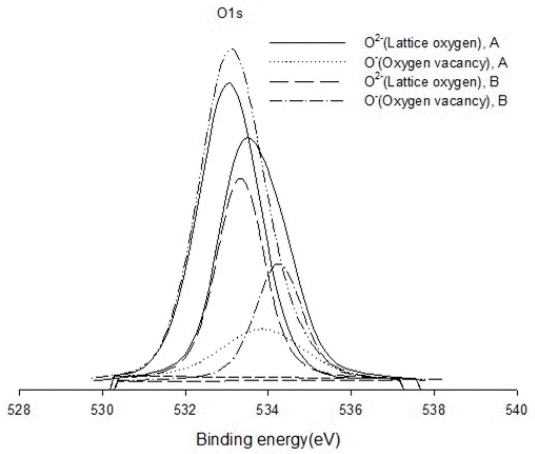
XPS spectra of O1s core electron levels for reduced Eu(1)-Ni(5)/SAB-15(A) and Ni(5)/SAB-15(B) before reaction.
Fig. 3은 Ni2p3/2의 핵심 전자 준위의 XPS 스펙트럼을 보여준다. Ni2p3/2의 특성 피크는 855.0, 857.1 및 860.6 eV에서 나타났고 그것은 각각 Ni0, Ni2+ 및 Ni 위성이었다. Ni(5)/ SBA-15 촉매에 Eu를 1wt% 첨가하면 환원된 Eu(1)-Ni(5)/ SBA-15 촉매의 Ni0 특성 피크가 증가하는 반면 환원된 Ni(5) 촉매의 Ni0 특성 피크는 감소한다. 이러한 현상은 생성된 산소 결함이 산소의 이동도를 증가시켜 촉매 표면에 Ni0 나노 입자의 분산을 증가시켜 촉매의 활성을 향상시킨 것으로 판단된다[39,40]. 또한 Eu3+, Ni2+ 및 SBA-15 담체 사이의 SMSI 효과[41]에 의해 Ni 입자의 소결이 방지되어 촉매의 안정성이 유지되는 경우로 사료된다.
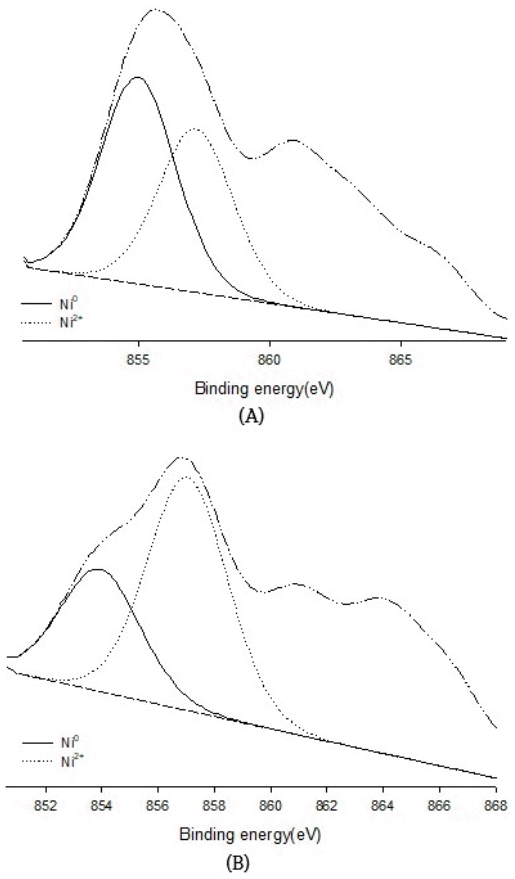
XPS spectra of Ni2p3/2 core electron levels for reduced Eu(1)-Ni(5)/SAB-15(A) and Ni(5)/SAB-15(B) before reaction.
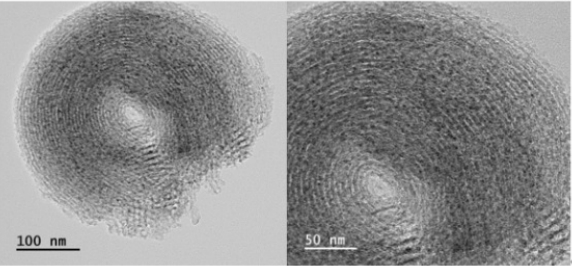
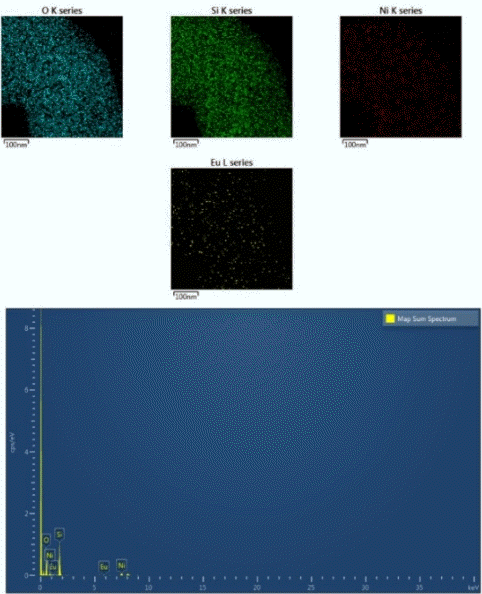
Fig. 4는 반응 전 환원된 Eu(1)-Ni(5)/SBA-15 촉매의 TEM 이미지를 보여준다. Fig. 4와 같이 넓은 표면적의 중기공성을 가진 SBA-15 촉매 담체 표면에 존재하는 -OH에 치환된 -ONi 또는 -OEu의 나노 입자들이 잘 분포되어 있음을 알 수 있다. Fig. 5와 Fig. 6은 EDS-계층화된 이미지와 촉매 표면의 Eu, Ni, O 및 Si 매핑을 보여준다.
촉매 표면에 Eu, Ni, O, Si 원소의 나노입자가 잘 분포되어 있음을 Fig. 5의 범례를 보고 알 수 있고, Eu, Ni, O, Si 원소의 원자 백분율은 각각 0.25, 1.83, 66.78, 31.13이었다.
3.2. 촉매 활성도
Fig. 7은 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu, Dy) 촉매의 반응 시간에 대한 메탄의 전환율을 보여준다. Ni(5)/SBA-15 촉매의 메탄 전화율은 12h의 반응 후에 빠르게 비활성화가 진행되었으나 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu, Dy) 촉매의 활성은 약 50h 까지 유지됨을 알 수 있었다. 이러한 현상은 메탄의 분해와 CO의 불균등화 및 낮은 Tammann 온도에 의한 Ni 입자의 소결[42]을 통해 Ni(5)/SBA- 15 촉매 표면상에 많은 탄소가 침착[43]되기 때문인 것으로 사료된다. 반면에 M(1)- Ni(5)/SBA-15(M = Tb, Pr, Eu, Dy) 촉매는 M3+, Ni2+ 및 SBA-15 사이의 상호 치환에 의해서 산소의 결함을 가진 담체의 SiOx가 SiO4로 산화를 피하기 위해서 Ni와 강하게 결합을 하는 SMSI 효과[41]에 의해 Ni 입자의 소결이 방지되고, 산소의 이동도를 증가시켜 촉매 표면상에 Ni0의 나노입자의 분산을 증가시켜 촉매의 활성이 유지되는 것으로 판단된다. M(1)-Ni (5)/SBA-15(M = Tb, Pr, Eu, Dy) 촉매의 초기 메탄 전환율은 60~80%이다.

Conversion of CH4 obtained in the partial oxidation of methane over M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, and Dy) catalysts in the packed bed reactor: P = 1 atm, T = 700 ℃, CH4/O2 = 2, and GHSV= 1.08 × 105 mLg-1h-1.
Fig. 8은 M(1)-Ni(5)/SBA-15(M=Tb, Pr, Eu, Dy) 촉매의 반응 시간에 대한 수소 수율을 나타낸다. 촉매의 수소 수율은 Eu(1)-Ni(5)/SBA-15(57.2%,25h)>>Dy(1)-Ni(5)/SBA-15 (49%,14h)>Pr(1)-Ni(5)/SBA-15(43.1%,29h)>Tb(1)- Ni(5)/SBA-15(42.8%, 25h) 이었다. 메탄의 전환율 과 수소의 수율은 식 (7) 및 (8)에 의하여 각각 계산되었다:
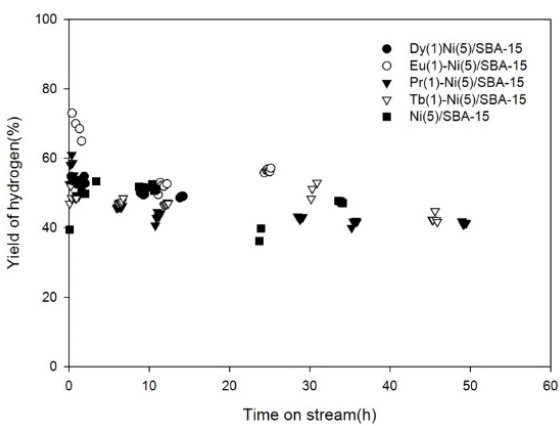
Yield of H2 obtained in the partial oxidation of methane over M(1)-Ni(5)/SBA-15 (M = Tb, Pr, Eu, and Dy) catalysts in the packed bed reactor: P = 1 atm, T = 700 ℃, CH4/O2 = 2, and GHSV = 1.08 × 105 mLg-1h-1.
4. 결 론
M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu, Dy) 촉매상에서 POM을 수행하여 수소 생산을 위한 촉매의 활성도와 촉매의 활성점을 조사하였다.
1) Ni(5)/SBA-15 촉매에 1wt%의 Eu를 첨가했을 때 Ni2p3/2의 원자 백분율는 0.12% 에서 0.15%로 증가하였다. Eu(1)- Ni(5)/SBA-15 촉매의 격자 산소와 산소 결함을 포함하는 산소 원자수는 Ni(5)/SBA-15 촉매보다 1.32배 많았으며 O1s 핵심 전자 준위의 특성 피크는 더 낮은 결합 에너지 쪽으로 화학적 이동을 헸다.
2) TEM 이미지는 Eu와 Ni의 원소가 촉매 표면에 규일하게 잘 분포되어 있음을 보여준다. EDS-계층화된 이미지와 Eu, Ni, O, Si의 매핑은 촉매 표면에 Eu, Ni, O, Si 원소의 나노입자가 잘 분포되어 있음을 보여주었고 Eu, Ni, O 및 Si 원소의 원자 백분율이 각각 0.25, 1.83, 66.78 및 31.13임을 나타낸다.
3) Ni(5)/SBA-15 촉매의 메탄의 전화율은 12h의 반응 후에 빠르게 비활성화되는 반면 M(1)-Ni(5)/SBA-15(M = Tb, Pr, Eu 및 Dy) 촉매는 약 50h 까지 일정하고 안정적인 촉매 활성을 나타내었다.
4) 수소 수율의 활성 순서는 Eu(1)-Ni(5)/SBA-15(57.2%, 25h) >> Dy(1)-Ni(5)/SBA-15(49%, 14h) > Pr(1)-Ni(5)/SBA- 15(43.1%, 29h) > Tb(1)-Ni(5)/SBA-15(42.8%, 25h)이었다.
Notes
Declaration of Competing Interest
The authors declare that they have no conflict of interest.