음식물쓰레기 2상 혐기성 소화 시스템 내 메탄 생성조 혼합액의 막 여과 특성
A Study on Membrane Filtration Characteristics of Methanogenic Mixed Liquor in Two Phase Anaerobic Digestion of Food Waste
Article information
Abstract
목적
본 연구에서는 2상 중온 혐기성 소화공정의 메탄 생성조 고형물체류시간(SRT)을 증가시켜 메탄 생산량 증대를 위해 혼합액의 막 분리 특성을 실험적으로 조사하였다.
방법
메탄 생성조 혼합액의 입경분포 0.5~700 µm의 범위에 기반하여 3등급의 막(MF, UF, NF)으로 Stirred cell과 평판형 모듈을 이용해 혼합액의 여과실험을 수행하였다. 나아가 UF막의 막 오염 유발 물질은 SEM-EDS, FTIR, SEC를 이용해 분석하였다.
결과 및 토의
실험결과 UF 막이 투과 계수(2.51 L/m2・h・bar)와 여과 후 표면세척에 따른 투과 계수의 회복률(100%) 및 막 여과 저항(Total 7.15.E+13 m-1)으로부터 가장 안정적인 여과가 가능한 것으로 나타났다. UF 막을 대상으로 평판형 모듈을 이용한 십자류 흐름 여과실험에서 투과 계수가 평균 18 L/m2・h・bar로 유지되었고, 막 오염은 주로 표면에 형성된 젤 및 케익층에 기인하였으나 물리적 세척으로 약 90%의 투과 유속이 회복되었다. 혼합액의 여과에 따른 막 오염 유발 물질은 탄수화물과 단백질의 분해 산물 등의 유기 성분이 주를 이루었고 소량의 무기 성분(염분, Struvite)으로 확인되었다.
결론
이상의 막 여과 특성으로부터 UF 막 결합 2상 혐기성 소화 공정은 새로운 종류의 음식물쓰레기 처리 시스템으로써 메탄 생성조의 고형물 체류 시간을 연장을 위한 적용가능성이 높은 것으로 판단된다.
Trans Abstract
Objectives
An experimental study was conducted to investigate the membrane filtration characteristics of mixed liquor in methanogenic reactor to extend solid retention time (SRT) in food waste anaerobic digestion system.
Methods
On the basis of the particle size distribution (0.5~700 µm) of the methanogenic mixed liquor, three grade membranes (MF, UF, NF) were tested in a stirred cell filtration and a plate type module. Furthermore foulants of membrane, especially UF, was investigated by SEM-EDS, FTIR, SEC.
Results and Discussion
As a result UF membrane was selected for stable filtration of the liquor in terms of flux (2.51 L/m2・h・bar) and the flux recovery (100%) as well as filtration resistance (Total 7.15.E+13 m-1). Average flux was 18 L/m2・h・bar for the selected UF membrane in cross flow filtration using a flat plate module. The filtration results showed that membrane fouling was caused by gel and cake layer formed on the membrane surface and 90% of the initial flux could be recovered by physical washing. It was identified that major fouling causing materials were byproducts of carbohydrate and protein decomposition, and small amount of inorganic substance detected on the membrane surface were salt and struvite like materials.
Conclusions
Based on the membrane filtration characteristics analyzed from the study, the UF membrane coupled anaerobic digestion is feasible to be applied as a novel food waste treatment system for SRT extension of the methanogenic reactor.
1. 서 론
최근 기후변화에 대응하여 화석연료 사용량 저감을 위하여 대체 에너지의 개발에 대한 관심이 높아지고 있다. 이에 혐기성 소화는 생분해 가능한 유기성 폐기물로부터 메탄과 같은 바이오 에너지를 생산함으로써 환경 및 위생적 측면뿐 아니라 경제적으로도 상당히 유용한 공정으로 인식되고 있다[1]. Rodriguez-Iglesias 연구팀에 의하면 파일럿 규모 실험에서 음식물쓰레기의 혐기성 소화에 의하여 메탄 함량 66%의 바이오가스를 생산할 수 있으며[2], Sawayama 등은 유기성 폐기물의 처리를 Upflow anaerobic sludge blanket (UASB) 방식의 혐기성 소화 공정을 통한 에너지 회수가 도시 고형폐기물의 소각을 통한 열에너지회수보다 우수함을 보여주었다[3].
혐기성 소화는 혐기성 미생물 작용으로 산생성(Acidogenesis and Acetogenesis) 및 메탄생성(Methanogenesis)의 2단계로 이루어지며, 이와 같은 2단계 반응이 단일 반응조 또는 2개의 반응조로 나뉘어 각각 일어나는가에 따라 단상(Single phase) 및 2상(Two phase) 혐기성 소화 공정으로 구분한다. 단상 혐기성 소화는 단순하면서 경제적이나 단일 반응조에서 2단계의 반응이 공존함으로써 특히 메탄생성단계의 생물학적 반응의 최적화가 어렵다. 이에 반하여 2상 혐기성 소화는 2개의 반응조로 구분되어 다소 경제적인 면에서 부족하지만 산생성 단계와 메탄생성 단계의 생물학적 반응을 최적화함으로써 메탄생성 미생물 성장의 안정화에 의하여 바이오가스 중 메탄가스의 함량을 최대화할 수 있다. Shen et al.은 2 g VS/L・day 이상의 유기물 부하에서 단상 혐기성 소화 공정을 운전할 때 pH가 낮아지는 반면 2상 혐기성 소화 공정은 pH의 저하 없이 안정적으로 운전되었으며 동시에 높은 메탄 수율과 유기물 처리용량을 나타내었다[4].
혐기성 소화 공정의 운전에 미치는 영향 인자로서 pH와 온도를 들 수 있다. 특히 온도는 고온(45-70℃) 및 중온(20-40℃)으로 구분되는 혐기성 미생물그룹별 활성도뿐만 아니라 기질의 용해도 및 대사속도에 미치는 영향도 크다. 그러나 고온 혐기성 소화는 반응속도가 빠르나 온도에 민감한 미생물의 활성을 유지하기 위하여 고도의 운전기술이 요구된다. 이에 비하여 중온 혐기성 소화는 미생물 반응이 환경변화에 민감하게 작용하지 않음으로 비교적 안정적인 운전이 가능하다[5]. 또한, 혐기성 소화 시스템의 설계 및 운전에 미치는 중요한 인자는 체류시간과 유기물 부하(OLR: organic loading rate)로 알려져 있다[1]. 일반적으로 반응속도가 낮은 혐기성 소화는 수리학적 체류시간(HRT: hydraulic retention time)과 고형물 체류시간(SRT: solid retention time)을 동일하게 운전하므로 비교적 긴 HRT에 의한 소화조의 용량이 크게 요구된다. 게다가 고농도의 유기물을 처리하는 경우에는 OLR이 높아져 공정의 안정적인 운전이 어려워질 수 있다[6]. Salminen 연구팀은 HRT를 조절하는 연구에서 가금류 도축장 폐기물을 처리하는 중온 혐기성 소화조의 HRT가 50~100일 일 때 공정이 안정적으로 운전되었으나, HRT가 12~30일로 줄었을 때는 휘발성 유기산(VFAs: volatile fatty acids)의 축적과 메탄수율의 저하가 발생한 것으로 보고하였다[7]. 이에 따라 혐기성 소화 시스템의 설계 및 운전의 최적화로 바이오가스 중 메탄 함량을 극대화함은 물론 시설의 경제성을 고려하여 소화조의 체류시간(HRT 또는 SRT)과 유기물 부하를 적정하게 유지해야 함을 알 수 있다. Nagao 연구팀에 의하면 단상 중온 혐기성 소화의 SRT를 60일로 유지하고 HRT 16일에서 유기물 부하를 9.2 g VS/L・day까지 증가시켰을 때 메탄생성 수율이 455 mL/g・day로 2상 중온 혐기성 소화의 360~373 mL/g・day보다 높게 나타나 혐기성 소화 시스템에서 SRT를 HRT와 분리하여 높게 유지함으로써 메탄생성량을 증가시킬 수 있음을 알 수 있다[8].
막 결합형 혐기성 소화(AnMBR: anaerobic membrane bioreactor)는 메탄생성조 미생물의 유실을 방지하여 SRT를 HRT와 분리하여 조절할 수 있는 기술로써 짧은 HRT에서도 고농도 유기물을 안정적으로 처리할 수 있다[9,10]. Apples 연구팀은 SRT가 길어질수록 바이오가스 생산량이 많아짐을 보여주었으며, 실험실 규모의 배치 실험결과에서 체류시간이 40일 이상일 때 바이오가스 최대생산량인 520 mL/g에 도달함을 보고했다[11]. Mei 연구팀은 생활하수의 처리에 AnMBR공정을 도입하여 생물 반응조의 HRT 최소 2.2시간에서 340일간 87%의 COD (chemical oxygen demand) 제거율을 유지하여 시스템을 안정적으로 유지할 수 있었다[12]. 한편 Amha 연구팀은 단상 AnMBR에 비해 2상 AnMBR의 메탄 발생량이 20.3% 높다는 점을 밝혔다[10]. 이러한 AnMBR의 실적용을 위하여 막의 파울링과 용해된 메탄의 회수 그리고 알칼리도 등 여러 가지 해결해야 할 문제점이 있으며 이 중 막의 파울링이 비용과 에너지 소비의 측면에서 가장 큰 문제점으로 부각되고 있다[13].
AnMBR은 막 모듈이 메탄 생성조 내부에 위치하는 침지형과 메탄 생성조 외부에 위치하는 순환형이 있다. Seib et al.은 순환형 막 모듈이 메탄 생성조 내 혼합액의 순환에 필요한 에너지 때문에 운전비용이 높음을 지적했다[14]. 그러나 순환형은 침지형에 비해 고형물 함량이 높아 막 오염이 쉽게 일어나는 폐수를 처리하는 경우 막 오염에 대한 저항과 투과 유속이 높으며 막 모듈과 분리막의 유지관리가 용이한 장점이 있다[15-17].
Kim은 일반적인 견해에 따른 Microfiltration (MF)과 Ultrafiltration (UF)의 비교 및 선정은 적합하지 않음을 지적하고 있다[18]. 즉, 여과 대상 시료의 특성에 따라 투과 유속 및 처리 수의 수질이 우수한 막이 다를 수 있다. Castaing은 미세조류를 제거를 목적으로 MF와 UF를 비교한 결과 MF가 우수한 투과 유속을 보였으며 주요 파울링 메커니즘은 케익층 형성에 의한 것임을 밝혔다[19]. Sun은 조류의 배양을 목적으로 MF와 UF를 비교하였으며, 같은 실험조건에서 두 막의 성능이 유사하게 나타났고 막 면 유속을 증가시켜 파울링을 억제함으로써 투과 유속을 높게 유지할 수 있음을 보였다[20]. Dominguez는 동일한 유기물 부하율에서 MF와 UF의 성능을 비교 분석하였을 때 MF가 투과 유속의 안정성 그리고 세척효율이 UF보다 높은 결과를 나타냈다[21]. Zulaikha는 음식점 폐수의 처리를 위해 UF와 Nanofiltration (NF)를 적용한 실험에서 UF와 NF의 COD 배제율은 유사하였으나 UF의 Flux 회복률이 15~38%인 반면 NF의 Flux 회복률은 50% 이상인 점에서 NF가 적합하다고 보고한 바 있다[22].
본 연구에서는 3가지 등급의 분리막(MF, UF, NF)을 사용하여 2상 혐기성 소화 시스템의 메탄생성조 혼합액의 고액분리에 적합한 막을 선정하고자 각 막의 투과 유속의 변화를 실험적으로 조사하였다. 또한 막면유속과 물리적 세척에 의한 각 분리막의 여과 성능에 대한 영향을 관찰하였다. 마지막으로 가장 적합한 것으로 나타난 분리막을 십자류 여과 방식의 모듈에 장착하여 단기 여과 성능을 관찰하고 파울링 물질을 분석하였다.
2. 재료 및 방법
2.1. 실험장치 구성 및 운전
2.1.1. Stirred cell 여과
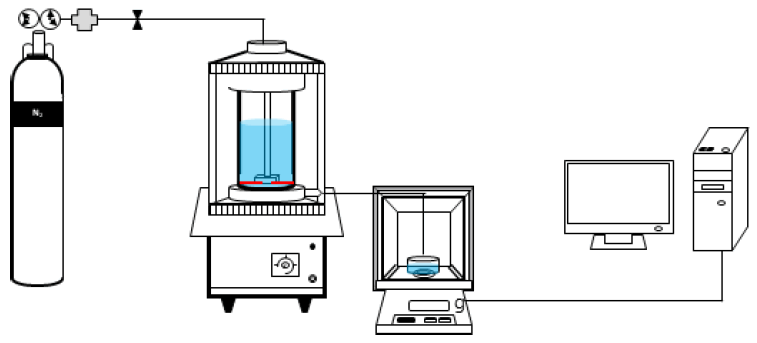
여과 방식(전량여과와 십자류 흐름 여과)에 따른 세 등급의 막(MF, UF, NF)에 대한 투과 유속(Flux) 변화와 회복률, 막 여과 저항을 비교하기 위해 Stirred cell (XFUF4701, Millipore)을 이용하였다[23]. 질소가스를 Cell의 상부에 공급하여 여과압력을 조정 및 유지하였으며, Cell 내부에 마그네틱 바가 장착되어있는 교반기로 교반 속도를 조절하여 막면 유속의 변화를 주었다. 투과수의 양을 1분마다 기록하여 투과 유속을 계산하였다. Fig. 1에 Stirred cell을 포함한 여과 장치의 구성을 나타내었다.
2.1.2. 십자류 흐름(Cross flow) 여과
Stirred cell에서는 막 표면에 회전력을 주어 십자류 여과 방식을 모사하였기 때문에 실제 십자류 여과 방식의 결과와 다를 수 있다[24]. 따라서 실제로 십자류 흐름 여과 방식을 적용할 수 있도록 Fig. 2와 같이 제작된 평판형 모듈을 사용하여 Table 2의 조건에서 여과했을 때의 투과 유속 감소와 회복률을 관찰하였다.
2.2. 실험 재료
2.2.1. 여과 대상 시료
음식물쓰레기를 처리하는 파일럿 규모(5 kg/day) 2상 중온 혐기성 소화 공정의 메탄생성조 내 혼합액을 여과대상 시료로 사용하였다. 혐기성 소화 공정의 유입 음식물쓰레기는 입경 2 mm 이하로 분쇄하여 수돗물과 1:1의 비율로 혼합하였으며 유기물 부하율은 3 g VS/L・day이다. 막의 손상을 최소화하고 실험장치의 막힘을 방지하기 위해 대상 시료를 600 µm의 체로 거른 뒤 막 여과를 수행하였다.
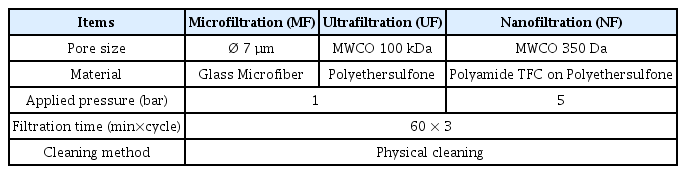
2.2.2. 분리막
Stirred cell 여과 실험에 사용된 막의 등급별로 재질과 공극의 크기, 실험조건을 Table 1에 나타내었다. MF와 UF의 여과압력은 1 bar로 설정하였으며 공극이 상대적으로 작은 NF의 여과 압력은 일반적으로 MF 및 UF보다 높게 설정되며 본 연구에서 사용된 Stirred cell의 가압 한계치에 따라 5 bar로 설정하였다. 여과 종료 후 막 표면을 스펀지로 가볍게 문지르고 증류수로 헹궈내어 물리적 세척을 수행하였으며 다음 실험에 사용되기 전까지 10%의 에탄올에 넣어 4℃에서 보관하였다.
2.3. 분석방법
2.3.1. 대상 시료의 성상 분석
대상 시료의 성상을 particle size distribution (PSD), pH, total chemical oxygen demand (TCOD), soluble chemical oxygen demand (SCOD), suspended solid (SS), total solid (TS), volatile solid (VS), VFAs 그리고 extracellular polymeric substances (EPS) 항목으로 분석하였다. 원심분리로 배제할 수 있는 입자의 크기를 관찰하기 위해 소화 슬러지 원수와 상등수(5000 rpm, 30 min)의 PSD를 각각 측정하였다. 입도분석기(Mastersizer2000, Malvern Korea)는 Mie Theory를 적용한 Laser diffraction방법을 기반으로 하고 있으며 측정 범위는 0.02~2000 µm이다. pH는 pH미터기(Seven compact pH/ION, Mettler Toledo)를 사용하였으며 TCOD와 SCOD는 CODcr법에 기초한 분석용 키트(2125925, Hach)를 이용해 분석하였다. SCOD와 VFAs 측정은 샘플을 5,000 rpm에서 30분간 원심분리한 후 상등액을 0.45 µm 시린지 필터로 여과한 뒤 수행하였다. VFAs는 고성능 액체크로마토그래피(LC-20A, Shimadzu)를 이용하여 분석하였으며, 검출기는 UV detector로 210 nm의 파장에서 측정하였다. 분석에 사용된 컬럼은 Bio-Rad사의 300 × 7.8 mm Aminex HPX-87H이다. 이동상으로 0.005 M 황산용액을 사용하였으며 유속은 0.6 mL/min으로 설정하였다. TS, VS 항목은 수질오염공정시험기준에 따라 분석하였다[25]. EPS는 열처리법을 통해 추출하고 VS 항목과 동일한 방법으로 분석하였으며[26], 추출된 EPS의 탄수화물과 단백질의 함량은 각각 Phenol-sulfuric acid법과 Lowry법을 이용해 측정하였다[27,28]. 분석에 사용된 증류수는 저항 18.2 Ω 이상이었으며 초순수 제조기(AQUAX-MAX-311, YL instruments)를 사용하여 제조하였다. 각 항목은 3회 분석한 결과의 평균값으로 나타내었다.
2.3.2. 투과 유속과 회복률
전자저울을 컴퓨터와 연결하여 투과수의 양을 1분 간격으로 측정하였다. 식 (1)에 따라 투과수의 양, 막 면적과 여과 시간을 고려하여 투과 유속(J)으로 표현하였다. 여과 전과 후의 투과 유속을 식 (2)에 대입하여 투과 유속 회복률(r)을 고려하였다.
여기서 Q는 투과수 양(L), A는 막면적(m2), Δt는 측정간격(h), Jp와 Jr은 각각 새 막과 여과 후 물리적으로 세척된 막의 증류수 투과 유속(L/m2・h)를 의미한다.
2.3.3. 막 여과 저항
세 가지 막의 여과 저항을 Darcy’s law 식에서 변형된 식 (3)과 (4)를 이용해 계산하였다. 여기서 ΔP는 막간 차압(kPa), µ는 투과수의 점도(Pa・s), Rm, Rp, Rc, Rt는 각각 막 고유의 여과 저항, 공극 막힘에 의한 저항, 케익층 형성에 의한 저항, 총 여과저항을 의미한다[29].
막 여과 저항은 1) 새 분리막으로 초순수를 여과할 때의 투과 유속 측정(Rm), 2) 메탄 생성조 혼합액을 여과할 때의 투과 유속 측정(Rt), 3) 막 표면의 케익층을 제거한 후 초순수를 여과할 때의 투과유속 측정(Rp), 4) 식 (4)를 활용하여 Rc를 계산하는 순서로 측정하였다.
2.3.4. 막오염 물질 분석
2.3.4.1. Scanning electron microscopy - Energy dispersive spectroscopy (SEM-EDS)
여과 전과 후의 막 표면을 관찰하기 위해 전계방사형 주사전자 현미경(CZ/MIRAⅠLMH, ZEISS)을 이용하여 가속 전압 20 kv에서 촬영하였다. 샘플은 실리카 겔이 충진된 데시게이터내에서 건조하여 실온에서 보관하였다가 측정 전에 Sputter coater (SC7640, Polaron)를 사용하여 막 표면을 백금으로 코팅하였다. 또한, 막오염에 관여하는 무기원소를 확인하기 위해 EDS분석을 함께 수행하였다.
2.3.4.2. Fourier transform infrared spectroscopy (FTIR)
막오염에 관여하는 유・무기 물질을 확인하기 위해 막 표면의 작용기 및 원소 결합형태를 FTIR spectrometer (FT/IR-6300, JASCO)를 이용하여 파장 범위 600~4000 cm-1에서 분석하였다.
2.3.4.3. Size exclusion chromatography (SEC)
유입 혼합액과 투과수, 농축수를 대상으로 물질의 분자량을 측정하기 위해 SEC를 수행하였다. 분석 장비는 HPLC-SEC으로 Protein Pak 125 Å (Waters) 컬럼을 사용하였으며 이동상으로 0.01 M NaCl을 0.5 mL/min으로 흘려주었다. 검출기는 UV (254 nm)이며 검량선 작성을 위한 표준 물질은 Polystyrene sulfonate이며 분자량 18, 8, 4.6, 1 kDa를 사용하였다.
3. 결과 및 고찰
3.1. 2상 혐기성 소화 메탄생성조 혼합액
2상 중온 혐기성 소화 공정의 혼합액 특성을 파악하기 위해 메탄생성조 내 혼합액의 pH, TCOD, SCOD, SS, TS, VS 및 VFAs의 농도를 분석하였다. 혼합액의 pH는 7.6±0.1으로 메탄생성에 최적 범위인 7~8을 유지하였다[30]. SS와 TS, VS는 각각 25.5±2.35 g/L, 29.4±1.59 g/L, 11.6±0.658 g/L로 고농도의 고형물을 함유하고 있으며 TCOD와 SCOD는 각각 19±1.2 g/L, 4.4±1.5 g/L였다. VFAs로써 Acetic acid와 Propionic acid는 각각 920±440 mg/L, 112±70 mg/L로 나타났고 Lactic acid와 Butyric acid는 검출되지 않았다. 이는 혐기성 소화 연구에서 메탄생성조의 pH가 6~7인 경우 Butyric acid가 높게 나타나지만 pH가 8에 가까운 경우 Acetic acid와 Propionic acid가 높은 농도로 나타난 결과와 유사하다[31]. 상기 혐기성 소화 액의 수질 분석 결과를 Table 3에 나타내었다.
원심분리기를 이용하여 회수할 수 있는 입자의 범위를 관찰하기 위해 메탄생성조 혼합액과 이를 원심분리한 이후 상등액을 대상으로 입도분석기(Mastersizer 2000, Malvern Korea)를 이용하여 0.02~2000 µm 범위에서 입도분포를 분석하였고 그 결과를 Fig. 3에 나타내었다. 입도분석을 위해 분석 시료는 초음파를 이용하여 입자를 분리하는 전처리를 수행하였다. 메탄생성조 혼합액과 원심분리 이후 상등액에서 동일하게 0.5 µm부터 700 µm 범위의 입자가 관찰되었다. 원수와 상등액의 입도 분포 경향은 약 20 µm까지 비슷했으며 그 이상에서 분포비율의 차이가 관찰되었다. 특히 200~700 µm 범위의 입자가 주로 제거되어 분포비율의 차이가 명확하게 나타났다. 그러나 메탄생성에 관여하는 미생물의 크기는 0.3~7.4 µm이므로[32], 원심분리를 통해 SRT를 조절하는 것은 보다 세밀한 검토가 필요하다.
3.2. 메탄생성조 혼합액의 막 여과 특성
메탄생성조 혼합액의 입도 분석 결과를 바탕으로 혼합액의 분리막에 의한 고액분리 특성을 검토하기 위하여 막의 등급(MF, UF, NF)에 따른 막 여과 특성을 조사하였다.
3.2.1. 투과 유속과 막 여과 저항
등급별(MF, UF, NF) 분리막을 이용하여 Stirred cell에 의한 혼합액의 막 여과 실험을 진행하였다. 여과 방식은 전량 여과(Dead end filtration)로 여과 압력을 MF와 UF는 1 bar로, NF는 5 bar로 설정하였다. 여과 실험은 1회당 60분씩 총 3회 실시하였다. 1회 여과 종료 후 막 표면을 스펀지로 부드럽게 문지른 뒤 증류수로 씻어내는 물리적 세척을 하였다. Fig. 4는 분리막 등급별 투과 유속과 물리적 세척에 의한 투과 유속 회복률을 나타낸 것이다.
MF막의 1회차 실험에서 초기 투과 유속은 91 L/m2・h・bar였으나 1분만에 11 L/m2・h・bar로 급격히 감소하여 30분 이후 1.71 L/m2・h・bar를 유지하였다. 평균 투과 유속은 4.18 L/m2・h・bar이었다. 물리적 세척 이후 평균 투과 유속은 2.94 L/m2・h・bar로 70%가 회복되었다. 2회차와 3회차의 초기 투과 유속은 각각 30과 28 L/m2・h・bar로 1회차에 비해 급감하였다. 여과시작 30분 이후의 유지 투과 유속은 2회, 3회차의 경우 1.68, 1.71 L/m2・h・bar로 1차 여과실험과 유사한 값을 기록했다. 물리적 세척 이후에 MF의 평균 투과 유속이 30% 감소한 것은 Fig. 3의 SEC 분석 결과 MF막의 공극 7 µm 영역대의 입자로부터 Intermediate blocking 및 Complete blocking과 같은 현상에 의해 막의 공극이 막힘에 기인함을 알 수 있다.
UF막의 경우, 1회차의 초기 투과 유속은 16 L/m2・h・bar였으며 1분 만에 8 L/m2・h・bar로 감소하였으며 평균 투과 유속은 2.51 L/m2・h・bar로 나타났다. 물리적 세척 이후 평균 투과 유속은 2.62 L/m2・h・bar로 100% 회복되었으며 2회차와 3회차의 초기 투과 유속도 16과 17 L/m2・h・bar로 나타나 100% 회복되었다. 또한, 1, 2, 3회차의 유지 투과 유속은 각각 1.7, 1.8, 1.8 L/m2・h・bar로 유사하게 나타났다. 모든 회차의 초기 투과 유속이 유사한 것으로 보아 물리적 세척에 의해 투과 유속이 완전히 회복되었으며 이는 막 표면에 발생한 가역적 케익 및 젤층 형성이 투과 유속 감소의 주된 파울링 현상임을 알 수 있다[33].
NF의 초기 투과 유속은 1, 2, 3회차에서 각각 0.80, 0.68, 0.60 L/m2・h・bar이었으며 평균 투과 유속은 0.59, 0.56, 0.55 L/m2・h・bar, 유지 투과 유속은 0.56, 0.53, 0.46 L/m2・h・bar로 나타나 파울링에 의한 초기 및 유지 투과 유속 차이가 가장 작은 것으로 나타났다. 그러나 NF는 여과 압력이 5 bar로 높음에도 불구하고 분획분자량이 350 Da으로 공극이 아주 작기 때문에 초기 및 유지 투과 유속 값이 MF와 UF에 비해 1/3 수준으로 나타났다.
MF, UF, NF에서 1회차의 초기 투과 유속은 91, 16, 0.8 L/m2・h・bar로 공극의 크기에 비례하여 높게 나타났으나 평균 투과 유속은 초기 투과 유속과 대비하여 95, 84, 30% 감소하였으며, 공극의 크기가 클수록 파울링에 의한 초기 투과 유속 감소가 심각하게 발생했다. 물리적 세척에 의한 MF, UF, NF의 평균 투과 유속 회복률은 70, 100, 95%로 MF가 가장 낮게 나타나 물리적으로 세척이 어려운 비가역적 파울링이 심하게 일어났다. 초기 투과 유속 감소율과 회복률을 고려했을 때 NF가 가장 우수하지만, 운전 압력이 상대적으로 높고 투과 유속 값이 낮게 나타나 실제 막 여과 공정에 적용하기에 경제적인 측면에서 부적합한 것으로 사료된다. 따라서 UF가 투과 유속의 감소 및 회복과 처리용량 측면에서 가장 효율적인 운전 및 유지가 가능할 것으로 판단된다.
막 여과 실험을 통해 얻은 세 막의 여과특성 비교 결과를 검토하기 위해 막 여과 저항을 측정하였다. 막 여과 저항 Rt는 식 (4)로 표현된다[29].
MF, UF, NF의 막 여과 저항값을 Table 4에 나타내고 Rt에 대한 Rm, Rp, Rc의 비율을 Fig. 5에 나타내었다. 막의 공극 및 특성에 따라 결정되는 Rm은 MF, UF, NF가 각각 5.93E+10, 2.82E+11, 5.34E+13 m-1로 공극이 작을수록 크게 나타났다. 여과 대상 시료의 특성에 따라 달라지는 Rp는 MF, UF, NF가 각각 3.57E+12, 1.43E+11, 5.55E+11 m-1로 MF가 가장 높게 나타났다. 케익 및 젤층에 의한 여과 저항 Rc는 각각 6.46E+13, 7.10E+13, 3.24E+14 m-1로 MF와 UF는 유사했으며 운전 압력이 5 bar인 NF가 가장 낮게 나타났다. MF의 총 여과 저항 Rt중 Rm, Rp, Rc가 차지하는 비율은 각각 0.09, 5.23, 94.68%로 Rc가 가장 높았으며 UF 및 NF와 비교했을 때 상대적으로 Rp가 높게 나타났다. UF에서는 Rm, Rp, Rc가 0.39, 0.20, 99.30%를 차지하며 Rc가 월등히 높았고 Rm이 Rp보다 조금 더 높은 비율을 차지했다. NF의 경우 Rm, Rp, Rc가 14.13, 0.15, 85.72%로 나타나 Rc가 우세했으나 다른 막에 비해 Rm이 높은 비율로 나타났다. 고농도 고형물을 함유하는 혐기 소화 슬러지로 인해 모든 막에서 막면 케익 및 젤층 형성에 의한 여과 저항 Rc가 가장 높게 나타났으나, MF는 공극 막힘에 의한 여과 저항이 상대적으로 높게 나타나 쉽게 제거되지 않는 비가역적 파울링이 많이 일어날 것으로 예상된다. 이는 3회 여과 실험에서 물리적 세척에 의한 MF의 투과 유속 회복률이 가장 낮은 원인으로 볼 수 있다. UF와 NF의 Rp는 낮게 나타나 물리적 세척에 의한 플럭스 회복에 유리하다. 하지만 NF는 막 자체에 의한 여과 저항 Rm이 비교적 높게 나타나 투과 유속값이 현저히 낮으므로 혐기 소화의 SRT조절에는 UF의 적용가능성이 가장 높은 것으로 판단된다.
3.2.2. 물질 배제 특성
메탄생성조 유입수와 막의 투과수(MFp, UFp, NFp)의 COD, TS, VS, FS 그리고 염도를 Table 5에 나타내었다.
유입수(feed solution)의 TCOD는 21 g/L였으며 막의 투과수는 각각 MF 6.2 g/L, UF 5.5 g/L, NF 3.1 g/L로 배제율은 71%, 74%, 85%[34]로 나타났다. 유입수 TS는 28.2 g/L로 VS가 15.4 g/L이고 FS는 12.6 g/L였다. 이에 대하여 MFp, UFp, NFp의 TS는 각각 17.9 g/L, 16.6 g/L, 12.3 g/L로 감소했다. VS는 6.06 g/L, 5.86 g/L, 4.06 g/L로 60%, 62%, 73%의 배제율을 보였다. 한편 막 투과수의 FS는 각각 11.9 g/L, 10.7 g/L, 8.22 g/L로 배제율 4%, 15%, 35%을 나타내었다. 이로부터 막 투과수 내 고형물의 배제는 대부분 VS에서 일어났음을 알 수 있다. 메탄생성조 내 유입수의 VS의 농도가 높을수록 메탄생성 수율도 함께 높아질 수 있으므로 분리막에 의한 VS의 높은 배제율은 바이오가스와 메탄 생성량의 증대에 기여할 것으로 추정할 수 있다[35]. FS는 대부분 투과되었으나 막의 공극이 작은 분리막에서 배제율이 상승하였다. FS는 무기성 물질을 포함하는 용존성 물질로 메탄 생성에 기여하지 못한다[36]. 주재영 연구팀의 연구 결과에 의하면 FS의 농도가 증가할 때 생분해도가 감소하였으므로, NF를 이용한 장기운전은 소화 효율의 저하를 가져올 수 있다[37]. 염분의 축적은 미생물의 활성을 방해하는 요소로써 특히 2% 이상의 농도에서 COD 제거효율과 바이오가스 발생량이 급격히 줄어든다[38]. MF, UF는 염분이 전혀 배제되지 않는 것으로 나타났으나 NF의 경우에는 염분 배제율이 7% 정도로 염분이 축적될 가능성을 보였다. 결과적으로 물질의 분리 특성은 MF와 UF가 적합하게 나타났지만, 투과 유속의 감소와 회복을 고려하면 UF가 가장 적합한 것을 알 수 있다.
3.2.3. 막면 유속에 따른 투과 유속 변화
AnMBR에서 투과 유속 감소의 주요 원인은 막면에 형성된 케익층과 젤층에 기인하는 것으로 알려져 있다[39]. 이는 막 면에 유입수의 흐름을 통해 막 표면에 전단력(Shear force)을 주어 완화할 수 있으며, 전단력은 표면 유속과 관계가 있다[40]. 따라서 막표면의 선속도에 의한 투과 유속의 변화를 평가하기 위해[41] Stirred cell 내부에 장착된 마그네틱 바의 회전 속도를 조절하여 막면 유속을 0 (Dead-end), 0.31, 0.94, 1.57, 2.20 m/s로 모사하였다. NF막은 막면 유속 0 (Dead-end), 0.31, 0.47, 0.94 m/s에 대하여 조사하였다.
2상 혐기성 소화 장치의 메탄생성조 혐기 소화 슬러지의 막 여과시 막면 유속변화에 따른 각 막의 투과 유속을 Fig. 6에 나타내었다. 막면 유속별 여과 초기 10분간은 투과 유속이 급격하게 감소였으며 그 이후 투과 유속이 유지되었다. MF막의 투과 유속은 막면 유속 0.94 m/s 이상에서 2.8~3.0 L/m2・h・bar로 유사하게 나타나 막면유속 0.31 m/s에 비해 투과 유속이 증가했다. 이는 막면 유속의 전단력으로 케익 및 젤층 형성을 억제함으로써 투과 유속을 향상시키는 연구결과에 부합한다[42].
UF막의 유지 투과 유속은 유속 0.31 m/s 이하에서 1.5 L/m2・h・bar로 나타났으나 막면 유속이 0.94, 1.57, 2.20 m/s로 증가함에 따라 투과 유속도 3.6, 5.9, 8.3 L/m2・h・bar로 증가하였다. 이는 막 표면의 전단력에 의해 막의 표면에 케익 및 젤층이 형성되는 것을 방지함으로써 유지 투과 유속이 향상되는 결과를 보여준다[42].
NF의 경우 초기 투과 유속과 유지 투과 유속의 차이가 거의 없었고 막면 유속이 0에서 0.31, 0.94, 1.57 m/s로 증가함에 따라 유지 투과 유속은 0.45, 0.63, 0.74, 0.37 L/m2・h・bar였다. 이상으로부터 NF는 막면유속의 증가보다 고압 및 고온의 조건에서 투과 유속의 향상이 유리한 것으로 판단된다[41]. 따라서 NF는 메탄생성조 내 슬러지의 SRT를 조절하기 위한 막으로 경제적인 측면에서 부적합하다.
3.3. UF 막에 의한 십자류 흐름 여과 특성
막의 공극이 다른 MF, UF, NF 막을 대상으로 투과 유속의 감소와 회복, 막면 유속에 의한 투과 유속 개선, 막 여과 저항을 비교 및 평가한 결과로부터 UF가 가장 적용가능성이 높게 나타났다. 그러나 Stirred cell을 이용한 실험결과는 실제 십자류 여과 방식의 모듈과 다른 양상을 나타내는 경우가 있다[43]. 따라서 이전 실험에서 가장 적용 가능성이 높게 나타난 UF막을 십자류 여과 방식의 평판형 모듈에서 혼합액을 여과했을 때 투과 유속 변화와 물리적 세척에 의한 회복률을 관찰하고 파울링을 일으키는 물질을 조사하였다.
3.3.1. 투과 유속의 변화
UF막을 십자류 여과 방식의 평판형 모듈에 장착하여 여과 실험을 진행하였으며, 1회당 4시간씩 총 3회 실시하였다. 1회 여과 종료 후, 막 표면을 스펀지와 증류수를 이용해 물리적으로 세척하였다. 여과 시간에 따른 1, 2, 3회의 투과 유속 변화를 1분 간격으로 측정하였으며 그 결과를 Fig. 7에 나타내었다. 1, 2, 3회의 평균 투과 유속은 각각 19.86, 18.54, 17.21 L/m2・h・bar로 막면 유속이 0.24 m/s로 낮음에도 불구하고 Stirred cell에서 모사한 막면유속 2.2 m/s에서 나타난 투과 유속 8.3 L/m2・h・bar에 비해 2배 이상 높게 나타났다. 이는 타 연구에서 Polyethersulfone으로 만들어진 분획분자량(MWCO: molecular weight cut off) 50 kDa의 막을 장착한 Stirred cell과 십자류 여과 방식의 모듈을 이용하여 같은 시료를 정압여과했을 때 투과 유속이 각각 80과 100 L/m2・h로, 실제 모듈의 투과 유속이 우수한 것과 유사한 결과이며 막 공극이 클수록 Stirred cell과 십자류 흐름 여과 방식 모듈의 투과 유속 차이가 상이하다고 판단된다[43]. 2, 3회차의 투과 유속 회복률은 각각 93, 87%였다. 케익 및 젤층의 제거로 90% 이상의 투과 유속을 회복할 수 있으므로 주요 파울링 메커니즘이 케익 및 젤층 형성임을 알 수 있다. 이는 Charfi가 UF막을 이용한 막 결합형 혐기성 소화에서 막의 재질과 모듈의 형태와 관계없이 투과 유속 감소에 가장 지대한 영향을 미치는 파울링 메커니즘은 케익 및 젤층 형성임을 밝힌 바 있다[39]. 하지만 Pore blocking과 Intermediate blocking과 같은 메커니즘에 의해 6~7%의 투과 유속이 지속적으로 감소하였다. 이러한 파울링은 역세척 혹은 화학적 세척에 의해 회복될 수 있다[44]. Zayen et al.은 매립지 침출수를 UF막이 결합된 AnMBR로 처리하였을 때 투과유속이 초기 8 L/m2・h에서 2~3일간은 큰 폭으로 감소하여 3 L/m2・h에 도달했다[45]. Saddoud et al.은 도시 폐수를 UF막이 결합된 AnMBR로 처리하였으며 투과 유속이 초기 13 L/m2・h에서 30일간 지속적으로 감소하여 약 9 L/m2・h에서 유지되었다[46]. 이 결과를 미루어 보아 UF막이 결합된 AnMBR의 장기운전에서 투과 유속은 30~70% 정도 지속적인 감소를 보일 것으로 예측된다.
3.3.2. 투과수의 성상 분석
UF막의 물질 배제 특성을 파악하기 위해 여과에 사용된 유입수와 농축수(Concentrate), 투과수(Permeate)의 다양한 수질을 분석 및 비교하였다. COD, SS, pH, 염도의 분석 결과를 Table 6에, VS와 EPS (Extracellular polymeric substances)의 함량, 추출된 EPS 중 탄수화물과 단백질의 분석 결과를 Table 7에 나타내었다.

The characteristics of feed, concentrate and permeate (VS, EPS content and composition as carbohydrate and protein).
유입수와 농축수, 투과수의 TCOD는 각각 21 g/L, 23 g/L, 1.3 g/L이며, SS는 25.5 g/L, 27.9 g/L, 0 g/L였다. 여과에 의한 유입수의 TCOD와 SS의 증가율은 각각 10%와 9%로 나타났다. TCOD의 상승은 미생물을 포함하는 SS 농축의 결과로 볼 수 있다. 유입수와 농축수, 투과수의 염도는 0.93%, 0.92%, 0.90%로, 막 여과 이후 염분의 축척이 심화되지 않을 것으로 판단된다[47].
농축수의 VS농도가 유입수에 비해 약 14% 증가할 때, EPS 함량은 약 4% 증가하였으며, 미생물의 농축도가 유기물보다 높게 나타났으므로 혐기성 소화 슬러지의 SRT를 안정적으로 증가시켜 소화 효율이 향상될 수 있다. 또한, SRT를 증가시키면 EPS에 의한 막 여과 저항이 감소되는 효과를 기대할 수 있다[48]. 일반적으로 혐기성 소화에서 단백질의 농도는 탄수화물에 비해 5배 정도 높게 나타나며, 막 여과에서 단백질의 투과량이 높게 나타나 여과 후 단백질/탄수화물의 비가 5에서 4로 감소한 것을 알 수 있다[48].
3.3.3. 막 오염 물질 분석
여과 전과 후, 그리고 물리적 세척 후 막의 표면을 관찰하기 위해 Scanning Electron Microscopy (SEM)으로 촬영하였다. 동시에 Energy Dispersive Microscopy (EDS)를 이용하여 막 오염 물질의 구성 원소를 확인하였다. SEM 이미지와 EDS 결과를 Fig. 8에 나타내었다.
여과 전 막의 표면은 EDS 결과에 의해 PES의 구성원소인 C, O, S만이 관찰되었다(Fig. 8(a)). 여과 후 막의 표면은 케익층과 다양한 입자상 물질이 끼어있는 상태를 확인할 수 있었으며, 케익층이 형성되어 C와 S의 비율은 감소하고(Fig. 8(b)) N, Mg, P, Na, Cl 등 다양한 원소가 관찰되었다. 그 중 N, Mg, P는 Struvite를 구성하는 원소로써 막 결합형 혐기성 소화에서 주로 관찰되는 막오염물질이다[43,49]. 그리고 음식물쓰레기의 높은 염분이 다양한 입자와 엉겨 붙어 Na와 Cl이 관찰되었고, 전체 혐기성 소화 공정에서 가용화를 위한 NaOH 주입이 있으므로 Na가 3.63%로 Cl보다 높게 관찰되었다. 그 외 Al, K, Ca와 같은 미네랄 성분이 관찰되었다. 물리적 세척 후 막의 표면은 여과 전과 유사한 수준으로 케익층이 제거되었으나 C 원소를 포함하는 유기물과 소량의 Na이온과 Si이온이 제거되지 않고 남아있는 것으로 사료된다.
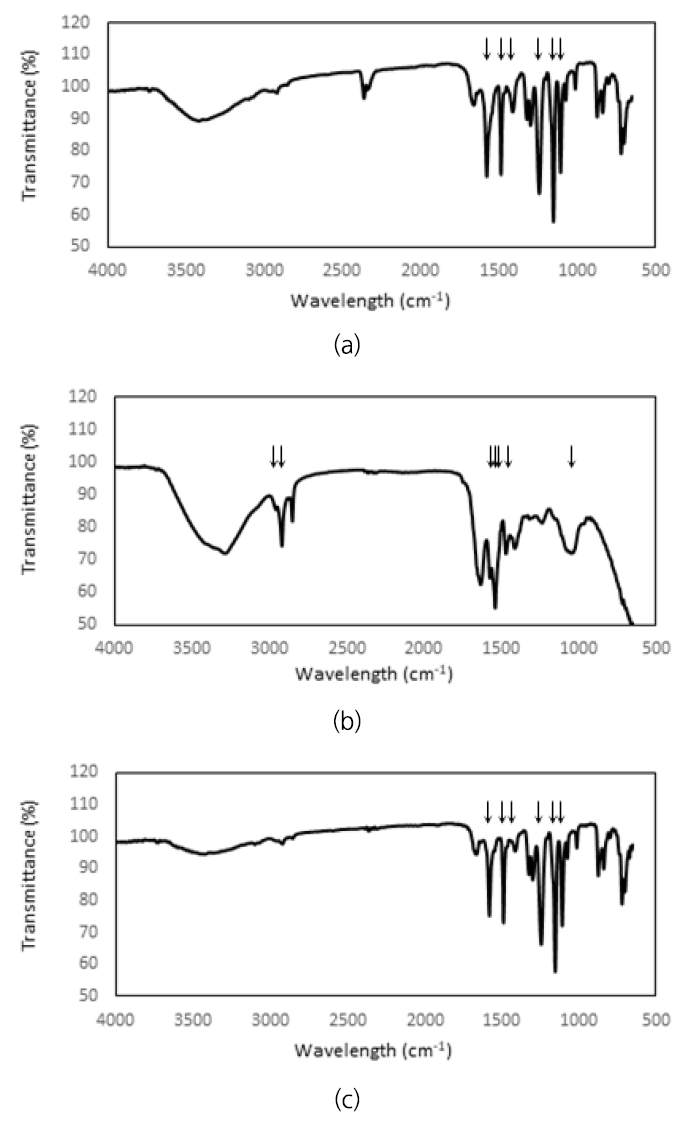
막 오염 물질의 원소 결합을 확인하여 주요 물질을 확인하고자 여과 전, 후 그리고 물리적 세척 후의 막을 FTIR을 이용하여 분석하였으며 그 결과를 Fig. 9에 나타내었다.
여과 전 막의 FTIR peak는 1661, 1577, 1467, 1412, 1322, 1298, 1242, 1151 그리고 1106 cm-1의 파장에서 나타났다. Zhu 등은 1580 (benzene ring), 1488 (C-C bond), 1244 (aromatic ether) 그리고 1106 (C-O bond) cm-1이 polyethersulfone (PES)막의 고유 피크라고 주장했다[50]. 그리고 Qu 등의 연구에 의하면 1324과 1239 cm-1이 C-O-C stretch, 1151과 1105 cm-1이 S=O stretch를 의미하는 피크라고 보고했다[51].
여과 후 막에서는 2916, 2849, 1632, 1574, 1539, 1469, 1412, 1235 그리고 1049 cm-1의 파장대의 흡수가 일어나 여과 전 막과는 다른 피크를 나타내었다. 2916 및 2849 cm-1은 알칸 및 지방족 메틸렌 결합의 C-H stretch이다[24,51]. 1632와 1574, 1539 cm-1의 피크는 amide 1과 2와 같은 단백질의 분해과정에서 생기는 단백질을 의미한다[51,52]. 1469 및 1412 cm-1은 탄산염(CaCO3)과 같은 무기성 물질을 의미한다.53,54) 탄산염의 존재는 EDS 분석 결과에서도 유추할 수 있다. 1049 cm-1의 넓은 스펙트럼은 다당류 또는 다당류 유사 물질을 나타낸다[24,51]. SEM-EDS와 FTIR의 결과를 통해 케익층은 주로 탄수화물과 단백질의 부산물, 미생물을 포함하는 유기 성분으로 구성되어 있으며 Na, Cl, CaCO3와 같은 무기 성분이 소량으로 구성되어 있음을 알 수 있다. 물리적 세척 후 막의 표면에도 주로 C 원소를 포함하는 유기 성분과 Na, Si 이온이 잔류해 투과유속을 감소시킨 것으로 사료되며 이는 화학적 세척으로 회복할 수 있다[55].
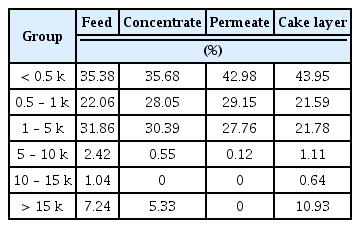
파울링을 일으키는 물질의 분자량을 분석하기 위해 유입수, 농축수, 투과수 그리고 케익 및 젤층(Cake layer)의 분자량 분포를 관찰하였으며 결과를 Fig. 10과 Table 8에 나타내었다.
Feed에 비해 농축수의 분자량 분포가 0.5~1 kDa에서 6% 증가하였고 0.5 이하와 1~5 kDa의 물질은 유사하게 나타났으며 나머지는 감소하였다. 한편 5~10 kDa의 물질은 2% 감소하였으나 투과수에서는 거의 나타나지 않아 대부분 케익층에 쌓이는 것으로 보인다. 10~15 kDa도 마찬가지로 Feed에서 1%인데 반해 농축수와 투과수에서 나타나지 않아 케익 및 젤층에 의해 배제되었음을 알 수 있다. 농축수에서 15 kDa를 초과하는 물질은 Feed의 7.24%에서 5.33%로 감소한 반면 케익층에서 10.93%로 분율이 높아졌다. 결과적으로 5 kDa 이상의 물질은 완전히 UF막에 의해 완전히 배제되어 투과수에서 관찰되지 않지만, 농축수보다 케익층에서 높은 분율로 존재하고 있어 막오염에 상당한 영향을 미치는 것으로 판단되며 물리적 세척 후 UF막에 잔류해 투과 유속을 감소시키는 물질에 대한 연구는 추가로 필요하다.
4. 결 론
본 연구의 목적은 음식물쓰레기를 처리하는 2상 중온 혐기성 소화 공정에 막의 적용 가능성을 여과 특성 및 오염 거동의 분석을 통해 평가하였으며 다음과 같은 결론을 도출하였다.
1) 2상 중온 혐기성 소화 슬러지의 고형물질은 25.5 g/L (SS), 29.4 g/L (TS)로 고농도이며 입도는 주로 0.5~700 µm의 범위로 존재하였다. 이를 원심분리(5,000 rpm, 30 min)할 경우 12 µm 이상의 입자의 제거가 용이하였으나 메탄생성조의 SRT 조절에는 적합하지 않은 것으로 나타났다.
2) UF막이 MF막과 NF막에 비해 투과 유속 변화와 회복률, 막 여과 저항을 고려했을 때 가장 적합하였고 막면 유속의 증가에 따라 투과 유속이 뚜렷하게 향상되었다.
3) UF막을 이용한 십자류 여과 방식의 평판형 모듈의 여과실험에서 투과 유속은 1회당 4시간씩 총 3회 여과에서 평균 18 L/m2・h・bar로 유지되었다. 투과 유속 감소에 주된 영향을 미치는 케익층은 물리적 세척에 의해 충분히 제거되어 1, 2회에서 여과에서 각각 93, 85%의 투과 유속 회복률을 보여 유지세정에 의해 운전기간을 연장할 수 있다.
4) 물리적 세척 이후 회복되지 않은 투과 유속은 막 면에 잔류하는 탄수화물과 단백질의 분해 산물 등의 유기 성분이 주를 이루었고 소량의 무기 성분(염분, Struvite)이 존재하였다.
Acknowledgements
이 논문은 2019~2020년도 창원대학교 자율연구과제 연구비 지원으로 수행된 연구결과임.