폴리비닐알코올 스펀지의 표면 개질을 통한 나노영가철의 부착성 향상
Enhancement of Nanoscale Zero-valent Iron Immobilization on Polyvinyl Alcohol Sponge through Surface Modification
Article information
Abstract
목적
본 연구에서는 나노 영가철의 적용성을 높이기 위하여 지지체 소재에 고정화하는 방법을 택하였으며, 시중에서 쉽게 구할 수 있는 폴리비닐알코올 스펀지(PVA)를 지지체로 사용하였다. 나노 영가철을 고정화시키는 데 있어서 지지체와의 결합력을 향상시키는 것은 오염물질 제거 효율 증대 및 나노 영가철의 탈리를 방지하는 측면에서 중요하다고 판단하였다. 지지체와의 결합력을 향상시키기 위하여 PVA 표면을 아크릴산으로 개질하여 카르복실기를 유도하는 일련의 표면 개질 방법을 사용하였으며, 이를 통하여 나노 영가철 입자의 부착이 향상되는지 여부에 대하여 평가하였다.
방법
나노 영가철을 고정하기 위한 담체로써 공극률 90%, 평균 공극 크기 130 µm, 겉보기 밀도 0.082 g/cm3의 PVA 스펀지를 사용하였으며, 취급에 용이하도록 0.3 × 0.3 × 0.3 cm3의 정육면체로 가공 후 사용하였다. PVA 스펀지는 아크릴산 및 과망간산칼륨과의 반응을 통하여 표면에 아크릴산 고분자를 유도하였다(PVA-AA). PVA-AA에 나노 영가철을 합성하기 위한 일련의 과정에서의 조건들을 최적화하였다. 고려한 조건은 나노 영가철의 전구 물질인 Fe2와 PVA의 질량 비율, Fe2 흡착 시간 및 NaBH4를 이용한 환원 시간이었다. PVA-AA의 Fe2 흡착량, 나노 영가철 합성 이후 SEM/EDS 분석을 실시하였으며, 질산성 질소 환원 실험을 통하여 환원 반응성을 평가하였다.
결과 및 토의
AA로 개질된 지지체 소재(PVA-AA)의 Fe2 흡착량이 미개질 소재(PVA)의 경우보다 우수함을 확인할 수 있었고, 흡착 평형에 이르는 시간도 30분으로 단축되는 것을 확인할 수 있었다. 최적 질량 비율은 Fe/PVA-AA = 1이었다. 이와 같은 결과는 AA를 이용한 표면 개질을 통하여 PVA 표면의 카르복실기를 형성하였고, 형성된 카르복실기가 철과의 강한 상호 결합을 유도하기 때문인 것으로 파악되었다. SEM/EDS를 통하여 분석한 결과, AA 개질을 통하여 PVA 스펀지 섬유 표면에 AA 고분자가 형성된 것을 확인할 수 있었고, 여기에 나노 영가철이 결합된 형태를 확인하였다. AA 개질을 통하여 다량의 나노 영가철이 결합된 것을 확인하였으며, 환원 시간을 0.5시간에서 1시간을 늘림에 따라 나노 영가철의 표면과 내부에서의 분포가 더욱 균일해지는 것을 확인할 수 있었다. 최종적으로 질산성 질소 환원 실험을 통하여 환원 반응성을 평가하였으며, 표면 개질을 수행하였던 PVA-AA-nZVI가 표면 개질을 수행하지 않은 PVA-nZVI에 비하여 환원 효율은 1.9배, 환원 속도는 3.5배 더 높은 것으로 나타났다.
결론
나노 영가철의 단점을 개선하고 활용성을 높이기 위해 지지체를 활용함에 있어 부착성을 향상시키기 위한 표면 개질 기술을 개발하고자 하는 목적으로 수행되었다. 시중에서 쉽게 구할 수 있는 PVA 스펀지 표면을 아크릴산을 개질함을 통하여 표면에 카르복실기를 다수 형성하여 나노 영가철의 부착 효율을 증대시킬 수 있었고, 더 높은 오염물질 환원 효율을 얻을 수 있었다. 영가철이 고정된 소재의 오염물질 환원율을 높이기 위해 중요한 인자는 영가철의 함량이라고 할 수 있다. 담체 표면을 개질하고 합성하는 과정으로 영가철의 합성량을 높인 소재의 개발로 실제 공정에 적용함에 있어 경제성과 오염물질의 제거 능력 모두 향상시킬 수 있을 것으로 기대된다.
Trans Abstract
Objectives
Nanoscale zero-valent iron (nZVI) is known to effectively remove various contaminants due to its small size and high specific surface area, but it is limited in practical water treatment processes due to its difficulty in recovery after use. In this study, a method of immobilizing nZVI on a support material was adopted in order to increase the applicability of nZVI. A polyvinyl alcohol sponge (PVA), which is readily available commercially, was used as a support. For the immobilization of nZVI, it was considered that improving the binding force with the support is essential in order to enhance the pollutant removal efficiency and prevent nZVI loss. A series of surface modification methods with acrylic acid to induce the formation of carboxyl groups were used to improve the bonding strength with the support.
Methods
A PVA sponge with a porosity of 90%, an average pore size of 130 µm, and an apparent density of 0.082 g/cm3 was used as a supporting material to immobilize nZVI. The PVA sponge was further cut into cubes of 0.3 × 0.3 × 0.3 cm3 for easy handling. The PVA sponge induced an acrylic acid polymer on the surface through the reaction of acrylic acid and potassium permanganate (PVA-AA). We optimized the conditions in a series of steps to synthesize nZVI on PVA-AA. The conditions considered were the mass ratio of Fe2+ and PVA, Fe2+ adsorption time, and the reduction time using NaBH4. A SEM/EDS analysis was performed to monitor the morphology of the synthesized nZVI on PVA-AA. The reduction reactivity was evaluated through nitrate reduction.
Results and Discussion
The amount of Fe2+ adsorption of the support material modified with AA (PVA-AA) was superior to that of the unmodified material (PVA), and the time to reach the adsorption equilibrium was shortened to 30 min. The optimum mass ratio was Fe/PVA-AA = 1. These results indicate that carboxyl groups are formed on the surface of PVA by surface modification using AA and that these carboxyl groups induce strong binding affinity toward iron. The SEM/EDS analysis results showed that AA polymer was formed on the surface of the PVA sponge fiber through AA modification. Moreover, a large amount of nZVI was formed on AA modified PVA (PVA-AA). As the reduction time was increased from 0.5 h to 1 h, the distribution of nZVI iron on the surface and inside the support was more uniform. Finally, the reducing reactivity was evaluated through a nitrate reduction experiment. The reduction efficiency and the reduction rate of PVA-AA-nZVI were 1.9 times and 3.5 times higher than those of PVA-nZVI, respectively.
Conclusions
A surface modification technology was developed to enhance nZVI immobilization on a commercially available supporting material. Through the modification of acrylic acid on the surface of a PVA sponge, which can be easily obtained on the market, it was possible to increase the attachment efficiency of nZVI by forming a large number of carboxyl groups on the surface, and subsequently higher pollutant reduction efficiency could be obtained. It is expected that both the economic efficiency and the ability to remove contaminants can be improved by the development of a material having an increased amount of nZVI by the surface modification technology developed in this study.
1. 서 론
영가철은 표준 환원 전위가 -0.44 V로써 환원제로 작용하여 여러 오염물질에 대한 반응성을 가지고 있는 것으로 알려져 있다. 특히 나노 영가철(nZVI, Nanoscale Zero-Valent Iron)은 수십 nm의 크기로 합성된 영가철을 지칭하는데, 그 작은 크기로 인한 넓은 표면적을 가지고 있어 오염물질에 대한 반응성이 뛰어난 특징을 가지고 있다[1]. 또한 특유의 core-shell 구조의 형성을 통한 표면의 산화철 및 수산화철의 존재로 인해 정전기적 인력으로 중금속 이온을 흡착하는 능력도 뛰어난 것으로 알려져 있다[2]. 여러 오염물질에 대한 반응성이 우수할 뿐만 아니라, 제조 과정이 비교적 간단하며 원료인 철이 경제성 면에서도 우수하기 때문에 나노 영가철은 각종 중금속 제거[3], 질산성 질소의 환원[4,5], 염소계 유기화합물의 제거[6] 등 다양한 분야에서 주목 받고 있다.
하지만 나노 영가철은 표면 에너지가 높고 서로 간의 자성으로 인하여 서로 뭉치려는 성질이 있는 것으로 알려져 있다. 한 연구에서는 나노 영가철의 농도가 높을수록 응집되는 속도가 증가하여 평균 20 nm 크기에서 개별 나노 영가철 입자가 마이크로미터 크기로 응집되기까지 10분밖에 소요되지 않았으며, 지속적으로 응집하여 침전하고 종래에는 우수한 환원 능력을 상실하는 문제가 있었다[7]. 또한 작은 크기로 인하여 체내 유입은 쉬운 반면에 수계 내에서 오염물질 처리 이후 회수하기는 어렵기 때문에 나노 영가철이 산화된 상태 그대로 수계 내에 존재하거나 나노 영가철 자체가 유출될 경우 독성 등의 우려를 일으킬 수 있다는 문제점도 가지고 있다.
이러한 문제점을 해결하기 위해 나노 영가철을 각종 지지체에 합성・고정하여 사용하고자 하는 연구가 다수 진행되었다. 대표적인 지지체로써 입상 및 분말활성탄[8~10], 알지네이트[11], 고분자 분리막[12] 등이 보고된 바 있다. 대부분의 경우에 지지체를 철 수용액(Fe2+ 혹은 Fe3+)에 일정시간 침지시켜 철 이온이 지지체의 표면에 흡착될 수 있도록 유도하고, 이후 NaBH4 등의 환원제를 주입하여 흡착된 철 이온을 영가철의 형태로 환원시키는 일련의 과정을 사용하였다. 하지만 이러한 함침법에 있어서 중요한 것은 고정 대상 물질의 부착량을 증가시키는 것이라고 할 수 있다. 나노 영가철과 같은 고정 대상 물질의 부착량이 증가되면, 이에 따라서 오염물질의 제거 효율이 증대되는 것이라 할 수 있기 때문이다. 또한 부착된 고정 대상 물질이 다시 탈리되어 수중으로 유출되는 현상은 최소화 되어야 한다. 이와 같은 측면에서 볼 때, 고정 대상 물질과 지지체와의 결합력을 향상시키는 것이 중요하다고 할 수 있다.
나노 입자와 지지체와의 결합력을 향상시키기 위한 지지체 표면 개질에 대한 선행 연구를 수행한 바 있다. 선행 연구에서 폴리비닐알코올 스펀지[13], 셀룰로오스 필터[14], 일라이트[15] 등의 지지체 표면을 가교 역할을 하는 고분자로 개질하여 고정 대상 물질인 프러시안 블루의 합성량을 증가 시키고 탈착되는 프러시안 블루의 양을 감소시킨 결과를 도출하였다. 해당 선행 연구들에서는 지지체로 사용되는 소재를 아크릴 산(acrylic acid; AA)을 사용해 표면 개질 함으로써 담체 표면에 다수의 카르복실기(-COOH)가 생성될 수 있게 한 이후, 철 이온(Fe3+)의 고정화 및 철 이온과 페로시안화 이온과의 반응을 통한 프러시안 블루의 합성의 과정을 사용하였다[13~15]. 본 연구는 상기 선행 연구의 합성과정에서 착안하여 표면 개질을 통해 카르복실기가 유도된 폴리비닐알코올(polyvinyl alcohol; PVA) 스펀지 소재에 철 이온을 고정한 뒤, 고정된 철을 환원시켜 나노 영가철을 합성하는 과정을 사용하고자 하였다.
카르복실기를 활용한 nZVI의 고정화에 대한 연구는 이미 진행된 바 있다. Xiao 등(2009)은 PVA와 AA를 혼합한 고분자 용액을 전기방사함으로써 나노 섬유를 합성하고, 여기에 nZVI를 합성한 바 있으며, 우수한 nZVI 고정화 효율을 AA의 카르복실기와 철 이온의 인력 때문이라고 설명하였다[16]. 본 연구는 상기 언급된 연구와 합성 방법에서 차별성을 갖는다. 상기 언급된 연구에서는 전기방사를 통하여 새로운 소재를 형성하는 데에 집중하였다면, 본 연구에서는 시중에서 쉽게 구매할 수 있는 PVA 스펀지에 간단한 표면 개질 처리를 통하여 PVA-AA 소재를 합성한 것이다. 따라서 새로운 소재를 합성하는 데 필요한 비용을 절감할 수 있으며, 원하는 기계적 물성을 가진 기성품을 취사선택할 수 있다는 장점을 가지고 있다.
본 연구의 목적은 상기 언급된 폴리비닐알코올 스펀지 소재(PVA)에 나노 영가철의 고정화 효율을 증대시키기 위한 표면 개질 기술을 개발하는 동시에, 합성 과정을 최적화 하는 것에 있다. 시중에서 쉽게 구매가 가능한 PVA 스펀지를 아크릴산으로 개질하여 PVA-AA를 합성하였으며, 이후 나노 영가철의 부착을 통해 PVA-AA-nZVI를 합성하였다. 합성 조건의 최적화를 위하여 PVA-AA와 철 이온의 질량 비율, 철 이온 흡착 시간, NaBH4를 이용한 환원 시간에 따른 PVA-AA-nZVI 합성 결과에 대한 분석을 실시하였다. 또한 최적화된 조건으로 제작된 PVA-AA-nZVI의 질산성 질소 환원 실험을 진행하여 개질 합성 소재의 환원 능력을 평가함으로써, AA를 이용한 표면 개질의 유효성을 확인하고자 하였다.
2. 실험방법
2.1. 실험 재료
본 연구에서 나노 영가철을 고정하기 위한 담체로써 공극률 90%, 평균 공극 크기 130 µm, 겉보기 밀도 0.082 g/cm3의 PVA 스펀지(삼광기업사)를 사용하였다. 장기간 건조시켜 실험 취급 시 용이하도록 0.3 × 0.3 × 0.3 cm3의 정육면체로 가공 후 사용하였다. PVA의 표면 개질을 위하여 acrylic acid (AA, SAMCHUN, 99.0%), potassium persulfate (KPS, SAMCHUN, 98.0%), ethyl alcohol (SAMCHUN, 94.5%)를 사용하였다. 이후 AA로 표면 개질된 PVA에 nZVI를 합성하기 위해 sodium chloride (DUKSAN, 99.0%), iron(II) sulfate heptahydrate (SAMCHUN, 98.0-102.0%)와 sodium borohydride (SAMCHUN, 98.0%)를 사용하였다. 합성된 소재의 환원능 평가 실험을 위해 potassium nitrate (KANTO, 99.0%)를 사용하였다. 실험에서 사용한 모든 용액은 철의 산화 방지를 위하여 한 시간 이상 질소로 탈기한 초순수를 사용하였다.
2.2. 아크릴산을 이용한 PVA 표면 개질
아크릴산을 이용한 PVA의 표면 개질 및 나노 영가철의 합성의 전 과정을 모식도로 나타내면 Fig. 1과 같다.
먼저 본 연구에 사용한 PVA 소재의 AA를 이용한 표면 개질 과정은 다음과 같이 진행하였다. PVA 스펀지 2.5 g을 600 mL 초순수, AA 100 mL, 라디칼 개시제인 KPS 0.6 g로 구성된 고분자 용액에 침지시켜 고분자 용액을 흡수 시켰다. 이를 진공 오븐을 이용하여 질소 조건 하에서 70℃에서 7시간 동안 가열하였다. 가열 이후 형성된 AA로 개질된 PVA 스펀지(PVA-AA)는 초순수를 이용하여 충분히 세척하였고, 이후 물과 에탄올의 비율 2:1인 희석액에 침지시킨 후 장시간 교반시켜 주는 과정을 통하여 세척하였다. 이후 철 합성 과정 전까지 0.5 M NaCl 용액에 침지시켜 놓았다. 본 개질 과정은 PVA 소재 표면에 있는 수산화기(-OH)를 KPS와 AA를 사용하여 카르복실기(-COOH)로 개질한 뒤, 카르복실기에 포함되어있는 수소를 NaCl을 사용해 Na로 치환시킴으로써 이후 소재에 철 이온 합성을 용이하게 만드는 과정이다.
2.3. PVA-AA 소재와 나노 영가철의 합성
2.3.1. Fe2+와 PVA 질량 비율, 흡착 시간의 최적화
PVA-AA에 나노 영가철 합성 과정에서의 농도와 시간 최적화는 다음과 같이 진행하였다. 먼저 PVA-AA 1 g을 50 mL 코니칼 튜브에 담고 45 mL의 0.4 M FeSO4・7H2O 용액을 주입하였다. 이것을 Fe/PVA-AA = 1이라 명명하였다. 여기서의 비율은 지지체인 PVA-AA와 주입된 Fe2+의 질량 비율을 나타낸다. 철 이온 수용액의 농도에 따른 비교를 위하여 같은 방법으로 PVA-AA 1 g에 0.2 M의 FeSO4・7H2O 용액 45 mL를 주입한 Fe/PVA-AA = 0.5, PVA-AA 1 g에 0.1 M의 FeSO4・7H2O 용액 45 mL를 주입한 Fe/PVA-AA = 0.25를 준비하였다. 그리고 개질 여부에 따른 비교를 위하여 마찬가지 방법으로 개질하지 않은 PVA 소재 1 g에 0.4 M, 0.2 M, 0.1 M의 FeSO4・7H2O를 각각 주입한 Fe/PVA = 1, Fe/PVA = 0.5, Fe/PVA = 0.25를 준비하였다.
준비된 6개의 코니칼 튜브들은 수직 회전 교반기를 이용하여 교반하며 흡착 실험을 실시하였다. 침지 시간에 따른 비교를 위하여 각 코니칼 튜브에서 용액을 0.5 h, 1 h, 3 h, 6 h, 24 h마다 주사기로 1 mL씩 채취하여 샘플을 준비하였고, 침지 초기의 흡착량 비교를 위하여 Fe/PVA-AA = 1에 대해서는 5 min, 10 min, 20 min의 샘플도 취하였다.
각 FeSO4・7H2O 수용액 농도, 교반 시간, 개질 여부에 따라 분류된 샘플들을 희석한 뒤 정량범위 0.5~5 mg Fe2+/L의 수질분석기(Libra S22, biochrom, United Kingdom)를 사용하여 남아 있는 Fe2+ 이온 농도를 측정하여 항목에 따라 그래프를 작성하여 분석하였다.
2.3.2. 철 환원 시간 및 개질 여부에 따른 합성효율 비교
나노 영가철의 합성은 철 이온을 환원시키는 다음의 반응에 의해 진행하였다(Eq. 1)) [17].
세부적인 방법으로 먼저 250 mL 삼구 둥근바닥 플라스크에 PVA-AA 3 g을 상기 2.3.1절에서 최적화 된 농도, 시간을 바탕으로 FeSO4・7H2O 용액 150 mL에 100 rpm으로 교반시켰다. 이후 250 rpm으로 교반시켜 주면서 NaBH4 용액 50 mL를 정량 펌프를 사용하여 5 mL/min의 유속으로 10분간 주입시켜 주었다. 이때 NaBH4 용액의 농도는 FeSO4・7H2O 용액 농도의 2.5배로 조정하였다. NaBH4 용액의 주입이 끝난 후에는, 교반속도를 100 rpm으로 감소시킨 후 20분 및 50분간의 안정화 시간을 두었다. 20분의 안정화 시간을 둔 시료는 총 환원 시간이 30분(NaBH4 주입 10분 및 안정화 시간 20분)으로 설정한 것이며, 50분의 안정화 시간을 둔 시료는 총 환원 시간이 1시간이 되도록 설정한 것이다. 이후 체를 이용하여 소재를 고액 분리한 후 혐기성 챔버에서 초순수와 에탄올을 사용해 세척하였다. 세척한 소재는 진공오븐을 이용하여 60℃에서 4시간 건조하고 혐기성 챔버(N2:H2=95:5, Coy Laboratory Products, USA)에 보관하여 추가적인 산화를 방지하였다.
준비된 소재들은 개질 여부에 따라 질량을 재고, 반으로 잘라 단면을 확인하였다. 그리고 주사전자현미경-에너지분산형 분광분석기(Scaning Electron Microscope-Energy dispersive spectrometry; SEM-EDS; SU8010, Hitachi High Technologies Corporation, Japan)를 통해 미개질, 미합성 소재와 비교하여 개질과 철의 합성을 확인하고 이후에 고분해능, 고배율로 분석하여 소재 표면의 구성 원소 및 소재 표면과 내부의 철 함량(Weight, %)을 비교하여 개질 여부 및 환원시간 변화에 따른 철 함량을 확인하였다.
2.3.3. 질산성 질소 환원 능력 평가
상기 2.3.1 및 2.3.2 절에서 최적화 된 조건에서 합성된 PVA-AA-nZVI의 오염물질과의 반응성 평가를 위하여 질산성 질소 환원 시험을 진행하였다. 질산성 질소는 Eq. 2의 반응식에서와 같이 영가철과 반응하여 암모니아성 질소로 환원되며[4], 본 연구에서는 질산성 질소 및 암모니아성 질소의 농도를 모니터링함으로써 준비된 PVA-AA-nZVI의 환원 반응성을 평가하였다. 비교를 위하여 개질되지 않은 PVA를 이용하여 합성한 PVA-nZVI도 사용하였다.
이후 50 mL 세럼 병을 이용하여 실험을 진행하였으며, 이때 사용된 PVA-AA-nZVI 및 PVA-nZVI의 양은 각각 1 g이었다. 초기 질산성 질소의 농도는 50 mg NO3-N/L으로 조성되었으며, 초기 pH를 조절하지 않은 실험 군과 초기 pH를 2로 조절한 실험 군으로 나누어 실험을 진행하였다.
상온에서 교반기를 사용해 200 rpm으로 교반하면서 반응을 진행하였다. 5분, 15분, 30분, 60분, 90분, 120분에 주사기로 반응기 내 용액을 2 mL씩 채취하고 0.45 μm 멤브레인 필터를 사용해 잔류하는 입자성 철을 걸러낸 뒤 채취 된 시료 내에 존재하는 질소의 농도를 측정하였다. 암모니아성 질소 농도는 인도페놀 법을 이용하여 UV로 분석하였고, 질산성 질소 농도는 이온크로마토그래피(Dionex Aquion RFIC; Thermo Scientific)으로 분석하였다. 컬럼으로 IonPac AS14, 용리액(Eluent)으로 3.5 mM Na2CO3 + 1 mM NaHCO3를 사용하여 1.2 mL/min의 유속으로 측정하였다.
3. 결과 및 고찰
3.1. Fe2+와 PVA-AA의 질량 비율, 흡착 시간의 최적화
본 연구에서는 PVA 및 PVA-AA에 철을 부착하기 위하여 FeSO4・7H2O 용액을 사용하였다. Fe2+이온의 흡착이 진행됨에 따라 철 이온 특유의 연한 녹색을 띠던 용액이 시간이 경과하며 투명해지는 것을 확인할 수 있었다. Fe2+의 질량과 지지체 소재의 질량 비율이 Fe2+ 흡착량에 미치는 영향을 알아보기 위해 FeSO4・7H2O 용액의 농도를 0.1 M, 0.2 M, 0.4 M로 달리하여 용액 중 Fe2+의 질량과 PVA의 질량 비율을 0.25:1, 0.5:1, 1:1로 조성하여 흡착 실험을 진행하였다. 또한 흡착 시간에 따른 영향을 확인하기 위하여 실험이 시작된 이후 30분에서 6시간까지 이르는 시간 동안 용액에 남아있는 철 이온 농도를 측정하여 이를 바탕으로 흡착된 철 이온의 양을 계산하였으며 그 결과를 Fig. 2와 같이 나타내었다.
Fig. 2(a)에서 확인할 수 있는 것처럼 AA로 개질된 지지체 소재(PVA-AA)의 Fe2+ 흡착량은 6시간의 흡착 시간 이후 0.626 g Fe/g으로써 0.368 g Fe/g의 미개질 소재(PVA)의 Fe2+ 흡착량보다 우수함을 확인할 수 있었고, Fe2+ 질량 비율이 높을수록 지지체 1 g 당 흡착된 Fe2+이온의 양이 증가함을 알 수 있었다. PVA-AA의 경우 Fe2+ 흡착량은 0.209~0.626 g Fe/g으로 Fe2+의 질량 비율이 높아짐에 따라 증가하는 것으로 나타났으며, PVA의 경우에는 이보다 낮은 0.136-0.368 g Fe/g으로 측정되어 AA를 이용한 표면 개질의 효과를 확인할 수 있었다. 시간에 따른 흡착량의 변화도 PVA-AA와 PVA에서 큰 차이를 확인할 수 있었다. PVA-AA의 경우 Fe2+의 흡착량은 30분까지 급격하게 증가 했다가 이후 변화 폭이 크지 않았으나, PVA의 경우에는 6시간의 흡착 시간 동안 흡착량이 서서히 증가하는 것으로 나타나 평형에 도달하기까지의 흡착 속도가 PVA-AA에 비하여 느림을 확인할 수 있었다. 이와 같은 결과는 AA를 이용한 표면 개질을 통하여 PVA 표면의 카르복실기를 형성하였고, 형성된 카르복실기가 철과의 강한 상호 결합을 유도하기 때문인 것으로 파악되며, 유사한 현상을 프러시안블루를 합성하기 위하여 철을 흡착시켰던 선행연구에서도 확인할 수 있었다[18].
선행연구에서는 본 연구에서 사용하였던 PVA-AA의 합성 과정과 동일한 표면 개질 방법을 사용하였다. 또한 해당 연구에서 합성하였던 프러시안블루는 Fe3+이온의 흡수 이후에 K4Fe(CN)6와의 반응을 통하여 합성하는데, 이러한 방법은 nZVI의 합성과정과 상당히 유사하다. 선행연구에서는 PVA 및 PVA-AA의 FTIR 분석 결과가 제시되어 있으며, PVA-AA의 경우에는 카르복실기를 나타내는 1,760~1,690 cm-1 구간에서 새로이 피크가 형성된 것을 확인할 수 있었다[18]. 본 연구에서는 선행 연구와 동일한 PVA-AA 합성 과정을 사용하였기 때문에 동일한 표면 개질 효과가 있을 것이라 기대할 수 있다.
질량 비율에 대하여 보다 정확한 최적화를 위해, Fe/PVA-AA = 2의 높은 질량비율 조건에서 PVA-AA의 철 흡착량 분석 실험을 실시하였으며, 그 결과를 상기 결과와 함께 Fig. 2(b)에 나타내었다. 이 경우에는 6시간의 흡착 평형 시간에서의 흡착량을 측정하였으며, 시간에 따른 변화는 측정하지 않았다. Fe/PVA-AA의 비율이 2로 높은 경우에는 흡착량이 증가하지 않고 오히려 일부 감소하는 것으로 나타나, 최적의 Fe/PVA-AA는 1로 결론지을 수 있었다. 이후 PVA-AA-nZVI의 합성을 위해서 상기 도출된 최적 조건인 Fe/PVA-AA = 1 및 0.5시간의 흡착 시간을 사용하였다.
3.2. 표면 개질에 따른 나노 영가철 합성 비교
상기 3.1절에서는 AA를 이용한 표면개질의 효과를 Fe2+의 흡착을 통하여 확인할 수 있었으며, 이후 nZVI의 합성에서의 효과를 확인하기 위하여 개질 소재(PVA-AA) 및 미개질 소재(PVA)에 Fe2+ 흡착 후 나노 영가철 합성을 진행하였다. 나노 영가철 합성 정도의 차이를 확인하기 위하여 합성이 완료된 소재의 질량을 측정하였으며, 소재의 단면을 SEM으로 관찰하였다. 또한 EDS를 사용하여 단면의 철의 분포를 보다 면밀히 관찰하였다.
합성이 완료된 소재들의 질량을 비교하여 Table 1에 나타내었다. 표면 개질을 거치지 않은 PVA의 경우, 나노 영가철 합성 이후 0.01 g의 질량을 갖는 것으로 측정되었으나, AA로 표면 개질을 거친 PVA의 경우, 나노 영가철 합성 이후 0.027 g의 질량을 갖는 것으로 측정되었다. 이와 같은 증가된 질량은 표면 개질 과정에서 표면에 형성된 아크릴산의 질량과 더불어 나노 영가철의 합성량이 증가되었기 때문으로 판단해 볼 수 있다. 그러나 증가된 나노 영가철 합성량을 단독으로 나타내지 못하기 때문에 SEM/EDS를 이용하여 보다 면밀히 관찰하였다.

Change of mass of PVA sponge (0.3 × 0.3 × 0.3 cm3) according to the AA modification and nZVI immobilization (n=3).
PVA, PVA-AA, 및 PVA-AA-nZVI의 단면을 SEM을 통해 관찰한 결과는 Fig. 3과 같다. 본 연구에서 사용한 지지체 소재인 PVA (Fig. 3(a))는 표면이 거칠고 공극이 많으며 공극의 크기도 50 μm 이상으로 큰 것을 관찰할 수 있었지만, 아크릴산을 이용한 표면 개질 이후(PVA-AA; Fig 3(b))에는 소재의 PVA 섬유 간 공극에 AA가 형성된 모습을 확인할 수 있었다. 섬유 사이 공간에 AA가 합성됨에 따라 공극의 크기도 작아져 약 20-30 μm 내외의 공극을 주로 확인할 수 있었다.
나노 영가철을 합성한 소재의 경우(PVA-AA-nZVI; Fig 3(c))에는 PVA-AA 표면에 다수의 구형 나노 영가철 입자들이 형성된 것을 확인할 수 있었다. 이와 같은 구형의 나노 영가철 입자는 나노 영가철의 합성에 관한 연구에서 일반적으로 보고된 형태로써, 활성탄을 지지체로 한 나노 영가철의 합성에 대한 선행 연구에서도 유사한 형상의 나노 영가철을 확인한 바 있다[8].
이와 같이 나노 영가철이 PVA-AA 표면에 성공적으로 합성된 것은 확인할 수 있었으나, 단면을 육안으로 관찰하였을 때 PVA-AA-nZVI 내부와 표면의 나노 영가철의 합성 정도의 차이가 큰 것을 확인할 수 있었다. 표면은 나노 영가철의 합성으로 인하여 검은색을 띠었지만, PVA-AA-nZVI 단면의 중앙부에는 PVA-AA의 흰색이 그대로 남아 있는 모습을 보였다. 이는 소재의 표면에서부터 안쪽으로 환원이 진행됨에 따라 Fig. 3(b)에서 보이는 것처럼 다량의 고분자 가교성분 및 합성된 영가철로 인해 PVA-AA의 공극이 막혀 안쪽 기공으로까지의 철 침투가 어려워져 철 합성량이 감소하기 때문인 것으로 판단되었다. 이와 같은 현상을 보다 면밀히 확인하기 위하여 소재의 단면을 표면부와 내부로 나누어 SEM/EDS를 사용하여 원소 분석을 실시하였다. 또한 나노 영가철 합성을 위한 환원 반응 시간에 따른 영향을 확인하기 위하여, 환원 반응시간을 기존의 0.5 h에서 1 h으로 연장하여 합성을 진행하였고, 이때의 시료를 PVA-AA-nZVI (1 h)로 명명하였다.
PVA-nZVI (0.5 h), PVA-AA-nZVI (0.5 h) 및 PVA-AA-nZVI (1 h)의 단면을 가로지르는 선의 형태로 EDS를 사용해 측정한 결과는 Fig. 4 및 Table 2와 같다. 표면 개질을 수행하지 않은 경우(PVA-nZVI)의 경우에는 소재 표면과 내부의 철의 분포의 큰 차이가 나타나지 않았다(Fig. 4(a)). 철의 함량도 표면 14.79%, 내부 16.39%로 표면과 내부에서 주목할 만한 차이가 나타나지 않았다. 반면 PVA-AA-nZVI (0.5 h)의 경우, 표면에 해당하는 양쪽에서의 철의 피크가 높게 나타났으며, 내부는 PVA-nZVI의 경우와 유사한 높이의 피크를 나타내어 전반적으로 U자 형태의 경향성을 나타내었다(Fig. 4(b)). 분석된 철의 함량도 표면 46.58%, 내부 14.45%로, 내부는 개질 전의 경우와 유사하나 표면에 높은 철의 분포도를 가짐을 확인할 수 있었다.
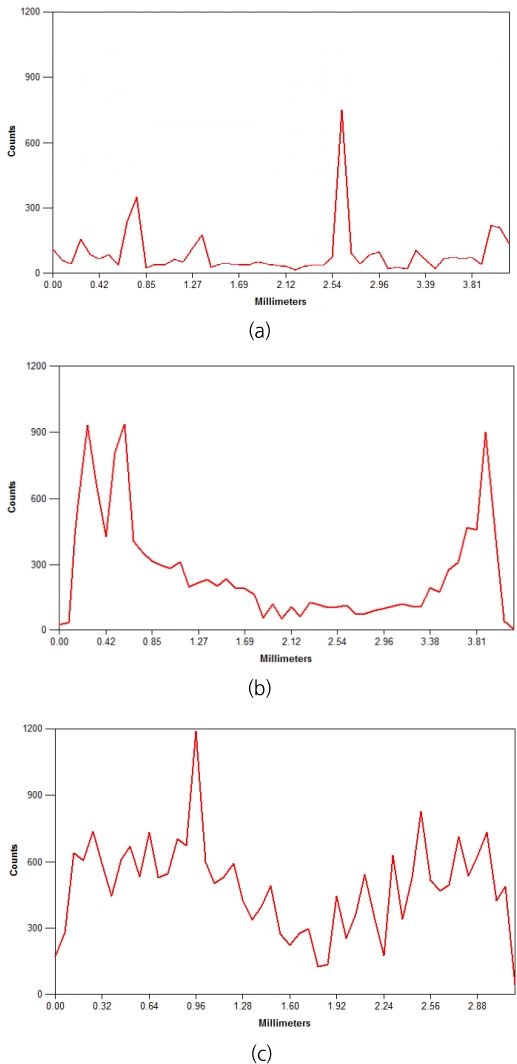
EDS analysis through cross section (Y axis refers to the X-ray counts of Fe, X axis represents cross sectional size of PVA) of (a) PVA-nZVI (0.5 h), (b) PVA-AA-nZVI (0.5 h), (c) PVA-AA-nZVI (1 h).
환원시간을 2배로 증가시킨 PVA-AA-nZVI (1 h)의 경우에는 철에 대한 피크 강도가 더 높아지고 피크들이 나타내는 U자형태의 바닥이 높아지고 폭이 줄어드는 것을 보아 상대적으로 내부까지 철의 합성이 잘 일어나는 것을 확인할 수 있었다(Fig. 4(c)). 분석된 철의 함량은 표면 64.37%, 내부 49.69%로, 표면과 내부의 철 함량 차이가 줄어들었으며, 전반적으로 철의 함량이 높아진 것으로 확인할 수 있었다. 이와 같은 결과는 환원 시간을 1시간으로 증가시켰을 경우에 나노 영가철의 합성이 더 효과적이었음을 나타내는 결과로써, 활성탄을 지지체로 하여 나노 영가철 합성을 수행하였던 사전 연구의 결과와 유사하였다[19].
3.3. 질산성 질소 환원능력 평가
본 연구에서는 질산성 질소의 환원을 이용하여 합성된 나노 영가철 기반 소재의 환원 능력을 평가하였다. 질산성 질소는 나노 영가철과 반응 시 암모니아성 질소로 환원되는 것으로 알려져 있다. 최근 수행한 선행 연구 결과에 따르면 나노 영가철의 질산성 질소의 환원 효율은 나노 영가철을 이용한 염소계 유기 화합물(트리클로로에틸렌, 1,1,1-트리클로로에탄) 및 농약(아트라진)의 환원 효율과 양의 상관 관계를 가지는 것으로 나타났다[20]. 따라서 질산성 질소의 환원 효율이 우수하다면 타 오염물질과의 반응성도 우수할 것으로 유추할 수 있다. 질산성 질소 및 암모니아성 질소는 간단한 습식 분석 및 IC를 이용하여 손쉽게 분석이 가능하며 취급이 비교적 안전하여 본 연구에서는 환원 능력을 평가하는 대표적 오염물질로 선정하여 사용하였다.
초기 질산성 질소 농도는 50 mg NO3--N/L로 설정하였고 초기 pH를 조절하지 않은 실험 군(pH 6)과 초기 pH를 2로 조정한 실험 군으로 나누어 실험을 진행하였으며, 표면 개질 유무에 따른 영향을 평가하기 위하여 PVA-nZVI 및 PVA-AA-nZVI를 사용하였다. 사용한 소재는 3.1 및 3.2에서 최적화된 조건(Fe/PVA = 1, 흡착 시간 0.5시간, 환원 시간 1시간)으로 합성된 것을 활용하여 오염물질의 환원 능력을 평가하였다.
Fig. 5에 초기 pH가 각각 pH 6, pH 2인 경우에서의 질산성 질소의 제거 및 암모니아의 생성 정도를 나타내었다. 앞서 Eq. 2에서 질산성 질소 소모량과 암모니아성 질소의 생성량의 비율은 1:1임을 확인할 수 있었는데, 실제 실험 결과에서도 질산성 질소의 소모량과 암모니아 질소의 생성량이 비슷해 총 질소의 물질수지가 유지됨을 확인할 수 있었다. Fig. 5(a)에서 보이는 것처럼 초기 pH를 조절해 주지 않았을 경우 질산성 질소 환원 능력은 2시간의 반응 시간 동안 20% 미만에 그쳤다. 표면 개질을 수행하였던 PVA-AA-nZVI의 경우에는 19.9%의 질산성 질소 환원 효율을 보여 주었으며, 표면 개질을 수행하지 않았던 PVA-nZVI의 경우에는 14.2%에 그쳤다. 이와 같은 낮은 제거 효율은 pH와 밀접히 연관되어 있을 것으로 판단해 볼 수 있으며, 실제로 최종 pH는 8.9로 상승하였다(Fig. 5(c)). 질산성 질소 환원과 동시에 발생하는 수산화이온은 용액의 pH를 상승시키는 것으로 알려져 있으며[4], 이러한 높은 pH 조건에서는 nZVI 표면에 산화철 피막이 형성된다고 알려져 있다. 이러한 산화철 피막은 질산성 질소 환원에 필요한 전자전달을 방해하기 때문에 질산성 질소 환원이 일어나지 않는 것으로 판단할 수 있으며, 이러한 결과는 pH가 질산성 질소 환원에 미치는 영향을 보고한 타 논문과 일치하는 결과이다[19,21,22].

Nitrate reduction and ammonium ion production through reaction with nZVI (a) initial pH 6, (b) initial pH 2, (c) pH change for 2 h.
초기 pH를 pH 2로 낮게 설정하였을 경우에는 2시간의 반응 이후 pH는 약 5.8로 상승하여 약산성 영역에서 반응을 유도할 수 있었으며, 표면의 산화 피막의 형성 및 불활성화에 의한 반응성 저해 영향이 낮아지는 것을 확인할 수 있었다(Fig. 5(b, c)). 표면 개질을 수행하였던 PVA-AA-nZVI의 경우에는 82.2%의 질산성 질소 환원 효율을 보여 주었으며, 표면 개질을 수행하지 않았던 PVA-nZVI의 경우에는 43.6%로 확인되어, 표면 개질을 수행한 경우가 1.9배 가량 높은 환원 효율을 나타내었다. 1차 반응식을 이용하여 속도 상수를 도출했을 경우 PVA-AA-nZVI 0.014 min-1, PVA-nZVI의 속도상수 값은 0.004 min-1로 PVA-AA-nZVI 소재의 질산성 질소 환원 속도가 더 빠른 것을 알 수 있었다. 이와 같이 높은 질산성 질소 환원 효율 및 환원 속도는 AA를 이용한 표면 개질을 통해 더 많은 양의 나노 영가철이 형성된 것에 기인하였다고 판단할 수 있다.
4. 결 론
본 연구는 나노 영가철의 단점을 개선하고 활용성을 높이기 위해 지지체를 활용함에 있어 부착성을 향상시키기 위한 표면 개질 기술을 개발하고자 하는 목적으로 수행되었다. 지지체 소재로써 시중에서 쉽게 구할 수 있는 PVA 스펀지를 사용하였으며, 아크릴산을 이용한 표면 개질을 통하여 표면에 카르복실기를 다수 형성하였다.
Fe2+이온과 PVA의 질량 비율 및 흡착 시간 최적화 실험을 통해 Fe:PVA = 1:1 비율과 30분의 흡착 시간을 최적 조건으로 도출하였다. 나노 영가철 합성을 위한 환원 시간의 최적화를 위하여 SEM/EDS 분석을 실시하였다. AA를 이용한 표면 개질을 통해 더 많은 양의 나노 영가철이 합성되었음을 확인할 수 있었으며, 환원 시간을 0.5시간에서 1시간을 증가시킴에 따라 나노 영가철의 불균일한 분포를 최소화할 수 있었다.
최적화 된 합성 소재를 이용하여 질산성 질소 환원 실험을 실시하였으며, 표면 개질의 결과로 개질 효율은 1.9배, 반응 속도는 3.5배 향상되어 표면 개질의 효과를 확인할 수 있었다. 영가철이 고정된 소재의 오염물질 환원율을 높이기 위해 중요한 인자는 영가철의 함량이라고 할 수 있다. 담체 표면을 개질하고 합성하는 과정으로 영가철의 합성 량을 높인 소재의 개발로 실제 공정에 적용함에 있어 경제성과 오염물질의 제거 능력 모두 향상시킬 수 있을 것으로 기대된다.
Acknowledgements
이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.



