열처리된 세피올라이트를 이용한 수용액상의 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 제거
Removal of Cd2+, Cu2+, Pb2+, Ni2+ in Aqueous Solution by Thermally Treated Sepiolite
Article information
Abstract
저렴한 천연 규산염 광물인 세피올라이트는 중금속 제거효율을 높이기 위해서 고온에서 열처리 되었다. 950℃에서 열처리한 세피올라이트(S950)의 Cd2+, Cu2+, Pb2+ 및 Ni2+의 흡착량이 가장 높았다. S950의 혼합 중금속의 흡착특성을 규명하였다. 동역학적 실험은 5분 이내에 평형에 도달했다. S950의 평형 실험 결과에 Freundlich 모델이 Langmuir 모델보다 더 잘 부합되는 것으로 나타났다. S950에서 Cd2+, Cu2+, Pb2+ 및 Ni2+의 최대흡착량은 각각 127.69 mg/g, 388.85 mg/g, 131.33 mg/g, 129.51 mg/g이었다. 열역학적 흡착의 결과, 중금속 흡착량은 반응 온도가 증가함에 따라 증가하였다. 열역학적 흡착은 S950으로의 중금속 흡착이 흡열 반응이며 자발적 반응인 것을 나타내었다. 이온 강도의 증가는 S950의 중금속 흡착을 감소시켰다. S950의 함량이 증가함에 따라 중금속 흡착량이 감소하고 총 제거율이 증가했다. 인산염의 존재가 S950의 중금속 흡착에 부정적인 영향을 미쳤다.
Trans Abstract
Low-cost mineral silicate sepiolite was calcined at high temperature to increase its heavy metal removal efficiency. Sepiolite calcined at 950℃ (S950) showed higher adsorption amount of Cd2+, Cu2+, Pb2+ and Ni2+ than that of sepiolite calcined at other temperature. The adsorption characteristics of mixed heavy metals onto S950 were investigated. The kinetic experiment showed that equilibrium adsorption was reached with 5 minutes of reaction. Equilibrium experimental data were better suited to Frendlich model than Langmuir model. The maximum adsorption capacities for Cd2+, Cu2+, Pb2+ and Ni2+ in S950 were 127.69 mg/g, 388.85 mg/g, 131.33 mg/g and 129.51 mg/g, respectively. As a result of the thermodynamic adsorption, the amount of heavy metal adsorption onto S950 increased with increasing reaction temperature. Thermodynamic analysis showed that the heavy metal adsorption onto S950 was endothermic and spontaneous reaction. The increase in ionic strength had a negative effect on the heavy metal adsorption of S950. As the dose of S950 increased, the heavy metal adsorption amount decreased but the total removal percentage of heavy metals increased. The presence of phosphate negatively influenced heavy metal adsorption to S950.
1. 서 론
최근 다양한 형태의 용존성 중금속이 하천 및 연안으로 유입되고 축적됨에 따라 공공의 건강을 위협하고 있다[1]. 중금속은 체내에 쉽게 축적되는 오염물질로써 인간에게 위해성이 매우 높다. 또한 지속성이 커서 자연환경에 노출시 아무리 미량일지라도, 생물체에 노출되어 급만성적 중독현상을 일으킨다. 유해중금속 중 카드뮴은 독성이 강하고 호흡기계의 질환을 유발하여 급성 폐렴이나 심장혈관계 질환을 유발시키고[2], 구리는 과다 섭취 시 간에 축적되어 적혈구 장애의 원인이 된다[3]. 납의 중독현상은 빈혈 및 신경 마비를 유발시키고[4], 니켈은 알레르기성 접촉 피부염[5]을 일으키는 물질이다. 따라서 카드뮴, 구리, 납, 니켈과 같은 유해한 중금속을 인체에 무해하도록 처리하는 것이 중요하다.
환경 오염을 일으키는 중금속 농도를 낮추기 위한 다양한 중금속 제거 기술이 연구되었다. 중금속 처리법으로는 화학응집 침전법[6], 이온교환법[7], 역삼투막법[8], 산화/환원법[9] 등이 있다. 산업적으로 사용되고 있는 이 방법들은 중금속의 회수가 가능한 장점이 있지만 비용이 많이 소요된다[10]. 이에 비해 흡착법을 이용한 중금속 제거 방법은 저렴한 비용과, 적은 에너지 소모, 유지관리가 쉬운 장점이 있다[11]. 중금속을 제거하는데 주로 사용되는 흡착제로는 석회석[12], 제올라이트[13], 아타풀자이트[14]와 같은 점토광물에 대한 연구가 활발히 진행되었다.
점토광물 입자의 표면은 음전하를 띄고 있어 양이온을 띄는 중금속 흡착에 중요한 역할을 하는 것으로 알려져 있다[15]. 그 중 세피올라이트(Sepiolite)는 섬유질 사슬 구조를 가진 규산 마그네슘 점토 광물로서 Mg4(Si2O5)3(OH)2・6H2O의 화학식을 갖고 있다. 세피올라이트는 8면체 구조로 중금속 양이온 이온과 결합할 수 있는 물질로 잘 알려져 있다[16,17]. 또한, 독성이 없고, 비용이 저렴하여 경제적이다[18]. 하지만 천연광물인 세피올라이트는 불순물을 다량 함유하고 있어 흡착 효율을 높이기 위해 개질이 필요하다. 흡착제의 개질을 위한 방법으로 주로 사용되는 열처리는 무기물 함량을 증가시키고, 비표면적의 변화와 공극의 형성으로 흡착효율을 향상시킬 수 있다[19].
이에 본 연구에서는 고온에서 소성된 세피올라이트를 이용하여 혼합 중금속 용액으로부터 Cd2+, Cu2+, Pb2+, Ni2+의 흡착량을 조사하였다. 950℃에서 열처리된 세피올라이트의 중금속 흡착량이 가장 높게 나타났고, 이를 이용하여 배치실험을 수행하였다. 배치 실험은 중금속 흡착에 대한 동적 및 평형, 열역학적 흡착실험, 이온강도, 세피올라이트 주입량, 인산염의 영향, 초기 pH에 따른 혼합 중금속 흡착실험을 수행하였다. 동역학적 모델, 평형 모델 및 열역학 모델을 사용하여 실험 결과를 분석하였다.
2. 재료 및 방법
2.1. 열처리를 통한 세피올라이트의 흡착특성 및 흡착실험
본 실험에서 사용된 세피올라이트는 (주)대은화학으로부터 제공받았다. 입경의 크기는 74 µm로 균일한 시료가 사용되었다. 세피올라이트의 중금속 흡착효율을 높이기 위해 열처리는 튜브퍼니스(직경 5.5 cm, 길이 55 cm)에서 100℃, 300℃, 500℃, 700℃, 750℃, 800℃, 850℃, 900℃, 950℃에서 4시간 동안 수행되었다. 세피올라이트를 열처리하기 전에, 질소(N2) 가스를 주입하여 무산소 조건에서 열처리하였다.
중금속 흡착실험은 평형 흡착실험, 동역학적 흡착실험, 열역학적 흡착실험, 이온강도의 영향 실험, 세피올라이트의 주입량에 따른 흡착실험 및 인산염 흡착실험이 수행되었다. 흡착조건은 세피올라이트 0.1 g과 1000 mg/L 혼합 중금속 용액 30 ml를 코니칼 튜브에 넣고 24시간 동안 25℃에서 160 rpm으로 반응시켰다. 실험에 사용된 혼합 중금속 용액은 Cd(NO3)2・4H2O, Cu(NO3)2・3H2O, Pb(NO3)2, Ni(NO3)2・6H2O를 혼합하였고, 1 M HCl과 1 N NaOH를 이용하여 pH를 4로 맞추어 표준용액을 제조하였다. 열처리 후 중금속 제거에 가장 효과적인 950℃로 열처리된 세피올라이트(S950)를 이용하여 동적 흡착실험(kinetic sorption test), 평형 흡착실험(equilibrium sorption test), 열역학적 흡착실험(thermodynamic sorption test) 등을 수행하였다. 동역학적 실험은 0.1 g의 S950에 혼합 중금속 수용액 1,000 mg/L 농도의 용액에서 0.25~24 h 반응시켜 흡착량을 분석하였다. 평형 흡착실험은 0.1 g의 S950을 농도가 100 mg/L, 200 mg/L, 300 mg/L, 500 mg/L, 1,000 mg/L, 2,000 mg/L인 혼합 중금속 용액에 넣고 24시간 동안 교반 후 흡착량을 분석하였다. 반응온도에 따른 세피올라이트의 중금속 흡착특성을 분석하기 위해, 15℃, 25℃, 35℃의 온도 조건에서 실험을 수행하였다. 용액의 이온강도가 중금속 흡착특성에 미치는 영향을 알아보기 위해, NaNO3를 이용하여 0 mM, 1 mM, 10 mM 이온강도가 다른 1000 mg/L의 혼합 중금속 용액을 제조하였다. 0.1 g, 0.2 g, 0.3 g, 0.4 g, 0.5 g의 흡착제를 이용하여 혼합 중금속 5000 mg/L 용액에 세피올라이트의 주입량에 따른 혼합 중금속의 흡착특성을 살펴보았다. 인산염이 S950의 중금속 흡착에 미치는 영향을 알아보기 위하여 1000 mg/L 농도의 혼합 중금속 용액에 1 mM과 10 mM 농도의 KH2PO4을 넣고 흡착실험과 동일한 조건에서 교반하였다. pH에 따른 S950의 중금속 흡착특성을 살펴보기 위하여 pH 1, 2, 3, 4 조건에서 실험을 수행하였다. 초기 pH는 1 M HCl을 이용하여 조절하였다. 칼슘 용출 실험은 흡착실험 조건과 동일하게 S950 0.1 g에 증류수 30 ml를 넣고 1시간 동안 교반 후 Ca2+의 농도를 ICP-OES (Agilent 5100 Series, USA)로 분석하였다.
모든 실험은 모두 3회 반복 수행하였으며, 흡착실험에 사용한 혼합 중금속 용액을 여과 후 희석하여 ICP-OES (Agilent 5100, Agilent Technologies, USA)로 측정하였다.
2.2. 데이터 분석
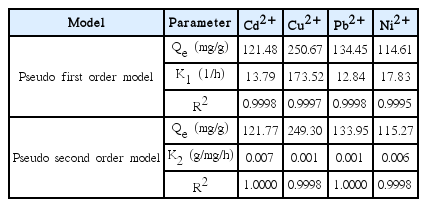
동역학적 흡착실험(kinetic sorption test) 결과는 유사 1차 모델(Pseudo first-order model)과 유사 2차 모델(Pseudo second-order model)으로 분석하였고, 식은 아래에 나타내었다.
여기에서 qt는 시간 t일 때에 여재의 단위질량당 흡착된 중금속의 양(mg/g), qe는 평형 상태에 도달했을 때 여재의 단위질량당 흡착된 중금속의 양(mg/g), k1는 유사 1차 반응 상수(1/h), k2는 유사 2차 반응 상수(g/mg/h)이다.
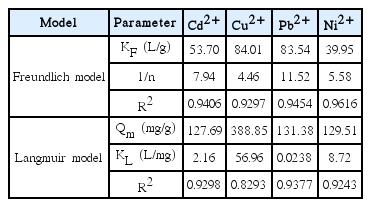
등온 흡착실험의 결과는 Langmuir (3)과 Freundlich (4) 모델을 이용하여 분석하였다.
여기에서 Ce는 평형상태에서의 수용액에 잔류하는 중금속의 농도(mg/L), KL는 결합 에너지와 관계된 Langmuir 흡착 상수(L/mg), Qm는 단위 질량의 여재 당 중금속의 최대 흡착량(mg/g), KF는 분배계수(L/g), 그리고 n은 Freundlich 상수이다.
반응 온도에 따른 흡착실험 결과는 아래의 식을 이용하여 열역학적 특성을 분석하였다.
여기서 ∆G0는 Gibb’s 표준 자유에너지의 변화(kJ/mol), ∆S0는 표준 엔트로피의 변화(J/k mol), ∆H0는 표준 엔탈피의 변화(kJ/mol), R은 기체상수(8.314 J/mol/K), Ke는 평형 상수, 그리고 α는 흡착제의 주입량(g/L)이다. ∆S0와 ∆H0는 식 (7)의 lnKe와 1/T의 관계식으로 계산하였다.
3. 결과 및 고찰
3.1. 열처리 온도에 따른 세피올라이트의 특성 및 혼합 중금속 제거 분석
본 연구에서 사용된 세피올라이트의 열처리 온도에 따른 중금속 흡착특성을 파악하기 위하여 0℃, 100℃, 300℃, 500℃, 700℃, 750℃, 800℃, 850℃, 900℃, 950℃에서 열처리한 세피올라이트의 중금속 흡착특성을 Fig. 1에 나타내었다. 열처리하지 않은 세피올라이트의 중금속 흡착량은 Cd2+는 98.65 mg/g, Cu2+는 113.22 mg/g, Pb2+는 84.72 mg/g, Ni2+는 100.70 mg/g에서 열처리 온도가 증가함에 따라 Cd2+, Cu2+, Pb2+, Ni2+의 흡착량이 모두 증가하였다. 특히 950℃에서 열처리된 세피올라이트에서 Cd2+는 150.72 mg/g, Cu2+는 257.98 mg/g, Pb2+는 140.67 mg/g, Ni2+는 124.33 mg/g으로 가장 높은 흡착량을 나타내었다. 이 결과는 열처리 하지 않은 세피올라이트에 비해 Cd2+, Cu2+, Pb2+, Ni2+의 흡착량이 각각 1.53배, 2.28배, 1.66배, 1.40배 증가하였다.
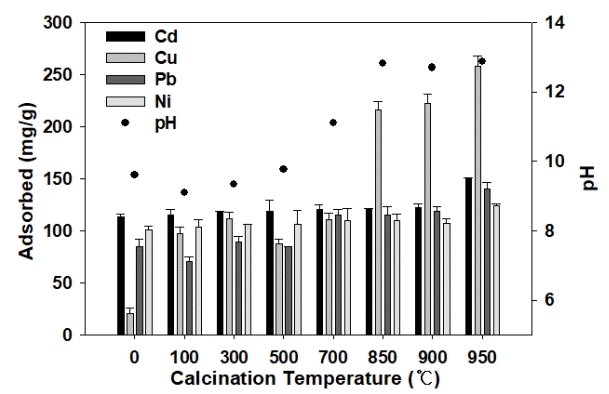
Effect of thermal treatment on the adsorption capacity of sepiolite for Cd2+, Cu2+, Pb2+, Ni2+ removal.
세피올라이트의 특성 분석 결과 0℃에서 950℃로 열처리 온도가 증가함에 따라서 용출된 칼슘 농도가 6.36 mg/L에서 299.59 mg/L로 증가하였다. 0℃에서 950℃로 열처리 온도가 증가할수록 칼슘의 농도가 증가되고 이는 Cd2+, Cu2+, Pb2+, Ni2+의 흡착량에 영향을 미친 것으로 판단된다. 세피올라이트와 유사한 돌로마이트의 중금속 흡착은 양이온 교환, 침전, 그리고 탄산염 이온과의 흡착을 통해서 이루어진다[20]. Ca2+의 용출 증가는 용액의 pH를 증가시켜서 침전에 의한 중금속 제거를 향상시킨다[20~22]. 또한 Ca2+의 용출 증가는 이온 교환에 의한 중금속 제거가 증가한다[20,23]. 열처리에 따른 세피올라이트의 비표면적이 감소하고 표면에 수산기가 형성되어 등전점(point of zero charge)이 증가한다[16]. 열처리 온도 증가에 따라서 비표면적은 감소하지만, 수산기가 다량 형성되어 중금속 흡착이 용이하게 된다.
950℃로 열처리한 세피올라이트의 pH는 Fig. 1과 같이 9.61에서 12.88로 증가하였다. S950의 Cd2+, Cu2+, Pb2+, Ni2+의 높은 흡착력을 나타내는 이유는 S950의 높은 pH로 중금속의 침전을 용이하게 한다[1,15]. 950℃에서 열처리한 세피올라이트의 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 흡착량이 가장 큰 것으로 나타났으므로 950℃에서 열처리한 세피올라이트(S950)를 이용하여 추후 흡착실험을 진행하였다.
3.2. S950의 동역학적 흡착특성
반응시간에 따른 S950의 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 흡착에 대한 결과를 Fig. 2에 나타내었다. Table 1은 유사 1차 모델과 유사 2차 모델을 적용한 결과를 나타낸다. S950에 Cd2+, Cu2+, Pb2+, Ni2+의 흡착은 모두 반응시작 후 5분 이내의 짧은 시간에 평형에 도달하였다. Cd2+, Cu2+, Pb2+, Ni2+는 R2 값이 모두 1에 가까운 값을 나타내어 유사 1차 모델과 유사 2차 모델 모두 잘 부합한 것을 알 수 있다. 이는 입자 내 확산 또는 화학적 결합 모두 S950의 Cd2+, Cu2+, Pb2+, Ni2+ 흡착에 영향을 미치는 것으로 판단된다[24,25].
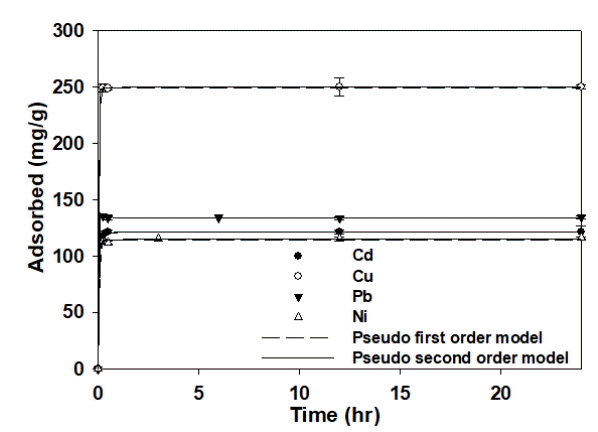
Kinetic adsorption data with model fits for the adsorption of heavy metals (Cd2+, Cu2+, Pb2+, Ni2+) to S950.
3.3. S950의 평형 흡착특성
혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 평형흡착실험은 Fig. 3과 같이 Freundlich 모델과 Langmuir 모델을 이용하여 분석하였다. Table 2에서와 같이 Freundlich 모델에서 분배계수(KF)는 Cd2+은 53.70 L/g, Cu2+은 84.01 L/g, Pb2+은 83.54 L/g, Ni2+은 39.95 L/g이며, 1/n 값은 Cd2+ (7.94)과 Cu2+ (4.46), Pb2+ (11.52), Ni2+ (5.58)에 대해서는 1/n > 0.5이므로 흡착경향이 약한 결합을 나타냈다[26]. Cd2+, Cu2+, Pb2+, Ni2+ 모두 Langmuir 모델의 R2 값보다 Freundlich 모델의 R2 값이 더 높게 나타나 Langmuir 모델보다는 Freundlich 모델이 더 잘 부합되어 단층흡착보다는 다층흡착인 것으로 판단된다.
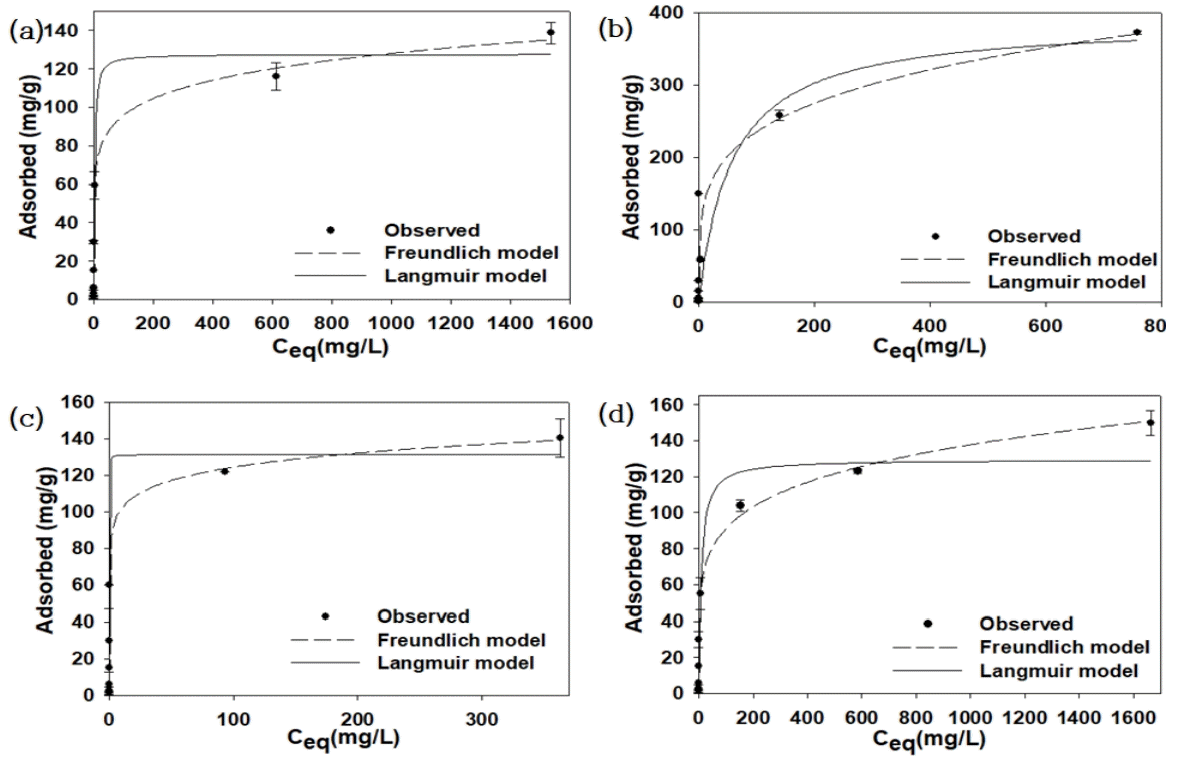
Equilibrium adsorption data with model fits for the adsorption of (a) Cd2+, (b) Cu2+, (c) Pb2+ and (d) Ni2+ to S950.
Langmuir 모델에서는 최대흡착량(Qm)은 Cd2+ (129.69 mg/g), Cu2+ (388.85 mg/g), Pb2+ (131.38 mg/g), Ni2+ (129.51 mg/g) 중 Cu2+가 S950에 대해 가장 높은 흡착량을 나타냈다. Langmuir 모델에서 최대흡착량(Qm)은 Cu2+≫Pb2+>Cd2+>Ni2+순이었다. Langmuir 모델에서 흡착상수값(KL)은 Cu2+>Ni2+>Cd2+>Pb2+순이었다. 점토광물의 중금속 단위흡착량을 비교해 보면 몬모릴로나이트[27]는 Cd2+, Pb2+, Ni2+의 최대흡착량은 각각 30.7 mg/g, 31.1 mg/g, 21.3 mg/g이고, 카올리나이트[27]는 각각 6.8 mg/g, 11.5 mg/g, 7.1 mg/g이였다. 돌로마이트의 Cu2+, Pb2+ 흡착량은 각각 0.13 mg/g, 0.11 mg/g, 벤토나이트[28]의 Cd2+의 최대흡착량은 9.3 mg/g다. 방해석[29]의 Cd2+, Pb2+ 흡착량은 각각 18.52 mg/g, 19.92 mg/g로 S950의 중금속 최대흡착량은 다른 천연광물 흡착제에 비해 높게 나타남을 확인할 수 있었다.
3.4. S950의 열역학적 흡착특성
S950에 대한 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 흡착에 있어 반응온도가 미치는 영향을 알아보기 위해 15℃, 25℃, 35℃ 조건에서 실험을 수행하였다. 혼합 중금속의 열역학적 흡착결과를 Table 3에 나타내었다. 반응온도가 증가할수록 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 흡착량은 증가하는 것으로 나타났으며, 이것은 흡열반응임을 의미한다. 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 ∆S0 값이 양수이므로 흡착과정에서 고체와 용액사이의 계면에서 무질서도가 증가함을 나타낸다. 본 실험 조건인 15℃, 25℃, 35℃에서 자유에너지 값(∆G0)이 Cd2+ (-1.29 kJ/mol, -4.09 kJ/mol, -6.89 kJ/mol), Cu2+ (-0.65 kJ/mol, -5.76 kJ/mol, -10.88 kJ/mol), Ni2+ (-2.55 kJ/mol, -4.66 kJ/mol, -6.77 kJ/mol)는 음의 값으로 본 실험조건에서 자발적인 반응임을 알 수 있다. Pb2+ (0.79 kJ/mol, 0.16 kJ/mol, -0.47 kJ/mol)의 경우 35℃ 조건에서만 자발적인 반응으로 나타났다.
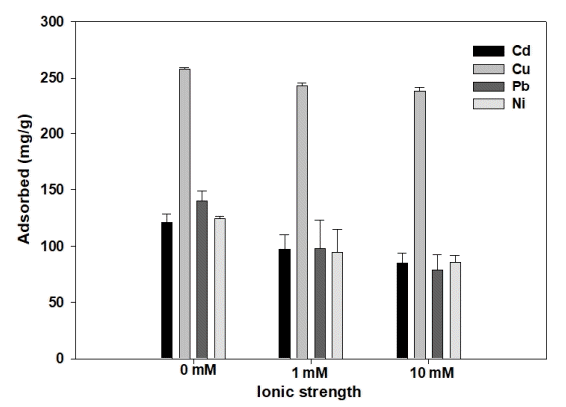
3.5. 이온강도에 따른 S950의 흡착특성
S950의 혼합 중금속의 흡착에 용액의 이온강도의 특성 및 혼합 중금속 제거율을 Fig. 4에 나타내었다. 이온강도가 0에서 10 mM로 증가할수록 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 모두 흡착량이 감소하였다. Cd2+의 경우, 타 이온이 존재하지 않은 경우에 비하여 이온강도가 1 mM일 때 19.64%의 감소량을 나타냈고, 10 mM일 때 흡착량은 29.92% 감소하였다. Cu2+의 경우, 이온강도 1 mM일 때 5.83%, 10 mM의 이온강도에서 7.78% 중금속 흡착량이 감소하였다. Pb2+의 경우, 1 mM의 이온강도에서 29.89% 감소하였고, 10 mM일 때 43.05% 감소하였다. Ni2+은 1 mM, 10 mM의 이온강도에서 각각 26.63%, 31.39% 감소하였다. Cd2+, Cu2+, Pb2+, Ni2+는 세피올라이트와 outer-sphere complex를 형성한다[30~33]. 비특이적 흡착은 상대 이온과의 경쟁 흡착 때문에 이온강도의 변화에 크게 영향을 받는 것으로 보고되어있다[34]. 일반적으로 이온강도는 inner-sphere complex 형성에 영향을 미치지 않지만, outer-sphere complex 형태의 흡착 감소를 유도하기 때문에 중금속의 흡착량이 감소하는 것으로 판단된다[28].
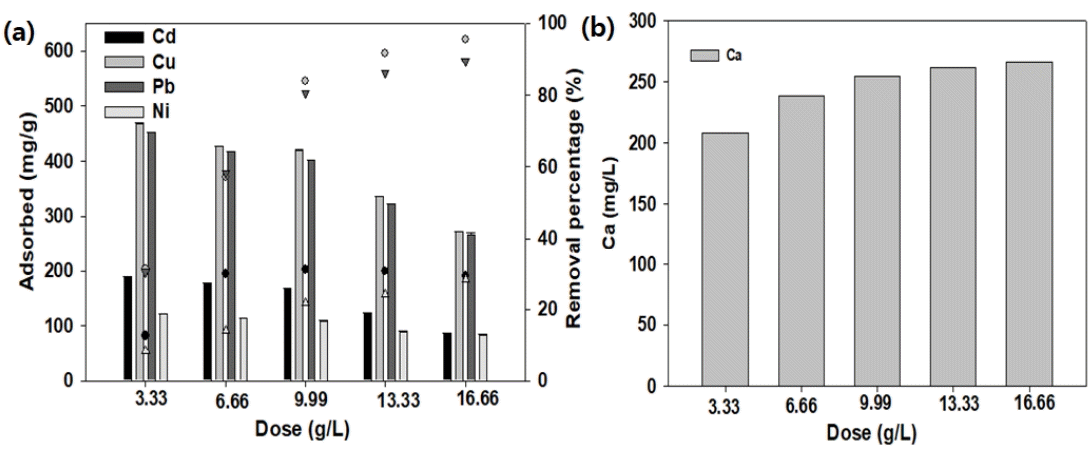
3.6. S950의 주입량에 따른 흡착특성
S950의 주입량이 혼합 중금속 흡착에 미치는 영향을 Fig. 5에 나타내었다. 혼합 중금속 용액에 S950의 주입량을 3.33 g/L에서 16.66 g/L으로 증가함에 따라 Cd2+의 흡착량은 187.95 mg/g에서 85.26 mg/g로 감소하였고 총 제거율은 12.58%에서 29.26%로 증가하였다. S950의 주입량이 증가함에 따라 Cu2+와의 흡착량 467.7 mg/g에서 272.58 mg/g으로 감소하였고, 제거율은 31.18%에서 95.44%로 증가하였다. Pb2+도 S950의 주입량이 증가할 때 452.4 mg/g에서 267.64 mg/g로 감소하였고, 제거율은 30.4%에서 89.49%로 증가하였다. Ni2+의 경우 흡착량은 122.10 mg/g에서 83.66 mg/g로 감소하였고, 제거율은 8.28%에서 28.38%로 증가하였다. S950을 16.66 g/L 주입 시에 Cu2+와 Pb2+은 90% 이상 제거할 수 있을 것으로 판단된다. S950의 주입량이 증가할수록 Fig. 5(b)와 같이 흡착 후 용출된 칼슘(Ca2+) 농도는 208.47 mg/L에서 266.35 mg/L로 증가하였다. 이를 통하여 S950의 Ca2+와 이온 교환에 의한 중금속의 흡착량은 증가함[20,23]을 확인할 수 있었다.
3.7. S950의 인 흡착이 중금속에 미치는 흡착특성
혼합 중금속 용액에 1 mM과 10 mM 농도의 인산염을 혼합 후 S950에 흡착한 결과를 Table 4에 나타내었다. 인산염의 농도가 높아질수록 중금속의 제거량은 감소하는 것으로 나타났다. S950에 인산염과 중금속 용액을 혼합하여 흡착 결과 Cu2+의 흡착량(257.98 mg/g)은 인산염 1 mM일 때 187.22 mg/g, 10 mM일 때 150.56 mg/g로 나타났다. 1 mM의 인산염 존재 시 다른 중금속 이온에 비해 Cu2+는 27.43%로 가장 크게 감소하였고, 인산염 농도가 10 mM로 높아질수록 41.64%로 더 크게 감소하였다.
Ca2+ 용출 실험 결과 6.36 mg/L (0℃), 6.69 mg/L (100℃), 4.98 mg/L (300℃), 4.71 mg/L (500℃), 17.32 mg/L (700℃), 120.90 mg/L (850℃), 166.17 mg/L (900℃), 299.59 mg/L (950℃)으로 나타났고, 이 중 S950의 Ca2+이 299.59 mg/L로 가장 높게 용출되었다. Ca2+이온 증가는 세피올라이트에서 탄산칼슘(calcium carbonate, CaCO3) 또는 수산화칼슘(calcium hydroxide, Ca(OH)2)가 해리되어 pH를 증가시키는 것으로 판단된다[35]. pH의 증가는 중금속의 침전에 의한 중금속 제거를 증가시킨다. 하지만 수용액 상에 인산염 존재 시 세피올라이트의 Ca2+이온은 수산화인회석(C10(PO4)6(OH)2)을 생성하여 Ca2+이온의 용출이 저하된다. 따라서 PO43-는 CaCO3 및 Ca(OH)2의 용해를 저하시켜서 침전에 의한 S950의 중금속(Cd²⁺, Cu²⁺, Pb²⁺, Ni²⁺) 제거에 부정적인 영향을 미치는 것으로 나타났다.
3.8. 용액의 pH가 S950의 중금속 흡착에 미치는 흡착특성
용액의 pH가 S950의 중금속 흡착에 미치는 흡착특성을 알아보기 위해 혼합 중금속 초기 용액의 pH를 다르게 조정하여 중금속 흡착특성을 알아보았다(Fig. 6). 혼합 중금속 용액의 초기 pH가 5 이상인 조건에서는 중금속의 침전이 일어나 4 이하의 pH 조건에서 pH를 변화시키며 흡착실험을 수행하였다. 혼합 중금속의 초기 pH가 1, 2, 3, 4에서 흡착 후 최종 pH는 각각 0.95, 3.47, 4.96, 4.98으로 초기 pH 1을 제외한 모든 조건에서 pH가 증가하였다. 4가지 pH 조건에서 혼합 중금속의 흡착량의 상대표준편차(RSD, %)는 Cd2+ (2.10%), Cu2+ (6.17%), Pb2+ (3.38%), Ni2+ (5.83%)로 초기 pH에 조건에 따른 혼합 중금속의 단위흡착량 변화가 크지 않았다. 따라서 낮은 pH의 중금속 오염 폐수를 처리하는데 있어서도 S950에 의해서 중금속이 효과적으로 제거됨을 알 수 있었다.
4. 결 론
본 연구에서는 열처리한 세피올라이트를 이용하여 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+)의 흡착특성을 살펴보았다. 세피올라이트의 열처리 온도가 증가함에 따라 혼합 중금속 제거량이 증가하였고, 950℃에서 최대의 흡착량을 나타내었다. S950의 동역학적 흡착 결과 Cd2+, Cu2+, Pb2+, Ni2+ 모두 5분 만에 평형에 도달하였고, 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 모두 유사 1차 모델과 유사 2차 모델 모두에 부합하는 것으로 나타났다. S950의 중금속 평형 흡착실험 결과 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 모두 Langmuir 모델보다 Freundlich 모델에 잘 부합하였다. 열역학적 흡착실험 결과 반응온도가 증가함에 따라 Cd²⁺, Cu²⁺, Pb²⁺, Ni²⁺ 모두 흡착량이 증가하여 흡열반응을 나타내었고, 35℃ 조건에서 ∆G0의 값이 음수로 자발적인 반응으로 나타났다. S950의 혼합 중금속 흡착특성은 이온강도가 증가할수록 감소하였다. S950의 주입량의 증가에 따른 모든 중금속의 흡착제 단위질량당 흡착량은 감소하였고, 모든 중금속의 총 제거율은 증가하였다. 수용액상의 인 존재는 S950의 중금속 흡착에 부정적인 영향을 미쳤다. S950는 높은 혼합 중금속(Cd2+, Cu2+, Pb2+, Ni2+) 제거특성을 나타내므로 수중 혼합 중금속 제거를 위한 효율적이고 경제적인 흡착 소재로 활용할 수 있을 것으로 판단된다.
Acknowledgements
이 논문은 2017년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(No. 2017R1D1A1B03030649).