고체상추출법과 GC/MS-SIM을 이용하여 볶음 처리한 곡류 중 아크릴아마이드 분석
Determination of Acrylamide using Solid-phase Extraction and Gas Chromatography-Mass Spectrometry Selected Ion Monitoring in Roasted Cereal Foods
Article information
Abstract
본 연구는 토양 또는 수계에 유입되어 오염을 일으킬 가능성이 있는 볶음 처리한 곡류 차 중 아크릴아마이드 분석방법을 검토하였다. 제시된 방법은 아크릴아마이드를 증류수로 추출한 후 고체상 추출법(solid phase extraction, SPE)을 이용하여 간섭 요인을 제거하고 브롬화 유도체화 반응을 최적화하여 생성된 2,3-dibromopropionamide를 ethyl acetate로 추출하여 GC/MS (SIM)분석하였다. 고체상 추출법(SPE)은 활성탄이 충진된 SupelcleanTM Coconut Charcoal cartridge를 사용하였다. 그 결과 분석방법의 방법검출한계(MDL)는 0.76 μg/kg이고, 정량한계(LOQ)는 2.32 μg/kg이였다. 검정곡선의 직선성 상관계수(R2)는 2.5~100 μg/kg의 농도범위에서 0.9997을 나타내었다. 그리고 정밀도(precision)와 정확도(accuracy)는 5.3~5.6% 이내로 안정적이었으며, 회수율(recovery)은 95.8~104%로 측정되었다.
Trans Abstract
An analytical method has been developed for the determination of acrylamide in cereal-based foods. The method is based on extraction of acrylamide with water, cleaned up through a solid phase extraction (SPE) cartridge, followed by bromination of the acrylamide double bond. The reaction product (2,3-dibromopropionamide) is extracted with ethyl acetate and analyzed by gas chromatography coupled to mass spectrometry (GC/MS) in selected ion monitoring (SIM), employing acrylamide-2,3,3-d3 (AA-d3) as internal standard. The SPE process for sample preconcentration was performed on a commercially available SupelcleanTM Coconut Charcoal cartridge packed with active carbon. In this method, correlation coefficients (R2) of calibration curves appeared to be 0.9997 in the concentration range of 2.5~100 μg/kg. The method detection limit (MDL) and the limit of quantitation (LOQ) of acrylamide were 0.76 μg/kg and 2.32 μg/kg, respectively. The calibration curve showed good linearity above 0.9997 in the ranges of the 2.5~100 μg/kg. For validation purposes, recovery studies were carried out at one concentration levels (10 μg/kg, n=3). The intraday assay accuracy and precision were in the range 104% and 5.6%, respectively, and the interday assay accuracy and precision were in the range 95.8% and 5.3%, respectively.
1. 서 론
아크릴아마이드는 백색 결정으로 물과 같은 극성 물질에 잘 녹는 특성이 있으며, 물리화학적 특성을 Table 1에 표기하였다[1,2]. 2002년 스웨덴 식품국(Swedens National Food Administration; NFA)과 스톡홀름대학(Stockholm University)의 공동 연구진이 탄수화물 함량이 높은 음식물을 굽거나 튀기는 과정에서 신경독성(neurotoxic agent) 물질의 일종인 아크릴아마이드가 다량 생성된다는 연구 결과가 최초로 보고되어 많은 연구가 진행되고 있다[3~7]. 아크릴아마이드는 실험동물을 이용한 독성평가 연구에 의하면 단량체로서 인체에 노출 시 중추[8] 및 말초신경 질환[9]을 일으킬 수 있다고 알려져 있다. 1994년에 세계보건기구(World Health Organization, WHO)산하 국제 암 연구소인 IARC (International Agency for Research on Cancer)에서는 인체에 대해 발암 가능성이 있다고 판단하여 Group 2A로 분류하고 있다[10]. 아크릴아마이드의 용도는 폴리머를 형성하는 성상으로 인하여 종이, 섬유 및 화장품 제조 시 응집제 등 산업계 뿐 만 아니라 단백질 분리를 위한 전기영동 방법에 필요한 젤을 만드는 시약으로 실험실에서도 사용되고 있다[5]. 이러한 아크릴아마이드를 검출하기 위한 기기분석법으로는 GC(ECD, FID, NPD) [11~13], GC/MS [14~17], HPLC [18], GC/MS/MS [19,20], LC/MS/MS [21,22] 등 다양한 분석기기를 이용한 분석법이 주로 사용되고 있다. 최근 아크릴아마이드 분석의 공정시험법에서는 주로 GC/MS 또는 LC-MS/MS가 대부분 이용되고 있다[1,23]. 또한 시료 전처리 방법에는 liquid-liquid extraction (LLE), solid-phase extraction (SPE), solid phase microextraction (SPME) 등이 널리 사용되고 있다. LLE 추출 방법은 시료 내의 불순물 제거가 어려워 검출한계가 높아지는 단점이 존재하며, 이를 극복하기 위해서 SPE 추출법을 사용한 응용 예가 보고되어 지고 있다[24]. SPE 추출은 적절한 고체상 및 용리액을 사용할 경우 효과적인 추출과 정제가 가능하며 동시에 여러 개의 시료를 처리할 수 있는 장점이 있다.
따라서 본 연구는 수질 및 토양환경에 유입되어 오염을 초래할 가능성이 있는 볶음 처리된 곡류 차를 선정하여 새로운 고상추출법(solid phase extraction, SPE)을 적용하고, 브롬화 반응의 최적화를 통하여 특정수질유해물질로 알려진 아크릴아마이드를 낮은 농도까지 GC/MS로 분석한 결과를 보고하고자 한다.
2. 재료 및 방법
2.1. 시료
본 연구에 사용된 시료는 국내에서 판매되는 볶음 처리된 곡류 차 5개사의 9제품을 선정하여 대형 마트에서 구입하였다. 이 중 5제품은 티백용, 4제품은 낟알 형태로 된 것으로 구매 즉시 4℃에서 냉장 보관하면서 사용하였으며 볶음 처리하지 않은 보리는 농촌진흥청 국립식량과학원으로부터 분양받아 사용하였다.
2.2. 시약 및 기구
본 실험에서 사용된 표준물질 acrylamide와 내부표준물질(Internal standard, IS) acrylamide-2,3,3-d3 (AA-d3)는 Sigma Aldrich사(St. Louis, MO, USA) 제품을 사용하였다. 표준시약의 농도는 2.5 ~ 100 μg/kg의 농도를 조제하여 검량곡선에 사용하였다. 내부표준물질의 농도는 0.31 μg/kg로 조제하여 사용하였다. 시료 전처리 과정 중 사용한 유기용매 methanol, ethyl acetate (EA) 및 dichloromethane (DCM)은 Wako사(Osaka, Japan), chloroform은 대정화금(주)사(Siheung, Korea), diethyl ether은 Showa사(Tokyo, Japan)의 잔류 농약분석용(PRA급)을 사용하였다. 브롬화 유도체화 시약인 potassium bromide, hydrobromic acid 및 bromine은 Junsei사(Tokyo, Japan) 제품을 그 외 sodium thiosulfate, sodium chloride, sodium sulfate anhydrous는 Wako사(Tokyo, Japan), potassium hexacyanoferrate(II) trihydrate, Zinc sulfate heptahydrate은 Sigma Aldrich사(St. Louis, MO, USA) 제품을 사용하였다. Carrez I 시약으로 15% potassium hexacyanoferrate (II), Carrez II 시약으로 30% Zinc sulfate를 각각 물에 녹여 사용하였다. 시료의 추출 및 정제를 위한 고체상추출(solid phase extraction, SPE)장치로는 Supelco (Bellefonte In, PA, USA)의 VisiprepTM SPE Vacuum manifold를 사용하였다. SPE cartridge로는 SupelcleanTM Coconut Charcoal solid phase extraction (SPE) cartridge (2 g, 6 cc), Supelclean TM ENVI - Carb SPE Tubes (0.25 g, 6 mL)는 Supelco, Cleanert S C18 (500 mg, 6 mL)는 Agela Technologies, Oasis HLB Extraction Cartridges (200 mg, 6 cc)은 Water사에서 구입하여 사용하였다. 분석 장비로는 Agilent 6890 GC/5973 MSD을 사용하여 SIM (selected ion monitoring)방법을 이용하였고, Column은 DB-5MS plus (30 m × 0.25 mm × 0.25 μm)를 이용하여 분석을 진행하였다.
2.3. 시료 전처리
분쇄한 시료 1 g을 정확히 취하여 100 mL 비이커에 넣고 증류수 40 mL, 내부표준용액 AA-d3 (0.31 μg/kg) 1 mL를 가한 후 Hot plate 상에서 magnetic bar를 이용하여 20분 교반 추출한 후 5000 rpm으로 10분간 원심분리 하여 추출물을 얻었다. 추출물에 함유되어 있는 단백질 또는 전분 등 고분자 물질을 제거하기 위하여 Carrez I 및 II 시약을 각각 1 mL를 가한 다음 생성된 침전을 원심분리(7000 rpm, 10분)하여 정제용 시료로 하였다.
시료의 정제는 vacuum manifold에 Coconut Charcoal SPE 카트리지(2 g, 6 cc)를 장착한 후 메탄올 5 mL, 증류수 5 mL를 차례로 통과시켜 컨디셔닝한 후 카트리지에 시료를 3 mL/min의 속도로 적재하여 시료 중 아크릴아마이드를 흡착시켰다. 시료의 적재가 끝난 카트리지는 약 10분간 진공 감압펌프를 이용하여 건조한 다음 메탄올 10 mL로 아크릴아마이드를 용리시켰다. 카트리지에서 유출된 추출액에 potassium bromide 7 g을 넣고 희석한 hydrobromic acid를 이용하여 pH 1.5로 조절한 다음 포화 브롬수 3 mL를 가했다. 빛을 차단하기 위하여 알루미늄 호일로 싸서 4℃ 냉장고 내에서 3시간 동안 브롬화 유도체화 반응을 시켰다. 유도체화 반응 후 1M sodium thiosulfate 0.2 mL를 가하여 과잉의 브롬을 제거하였다. 염석을 위하여 염화나트륨 5 g을 넣고 브롬화 반응 생성물인 2,3-DBPA를 EA 25 mL로 2회 반복하여 추출하였다. 무수황산나트륨을 가하여 수분을 제거한 다음 회전감압농축기로 0.5 mL까지 농축시킨 다음 질소 가스로 완전히 건조시킨 후 잔류물에 EA 2 mL를 가하여 녹인 후 1 μL를 GC/MS에 주입하여 분석하였다.
2.4. GC/MS의 분석조건
아크릴아마이드 분석을 위하여 사용된 분석기기는 Agilent 6890 GC/5973 MSD이며, 선택적 이온 모니터링 분석법인 SIM (Selected Ion Monitoring) 모드로 정량 분석하였다. 정량분석에 사용한 SIM 이온은 아크릴아마이드의 브롬 유도체 2,3-dibromopropionamide (2,3-DBPA)의 mass fragment ion은 m/z 150 및 m/z 152을 사용하였고, 내부표준물질 AA-d3의 브롬 유도체 d3-2,3-dibromopropionamide (d3-2,3-DBPA)의 mass fragment ion은 m/z 155를 사용하였다. GC/MS에 사용한 column 및 분석조건은 Table 2에 나타내었다.
3. 결과 및 고찰
3.1. 브롬화 유도체화 반응의 최적화
3.1.1. 반응시간의 영향
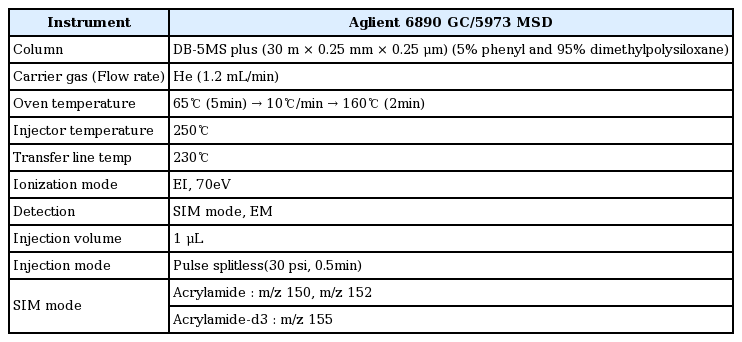
브롬화 반응의 최적 시간을 선정하기 위하여 정제수 250 mL에 아크릴아마이드 농도가 30 μg/kg인 표준용액 2 mL와 내부표준물질(0.31 μg/kg) 1 mL를 첨가하였다. 시료와 동일한 조건으로 4℃에서 유도체화 반응을 시키면서 1시간마다 시료를 채취하여 분석한 회수율의 결과를 Fig. 1에 나타내었다. Fig. 1에서 보는 바와 같이 2시간 전까지는 회수율이 94.2%였으나 3시간 후 부터는 회수율이 103.9%로 반응이 완료된 것으로 나타났다. Cheng 등[25]은 유도체 반응시간을 4℃에서 15시간, Dorin 등[26]은 4℃에서 24시간, Eom [27]은 0℃에서 24시간으로 하였다. 이와 같이 아크릴아마이드의 브롬화 유도체화의 최적 반응 시간은 다양한 시간이 보고되어 있다. 이번 실험을 통하여 회수율이 양호한 최적의 시간을 확인함으로써 분석시간을 단축할 수 있는 분석방법을 확립하였다.
3.1.2. 추출용매
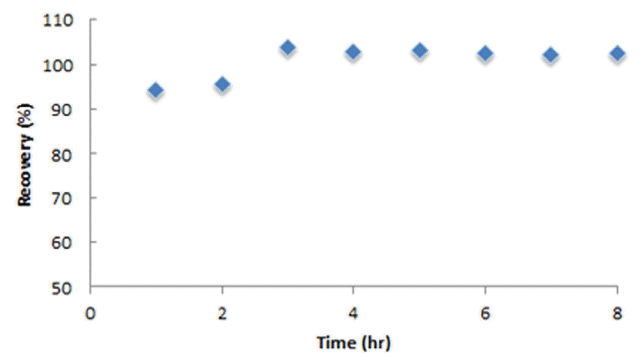
아크릴아마이드 브롬 유도체(2,3-DBPA)를 효과적으로 추출하기 위한 추출용매의 영향을 조사하기 위하여 유기 용매 중에서 물과 섞이지 않는 일반적인 추출용매로 사용되는 EA, DCM, diethyl ether, chloroform 용매의 극성 차이를 적절하게 선정하여 회수율을 측정한 결과를 Fig. 2에 나타내었다. Fig. 2에서 보는 바와 같이 아크릴아마이드 브롬화 유도체(2,3-DBPA)의 회수율은 EA가 96.7%로 가장 높았고 DCM은 82.8%, diethyl ether는 54.1%, chloroform은 36.5%가 추출되었다. 이와 같은 결과는 아크릴아마이드의 브롬화 유도체화 반응 생성물인 2,3-DBPA가 EA에 추출되기 적당한 극성(Log KOW ; -0.7 → 0.7)으로 변화하였기 때문이라고 보고되어 있다[18]. 따라서 이후 시험에서는 ethyl acetate를 추출용매로 사용하여 분석하였다.
3.2. SPE cartridge의 선정
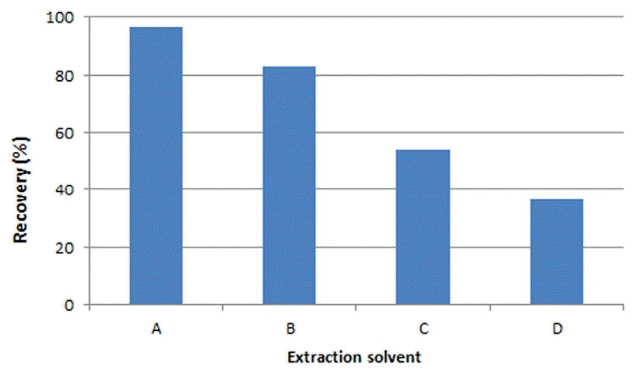
현재 식품 중 아크릴아마이드 분석은 FDA 방법을 기반으로 추출 하여, Oasis HLB 카트리지와 Bond Elut-Accucat 카트리지로 방해물질을 제거 후 LC-MS/MS를 이용하여 분석을 진행한다[23]. 하지만 LC-MS/MS는 고가의 장비로 쉽게 취급하기 어려운 단점이 있으며, 2개의 카트리지를 사용함으로써 전처리 시 비용이 많이 소모되게 된다. 이를 보완하면서 적당한 카트리지를 선정하기 위하여 SupelcleanTM Coconut Charcoal, ENVI - Carb, Cleanert S C18 및 Oasis HLB의 4종을 이용하여 회수율을 실험하였다. 아크릴아마이드 표준용액(30 μg/kg)과 내부표준물질(0.31 μg/kg)을 첨가하여 2.3의 방법으로 실험한 결과를 Table 3에 나타내었다. Table 3에서 SupelcleanTM Coconut Charcoal 카트리지를 제외한 나머지 SPE 카트리지에서는 회수율이 낮게 나타나 본 연구에는 사용할 수 없었으며, SupelcleanTM Coconut Charcoal 카트리지는 104% 회수율을 보여 본 연구에 사용하기에 적합한 것으로 판단되었다. 이와 같은 결과는 Coconut Charcoal 카트리지가 충진제로써 활성탄으로 구성되어 있고, 활성탄에 친수성이며 극성이 큰 아크릴아마이드가 흡착하는 성질로 보인다[20]. 향후 시료양이 많은 수질 시료에서 고농축이 가능한 아크릴아마이드 분석에도 유리하리라 생각된다. 따라서 본 연구를 통해서 시료 전처리 시 사용할 SPE는 Coconut Charcoal 카트리지로 선정하여 사용하였다.
3.3. 방해물질 제거 효과
시료의 전처리 진행과정에서 SPE를 진행하지 않았을 경우와 진행했을 경우를 Fig. 3에 나타내었다. Fig. 3과 같이 SPE를 진행하지 않을 경우 시료 내 불순물이 함께 추출되어 피크를 형성하게 되고 이로 인하여 기기분석 시 방해효과로 작용된다. 방해물질을 적절하게 제거하지 않을 경우, 휘발하지 않는 방해물질들은 GC의 주입구나 컬럼에 머무르게 되며 이를 통하여 분석물들이 이동하는 과정에서 환원되거나 변형이 이루어지게 된다[28,29]. 방해물질들 때문에 실제 아크릴아마이드 피크가 상승되는 것을 확인할 수 있었고, 분석 결과 회수율이 290%로 상이한 결과를 도출하게 된다. 반면에 SPE를 진행할 경우 방해물질을 효과적으로 제거하게 되어서 불순물 피크들이 줄어드는 것을 확인할 수 있다. 이는 기기 유지 관리 면에서도 좋으며 실제 표준품과의 회수율이 104%가 형성됨에 따라 실제 시료를 분석함에 있어서 정확한 결과를 도출할 수 있다.
3.4. 분석방법의 검증
아크릴아마이드 표준품을 2.5~100 μg/kg 범위에서 7개 농도를 조제하여 2.3 방법으로 실험을 진행하였다. 내부표준방법을 기반으로 아크릴아마이드 유도체(m/z : 150, m/z : 152) 피크와 내부표준물질(m/z 155) 피크의 면적비 [AS/AIS]를 Y축으로 하고 표준물질의 농도를 X 축으로 하여 표준검정곡선을 작성한 결과를 Fig. 4에 나타냈다. 상관계수(Correlation coefficient, R2)값이 0.9997로서 고도의 상관성을 띈 직선성을 나타내었다. 방법검출한계(MDL) 및 정량한계(LOQ)는 검량선의 y 절편의 표준편차와 검량선의 기울기에 근거하는 방법으로 계산하여 확인한 결과 방법검출한계와 정량한계는 각각 0.76 μg/kg 및 2.32 μg/kg으로 나타났다. GC-Ion trap-MS로 중국식품을 분석한 정량한계 10 μg/kg [25]과 biscuits를 시료로 bromination 후 GC/MS/MS로 분석한 결과의 정량한계 13.89 μg/kg [19]보다 더 낮은 정량한계를 나타냄으로써 하위 장비인 GC/MS로 더 좋은 감도로 분석이 가능한 결과를 나타내었다. 정확도와 정밀도는 3회 반복 측정하여 정밀도는 측정값의 상대표준편차(RSD, %)로 정확도는 회수율로 Table 4에 나타내었다. intra-day 회수율은 104.4%, 상대표준편차는 5.6%로 나타났다. 한편 inter-day 회수율은 95.8%였으며, 상대표준편차는 5.3%로 나타났다.
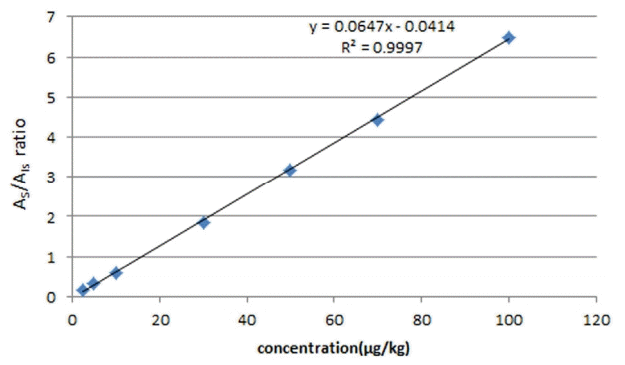
Standard curve of acrylamide at concentration ranged from 2.5 to 100 μg/kg using d3-acrylamide as an internal standard.
3.5. 실제 시료 분석
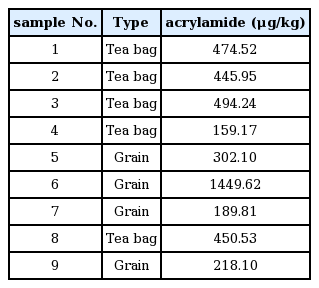
상품화되어 판매하는 볶음 처리된 곡류 차 5개사의 9제품을 분석한 결과는 Table 5와 같다. 각 제품군에 아크릴아마이드가 159 ~ 1450 μg/kg의 분포를 보였다. Koh [30]는 볶은 보리에서 165 ~ 449 μg/kg, 옥수수에서 116 ~ 400 μg/kg의 아크릴아마이드가 검출되었다는 보고되어 있다. 그 외 빵[2] 및 biscuit [20]과같이 가열 처리한 식품에서 아크릴아마이드가 검출되었다. 기존의 분석한 문헌과 유사한 결과를 얻음으로써 분석방법의 신뢰성을 확인할 수 있었으며, 아크릴아마이드가 중추 및 말초신경 질환을 유발하는 것으로 보아 꾸준히 관리 감독하며 모니터링을 할 필요가 있다고 판단된다.
4. 결 론
본 연구는 시중에서 판매되는 볶음 처리한 곡류 차 중 아크릴아마이드의 분석방법을 검토하였다. 현재 많이 사용하고 있는 FDA 기반 아크릴아마이드 분석방법은 LC-MS/MS를 이용하여 SPE 카트리지 2개를 사용하여 분석을 진행하고 있다. 이에 고사양의 LC-MS/MS를 보편적인 GC-MS로 방법을 진행하였다. 이를 보완하기 위하여 전처리 과정에서 SupelcleanTM Coconut Charcoal 카트리지를 사용함으로써, 추출액의 농축이 가능하고 효과적으로 방해물질을 제거할 수 있었다. 이로 인하여 조금 더 저렴한 비용으로 저농도까지 분석이 가능하다. 또한 브롬화 유도체화 반응을 최적화함으로써 시간을 단축한 분석법을 확립하였다. 이에 앞으로 토양 또는 수계에 유입되어 오염을 일으킬 가능성이 있는 식품에 대한 꾸준한 모니터링과 함께 낮은 농도의 아크릴아마이드 분석 방법도 계속 연구되어야 할 것이다.
1) SPE 카트리지 실험 결과, 고 농축을 진행할 수 있고 방해물질을 효과적으로 제거할 수 있는 SupelcleanTM Coconut Charcoal 카트리지를 사용함으로써 LC-MS/MS의 고 사양장비를 보편적인 GC-MS로 분석이 가능하며, 사용하는 카트리지 수를 줄임으로써 저렴한 분석을 진행할 수 있다.
2) 브롬화 유도체화 반응의 최적 반응시간은 4℃에서 3시간으로 나타났고 전처리 시간을 단축할 수 있었다.
3) 아크릴아마이드의 브롬화 유도체화 반응 생성물인 2,3- DBPA와 내부표준물질 AA-d3의 유도체화 반응 생성물인 d3-2,3-DBPA의 추출용매는 EA가 가장 양호하였다.
4) 표준품 농도 2.5~100 μg/kg 범위에서 상관계수(Correlation coefficient, R2)값이 0.9997로서 고도의 상관성을 갖는 직선성을 나타내었으며 방법검출한계(MDL) 및 정량한계(LOQ)는 각각 0.76 μg/kg 및 2.32 μg/kg이었다.
5) 확립된 분석방법으로 볶음 처리된 곡류 차 5개사의 9제품을 분석한 결과 각 제품군에 아크릴아마이드가 159 ~ 1450 μg/kg의 분포를 보였다.