Mini-module을 이용한 막투과유속 평가와 세정폐액 분석을 통한 I 막여과 정수장에서의 막오염 원인물질 규명
Investigation of Membrane Fouling Materials in I Membrane Water Treatment Plant by Analyzing Discharge Liquid from CIP Processes and the Flux Test using the Mini-Modules
Article information
Abstract
I 막여과 정수장은 초기에는 원수 내 막오염 원인물질 중 망간 및 철의 농도가 낮아 막오염 속도가 낮았던 것으로 평가되었다. 그러나 최근에는 원수 내 망간과 철의 농도 증가가 나타나고 있으며, 이와 함께 막차압도 함께 증가하였다. 정확한 막오염 원인물질을 규명하기 위해 실제 I 정수장에서 이뤄진 약품세정 공정 중 단계별 회복률과 폐액 중 막오염 원인물질을 분석하였고, 또한 실제로 오염된 막모듈 fiber를 이용해 mini-module을 만들어 각 세정 조건별로 세정 후 막투과유속 평가를 수행하였다. 막투과유속 평가결과 약품세정(CIP) 조건 중 산세정 조건에서 막투과유속이 대부분 회복 되었으며, CIP 폐액 분석결과 망간과 알루미늄이 폐액 내 주요 구성물질인 것으로 나타났다. 그리고 mini-module을 이용한 CIP 평가결과로부터 망간 용출 효율이 우수했던 구연산 산세정 조건이 염산 단독 산세정 조건에 비해 막오염 회복률이 더 큰 것으로 나타나, 망간이 I 막여과 정수장에서 주요 막오염 원인 물질인 것으로 판단되었다.
Trans Abstract
In the case of I membrane filtration water treatment plant, it was estimated that membrane fouling rate was low due to the low concentration of manganese and iron in the raw water. However, recently, the concentration of both manganese and iron in the raw water has been increasing, and the membrane fouling rate also increased. In order to identify the precise membrane foulants, we evaluated the recovery rate at each CIP stage, and we also analyzed the discharged liquid from CIP processes to investigate the membrane fouling materials. And mini-modules were manufactured by using the contaminated membrane module fiber, and the flux-test was performed after cleaning by each CIP condition. The flux-test results showed that most of the flux recovered at the acid washing condition in the CIP process, and manganese and aluminum were main compounds in CIP liquid. As a result of CIP test using mini-modules, the citric acid washing condition, which has high manganese dissolution efficiency, showed a higher recovery rate of membrane fouling than the hydrochloric acid washing condition. Therefore, manganese was estimated to be the main membrane fouling material in I membrane water treatment plant.
1. 서 론
지구 온난화에 따른 기온상승과 강수량 부족 등의 기후 변화로 인한 이상 수질이 최근 상수원에서 빈번하게 나타나고 있다[1]. 일부 수계에서는 계절과 관계없이 조류에서 기인된 맛․냄새물질 발생과 상수원수 내 철․망간 유출 문제가 지속적으로 나타나고 있는 것으로 보고되고 있다[2,3]. 일반적으로 망간 유출 문제는 복류수, 지하수, 강변여과수 등에서 국한되어 나타나며, 일부 저수지에서는 계절적인 요인으로 빈산소(hypoxic condition) 또는 무산소(anoxic condition) 조건인 저수지 심층부에서 환원된 용존망간이 Turn-over 현상에 의해 표층부까지 유출되어 나타나게 된다[4]. 그러나 최근 빈번하게 발생되는 극한 강우사상에 따른 가뭄의 영향으로 상수 공급을 위해 건설된 댐의 저수율이 낮아져 원수 내 망간의 농도가 증가하는 등 표층수에서까지 망간에 대한 문제가 대두되는 것으로 나타났다[5].
용존망간의 제거는 염소산화, 오존산화, 폭기 및 과망간산칼륨 산화 등의 산화제 주입공정을 통해 용존망간을 산화 후 침전 및 여과시켜 제거하거나, 이산화망간이 부착된 망간사를 이용하여 접촉산화 및 여과를 통해 이뤄진다. 이러한 망간제거 공정 중 망간사를 이용한 접촉산화 공정이 일반 염소산화 및 오존산화에 비해 망간제거 속도와 성능이 우수한 것으로 평가되고 있다[6~10].
국내에서는 병원성 미생물 등에 대해서 먹는물에 대한 수질 안정성 확보를 위해 막여과 정수처리 공법 도입사례가 늘어나고 있으며, 이러한 막여과 정수처리 공정은 기존 표준정수처리 공정에 비해 소요면적이 작고 수질변화 대응성이 우수하여 국내 적용성이 우수한 것으로 평가된다[11,12]. 그러나 막여과 공정은 유기물 및 무기물로 부터 기인된 막오염에 의한 막차압 상승의 문제가 있으며, 이러한 막오염을 해결하기 위해 전처리공정, 역세척 및 약품세정 공정 등이 적용된다. 하지만 막여과 정수장으로 망간이 유입될 경우에는 일반적인 응집 전처리 및 무기약품 세정을 통해서 막오염을 제어하기가 용이하지 않으며, 정수처리 공정 중에 주입되는 전염소 등의 산화제에 의해 망간에 기인된 막오염이 가중될 수 있다[13~15]. 또한 망간에 의한 막오염이 발생될 경우 원수 내 망간 이온이 막에 형성된 망간 산화물과 자가촉매 반응을 하여 막오염이 급격하게 증가하게 된다[16,17]. 따라서 망간에 기인된 막오염을 제어하기 위해서는 정수장으로 유입되는 망간을 저감하여 망간에 의한 막오염을 억제하는 방안과 분리막 약품세정(Clean In Place, CIP)을 통해 막을 오염시킨 망간 산화물을 막으로부터 제거하여 막모듈의 성능을 회복시키는 방안이 있다.
섬진강 수계 원수를 사용하는 I 정수장은 막여과 운영초기에는 망간 유입이 적었던 반면, 최근에는 유입되는 망간농도와 발생빈도가 증가하는 것으로 나타나고 있으며, 이와 함께 막오염에 따른 막차압 상승이 나타나고 있다. 따라서 본 연구에서는 막오염 원인물질 규명과 적정 약품세정 방안을 제시하기 위해 I 정수장에서 수행한 약품세정 단계별 회복률 및 폐액분석과 함께 실제 현장에서 오염된 막모듈로 제작된 mini-module을 이용하여 약품세척 조건별 여과유속과 세정폐액을 분석하였다.
2. 연구방법
2.1. I 정수장 운영현황
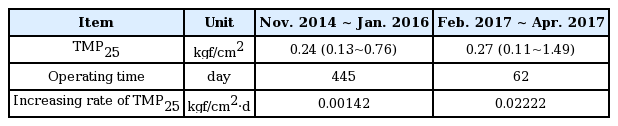
I 정수장은 시설용량 7,000 m3/일 규모의 시설로, 혼화-응집-침전 전처리공정을 거친 침전수가 가압식 정밀여과막(MF)으로 유입되도록 설계되었다. 아래 Table 1에 I 정수장의 주요 시설 및 운영조건을 나타내었으며, Table 6에는 수질변화 이전의 대표적인 막여과 운영 결과(2014년 11월~ 2016년 1월)와 수질변화 이후에의 대표적인 운영결과(2017년 2월~ 4월)를 약품세정이 실시된 이후부터 약품세정 이전까지의 운영일을 기준으로 막차압 변화 및 막차압 상승속도를 각각 나타내었다. Table 2에는 분리막 약품세정 조건을 나타내었으며, 약품세정 시에는 각 단계별 세정효율을 확인하기 위해 보정여과유속을 측정하여 Table 7에 나타내었다. 또한 막오염 원인물질 확인을 위해 각각의 세정 단계별 약품세정 폐액에 대해 TOC, 철, 망간, 알루미늄을 분석하여 Table 8에 나타내었다.
2.2. 실험실 규모 막여과 및 세정실험
2.2.1. 막투과유속 평가(flux-test) 장치
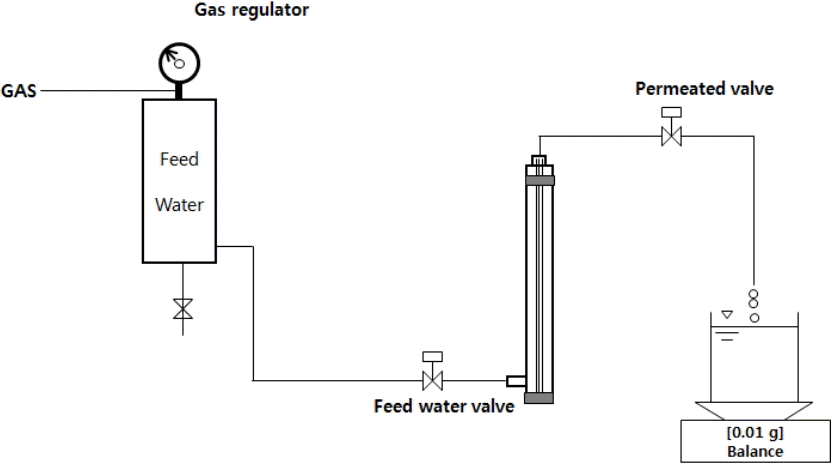
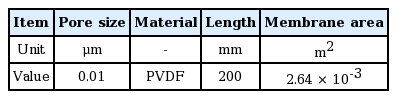
약품세정 조건별 효율평가를 위해 아래 Fig. 1의 실험 장치로 막투과유속 평가를 수행하였다. 막투과유속 평가 장치는 원수조, mini-module, 압력공급 및 제어설비 등으로 구성하였다. 여과시간은 타이머 설치를 통해 조정하였고, 압력조절은 질소가스를 이용해 정압제어를 실시하였다. 막투과유속 평가 장치에 적용된 mini-module은 I 정수장에서 운영되어 실제로 오염된 중공사막 fiber를 절단하여 사용하였다. 막투과유속 평가 장치의 공정도는 Fig. 1과 같고, minimodule의 사진 및 사양은 Fig. 2와 Table 3에 각각 제시하였다.
2.2.2. 실험실규모 약품세정 조건 및 막투과유속 평가 방법
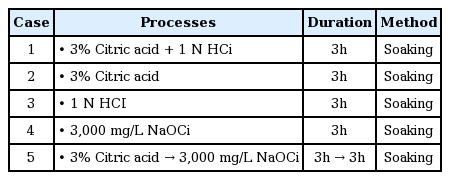
최적 약품세정 조건을 도출하기 위해 mini-module을 이용하여 여과유속 평가와 약품세정 폐액 내 막오염 원인물질을 분석하였다. 막투과유속 평가 방법은 각각의 세정 조건에 따라 세정 전, 후의 mini-module에 초순수를 일정한 압력으로 공급하여 시간당 투과량 측정을 통해 수행하였으며, 실험은 조건별로 2회씩 반복하여 실험하였다. 본 실험을 통해 각 세정 조건별 막투과유속에 대한 회복률이 평가되었다. 약품세정 방법은 오염된 mini-module을 각각의 세정약품 0.75 L에 3시간 동안 침적하였으며, 적용된 세부 약품세정 조건은 Table 4에 나타내었다.
2.2.3. 수질분석 방법
I 정수장에서 운영 중인 실제 막모듈 표면에 오염물의 성상 및 특성을 규명하기 위해 SEM-Novanano FE-SEM (FEI社)과 EDS-Apollo X-SDD (EDAX社)를 이용하여 분석하였다. 정수장으로 유입되는 원수와 약품세정 폐액 내에 총유기탄소를 분석하기 위해 TOC-L (Shimadzu社)을 이용하였으며, 원수 내 철과 망간, 그리고 약품세정 폐액 내 Al, Fe, Mn 등의 무기물의 농도를 분석하기 위해 ICP Activa-m (Horiba Jobinyvon社)를 이용하였다. 그리고 2016년 일부 원수 시료 중 망간 분석은 Hach Method 8149으로 DR5000(Hach社)기기를 이용하여 분석하였다.
3. 결과 및 고찰
3.1. I 정수장 현장운영 결과
3.1.1. 원수 내 막오염 원인물질 변화
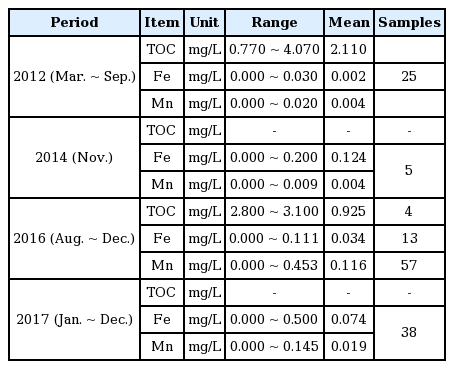
I 정수장으로 유입되는 원수 중 막오염을 유발할 수 있는 철, 망간, TOC 항목에 대한 수질변화를 확인하기 위해 2012년, 2014년, 2016년, 2017년의 원수수질 자료를 Table 5에 나타내었다. 원수에 대한 막오염 물질 분석을 위해 2012년에는 3월에서 9월까지 총 25회 시료를 채취하여 원수에 대한 수질분석을 수행하였고, 2014년에는 11월에 총 5회, 2016년에는 8월부터 12월까지 총 57회 그리고 2017년에는 1월에서 12월까지 총 38회 수질분석을 수행하였다. 분석결과 2012년, 2014년 평균 망간농도는 0.004 mg/L였으나 2016년, 2017년에는 각각 평균 0.116 mg/L, 0.019 mg/L로 증가한 것으로 나타났다. 또한 철 농도도 2012년 평균 0.002 mg/L였으나 2014년, 2016년, 2017년에는 각각 평균 0.124 mg/L, 0.034 mg/L, 0.074 mg/L로 2014년 이후 정수장 유입수 내 철 농도가 급격하게 증가한 것으로 나타났다.
3.1.2. 현장운영 결과
I 정수장은 2014년 7월부터 막여과 정수시설로 운영을 시작하였으며, 망간 등의 막오염 원인물질이 적게 유입된 2016년 이전에는 I 정수장은 저수온기, 갈수기, 고탁도 시기 등에도 안정적인 처리수질과 막여과 안정성을 나타내었다. 이때 약품세정 주기는 평균 1년 이상으로 Table 6의 막차압 증가속도가 0.00142 kgf/cm2 d으로 매우 안정적으로 나타났다. 반면에 철, 망간 등 막오염 원인물질 농도가 증가한 이후인 2017년도에는 막차압 상승속도도 0.0222 kgf/cm2 d으로 증가하였다. 중염소가 주입되고 있는 I 정수장 특성상 망간에 의한 막오염이 쉽게 나타날 수 있으며, 막표면에 망간산화물이 형성되기 시작하면 다음과 같은 반응에 의해 급속하게 망간에 의한 막오염이 진행될 수 있다[18,19].
3.2. I 정수장 약품세정 및 막모듈 표면분석 결과
3.2.1. 약품세정에 의한 보정여과유속 분석 및 막오염 원인물질 규명
약품세정은 물리세정으로 회복되지 않은 막의 비가역적 오염물질을 화학약품(강산, 강염기 등)을 사용하여 제거하는 공정으로 약품세정의 시행 시기는 막차압(TMP@25℃)이 임계차압 또는 관리기준 등 설정한 차압에 도달하는 경우 실시하며, I 정수장은 세정 관리기준을 보정차압으로 1.0 kgf/cm2로 설정하여 운영하였다.
I 정수장의 분리막 세정은 Table 2에 제시한 것과 같이, 산(HCl 1 N, Citric acid 3%) → 알칼리(NaOCl 3,000 mg/L) → 산(HCl 1 N) 순서로 각각 3시간 동안 투과와 순환을 하였으며, 각 세정 단계별로 보정여과유속 평가와 세정 폐액에 대해서는 막오염 물질인 철, 망간, 알루미늄, TOC에 대한 수질분석을 수행하였다. 특히 1차 산세정 시에 적용약품으로 염산 이외에 산화철, 산화망간 등의 용출에 효과가 우수한 것으로 알려져 있는 구연산을 함께 적용을 하여 산세정의 효율을 높이고자 하였다[20~22]. 구연산은 pH 2 조건에서는 산으로서 금속을 용출시키는 능력이 크며, pH가 4~5범위인 경우에는 금속과 착물(complexation)을 형성하여 용출시키는 능력이 증가되는 것으로 알려져 있다[23].
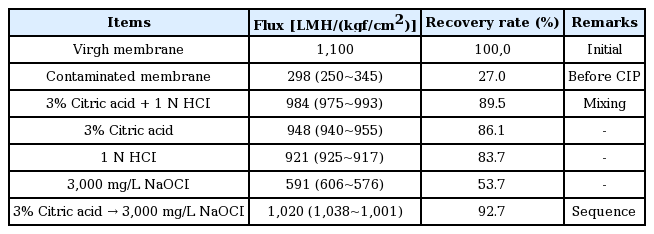
Table 7에는 약품세정 수행시기별, 개별 약품세정 단계별 보정여과유속을 나타냈다. Event 1은 2014년 11월부터 2016년 1월까지 총 445일을 운영한 이후 약품세정을 수행한 시점이며, Event 2는 2017년 2월부터 2017년 4월까지 총 62일 운영한 이후 약품세정을 수행한 시점이다. 그리고 약품세정 단계는 앞에서 제시한 것과 같이 1차 산세정, 1차 염기세정, 2차 산세정을 의미하며, 각 단계별 보정여과유속 측정 및 약품폐액에 대한 분석이 수행되었다. Table 7의 결과와 같이 약품세정 단계 중 1차 산세정을 통해 대부분의 막오염이 회복되었으며, 이후에 진행되는 1차 염기세정과 2차 산세정을 통한 추가적인 보정여과유속 증가는 크지 않았다. 따라서 I 정수장에서의 막오염 물질들은 산세정을 통해 제거되는 성분인 것으로 판단된다.
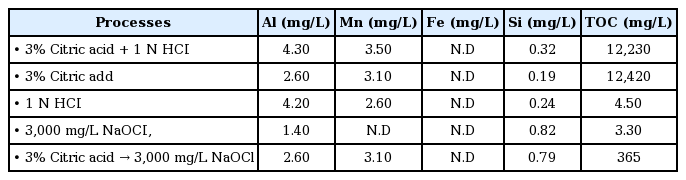
또한 각 약품세정 수행시기별, 개별 약품세정 단계별 세정폐액에 대한 막오염 물질 분석 결과는 Table 8에 나타내었다. 분석결과 각 약품세정 폐액 중에서 가장 많이 용출된 오염물질은 망간과 알루미늄 성분이었으며, 개별 약품세정 결과에서 세정단계별로 보면 1차 세정을 통해 망간과 알루미늄 성분이 가장 많이 용출된 것으로 나타났다. 그리고 약품세정을 통해 용출된 오염물량을 막면적과 운영일수로 나눠서 구한 일간 단위 막면적 당 오염물 부착량(deposit mass)은 식 (2)로 표현되며, 식 (2)를 이용하여 산정된 2017년 4월(Event 2) 수행 시에서의 망간과 알루미늄에 대한 부착량 결과는 2016년 1월(Event 1)에 수행한 결과와 비교할 때 두 배 가량 높은 것으로 나타났다. I 정수장의 주요 막오염원인물질로 평가된 망간은 원수 내 망간 성분에 기인된 것으로 판단되며, 알루미늄의 경우는 알루미늄 계열의 응집제 사용에 따른 것으로 판단된다.
여기서 Deposit mass는 일간 단위 면적당 오염물 부착량(mg/m2/day), M은 CIP 폐액 내 오염물량(mg), A는 적용된 막모듈의 막면적(m2), T는 막여과 정수장 운영일수(day)이다.
Table 5에서 제시한 바와 같이, I 정수장으로 유입되는 원수에서의 막오염 원인물질 분석 결과에 따르면 2012년도를 기준으로 망간 농도는 평균 0.004 mg/L였으며, 철 농도는 0.002 mg/L로 측정되었다. 반면, 2017년도에는 망간과 철의 농도는 각각 0.019 mg/L와 0.074 mg/L로 망간 농도는 4.8배가 증가한 반면 철 농도는 37배가 증가하여 망간에 비해 철 농도가 더 크게 증가하였다. 그리고 2017년도 기준으로 원수 내 존재하는 망간 농도 보다 철 농도가 3배 이상 높은 것으로 나타났다. 하지만 I 정수장에서 2017년 4월(Event 2)에 수행한 약품세정 시 발생된 폐액을 분석한 결과, 막모듈로부터 각 단계별 용출되는 망간 농도를 합한 값은 164.3 mg/L였으며 철의 경우에는 4.5 mg/L로 망간 농도가 철 농도에 비해 36배 이상 높은 것으로 나타났다. 이러한 결과가 나타난 이유는 I 정수장은 중염소를 주입하기 때문에 산화속도가 빠른 철의 경우 막에 도달하기 이전에 입자성 산화물로 전환되어 비가역적 막오염을 유발하지 않는 반면, 산화속도가 느린 망간의 경우는 완전히 산화되기 이전에 막 표면에 도달하여 막 표면 및 공경에서 산화물 형태로 부착되어 비가역적 막오염을 유발시키는 것으로 판단된다[13]. 앞서 평가된 결과로 부터 I 정수장의 경우에서는 무기물에 의한 오염이 주된 원인으로 판단되었으며, 원수 내 무기물 중 철 성분 보다 상대적으로 반응속도가 느린 망간 성분이 막오염을 유발하는데 더 크게 영향을 미치는 것으로 사료된다. 따라서 망간에 의한 막오염을 저감하기 위해서는 중염소 또는 전염소 주입을 지양하거나, 근본적인 해결을 위해 원수내 망간을 제거하기 위한 전처리 공정 도입이 필요한 것으로 판단된다.
3.2.2. 막모듈 표면분석
I 정수장에 설치되어 운영된 막모듈 내 가역적 오염물들을 제거하기 위해 역세공정을 수행한 이후 막모듈을 스키드로부터 탈착하였다. 탈착된 막모듈 내 중공사막 fiber 표면을 육안 및 표면분석 기기를 이용하여 분석한 결과 막 fiber 표면(Fig. 3)은 전반적으로 흑갈색을 나타내고 있었으며, 오염되지 않은 막 표면의 SEM (Scanning Electron Microscope) 이미지(Fig. 4(b))에서는 공경이 균질하게 분포되어 있는 것을 관찰된 반면, 오염된 막 표면의 SEM 이미지(Fig. 4(a)) 경우에는 물리세척으로 막 표면으로부터 탈리되지 않은 오염물 층이 존재하고 있었다.
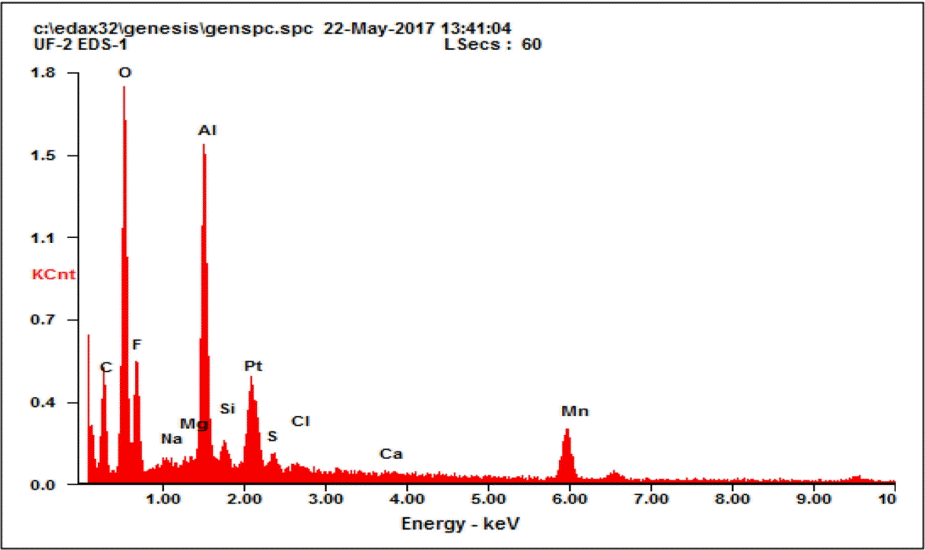
Fig. 5는 막 표면에 부착되어 있는 오염물질의 성분을 EDS (Energy Disper-sive Spectroscopy) 분석을 통해 나타낸 것이다. Fig. 5의 결과와 같이 막 표면에 부착된 물질은 망간과 알루미늄 성분이 주된 것으로 나타났으며, 약품세정 폐액에 대한 수질 분석 결과에서도 망간과 알루미늄 농도가 높게 분석되어 두 결과 모두 유사한 경향을 보이는 것으로 나타났다. 따라서 막 표면에서 전반적으로 나타내는 흑갈색 물질은 망간과 알루미늄으로부터 기인된 것으로 판단된다.
3.3. 실험실 규모 평가 결과
3.3.1. 약품세정 방법별 막투과유속 회복률 비교
현장 평가결과에 대한 검증 및 최적 세정방법을 도출하기 위해 실제 현장에 적용되어 오염된 중공사막 fiber를 이용하여 Table 3과 같이 mini-module을 제작하였다. Table 4에서 나타낸 5가지 세정방식을 적용한 이후 막투과유속 평가를 통해 각각의 세정효율을 확인하였다. 아래 Table 9의 결과와 같이 구연산 이후에 차아염소산 세정을 순차적으로 수행한 방식의 회복률이 92% 이상으로 가장 높았으며, 그 다음으로는 구연산+염산(89.5%), 구연산 단독(86.1%), 염산 단독(83.7%), 차아염소산 단독(53.7%) 적용 순서로 나타났다.
산세정 이후에 알칼리세정 적용 시 92.7%로 가장 높은 회복률을 나타냈지만, 구연산+ 염산으로 산세정만 적용 시와의 차이는 3.2%에 불과한 것으로 나타났다. 이는 산세정을 통해 대부분의 오염물들이 막으로부터 제거된 것으로 판단된다. 반면, 염기세정(차아염소산) 적용 시에는 회복률이 53.7%에 그쳐서 산세정 시에 나타난 회복률과의 차이가 큰 것으로 나타났다. 따라서 앞서 I 정수장 세척결과와 같이 비가역적인 오염을 유발하는 주요 원인물질은 산세정을 통해 제거되는 무기물인 것으로 판단된다.
3.3.2. 약품세정 조건별 막오염 원인물질 농도비교
I 정수장에서의 막오염 원인 물질 규명을 위해 현장에서 오염된 mini-module을 이용하여 Table 4 조건에 따라서 약품세정을 수행하였다. 이후, 각각의 세정폐액에 대해 수질 분석을 수행하였으며, 산세정 방법 중 무기물질이 가장 많이 용출된 조건은 구연산과 염산을 함께 적용한 경우로 나타났다. 염기세정(차아염소산) 적용 시에는 망간과 철 성분은 검출한계 이하로 나타났다. 반면, 알루미늄, 실리카, TOC 성분은 각각 1.40 mg/L, 0.82 mg/L, 3.30 mg/L로 분석되었다. 구연산 단독 적용방안과 염산 단독 적용방안에 따른 망간 용출효율을 비교할 경우, 구연산 단독 적용 시가 더 높았으며, 알루미늄과 실리카의 경우에서는 염산 단독 적용 시가 더 높은 것으로 나타났다.
각 세정 방법별 유기물의 용출결과는 구연산을 적용한 경우(구연산+염산, 구연산 단독)가 가장 높게 나타났으며, 구연산 세정 이후 차아염소산 세정, 염산 세정, 차아염소산 세정 순으로 타났다. 구연산을 적용하여 산세정한 경우 TOC 농도가 12,000 mg/L 이상으로 나타났으나, 본 조건에서 검출된 TOC 농도 대부분은 세정약품으로 사용한 구연산으로부터 기인된 유기물로 판단되며, 구연산 세정 이후 차아염소산 세정 시에 용출된 TOC 결과 역시 잔류하고 있는 구연산에 의한 영향인 것으로 판단된다.
Table 9와 10에서 제시된 결과와 같이 오염된 mini-module로부터 알루미늄, 망간, 실리카 등 무기물의 용출 효율이 높은 산세정(구연산+ 염산) 적용 시에 막투과유속 회복률은 89.5%로 나타났으며, 유기성 막파울링 물질 제거 방법으로 알려진 염기(차아염소산) 세정방법 적용 시에 회복률은 53.7%로 나타났다. 따라서 주요 막오염 원인물질은 현장 약품세정 수행결과와 동일하게 무기물인 것으로 판단된다. 그리고 알루미늄보다 망간 용출 능력이 더 우수한 것으로 평가된 구연산 단독 세정 조건에서는 막투과유속 회복률은 86.1%로 나타났으며, 알루미늄 및 실리카의 용출 능력이 상대적으로 더 우수했던 염산 단독 세정 조건의 회복률은 83.7%로 나타났다. 따라서 염산 단독 적용 시 보다는 구연산 단독 적용 시 세정 회복률이 더 증가한 것으로 평가되었으며, 이러한 결과로부터 알루미늄, 실리카, 철 그리고 망간 성분 중에서 망간이 I 정수장의 막오염 및 막투과유속 감소에 미치는 영향이 더 큰 것으로 사료되었다.
본 mini-module을 이용한 막투과유속을 평가한 결과로부터, 분리막 약품세정 중 산세정 방법으로는 구연산과 염산을 함께 적용하는 방안이 우수하였으며, 산세정 이후에 염기세정을 순차적으로 세정하는 방안 적용 시 세정효율이 추가로 증가되는 것으로 나타났다. 따라서, 현재 I 정수장에서 약품세정 방법으로 적용 중인 구연산과 염산을 동시에 적용하여 산세정 한 이후 염기세정(차아염소산)하는 방법은 막오염 원인물질로 판단된 망간제거에 적합한 것으로 확인되었다.
4. 결 론
1) I 정수장으로 유입되는 원수 내 막오염을 유발할 수 있는 망간 성분이 2016년 이후 증가하였으며, 망간 농도 증가와 함께 막차압도 함께 상승하고 있는 것으로 나타났다.
2) I 정수장 약품세정 결과 산세정과 염기세정 중에서 산세정을 통해서 대부분의 보정여과유속이 회복되는 것으로 나타나 무기물에 의한 오염이 주요한 것으로 평가되었다. 약품세정 폐액을 분석한 결과 무기물 중 철 성분 보다는 망간 성분의 농도가 높게 분석되었으며, 중염소를 주입하는 I 정수장의 특성상 염소와 망간이 반응하여 막표면에 망간산화물 형태로 부착되어 비가역적 막오염의 유발을 가중시킨 것으로 판단되었다.
3) I 정수장 현장에 적용된 막모듈을 탈착해 모듈 내 오염된 중공사막 fiber 표면을 SEM 및 EDS분석한 결과 막표면에 존재하는 갈색 오염물 층은 망간과 알루미늄으로 구성된 물질인 것으로 분석되었다.
4) Mini-module을 이용한 세정조건 별 막투과유속과 세정폐액을 분석한 결과, 산세정 방법 중 망간과 알루미늄 용출효율이 모두 높은 구연산과 염산을 함께 적용한 경우의 회복률이 89.5%로 나타나 가장 우수하였다. 염산 단독 세정에 비해 알루미늄 용출효율은 낮은 반면, 망간 용출효율이 우수했던 구연산 단독 세정 시가 염산 단독 세정에 비해 회복률이 더 높은 것으로 평가되었다. 그러므로 본 I 정수장에서는 무기성분 중 막투과유속 감소에 미치는 영향이 상대적으로 높게 평가된 망간 성분이 주요 막오염 원인물질인 것으로 판단된다.