하천에서 분해되는 보릿짚 유래 페놀산의 추출 및 분석법 개발
Development of Extraction and Analytical Methods of Phenolic Compounds Degraded from Barley Straw in River
Article information
Abstract
하천과 호소 내 다양한 유기/무기물질과 함께 존재하는 보릿짚 유래 페놀산의 추출·분석을 위한 전처리법(pretreatment)과 Ultra High Performance Liquid Chromatography (UHPLC)-MS 분석법을 개발 후 페놀산의 정량/정성분석을 실시해 분석 회수율(analytical recovery), 정확도(accuracy), 정밀도(precision)를 검증하였다. 검증결과, 보릿짚으로부터 용출되는 것으로 보고된 페놀산 7종 화합물의 크로마토그램 내 peak는 Gallic acid > 4-Hydroxybenzoic acid > Vanillic acid, Caffeic acid > Syringic acid > Coumaric acid > Ferulic acid 순으로 상호 간섭없이 분리되었으며, 전처리 과정을 통해 추출된 Gallic acid와 Caffeic acid를 제외한 5종의 페놀산은 80.4~112.8%의 분석 회수율을 나타내었다. 실제 하천·호수 시료 내에 존재하는 4종의 페놀산(4-Hydroxybenzoic acid, Vanillic acid, Syringic acid, Ferulic acid)의 검량선의 직선상관성(R2)값은 0.998~1.0으로 비교적 넓은 검출범위 내에서 높은 직선성을 나타냈으며, 비교적 낮은 검출한계(LOD)와 정량한계(LOQ)로 조사되었다. 현장 하천수 내 보릿짚 유래 페놀산의 용출 농도는 검출한계와 유사한 극미량(0.095~0.273 μg/mL)이며, 유의할만한 농도의 페놀산 용출 지속 시간도 10일 이내인 것으로 조사되었다. 본 연구를 통해 개발된 전처리법과 UHPLC-MS 분석법을 통해 보릿짚 유래 페놀산의 추출 및 분석을 하천수 및 호소수와 같은 복잡한 매트릭스에서도 효과적으로 적용할 수 있는 것으로 확인되었다.
Trans Abstract
Both extraction of phenolic acids eluted from barley straw in rivers/lakes and analytical method for the extracted phenolic acids using ultra high performance liquid chromatography (UHPLC)-mass spectroscopy (MS) were developed. Then, the analytical recovery, accuracy and precision of the developed analytical method were evaluated based on the quantitative/qualitative analysis. According to the chromatograms, seven phenolic acids eluted from barley straw were clearly separated in the order of Gallic acid > 4-Hydroxybenzoic acid > Vanillic acid > Caffeic acid > Syringic acid > Coumaric acid > Ferulic acid, and five phenolic acids except Gallic acid and Caffeic acid were found to have analysis recovery of 80.4~112.8%. Four phenolic acids (4-Hydroxybenzoic acid, Vanillic acid, Syringic acid, and Ferulic acid) presented in rivers/lakes displayed high linear correlation (R2) values (i.e., 0.998~1.0) of calibration curves within the wide detection ranges, and had relatively low limit of detection (LOD) and limit of quantitation (LOQ). From the results of this study, the developed pretreatment method and analytical method were confirmed to effectively extract and analyze phenolic acid mixtures eluted from barley straw in complex environment matrix such as rivers/lakes.
1. 서 론
유기산(organic acid)은 아미노산의 대사산물, 탄수화물, 지방산 등의 중간 대사산물로서 카르복실기를 포함하고 있으며, 일반적으로 향균 기능이 있어 낮은 pH영역에서 미생물 활성을 저하시키는 것으로 보고되고 있다[1~4]. 유기산 중 페놀산(phenolic acids)은 페놀화합물(phenolic compounds)의 화학구조에서 방향족 고리를 중심으로 수산기(-OH), 카르복실기(-CO2H) 및 메톡시기(-CH3O)가 서로 다르게 결합되어 정상세포 및 암세포에 각각 상이한 세포독성을 나타나는 것으로 보고된다[5]. 이러한 식물에서 유래된 페놀화합물과 중간 대사산물의 연구는 와인, 수삼, 쌀 및 다양한 식물을 가공한 식품 내 페놀산의 추출(extraction) 및 분석(analysis)에 관한 연구[6~9] 또는 페놀산의 암세포에 대한 세포독성 등에 관한 연구가 주로 이루어졌다[5]. 그러나 하천이나 호소에서 생분해되는 보릿짚(barley straw)과 같은 생물유래 물질의 지속적 분해로 발생한 페놀산과 대사산물의 추출 및 분석에 관한 연구는 거의 수행되지 않았다.
일부 연구에 따르면, 수중의 호기성 미생물에 의한 보릿짚의 생분해를 통해 발생하는 페놀화합물과 퀴논(quinones)이 자연광 에너지에 조사되면 페놀화합물 자기 산화(auto oxidation)과정에서 생성된 과산화수소(H2O2)에 의해 남조류(blue-green algae)의 과도한 조류성장(algal growth)을 억제할 수 있다고 보고하고 있다[10~14]. 비록, 국외에서는 1970년대 말부터 보릿짚의 담수생태계 투입을 통해 남조류의 성장 억제를 경험적으로 시행해왔으며[15,16], 6개월 동안 조류성장 억제 및 선택적 조류제어가 가능하고 수생태계에 미치는 영향이 미미하다고 보고하고 있지만[17,18] 하천 및 호소 내 다양한 유기/무기물질과 함께 존재하는 보릿짚 유래 페놀산의 전처리 및 정량분석법에 관한 연구는 전무한 실정이다. 일부 연구[12,19]에서 Gas Chromatography (GC)-Mass Spectrometry (MS)를 이용해 보릿짚 추출물 내 페놀산 중 Vanillic acid, Syringic acid, p-Coumaric acid, Gallic acid, Ferulic acid, Caffeic acid, Sinapic acid 등 총 7종의 페놀화합물을 하천수에서 검출하였으나, 이 방법은 표준물질을 사용해 유도체화 시약(BSTFA+TMCS, 99:1, Supelco)으로 반응시킨 후 분석을 실시해 페놀화합물의 분석 회수율이 낮으며, 재현성이 우수하지 않고 전처리에 장시간이 소요된다는 단점이 있다.
따라서 본 연구에서는 하천과 호소 내 다양한 유기/무기물질과 함께 존재하는 보릿짚 유래 페놀산의 추출을 위한 전처리법(pretreatment)을 개발하고, 전처리법에 따라 Ultra High Performance Liquid Chromatography (UHPLC)-MS를 활용해 추출한 페놀산의 정량/정성분석을 실시하여 우수한 분석 회수율(analytical recovery), 정확도(accuracy), 정밀도(precision)를 나타내는 UHPLC-MS 기반 페놀산 분석법을 정립하는 것을 주요 목표로 한다. 개발된 UHPLC-MS 분석법을 통해 보릿짚 유래 페놀산의 용출 농도, 지속 시간 및 페놀산의 분해 중간대사산물 확인 등을 통해 보릿짚을 활용한 남조류의 선택적 성장억제 기작을 도출하고 수체 내 남조류의 과다성장을 억제하기 위해 보릿짚 주입량과 주입시기 등의 결정에 중요한 정보를 제공할 것으로 판단된다.
2. 연구재료 및 방법
2.1. 시약 및 재료(Reagents and Materials)
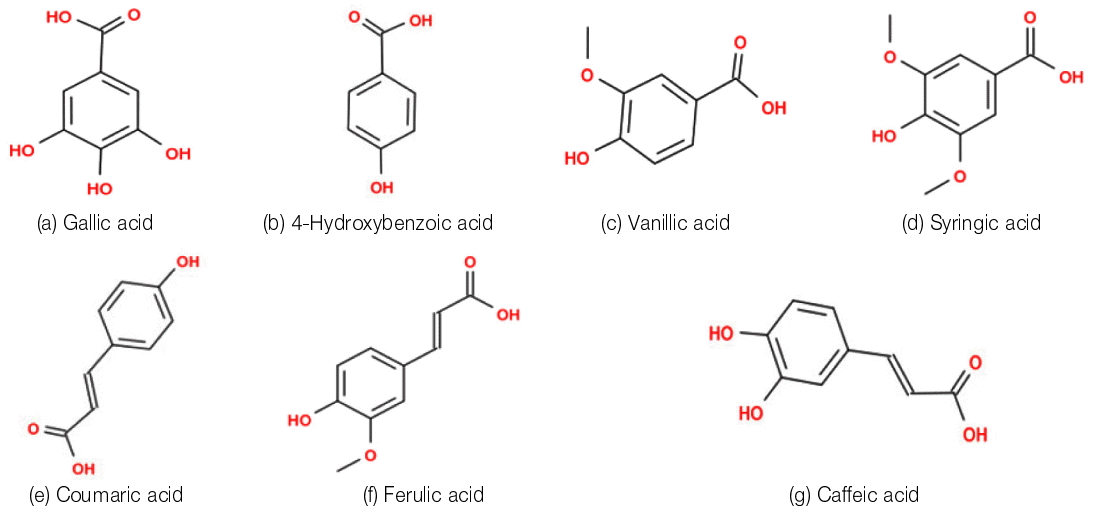
HCl과 Acetonitrile은 Samchun (Korea)의 실험 연구용을, Acetic acid는 Ducksan (Korea)의 실험 연구용을, Methanol, Ethyl acetate는 Ducksan (Korea)의 HPLC용을 사용하였다. 각 페놀산(Gallic acid, 4-Hydroxybenzoic acid, Vanillic acid, Caffeic acid, Syringic acid, Coumaric acid, Ferulic acid)의 화학구조식은 Fig. 1에 제시되었으며 Sigma (USA)의 ReagentPlus®을 사용하였다. 구매된 각 페놀산을 단독(single) 또는 혼합(mixture)하여 methanol 혹은 증류수에 정량을 주입하여 실험에 타당한 표준용액(standard solution)을 조제하여 사용하였다.
고체상 추출 카트리지는 Phenomenex (USA)의 Strata-X (200 mg/6 mL), 시료의 추출을 위한 syringe filter는 Phenomenex (USA)의 Phenex-NY (15 mm)를 사용하였으며, 용출장치는 Visiprep (USA)의 Vaccum Manifold system을 사용하였다.
2.2. 분석법 및 기기분석(Analytical Methods & Instrument Analysis)
전처리법(pretreatment method) 확립을 위한 표준용액 시료분석에는 Photodiode array detector (SPD-M20A)가 부착된 SHIMADZU (Japan)의 LC-UV/Vis system을 사용하였다. 분리 분석컬럼은 Phenomenex (USA)의 Gemini 5 μm C18 110 Å (ID 4.6 mm, Length 250 mm)을 사용하였다. 이동상(mobile phase)은 HPLC용 acetonitrile (ACN)과 증류수에 1% acetic acid 용액을 membrane filter로 여과하여 Table 1과 같이 gradient elution하였다.

Operating conditions for liquid chromatography with UV/Vis detector to validate the efficiency of pretreatment method
하천수 시료 분석에는 Nexera X2 chromatography와 8050 Mass spectometry가 부착된 UHPLC-MS (SHIMADZU, Japan)를 사용하였으며, 분리 분석컬럼은 ACQUITY (USA)의 BEH C18 (ID 2.1 mm, Length 100 mm)을 사용하였다. 이동상은 증류수(0.1% Formic acid)와 Acetonitrile (0.1% Formic acid) 용액을 Table 2와 같이 gradient elution하였으며, MS Method는 positive mode와 negative mode 중에서 반응감도가 높은 방법을 사용하여 Table 3의 조건으로 분석하였다.

Operating conditions for ultra high performance liquid chromatography-mass spectrometry to analyze phenolic acids in various samples
2.3. 전처리법(Pretreatment Method)
표준용액, 하천 및 호소 시료는 분석 전에 전처리를 실시하여 시료 내 페놀산의 이온화 등을 방지하고 추출효율을 최적화하여 Fig. 2에 제시하였다. 채취된 시료는 0.1 N 염산(HCl)으로 pH 2가 되도록 조정한 후 예상 농도별 일정량을 취하여 0.45 μm GF/C filter (Whatman)를 이용해 여과하여 분석용 시료를 준비하였다. 페놀산을 선별하여 추출할 Strata-X 카트리지(Cartridge)는 미리 5 mL의 메탄올(methanol)로 세정 후 pH 2로 조정된 증류수 5 mL를 순차적으로 주입하여 활성화(activation)시켰다. 여과된 시료를 활성화된 카트리지에 1 mL/ min의 유속으로 주입해 시료 50 mL를 통과시킨 후 카트리지에 수착된 일부 sugar와 polar compounds를 제거하기 위해 pH 2로 조정된 증류수 10 mL를 카트리지에 1 mL/min의 유속으로 통과시켜 용해․제거하였다. 이어서 카트리지 내 수착된 페놀산을 최종적으로 추출하기 위해 methanol:1% acetic acid (9:1) 용액 10 mL를 1 mL/min의 유속으로 통과(elution)시켰다. 추출된 페놀산 용액은 회전증발농축기(vacuum evaporator)를 이용하여 수분 및 methanol을 휘발시킨 후, 1% acetic acid:ACN (9:1) 10 mL로 플라스크에 잔류된 페놀산을 용해시킨 후 conical 튜브로 이동시켰다. 마지막으로 페놀산 용해액을 Syringe를 이용해 채취 후 Syringe filter로 여과시킨 후 LC-UV/Vis, UHPLC-MS로 10 μL를 주입하여 최종 분석하였다.
2.4. 분석 회수율(Analytical Recovery), 직선성(Linearity), 검출한계(Limit of Detection) 및 정량한계(Limit of Quantification)
시료의 준비, 전처리를 통한 분석 대상물질의 추출, 정량 이전의 분석과정과 관련된 다양한 오차(errors)를 측정하기 위해 일정한 농도로 각 페놀산(Gallic acid, 4-Hydroxybenzoic acid, Vanillic acid, Caffeic acid, Syringic acid, Coumaric acid, Ferulic acid)을 증류수에 주입 및 전처리 후 측정된(measured) 농도와 전처리 전 인증(reference)농도의 분율로 분석 회수율(recovery)을 산정하였다. 현장에서 검출되는 페놀산 농도 범위의 0~150%가 포함된 표준용액을 전처리 후 표준용액 내 각 페놀산의 농도 vs. peak면적을 산출하여 검량선을 작성하였다. 작성된 검량선으로부터 각 페놀산 분석의 직선(linearity) 상관성(R2)과 적용범위(working range)를 도출하였다. 또한, 각 페놀산의 적절한 불확도(uncertainty)를 고려한 검출 가능한 페놀산 최소 농도를 추정하기 위해, 검량선의 기울기(S) 및 표준편차(σ)를 이용해 식 (1)과 (2)를 활용해 검출한계(limit of detection, LOD)와 정량한계(limit of quantification, LOQ)를 산출하였다.
2.5. 하천수 시료분석(Analysis of river samples)
본 연구에 사용된 현장시료는 하천수를 기반으로 하여 3가지 실험조건, 즉, (1) 하천수에 살조제(NaNO3) 300 mg/L를 투여하여 조류 및 미생물을 사멸한 보릿짚 시료, (2) 미처리 하천수, (3) 보릿짚을 적용한 하천수를 준비했으며, 하천수는 조류(algae) 영향을 최소화하기 위해 플랑크톤 네트를 투과 후 실험에 활용하였다. 건조된 보릿짚은 전처리 없이 길이 10 cm로 절단 후 정량하여 미세망에 주입하여 부유시켰으며, 보릿짚 투여량은 선행연구[12]를 근거로 40 L의 수체에 100 g의 보릿짚을 투여하여 보릿짚과 하천수의 비율을 1:400 (by weight)의 저농도 시료와 페놀산의 보릿짚과 하천수의 비율을 1:8.5 (by weight)로 적용된 고농도 시료를 조제하였다(Fig. 3).

Pictorival view of outdoor experiment to monitor the phenolic acids in river samples during 100 days.
보릿짚의 조류성장억제 효과는 호기성 미생물에 의한 보릿짚 유기물의 지속적인 분해에 기인하므로, Fig. 3에 제시된 (1) 조건과 (3) 조건을 비교해 수중미생물의 활동 유무에 따른 보릿짚 분해 기반 페놀산을 비교하였고, (2) 조건과 (3) 조건을 비교해 하천수 내의 페놀산과 하천수에 보릿짚을 적용한 시료 내의 페놀산의 농도변화를 비교하였다. 실험은 총 100일간 진행되었으며, 호기성 조건에서 보릿짚의 작용을 위해 폭기 장치를 지속적으로 적용하였으며, 채수주기는 2주 동안은 5일마다, 이후 10일마다 채수하여 알루미늄 호일로 암막상태로서 4℃ 냉장 보관하였다.
3. 결과 및 고찰(Results and Discussion)
3.1. 분석법의 선택성(Selectivity) 검증
시료 내 다른 물질이 공존 시 대상 페놀산을 분리하여 정량하는 방법의 페놀산 별 선택성을 검증하기 위해 순수 methanol에 표준 페놀산 시약을 단일(single) 주입하여 전처리과정 없이 LC-UV/Vis와 UHPLC-MS를 활용해 분석하고 크로마토그램 내 개별 peak를 확인 후 추가(additional) 주입하였다. LC-UV/Vis를 활용해 분석한 경우, Fig. 4에 제시되었듯이 보릿짚으로부터 용출되는 것으로 보고된[12] 페놀산 7종 화합물인 Gallic acid, 4-Hydroxybenzoic acid, Vanillic acid, Caffeic acid, Syringic acid, Coumaric acid, Ferulic acid 중 Vanillic acid와 Caffeic acid의 경우를 제외하고는 페놀산을 상호 간섭없이 명확하게 분리할 수 있음을 확인하였다. Vanillic acid와 Caffeic acid는 서로 유사한 분자구조와 분자량 등의 특성으로 인해 다양한 분석법에도 peak의 분리가 어려웠으며, 혼합된 페놀산 7종의 크로마토그램 내 peak순서를 통해 Gallic acid > 4-Hydroxybenzoic aicd > Vanillic acid, Caffeic acid > Syringic acid > Coumaric acid > Ferulic acid 순으로 검출됨을 알 수 있다.

LC-UV/Vis Chromatogram of phenolic acid mixtures in methanol solution (1. Gallic acid; 2. 4-Hydroxybenzoic acid; 3. Vanillic acid, Caffeic acid; 4 . Syringic acid; 5. Coumaric acid; and, 6. Ferulic acid).
반면에, Fig. 5에 제시된 UHPLC-MS를 활용해 분석한 경우, 페놀산 7종 화합물인 Gallic acid, 4-Hydroxybenzoic acid, Vanillic acid, Caffeic acid, Syringic acid, Coumaric acid, Ferulic acid 모두를 상호 간섭없이 명확하게 분리할 수 있음을 확인하였다. 따라서 본 연구에서 개발된 UHPLC-MS 기반 분석법은 다양한 페놀산이 혼합된 시료에서도 개별 페놀산의 상호 간섭없이 명확한 peak의 분리와 분화된 체류시간(retention time)을 통해 선택성이 우수한 것으로 검증되었으며, 수체 내 다른 물질과의 간섭과 교란없이 보릿짚 유래 페놀산을 분리할 수 있는 타당한 방법이라고 사료된다.
3.2. 전처리법의 분석 회수율(Recovery) 평가
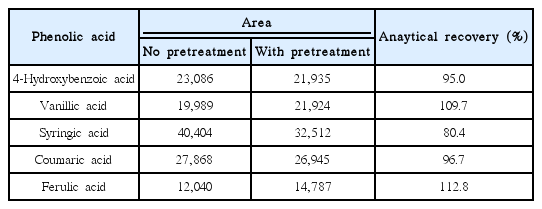
본 연구에서 도출된 전처리법과 관련된 분석 오차(analytical error)를 측정하기 위해 분석 회수율(analytical recovery)을 산정하였다. 분석 회수율은 7종의 페놀산을 메탄올에 각각 주입하여 1 mg/L의 표준용액을 제조 후 전처리의 유무에 따른 각 페놀산의 분석 회수율을 평가하였다. 분석결과 Gallic acid와 Caffeic acid는 전처리 후 검출되지 않거나 매우 미량이 검출되어 회수율 평가가 불가하였으며, 이는 Gallic acid와 Caffeic acid가 전처리 과정 중 Strata-X 카트리지 공정에 수착(sorption) 후 일부 sugar와 polar compounds 제거 과정에서 함께 용해 및 제거되었거나, Cartridge내에 수착된 페놀산을 최종적으로 추출하는 과정에서 일부 추출되지 않은 것으로 판단된다. 현재 이를 개선하기 위해 개발된 전처리법을 개선하고 있는 시행착오를 진행 중에 있다.
Gallic acid와 Caffeic acid를 제외한 5종의 페놀산의 분석 회수율은 Table 4에 제시되어있다. 분석 회수율은 대상 페놀산에 따라 일부 상이했으나, 80.4~112.8%의 분석 회수율을 나타내었다. 이러한 결과를 통해 Gallic acid와 Caffeic acid를 제외한 대부분의 페놀산 분석에 있어 개발된 전처리법이 비교적 높은 신뢰성(reliability)과 적합성(relevance)을 가지고 있음을 알 수 있으며, 개발된 전처리법을 활용해 다양한 매트릭스 내 기타 물질을 배제하고 대상 페놀산을 선택적으로 추출해 분석효율을 증대시킬 수 있을 것으로 판단된다.
3.3. 직선성(Linearity), 검출한계(Limit of Detection) 및 정량한계(Limit of Quantification) 산정
본 연구에서 확립된 UHPLC-MS 분석법과 전처리법 관련된 분석오차를 측정하기 위해 신뢰도를 검증을 하였다. 실제 하천수 시료분석 결과 Gallic acid, Caffeic acid, Coumaric acid가 검출한계(LOD) 미만으로 분석되었으며, 따라서 이를 제외한 4종의 페놀산(4-Hydroxybenzoic acid, Vanillic acid, Syringic acid, Ferulic acid)의 농도 산출을 위해 0.05, 0.1, 0.2, 0.5, 1, 2 μg/mL 농도의 표준용액 검량선을 작성한 결과, 각 페놀산 검량선의 직선상관성(R2)값은 0.998~1.0으로 검출범위 내에서 매우 높은 직선성을 나타내 페놀산 검량선이 타당함을 확인할 수 있다(Fig. 6).
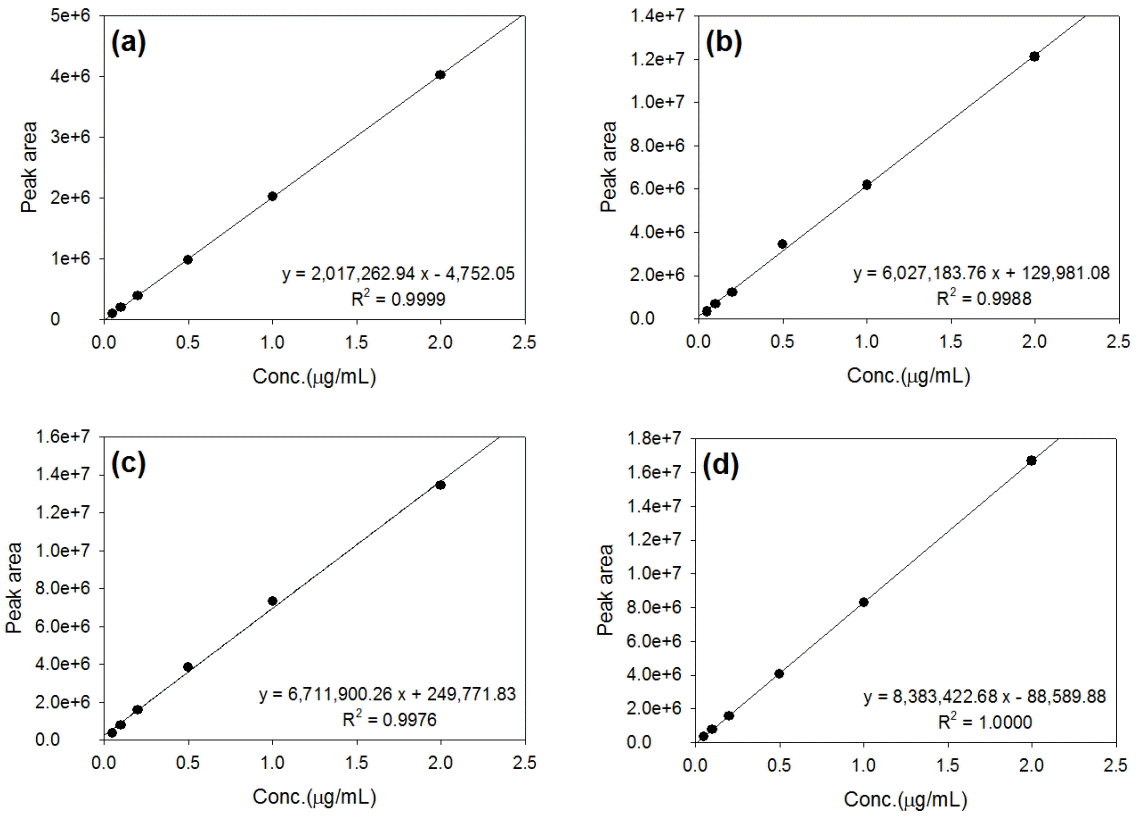
Linearity of the standard calibration curves for phenolic acid mixtures using UHPLC-MS (a. 4-Hydroxybenzoic acid; b. Vanillic acid; c. Syringic acid; and, d. Ferulic acid)
본 연구에서 확립한 전처리법과 UHPLC-MS 분석법의 검출한계와 정량한계를 산정하여 Table 5에 제시하였다. 4-Hydroxybenzoic acid, Vanillic acid와 Ferulic acid가 비교적 유사한 검출한계와 정량한계를 나타냈으나, Syringic acid는 비교적 높은 검출한계와 정량한계를 나타냈다. 이는 HPLC-MS를 활용해 다양한 식물에서 유래된 페놀화합물의 분석을 실시한 기존 연구[20~22] 결과와 유사하며, 본 연구에서 확립한 전처리법과 UHPLC-MS 분석법이 타당함을 알 수 있다.
3.4. 하천수 내 페놀산 농도변화 결과
하천수 수표면에 보릿짚 미세망이 간헐적으로 부유된 보릿짚:하천수 비율이 1:400 (by weight)의 저농도 시료를 전처리 후 UHPLC-MS로 분석한 결과, (1), (2), (3)의 모든 실험조건에서 페놀산의 peak가 불분명 혹은 미검출되어 실험조건 별 비교가 불가하여 보릿짚과 미생물의 유무에 관계없이 하천수중 페놀산의 농도가 검출한계(LOD) 미만의 극미량일 것으로 판단되었다. 반면에, 하천수 수표면에 보릿짚 미세망이 촘촘히 부유된 보릿짚:하천수 비율이 1:8.5 (by weight)로 적용된 고농도 시료의 경우에는 (3)의 실험조건에서 5일차에는 4-Hydroxybenzoic acid, Vanillic aicd, Syringic acid 및 Ferulic acid가 포함된 4가지의 페놀산이 검출한계와 유사하거나 보다 높은 농도로 분석되었으나, 10일차에는 4종의 페놀산 중 4-Hydroxybenzoic acid를 제외한 3종의 페놀산이 검출한계 보다 높은 농도로 분석되었으며, 15일차에는 유의할만한 피크가 도출되지 않았다(Table 6 및 Fig. 7). 또한, 5일차 시료 대비 10일차 시료에서 검출된 페놀산의 농도 변화를 비교한 결과, 급격히 감소하는 것으로 조사되었다. 이러한 결과를 통해 본 연구결과에서는 보릿짚으로부터 페놀산이 추출되어 검출한계 이상의 유의한 값이 유지되는 기간은 대체적으로 10일 이내이며, 10일 이후에는 광학적, 화학적 및 생물학적 페놀산 분해로 인해 하천수 시료 내에서 페놀산 성분이 검출한계 미만으로 존재하는 것으로 사료된다. 이러한 결과는 기존 연구에서 6개월 동안 조류성장 억제 및 선택적 조류제어가 가능하다는 보고[17,18] 대비 매우 짧은 기간으로, 하천수 시료 실험 중 호기성 조건을 위해 지속적인 폭기를 통해 보릿짚의 분해속도가 지연되지 않아 발생한 차이로 판단된다.

Concentration changes of phenolic acid mixtures in high ratio of barley straw to river water samples with time

UHPLC-MS Chromatogram of phenolic acid mixtures in river samples (a) elapsed time of 5 day s, and (b) elapsed time of 10 day s (2. 4-Hy droxy benzoic acid; 3. Vanillic acid; 5. Sy ringic acid; 7. Ferulic acid).
본 연구에서 개발된 UHPLC-MS 분석법과 전처리법을 통해 현장 하천수 내 보릿짚 유래 페놀산의 용출 농도는 검출 한계와 유사한 극미량(0.095~0.273 μg/mL)이며, 유의할만한 농도의 페놀산 용출 지속 시간도 10일 이내인 것으로 조사되었다. 따라서 남조류의 과다성장을 억제하기 위해 정체된 하천과 호수에 보릿짚을 적용 시, 주입 후 약 10일~14일 이후에는 회수하는 것이 보릿짚의 지속 분해에 따른 용존산소 고갈 및 악취 방지 등의 2차적 오염을 예방할 수 있을 것으로 판단된다. 하지만, 보릿짚의 분해에 따른 페놀산의 용출농도와 지속기간은 하천 및 호소의 수질현황, 보릿짚 투여방법 및 투여량, 광량, 수온, 수중 미생물 군집 및 우점종 등에 따라 차이가 발생할 수 있으므로, 보릿짚이 적용된 현장 시료 내 페놀산의 농도를 분석하여 보릿짚 주입량과 주입시기 등을 결정하는 것이 타당하다. 본 연구를 통해 개발한 전처리법과 UHPLC-MS 분석법을 통해 보릿짚과 같은 생물유래 물질의 지속적 분해로 발생한 페놀산과 대사산물의 추출 및 분석을 하천수 및 호소수와 같은 복잡한 매트릭스에서도 효과적으로 적용할 수 있음을 증명하였다.
4. 결 론
하천과 호소 내 다양한 유기/무기물질과 함께 존재하는 보릿짚 유래 페놀산의 추출을 위한 전처리법(pretreatment)을 개발하고, 전처리법에 따라 Ultra High Performance Liquid Chromatography (UHPLC)-MS를 활용해 하천수 내에서 보릿짚의 분해에 따라 장기적으로 용출되는 페놀산의 정량/정성분석을 실시하여 우수한 분석 회수율(analytical recovery), 정확도(accuracy), 정밀도(precision)를 나타내는 UHPLC-MS 기반 페놀산 분석법을 개발하였다. 본 연구에서 도출한 주요한 연구결과는 다음과 같다.
1) UHPLC-MS를 활용해 분석한 경우, 페놀산 7종 화합물인 Gallic acid, 4-Hydroxybenzoic acid, Vanillic acid, Caffeic acid, Syringic acid, Coumaric acid, Ferulic acid 모두를 상호 간섭없이 명확하게 분리할 수 있음을 확인하였으며, 본 연구에서 개발된 전처리법과 UHPLC-MS 분석법이 다양한 페놀산이 혼합된 시료에서도 개별 페놀산의 상호 간섭없이 명확한 peak의 분리와 분화된 체류시간(retention time)을 통해 선택성이 우수한 분석법인 것으로 판단된다.
2) Gallic acid와 Caffeic acid를 제외한 페놀산 5종 화합물의 분석 회수율은 대상 페놀산에 따라 일부 상이했으나, 80.4~112.8%의 분석 회수율을 나타내었으며, 개발된 전처리법이 비교적 높은 신뢰성(reliability)과 적합성(relevance)을 가지고 있어 다양한 매트릭스 내 기타 물질을 배제하고 대상 페놀산을 선택적으로 추출해 분석효율을 증대시킬 수 있을 것으로 판단된다.
3) 4종의 페놀산(4-Hydroxybenzoic acid, Vanillic acid, Syringic acid, Ferulic acid) 검량선의 직선상관성(R2)값은 0.998~1.0으로 검출범위 내에서 매우 높은 직선성을 나타내 페놀산 검량선이 타당함을 확인하였으며, 4-Hydroxybenzoic acid, Vanillic acid와 Ferulic acid가 비교적 낮은 검출한계(LOD)와 정량한계(LOQ)를 나타냈으나, Syringic acid는 비교적 높은 검출한계와 정량한계를 나타냈다.
4) 보릿짚과 하천수의 비율을 1:8.5 (by weight)로 적용된 고농도 보릿짚 시료를 분석한 결과, 보릿짚으로부터 페놀산이 추출되어 검출한계 이상의 유의한 값이 유지되는 기간은 대체적으로 10일 이내이며, 10일 이후에는 광학적, 화학적 및 생물학적 페놀산 분해로 인해 하천수 시료 내에서 페놀산 성분이 검출한계 미만으로 존재하는 것으로 사료된다.
5) 본 연구에서 개발된 전처리법과 UHPLC-MS 분석법과 전처리법을 통해 현장 하천수 내 보릿짚 유래 페놀산의 용출 농도는 검출한계와 유사한 극미량(0.095~0.273 μg/mL)이며, 유의할 만한 농도의 페놀산 용출 지속 시간도 10일 이내인 것으로 조사되었으나, 남조류의 과다성장을 억제하기 위해 정체된 하천과 호수에 보릿짚을 적용 시, 현장 시료 내 페놀산의 농도를 분석하여 보릿짚 주입량과 주입시기 등을 결정하는 것이 타당하다. 최종적으로 개발된 전처리법과 UHPLC-MS 분석법을 통해 보릿짚과 같은 생물유래 물질의 지속적 분해로 발생한 페놀산과 대사산물의 추출 및 분석을 하천수 및 호소수와 같은 복잡한 매트릭스에서도 효과적으로 적용할 수 있음을 알 수 있다.
Acknowledgements
본 연구는 국토교통부 물관리연구개발사업의 하천구조체를 활용한 하천 내 녹조관리기술 개발(18AWMP-B098632-04 & 18AWMP-B098640-04) 과제에 의해 수행되었습니다.