CO2 포집용 아민 흡수제에서 탄산무수화 효소가 CO2 흡수에 미치는 영향
Effect of Carbonic Anhydrase on CO2 Absorption in Amine Solutions for CO2 Capture
Article information
Abstract
연소후 아민 CO2 포집공정에서 탄산수화 효소의 첨가에 따른 다양한 아민 흡수제의 CO2 흡수에 미치는 영향과 반응열을 평가하였다. 30 wt%의 MEA, AMP, DMEA, MDEA 수용액에 소의 적혈구에서 추출한 탄산무수화 효소 250 mg/L 첨가한 후 흡수속도를 분석한 결과, 모든 흡수제에서 CO2 흡수속도가 증가하였다. 특히, 1차아민인 MEA와 입체장애아민인 AMP 보다는 3차아민인 DMEA와 MDEA에서 속도증진 효과가 컸다. 반응열량계를 이용하여 탄산무수화 효소 첨가후 흡수제 (MEA, DMEA, MDEA)와 CO2 사이의 화학 반응 시 발생하는 반응열을 측정한 결과 효소 촉매의 첨가로 모든 흡수제의 반응 열량이 낮아짐을 확인할 수 있었다. 특히, 연소후 아민 흡수제를 이용하는 이산화탄소 포집공정에 탈기 성능이 우수한 3차 아민 계열의 흡수제가 탄산무수화 효소 촉매 적용에 유리한 흡수제이며 이중 MDEA에서 효과가 가장 큼을 알 수 있었다.
Trans Abstract
The effect of carbonic anhydrase on CO2 absorption rates and the heat of reaction were evaluated in various amine solutions for post combustion CO2 capture process. The CO2 absorption rate was analyzed in 30 wt% MEA, AMP, DMEA, MDEA aqueous solutions with and without carbonic anhydrase (250 mg/L) from bovine erythrocyte. CO2 absorption rates were increased in all solutions with carbonic anhydrase. The effect of carbonic anhydrase on absorption rates was more in tertiary amine (DMEA and MDEA) solutions than in primary amine (MEA) and hindered amine (AMP) solutions. The heat of reaction of MEA, DMEA, MDEA aqueous solutions with and without carbonic anhydrase were measured using reaction calorimeter. Carbonic anhydrase decreased the heat of absorption in all solutions. The results suggested that tertiary amines that have the excellent desorption ability were suitable for applying carbonic anhydrase to the post combustion CO2 capture process and the effect of carbonic anhydrase was best in MDEA solution.
서 론
탄소 포집 및 저장(Carbon Capture and Storage, CCS) 기술은 화석연료의 연소시 발생하는 온실가스인 이산화탄소를 포집하여 안전하게 저장하는 기술이다. IEA 보고에 따르면 2060년 CO2 감축량 중 16%가 CCS 기술에 의해 감축되고 CCS 기술을 적용하지 않을 경우 CO2 저감비용이 40%이상 증가할 것으로 예상하고 있다[1,2].
CCS 기술에서 포집기술은 연소전 포집, 연소후 포집 기술 및 순산소 연소기술로 구분되며 배가스중 이산화탄소를 포집하는 기술은 연소후 포집기술이다. 연소후 포집기술 중아민 수용액을 이용한 기술은 포집효율이 높고 공정이 안정되어 대규모 실증화가 가장 먼저 진행되고 있다. 이 공정에서는 1차 아민인 monoethanolamine (MEA)와, 2차 아민인 diethanolamine (DEA), 3차 아민인 N-methyldiethanolamine(MDEA), 입체장애 아민인 AMP (2-amino-2-methyl-1-propanol)등 다양한 아민 수용액이 용매로 사용되고 있다[3].
최근 탄산무수화 효소(Carbonic Anhydrase, CA)의 수용액중 CO2 흡수속도 증진 효과가 확인되면서 연소후 습식 아민 공정에 CA 효소를 흡수 반응촉진제(촉매)로 활용하려는 혁신 연구가 출현되고 있다[4,5].
탄산무수화 효소를 촉매로 이용한 습식 CO2 포집 기술은 흡수속도가 낮지만 탈기능력이 우수한 흡수제에 CA 효소촉매를 적용하여 흡수능력과 탈기능력을 동시에 높여 흡수제와 이산화탄소의 분리에 소비되는 에너지를 혁신적으로 줄이기 위한 기술이다. 이에 따라 포집설비의 운영비를 줄일 수 있다[6].
본 연구에서는 연소후 아민 CO2 포집공정에서 탄산무수화 효소촉매의 흡수 속도 증진효과를 알아보고 적용 가능흡수제의 선정을 위한 기초자료를 확보하고자 흡수제의 종류에 따른 탄산무수화 효소의 CO2 흡수속도에 미치는 영향과 반응열을 평가하였다. 흡수성능평가를 위하여 적용된 흡수제는 1차 아민인 MEA와 입체장애아민인 AMP 그리고 3차 아민인 DMEA와 MDEA이다.
2. 이론적 고찰
2.1. 아민 흡수제 종류에 따른 흡수반응
1, 2차 아민과 3차 아민은 CO2와 반응에 있어 서로 다른 반응 메카니즘을 가지고 있다[3]. 1, 2차 아민은 이산화탄소와 반응하여 카바민산염 이온(RNHCOO-)을 형성하여 이산화탄소를 흡수하는 반면 3차 아민은 질소에 붙어있는 수소가 부족하여 카바민산을 생성하지 않으며 용액중 물과 반응하여 중탄산염 이온(HCO3-)을 형성한다.
MEA와 같은 1차 아민은 3차 아민보다 CO2와 빠르게 반응한다. 빠른 반응의 결과로 3차 아민을 사용할 때보다 흡수탑의 크기를 더 작게 할 수 있다. 반면 MDEA와 같은 3차 아민의 장점은 CO2 탈기시 필요한 재생에너지가 1차 아민보다 상당히 적다는 것이다. 3차 아민의 낮은 재생에너지 결과로 탈기를 위한 에너지 비용이 낮게 된다. 이상적인 CO2 포집 흡수제는 1차 아민과 같은 빠른 흡수와 3차 아민과 같은 낮은 재생에너지의 특성을 가지고 있는 흡수제이다[7].
2.2. 탄산무수화 효소 첨가에 따른 반응 메카니즘
탄산무수화 효소는 수용액상에서 CO2를 HCO3-로 전환하는 가역반응을 증진하는 매우 효과적인 촉매라는 것이 적혈구에서 처음 밝혀졌다. 탄산무수화 효소는 자연계에서 동식물, 세균, 효모 등에 널리 존재하며, α, β, γ, δ, ε형 등 다양한 형태로 존재한다. 식물에는 β형 탄산무수화 효소가 존재하는데 이것은 다른 탄산무수화 효소들과 진화적으로 서로 다르지만 구조와 기능면에서는 비슷하다. 이 효소의 기능은 식물의 탄소고정과정에서 엽록체 내 이산화탄소 농도를 높이는 기능을 하는 것으로 알려져 있다[8].
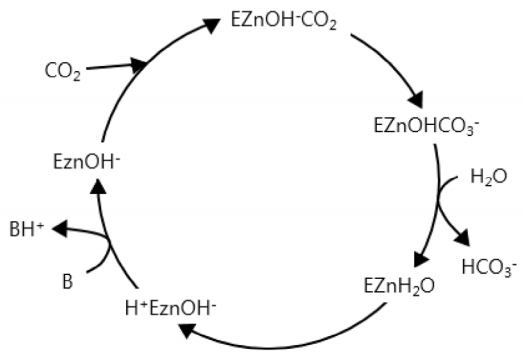
가장 널리 연구되는 효소는 동물에 존재하는 α형 탄산무수화 효소이며 가장 큰 촉매 전환율을 갖는다[9]. 이 효소의 주요한 생물학적 기능은 혈액과 조직에서 산-염기의 평형을 유지하고, 조직으로 이산화탄소 운반을 용이하게 하기 위해 이산화탄소와 중탄산 이온이 서로 교환되도록 해주는 것으로 알려져 있다. 본 실험에서는 소의 적혈구에서 축출한 α형 탄산무수화 효소를 사용하였다. 이 효소는 호흡과 피의 산염기 균형에 중요한 역할을 한다. CO2의 수화 촉매반응에 있어 탄산무수화 효소에 대한 메카니즘이 다음과 같이 제안되었다[10].
낮은 버퍼(B) 농도에서는 분자내 proton 이동, 탄산무수화효소 재생반응의 두 번째 단계가 율속단계이다. 반면 높은 버퍼 농도에서는 분자간 proton 이동 탄산무수화 효소 재생반응의 첫단계가 율속단계이다. 물은 매우 약한 염기이므로 약한 proton acceptor이고 OH-는 풍부하지 않기 때문에 이때 효소의 기능이 최고가 되고 버퍼 용액은 일반적으로 속도실험에서 proton acceptor로 사용되며 본 실험에서 희석버퍼 용액은 알칸올아민 용액이 된다. 이상의 CO2 hydration의 촉매 반응 메카니즘은 Fig. 1에 묘사하였다[10].
2. 연구방법
본 연구에서는 흡수제의 종류(MEA, AMP, DMEA, MDEA)에 따른 탄산무수화 효소 첨가 전후의 이산화탄소 흡수성능과 이산화탄소와의 화학반응시 발생하는 반응열을 측정하였다.
실험에 사용된 아민(MEA, AMP, DMEA, MDEA)은 Sigma-Aldrich사 제품을 사용하였으며 아민 30 wt%와 증류수 70wt% 비율로 혼합하여 준비하였다. 실험에 사용된 흡수제의 농도는 Table 1과 같다. 탄산무수화 효소는 소의 적혈구에서 추출한 효소로 미국 Worthington Biochemical사로부터 구입하였다. 효소의 투입량은 250 mg/L로 하였다.
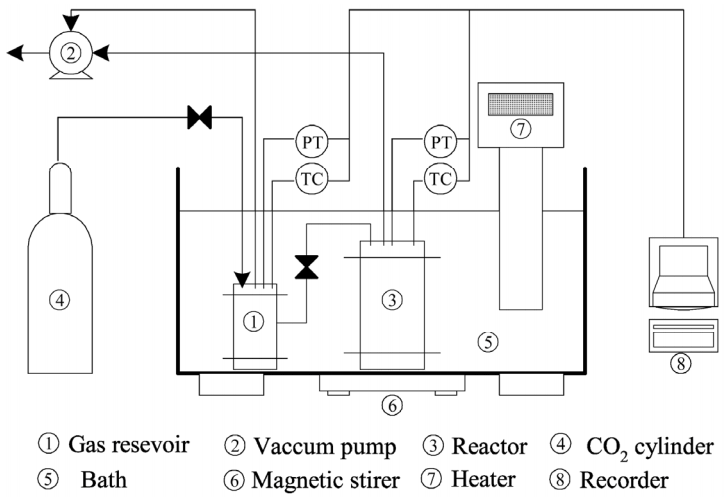
흡수제의 흡수 성능을 평가하기 위해 기액 평형반응기를 응용한 Fig. 2의 흡수 장치를 사용하였다. 먼저 가스저장조(250 mL)는 진공펌프를 가동하여 진공상태를 유지한다. 인코넬 재질의 온도조절 교반 흡수반응기(200 mL)에 흡수제(100 mL)와 효소촉매를 250 mg/L 첨가하여 넣고 진공펌프를 가동하여 진공상태를 유지한다. 가스실린더에서 주입되는 고순도(99.999%)의 이산화탄소를 밸브를 조절하여 약 1.5 bar (150 kpa)의 압력으로 가스저장조로 주입한다. 가스저장조에 주입된 이산화탄소를 순환조를 가동하여 25℃의 일정한 온도로 유지시킨다. 일정한 온도 및 압력이 유지된 이산화탄소를 밸브를 조절하여 반응기로 이송한다. 반응기 내부의 온도와 압력이 보정된 이산화탄소와 흡수제의 표면반응을 원활하게 하기 위하여 마그네틱 교반기를 이용하여 약 100RPM의 속도로 교반한다. 측정시간은 반응기의 압력변화가 거의 발생하진 않는 약 160분까지 측정하였다. 이산화탄소와 흡수제의 반응에 의한 반응기내의 압력 강하에 의한 흡수성능을 분석하였다.
탄산무수화 효소 촉매의 주입에 따른 흡수제의 반응열량을 측정하기 위하여 영국의 HEL사에서 제작한 SIMULAR 반응열량계를 사용하였다. 이 반응열량계는 heat flow 방식과 power compensation 방식을 모두 측정 가능하다. 본 실험에서는 반응기의 온도(40℃)를 일정하게 유지한 상태에서 power compensation 방식을 통해 흡수제와 이산화탄소의 반응열을 측정하였다[11].
3. 결과 및 고찰
3.1. CO2 흡수성능 실험
3.1.1. MEA (Monoethanol amine)
1차 아민인 30 wt%의 MEA 수용액에 250 mg/L의 탄산무수화 효소(CA)를 첨가한 후 주입 전후의 반응기내의 압력변화(흡수속도)를 분석하였다. Fig. 3과 같이 효소촉매 주입 후 흡수속도가 다소 증가하였으나 흡수속도의 차가 크지 않았다. 이것은 MEA의 1차 아민의 특성인 빠른 흡수성능으로 인하여 탄산무수화 효소의 주입에 따른 흡수속도 촉진 효과가 크게 나타나지 않았기 때문이다.
Fig. 3과 같이 1차 아민인 MEA 흡수제는 빠른 흡수속도를 가지고 있어 엔지니어링 관점에서 흡수탑의 크기를 더작게 할 수 있는 장점이 있는 반면 CO2와의 결합력이 높아 CO2 흡수 후 분리를 위한 탈기에너지가 많이 소모된다. 또한 탄산무수화 효소의 주입에 따라 흡수속도 증진 효과가 크지 않아 탄산무수화 효소를 적용하기 위한 흡수제로 효과적이지 않을 것으로 사료된다.
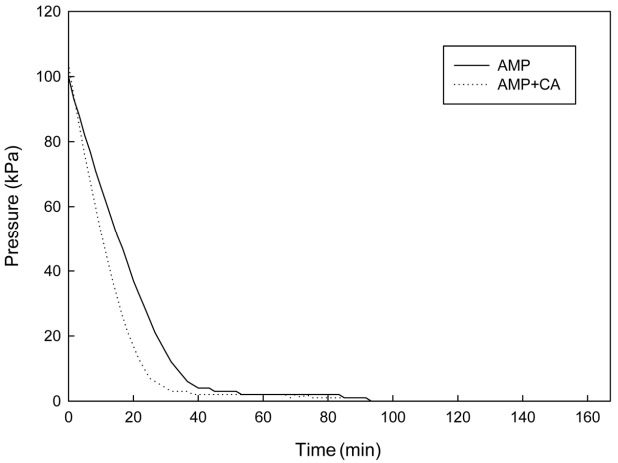
3.1.2. AMP (2-Amino-2-methyl-1-propanol)
AMP는 입체장애아민의 대표적인 CO2 흡수제로 흡수용량과 속도론적으로 큰 장점을 가진 것으로 알려져 있다. 특히 입체장애아민은 입체장애 효과에 따라 아미노 그룹과 이산화탄소와의 결합력이 낮아 기존의 아민 흡수제에 비해 이산화탄소의 탈기특성, 에너지 소비량 및 흡수제 손실률 등에서 우수한 특성을 가지고 있다[12].
본 실험에서는 입체장애 아민인 30 wt%의 AMP 수용액에 250 mg/L의 탄산무수화 효소 촉매(CA)를 첨가한 후 주입 전후의 반응기내의 압력변화(흡수속도)를 분석하였다. Fig. 4에서와 같이 MEA 수용액보다는 다소 증가했지만 주입 전후의 흡수속도가 크게 나타나지 않았다.
3.1.3. DMEA (Dimethylentahnolamine)
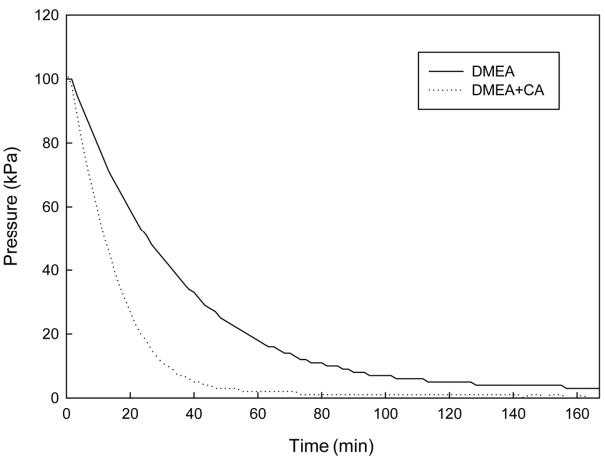
30 wt%의 DMEA 수용액에 250 mg/L의 탄산무수화 효소(CA)를 첨가한 후 주입 전후의 반응기내의 압력변화(흡수속도)를 분석하였다. 탄산무수화 효소 주입전후의 압력변화의 차가 앞의 1차 아민(MEA)과 입체장애아민(AMP)보다 크게 증가한 것을 알 수 있다(Fig. 5). 이것은 3차 아민의 일반적인 특성인 낮은 이산화탄소 흡수속도를 CA 효소가 증가시킨 것을 알 수 있다. 따라서 DMEA의 낮은 이산화탄소 반응속도를 탄산무수화 효소를 첨가하여 높일 수 있다면 우수한 탈기능력 등 흡수제로서의 장점을 가지고 있는 DMEA의 이산화탄소 포집흡수제로서의 가능성을 보여주고 있다.
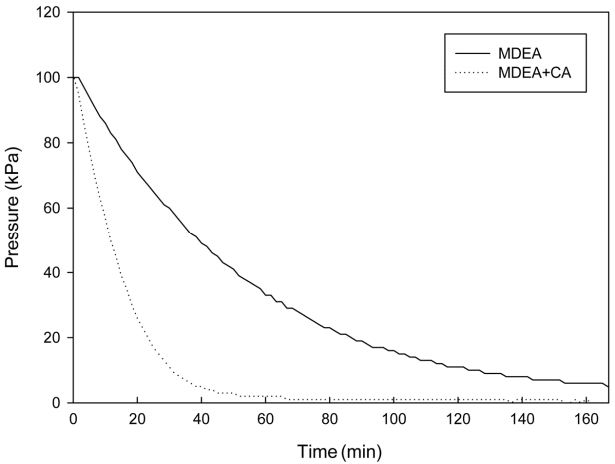
3.1.4. MDEA (Methyldiethanolamine)
3차 아민인 30 wt%의 MDEA 수용액에 250 mg/L의 탄산무수화 효소 촉매(CA)를 첨가한 후 주입 전후의 반응기내의 압력변화(흡수속도)를 분석하였다. Fig. 6에서와 같이 CA 주입전후의 압력변화의 차가 앞의 MEA, AMP 흡수제 뿐만이 아니라 3차아민인 DMEA 보다도 크게 증가한 것을 알 수 있다. 탄산무수화 효소 촉매의 첨가에 의한 이산화탄소 흡수 효과 증가는 MDEA에서 가장 크게 나타났다.
따라서 탄산무수화 효소 촉매를 이산화탄소 포집 및 흡수공정에 적용할 경우 3차 아민 계열의 흡수제가 적용 가능 흡수제이며 이중 MDEA 흡수제가 효과가 가장 클 것으로 예상된다.
특히, MDEA는 증기압이 낮아 증발에 의한 용매의 손실이 거의 없을 뿐 아니라 열적, 화학적 변성이 강하고 부식성이 없으며, 부반응 생성물이 없어 리클레이머(reclaimer) 또한 필요하지 않다. 이산화탄소와 직접 반응하지 않기 때문에 단순히 압력을 감소시키는 방법에 의해서도 탈기가 가능하고, 가열에 의한 탈기시에도 에너지 요구량이 MEA에 비하여 대단히 작다.
다양한 흡수제(MEA, AMP, DMEA, MDEA)에 상용 탄산무수화 효소 촉매 250 mg/L를 투입 후 시간에 따른 이산화탄소 흡수특성을 평가하였다. Table 2에 각각의 흡수제에서 30분 경과할 때의 탄산무수화 효소 촉매 주입하지 않은 경우와 주입한 경우의 압력차를 비교하여 증가효과를 비교하였다. 흡수능이 높은 1차 아민 MEA보다 흡수능이 낮은 3차 아민 MDEA, DMEA에서 효과가 컸다. 따라서 탈기능력이 우수한 3차 아민 계열의 흡수제가 효소 촉매 적용 가능흡수제이며 이중 MDEA 흡수제가 효과가 가장 컸다.
3.2. 반응열량분석 실험
흡수제를 이용한 이산화탄소 포집 공정에서 가장 많은 에너지가 소비되는 부분이 흡수제의 재생에너지 부분이며 재생에너지는 반응열, 현열, 잠열로 구성된다. 이중 반응열이 50% 이상을 차지하므로 재생에너지를 결정하는 중요한 물성데이터로 흡수제와 이산화탄소와의 반응열을 들 수 있다[13]. 반응열이 높다는 것은 흡수제와 이산화탄소의 결합에너지가 높고 흡수제와 이산화탄소를 분리하는 흡수제 재생 반응에 많은 에너지가 소비될 수 있다는 것을 의미한다[14,15].
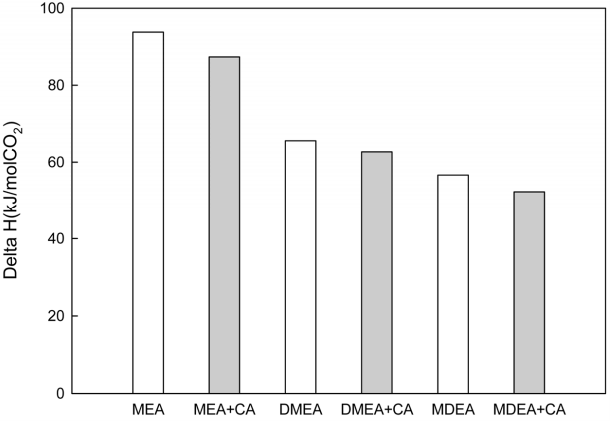
본 실험에서는 이와 관련하여 반응열량계를 이용하여 흡수제의 종류(MEA, MDEA, DMEA)에 따른 탄산무수화 효소 첨가 전후의 이산화탄소와의 화학반응 시 발생되는 반응열을 측정하였다. 분석 결과 Fig. 7에서 알 수 있듯이 MEA > DMEA > MDEA의 순으로 반응열량이 낮았으며 효소 촉매의 첨가로 모든 흡수제의 반응열량이 낮아짐을 확인할 수 있었다. 효소에 의한 반응열 감소는 탄산무수화 효소가 흡수액상에서 CO2를 HCO3-로 전환하는 가역반응을 증진하는 효과에 기인한다[10]. 이로부터 탄산무수화 효소촉매를 CO2 포집공정에 적용시 재생에너지가 낮아질 수 있음을 확인할 수 있었다.
4. 결 론
탄산무수화 효소촉매의 연소후 아민 CO2 포집공정에서 흡수 속도 증진효과를 알아보고 적용 가능 흡수제의 선정을 위한 기초자료를 확보하고자 흡수제의 종류에 따른 탄산무수화 효소의 CO2 흡수에 미치는 영향과 반응열을 평가한 결론은 다음과 같다.
1) 30 wt%의 MEA, AMP, DMEA, MDEA 수용액에 소의 적혈구에서 추출한 탄산무수화 효소 촉매(CA)를 250 mg/L의 첨가한 후 주입 전후의 반응기내의 흡수속도를 분석한 결과, 모든 흡수제에서 탄산무수화 효소촉매를 첨가시 CO2 흡수속도가 증가함을 알 수 있었다. 특히, 1차아민인 MEA와 입체장애아민인 AMP 보다는 3차아민인 DMEA와 MDEA에서 속도증진효과가 컸다.
2) 반응열량계를 이용하여 흡수제의 종류(MEA, MDEA, DMEA)에 따른 탄산무수화 효소 첨가 전후의 이산화탄소와의 화학반응 시 발생되는 반응열을 측정한 결과 MEA > DMEA > MDEA의 순으로 반응열량이 낮았으며 효소 촉매의 첨가로 모든 흡수제의 반응열량이 낮아짐을 확인할 수 있었다. 이로부터 탄산무수화 효소촉매의 실 공정 적용시 재생에너지가 낮아질 수 있음을 알 수 있었다.
이상의 다양한 아민 흡수제(MEA, AMP, DMEA, MDEA)에서 CO2 흡수속도시험과 반응열량실험으로부터 탄산무수화효소 촉매의 CO2 흡수속도 및 반응열에 미치는 영향을 확인할 수 있었다. 특히, 연소후 아민 흡수제를 이용하는 이산화탄소 포집공정에 탈기능력이 우수한 3차 아민 계열의 흡수제가 탄산무수화 효소 촉매 적용에 유리한 흡수제이며 이중 MDEA가 효과가 가장 큼을 알 수 있었다.
이를 통해 흡수속도가 낮지만 탈기능력이 우수한 3차 아민 계열의 흡수제에 탄산무수화 효소촉매를 적용하면 흡수능력과 탈기능력을 동시에 높여 흡수제와 이산화탄소의 분리에 소비되는 에너지를 줄일 수 있을 것이다. 하지만, 탄산무수화 효소를 CO2 포집을 위한 실제 공정에 적용하기 위해서는 CO2 흡수에 따른 pH의 변화와 온도 등 포집공정변수에 따른 영향에 대한 연구가 진행되어져야 할 것이다.