광 산란방법을 이용한 계면활성제 농도측정
Measurement of Surfactant Concentration Using Light Scattering Method
Article information
Abstract
본 연구에서는 미세기포를 산란체로 사용한 편광산란 측정법을 이용하여 수중 계면활성제의 농도를 측정하는 방법을 개발하였다. Mueller 요소 M<sub>11</sub>은 계면활성제의 농도가 0 ppm부터 60 ppm 사이 영역에서 농도와 선형적인 비례관계를 가져 계면활성제 농도를 측정할 수 있는 유용한 파라메터로 사용될 수 있음을 알았다. 이 측정은 산란각이 150도, 소광비가 56.2 조건에서 가장 효과적 이였다. 이 연구 결과를 볼 때, 편광산란 측정법(EPLS)은 강이나 호수에서 수질을 실시간적으로 모니터하는데 있어 충분히 효과적인 수단으로 보인다.
Trans Abstract
A method for measuring the concentration of surfactant in water was developed. In this technique, microbubbles were used as light scatterers. The polarization change of light scattered by microbubbles was analyzed by Mueller matrix analysis. M<sub>11</sub>, one of the Mueller matrix elements, was found to be a key parameter inferring the surfactant concentration within the concentration range of 0 ppm to 60 ppm. The best results for this measurement were obtained when the scattering angle was 150° and the extinction ratio was 56.2. This experimental result shows that the EPLS can be effectively used as a real time inspection method for water quality monitoring in lakes or rivers.
1. 서 론
지금까지 진행되어온 수질 분석의 전형적인 방법은 현장에서 오염시료를 수집하고 이를 실험실로 가져와 화학적으로 분석하는 것이었다. 이 방법은 정확도에서는 뛰어나지만 분석하는데 시간이 많이 걸릴 뿐 아니라 실험실에서 작업이 진행되어야 한다는 어려운 점이 있다. 이 연구에서는 이러한 문제점을 해결하기 위해 실시간 적이며 현장에서 측정이 가능한 광학적 측정방법을 제시하고자한다. 이 연구의 핵심은 계면활성제 포함 수에 미세 기포를 발생시킨 후 여기에 입사된 빛에 대한 산란광의 편광변화를 분석하는 것이다. 수중에 형성되는 미세기포는 기포 특성에 따라 입사된 빛의 편광을 변화시킨다. 이때 편광상태는 기포의 크기나 크기 분포 등 기포자체의 기하학적 요인에 의해 변한다. 만약 매질인 물에 계면활성제가 녹여진다면 농도에 따라 기포의 크기나 분포 그리고 개체수가 달라져 이로 인한 편광변화가 유도된다. Aslan 등[1]은 실제로 계면활성제가 녹아 있는 수용액 속에서 발생된 수백 um 크기의 미세기포로부터 편광 변화가 있음을 보임으로서, 기포의 특성을 광 산란 방법으로 알아낼 수 있음을 보여 주었다. 이 연구에서는 계면활성제 농도에 따라 변화되는 특정 산란 matrix 요소가 특정 조건에서 농도와 1차적 관계가 있음을 보임으로서 광 산란 방법으로 수중 계면활성제 농도를 실 시간적이며 비접촉 방법으로 알아낼 수 있음을 처음으로 보였다.
2. 연구방법
2.1. 이 론
빛의 편광상태는 Stokes vector로 표현하며[2] 이 벡터는 4개의 성분[S0, S1, S2, S3]을 포함한다. 여기에서 S0는 빛의 세기, S1은 ± 90도 방향으로 편광된 성분의 빛의 세기로, 수평 편광이면 +1, 수직 편광이면 -1로 나타낸다, S2는 ± 45도 방향으로 편광된 성분의 빛의 세기를 그리고 S3는 원편광성분의 빛의 세기를 각각 나타낸다.
편광 된 빛이 미세 기포에 입사하게 되면 기포의 특성에 따라 산란광의 편광의 상태가 변하게 된다. 이렇게 계면에서 상호작용하는 편광의 상태는 stokes vector S = [S0, S1, S2, S3] T3)에 대한 Mueller matrix F (4×4, scattering matrix) 연산으로 결정된다. Stokes vector와 Mueller Matrix를 통해서 입사와 산란의 과정을 다음과 같이 묘사된다.
여기에서 k는 파수(wave number)를 그리고 r는 기포와 측정기 사이의 거리를 의미한다. Mueller matrix내의 16개 원소(Fij)들은 광원의 파장과 산란각에 의존하는 매개 변수이다. 구형의 미세기포로부터 축 대칭성(axisymmetric)을 고려하면 Mueller matrix는 아래와 같이 간단해진다[4].
Mueller matrix의 편광 효과를 볼 때, 분석을 단순화하고 편광 효과로부터 강도 의존 효과를 분리하기 위해 F11을 이용하여 규격화(normalize) 하는 것이 유리하다[5]. 위 식에서 Fij를 규격화시키기 위하여 F11으로 나눈 값을 Mij라고 한다면 윗 식은 다음과 같이 표현할 수 있다.
위 식을 간단히 표현하면
산란체의 편광을 분석하는 EPLS (Elliptically polarized light scatering technique)에 따르면 이 식은 편광소자의 회전각 함수로 다음과 같이 표현된다[6].
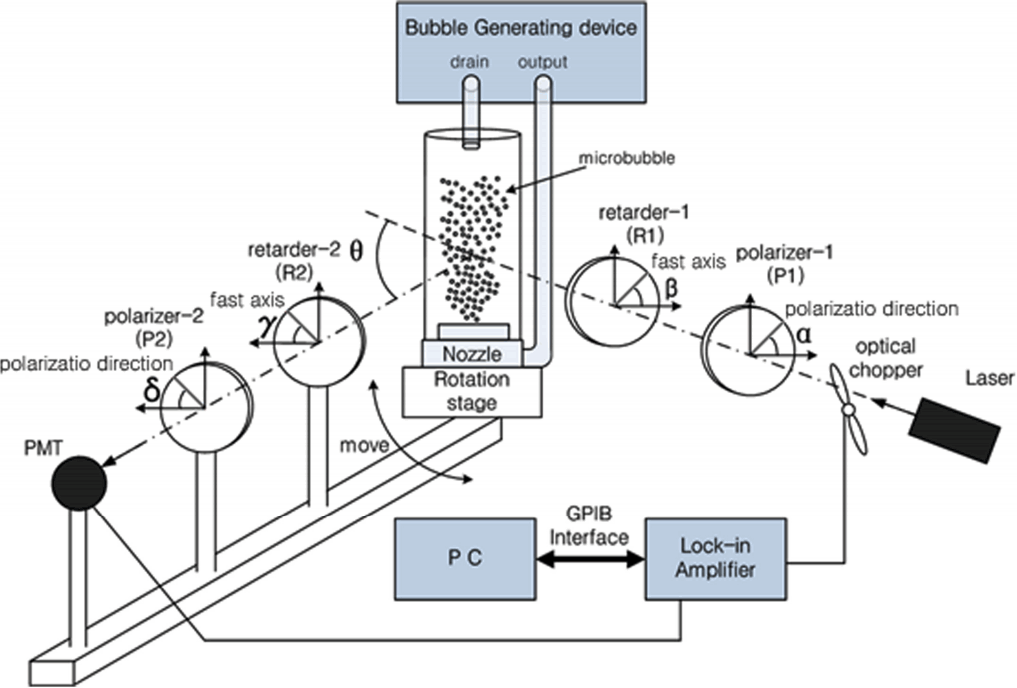
이렇게 구성된 측정시스템에서 우리가 구하고자 하는 행렬요소들은 Fig. 1의 회전각 α, β, γ, δ에 대한 조합을 변화시킴으로 구할 수 있다. 행렬요소의 대칭을 고려하면 이 시스템에서 얻을 수 있는 6개의 요소(F11,F12,F22,F33,F34,F44)는 Table 1의 조합으로부터 연산이 가능하다.

The orientation combinations of the polarizer and the retarders for the measurement of six independent Mueller matrix elements
행렬요소들에 대한 광학적 해석을 바탕으로 측정 결과를 분석하여보면 미세기포의 정보를 추출해 낼 수 있다. M11은 편광과 무관하게 입사광에 대한 산란광의 광세기의 크기 비이다. 따라서 기포의 직경변화나 산란체의 개수 변화에 민감하게 변할 수 있다. 이에 비해 M12 (degree of linear polarization, DLP)는 선형성분의 입사광이 산란에 의해 얼마나 산란광세기에 변화를 주었는가를 보여주는 변수로 구형 기포의 경우 대칭성 때문에 덜 민감하게 반영된다. 행렬 요소 M22는 S1' /S1로 정의되며 이는 산란에 의해 수평, 수직 입사 선형성분이 얼마나 변화했는지를 보이는 선편광 성분 세기의 비로 나타낸다. 기포의 모양이 유속 등 외부영향에 의해 형태가 일그러질 경우 선형편광 성분은 변하게 된다. 따라서 이 요소는 기포의 형상 변화 측정에 유용한 파라메터로 사용될 수 있다. M34는 기포에 의해 선형 편광성분이 얼마나 원편광으로 변했는가를 보여주는 성분이다. 그러나 임계각보다 큰 산란에서는 이런 현상이 생기지 않으므로 거의 0에 가깝게 나타나게 된다. M33, M44는 원형 편광정도(degree of circular polarization, DCP)를 나타내는 요소로 기포 직경크기 증가에 따라 민감하게 변화한다. 기포 직경이 커질수록 기포는 회전이 용이해 원형 편광세기에 영향을 미친다. 이 요소는 M11과 함께 기포 직경 변화에 민감한 요소로 알려져 있다.
2.2. 실험 장치 및 방법
본 연구에서는 (주) 스틱스사의 마이크로버블장치(Micro bubble generating device)[7]를 사용하여 미세기포를 발생시키고 EPLS(Elliptically polarized light scattering) 방법을 사용하여 기포로부터 발생한 산란광의 편광변화를 측정하였다. 기포의 직경과 이에 따른 기포의 부상속도의 관계는 이미 잘 알려져[8] 있어 생존시간 측정으로 미세기포의 직경을 가늠할 수 있다. 우리는 수중에서 최소 2분 이상 생존이 가능 하도록 기포 직경이 50 µm 이하가 되도록 목표를 설정하였다. 기포의 생존시간은 기포생성 nozzle로부터 17 cm 위를 통과하는 레이저 빛의 투과도를 측정함으로서 알 수 있다. 참고문헌 7에 따르면 기포 직경이 50 um의 경우 이 시간은 약 170초 정도이다. nozzle에서 방출되는 와류를 일정간격의 mesh를 통과시켜 미세기포를 생성하기 때문에 mesh 간격과 공기 유입량을 조절하여 가며 생존시간을 측정한다면 원하는 기포직경을 얻을 수 있었다.
미세기포의 산란에 의한 편광변화를 측정하기 위한 실험장치의 구성은 Fig. 1과 같다. 미세기포 발생장치의 버블방출유닛(Nozzle)에 유리관(glass column)을 결합하였고, 산란각에 대한 편광 측정을 위해 EPLS system은 스텝모터로 구동되는 rotation stage 위에 설치하였다. 사용된 유리관의 외경은 55 mm, 두께는 2.5 mm 높이는 450 mm이었다.
광원으로는 532 nm의 diode laser를 사용하였으며, 위상지연판은 이 파장에 대한 λ/4 판을 사용하였다[9]. 미세기포로부터 산란되는 산란광은 광증배관을 이용하여 측정하였다. 측면산란광이나 후방산란광의 세기는 매우 약하므로 외부의 노이즈에 묻혀 측정오류를 일으키기 쉽다. 따라서 집속 광학계를 광증배관 앞에 설치하였고 노이즈제거를 위해 lock-in amp를 사용하였다.
공기주입량이나 계면활성제의 농도에 따라 발생되는 미세기포의 직경이나 발생량은 달라질 수 있다. 이 관계를 알아보기 위해 부상시간 측정 방법과 미세기포 촬영 방법을 사용하였다. 기포 부상시간은 미세기포가 가득 채워진 평형상태에서 펌프 작동을 중단한 후부터 시작하여 미세기포 부상으로 인해 투명해기까지 시간을 측정하여 구하였다. 이 과정은 기포가 담긴 유리관을 통과하는 532 nm diode laser 빛의 세기 변화로 측정하였으며 이 결과로부터 시료에서의 광학적 길이 τ와 소광계수를 측정하였다.
미세기포 촬영을 통한 기포 상태측정은 다음과 같이 진행하였다. 실험에서의 미세기포의 직경은 수십 µm로, 접사렌즈를 사용하더라도 관측이 쉽지 않다. 따라서 무한초점의 대물렌즈(5X Mitutoyo Plan Apo Infinity Corrected Long WD Objective)와 경통 그리고 camera (Nikon 300S:12.3M pixel)를 결합하고 초점면과의 거리를 조정하여가며 형상을 관측할 수 있도록 광학계를 구축하였다. 이때 카메라의 초점심도를 고려하여 조리개는 최대한 개방하였으며 기포의 상승속도와 조명의 위치에 따라 노출시간을 변화시켜가며 가장 선명한 영상을 얻을 수 있도록 하였다.
3. 결과 및 고찰
3.1. 순수와 계면활성제 포함 수에서의 미세기포 크기 및 크기분포 측정
미세기포의 기하학적 구조는 공기주입량과 mesh 간격에 따라 달라진다. Fig. 2(a)는 공기주입량은 고정하고 mesh 간격에 따라 변화는 미세기포의 생존시간 결과를 보여준다. 그림에서 볼 수 있듯이 mesh 간격이 20 ppi (pixels per inch)에서 100 ppi로 좁혀줌에 따라 생존시간은 점점 길어지고 있다. 참고문헌의 결과(Fig. 2(d))[10]를 보면 미세기포의 부상 시간은 기포의 직경이 작아짐에 따라 길어져 100 ppi의 mesh를 사용하였을 경우 미세기포 직경은 45 μm까지 줄어드는 것을 알 수 있다.
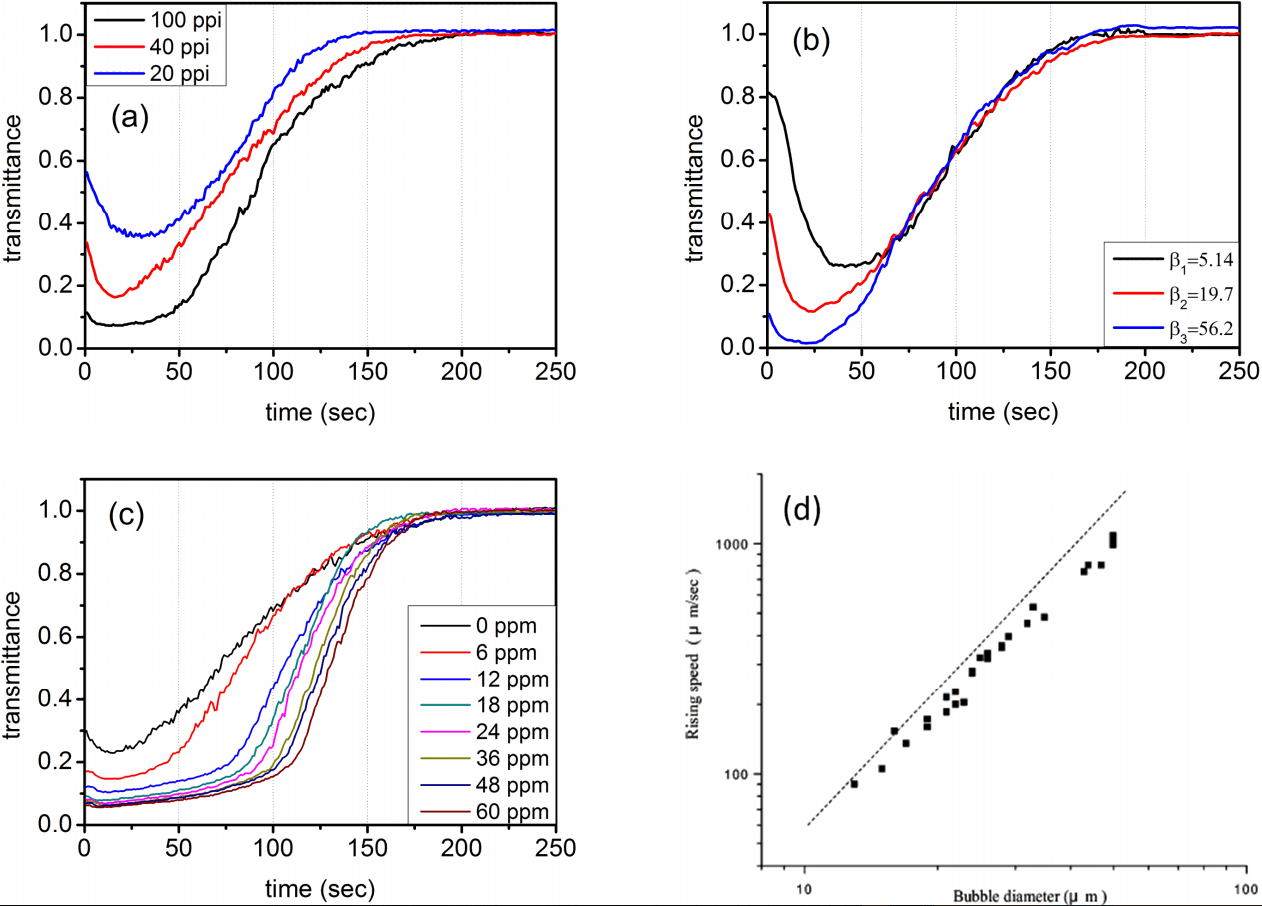
The floating characteristics of microbubbles in a water : (a) different mesh sizes, (b) different air injections, and (c) different concentrations of surfactant. (d) Dependence of bubble rising speed on bubble diameter (Adopted from Ref.9).
이후 100 ppi로 mesh 간격을 고정하고 공기주입량만을 달리하여 미세기포의 특성을 변화시켰다. 공기 주입량을 달리하면 수중 미세기포 발생 환경이 변화되어 유리관을 통과하는 빛 투과량이 달라진다. 공기주입량은 이 실험에만 적용될 수 있는 변수이므로 절대 변수인 소광계수로 변환시켜야 객관화 시킬 수 있다. 유리관을 통과하는 빛의 투과도는 다음과 같다.
이 식에서 I0는 유리관내 순수가 담겨져 있을 때 유리관을 통과한 레이저 빛의 세기, I는 기포가 발생되었을 경우 유리관을 통과한 레이저 빛의 세기를 나타내며, τ는 광학적 길이(optical length), β는 소광계수(extinction ratio), l은 유리관의 직경을 나타낸다.
Fig. 2(b)는 mesh size가 100 ppi일 때 공기주입량만을 바꾸어가며 측정한 미세기포의 부상시간을 측정한 결과이다. 공기주입량을 증가시킬수록 유리관내 유체는 불투명해져 투과도는 급격히 떨어진다. 이에 따라 β 값은 증가하므로 그림에서 β 값이 크다는 것은 주입공기량이 많음을 의미한다. 이 그림에서 흥미로운 특징은 공기 주입량이 달라 β 값이 차이가 나도 기포의 생존 시간이 모두 200 초로 동일하게 측정되었다는 사실이다. 이 사실로부터 미세기포의 직경은 mesh 간격에 의해 결정됨을 알 수 있으며 공기주입량을 변화시켜도 기포의 직경은 모두 동일하게 45 µm임을 알 수 있었다.
이에 따라 측정 시작 후 50초 이내에 관측된 감쇠 패턴들은 펌프작동 정지 후 남아있던 공기들이 만든 여러 다른 직경의 기포로 인한 것임을 알 수 있으며, 현미경 관찰 결과 이들은 대부분 짧은 생존시간을 보이는 큰 직경의 기포들로 이루어짐을 알 수 있었다.
이 연구의 목적은 계면 활성제 농도 측정이므로 농도에 따라 미세기포의 직경변화를 알아보는 것은 중요하다. Fig. 2(c)는 계면활성제 농도에 따른 미세 기포의 생존시간 측정 결과이다. mesh 간격은 100 ppi이었으며 0 ppm에서의 주입공기량 조건은 β = 56.2로 고정하였다. 계면활성제 농도는 0 ppm에서 60 ppm까지 8가지의 시료를 사용하였다. 이 경우에서도 역시 미세기포의 생존시간은 200초로 관측되었다. 다만 농도의 증가에 따라 투과율 기울기의 상승시점이 점점 길어져, 60 ppm의 농도에서는 이 시간이 거의 120초까지 지연됨을 볼 수 있었다. 이는 측정 초기의 잔여공기와 계면활성제로 인해 더 많은 기포들이 생기기 때문이며 계면활성제 농도가 증가함에 따라 기포 수는 더욱 증가되어 지연이 길어지게 된다. 그러나 생존시간이 200초로 농도와 무관하게 측정됨을 보아 어느 측정에서도 산란에 주된 역할을 하는 기포의 직경은 45 µm 부근임을 알 수 있었다.
Fig. 3은 계면활성제 농도가 0 ppm, 18 ppm, 60 ppm 일 때 촬영한 미세 기포들의 영상과 기포의 크기 분포를 나타낸 예이다. 영상은 펌프작동 정지 후 20초 지난 다음 촬영되었다.
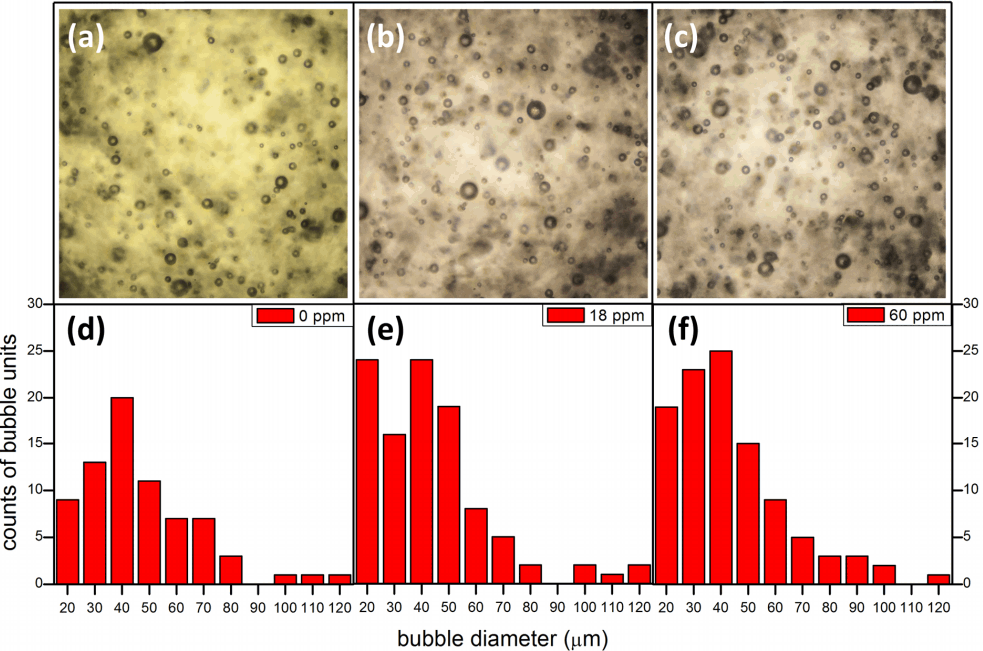
Microscopic images of bubbles at surfactant concentration of (a) 0 ppm, (b) 18 ppm, and (c) 60 ppm. The images represent 2 by 2 mm area. Corresponding bubble size distribution ; (d) 0 ppm, (e) 18 ppm, (f) 60 ppm.
생존시간 측정에서의 결과와 같이, 계면활성제 농도 증가에 따라 미세기포 수가 증가됨을 이 영상은 확실히 보여주고 있다. 이를 확인하기 위해 주어진 영상으로 부터 기포의 직경 분포를 구하였다. 분포 측정에서 특별히 주의해야 할 것은 참 데이터로 쓰일 수 있는 기포영상 선정이다. 이 측정에는 현미경 대물렌즈를 사용되었기 때문에 초점 심도는 극히 낮다. 따라서 초점을 벗어난 기포의 영상은 흐리게 나타난다. 만약 기포가 초점면상에 있다면 기포들은 낮은 초점 심도로 인해 중심부분이 희고 테두리가 검은 원으로 나타난다. 따라서 분포측정에서는 이런 고리모양의 기포만을 참 데이터로 인정하여 Fig. 3(d)~(f)의 결과에 반영하였다.
2 mm × 2 mm 면적, 심도 폭인 100 µm의 체적 속에 있는 기포수가 적어 통계처리의 신뢰도에 문제를 줄 수 있다. 따라서 동일 조건에서 10회 이상 측정한 결과로부터 구한 평균 기포수와 평균직경을 Table 2에 보였다. 이렇게 구한 미세기포 평균직경도 44 µm로 생존시간 측정으로 구한 미세기포 직경과 거의 같은 결과를 보여주고 있었다.

The statistical data of microbubbles obtained from the bubble size distribution represented in fig. 3(d)~(f)
기포 직경이 수백 µm일 경우 계면 활성제 농도 증가에 따라 기포의 직경은 적어지는 경향[1]을 보이나, 우리처럼 수십 µm의 기포를 사용할 경우 기포직경은 계면활성제 농도에 무관함을 보이고 있어 산란을 통한 계면활성제 농도 측정에 있어 기포의 직경 선택은 중요 변수가 됨을 알 수 있었다.
3.2. 계면활성제 농도에 따른 편광산란 측정방법의 효율성
빛이 기포에 입사되면 기포 표면에서 굴절률 차이에 의한 반사가 이루어진다. 입사 빛은 굴절률이 높은 물(n = 1.33)에서 공기(n = 1)쪽으로 입사되므로 이때 임계각 θc는 82.5°이다. 우리가 택한 후방산란은 전반사한 효과를 고려하지 않아도 되고 전방 산란시 두꺼운 광학적 길이 때문에 발생하는 측정 오차 문제도 피할 수 있어 계면 활성제농도 측정에 보다 유리하다[11]. 이후 모든 산란 실험을 90°~150°까지 변화시키며 측정하였다. 측정이 150도로 제한된 이유는 이상의 산란각도에서는 측정기인 광증배관이 입사빛을 가리는 실험적 이유 때문이었다.
산란 해석에 있어 광학두께(optical thickness: τ)는 산란과 흡수에 감쇠되는 빛의 세기 공식 I / I0 = exp(- r)으로부터 계산되며, τ = 2.5를 기준[1]으로 산란은 독립 산란영역과 종속산란영역[12]으로 나뉜다. 0 ppm부터 60 ppm까지의 계면활성제 포함시료로부터 구한 광학두께는 모두 4.3 이상이었으므로 우리 실험의 영역은 산란에 있어 각 기포의 영향을 고려해야 하는 종속다중산란 영역임을 알 수 있었다[13].
Fig. 4(a)는 수식 (2)에 따른 결과이며 수식 (3)에 맞게 규격화된 결과를 Fig. 4(b)에 보였다.
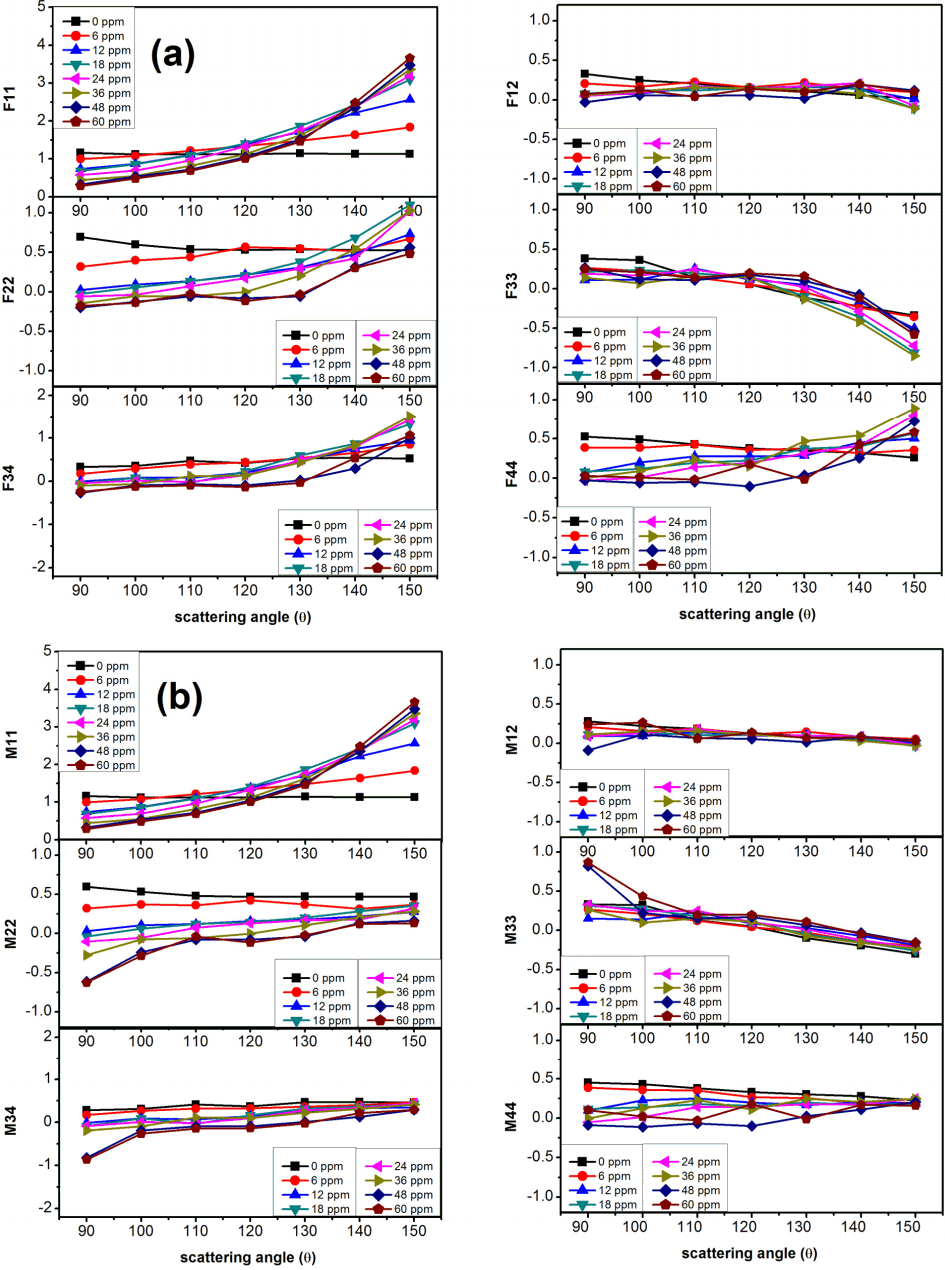
(a) Scattering matrix elements Fij calculated from the experimental intensity measurement. (b) Normalized scattering matrix elements Mij (Fij / F11).
90°~150° 후방산란 영역에서 계면활성제 농도에 따른 Mueller matrix 성분들의 변화를 Fig. 4에 보였다. 계면활성제 농도범위는 방류수 수질관리 기준인 5 ppm을 포함하여 오염이 심한 정도인 60 ppm까지로 하였다.
6개의 Mueller 요소 M11은 입사빛 세기에 대한 산란 빛의 세기의 비로, 산란으로 해당 각도 방향으로 얼마나 많은 빛을 산란시켰는가를 보여준다. 측방산란(90°)의 경우 M11은 농도가 증가할수록 작아진다. 이전 영상 결과에서 알 수 있듯이 계면 활성제 농도가 증가하면 발생되는 기포 수도 증가한다. 따라서 이 결과는 기포 수 증가에 따라 측방에서는 산란광세기가 감소되고 있음을 보여준다. 그러나 이 양상은 후방산란으로 갈수록 바뀌어 150°의 후방산란에서는 정반대의 양상을 보이게 된다. 즉 순수의 경우 산란광세기는 측방측정에 비해 후방측정에서 더 적게 나오는 반면, 60 ppm 시료의 경우 산란광세기는 후방 측정값이 측방 측정값에 비해 거의 13배 정도 크게 나오고 있음을 알 수 있었다.
M11을 제외한 5개 요소는 특별한 농도 의존성을 보이지 않았다. 그러나 이 결과로 부터 기포 형상에 대한 부수적 특성을 보여주었다. M12 (degree of linear polarization, DLP)도 모든 산란각 영역에서 농도 의존성을 보이지 않았다. 이는 미세기포가 구형임을 보여주는 결과로 구형 기포의 경우 대칭성에 의해 선형 편광 성분의 변화가 거의 없기 때문이다. M22 역시 기포 변형에 민감한 파라메터이다. 따라서 구의 형태를 유지되는 이 경우에서 이 파라메터로 농도의 변화를 감지하기에는 분해능이 너무 낮다고 보인다. M34는 기포에 의해 선형 편광성분이 얼마나 원편광으로 변했는가를 보여주는 성분이다. 그러나 임계각보다 큰 산란에서는 이런 현상이 생기지 않으므로 측정 결과 역시 농도 의존성을 보이지 않았다. M33, M44는 원형 편광성분의 정도(degree of circular polarization, DCP)를 나타내는 요소로, 이들은 기포 직경크기 변화에 민감하다. 기포 직경이 커지면 회전도 보다 용이해져 산란 후 원형 편광요소의 변화가 증가되기 때문이다. 그러나 그림 결과를 보면 이들 역시 농도의존성을 별로 보이지 않는다. 이 사실은 기포가 형성되는 수용액이 어떤 성분을 가졌던 상관없이 기포의 직경은 mesh 의 간격에 의해 결정된다는 이전의 결과를 다시 한번 뒷받침해 준다.
3.3. 농도 측정을 위한 실험 조건 도출
3.2절에서 6개의 Mueller 요소 중 오직 M11 만이 계면활성제 농도에 민감하게 반응함을 보았다. 따라서 농도 측정에 있어 M11 만을 고려하여 분석을 시도하였다.
Fig. 4(b)를 보면 측방산란(90°)에서는 농도가 증가함에 따라 M11값은 적어졌다. 그러나 측정각이 커질수록 농도차이로 인한 M11값 차이는 줄어들었으며, 측정각이 더 커지면 고농도의 M11값이 저농도의 M11값보다 도리어 적어지는 역전현상을 보였다. 이를 확인하기 위해 측방(90°)에서 측정한 M11 (90°)을 1로 하고 나머지 각도에서의 M11값을 규격화한 결과를 Fig. 5에 보였다.
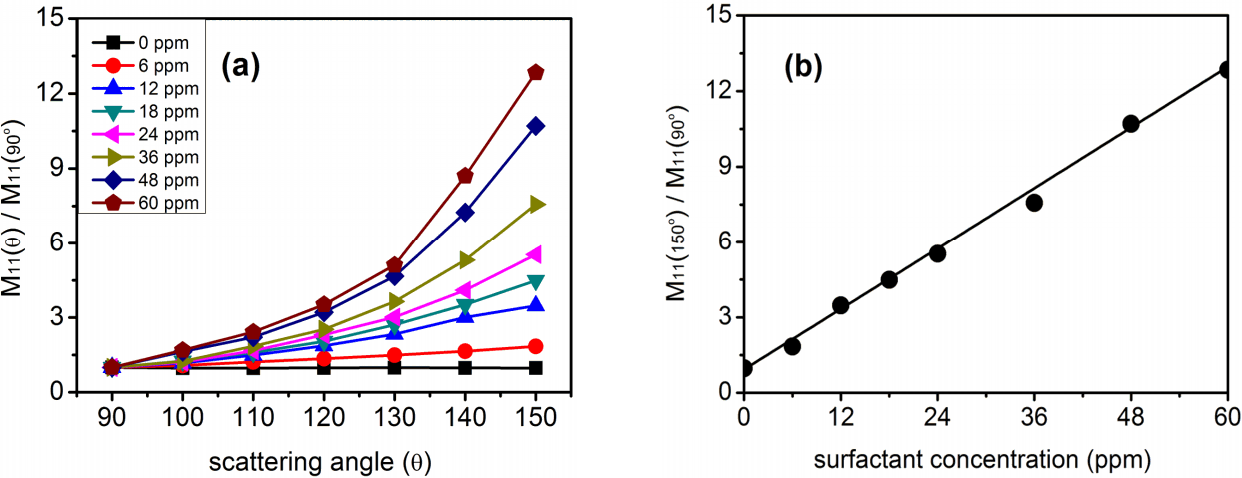
(a) Normalized scattering matrix element M11 (θ) / M11 (90º) measured for the systems with different surfactant concentrations. (b) Plot of M11 (150º) / M11 (90º) for different surfactant concentrations.
Fig. 5(a)에서 보듯이 후방산란으로 갈수록 농도변화에 따른 산란 세기의 변화는 더욱 뚜렷하다. M11 값으로 농도 측정의 지표로 사용되려면 M11과 농도 사이에 일정한 수학적 관계가 있어야 한다. Fig. 5(b)는 농도에 증가에 따라 Fig. 5(a) 측정각 150°에서의 크기 그래프를 구한 결과이다. 이 그림에서 종축은 측방(90°)에서 측정한 값에 대한 상대적 비율이다. Fig. 5(b)를 보듯 계면활성제 농도 변화에 따른 기울기가 1차원적인 비례관계를 보이고 있어, M11 측정으로도 계면활성제 농도를 추정할 수 있는 충분한 개연성을 보이고 있다.
우리는 계면활성제 농도를 미세기포를 통한 후방 광산란 측정할 수 있음을 보임으로서, 강이나 호수에서 시료 채취를 하지 않고도 현장에서 계면활성제 농도를 실시간적으로 측정할 수 있음을 보였다.
이 연구는 미세기포의 크기가 100 µm 이내, 그리고 수중 녹아있는 물질이 계면활성제에 국한되어 진행되었으므로, 이 측정 방법의 범용성을 주장하기에는 아직 이르다. 그러나 계면활성제의 농도 영역을 넓히거나 물에 녹을 수 있는 다른 물질에 대한 연구를 더 진행함으로서 이 방법의 적용가능성을 판별할 수 있을 것으로 본다.
4. 결 론
1) 본 연구에서는 미세기포를 이용한 편광산란 측정법(EPLS)을 사용하여 수중 계면활성제 농도를 측정하였다. 후방산란으로 측정한 6개의 Mueller 요소 중 M11 만이 계면활성제 농도에 따라 뚜렷한 연관성을 가졌다. 미세기포 형성을 위해 주입하는 공기량에 따라 농도측정의 분해능이 달라졌으며 이 실험의 경우 공기주입량을 많이 할수록 분해능이 향상되었다.
2) 계면활성제 농도 측정을 위한 EPLS 측정에서 가장 효과적인 측정각도는 150도이었으며 실험적 한계를 극복한다면 그 이상의 각도에서도 더 향상된 결과를 얻을 수 있을 것으로 보인다. 계면활성제 농도와 M11크기의 수학적 관계를 구하기 위해 150도에서 측정한 M11크기를 90도에서 측정한 M11 크기로 나누어 상대적인 비례 계수를 구해본 결과 β값이 56.2일 때 가장 선형적 비례관계를 보았다.
3) 실제 수중의 계면활성제 농도를 측정에 있어, 수면 밑에는 기포 발생장치를 설치하고 수면 위에 편광산란 측정 장치를 설치하여 비접촉, 실시간적인 측정이 가능할 수 있음을 보였다.