촉매 오존화 공정에서 메틸오렌지 제거에 미치는 운전변수의 영향
Effect of Operating Parameters on Methyl Orange Removal in Catalytic Ozonation
Article information
Abstract
촉매오존화 공정에 의한 메틸오렌지 제거특성과 그에 미치는 운전변수의 영향에 관한 회분식 실험과 동력학적 연구를 수행하였다. 활성탄은 오존의 자가분해를 촉진시켜 OH·를 발생시키므로 메틸오렌지 분해속도를 증가시키는 것으로 나타났다. 활성탄의 투입량이 증가함에 따라 메틸오렌지 분해반응의 속도상수가 증가하는 것으로 나타났다. 가스상 오존농도 증가는 수용액으로의 물질전달을 증가시켜 메틸오렌지 분해반응의 속도를 증가시키는 것으로 나타났다. 메틸오렌지 제거반응은 실험된 5~12 범위에서, TOC 제거는 7 이상의 pH에서 큰 영향을 미치지 않는 것으로 나타났다. 이러한 결과는 촉매오존화 공정이 효과적인 염료처리 기술로서 고려될 수 있음을 보여준다.
Trans Abstract
Removal characteristics of methyl orange and their dependence on operating parameters in a catalytic ozonation were investigated through a series of batch experiments. Activated carbon enhanced the self-decomposition of ozone, generating OH·, thus promoting methyl orange degradation. As the carbon dose increases, the pseudo-first order rate constants of methyl orange degradation increased, resulting in the fast removal of methyl orange. The increase of gaseous ozone concentration enhanced the mass transfer to the aqueous solution, therefore, promoted the methyl orange removal. The methyl orange degradation was not significantly affected by the change of pH in the range of 5~12, and TOC removal was negligibly affected by the variation of pH over 7. The results indicate that the catalytic ozonation can be considered as an effective dye treatment technology.
1. 서 론
다양한 화학물질을 사용함으로 인해 발생되는 환경오염이 중요한 사회문제가 되어왔다[1]. 섬유산업에서는 많은 종류의 합성염료들이 사용되고 있으며 잠재적 독성과 불쾌한 색도를 지닌 폐수가 배출되고 있다. 많은 유기화합물들은 생물학적 처리공정과 같은 재래적인 기술로는 효과적으로 분해할 수 없는 것으로 알려져 있다[2]. 즉, 염색폐수를 포함한 다양한 산업폐수는 복잡한 분자 구조를 가진 물질을 함유하며 일반적으로 낮은 BOD/COD비를 가지므로 생물학적으로 처리하기 어렵다는 특징을 갖는다. 따라서, 생물학적 처리외에 흡착, 응집, 광촉매, 전기화학적 산화, 오존, 전기방전 등과 같은 다양한 기술들이 난분해성 폐수를 처리하기 위해 적용되어 왔다[2~8].
비교적 최근부터 난분해성 물질을 효과적으로 처리할 수 있는 공정으로서 촉매오존화 공정(catalytic ozonation)이 주목받고 있다[2]. 오존은 높은 산화력을 가지고 있으나 선택성을 가지므로 난분해성 유기물질의 제거에 한계를 지니고 있다[8]. 즉, 많은 유기물질이나 이의 산화에 의해 생성되는 중간생성물은 오존과의 반응성이 좋지 않으므로 오존 처리에 의해 효과적으로 제거될 수 없다. 따라서 오존 처리 과정에서 활성탄을 오존 분해반응의 촉매로 활용함으로써 강한 산화력을 가진 수산화라디칼(OH·)을 생성시키기 위한 다양한 연구들이 수행되어 왔다[9~22].
촉매오존화 기술은 활성탄을 촉매로 하여 오존의 자가분해를 촉진시켜 OH·을 생성시키는 기술이다. 활성탄은 오존 분해의 개시자(initiator) 또는 촉진자(promoter) 역할을 하는 것으로 알려져 있다[20~22]. 현재까지 촉매오존화에 의한 염료 처리에 관한 몇몇 연구들이 진행되어 왔으나 염료성분의 처리과정에서 일어나는 제거현상의 동력학적 해석을 수행한 연구는 드물다. 촉매오존화 공정에 의한 유기물 분해는 오존에 의한 직접산화나 오존의 분해생성물인 OH·에 의한 간접산화에 의해 일어나는 것으로 알려져 있다. 촉매오존화 공정에서 메틸오렌지 제거반응의 속도는 다음과 같이 표현될 수 있다[2,20].
여기서 k는 메틸오렌지 제거반응의 유사 일차반응 속도상수이다. 식 (1)을 적분하면 식 (3)이 되며, 반응시간에 따른 메틸오렌지의 농도와 초기농도의 1/2이 되는 반감기는 식 (4)와 같이 표현된다.
본 연구에서는 촉매오존화 공정에 의한 염료 제거특성을 관찰하기 위해 메틸오렌지를 대상으로 회분식 실험을 수행하였다. 메틸오렌지 제거에 미치는 활성탄 투입량, 가스상 오존농도, pH와 같은 운전인자의 영향을 관찰하였으며, 그 결과를 동력학적으로 해석하였다.
2. 실험장치 및 방법
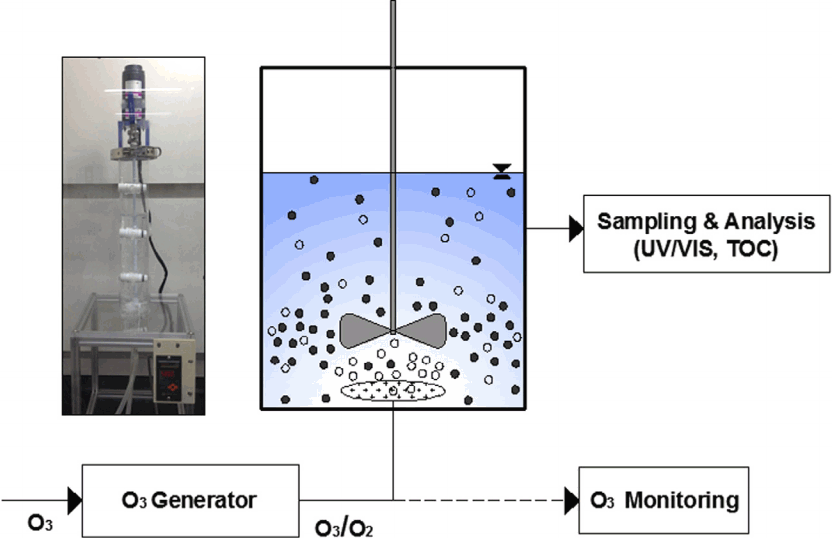
본 연구에서 사용된 실험장치는 오존 발생장치, 접촉 반응조 및 분석 장비로 구성되어 있다(Fig. 1). 가스상 오존을 생성시키기 위해 오존 발생기(Fischer Ozone 500 M, Germany)를 사용하였으며 유입가스로 순산소를 이용하였다. 반응기는 유리재질을 이용하여 1.76 L 용량(유효용량 1.0 L)으로 제작하였으며 오존 기포의 수용액내 체류시간을 증가시키기 위해 직경대비 높이의 비(h/d)를 약 4.3으로 하였다. 가스상 오존농도를 측정하기 위해 오존분석기(InUSA, In-2000, USA)를 사용하였으며 메틸오렌지 분석을 위해 UV/VIS spectrophotometer (Agilent Technologies 8453)를 사용하여 각각 480 nm의 파장에서 흡광도를 측정하였다. 또한 시료의 총유기탄소(TOC, Total organic carbon)를 분석하기 위해 총유기탄소분석기(TOC-LCP, Shimadzu, Japan)를 이용하였다.
실험에 사용된 활성탄은 상용 입상활성탄(Norit GAC 1240, Netherland)을 분쇄한 분말 활성탄(PAC, powdered activated carbon)이다. GAC는 분쇄 전에 불순물을 제거하고 표면작용기를 활성화시키기 위해 염산(35%)을 이용하여 처리한 후에 증류수로 세척하여 건조시켰다. 실험에서 순도 99%의 시약용 메틸오렌지(Samchun Chemical, Korea)를 사용하였고 증류수를 사용하여 1,000 mg/L의 stock solution을 제조한 후에 희석하여 사용하였다. 용액의 pH를 조절하기 위해 0.1 M의 염산과 수산화나트륨 수용액을 사용하였다. 반응기로부터 일정한 시간간격으로 시료를 채취하기 위해 0.2 μm의 필터(ADVANTEC, Japan)를 장착시킨 시린지를 이용하였다. 약 3 mL의 시료가 채취되었으며 추가의 오존반응을 억제시키기 위해 0.1 mL의 Sodium thiosulfate (Na2S2O3)를 주입하였다.
Table 1은 본 연구의 주요 운전변수와 범위를 나타내고 있다. 용액의 pH는 5~12의 범위에서 실험하였으며 활성탄 투입량은 0.3~1.5 g/L의 범위에서 운전하였다. 반응기로 공급되는 가스상 오존농도는 3,000~7,000 ppm의 범위에서 실험하였으며 반응시간은 120분으로 설정하였다. 모든 실험은 2회 이상 수행하였으며 평균값을 대푯값으로 취하였다.
3. 결과 및 고찰
3.1. 처리기술별 메틸오렌지 제거 경향
수용액의 pH가 5인 조건에서 100 mg/L의 초기농도를 가진 메틸오렌지 제거특성을 촉매오존화, 오존화, 흡착 기술 별로 비교하여 Fig. 2에 나타내었다. 오존화와 촉매오존화 실험에서는 5,000 ppm의 농도를 가진 오존가스를 0.2 LPM으로 반응기에 공급하였으며 촉매오존화와 흡착실험에서 활성탄 투입량은 1 g/L였다. 활성탄으로의 메틸오렌지 흡착은 초기에는 빠르게 진행되었고 시간이 경과할수록 흡착지점의 감소로 인해 서서히 진행되는 일반적인 유기오염물질 흡착특성을 나타내었다. 메틸오렌지 흡착은 약 40분의 시간이 경과하면 포화되는 것으로 나타났으며 PAC의 흡착용량은 71.9 mg/g인 것으로 나타났다. 이 결과는 흡착기술을 이용할 때, 약 70%의 제한된 제거효율을 얻을 수 있음을 보여준다. 오존화 및 촉매오존화 기술을 적용한 경우에는 메틸오렌지가 완전히 제거되었으며, 오존 처리보다 촉매오존화 공정에서 상대적으로 빠르게 제거되는 것으로 나타났다. 즉, 메틸오렌지는 오존화에서 60분 이상이 경과한 후에 완전히 제거되었으며 촉매오존화에서는 약 40분이 경과하면 완전히 제거되었다. TOC의 제거경향은 처리기술별 특성을 보다 명확하게 보여준다. 초기 TOC 농도는 약 53.3 mg/L이었으며 반응시간 15, 30, 60, 90분에 시료를 채취하여 농도를 분석하였다. 반응시간 90분이 경과한 후에 TOC 제거효율은 오존화 기술이 24.8%로 가장 낮았으며, 흡착기술(51.5%), 촉매오존화 기술(58.1%)의 순으로 증가하였다. 오존 처리시에 메틸오렌지가 완전히 제거되나 TOC 제거는 원활하게 이루어지지 않는 점은 주목할 만한 것으로 판단된다. 이러한 현상은 메틸오렌지 제거과정에서 생성되는 중간생성물로 인해 일어난 것으로 이해할 수 있다. 산화기술을 적용하여 유기오염물질을 처리할 때, 그 물질이 완전히 제거더라도 원래의 유기물 자체보다 분해가 어려운 물질이 생성될 수 있다. 촉매 오존화 공정이 오존 처리보다 훨씬 높은 TOC 제거효율을 가지는 것은 활성탄이 오존 분해의 촉매로 작용함으로써 산화력이 보다 강한 OH·을 생성시키기 때문이다[8,23]. 기존의 연구에서 활성탄 투입에 의해 용존 오존의 감소현상이 보고되었다[2].
3.2. 메틸오렌지 제거에 미치는 운전변수의 영향
촉매오존화 공정에서 메틸오렌지 제거에 미치는 활성탄 투입량의 영향을 Fig. 3에 나타내었다. 모든 조건에서 반응 시간이 경과함에 따라 메틸오렌지 농도가 감소하였으며 활성탄 투입량이 증가함에 따라 분해속도가 증가하는 것으로 나타났다. 메틸오렌지가 완전히 제거되기 위해 필요한 시간은 활성탄 투입량이 0.3 g/L인 조건에서는 약 60분이었으나 투입량이 0.8, 1.5 g/L로 증가함에 따라 각각 40, 30분으로 감소하였다. 각 조건별로 완전히 제거되는 시간까지 메틸오렌지 분해반응의 속도상수(k)와 반감기(t1/2)를 계산한 결과를 Table 2에 나타내었다. 모든 실험조건에서 결정계수(R2)의 값이 0.97보다 높게 나타나 촉매오존화 공정에서 메틸오렌지 분해반응이 식 (1)에서 식 (4)에 의해 주어진 속도모델에 의해 적절하게 설명될 수 있음을 보여준다. 활성탄의 투입량이 0.3, 0.8, 1.5 g/L으로 증가할 때, 속도상수의 값은 각각 0.0647, 0.1196, 0.1544 min-1으로 증가하였으며 반감기는 10.71, 5.80, 4.49 min으로 감소하였다. 활성탄 투입량의 증가에 따른 메틸오렌지 분해속도의 증가는 오존의 자가분해가 촉진되어 일어난 현상으로 판단된다.
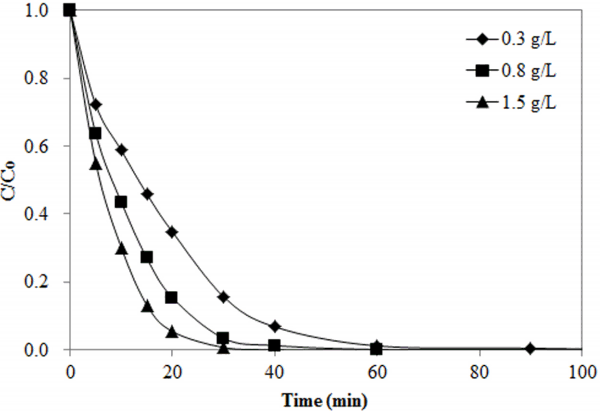
Effect of activated carbon dose on methyl orange removal (C0 = 100 ppm, pH0 = 5, O3 conc. = 5,000 ppm).

Effect of activated carbon dose on kinetic parameters for methyl orange removal in catalytic ozonation (C0 = 100 ppm, pH0 = 5, O3 conc. = 5,000 ppm)
Fig. 4는 가스상 오존농도의 변화에 따른 메틸오렌지 제거특성을 나타내고 있다. 반응기로 공급되는 가스상 오존 농도가 증가할수록 메틸오렌지가 더 빠른 속도로 제거되는 것을 알 수 있다. 메틸오렌지가 완전히 분해되는데 소요되는 시간은 가스상 오존농도가 3,000, 5,000, 7,000 ppm으로 증가함에 따라 각각 60, 40, 20분으로 감소하였다. 실험된 오존농도 조건에서 메틸오렌지 분해반응의 속도상수(k)와 반감기(t1/2)를 Table 3에 나타내었다. 가스상 오존농도가 3,000, 5,000, 7,000 ppm으로 증가함에 따라 속도상수의 값은 각각 0.0924, 0.1212, 0.1443 min-1으로 증가하였으며 반감기는 7.50, 5.72, 4.80 min으로 감소하였다. 오존농도가 증가함에 따라 메틸오렌지 분해속도가 증가하는 현상은 오존의 물질 전달 증가와 더불어 자가분해가 촉진되기 때문에 일어난 결과로 판단된다.
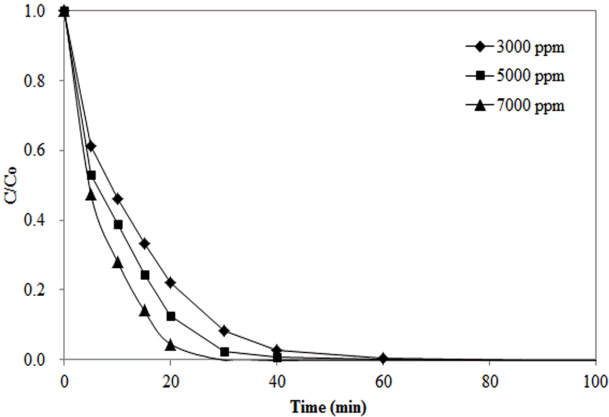
Effect of gaseous ozone concentration on methyl orange removal (C0 = 100 ppm, pH0 = 5, PAC dose = 1 g/L).

Effect of gaseous ozone concentration on kinetic parameters for methyl orange removal in catalytic ozonation (C0 = 100 ppm, pH0 = 5, PAC dose = 1 g/L)
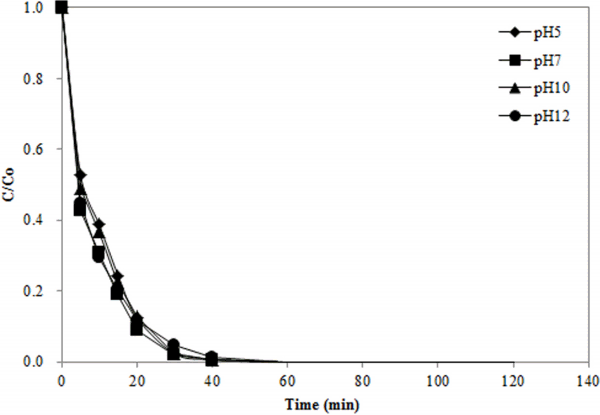
오존의 자가분해 반응은 수용액의 pH에 의해 영향을 받는 것으로 알려져 있다. 즉, pH가 증가하면, 수산화이온(OH-)에 의해 오존의 자가분해가 증가함으로써 강한 산화력을 가진 OH·의 생성이 증가하게 된다[15,24]. 따라서 유기물질을 오존으로 처리할 경우에 일반적으로 pH가 증가함에 따라 처리효율이 증가하는 현상이 관찰된다[8,15]. 촉매오존화 공정에서는 활성탄이 오존분해를 촉진시키므로 pH의 변화가 미치는 영향이 오존 처리에서 관찰되는 것과 다를 수 있다. 촉매오존화 공정에서 메틸오렌지 제거에 미치는 pH의 영향을 Fig. 5에 나타내었다. 실험된 모든 pH 조건에서 약 40분이 경과하면 모든 메틸오렌지가 제거되는 것으로 나타났다. 수용액의 pH 조건별 페놀분해의 동력학적 특성을 계산한 결과를 Table 4에 나타내었다. pH가 5, 7, 10, 12인 조건에서 유사 일차반응 속도상수의 값은 각각 0.1212, 0.1312, 0.1231, 0.1079 min-1이며 반감기는 5.72, 5.28, 5.63, 6.42 min으로 나타났다. 이러한 결과는 촉매오존화 공정에서 pH의 변화가 메틸오렌지의 제거에 큰 영향을 미치지 않는 것을 보여준다.
3.3. 총 유기탄소 제거특성
촉매오존화 공정에서 메틸오렌지가 산화되어 CO2와 H2O로 무기화되는 경향을 검토하기 위해 운전변수에 따른 TOC 제거경향을 관찰하였다. 현재까지 촉매오존화에서 메틸오렌지가 제거될 때 생성되는 중간생성물에 대한 발표는 이루어져 있지 않은 상태이다. 일반적으로 산화공정을 적용할 때, 메틸오렌지는 염소화 화합물, 벤젠 유도체들, 긴 사슬의 알칸류 등을 포함한 다양한 종류의 중간생성물을 거쳐 무기화되는 것으로 알려져 있다[25]. Table 5는 초기농도 100 mg/L의 메틸오렌지를 제거할 때, 반응시간 90분에서 운전조건별 TOC 제거효율을 나타낸 결과이다. 수용액의 pH가 5, 가스상 오존농도가 5,000 ppm인 조건에서 활성탄의 투입량이 0.3, 0.8, 1.5 g/L로 증가함에 따라 TOC 제거효율은 29.5, 43.8, 60.4%로 증가하였다. 활성탄 투입량이 1 g/L, pH가 5인 조건에서 가스상 오존농도가 3,000, 5,000, 7,000 ppm으로 증가할 때, TOC 제거효율은 53.3, 58.1, 63.9%로 증가하였다. 가스상 오존농도가 5,000 ppm, 활성탄 투입량이 1 g/L인 조건에서 pH가 5, 7, 10, 12인 조건에서 TOC 제거효율은 각각 51.5, 61.8, 58.7, 64.2%로 나타났다. 활성탄 투입량과 가스상 오존농도의 증가에 따른 TOC 제거효율의 증가는 메틸오렌지 제거반응에서와 같이 활성탄의 양이 증가함에 따라 오존의 자기분해 반응이 촉진되고, 가스상 오존의 유입농도에 따른 물질전달의 증가로 인해 활성종의 생성이 증가함으로써 일어난 것으로 판단된다. TOC 제거에 미치는 pH의 영향을 보면, 비록 pH가 5인 조건에서는 TOC 제거효율이 51.5%로 가장 낮았으나 pH가 7보다 커지면 pH의 영향이 크지 않은 것으로 나타났다. 이 현상은 촉매오존화 기술이 오존화 기술에 비해 유입되는 폐수의 pH 변화에 큰 영향을 받지 않음을 보여준다.
이상과 같은 결과는 촉매오존화 기술의 적용상의 장점을 보여준다. 즉, 흡착용량이 제한되어 일정한 시간이 경과하면 흡착제의 재생이 필요한 흡착기술과는 대조적으로 연속적으로 오염물질을 제거할 수 있는 산화기술로서의 장점이 있다. 또한 활성탄의 촉매작용에 의해 산화력이 강한 OH·을 생성시켜 오존화 기술보다 빠른 오염물질 제거속도를 얻을 수 있으므로 염료처리에 효과적으로 활용될 수 있음을 보여준다.
4. 결 론
본 연구에서는 촉매오존화 공정에서 메틸오렌지 제거특성과 그에 미치는 운전변수의 영향을 규명하고자 하였으며 다음과 같은 결론을 얻었다.
1) 메틸오렌지 초기농도가 100 mg/L인 조건에서 활성탄을 활용한 흡착기술은 약 70%의 제거효율을 얻었으나 촉매오존화 및 오존화 처리는 100%의 제거효율을 얻을 수 있는 것으로 나타났다. 반응시간이 90분일 때, 촉매오존화 공정에서는 TOC 제거효율이 58.1%로 오존 처리의 24.8%에 비해 2배 이상 높은 것으로 나타났다.
2) 촉매오존화 공정에서 활성탄 투입량이 증가함에 따라 오존의 자가분해에 의한 OH· 생성이 촉진되므로 메틸오렌지 제거속도가 증가하는 것으로 나타났다. 활성탄의 투입량이 0.3, 0.8, 1.5 g/L으로 증가할 때, 메틸오렌지 분해반응의 속도상수 값은 각각 0.0647, 0.1196, 0.1544 min-1으로 증가하였다.
3) 가스상 오존농도가 증가함에 따라 수용액으로 물질전달이 원활하게 이루어지므로 메틸오렌지 분해속도가 증가하는 것으로 나타났다. 오존농도가 3,000, 5,000, 7,000 ppm으로 증가함에 따라 속도상수 값은 각각 0.0924, 0.1212, 0.1443 min-1으로 증가하였다.
4) pH가 5, 7, 10, 12인 조건에서 메틸오렌지 제거반응의 속도상수는 각각 0.1212, 0.1312, 0.1231, 0.1079 min-1으로 나타나 메틸오렌지 제거반응이 실험된 pH 범위에서 큰 영향을 미치지 않는 것으로 나타났다.
5) TOC 제거효율은 활성탄 투입량과 가스상 오존농도가 증가함에 따라 증가하였으며 7 이상의 pH에서 pH의 변화에 의해 큰 영향을 받지 않는 것으로 나타났다.
Acknowledgements
이 논문은 2016년도 경남과학기술대학교 대학회계 연구비 지원을 받아 수행된 연구로 연구비 지원에 감사드립니다.