알칼리성 폐기물과 해수를 이용한 이산화탄소 포집 및 해양저장
Capture and Ocean Storage of Carbon Dioxide Using Alkaline Wastes and Seawater
Article information
Abstract
본 연구에서는 이산화탄소를 해수와 생석회를 포함하는 알칼리성 폐기물을 이용하여 중탄산 이온으로 변환한 후 해 양에 방류함으로써 친환경적으로 해양에 격리하는 방법을 제안하고자 하였다. 기존의 폐석회석을 이용하여 이산화탄소를 중 탄산 이온으로 중화시키는 방법(석회석 중화반응, accelerated weathering of limestone)에서 폐 석회석 대신 폐 생석회를 이용, 해수 중 다량으로 존재하는 마그네슘 이온을 산화마그네슘으로 침전시키는 공정을 추가하여 단위 해수 당 중탄산 이온의 농 도가 배경 해수의 100배 이상이 되도록 하였다. 이렇게 중탄산 이온이 농축된 해수를 해양에 방류할 경우 자연 희석되거나 밀도류에 의하여 심층으로 이동하게 되어 장기간 해양에 격리된다. 중탄산 이온 해수의 방류에 따른 해양환경영향 연구 및 폐자원을 이용에 따른 불순물 제거 연구 등이 추가적으로 진행된다면, 본 기술은 이산화탄소 지중저장의 대안으로 활용될 수 있을 것으로 기대된다.
Trans Abstract
We investigate the availability of CO2 ocean storage by means of chemical conversion of CO2 to the dissolved inorganic carbon (mainly the bicarbonate ion) in seawater. The accelerated weathering of limestone (AWL) technique, which is accelerating the natural CO2 uptake process through the chemical conversion using limestone and seawater, was proposed as an alternative method for reducing energy-related CO2 emission. The method presented in this paper is slightly different from the AWL method. It involves reacting CO2 with seawater and quicklime obtained from alkaline wastes to produce the bicarbonate- rich solution over 100 times more than seawater, which could be released and diluted into the ocean. The released dense bicarbonate-enriched water mass could subside into the deeper layer because of the density flow, and could be sequestrated stably in the ocean.
서 론
1992년 교토의정서 채택 이후, 산업 활동에 의해 발생하는 대기 중 이산화탄소의 영향에 관한 심각성이 대중적으로 인식되었다. 교토의정서에 이어 2015년 12월 유엔 기후변화협약 당사국 총회(COP21)에서 196개 협약 당사국이 채택한 파리협정은 2100년까지 산업화 이전 대비 지구 온도를 2℃ 이내로 상승 억제할 것을 결의하였다[1~2]. 기후 변화를 효과적으로 대비하는 가장 이상적인 방법은 화석연료를 전혀 사용하지 않는 에너지 체제로의 전환이지만, 세계 각국은 경제 성장을 위하여 기존 석유, 석탄뿐만 아니라 셰일가스, 타르샌드에 이르기까지 꾸준하게 화석연료를 확장하여 사용하고 있다.
현재 화석연료를 기반으로 한 에너지 수요는 유지하면서 기후 변화를 최소화하기 위해서 연구자들은 다양한 CO2 감축 기술을 제안하고 있다. 이를 위하여 에너지 절약, 고효율 발전 기술, 신재생에너지, 생물학적 처리기술 등 다양한 기술이 개발되고 있는데, 특히 최근 미생물 전기화학적으로 폐 유기물을 처리하며 에너지를 회수하는 공정 등이 각광을 받고 있다[3]. 그러나 산업 기반을 유지 발전시켜야 하는 현실에서 단기간 내에 많은 양의 이산화탄소 배출을 저감할 수 있는 기술은 이산화탄소 포집 및 저장 기술(carbon capture and storage, CCS)을 빼놓을 수 없다. CCS 기술은 포집과 저장으로 구분할 수 있다. 포집 기술은 연소 후 포집기술, 연소 전 포집기술, 순산소 연소기술 등으로 이루어진다[4]. 연소 후 포집기술은 연소 후 배기가스에 포함된 이산화탄소를 분리하는 기술로서 기존 발생원에 적용하기에 가장 용이하다. 연소 전 포집기술은 탄소가 포함된 연료를 적절한 반응을 이용하여 이산화탄소와 수소연료로 변환한 후, 이산화탄소를 포집․제거하여 연소시킴으로써 반응 생성물로 이산화탄소가 원천적으로 발생하지 않도록 하는 기술이다. 순산소 연소기술은 연료의 산화제로 공기를 사용하지 않고 질소가 제거된 산소만을 이용함으로써 절대적인 배기가스의 양이 감소되며 배기가스 조성이 이산화탄소와 물만 존재하므로 이산화탄소의 분리 제거가 용이하다. 이렇게 포집된 CO2를 가장 용이하게 대기와 격리하기 위하여 세계 각국은 초임계상태로 유전, 가스전, 염수층 등의 지하공간에 주입․격리하는 지중저장이 활발하게 시도되고 있다. 유전이나 가스전에 저장할 경우 이산화탄소 주입과 동시에 추가적인 원유 또는 가스를 얻을 수 있으므로 저장비용 절약에 기여할 수 있다는 장점이 있으나 지리적 분포의 한계와 더불어 이 과정에서 얻은 자원 또한 사용 후 이산화탄소가 발생되는 문제가 존재한다[4]. 염수층은 화학폐기물 저장 공간으로 사용되어왔으며, 잠재적 저장 용량이 매우 크다는 장점이 있다[4]. 그러나 유전 등에 비해 상대적으로 알려진 바가 적고 대기 중으로의 재방출 가능성이 높다는 단점이 있다. 지중저장과 함께 미네랄과 이산화탄소의 반응을 통해 탄산염광물을 만들어 이산화탄소를 저장하는 방법도 제안되고 있다. 탄산염은 열역학적으로 안정하기 때문에 대기 중으로의 재방출이 거의 발생하지 않는다. 그러나 고온 고압의 반응조건이 필요하며 반응속도가 매우 느리다는 단점이 있다[4].
2000년대 초반 지중저장의 대안으로 석회석 중화반응(neutralization)을 이용하여 CO2를 해양에 저장하는 AWL (Accelerated Weathering of Limestone) 기술이 처음 제안되었다[5~8]. AWL 기술은 Kheshgi [9]에 의하여 발표된 해양에 석회를 살포(ocean liming)하면 효과적으로 대기 중 CO2를 흡수한다는 연구내용에 기초를 둔 것이다. 이는 육상의 석회석을 이용하여 CO2와 해수의 중화반응을 가속시켜 해양에 중탄산(bicarbonate) 이온 형태로 방류하는 AWL 기술로 개선되어 제안되었다[5~8]. Rau 등[6]에 의하면 이 방법은 미국 내 대량 배출원에서 배출하는 CO2의 약 10-20%를 저감할 수 있는 잠재력을 가진다고 평가하였다. 그러나 AWL 공정에서 배출되는 해수의 해양 방류는 육상폐기물의 해양 투기를 원칙적으로 금지하는 런던협약/런던의정서에 의하여 현재 금지되고 있다[10]. 그러나 매년 열리는 해양 투기 관련 국제해사기구 회의에서는 기후 변화를 막기 위한 활동에 한하여 런던의정서의 제한을 완화하기도 한다[11]. AWL 공정을 통한 배출수는 해양의 알칼리도를 높여 해양산성화를 방지하는 기술이기 때문에 그 제한 완화 조항에 포함하기 위하여 런던의정서 과학협동그룹에 꾸준히 제안 중에 있다. 그러나 AWL 배출수를 양식, 어업활동 및 해양 레저 활동이 활발한 연안에 배출할 경우, 그 환경영향에 관한 불확실성과 관련하여 공공 수용성(public acceptance)이 낮은 것은 사실이며, 해양환경에 주는 영향에 관해 연구가 진행 중이다[12].
여기서는 이를 극복하기 위하여 AWL 방법과는 조금 다른 접근을 시도하였다. AWL 기술보다 일정 해수에 훨씬 많은 CO2를 반응시켜 용존 무기탄소(dissolved inorganic carbon, 주로 중탄산 이온)의 농도를 극대화하는 방법으로 그 밀도를 표층 해수보다 높였다. 이는 용존 무기탄소의 농도를 극대화시킨 해수를 연안의 혼합층 아래에 방류하여 밀도류에 의하여 그 수괴(water mass)가 가라앉기 용이하도록 하기 위함이다[13]. 여기서의 반응은 석회석(CaCO3) 대신 생석회(CaO)를 사용한다. 생석회의 경우 석회석보다 경제적이지 못할 뿐만 아니라 생석회 제조공정에서 CO2가 발생하므로 그 사용이 적절치 않을 수 있으나, 철강슬래그 및 건설폐기물 등에 포함된 생석회를 재사용할 경우 경제적으로, 환경적으로 그 단점을 극복할 수 있다.
본 논문에서는 알칼리성 폐기물을 이용하여 해수에 중탄산 이온의 농도를 최대화하기 위한 방법을 기초 실험을 통하여 제시하였다.
2. 실험방법
2.1. CaO 투입량에 따른 해수 중 CO2 변환 실험
우선 알칼리성 물질과 해수를 이용한 CO2 중화반응을 통하여 해수 중 용존 무기탄소의 농도를 극대화하기 위하여 알칼리성 물질(여기서는 CaO 사용) 투입량의 효과를 알아보기로 하였다. 이를 위해, 해수에 넣어준 CaO 양에 따라 CO2가 주로 중탄산(HCO3-) 이온 형태로 존재하는 용존 무기탄소로 변환되는 양을 측정하는 실험을 수행하였다. 6개의 1.5 L의 대형 비이커에 해수 1 kg을 넣고 각각 다른 양의 CaO (0.25, 0.75, 1.25, 2.5, 5.0, 7.5 g)를 넣어준 후 자기 교반기(magnetic stirrer)를 이용하여 30분간 혼합해 주었다. 발전소 배가스의 모사가스(15% CO2 balanced with N2)를 질량유량계(mass flow controller)를 이용하여 500 mL min-1 속도로 넣어주면서, NIST (National Institute of Standards and Technology) 기준으로 보정된 멀티미터(THERMO Orion Star A329 with 8302BN combination electrode and DuraProbeTM 4-electrode conductivity cells)를 이용하여 해수의 pH (National Bureau of Standards scale: NBS scale)를 연속적으로 측정하였다. CaO를 넣은 해수는 pH가 12 이상으로 상승하게 되는데, 이 때 CO2 모사가스를 유입시켜 pH가 7.4가 되면 유입을 멈추고 염분, 온도, pH의 측정은 1시간 정도 더 지속하였다. 그 후 용존 무기탄소 측정을 위하여 0.45 μm 셀룰로오스 아세테이트 필터를 사용하여 반응 후 해수를 필터링하는 방법으로 부유물질을 제거한 후 빈 공간(headspace)이 없이 40 mL 바이알에 가득 채워 테플론으로 코팅된 고무전 마개(open top cap sealed with a rubber septum)로 밀봉하였다. 이 때 미생물 영향을 제거하기 위하여 포화된 염화수은(HgCl2) 용액을 20 μL 넣어주고 분석하기 전까지 4℃ 이하에서 보관하였다. 그리고 반응 중 생성된 침전물은 원심분리기를 이용하여 분리하여 오븐에서 건조하였다. 건조된 침전물은 모두 정량한 후 물질분석을 위하여 한국화학연구원 분석센터(http://www.krict.re.kr)에 의뢰하여 XRD 및 EDS로 분석하였다.
2.2. 해수 전처리 양에 따른 CO2 변환 특성 실험
해수 중 용존 무기탄소의 농도와 과량의 CaO와 반응하는 해수 중 Ca2+ 및 Mg2+ 양의 관계를 추정하기 위하여, 0.5 L에서 4 L에 이르는 비이커에 과량의 CaO (13.0 g)에 다양한 양의 해수(400, 1000, 1300, 1800, 2600, 3300, 3600 g)를 각각 넣어준 후 자기 교반기를 이용하여 30분간 혼합시켰다. 이 용액을 1시간 정치시켜 고체 부유물질이 침전되도록 한 후 400 g의 해수를 남기고 상층액을 제거하였다. 여기에 CO2 모사가스를 흘려준 후 pH가 7.4가 되면 반응을 멈추고 pH의 측정은 1시간 정도 더 지속하였다. 그 후 용존 무기탄소 측정을 위하여 0.45 μm 셀룰로오스 아세테이트 필터를 사용하여 반응 해수를 필터링하여 부유물질을 제거한 후 빈 공간이 없이 40 mL 바이알에 가득 채워 테플론 코팅된 고무전 마개로 밀봉하였다. 이 때 미생물 영향에 의한 분석 오차를 줄이기 위하여 20 μL 포화된 염화수은(HgCl2) 용액을 넣어주고 분석할 때까지 4℃ 이하에서 보관하였다. 또한 Ca2+ 및 Mg2+의 농도를 측정하기 위하여 시료를 0.45 μm의 GF/F 필터를 이용하여 부유물을 제거한 후 20 ml의 바이알에 담아 분석할 때까지 4℃ 이하에서 보관하였다.
2.3. 시료분석방법
용존 무기탄소(dissolved inorganic carbon, DIC)의 농도는 비분산형 적외선 감지기가 포함된 TOC (Shimadzu TOC-LCPH)를 사용하여 분석하였다. 분석값의 농도 분석을 위하여 기기 제조사의 추천방법에 따라 시약급 NaHCO3 및 Na2CO3를 이용하여 농도가 다른 6개의 표준시료(50, 100, 150, 200, 250, 300 mM)를 만들어 보정하였다. 그리고 시료 10개마다 표준시료를 분석하여 분석의 정밀도를 확인하였다. 시료 및 표준시료를 반복 측정하여 얻은 용존 무기탄소 분석값은 ±1% 이내의 정밀도를 얻었다. Ca2+ 및 Mg2+의 분석은 Dionex Ionpac (column: CG16 4 × 250 mm; suppressor: CSRS®300 4 mm)이 장착된 이온 크로마토그래프(Dionex ICS-2100)를 사용하였다. 표준시료(Dionex stock solution) 분석으로부터 계산된 표준오차는 Ca2+의 경우 ±0.03 mM, Mg2+의 경우 ±0.04 mM이었다.
3. 결과 및 토의
3.1. CaO 투입량에 따른 해수 중 CO2 변환 특성
CaO가 투입된 해수는 반응식 (R1)와 같이 CO2가 HCO3-로 변환된다.
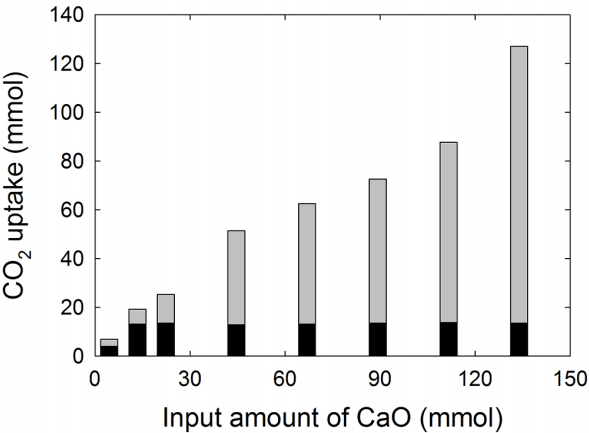
각각 다른 양의 CaO (0.25, 0.75, 1.25, 2.5, 5.0, 7.5 g)를 넣어준 해수 1 kg에 15%의 CO2를 흘려주면서 pH가 7.4가 될 때까지 기다린 후 채취한 해수의 용존 무기탄소의 농도를 Fig. 1에 나타내었다. 여기서 pH 7.4는 해양 중층 이하의 해수가 가지는 일반적인 pH 값으로 해양 환경에 안정적으로 존재하는 값이다. 만약 pH를 7.4 이외의 조건으로 실험하였을 경우 그 총 탄소농도는 감소(pH > 7.4) 또는 증가(pH < 7.4)하였을 것으로 예상할 수 있다. 그러나 pH가 7.4 이하의 값에서는 총 탄소농도는 증가하지만, 해수에 안정적으로 존재하는 중탄산이온(HCO3-) 형태보다는 CO2(aq)가 증가하게 되므로 안정적 격리가 어렵고 해양 pH 변화에 주는 영향이 클 것이므로 최종 pH를 7.4로 고정하였다. Fig. 1의 X축 상단에는 넣어준 CaO의 양을, 하단에는 그에 해당하는 몰수를 표시하였다. 반응식 R1에 의하여 넣어준 CaO 양에 비례하여 용존 무기탄소의 농도가 증가할 것으로 예상하였으나, 실험 결과 CaO의 양과 상관없이 용존 무기탄소 농도는 약 13 mM에서 일정하게 유지되었다(Fig. 1). 이 때 CO2 반응 전과 후에 해수 중 녹지 않는 침전물의 무게를 재고 이 침전물을 채취하여 XRD 및 EDS로 분석한 결과, 침전물의 대부분은 Ca(OH)2와 CaCO3로 이 물질들 외에 극소량의 Mg(OH)2가 존재한다는 것을 알아내었다. 각 물질의 조성비를 침전물 무게와 곱하여 각 물질이 생성된 몰수를 계산하여 Fig. 2에 도시하였다. 해수에 넣어 준 CaO 중 약 13 mmol에 해당하는 양만이 해수 중 용존 무기탄소의 형태(Fig. 2의 검정색 부분)로 존재하고, 거의 대부분은 CaCO3로 전환되어 침전(Fig. 2의 회색부분)되었다. 즉, 해수 중에 CaO를 많이 투입하여도 HCO3- 이온으로 변환되는 양은 극히 일부분이며 대부분 CaCO3로 침전되어 알칼리성 폐기물과 함께 고체로 남게 된다. 이는 CaCO3의 낮은 용해도 때문에 일어나는 현상이다.

Plot of the dissolved inorganic carbon (DIC) concentrations versus input amounts of CaO in 1 kg of seawater bubbled with 15% of CO2 (balanced with N2) until the pH of the seawater arrived at 7.4.
3.2. 해수 중 CO2 변환 반응 중 양이온(Ca2+ 및 Mg2+)의 거동
알칼리성 폐기물을 이용하여 해수 중에 CO2를 용존 무기탄소의 형태로 최대한 변환하기 위한 방법을 찾기 위하여, 변환 반응 중 해수에 존재하는 주요 양이온들의 농도를 측정하는 실험을 수행하였다. 여기에서는 CO2가 해수 중에 용해될 때 존재할 수 있는 탄산이온들(HCO3- 또는 CO32-)과 반응이 가능한 양이온(Ca2+ 및 Mg2+)의 분석을 목적으로 하였다. 해수 1 kg에 과량의 CaO (7.5 g, 약 130 mmol)를 넣어서 stirrer에서 혼합시키면서 15% CO2를 500 ml min-1의 유속으로 흘려주었다. 이 때 pH를 모니터링하고, 5분 간격으로 해수를 채취하여 Ca2+와 Mg2+의 농도를 측정하여 그 결과를 Fig. 3에 나타내었다. 해수 중 Ca2+와 Mg2+의 초기 농도는 각각 약 10 mM과 약 50 mM이었다. 이 해수에 CaO 7.5 g을 넣어준 후에는 Ca2+는 77 mM로 약 67 mM 증가하였고, 약 50 mM이었던 Mg2+는 존재하지 않았다. 이는 CaO가 해수에 용해되어 Ca2+는 67 mM만큼 증가하였고, Mg2+는 CaO가 해수에 녹아 생성된 OH-와 반응하여 Mg(OH)2로 침전되었음을 의미한다. 이 결과는 Table 1의 Ca(OH)2와 Mg(OH)2의 용해도에서 그 반응을 유추할 수 있다. 여기에 CO2를 흘려주면 pH가 서서히 감소하다가 급격히 떨어지는 점에서 Ca2+ 농도는 감소하고, Mg2+의 농도는 증가함을 알 수 있다. 이후 공급된 CO2가 Ca(OH)2 및 Mg(OH)2와 반응하여 CaCO3, MgCO3, 또는 HCO3-로 변환된다. 그 반응식은 R2 , R3과 같다.
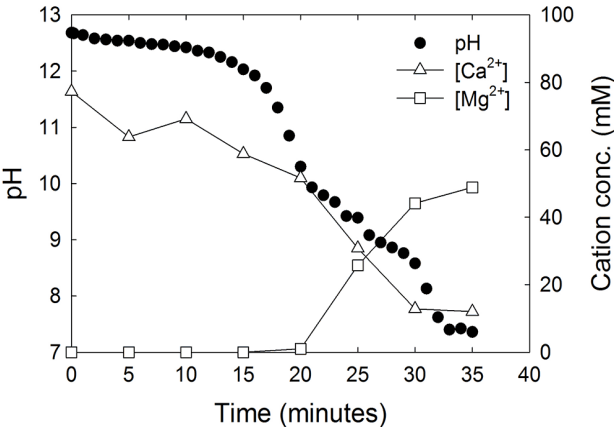
Time course of seawater pH, and concentrations of Ca2+ and Mg2+ during CO2 bubbling (with the flow rate of 500 mL min-1) into 1 kg of seawater added with 7.5 g of CaO until the seawater pH arrived at 7.4.
3.3. 해수 전처리 양에 따른 CO2 변환 특성
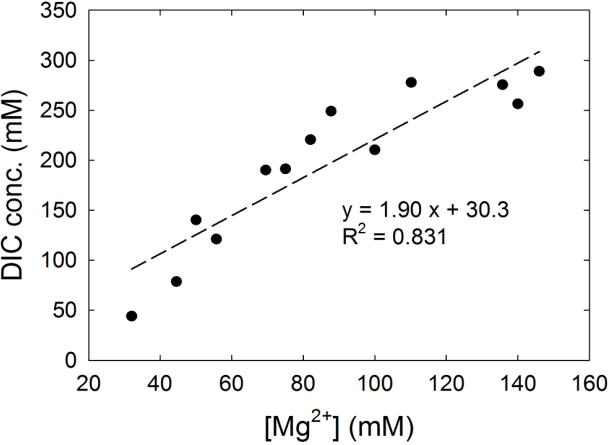
Table 1의 CaCO3와 MgCO3 용해도 상수를 참고하면, CaCO3는 MgCO3에 비해 침전되는 비율이 100배 이상 높기 때문에 해수 중 HCO3-의 농도는 Ca(OH)2의 양이 아니라 Mg(OH)2의 양에 의존함을 알 수 있다. 따라서 해수 중 용존 무기탄소의 농도를 최대화하기 위해서는 Mg(OH)2의 양을 늘려주어야 한다. 알칼리성 폐기물의 CaO를 이용하여 Mg(OH)2의 양을 늘리기 위하여 과량의 해수와 CaO를 반응시키는 (R4), (R5)의 2단계 반응을 거치도록 하였고, 그 전체반응은 (R6)와 같다.
CaO에 비해 MgO (또는 Mg(OH)2)는 알칼리성 폐기물로부터 얻을 수 있는 양이 제한되기 때문에 MgO를 직접 사용하지 않고, 여기서는 CaO와 해수 중 약 50 mM 정도 존재하는 Mg2+를 이용하여 Mg(OH)2로 침전시킨 후 상층에 존재하는 여분의 해수를 제거하는 방법을 사용하였다. pH 7.4에 도달할 때까지 CO2를 흘려준 후 해수 중 용존 무기탄소와 Mg2+ 이온 농도와의 관계를 Fig. 4에 나타내었다. CaO가 제공하는 OH- 이온에 의해 용존 무기탄소의 농도는 다소 높게 측정되었지만, Mg2+와 용존 무기탄소의 기울기가 1.9인 결과(Fig. 4)는 위 반응식 (R3)에 의하여 Mg(OH)2 1 mol 당 용존 무기탄소가 약 2 mol이 생성되었음을 유추할 수 있다.
3.4. 알칼리성 폐기물의 적용
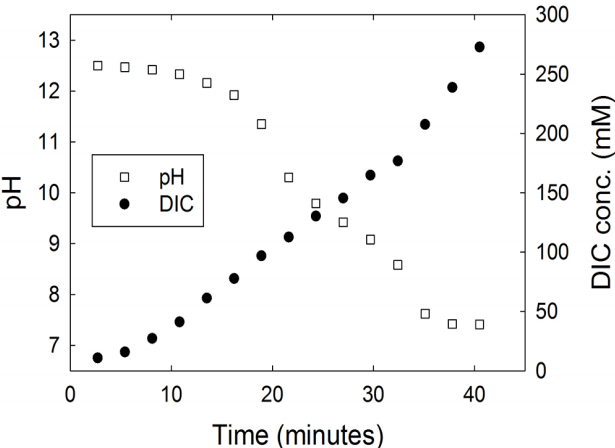
마지막으로 해수 3 kg에 알칼리성 폐기물(철강 슬래그, CaO 48.4 wt%)을 약 100 g 넣어 준 후 stirrer를 이용하여 충분히 혼합한 후 약 2시간 정치시켜 침전물이 가라앉도록 하였다. 그리고 상층 해수 2 kg을 제거한 후 CO2를 pH가 7.4에 도달할 때까지 흘려주었다. 이 때 pH 및 용존 무기탄소 농도의 변화를 Fig. 5에 나타내었다. 실험 결과, (R6) 반응에 따라 해수 중 용존 무기탄소의 농도는 300-350 mM까지 높아지는데, 이는 일반 해수(약 2 mM)보다 약 150배가 농축된 결과로 나타난다. 이렇게 용존 무기탄소의 농도가 높은 해수는 그 밀도가 0.1~0.2% 상승하는데, 이는 동해 해수의 수심별 밀도 분포를 보았을 때 혼합층과 수심 300 m 이하의 밀도 차와 같다[13]. 따라서 이는 수심이 얕은 곳에 반응 후 해수를 배출하였을 때 그 밀도류에 의해서 심층으로 그 수괴가 이동할 수 있을 것으로 예측된다.13) 이 방법은 고농도로 존재하는 용존 무기탄소가 대기와의 평형에 의해 다시 대기 중으로 CO2의 형태로 재방출되는 것을 최소화할 수 있고 어업 및 생물생산이 활발한 연안 환경에 영향을 줄일 수 있을 것으로 기대된다.
4. 결 론
본 연구에서는 해수와 알칼리성 폐기물을 이용하여 석탄화력발전소 등에서 배출하는 CO2를 포집하고 이를 해양에 저장하기 위한 기초 연구를 수행하였다. CO2 해양저장은 우리나라와 같이 지중저장 공간이 부족한 조건에서 대안기술로 사용될 수 있다. 알칼리성 폐기물 중 CaO를 이용하여 해수 중 용존 무기탄소의 농도를 극대화하여 그 밀도를 높인 후 연안의 혼합층 아래에 배출하면 그 수괴는 밀도류에 의해 심층으로 가라앉게 되므로 CO2 저장 측면에 있어 안정성을 가지게 된다[14]. 혼합층 아래보다 표층에 중탄산 이온 해수를 방류하면 비용과 에너지 사용 측면에서 유리하지만, 물질 확산에 의해 대기 중으로 이산화탄소가 방출될 가능성이 존재한다. 그러나 해수의 pH 조건에서 탄산염의 90% 이상이 CO2(aq)가 아닌 HCO3- 형태로 존재하므로 알칼리성 폐기물을 사용하는 본 기술은 대기 중으로의 방출을 최소화 할 수 있다[15].
본 논문에서는 해수의 용존 무기탄소 농도를 극대화하기 위하여 해수, 알칼리성 물질 및 CO2의 반응에 관한 다양한 실험을 수행하였다. 그 결과, 해수의 용존 무기탄소 농도를 극대화하기 위해서 CaO를 과량의 해수와 반응시켜 Mg(OH)2로 전환 침전시킨 후 CO2를 유입하여 해수 중 용존 무기탄소 농도의 약 150배, Mg(OH)2의 전환 침전 과정을 생략하고 CaO만 사용하였을 때보다 약 10배 이상 농축되는 과정을 밝혀내었다. 이는 CaCO3에 비해 100배 이상 높은 용해도를 가지는 MgCO3의 경우에 용존 무기탄소의 농도가 훨씬 높아지기 때문이다. 따라서 Mg(OH)2의 전환 침전이라는 추가 공정을 통하여 해수의 pH를 7.4로 고정하는 조건에서 CO2의 용해도를 100배 이상 높일 수 있게 된다.
발전소 냉각수로 사용되는 해수와 알칼리성 폐기물을 이용하여 Mg(OH)2로 전환 침전 공정을 추가하여 CO2를 반응하면 해수 1톤당 약 13 kg의 CO2를 저장할 수 있다. 이는 Rau 등[6]이 제안한 AWL 공정보다 약 130배(AWL 공정 후 해수 중 총탄소농도: 0.1 kgCO2/해수 1톤) 높임으로써 고밀도의 해수를 연안의 혼합층 아래에 방류하여 밀도류에 의하여 저층에 격리하는 것이 보다 용이하다[13]. 따라서 배출수를 양식, 어업활동 및 해양 레저 활동이 활발한 연안에 배출하기 보다는 혼합층 아래에 방류하는 것이 환경영향에 관한 불확실성을 줄이고, 공공 수용성을 높여 CO2 해양저장 기술의 적용을 실현시킬 수 있을 것이다. 본 논문에서 제안하는 CO2 해양저장 기술의 실증을 위해서는 연속 반응공정과 공정 중 pH에 따른 반응율/속도에 관한 추가적 연구를 통하여 효율적 시스템을 설계하는 것이 중요하다. 또한 본 반응을 거친 배출해수에 관한 해양환경영향에 관한 추가적 연구가 필수적이며, 해양산성화 완화기술로서의 유효성에 관한 연구는 런던협약/의정서의 해양배출금지 완화를 위해 매우 효과적일 수 있다.
Acknowledgements
본 논문은 2011년도 지식경제부의 재원으로 한국에너지 기술평가원(KETEP)의 지원을 받은 연구과제(2011 202000020) 및 2011년도 한국전력공사(KEPCO) 지원을 받은 자체연구 과제(R11VA01)를 통해 수행된 연구입니다.