BAC 공정에서의 고지혈증 치료제 생물분해 특성
Biodegradation of Blood Lipid Lower Agents (BLLAs) in Biological Activated Carbon (BAC) Process
Article information
Abstract
생물활성탄 공정과 안트라사이트를 여재로 사용한 biofilter에서 공탑 체류시간(EBCT)과 수온의 변화에 따른 8종의 고지혈증 치료제류(blood lipid regulator agents, BLLAs)의 생물분해 특성을 평가하였다. 수온 8℃, 16℃ 및 24℃에서 공탑 체 류시간을 5분~15분까지 변화시켰다. 생물활성탄 공정에서 고지혈증 치료제류 8종의 생물분해 제거율은 공탑 체류시간과 수 온의 변화에 많은 영향을 받았으며, 공탑 체류시간과 수온이 증가할수록 생분해 제거율이 증가하였다. 고지혈증 치료제류의 종류에 따른 생물활성탄 공정에서 생분해 제거율은 statin계의 경우 simvastatin이 가장 높았으며 다음으로 mevastatin, fluvastatin 및 atorvastatin 순이었다. 또한, Fibrate계 고지혈증 치료제들의 생물분해능은 fenofibrate가 가장 높았으며 다음으로 gemfibrozil, bezafibrate, clofibric acid순이었다. BAC 공정에서 생물분해 제거능이 가장 낮은 clofibric acid와 atorvastatin의 생물분해 속도 상수(K<sub>bio</sub>;)는 수온이 8℃에서 24℃로 상승하였을 경우, 각각 0.0075 min-1과 0.0122 min-1에서 0.0540 min-1과 0.0866 min-1으로 증가하여 각각 7.2배 및 7.1배 정도 증가하였다.
Trans Abstract
In this study, We investigated the effects of water temperature and empty bed contact time (EBCT) on the biodegradability of 8 blood lipid lower agents (BLLAs) in biological activated carbon (BAC) process. Experiments were conducted at three water temperatures (8℃, 16℃ and 24℃) and three EBCTs (5 min, 10 min and 15 min). Increasing water temperature and EBCT increased the biodegradation efficiency of BLLAs in BAC process. Simvastatin and fenofibrate were the highest biodegradation efficiency, but atorvastatin and clofibric acid were the lowest. The kinetic analysis suggested a pseudo-first-order reaction model for biodegradation of 8 BLLAs at various water temperatures and EBCTs. The pseudo-first-order biodegradation rate constants (kbio) of clofibric acid and atorvastatin were 0.0075 min-1 and 0.0122 min-1 at 8℃, and were 0.0540 min-1 and 0.0866 min-1 at 24℃, respectively. By increasing the water temperature from 8℃ to 24℃, the biodegradation rate constants (kbio) were increased 7.1~7.2 times.
1. 서 론
최근에는 환경중의 잔류 의약물질들로 인한 환경 오염과 환경 독성에 대한 많은 연구가 진행되고 있다. 상수원수 중에 잔존하는 잔류 의약물질들은 의약물질의 생산 및 저장과정에서 유출되거나 가정과 병원에서 유래한 도시하수, 축산폐수 등과 같은 다양한 경로를 통하여 강이나 호소 등과 같은 상수원으로 유입되어 수중에 잔류한다[1~3]. 잔류 의약물질들은 수중에서 장시간 동안 생물학적 활성을 지니면서 잔존하기 때문에 수중 생태계에 지속적인 위해성을 나타낸다[4]. 살충제, 소독제 등과 같은 오염물질들과는 달리 이들 잔류 의약물질들은 수 환경 내에서 수 ng/L~수 μg/L 정도의 농도로 잔존하기 때문에 수생태계에 대해 높은 저항력을 유발하지 않으면서 수생태계에 지속적인 독성을 유발한다[5,6]. 최근에는 분석기술의 발달로 인해 수환경에서 검출되는 잔류 의약물질들의 종류와 검출빈도가 높아지고 있으며, 전 세계적으로 수환경 중에서의 잔류 의약물질들의 검출, 거동, 영향 및 수처리 공정에서의 제거에 대한 연구결과들이 발표되고 있다[7~10].
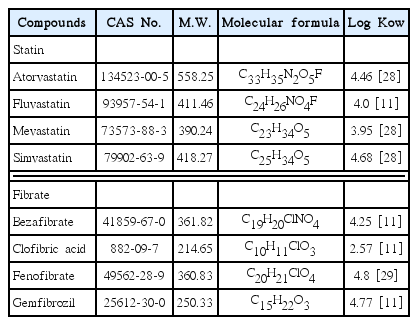
최근에는 여러 잔류의약물질 그룹들 중 고지혈증 치료제들(blood lipid lower agents, BLLAs)에 대한 상수원에서의 검출에 관한 연구결과들이 보고되고 있다[11]. 콜레스테롤 저하나 고지혈증 치료 목적으로 많이 사용되고 있는 이들 BLLA류는 fibrate계와 statin계로 분류된다. 이들은 하수처리 공정에서의 제거율이 50% 이하로 매우 낮아서 강이나 호소수 등과 같은 상수원수 및 수돗물에서도 검출되는 것으로 보고되었다[11~14]. 또한, BLLA류는 잔류 의약물질들 중에서도 높은 Log Kow 값을 가지기 때문에 생체농축성이 강하고, 발암 및 돌연변이원성과 같은 생체독성도 높은 것으로 보고되고 있다[11,15].
상수원으로의 BLLA류 유입경로를 살펴보면 가정 또는 병원에서 유래된 하수 중에 함유된 BLLA류가 하수처리 공정상에서 완전히 제거되지 못하고 강이나 호수 등의 상수원으로 방류되기 때문이다[8,12,16]. 스페인의 5개의 강을 대상으로 하수처리장 방류수의 영향을 받는 몇몇 지점들에서의 9종의 BLLA류 검출현황을 조사한 Valcárcel 등의 연구결과에서 9종 각각의 검출농도가 수십~수천 ng/L(총 BLLA류 농도: 2,940~25,784 ng/L)로 보고하고 있다[17]. 국내 낙동강에서는 대도시 하수처리장 방류수의 영향을 받는 몇몇 본류와 지류들에서 수~수십 ng/L의 농도로 검출되는 것으로 보고되었다[18].
수처리 공정에서의 BLLA류에 관한 연구는 산화(oxidation)공정과 생물분해 공정에서의 거동 및 반응 부산물들 평가 등이 대부분이며[19~23], 다른 잔류의약물질들에 비해서 연구결과들이 매우 저조한 편이다.
정수처리 공정에 적용되고 있는 생물활성탄(biological activated carbon, BAC) 공정은 활성탄의 표면과 세공에 다양한 종속영양성 박테리아들이 부착되어 유기성 오염물질의 생물학적 제거능을 극대화시켜 수중의 다양한 미량 오염물질들에 대해 높은 제거능을 나타내는 것으로 보고되고 있으며, 국내 대규모 정수장들에 도입되어 운전되고 있다[24~27].
본 연구에서는 재래식 정수처리 공정에서 제거율이 낮은 BLLA류가 정수장의 생물학적 처리공정인 BAC 공정으로 유입되었을 경우를 대비하여 BAC 공정의 제거효율에 큰 영향을 미치는 수온과 공탑 체류시간(empty bed contact time, EBCT)을 다양한 조건으로 변화시켜 이에 따른 8종의 BLLA류의 생물분해 제거 특성을 조사하였다.
2. 실험재료 및 방법
2.1. BLLA류 및 유입수 성상
실험에 사용된 BLLA류들은 statin계인 fluvastatin, mevastatin, atorvastatin, simvastatin 4종 및 fibrate계 clofibric acid, bezafibrate, gemfibrozil, fenofibrate 4종이다. Clofibric acid는 Sigma-aldrich (USA)사의 특급시약( ≥ 97%)을 사용하였고, 나머지 7종은 TCI (Tokyo chemical industry, Japan)사의 특급시약( ≥ 97%)을 사용하였다. Table 1에는 실험에 사용된 8종의 BLLA류에 대한 물리・화학적인 특성을 나타내었다.
유입수는 300 m3/일 처리 규모 파일럿의 후오존 처리수를 사용하였으며, 후오존 처리수에 BLLA류 8종을 투입하여 BAC와 biofilter로 유입되는 BLLA류 각각의 농도가 1,000 ng/L가 되도록 하였다. 실제 정수장에서의 BAC 공정과 동일한 조건으로 운전하기 위해서 후오존 처리수를 사용하였으며, Table 2에는 유입수로 사용된 후오존 처리수의 특성을 나타내었다.
2.2. BAC 및 biofilter 성상 및 운전
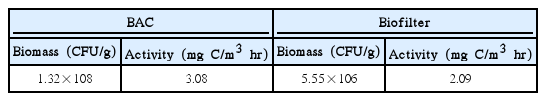
BAC (F400, Calgon, USA) 및 안트라사이트-biofilter(한국안트라사이트)는 300 m3/일 처리규모의 pilot-plant에서 대략 3.5년 정도 사용한 것으로 운전한 bed volume은 190,000정도이다. Table 3에는 3.5년 정도 사용된 BAC와 biofilter의 수온을 20℃로 조절하여 7일간 순응시킨 후 부착 박테리아의 생체량(biomass)과 활성도(activity) 측정 결과를 나타내었다. Table 3의 결과에서 BAC가 안트라사이트(biofilter)에 비해 생체량 및 활성도가 각각 23.7배와 1.5배 정도 높게 나타나 부착 박테리아의 특성에 다소 차이를 나타내었다.
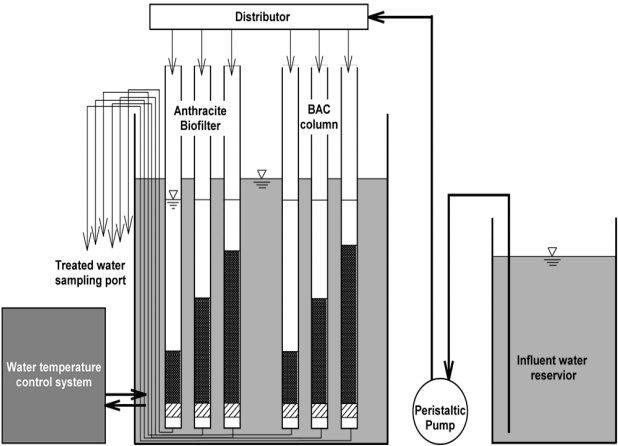
BAC 및 biofilter 컬럼의 운전은 수온 조절이 가능한 80 L용량의 수조에 유입수로 사용된 후오존 처리수를 채운 후 BLLA류 8종을 각각 1,000 ng/L의 농도로 투입・희석하였다. 정량펌프(MASTER FlexⓇ L/S, Cole-Parmer, USA)를 사용하여 각각의 컬럼(투명 아크릴 재질, 직경 2 cm, 길이 20 cm)으로 3 mL/min 씩 균등하게 분배되도록 하였다. BAC와 biofilter의 EBCT가 5, 10, 15분이 되도록 각각의 컬럼에 BAC와 안트라사이트를 각각 15, 30, 45 mL 씩 충진하여 하향류 방식으로 운전하였으며, Fig. 1에 시스템의 개략도를 나타내었다. 역세척은 주 1회 실시하였고, 공세는 실시하지 않았다. 컬럼 내부의 수온 조절을 위해 수온조절 장치(Buchi, Recirculating chiller B-740, Swiss)를 사용하여 Fig. 1과 같이 수온을 8℃, 16℃ 및 24℃로 조절하였고, 수온을 조절한 후에는 변화된 수온에서의 부착 박테리아들의 순응을 위하여 7~10일 정도의 순응기간을 거친 후 실험을 실시하였다.
2.3. 회분식 생물분해 실험
8종의 BLLA류들의 생물분해능 테스트를 위해 300 mL 용량의 BOD병을 이용하여 회분식 실험을 수행하였다. 회분식 생물분해 실험을 위해 8종의 BLLA류를 300 mL BOD병에 각각 10,000 ng/L의 농도로 투입한 초순수를 200 mL 채운 후 영양염 혼합액을 투입하여 박테리아 생장에 필요한 영양염류를 공급하였다[30].
회분식 생물반응기의 박테리아 식종(inoculation)을 위해 3.5년 정도 운전한 pilot-plant BAC 여과지의 상층부에서 생물활성탄 1 g(습중량)을 채집하여 20 mL의 생리식염수에 투입, 초음파 처리하여 박테리아들을 탈리[31]시켜 2.0 μm 멤브레인 필터(Millipore, USA)로 여과한 여액(식종액)을 200 mL의 시료수에 2 mL 투입하였다. 식종된 생물 반응기는 20℃, 150 rpm의 조건(shaking incubator, HB201SF, 한백과학)으로 운전하면서 배양기간에 따른 BLLA류의 생물분해능을 조사하였다[32].
2.4. BLLA류 분석
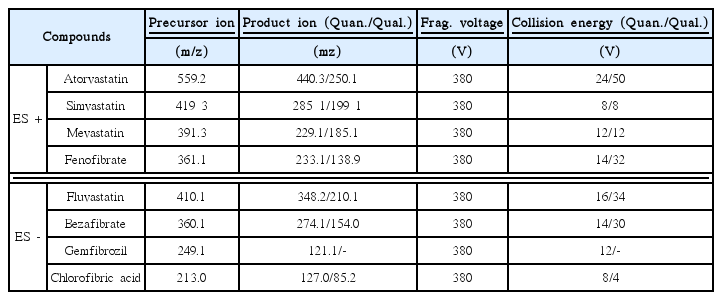
8종의 BLLA류 분석에는 online SPE 시스템이 장착된 LCMS/MS (LC: Agilent, 1260, MS/MS: Agilent, 6490, USA)를 사용하였다. 시료수 900 μL를 online SPE로 주입, 농축한 후 LC 이동상을 이용하여 SPE 카트리지에 농축된 BLLA류를 탈착시켜 LC 컬럼으로 주입되도록 하였다. BLLA류 8종의 분리를 위해 Extend-C18 column (Agilent, 2.1 mm × 100 mm, 3.5 μm)을 사용하였으며, Table 4에 LC/MS-MS의 분석조건을 나타내었다. 또한, MS-MS 분석에 사용된 각각의 BLLA류의 precursor ion 및 product ion의 분자량과 fragment voltage 및 collision energy 값을 Table 5에 나타내었다. BLLA류의 정량한계(limit of quantification, LOQ)는 1~10 ng/L 범위였다.
3. 결과 및 고찰
3.1. 회분식 실험에 의한 BLLA류의 생물분해 특성 평가
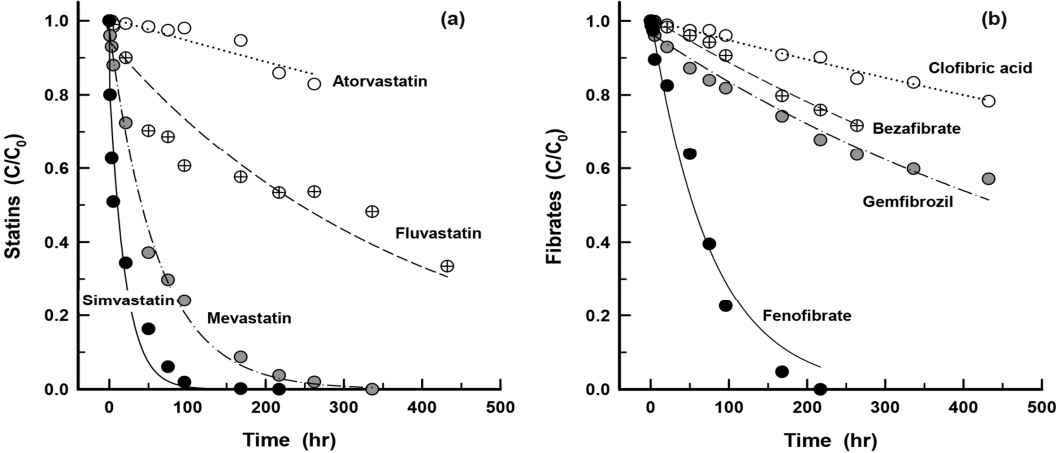
회분식 생물반응기에서의 배양시간 경과에 따라 statin계 4종과 fibrate계 4종의 생물분해 특성을 Fig. 2에 나타내었다. Fig. 2(a)에서 볼 수 있듯이 statin계의 경우 simvastatin이 가장 빠른 생물분해능을 나타내었으며, 다음으로 mevastatin, fluvastatin 및 atorvastatin순이었다. 또한, Fig. 2(b)에 나타낸 fibrate계 4종의 경우는 fenofibrate가 배양 200시간 후에 완전히 생물분해되었고, gemfibrozil과 clofibric acid의 경우는 배양 432시간 후에 각각 초기 농도의 43% 및 22% 정도가 생물분해되었다.
일반적으로 생물분해에 영향을 미치는 물질의 특성으로는 용해도(water solubility), 친지질성(lipophilicity), 박테리아가 분비하는 효소와의 친화도(affinity) 및 향균 효과(antimicrobial effect) 등이 있다[26]. 박테리아의 세포막은 친지질성을 나타내기 때문에 친지질성 물질들은 박테리아들에 의한 흡수능이 증대되며[24,27], 효소 친화도 역시 박테리아의 세포막을 통해 박테리아 체내로 흡수된 물질을 분해 및 변형시키는 중요한 역할을 한다. 또한, 물질이 나타내는 향균 효과는 생물학적 처리에서 매우 중요한 작용을 하는 인자로 향균 효과를 나타내는 물질들은 미생물에 위해를 가해 유기성 오염물질 분해능을 저감시킨다[26].
Fig. 2(a)에 나타낸 atorvastatin과 Fig. 2(b)에 나타낸 clofibric acid는 다른 BLLA류들에 비해 매우 낮은 생물분해율을 나타내고 있어 이들 두 물질들은 생물분해에 대해 내성을 가지는 것으로 나타났다. Statin계 BLLA류는 구조적으로 락톤기(-COO-) 또는 개환된(open-ring) 하이드록시산을 관능기로 가지는 2가지 형태이다. 불안정하고 반응성이 높은 락톤기를 가지는 statin계 BLLA류는 하이드록시산 관능기를 가지는 statin계 BLLA류에 비해 쉽게 생분해되는 것으로 보고되고 있으며[33], Statin계 BLLA류 중에서 락톤기를 가지고 있는 물질로는 simvastatin과 lovastatin이 있다. 본 연구에서 결과로 나타내지는 않았으나 lovastatin은 simvastatin과 거의 유사한 생물분해율과 경향을 나타내었다.
Fibrate계 BLLA류에서 clofibric acid의 경우는 여러 연구결과들[23,34]에서 다양한 생물학적 처리공정에서의 제거율이 매우 저조한 것으로 보고되고 있고, gemfibrozil과 bezafibrate는 생물학적 하수처리공정인 활성슬러지 공정 및 MBR 공정에서 0%~90% 정도의 제거율 나타내는 것으로 보고되었으며, 이처럼 제거율에 많은 차이를 나타내는 이유로는 유입 농도, 생물분해 및 생물흡착에 기여하는 활성슬러지 농도 등의 조건이 생물학적 처리효율에 많은 영향을 미친 것으로 보고하고 있다[35]. 스페인의 7개 하수처리장을 대상으로 다양한 PPCP류에 대해 제거율을 조사한 Gros 등의 연구결과[36]에서는 gemfibrozil과 bezafibrate의 제거율이 각각 30%~99% 및 23%~99%로 두 물질의 경우 본 연구에서와 같이 유사한 제거율을 나타내었다. 또한, 하수처리장의 MBR 공정에서 fibrate계 3종(bezafibrate, clofibrate, fenofibrate)에 대한 제거실험을 수행한 Schröder의 연구결과[37]에서 fenofibrate는 완전 생물분해되어 MBR 처리수에서 검출되지 않았으나 bezafibrate는 유입수에 비해 유출수에서는 소폭 감소된 농도로 검출되어 생물분해에 대해 내성을 가지며, 구조상으로 서로 유사하더라도 약간의 구조적 차이에 의해 생물학적 제거율에는 큰 차이가 유발되는 것으로 보고하고 있다.
3.2. BAC 공정에서 EBCT 변화에 따른 BLLA류 생분해 특성
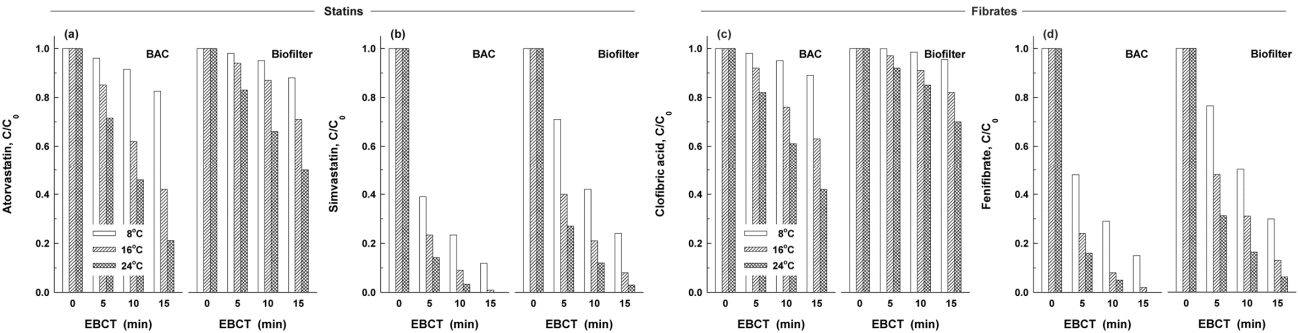
유입수의 수온이 16℃일 때 BLLA류 8종을 각각 1,000 ng/L의 농도로 투입하여 BAC 및 biofilter에서의 EBCT 5분~15분에 대한 제거율을 조사하였으며, Fig. 3(a)~(h)에는 statin계 4종과 fibrate 4종에 대한 생분해 특성을 나타내었다.
BAC 공정에서의 EBCT 변화에 따른 BLLA류 8종의 제거율 변화를 살펴보면 statin계의 경우 atorvastatin (Fig. 3(a))이 15% (EBCT 5분)~58% (EBCT 15분)의 제거율을 나타내어 statin계 4종 중 가장 낮은 제거율을 보였으며, simvastatin (Fig. 3(d))이 EBCT가 5분에서 15분으로 증가할수록 제거율은 77%에서 99%로 증가하여 statin계 4종 중 가장 높은 제거율을 나타내었다. 또한, fibrate계의 경우는 clofibric acid (Fig. 3(e))가 8% (EBCT 5분)~37% (EBCT 15분)의 제거율을 나타내어 가장 낮은 제거율을 보였으며, fenofibrate가 76% (EBCT 5분)~98% (EBCT 15분)의 제거율을 나타내어 fibrate계 4종 중 가장 낮은 제거율을 나타내었다.
EBCT 변화에 따른 biofiltration 공정에서의 BLLA류 8종의 제거 특성을 평가해 보면, BAC 공정에서와 마찬가지로 atorvastatin과 clofibric acid가 가장 낮은 제거율을 나타내었으며, 5분에서 15분으로 EBCT가 증가할수록 제거율은 각각 6%~29% 및 3%~18%로 나타났다. 또한, simvastatin과 fenofibrate가 가장 높은 제거율을 나타내었으며, 5분~15분의 EBCT에서의 제거율이 각각 62%~92% 및 52%~87%로 나타났다.
안트라사이트는 거의 세공(pore)이 없는 반면 활성탄의 경우는 매우 큰 세공용적을 가지고 있어서 안트라사이트에 비해 활성탄에 박테리아의 부착하여 서식이 가능한 공간이 훨씬 크다. 또한 활성탄의 경우는 유기성 오염물질에 대한 높은 흡착능으로 인해 부착 박테리아들의 유기탄소원 공급 능력이 안트라사이트 보다 우수하여 생체량과 활성도가 현저히 높다[31]. 생분해 메카니즘의 경우는 안트라사이트-biofilter에서는 여재 표면에 부착된 박테리아 군집들이 수류 흐름에 의해 전달되는 용존 유기물질(유기 탄소원)을 직접 제거하는 메카니즘이며 반면에, 다공성 여재인 활성탄의 경우는 활성탄 표면뿐만 아니라 공극(pore) 내에 박테리아들이 많이 군집하여 직접적인 생분해뿐만 아니라 세공의 흡착력에 의해 세공에 흡착된 유기 오염물질들을 서서히 생물분해시켜 제거하는 간접적인 생분해 메카니즘도 가진다. 따라서 BAC와 안트라사이트-biofilter 공정과의 제거율 차이는 위에서 기술한 여재 및 생물분해 메카니즘 차이에 의해 기인된 것이다[31].
3.3. BAC 공정에서 수온 변화에 따른 BLLA류 생분해 특성
유입수의 수온변화에 따른 BLLA류 8종에 대한 BAC와 biofilter에서의 생물분해 특성 평가하였으며, atorvastatin, simvastatin, clofibric acid 및 fenofibrate 4종에 대한 결과를 Fig. 4에 나타내었다. 수온변화에 따른 BAC와 biofilter에서의 atorvastatin의 생물분해 특성을 나타낸 Fig. 4(a)를 보면 수온이 8℃, 16℃ 및 24℃일 때 EBCT 5분~15분에서의 BAC 컬럼에서 생물분해율은 각각 4%~18%, 15%~58% 및 28%~79%를 나타내어 수온이 24℃에서 8℃로 저하됨에 따라 생물분해에 의한 제거율은 EBCT 5분에서는 24% 정도, EBCT 15분에서는 61% 정도 감소하는 것으로 나타났다. 또한, Biofilter 컬럼에서의 수온이 24℃에서 8℃로 저하될 경우, EBCT 5분에서의 제거율은 17%에서 2%로 15% 정도 감소하였고, EBCT 15분의 경우는 제거율이 50%에서 12%로 38% 정도 감소하였다.
Statin계 물질들 중에서 가장 높은 생물분해능을 나타낸 simvastatin의 생물분해 특성을 나타낸 Fig. 4(b)를 보면 수온이 8℃, 16℃ 및 24℃일 때 EBCT 5분~15분에서의 BAC 컬럼에서 생물분해율은 각각 61%~88%, 77%~99% 및 86%~100%를 나타내어 수온이 24℃에서 8℃로 저하됨에 따라 생물분해에 의한 제거율은 EBCT 5분에서는 25% 정도, EBCT 15분에서는 12% 정도 감소하는 것으로 나타났다. 또한, Biofilter 컬럼에서의 수온이 24℃에서 8℃로 저하될 경우, EBCT 5분에서의 제거율은 73%에서 29%로 44% 정도 감소하였고, EBCT 15분의 경우는 제거율이 97%에서 76%로 21% 정도 감소하였다.
Fig. 4(c)와 (d)에 나타낸 fibrate계 clofibric acid와 fenofibrate의 경우도 생물분해 제거율의 차이만 있을 뿐 Fig. 4(a)와 (b)에 나타낸 atorvastatin 및 simvastatin과 유사한 경향을 나타내었다. Clofibric acid의 경우, 수온이 24℃에서 8℃로 저하 시에 BAC 컬럼에서의 생물분해 제거율은 EBCT 5분일 때는 18%에서 2%로 감소하였고, EBCT 15분일 때는 58%에서 11%로 감소하였다. 또한, fenofibrate의 경우는 EBCT 5분일 때는 제거율이 84%에서 52%로 32% 정도 감소하였고, EBCT 15분일 때는 제거율이 100%에서 85%로 15% 정도 감소하였다.
Atorvastatin과 clofibric acid와 같이 생물분해에 내성을 가지는 BLLA류들은 수온이 24℃ 정도의 고수온기에도 BAC 공정의 EBCT 15분에서 각각 79%와 58% 정도만이 제거되어 BAC 공정에서 이들의 제어가 어려웠다. 따라서 정수처리 공정으로 이들이 고농도로 유입되거나 BAC 공정의 운전효율이 낮은 저온기에 유입될 경우에는 BAC 공정의 EBCT를 최대한 연장하여 운전해야 하며, 추가적으로 분말활성탄 투입이나 염소나 오존 같은 전산화 공정[38,39]에서 산화제 투입량을 증가시켜 운전해야 정수처리 공정에서의 적절한 제어가 가능할 것으로 판단되었다.
3.4. BAC 공정에서 BLLA류의 생물분해 동력학 평가
Fig. 4에서 도출된 결과를 이용하여 BAC 및 biofilter 공정에서 수온변화에 따른 BLLA류 8종에 대한 생물분해 속도상수(biodegradation rate constant, kbio)를 구하였다(식 1).
C는 반응시간 후의 농도, C0는 초기 농도, kbio는 생물분해 속도상수, t는 반응시간(EBCT)이다. 또한, BLLA류 8종의 50% 제거시점인 반감기(half-life, t1/2)를 식 (2)로 구하였다.
BAC와 biofilter 유입수의 수온이 8℃, 16℃ 및 24℃일 때의 8종의 BLLA류들의 생물분해 속도상수(kbio)와 반감기(t1/2)를 Table 6에 나타내었다. 수온이 8℃, 16℃ 및 24℃일 때, fibrate계 중에서 가장 낮은 생물분해율을 나타낸 clofibric acid의 경우는 BAC 컬럼에서 kbio와 t1/2이 각각 0.0075 min-1과 92.4 min, 0.0302 min-1과 22.9 min 및 0.0540 min-1과 12.8 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0030 min-1과 231.0 min, 0.0128 min-1과 54.1 min 및 0.022 min-1과 31.5 min이었다. 또한, fibrate계 중에서 가장 높은 생물분해율을 나타낸 fenofibrate의 경우는 BAC 컬럼에서 수온 8℃, 16℃ 및 24℃일 때, kbio와 t1/2이 각각 0.1313 min-1과 5.3 min, 0.2773 min-1과 2.5 min 및 0.3582 min-1과 1.9 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0730 min-1과 9.5 min, 0.1307 min-1과 5.3 min 및 0.2095 min-1과 3.3 min이었다.
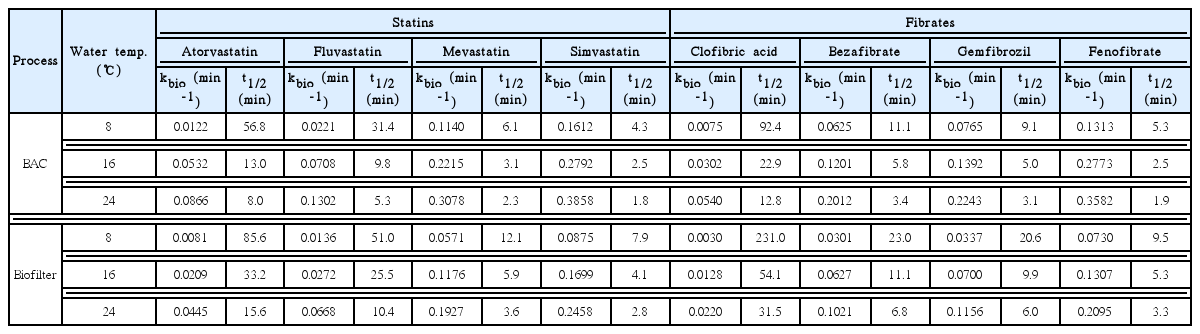
Biodegradation rate constants (kbio) and half-lives (t1/2) for 8 BLLAs at various water temperatures and processes
Statin계 중에서 가장 낮은 생물분해율을 나타낸 atorvastatin의 경우, 수온이 8℃, 16℃ 및 24℃일 때 BAC 컬럼에서 kbio와 t1/2이 각각 0.0122 min-1과 56.8 min, 0.0532 min-1과 13.0 min 및 0.0866 min-1과 8.0 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0081 min-1과 85.6 min, 0.0209 min-1과 33.2 min 및 0.0445 min-1과 15.6 min이었다. 또한, statin계 중에서 가장 높은 생물분해율을 나타낸 simvastatin의 경우, 수온이 8℃, 16℃ 및 24℃일 때 BAC 컬럼에서 kbio와 t1/2이 각각 0.1612 min-1과 4.3 min, 0.2792 min-1과 2.5 min 및 0.3858 min-1과 1.8 min이었으며, biofilter 컬럼에서는 kbio와 t1/2이 각각 0.0875 min-1과 7.9 min, 0.1699 min-1과 4.1 min 및 0.2458 min-1과 2.8 min이었다.
4. 결 론
정수처리 공정에서 생물학적 처리공정으로 널리 이용되고 있는 BAC 공정과 biofilter 공정에서의 EBCT 및 수온변화에 따른 BLLA류 8종에 대한 생물분해 특성을 조사한 결과, 다음과 같은 결론을 얻을 수 있었다.
1) 생물활성탄 공정에서 BLLA류 8종의 생물분해율은 EBCT와 수온에 따라 큰 영향을 받았으며 EBCT와 수온이 증가할수록 생물분해율은 급격히 증가하였다.
2) BAC 공정에서 statin계 BLLA류들의 생물분해능은 simvastatin이 가장 높았으며 다음으로 mevastatin, fluvastatin 및 atorvastatin 순이었다. 또한, fibrate계의 경우는 fenofibrate의 생물분해능이 가장 높았으며 다음으로 gemfibrozil, bezafibrate, clofibric acid 순으로 나타났다.
3) BAC 공정에서 셍물분해능이 가장 낮은 clofibric acid와 atorvastatin의 생물분해 속도상수(kbio)는 수온이 8℃에서 24℃로 상승하였을 경우, 각각 0.0075 min-1과 0.0122 min-1에서 0.0540 min-1과 0.0866 min-1으로 증가하여 각각 7.2배 및 7.1배 정도 증가하였다.
4) 수온이 8℃일 때, BAC 공정에서 clofibric acid와 atorvastatin의 생물분해 반감기(t1/2)가 각각 92.4분과 56.8분으로 나타나 저수온기에 clofibric acid와 atorvastatin이 정수장의 BAC 공정으로 유입될 경우에는 유입된 농도의 대부분이 제거되지 않고 유출될 가능성이 높았다.