1. 서 론
정수처리 공정에서 운영되고 있는 생물활성탄(biological activated carbon, BAC) 공정은 활성탄 표면과 세공에 다양한 박테리아들이 자연적으로 서식하며 형성된 생물막에 의해서 수중의 오염물질이 분해되어 제거되는 원리이다[1]. BAC에 형성된 활성 생물막은 수중에 잔존하는 다양한 오염물질들에 대해 우수한 제거능을 나타낸다[1]. 즉, 수중에 잔존하는 소독부산물 전구물질을 비롯한 다양한 유기물질들, 이취 유발물질, 잔류 의약물질, 개인위생용품 첨가물질, 내분비계 장애물질, 암모니아성 질소, 용존 망간 등의 제거뿐만 아니라 관망에서의 미생물 재성장능 저감 목적으로 적용되고 있다[1-4].
BAC 공정의 제거효율에 영향을 미치는 인자들로는 활성탄의 재질, 접촉시간, 역세척, 수온, 제한 영양물질 등 다양하며, 이러한 영향인자들은 생물막의 특성에 영향을 미쳐 오염물질 제거능에 변화를 초래한다[2,3,5,6].
최근에는 BAC 공정의 효율증진 목적으로 강화 BAC 공정에 대해 많은 연구가 진행 중이다. 강화 BAC 공정은 유입수에 영양염(N, P) 또는 과산화수소를 투입하여 BAC에 형성된 생물막의 생체량과 활성을 증진시켜 BAC 공정의 제거효율 상승을 유도하는 원리이다[7,8]. BAC 공정 유입수 중에 인(P) 농도가 충분하지 않은 경우, 생물막의 물리적 구조와 형태가 변형되어 손실수두 증가와 오염물질 제거능이 감소된다[9]. 일반적으로 박테리아의 증식 및 생장에 필요한 C (BDOC):N (NH4-N):P (PO4-P)는 100:10:1(화학량론적인 질량농도 비=1 mg/L:0.117 mg/L:0.026 mg/L)로 보고되고 있다[10].
또한, BAC 공정 강화목적으로 사용되는 과산화수소는 부착 생물막으로의 추가적인 용존산소 공급원으로 작용할 뿐만 아니라 생물막에 서식하는 특정 미생물 군집이 유기 화합물의 산화를 촉진시키도록 과산화 효소 발현을 유도한다[11]. 이전의 연구결과들에서 저농도(1 mg/L 이하)로 투입된 과산화수소는 생물막 내 활성 생체량의 생물학적 활성은 유지시키면서 비활성 생체량에 대해서는 효과적으로 산화・제거시키는 것으로 보고되고 있다[12,13].
정수장의 응집공정에서 사용되는 응집제들은 수중에 저농도로 잔존하는 인(P)을 매우 효과적으로 제거하기 때문에 응집/침전 공정의 후단에 위치한 BAC 공정 유입수 중의 인(P) 농도는 0.01 mg/L 미만이다[14]. 후오존 처리수 중의 BDOC (biodegradable dissolved organic carbon) 농도가 0.38 mg/L보다 높을 경우 인(P)이 제한인자로 작용하여 효율적인 BDOC 제거능을 기대할 수 없기 때문에 인(P)의 보충이 필요하다.
본 연구에서는 낙동강 하류에 위치한 300 톤/일 규모의 pilot-plant에서 기존 BAC 공정과 인과 과산화수소를 투입하는 강화 BAC 공정에서의 생물막 특성과 BDOC 제거능을 동일한 운전조건에서 비교・평가하였다. 특히, (1) 생물막 손상에 따른 부착 생물막 회복능, (2) 부착 생물막의 생체량과 활성도, (3) BDOC 제거능, (4) 생물막의 안정도를 비교・평가하여 낙동강 하류에 위치한 대규모 정수장들의 노후화된 O3/BAC 공정의 운전효율 증대를 위한 적용가능성을 평가하였다.
2. 실험재료 및 방법
2.1. 실험재료
2.1.1. BAC용 활성탄
BAC용 입상활성탄은 낙동강 하류에 위치한 정수장의 오존/BAC 공정에서 2년 정도 사용한 것으로 BAC 여과지 표층 10 cm 이내에서 채집하였다. 채집한 BAC를 수돗물로 여러 번 세척한 후 수돗물에 침지시켜 7일간 수돗물을 매일 2회 갈아주면서 BAC 부착 생물막의 생체량과 활성도를 인위적으로 저하시켰다. 이는 BAC 강화 조건에 따른 운전 초기의 생물막 회복능을 평가하기 위함으로 부착 생물막의 생체량과 활성도 저하과정을 거친 후의 생물막의 생체량(n=3)과 활성도(n=3)는 각각 1.47±0.29 µg・ATP/g・GAC 및 1.13±0.24 mg・C/m3・h이었다.
2.1.2. 후오존 처리수 성상
BAC 공정으로 유입되는 후오존 처리수는 300 톤/일 처리규모 pilot-plant의 후오존 처리수를 사용하였다. 실험기간(2019년 4월~2019년 12월) 동안의 후오존 투입농도는 BDOC 생성율이 높은 것으로 보고된 오존 투입농도인 1 mg・O3/mg・DOC로 고정하여 운전하였으며[15], 1주일에 3번 후오존 공정으로 유입되는 모래여과수의 DOC 농도를 측정하여 후오존 투입농도를 조절하였다. 후오존 공정에서의 체류시간은 15분이며, 후오존 공정 후단에 저류조가 있어 잔류오존이 완전히 소모된 후 각각의 BAC 컬럼들로 후오존 처리수가 공급된다. 실험기간 동안의 후오존 처리수 성상을 Table 1에 나타내었다. DOC 농도범위는 2.14~3.05 mg/L, 평균 2.59 mg/L였으며, BDOC 농도범위는 0.32~0.83 mg/L, 평균 0.63 mg/L였다. 수온은 7~26℃였다.
2.1.3. BAC 컬럼 시스템 및 운전
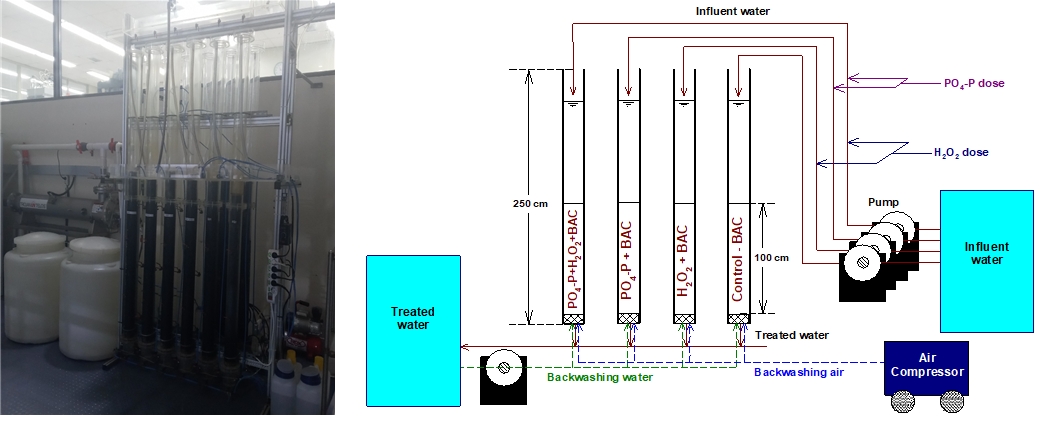
본 실험에 사용된 BAC 컬럼 시스템은 Fig. 1에서 볼 수 있듯이 내경 20 cm, 높이 250 cm의 아크릴 컬럼 4개를 사용하였으며, 후오존 저류조에서 이송된 후오존 처리수가 각각의 BAC 컬럼들 상부로 공급되는 하향류 방식으로 운전하였다. 각각의 BAC 컬럼에 층고 100 cm가 되도록 BAC를 충진하여 공탑체류시간(empty bed contact time, EBCT) 20분으로 고정하여 운전하였다. 역세척은 공세 3분 및 수세 10분의 조건으로 주 1회 실시하였다.
4개의 BAC 컬럼들은 인(PO4-P)과 과산화수소(H2O2)를 투입하지 않는 기존 BAC 컬럼(control-BAC), H2O2를 투입하는 강화 BAC 컬럼(H2O2+BAC), PO4-P를 투입하는 강화 BAC 컬럼(PO4-P+BAC) 및 PO4-P와 H2O2를 함께 투입하는 강화 BAC 컬럼(PO4-P+H2O2+BAC)이며, 병렬로 설치하여 운전하였다. PO4-P와 H2O2는 각각의 BAC 컬럼으로 이송되는 후오존 처리수 공급라인에 정밀유량 펌프(MasterflexⓇL/SⓇ, Cole-Parmer, USA)를 설치하여 각각의 강화 BAC 컬럼들의 운전조건에 맞춰 인과 과산화수소를 투입하였다.
PO4-P를 투입하는 강화 BAC 컬럼들에는 유입수에 추가적으로 0.010 mg/L의 PO4-P가 더 공급되도록 PO4-P를 투입하였다. 이전의 연구들에서는 응집/침전/모래여과 공정에서 제거되지 않고 후단으로 유입된 수산화알루미늄에 의한 PO4-P 흡착 방지와 BAC 생물막으로의 일관된 PO4-P의 전달을 위해 BAC 공정에서 필요한 PO4-P의 요구량의 2배 이상의 PO4-P를 투입하였다[7]. 그러나 본 연구에서는 과량으로 투입된 PO4-P는 배・급수관망으로의 유출되어 미생물 재성장을 유발할 가능성 때문에 실제 정수장 적용에 한계가 있어 낙동강 하류에 위치한 정수장의 후오존 처리수 중에 함유된 BDOC 농도(최대 0.55 mg/L)를 기준으로 0.010 mg/L를 투입하였다. 실험기간 동안 후오존 처리수의 PO4-P 농도는 평균 0.005 mg/L로 정도로 나타났다.
H2O2를 투입하는 강화 BAC 컬럼들에는 BAC 컬럼으로 유입되는 H2O2 농도가 1 mg/L가 되도록 투입하였다. PO4-P와 H2O2는 각각 85% 인산 용액(Sigma-aldrich, USA)과 30% 과산화수소 용액(Sigma-aldrich, USA)을 희석하여 사용하였다.
2.2. 실험방법
2.2.1. BAC 부착 박테리아 생체량 및 활성도
부착 박테리아의 생체량은 ATP 농도를 측정하여 평가하였다. 활성탄 습중량 200 mg을 채집하여 Velten 등이 제시한 방법[16]으로 전처리한 후 luminometer (Victor3, PerkinElmer, USA)를 이용하여 분석하였다.
부착 박테리아의 활성도는 Son 등의 연구[17]에서 사용된 방법인 3H-thymidine이 DNA에 흡수되는 양을 측정하는 방법을 이용하였다. 활성탄 습중량 1 g을 채집하여 전처리한 후 liquid scintillation analyzer (PerkinElmer, Quantulus 1220, USA)로 분석하였으며, 얻어진 DPM (disintergrate per minute) 값으로부터 박테리아에 결합된 thymidine의 양을 계산하여 활성탄 g당 생체량으로 환산하였다.
2.2.2. 총 박테리아 개체수 분석
부착 생물막의 안정도 평가를 위해 각각의 BAC 컬럼 처리수 중에 함유된 총 박테리아 개체수(total cell count, TCC)를 flow cytometer (CytoFLEX, Beckman Coulter, USA)를 사용하여 분석하였다. 입자상 물질 제거를 위해 GF/C 여지(Whatman, USA)로 여과한 시료 300 µL에 SYBR 염색약(SYBRⓇ Gold nucleic acid gel stain, Invitrogen, USA) 10 µL와 50 µg/mL 농도로 조제한 PI 염색약(propidium iodide, Invitrogen, USA) 10 µL를 첨가하여 잘 혼합한 다음 10분간 정치반응 후 flow cytometer로 측정하였다. SYBR 시약은 활성 세포의 두 가닥 DNA 사이에 염색되어 형광 발색되며, PI 시약은 비활성 세포의 핵에 염색된다.
2.2.3. BDOC 분석
유입수와 처리수에 함유된 생물분해 가능한 유기탄소(biodegradable dissolved organic carbon, BDOC) 농도는 Servais 등이 제안한 방법을 이용하였다[18]. 시료수 200 mL를 공극크기 0.2 µm인 멤브레인 필터(Millipore, USA)로 여과한 시료에 BAC에서 탈리시킨 부착 박테리아 탈리액을 공극크기 2 µm인 멤브레인 필터(Millipore, USA)로 여과하여 여액 2 mL를 식종하였다. 유기탄소가 박테리아 대사의 제한인자로 작용하도록 무기 영양염 농축 cocktail [19]을 주입하였다. 20℃ 항온배양기에서 28일간 배양하여 배양 전・후의 DOC 농도 차로 BDOC 농도를 산정하였다. DOC 농도는 총유기탄소 측정기(Sievers M9, GE, USA)를 이용하여 분석하였다.
3. 결과 및 고찰
3.1. 운전초기의 부착 생물막 특성 평가
정수장에서 채집한 BAC의 생물막 생체량을 인위적으로 저하시켜 컬럼들에 충진 후 각각의 강화 조건에 따라 운전기간 증가에 따른 BAC 상층부의 생물막 생체량(ATP 농도) 변화를 평가한 것을 Fig. 2에 나타내었다. Fig. 2에서 볼 수 있듯이 기존 BAC (control-BAC)와 3가지 강화 조건을 적용한 BAC 컬럼들에서 운전 기간의 증가에 따라 생물막 생체량이 증대되었으며, 특히, PO4-P를 투입한 PO4-P+BAC와 PO4-P+H2O2+BAC에서 생물막의 생체량 증대가 두드러졌다.
Control-BAC와 H2O2+BAC에서는 운전 초기에 비하여 각각 0.70와 0.84 µg・ATP/g・GAC가 증가하였으며, 증가율은 대략 43%와 52%로 나타났다. 또한, PO4-P+BAC와 PO4-P+H2O2+BAC의 경우는 각각 1.32와 1.60 µg・ATP/g・GAC가 증가하여 단기간에 생물막의 생체량이 81%와 99% 정도 증가하였다.
50일 운전 이후에 control-BAC와 강화 BAC 컬럼들의 부착 생물막 생체량을 비교해보면 control-BAC의 2.32 µg・ATP/g・GAC에 비하여 H2O2+BAC, PO4-P+BAC 및 PO4-P+H2O2+BAC에서는 각각 2.46, 2.94 및 3.22 µg・ATP/g・GAC의 ATP 농도를 나타내어 대략 6%, 27% 및 39% 정도 더 높은 생체량을 보였다.
여러 연구결과들에서 유입수에 PO4-P를 강화(보충)시킨 경우, 여재 부착 생물막의 생체량이 증가한 것으로 보고하고 있으며[14,20], Lauderdale 등의 연구결과[7]에서도 유입수에 PO4-P 농도를 강화시켜 운전한 biofilter에서 대조군 biofilter에 비해 부착 생물막의 ATP 농도가 30% 정도 더 높은 것으로 보고하고 있다. BAC와 같은 생물여과(biofiltration) 공정에서 유입수 중에 PO4-P가 제한적인 경우, PO4-P의 보충(강화)에 의해 BAC 부착 박테리아의 기질대사 및 세포합성 능력을 향상시켜 생물막의 생체량 및 활성도가 증대되며, 이것은 결국 수중의 오염물질 제거능의 향상으로 연결된다.
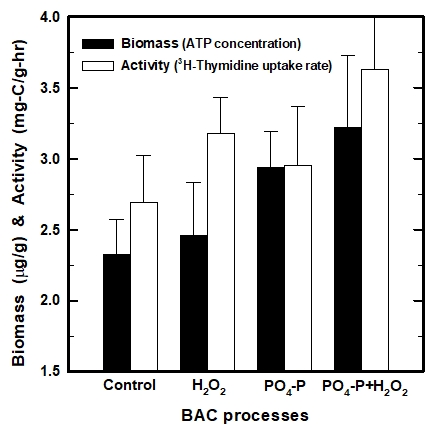
운전 시작 50일 이후에 각각의 BAC 컬럼 상층부에 형성된 생물막의 생체량과 활성도 평가 결과를 Fig. 3에 나타내었다. 생체량과 유사하게 활성도의 경우도 기존 BAC (control-BAC)에 비하여 H2O2와 PO4-P를 투입한 강화 BAC 컬럼들에서 높게 나타났다.
활성도의 경우, control-BAC의 2.69 mg・C/g・h에 비해 H2O2+BAC, PO4-P+BAC 및 PO4-P+H2O2+BAC에서는 각각 3.18, 2.96 및 3.63 mg・C/g・h로 나타나 대략 18%, 10% 및 35% 정도 증가하였으며, 특히, H2O2를 투입한 BAC (H2O2+BAC와 PO4-P+H2O2+BAC)에서의 활성도 증가가 뚜렷하게 나타났다. Fig. 2와 Fig. 3에서 살펴본 바와 같이 BAC 강화 목적으로 투입되는 인(PO4-P)은 부착 생물막의 생체량 증대에 주로 기여하는 반면, 과산화수소(H2O2)의 경우는 생물막의 활성도 증대에 기여하는 것으로 평가되었다.
3.2. 유기물질 제거능 평가
유기물질 제거율이 정상상태에 도달한 이후의 생물막 특성과 유기물질 제거능을 평가한 것을 Table 2 및 Fig. 4와 Fig. 5에 나타내었다. 이전의 연구결과들에서 biofilter의 유기물질 제거율이 정상상태에 도달하는 기간은 20일부터 16개월까지로 상당한 차이를 나타내고 있다.21) 이는 유입수 중의 BOM (biodegradable organic matter) 농도, 수온, 여재 특성 및 역세척 주기와 같은 다양한 인자들이 영향을 미치기 때문이며2), 본 연구에서는 운전 시작 후 3개월 정도 경과한 시점에서 각각의 BAC 컬럼들의 유기물질 제거율과 생물막 생체량이 정상상태에 도달하였다. 정상상태 도달 이후 6개월 동안 월 2회씩 총 12회 분석한 각각의 BAC 컬럼들의 여층 깊이별(-5~-90 cm) 생물막 생체량과 활성도 변화에 대한 평균값을 Table 2에 나타내었다.
Table 2에서 볼 수 있듯이 PO4-P를 투입한 강화 BAC (PO4-P+BAC)에서는 전 여층(-5~-90 cm)에서 기존 BAC (control-BAC)에 비해 생물막의 생체량이 20~86% 정도 높게 나타났고, 활성도의 경우에는 7~14% 정도 증가하여 생체량에 비해서는 낮은 증가율을 보였다. 또한, H2O2를 투입한 강화 BAC (H2O2+BAC)에서는 전 여층에서 생체량과 활성도가 control-BAC와 비교하여 각각 -2~3% 및 3~11% 정도 높게 나타나 H2O2 투입에 의해 생체량은 증가하지 않은 반면 활성도는 증대되었다. PO4-P와 H2O2를 함께 투입한 강화 BAC (PO4-P+H2O2+BAC)의 경우는 control-BAC에 비하여 생체량과 활성도가 각각 27~87% 및 8~20% 정도 높게 나타났다.
또한, control-BAC에 비해 PO4-P를 투입한 강화 BAC에서는 중・하층부의 생물막 생체량 증가율이 매우 높게 나타났다. 이러한 결과는 control-BAC의 경우 여층 상부에서의 높은 PO4-P 요구량으로 인해 유입수에 함유된 PO4-P 농도만으로는 중・하층부 생물막의 PO4-P 요구량을 만족시키지 못한다는 것을 보여준다. 그리고 H2O2를 투입한 강화 BAC의 경우에는 전 여층에서 소폭으로 생물막 활성도가 증가하였다. H2O2는 용존산소 공급, 활성 박테리아 활성 증대, 유기물 산화 촉진 효소(과산화 효소) 발현을 유도하는 역할뿐만 아니라 비활성 박테리아 산화・제거 역할을 한다[11-13]. 본 연구에서는 처리수를 포함하여 여층 중・하층으로 유입되는 H2O2의 농도는 모니터링하지는 않았으나 BAC 컬럼으로 유입된 H2O2의 대부분이 상층부에서 물과 용존산소로 분해되었을 것으로 판단하며, 중・하층부로의 H2O2 유입이 없는 상황에서 부착 생물막의 활성도가 증진된 것은 용존산소 농도 증가와 상층부의 비활성 생체량의 산화・제거시 발생되는 유기탄소와 미량 영양염이 중・하층부로 유입되어 생물막의 활성도 증진에 영향을 미친 것으로 판단하였으며, 이에 대한 추가적인 연구가 필요한 것으로 나타났다.
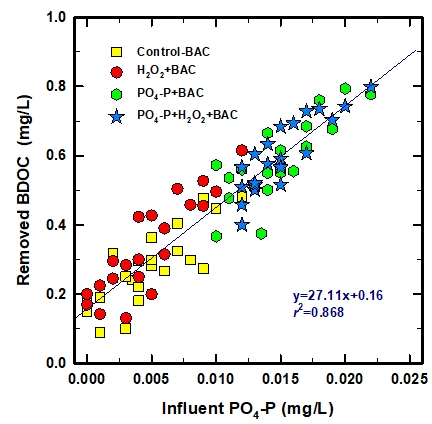
정상상태 도달 이후, BAC 공정 유입수 중의 PO4-P 농도와 각각의 BAC 컬럼들에서 제거된 BDOC 농도와의 상관성을 평가한 결과를 Fig. 4에 나타내었다. 실험기간 동안 후오존 처리수 중에 함유된 PO4-P 농도와 BDOC 농도는 각각 ND~0.012 mg/L(평균: 0.0049 mg/L) 및 0.32~0.83 mg/L(평균: 0.63 mg/L)였다.
Fig. 4에서 볼 수 있듯이 BAC 컬럼으로 공급된 PO4-P 농도와 BAC 컬럼에서 제거된 BDOC 농도와는 높은 상관성(r2=0.868)을 나타내었고, 유입수에 PO4-P를 강화한 경우에 추가적인 BDOC의 제거가 유발되었다. 즉, PO4-P를 투입하지 않은 BAC (control-BAC와 H2O2+BAC)에서의 PO4-P 농도범위는 ND~0.012 mg/L였으며, 제거된 BDOC 농도범위는 0.089~0.615 mg/L였다. 그러나 추가적으로 0.01 mg/L의 PO4-P를 투입한 경우(PO4-P+BAC와 PO4-P+H2O2+BAC)에 0.011~0.023 mg/L의 PO4-P 농도 범위에서 제거된 BDOC 농도 범위는 0.367~0.798 mg/L로 나타났다.
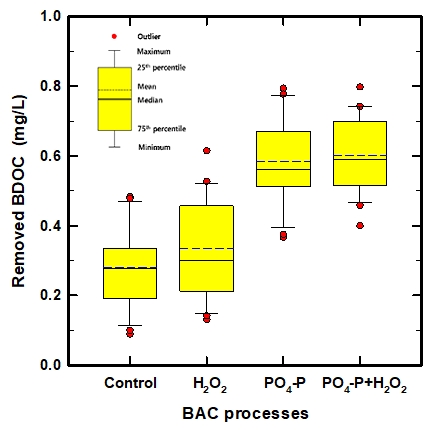
Fig. 5에서 볼 수 있듯이 각각의 BAC 컬럼들에서 평균적으로 제거된 BDOC 농도의 경우, control-BAC에서는 0.279 mg/L, H2O2+BAC에서는 0.336 mg/L, PO4-P를 첨가한 PO4-P+BAC와 PO4-P+H2O2+BAC에서는 각각 0.583과 0.602 mg/L로 나타났다. Control-BAC에 비하여 H2O2+BAC에서의 평균 BDOC 제거율은 20% 정도 높게 나타났고, PO4-P+BAC와 PO4-P+H2O2+BAC에서는 각각 109% 및 116% 정도 높은 것으로 평가되었다.
Nishijima 등[14]은 DOC 농도가 9.5 mg/L인 유입수에 대해 PO4-P 투입 유무에 따른 BAC 처리 유출수에서의 DOC 농도를 평가한 결과, PO4-P를 투입한 BAC 처리수에서 DOC 농도는 3.9 mg/L(제거율: 59%)로 나타난 반면 PO4-P를 투입하지 않은 BAC 처리수에서의 DOC 농도는 8.7 mg/L(제거율: 8%)로 나타나 PO4-P 투입에 따른 현저한 BAC 효율 차이를 보고하였다. 또한, Lauderdale 등의 연구결과[7]에서도 기존 biofilter에 H2O2와 PO4-P를 각각 투입(강화)하여 0.2 mg/L와 0.35 mg/L의 DOC가 추가적으로 제거된 것으로 보고하고 있다. Sang 등의 연구결과[22]에서도 세라믹 다공질 담체를 충진한 biofilter들을 장기간 운전하면서 PO4-P 보충 유무에 따른 TOC 제거율을 평가한 결과, PO4-P을 보충한 biofilter에서의 평균 제거율은 22%~27%, 영양(PO4-P) 제한이 있는 biofilter에서는 17%~21%의 TOC 제거율을 나타낸 것으로 보고하고 있다. 그러나 Selbes 등[8]과 Noh 등[20]의 연구결과에서는 H2O2와 PO4-P를 첨가하여 운전한 경우에도 추가적인 유기물질 제거율의 상승은 관찰되지 않은 것으로 보고하고 있어 본 연구와 상이한 결과를 나타내었다. Selbes 등[8]은 biofilter 제거효율에 있어서 다양한 요소들이 biofilter의 영양염(PO4-P) 보충 효과를 상쇄시킬 수 있기 때문에 biofilter 최적화를 위한 영양염 보충 전략의 유용성을 명확히 하기 위한 추가적인 연구의 필요성을 지적하고 있다.
3.3. 생물막 안정도 평가
정상 상태에 도달한 biofilter의 생물막에서는 생체량의 성장 및 감소가 균형을 이룬다[23]. 생물막 생체량의 감소요인으로는 활성 저하로 인한 탈리, 역세척에 따른 마모 및 세포 노화로 인한 사멸 등이 있다[23]. 따라서 BAC와 같은 biofilter 처리수에서는 생물막에서 탈리된 박테리아들이 검출되고, 이러한 현상은 일반적으로 수질문제로 간주되지는 않는다[8].
Kim 등의 연구결과[24]에서는 하절기에 비하여 동절기에 BAC 처리수에서 종속영양성 박테리아 개체수(heterotrophic plate count, HPC)가 증가하였으며, 이를 동절기의 낮은 수온으로 인한 부착 박테리아들의 활성도 저하에 의한 것으로 보고하고 있다. 수온이 상승함에 따라 BAC 처리수에서의 HPC도 점진적으로 감소하는 것으로 보고하고 있어 생물막의 탈리현상은 부착 생물막의 생체량의 많고 적음보다는 생물막 활성도의 높고 낮음에 좌우되는 경향을 나타낸다.
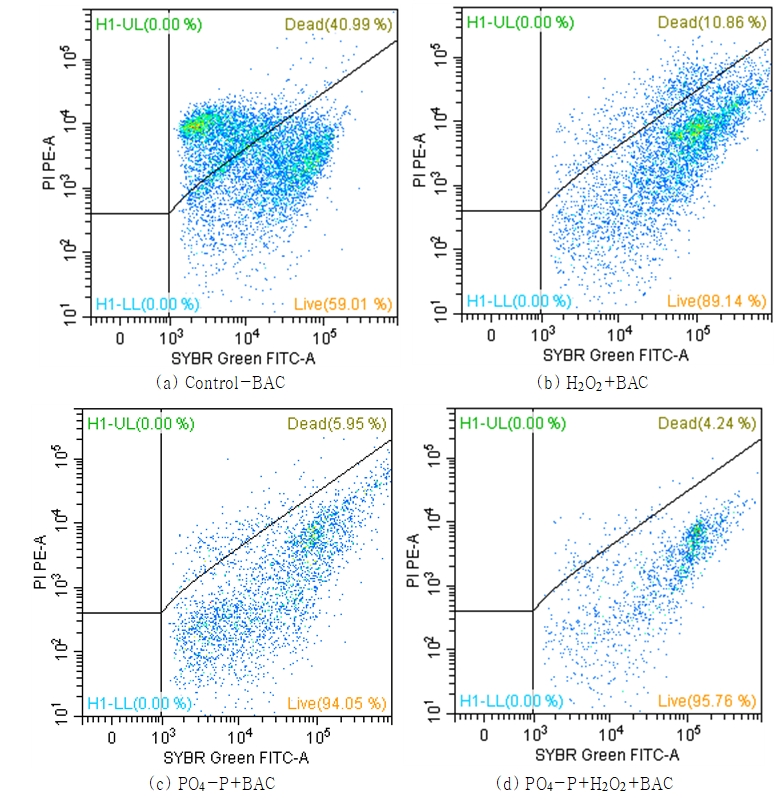
정상상태에 도달한 각각의 BAC 컬럼들의 유출수를 대상으로 flow cytometer를 사용하여 총 박테리아 개체수(TCC)를 분석한 결과를 Fig. 6에 나타내었다. Flow cytometer를 이용한 TCC 분석은 배양 가능한 박테리아뿐만 아니라 배양이 불가능한 박테리아까지 측정이 가능하며, 박테리아의 활성 유무까지 판별된다. Fig. 6에서 볼 수 있듯이 4등분된 그림의 우측 상단 구역은 염색된 비활성(dead) 박테리아 개체를 청색 점으로 나타내고 있으며, 우측 하단 구역은 염색된 활성(live) 박테리아 개체를 청색 점으로 나타내고 있다. Control-BAC에 비하여 H2O2와 PO4-P를 투입한 강화 BAC에서 탈리된 박테리아 개체수가 적었으며, 또한, 탈리된 박테리아의 대부분이 활성 박테리아로 평가되었다(Fig. 6).
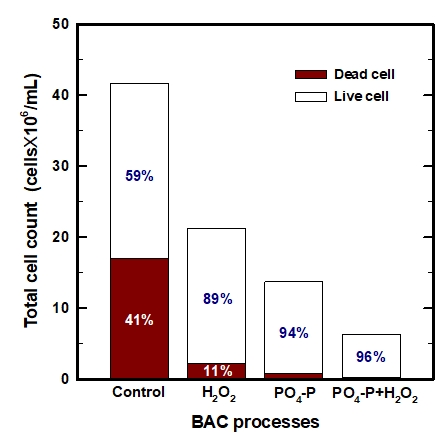
정상상태에 도달한 이후, BAC 처리수 중의 TCC를 월 4회 분석(총 24회)하여 평균한 결과를 Fig. 7에 나타내었다. Fig. 7에서 볼 수 있듯이 control-BAC 처리수의 TCC는 평균 41.7×106 cells/mL로 나타났다. 또한, H2O2+BAC, PO4-P+BAC 및 PO4-P+H2O2+BAC 처리수의 경우는 평균 21.2×106 cells/mL, 13.7×106 cells/mL 및 6.3×106 cells/mL로 control-BAC에 비해 각각 49%, 67% 및 85% 정도 감소되었다.
또한, TCC를 구성하는 활성 및 비활성 박테리아의 구성 비율을 살펴보면 control-BAC에서는 평균적으로 활성 박테리아가 59%, 비활성 박테리아가 41%로 나타났으나 강화 BAC들에서는 활성 박테리아의 비율이 89%~96%로 매우 높게 나타났다. 이러한 결과는 강화 BAC들에서는 부착 생물막을 구성하는 박테리아의 대부분이 활성 박테리아로 구성되어져 있다는 것을 의미하며, Table 2에서 볼 수 있듯이 강화된 BAC들의 생물막 활성도가 기존 BAC (control-BAC)에 비하여 높기 때문에 여층 내에서 수류의 전단력으로 인해 탈리되는 박테리아들의 개체수도 적은 것으로 평가되었다.
4. 결 론
인(PO4-P)과 과산화수소(H2O2)를 투입한 강화 BAC 공정에서의 부착 생물막의 특성과 BDOC 제거능을 기존의 BAC 공정과 동일한 운전조건에서 비교・평가하여 다음과 같은 결론을 얻을 수 있었다.
1) BAC 강화 조건에 따른 생물막 회복능을 평가한 결과, H2O2를 투입한 강화 BAC에서는 기존 BAC와 비교하여 생체량 회복율에 차이는 없었으며, PO4-P를 투입한 강화 BAC에서는 기존 BAC에 비해 생체량의 빠른 회복율을 나타내었다.
2) 정상상태 도달 이후의 생물막 특성 평가에서 지속적으로 PO4-P를 투입한 강화 BAC에서는 기존 BAC에 비해 생체량과 활성도가 각각 20~86% 및 7~14% 정도 증가하였으나 H2O2를 투입한 강화 BAC에서는 활성도만 3~11% 정도 증대되었다.
3) BDOC 제거율 평가에서는 기존 BAC에 비하여 강화 BAC에서의 BDOC 제거율이 증대되었으며, 특히, PO4-P를 투입한 강화 BAC에서 BDOC 제거율이 100% 이상 증대되었다.
4) 생물막에서의 박테리아 탈리율로 평가한 생물막 안정도는 기존 BAC에 비하여 강화 BAC에서 탈리율이 49~85% 저감되었으며, PO4-P를 투입한 강화 BAC에서 높은 생물막 안정도(낮은 박테리아 탈리율)를 나타내었다.