|
The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
AbstractObjectivesThe use of phase change materials (PCMs) with the ability to absorb and release heat as an energy medium has been extensively studied where encapsulated material was used. Though these heat storage systems seem efficient but practical application suffers due to their high manufacturing cost, complexity in the manufacturing process, and eco-unfriendly nature. In this study, we developed an affordable, simpler and more efficient heat storage media by using activated carbon as a filling medium for PCM. The purpose of this study is to develop a method for caging a PCM by using the adsorption phenomenon where the PCM is adsorbed by the capillary phenomenon in the pores of activated carbon. The heat absorption and releasing characteristics of PCM embedded-activated carbon composite was investigated to comment on the applicability of the composite.
MethodsThe PCM used in this experiment were caprylic acid (CH3(CH2)8COOH), Mn(NO3)2・4H2O, Mn(NO3)2・6H2O, Zn(NO3)2・6H2O, and n-hexadecane. The PCM embedded-activated carbon composites were prepared and studied by adopting a standard protocol. After adding and mixing the degassed activated carbon in a beaker containing a PCM, it was maintained in a high-pressure reactor of 10 atm to push the PCM into the pores of the activated carbon. The heat absorption/release capacity of the PCM embedded-activated carbon was examined within the range of 10℃ to 50℃.
Results and DiscussionThe organic acid and the hydrated salt decreased the volume by decreasing the average distance between molecules as the temperature decreased. The heat absorption and release temperature of caprylic acid and n-Hexadecane was ~17℃ and ~15℃, respectively. Also, for Mn(NO3)2・4H2O and Zn(NO3)2・6H2O, the absorption and release of heat, i.e., latent heat was ~35℃ and ~25℃, respectively. In particular, the process of absorbing heat proceeds slowly while the process of heat release proceeds very rapidly. Moreover, Mn(NO3)2・4H2O and Zn(NO3)2・6H2O showed two inflection points in the heat release process. It was probably due to the supercooling phenomenon where the liquid and solid phase coexisted during the phase transition. From the evaluation of the mixed PCM, the inflection point of heat absorption and emission was given for the mixture of Mn(NO3)2・4H2O/Mn(NO3)2・6H2O and Mn(NO3)2・4H2O/Zn(NO3)2・6H2O. Similar trends were observed in repeated experiments. On the other hand, when Mn(NO3)S・6H2O and Zn(NO3)2・6H2O with higher water molecules content were mixed, reproducibility decreased in the subsequent heat absorption and release cycles. The heat absorption and emission characteristics of caprylic acid, Mn(NO3)2・6H2O and Zn(NO3)2・6H2O embedded activated carbon was found reproducible in multiple melting and freezing cycles and the overcooling phenomenon was overcome. The heat absorption and release characteristics of laminated PCM embedded activated carbon showed that the absorption of heat proceeded gradually from the bottom to the top, and the absorption of heat was significantly high at the top. On the contrary, heat dissipation was observed to proceed more at the bottom than at the top. The homogeneous mixing of various PCM embedded activated carbon composites resulted in a uniform distribution over a wide range of temperatures. Dozens of repeated experiments showed a similar pattern, which ensured that the activated carbon can be used as a stable thermal charging medium even with a PCM.
Conclusions1) Caprylic acid and n-hexadecane did not have the supercooling phenomena, but the hydrate-containing inorganic phase change material showed the supercooling phenomenon where both the liquid and solid phases coexisted. 2) The supercooling phenomena occurred during the cooling process that released the heat, especially when the hydrated water content was higher. On the other hand, when the phase change material is filled into the activated carbon pores, the supercooling phenomenon disappeared in the cooling process. It was considered that the external stimulus was formed because the phase change material expanded and contracted in a narrow space in the pore. 3) Mixing of hydrate-containing inorganic phase change materials which have different melting point resulted in the absorption and release of heat at the intrinsic melting point of raw material, even when filled in activated carbon pores. It was found that when the phase change materials having different melting points were used after being embedded in the activated carbon pores and mixed, they could be used as heat absorbers and release agents in a wider range of temperatures.
요약목적열의 흡수 및 방출능력이 있는 상전이 물질을 에너지 매체로 사용하는 연구는 꾸준히 진행되어왔으며 캡슐형태로 주로 적용되었다. 하지만 제조공정이 복잡하고 환경오염물질이 발생되어 생산비의 대부분이 오염물질 제거에 사용되는 문제점이 있다. 본 연구에서는 활성탄을 상전이 물질의 충전매체로 사용하여 보다 간단하고 효과적인 열저장매체를 개발하고자 한다. 활성탄의 세공에 상전이 물질이 모세관 현상으로 흡착되는 원리를 이용하여 상전이 물질을 충전하는 방법을 개발하고 개발 소재의 열흡수 및 방출에 대한 특성을 알아보고자 한다.
방법본 실험에 사용한 상전이 물질은 지방산 물질인 Caprylic acid, 수화물 무기염으로는 Mn(NO3)2・4H2O, Mn(NO3)2・6H2O, Zn(NO3)2・6H2O, 그리고 알칸계 탄화수소류로는 n-hexadecane을 이용하였다. 활성탄 세공에 상전이 물질을 다음과 같이 충전하였다. 상전이 물질에 활성탄을 주입하여 혼합한 후 10기압의 고압반응기에서 약 10시간을 유지시킨다. 마지막으로 10℃에서 50℃ 범위 안에서 개발 소재의 열의 흡수/방출 능력을 알아보았다.
결과 및 토의온도에 따른 상전이 물질의 부피변화를 확인한 결과 유기산 및 수화물 염은 온도가 내려가면서 분자 간 평균거리가 감소하여 부피가 감소함을 알 수 있다. 각 상전이 물질의 열 흡수 방출특성을 평가한 결과 Caprylic acid는 약 17℃에서 근처에서 그리고 n-Hexadecane은 약 15℃ 근처에서 열흡수 및 방출이 일어남을 보여주고, Mn(NO3)2・4H2O 및 Zn(NO3)2・6H2O 은 약 35℃ 근처에서 그리고 Mn(NO3)2・6H2O 약 25℃ 근처에서 열의 흡수 및 방출 즉, 잠열이 있음을 보여주고 있다. 특히 열을 흡수하는 과정은 서서히 진행되는 반면 열을 방출하는 과정은 매우 급격하게 진행되었으며 Mn(NO3)2・4H2O 및 Zn(NO3)2・6H2O의 경우 열의 방출과정에서 두 번의 변곡점을 보여주고 있어 상전이 시 액체상태와 고체의 불안한 상태를 유지하는 과냉각(super cooling) 현상 때문인 것으로 사료되었다. 혼합 상전이 물질을 평가한 결과 Mn(NO3)2・4H2O/Mn(NO3)2・6H2O 혼합물과 Mn(NO3)2・4H2O/Zn(NO3)2・6H2O 혼합물의 경우 열 흡수와 방출 2개의 변곡점을 보여주었으며 반복실험에서도 비슷한 경향을 나타내었다. 반면에 Mn(NO3)2・6H2O과 Zn(NO3)2・6H2O을 혼합한 경우는 열흡수 및 방출실험을 반복할수록 재현성이 저하되었다. 충전된 상전이 충진된 활성탄의 열 흡수 및 방출특성을 평가한 결과 Caprylic acid, Mn(NO3)2・6H2O, Zn(NO3)2・6H2O 모두 열의 흡수 및 방출이 진행되었으며 각각의 녹는점 및 어는점은 원료물질 그대로의 온도에서 재현되었으며 특히 수화물 염의 가장 단점인 과냉각현상을 극복할 수 있었다. 활성탄 세공에 충전된 상전이 물질을 적층시켜 열흡수 및 방출특성을 평가한 결과 열의 흡수의 경우 하부에서부터 상부까지 점진적으로 진행되며 특히 상부에서 열의 흡수가 많음을 확인하였다. 반면에 열 방출의 경우 상부보다는 하부에서 많이 진행됨을 보여주고 있다. 각각의 상전이 물질을 균일하게 혼합하였을 경우 광범위 온도에서 균일한 분포로 일어났으며, 반복 실험에서도 비슷한 양상을 보여주어서 활성탄세공에 상전이 물질을 충진하여도 안정된 열 충전 매체로 사용할 수 있음을 확신할 수 있었다.
결론1) 상전이 물질중 acprylic acid, n-hexadecane은 과냉각 현상이 없었으나 무기성 상전이 물질은 과냉각 현상이 발생하였다. 2) 과냉각 현상은 열을 방출하는 냉각과정에서 발생하였으며 수화물 함량이 높을수록 경향을 뚜렷하게 나타내었다. 반면에 활성탄 세공에 상전이 물질을 충전하여 사용 시 과냉각현상이 해소되었으며 이는 세공 내에서 상전이 물질이 팽창 및 수축이 일어나면서 상전이 물질을 정체시키지 않기 때문이라고 사료되었다. 3) 융점이 다른 수화물 함유 무기성 상전이 물질을 혼합시킬 경우 각 열의 흡수 및 방출이 재현되었으며, 융점이 다른 각각의 상전이 물질을 활성탄 세공에 충진 후 혼합하여 사용할 경우 광범위한 온도에서 열의 흡수 및 방출제로 사용 가능함을 알 수 있었다.
1. 서 론화석 연료의 고갈로 인하여 대체에너지의 확보는 선택이 아닌 생존을 위한 전 세계적인 필수과제가 되었다. 이에 따라 지속적으로 사용이 가능한 태양열, 태양광, 풍력 등 친환경 에너지원이 화석연료의 대체 에너지원으로서 연구되고 있다. 그러나 이러한 에너지원을 전력으로 변환하기 위한 기반시설은 유치 비용이 많이 소요되는 것에 반하여, 에너지의 밀도가 시간에 따라 균일하지 않고 발생 빈도 등을 예측하기 어렵기 때문에 상용전력으로서의 한계가 있다. 초기 투자비용이 높고 에너지효율이 낮은 대규모 발전 설비를 구축하는 대신, 최근에는 열저장 매체를 이용한 에너지의 효율적 관리 기술이 새롭게 각광을 받고 있다. 열저장 기술은 열저장 매체에 따라 감열저장 기술과 잠열저장 기술로 나뉘며 감열저장기술은 콘크리트, 토양, 물 등의 열에너지 저장매체의 온도변화를 통해 에너지를 저장하는 기술로 구조가 단순하고, 낮은 가격으로 운전이 가능하다는 장점이 있으나, 에너지 저장밀도가 매우 낮다는 단점이 있다. 반면 상전이 물질을 이용한 잠열 저장 기술은 그 무공해성, 지속가능성, 높은 열저장 밀도로 무한한 가능성을 갖는 것으로 평가된다[1]. 상전이 물질은 물질의 상이 변할 때 흡수나 방출하는 에너지를 잠열로 저장하며 부피변화가 상대적으로 작은 고체-액체의 상변화를 이용한다[2~4]. 상전이 물질은 고체에서 액체로 용융되며 잠열을 흡수하는데, 이때 액체 상태에서의 상전이 물질의 형태를 안정화시키는 ‘고정화’ 공정이 필요하다. 상전이 물질의 고정화에 널리 쓰이고 있는 캡슐화기술은 대체로 에폭시 또는 폴리우레탄 등의 폴리머로 상전이 물질을 포획하는 기술 이루어져 있으며[5~7] 캡슐화를 위해서는 유기용매제 및 분산제 등의 다양한 화학물질 필요하며, 이 과정에서 발생하는 화학성 오염물질과 요구되는 에너지는 상전이 물질이 갖는 다양한 장점을 상쇄시키며 상용화를 지연시키는 요소이다. 따라서 2차 공해가 없고 친환경적인 상전이물질 고정화 공정이 구축된다면 기존 대체에너지원의 한계를 효과적으로 보완하는 열저장 물질로서 이용될 것이다.
본 연구에서는 활성탄을 상전이 물질의 충전매체로 사용하여 보다 간단하고 효과적인 열저장매체를 개발하고자 한다. 활성탄의 세공에 상전이 물질이 모세관 현상으로 흡착되는 원리와 무기성 상전이 물질을 충전하는 방법을 고안하여 고정화를 보다 용이하게 하며 상전이 물질이 충전된 활성탄을 대상으로 열흡수 및 방출에 대한 특성을 알아보고자 한다.
2. 연구수행 내용 및 방법2.1. 실험장치열흡수 및 방출을 알아보기 위한 실험장치는 열공급 장치, 상전이 물질을 충진할 유리용기 그리고 충진한 매체의 열의 흡수 및 방출을 측정하는 온도계측기 세 가지로 구성하였으며 Fig. 1에 나타내었다. 열 공급장치는 -20℃~50℃까지 온도조절이 가능하고 공급장치 내의 균일한 온도유지가 가능하도록 송풍시설이 내장된 대류형 열 공급장치를 사용하였다. 실험에 사용된 상전이 물질의 상변화 온도가 설정 온도범위 내에 존재하게 하기위해 실험 온도범위를 10℃에서 50℃범위로 설정하였으며, 장치는 두 대를 설치하여 한 대는 항상 10℃를 유지시키고 다른 한 대는 50℃를 유지시켜서 가동하였다. 상전이 물질의 열의 흡수능력을 알아보기 위해서는 10℃에서 장시간 보관한 후 50℃로 유지되고 있는 반응조에 넣어서 시간에 따른 열의 흡수능력을 알아보고 열의 방출능력을 알아보기 위해서는 반대로 50℃로 장시간 유지시킨 후 10℃로 유지되고 있는 반응조에 넣어서 시간에 따른 열의 방출능력을 알아보았다. 상전이 물질을 넣을 유리용기는 지름 1 cm, 높이 약 10 cm의 튜브를 사용하였고 튜브 내에는 상전이 물질을 약 10 ml 정도를 주입하였다. 그리고 상전이 물질에 의한 내부의 온도변화를 알아보기 위하여 튜브주변은 난방용 단열제로 보온을 하고 튜브바닥은 보온제를 제거하여 바닥을 통해서만 열의 이동이 있도록 하였다.
2.2. 상전이 물질의 활성탄 세공에 충전방법
Fig. 2는 활성탄 세공에 상전이 물질 충전방법에 대하여 나타낸 것이다. 활성탄 세공 속의 기포를 제거하기 위하여 약 200℃의 오븐에서 가열하고 다시 진공펌프로 감압과정을 거친다. 상전이 물질이 담겨진 비이커에 기포가 제거된 활성탄을 주입하여 혼합한 후 한번 더 감압과정을 거쳐서 활성탄 기공에 쌓인 기포를 제거하고 상전이 물질을 활성탄 기공에 밀어 넣기 위하여 10기압의 고압 솥에서 약 10시간을 유지시킨다. 상전이 물질이 충전된 활성탄은 다시 여과시키고 표면에 묻은 상전이 물질을 제거하기 위하여 세척과정을 거친다. 모든 실험절차에서 50℃로 유지하는 이유는 본 실험에서 사용된 상전이 물질은 상온에서 고체에서 액체에서 고체로 상전이가 일어나기 때문에 액체상태로 유지시켜 점도를 낮추어 활성탄 세공으로 충전시키기 위함이다.
2.3. 상전이 물질의 열흡수 및 방출 특성 실험방법 및 내용2.3.1. 실험에 사용된 상전이 물질 및 활성탄본 실험에 사용한 상전이 물질은 지방산 물질(fatty acid)로는 Caprylic acid(CH3(CH2)8COOH), 수화물 무기염(hydrated inorganic salts)으로는 Mn(NO3)2・4H2O, Mn(NO3)2・6H2O Zn(NO3)2・6H2O, 그리고 알칸계 탄화수소류로는 n-hexadecane을 이용하였으며 주요 열 물성은 Table 1과 같다[8]. 열흡수 및 방출특성은 우선적으로 개별물질에 대하여 열의 흡수 및 방출특성에 대하여 알아보고, 각각의 물질을 혼합하였을 때, 활성탄 세공에 충전하였을 때, 마지막으로 상전이물질이 충진된 활성탄을 섞어서 광범위 온도에서 사용 가능할 수 있는지를 각각에 대하여 알아보았다. 또한 고체에서 액체, 액체에서 고체로 상전이시 부피변화 실험, 상전이물질을 10℃에서 50℃, 50℃에서 10℃로 반복실험하여 반복에 따른 상전이 물질의 안정성을 확인하였다. 실험에 사용된 활성탄은 YAKURI Pure chemical사의 편백나무를 주원료로 만든 목탄계 분말 활성탄(250-350 mesh)을 사용하였으며 공극 특성은 Table 2와 같다.
3. 결과 및 고찰3.1. 온도에 따른 부피변화본 연구에서 사용한 상전이 물질은 유기산 계열의 상전이 물질, 수화물 무기염 계통의 상전이 물질이 고체에서 액체, 액체에서 고체로 상전이 시 부피팽창의 변화를 알아보기 위하여 상전이 물질을 튜브에 넣고 고체에서 액체, 액체에서 고체로 변할 때 부피의 변화를 육안으로 관찰하였다. Fig. 3(a)는 상전이 물질을 50℃로 승온 시켜서 액체 상태로 유지한 경우를 나타낸 것이고 Fig. 3(b)는 10℃로 낮추어 고체 상태를 유지한 경우를 보여준 것이다. 증류수의 경우는 0℃에서 액체에서 고체로 상변화 시 부피팽창이 일어나 밀도가 급격히 감소하나 본 실험에서 사용한 유기산 및 수화물 염은 온도가 내려가면서 분자 간 평균거리가 감소하여 부피가 감소함을 알 수 있다.
3.2. 열의 흡수 및 방출 실험3.2.1. 개별 상전이 물질의 열 흡수 및 방출 특성열의 흡수 실험은 10℃에서 장시간 유지시킨 시료를 50℃로 유지되고 있는 건조기에 넣어서 열의 흡수 유무를 알아보고 열의 방출실험은 50℃에서 장시간 유지시킨 시료를 10℃로 유지되는 냉온조에 넣어서 열의 방출유무를 반복적으로 수행하여 알아보았다. Fig. 4는 Caprylic acid, n-Hexadecane, Mn(NO3)2・6H2O, Mn(NO3)2・4H2O, Zn(NO3)2・6H2O 각 상전이 물질 열 흡수 및 방출특성에 대하여 나타낸 것이다. Caprylic acid는 약 17℃에서 근처에서 그리고 n-Hexadecane은 약 15℃ 근처에서 열흡수 및 방출이 일어남을 보여주고, Mn(NO3)2・4H2O 및 Zn(NO3)2・6HSO은 약 35℃ 근처에서 그리고 Mn(NO3)2・6H2O 약 25℃ 근처에서 열의 흡수 및 방출 즉 잠열이 있음을 보여주고 있다[9]. 특히 열을 흡수하는 과정(고체에서 액체로 상전이)은 서서히 진행되는 경향을 보여주었으나 열을 방출하는 과정(액체에서 고체로 상전이)은 매우 급격하게 진행되었으며 Mn(NO3)2・4H2O 및 Zn(NO3)2・6H2O의 경우 열의 방출과정에서 두 번의 변곡점을 보여주고 있는 것은 액체상태에서 고체로 상전이시 액체상태와 고체의 불안한 상태를 유지하는 과냉각(supercooling)현상 때문인 것으로 사료되었다[10]. 이는 액체상태에서 이온화된 화학적 구조를 고체상태로 상변화시 결정화된 구조를 형성하기 위해서는 온도변화에 의한 단순 에너지 공급 외에 외부로부터 충격 등의 물리적인 힘이 필요하기 때문이다.
3.2.2. 복합 혼합염의 열 흡수 및 방출 특성 및 재현성 시험
Fig. 5는 수화물 염을 혼합시켜서 혼합염의 상전이에 대하여 반복적으로 수행한 결과이다. 약 25℃ 근처에서 열의 흡수 및 방출이 일어나는 Mn(NO3)2・6H2O과 약 35℃ 근처에서 열의 흡수 및 방출이 일어나는 Mn(NO3)2・4H2O, Zn(NO3)2・6H2O 각각을 부피비로 1:1로 혼합하여 수행하였다. Mn(NO3)2・4H2O와 Mn(NO3)2・6H2O 혼합물의 경우 주변의 온도가 50℃인 경우 초기에는 온도의 상승이 가파르게 일어나다가 상전이 온도인 25℃부터 느린 속도로 온도가 상승되어 열의 흡수가 계속적으로 일어남을 보여주었고, 주변의 온도가 10℃인 경우에는 온도의 하강 속도가 빨라지다가 열흡수 시작온도인 25℃ 근처에서 Mn(NO3)2・4H2O 및 Mn(NO3)2・6H2O 각각의 열 방출 2개의 변곡점을 보여주었으며 반복실험에서도 비슷한 경향을 나타내었다. Mn(NO3)2・4H2O과 Zn(NO3)2・6H2O을 혼합한 경우도 비슷한 경향을 나타내었으며 반복 실험에서도 재현성을 보여주었다. 반면에 물분자 함량이 높은 Mn(NO3)2・6H2O과 Zn(NO3)2・6H2O을 혼합한 경우는 열흡수 및 방출실험을 반복할수록 재현성이 저하되었다. 이는 외부의 열을 흡수하여 고체에서 액체로의 상변화시 액체상태에서는 화학종이 균일한 농도분포를 이루나 액체상태에서 고체상태로의 상변화시에는 액체상태의 전화학종이 고체로 전환되지 않고 물분자와 화학종 간에 분리(separation)가 일어났기 때문인 것으로 사료되었다[11,12]. 특히, 높은 물함량으로 인해 과냉각 현상으로 상분리가 지속되기 때문인 것으로 사료되었다. 결론적으로 수화물함량이 높을수록 과냉각현상이 더욱 커짐을 알 수 있다.
3.2.3. 활성탄 세공에 충전된 상전이 물질의 열 흡수 및 방출 특성
Fig. 6은 상전이 물질의 충전시킬 저장용기로서 활성탄 세공을 이용하여 충전된 상전이 물질의 온도변화에 따른 열의 흡수 및 방출을 반복적으로 수행하여 나타낸 것이다. 지방산인 Caprylic acid의 경우 약 15℃ 근처에서 열의 흡수 및 방출이 일어났으며, Mn(NO3)2・6H2O의 경우는 약 25℃ 근처에서 그리고 Zn(NO3)2・6H2O의 경우는 약 35℃ 근처에서 열의 흡수 및 방출이 진행되었으며 각각의 융점(melting point) 및 어는 점(freezing point)은 원료물질 그대로의 온도에서 재현되었으며 특히 수화물 염의 단점인 과냉각현상을 극복할 수 있었다. 이는 상전이 물질이 활성탄의 미세세공에 충진되면 세공 내에서 상전이 물질이 팽창 및 수축이 일어나면서 좁고 불규칙한 세공벽이 상전이 물질을 정체시키지 않고 자연스런 움직임(moving)을 일으켜 고체와 액체를 분리시키는 과냉현상을 방지시킬 수 있기 때문인 것으로 사료되었다. Zhang 등은 상전이 물질의 열저장 특성을 개선할 수 있는 방안으로 다공성 물질에 충진하고 순수 상전이 물질로 수행한 기존 실험과 모델 예측 결과를 비교하였으며[13] 다공성 벌크 물질의 열전도도와 다공도(porosity)가 높을수록 더 높은 열저장 성능을 나타내었으며, 높은 열전도도의 다공성 물질의 활용이 상전이 물질의 열저장 특성을 개선할 수 있는 유용한 방법임을 확인하였다.
3.2.4. 활성탄 세공에 충전된 상전이 물질의 조합에 따른 열흡수 및 방출
Fig. 7은 15℃ (caprylic acid), 25℃ (Mn(NO3)2・6H2O), 35℃ (Zn(NO3)2・6H2O) 각각의 근처 온도에서 상전이가 일어나는 각각의 물질을 낮은 온도부에서 일어나는 물질을 하부에서부터 순차적으로 적층시키고 각각에 대하여 열의 흡수 및 방출에 따른 온도변화를 나타낸 것이다. 각 물질별로 열의 흡수의 경우 하부에서부터 상부까지 점진적으로 진행되며 특히 상부에서 열의 흡수가 많음을 나타내고 있다. 반면에 열 방출의 경우 상부보다는 하부에서 많이 진행됨을 보여주고 있다. 이는 외부로부터 에너지를 받으면 활성탄으로의 열전달시간이 걸리기 때문에 열 흡수의 경우 상부에 축열이 일어나고 반대로 열 방출의 경우 하부에서 축열이 일어나는 것으로 사료되었다.
Fig. 8은 각각의 상전이 물질을 균일하게 혼합하였을 때 일어나는 온도변화를 나타낸 것이다. 적층한 경우는 열의 흡수 및 방출이 높이에 따라 분포가 다르게 나타났으나 균일하게 혼합한 경우는 10℃부터 50℃까지, 50℃에서 10℃까지 광범위 온도에서 균일한 분포로 일어났다. 이에 따라 상전이 물질의 조합에 의해서 주변열의 흡수시간 및 주변으로의 열 방출시간을 더 연장시킬 수 있어서 보다 더 안정적으로 안정적 온도유지를 할 수 있을 것으로 판단되었다. Regin 등은 PEG (Polyethylene glycol)을 다른 세공 특성을 지닌 탄소 기반의 다공성 물질들(Expandable graphite, granular activated carbon, CMK-5)에 충진한 후 FT-IR 측정을 통해 상전이 물질이 탄소 및 실리카 기반의 다공성 물질의 세공에 충진되며 발생하는 화학적 변화를 분석한 결과, 파라핀계 wax류 상전이 물질을 활성탄 상전이 물질을 충진시킬 경우 C=O / O-H 그룹 사이의 수소결합에 의해 피크의 shift가 일어났으며 상전이 물질의 열흡수 및 방출능력이 저하되었다고 보고하였다[4]. 결론적으로 본 연구의 결과로 보아 상전이 물질 저장용기로서 활성탄은 수화물 함유 무기성 상전이 물질이 더 적당함을 알 수 있다.
3.2.5. 활성탄 세공에 충전된 상전이 물질의 조합에 따른 열 흡수 및 방출의 장시간 반복실험
Fig. 9는 주변의 온도변화에 따른 활성탄 세공 내에서 상전이 물질의 온도변화를 나타낸 것이다. 주변의 온도변화는 5℃에서 10℃, 10℃에서 다시 5℃, 10℃에서 30℃, 30℃에서 10℃ 등과 같이 점차적으로 승온과 냉각을 반복하고 이에 따라 상전이물질의 온도감응을 나타낸 것이다. 사용한 상전이 물질은 Fig. 8에서 사용한 caprylic acid, Mn(NO3)2・6H2O, Zn(NO3)2・6H2O 각각을 충진한 활성탄을 혼합하여 수행한 것이다. 주변 온도가 상승할 경우 상전이 물질의 승온속도는 느리고 주변온도가 냉각시에는 상전이 물질의 온도 하강속도는 마찬가지로 느림을 보여주었으며[14] 그 변화폭이 주변온도와 약 10℃ 정도 차이가 남을 보여주고 있다. 또한, 이와 같은 과정은 수십 번의 반복에서도 비슷한 양상을 보여주어서 활성탄 세공에 상전이 물질을 충진 하여도 안정된 열 충전 매체로 사용할 수 있음을 확신할 수 있었다. 또한, 이와 같은 온도의 승온속도 및 하강속도의 지연은 상전이 온도가 다른 물질을 조합하면 광범위온도에서 열의 흡수 및 방출이 가능한 열축적 매체를 개발할 수 있음을 알 수 있었다.
4. 결 론1) 상전이 물질로서 지방산인 acprylic acid, 알칸계 물질인 n-hexadecane은 과냉각 현상이 없었으나 수화물 함유 무기성 상전이 물질은 액체와 고체가 분리되는 과냉각 현상이 발생하였다.
2) 과냉각 형상은 열을 흡수하는 승온과정에서는 발생하지 않았으나 열을 방출하는 냉각과정에서 발생하였으며 수화물 함량이 높을수록 경향을 뚜렷하게 나타내었다. 반면에 다공성 물질인 활성탄 세공에 상전이 물질을 충전하여 사용 시 냉각과정에서 과냉각현상이 해소되었으며 이는 액체에서 고체로 상전이 시 세공 내의 좁은 공간에서 상전이 물질이 팽창 및 수축이 일어나면서 자연스런 움직임(moving)을 일으켜 상전이 물질을 정체시키지 않고 외부자극이 조성되었기 때문이라고 사료되었다.
3) 융점이 다른 수화물 함유 무기성 상전이 물질을 혼합시킬 경우 각 물질의 고유 융점에서 열의 흡수 및 방출이 재현되었으며, 활성탄 세공에 충진하였을 경우도 마찬가지였다. 융점이 다른 각각의 상전이 물질을 활성탄 세공에 충진 후 혼합하여 사용할 경우 광범위한 온도에서 열의 흡수 및 방출제로 사용 가능함을 알 수 있었다.
Fig. 3.Comparison of volume in tube between liquid phase temperature of 50℃ (a), and solid phase temperature of 10℃(b). 
Fig. 4.Thermal history of Heat storage and emission for pure PCMs : (a) Caprylic acid, (b) n-Hexadecane, (c) Mn(NO3)2・6H2O, (d) Mn(NO3)2・4H2O, (e) Zn(NO3)2・6H2O. 
Fig. 5.Thermal history of Heat storage and emission for pure PCMs mixture : (a) Mn(NO3)2・4H2O+Mn(NO3)2・6H2O, (b) Mn(NO3)2・4H2O+Zn(NO3)2・6H2O, (c) Mn(NO3)2・6H2O+Zn(NO3)2・6H2O. 
Fig. 6.Thermal history of Heat storage and emission for activated carbon embedded with PCMs: (a) Caprylic acid, (b) Mn(NO3)2・6H2O, (c) Zn(NO3)2・6H2O. 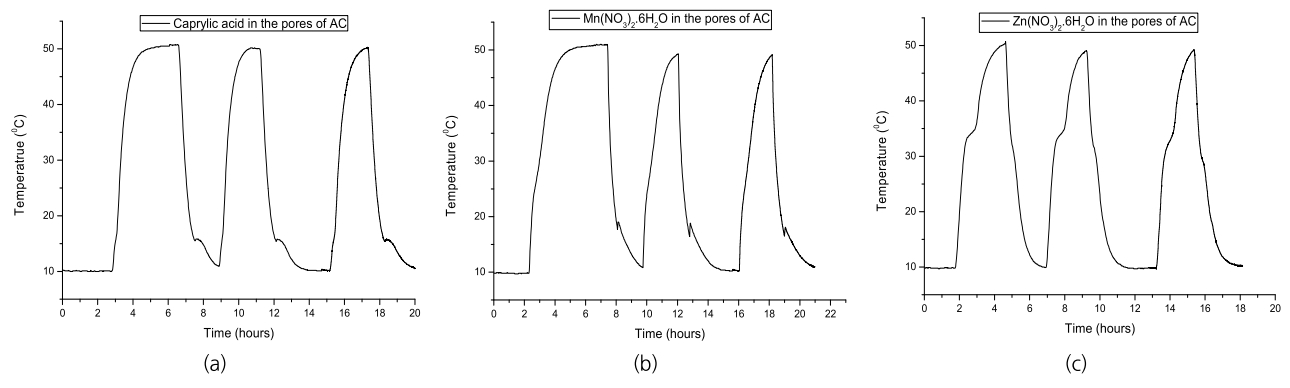
Fig. 7.Thermal history of Heat storage and emission in (a) bottom, (b) middle, (c) top of the test tube test tube stacked with different activated carbon embedded with PCMs. 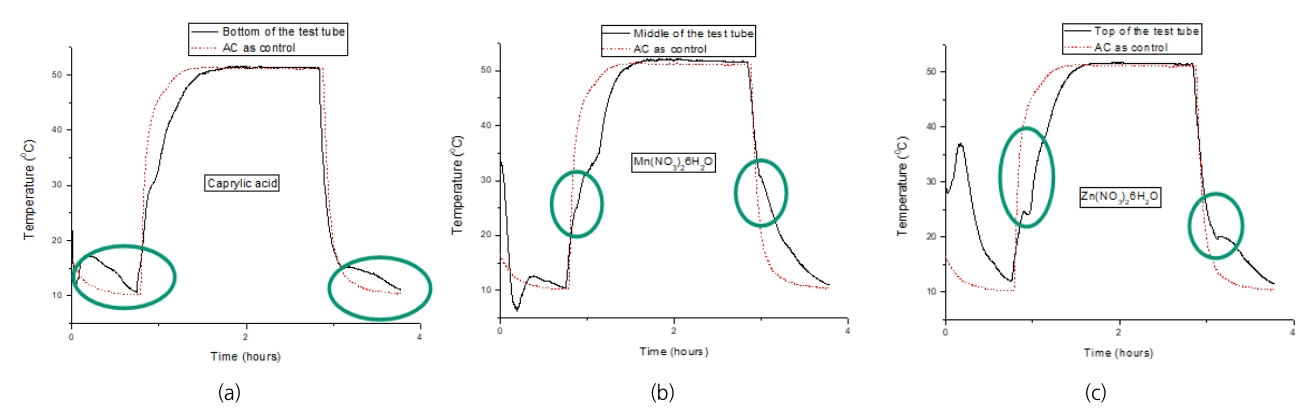
Fig. 9.Comparison of thermal history between outer temperature of the test tube as control and inner temperature of the test tube mixed with activated carbon PCMs. 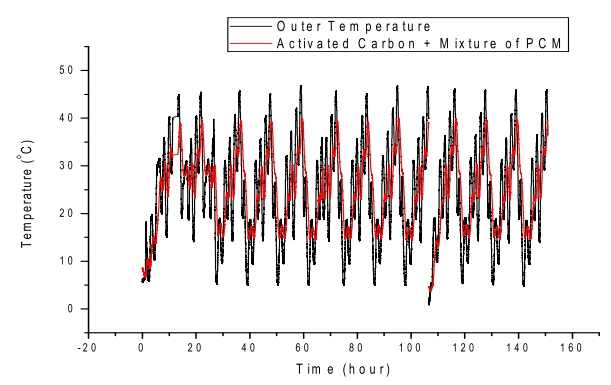
Table 1.Thermal characteristics of pure PCMs. References1. M. Eslami, M. A. Bahrami, Sensible and latent thermal energy storage with constructal fins, Int. J. Hydrogen Energy., 42(28), 17681-17691(2017).
2. A. Sharma, V. V. Tyagi, C. R. Chen, D. Buddhi, Review on thermal energy storage with phase change materials and applications, Renew. Sust. Energ. Rev., 13(2), 318-345(2009).
3. M. M. Farid, A. M. Khudhair, S. A. K. Razack, S. Al-Hallaj, Review: A review on phase change energy storage: materials and applications, Energy Convers. Manage., 45(9-10), 1597-1615(2004).
4. A. F. Regin, S. C. Solanki, J. S. Saini, Heat transfer characteristics of thermal energy storage system using PCM capsules: A review, Renew. Sust. Energ. Rev., 12(9), 2438-2458(2008).
5. W. Aftab, X. Huang, W. Wu, Z. Liang, A. Mahmood, R. Zou, Nanoconfined phase change materials for thermal energy applications, Energy Environ. Sci., 11(6), 1392(2018).
6. C. Y. Zhao, G. H. Zhang, Review on microencapsulated phase change materials(MEPCMs): fabrication, Renew. Sust. Energ. Rev., 15(8), 3813-3832(2011).
7. L. Chen, T. Wang, Y. Zhao, X.-R. Zhang, Characterization of thermal and hydrodynamic properties for microencapsulated phase change slurry (MPCS), Energ. Convers. Manage., 79, 317-333(2014).
8. S. Mondal, Phase change materials for smart textiles–An overview, Appl. Therm. Eng., 28(11-12), 1536-1550(2008).
9. H. U. Paksoy, Thermal energy storage for sustainable energy consumption: fundamentals, case studies and design, 1st ed., Springer Netherlands, Netherlands, pp. 3-22(2007).
10. P. Charunyakorn, S. Sengupta, S. K. Roy, Forced convection heat transfer in microencapsulated phase change material slurries: flow in circular ducts’, Int. J. Heat Mass Transf., 34(3), 819-833(1991).
11. H. Mehling, L. F. Cabeza, Heat and cold storage with PCM. An up to date introduction into basics and applications, 1st ed., Springer-Verlag Berlin Heidelberg, Germany, pp. 11-55(2008).
12. L. Royon, G. Guiffant, P. Flaud, Investigation of heat transfer in a polymeric phase change material for low level heat storage, Energy Convers. Manag., 38(6), 517-524(1997).
|
|
||||||||||||||||||||||||||||||||||||||||