The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
NaA 형 제올라이트를 이용한 수중의 Sr 이온 제거에서 회분식 및 연속식 운전 특성
Abstract
The adsorption characteristics of Sr ion in aqueous solution was examined using zeolite NaA powder (Z-PA) and pellets (Z-BA). In batch experiment, the adsorption of Sr ions by Z-BA and Z-PA was well expressed by pseudo-second-order kinetic model than psedo-first-order kinetic model. Experimental isotherm results was well fitted to Langmuir isotherm model and the maximum adsorption capacities obtained from Langmuir isotherm model were 233.32 mg/g for Z-PA and 164.60 mg/g for Z-BA, respectively. The continuous experiment results showed that the total Sr ion uptake (q) increased, but the breakthrough time, effluent volume (Veff) and total removal (R) of Sr ion decreased with the Sr ion concentration. The breakthrough curves obtained from the experiment was modeled by Thomas model.
Key words: Zeolite, Adsorption, Sr ion, Batch, Continuous
요약
NaA 제올라이트 분말(Z-PA) 및 펠렛(Z-BA)를 이용하여 수중의 Sr 이온의 흡착특성을 검토하였다. 회분식 실험에서 Z-BA와 Z-PA에 의한 Sr 이온의 흡착은 유사 1차식보다는 유사 2차식에 잘 부합되었고, 등온 흡착실험 결과는 Langmuir 등온식에 잘 부합하였으며, 이 등온식으로부터 구한 최대 흡착량은 Z-PA는 233.32 mg/g, Z-BA는 164.60 mg/g이었다. 연속식 실험에서 Sr 이온의 농도가 증가함에 따라 Sr 이온의 총 흡착량(q)는 증가하였으나 파과시간, 처리 부피(Veff) 및 총 제거율(R)은 감소하였다. 실험으로부터 구한 파과곡선은 Thomas 모델식에 의해 잘 모사되었다.
주제어: 제올라이트, 흡착, 스트론튬 이온, 회분식, 연속식
1. 서 론
과학기술 발전, 산업의 고도화, 에너지 소비 증가 등으로 인하여 전 세계적으로 경제성과 안정성을 가지는 원자력 발전소를 건설하여 사용하고 있으나, 운영 중에 발생하는 방사선 피폭과 방사성 폐기물의 처리 문제는 원자력 이용에 대한 찬반 논쟁과 사회적 갈등의 주된 요인이 되고 있다. 특히, 러시아 체르노빌 원전 폭발사고 및 일본 후쿠시마 원전사고 이후 방사성 핵종의 처리문제는 시급히 해결해야 할 중요한 과제로 떠오르고 있다[ 1]. 일반적으로 방사성 물질들은 반감기가 길고 물에 대한 용해도가 큰 특성을 가지고 있어 토양으로 유출되었을 경우 토양 오염, 지하수 오염, 그리고 지하수의 흐름에 따른 오염 확산 등의 문제를 일으키게 된다[ 2]. 그 중 Sr은 체내에 유입될 때 다양한 조직으로 이동하며, 제거 또는 소멸 될 때까지 계속해서 방사선을 방출해 체내를 오염시키므로 백혈병, 피부병, 골암 등의 질병을 유발할 수 있다[ 3]. 수중의 Sr 이온을 제거하기 위한 방법으로 침전법[ 4], 이온교환법[ 5], 용매추출법[ 6], 흡착법[ 7] 등이 사용되고 있다. 침전법은 응집․침전제를 첨가하여 방사성 핵종물질을 수화물 형태로 공침시키는 방법으로써 저비용으로 대량으로 처리가 가능하지만 다량 발생되는 슬러지의 침전분리를 위해 많은 시간이 소요된다. 이온교환방법은 응집침전에 비해 중금속 처리효율이 높고 저농도 중금속 및 독성물질을 선택적으로 제거할 수 있지만, 고가의 이온교환 수지를 사용해야 하기 때문에 물질 회수 및 흡착제가 재사용되지 않을 경우 경제성이 떨어질 수 있다. 용매추출법은 금속이온의 선택성과 제거능이 우수하지만 다량으로 사용되는 유기용매의 손실이 발생하기 때문에 추가적인 수질오염을 가져오는 문제를 일으킬 수 있다. 이에 반하여 흡착법은 설치비가 저렴하고 에너지가 적게 요구되고, 환경 친화적이며 보조연료가 필요없기 때문에 경제성 및 조작성의 관점에서 수중의 Sr과 같은 방사성 이온을 제거 하는데 있어서 가장 유용한 방법으로 알려져 있다[ 8]. 흡착제로는 활성탄, 금속산화물, 천연 광물, 제올라이트 등이 사용되고 있으나, 이들 흡착제 중에서 제올라이트는 다른 종류의 흡착제에 비하여 흡착능이 우수하며 열적으로 안정하기 때문에 방사능 이온 제거에 널리 이용되고 있다. Chefrouche 등[ 9]은 활성탄으로 Sr 이온을 제거하였을 때는 흡착량이 44.4 mg/g이었다고 하였고, Smiciklas 등[ 10]은 천연 제올라이트인 클리노프틸로라이트를 사용한 경우에 흡착량이 6.69 mg/g였으며, El-Kamash [ 11]은 합성 제올라이트를 이용하여 Sr 이온 제거 시에는 흡착량이 202.5 mg/g이었다고 하였다. 하지만 제올라이트는 나노미터에서 마이크로미터 크기를 가지는 미세한 결정 입자이기 때문에 폐수와 잔여물로부터 고액분리가 어렵고 재사용이 힘들다. 또한 제올라이트를 분말 형태로 고정상 컬럼에 충전하여 사용할 경우 여층의 막힘으로 인한 압력강하를 일으킬 수 있다[ 12]. 따라서 이러한 문제를 보완하기 방안으로 분말 형태의 흡착제를 펠릿형태로 제조하여 사용하는 연구가 되고 있다. Gulay와 Yakup [ 13]은 fungus를 펠릿으로 제조하여 수은, 카드뮴, 아연과 같은 중금속 이온을 제거하는 연구를 하였고, Kim 등[ 14]은 인공 제올라이트 펠릿을 이용하여 폐수중의 암모니아를 흡착제거하는 연구를 수행하였다. 또한 Juang과 Shao [ 15]는 키토산비드를 제조하여 수중의 구리, 니켈, 아연 이온을 제거하는 연구를 하였다. Silva와 Rodrigues [ 16]은 5A 제올라이트를 펠릿으로 제조하여 헥산을 제거하는 연구를 하였다. Han 등[ 17]과 Bhatnagar 등[ 18]은 red mud를 펠릿으로 만들어 수중의 중금속 이온을 제거하는 연구를 하였다. 따라서, 본 연구에서는 상용 Na-A 제올라이트를 분말(Z-PA) 과 이로부터 제조한 펠릿(Z-BA)을 이용하여 회분식 실험과 연속식 실험을 수행하여 방사성 물질인 Sr 이온에 대한 흡착효율을 비교 검토하였다. 분말과 펠릿 형태의 제올라이트 특성은 SEM, XRD, XRF를 통해 분석하였다. 회분식 흡착실험을 통해 흡착 속도와 등온흡착 특성을 알아보고, 연속 고정층 실험을 통해 흡착 파과특성을 평가하였다.
2. 재료 및 방법
2.1. 실험재료
본 연구에 사용된 제올라이트는 상업용 Na-A 제올라이트(Z-PA : Cosmo fine chemicals Co., Ltd)를 이용하였다. 제올라이트 펠릿(Z-BA)은 다음과 같이 제조하였다. 구입한 Na-A 제올라이트 분말과 유기(메틸셀룰로오스)/무기(실리카, 물유리) 바인더를 적절한 비율로 혼합한 후 반죽기에서 1차 반죽(건식 혼합)을 하였으며, 1차 반죽된 Na-A형 제올라이트를 2차 반죽(습식 반죽)하여 2시간동안 숙성 후 압출성형기에서 직경 약 3 mm 노즐로 압출 성형하였다. 압출 성형된 Na-A형 제올라이트는 105~110 ℃에서 건조 후 절단기를 이용하여 길이 3~5 mm 펠릿 형태로 절단하였다. 이를 450℃에서 1시간 동안 소성하여 제조하였다.
실험에 사용된 대상이온인 Sr은 질산스트론튬(Sr(NO3)2, Samchun, EP)을 사용해 각각의 이온에 대해서 1,000 mg/L의 모액(stock solution)을 만든 다음 이것을 희석하여 사용하였다.
2.2. 분석방법
Z-PA의 결정구조는 X선 회절 분석장치(X-ray diffractometer, XRD, Rigaku, D/MAX2100H)를 이용하여 분석하였다. XRD의 분석조건은 Cu Ka ray 광원(λ = 1.54 Å)에서 가속전압 및 전류를 각각 40 kV와 40 mA로 설정하여 분말 형태의 시료(Z-PA)를 주입한 후 2θ를 5° - 50°의 범위에서 0.02° step (3 s/step)으로 분석하였다. Z-PA와 Z-BA의 화학적 조성을 분석하기 위하여 X-Ray Fluorescence Spectrometer (XRF, Shimadzu. XRF-1700)을 이용하였다. 주사전자현미경(Scanning Electron Microscope, SEM, Hitachi, S-2700)로부터 촬영된 SEM 사진을 이용하여 Z-PA와 Z-BA의 미세한 결정 및 표면구조를 관찰하였다.
2.3. 실험방법
회분식 실험은 500 mL의 삼각플라스크에 일정 농도의 Sr 이온 용액 200 mL를 분취하여 흡착제 1 g을 넣은 후 수평진탕기(Johnsam, JS-FS-2500)상에서 180 rpm으로 교반하면서 일정시간 간격으로 시료를 채취하면서 수행하였다. Sr 이온의 농도는 원자흡광광도계(Shinmadzu. AA-7000)를 이용하여 분석하였다.
흡착제에 흡착된 Sr 이온의 흡착량은 다음 식으로 계산하였다.
여기에서, qt는 흡착시간 t에서 Sr 이온의 흡착량(mg/g), C0와 Ct는 각각 초기시간과 흡착시간 t에서 용액 내 Sr 이온 의 농도(mg/L), V와 M은 각각 용액의 부피(L)와 사용된 흡착제 양(g)이다.
고정층 흡착의 실험은 직경 2 cm인 유리 컬럼에 일정량의 Z-BA을 채우고 상향류식으로 실시하였다. 페리스탈틱펌프(Masterflex, USA)를 사용하여 일정 농도의 Sr 이온 용액을 일정 속도로 컬럼에 유입시켰으며, 컬럼 상단에서 유출되는 용액을 채취하여 Sr 이온 농도를 분석하였다.
3. 실험 결과
3.1. 특성분석
Table 1은 제올라이트 분말(Z-PA)와 펠릿(Z-BA)의 XRF분석 결과를 나타낸 것이다. Table 1에서 보듯이 사용한 Z-PA와 Z-BA의 성분조성은 각각 SiO 2 59.3%, Al 2O 3 26.7%, Na 2O 13.33%과 SiO 2 69.5%, Al 2O 3 19.7%, Na 2O 9.29%로 구성되어 있었다. Z-PA와 Z-BA의 Si/Al 몰비는 각각 1.89와 2.99로서 Z-PA의 경우 표준 제올라이트 A의 값과 유사하였지만 Z-BA는 펠릿의 제조과정에서 바인더가 첨가되어 Si/Al 몰비가 달라진 것으로 사료되었다.
Fig. 1은 실험에 사용한 제올라이트(Z-PA)의 XRD 분석 결과를 나타낸 것이다. Fig. 1(a)에서 보면 7.2 - 34.2의 2θ 값 범위에서 회절 피크가 관측되었으며, 이를 Fig. 1(b)에서 JCPDS card의 표준 Na-A형 제올라이트(Na 12Al 12Si 12O 4827.4H 2O)의 XRD피크와 비교해 보면 주요 회절피크의 위치가 거의 표준 Na-A형 제올라이트와 일치하였다.
Fig. 2는 Z-PA와 Z-BA의 SEM 이미지를 비교하여 나타낸 것이다. Fig. 2(a)에서 보듯이 Z-PA는 Na-A형 제올라이트의 전형적인 구조인 정방형 결정구조를 나타내고 있으며, Fig. 2(b)에서 Z-BA는 분말상 제올라이트인 Z-PA를 펠릿화하기 위하여 혼합한 바인더에 정방형 입자가 결합된 구조를 나타내고 있다.
3.2. 회분식 실험
3.2.1. Z-PA 및 Z-BA의 흡착 특성
Fig. 3은 Z-PA와 Z-BA를 이용하여 Sr 이온의 초기 농도를 각각 100~ 500 mg/L와 500~900 mg/L로 달리한 경우에 시간에 따른 흡착량 변화를 나타낸 것이다. Fig. 3(a)에서 보면 Z-PA는 0.5 h까지는 빠르게 흡착이 이루어지다가 차츰 완만해져서 약 1 h 이후에서는 변화가 거의 일어나지 않았다. 따라서 이 시간에 평형에 도달하였다고 간주한다. 이러한 현상은 일반적으로 흡착 초기 단계에서는 제올라이트 분말에 비어 있는 활성점이 많아 쉽게 흡착이 일어나지만, 시간이 경과할수록 비어 있는 활성점이 감소하게 되기 때문으로 사료된다[ 19]. Sr 이온의 초기농도가 100~500 mg/L으로 증가함에 따라 Sr 이온의 흡착량은 202.78~230.08 mg/g으로 증가하였다. 반면, Fig. 4(b)에서 보면 Z-BA를 사용한 경우에는 대체로 48 h까지 빠르게 흡착이 이루어지다가 차츰 완만해져서 약 72 h 이후에는 평형에 도달하였다. 또한, Sr 이온의 초기농도를 Z-PA에 비해 500~900 mg/L으로 높게 하여도 Sr 이온의 흡착량은 82.98~126.49 mg/g으로 Z-PA에 비해 상대적으로 낮게 나타났다. 이러한 결과는 Z-BA를 제조시 첨가한 바인더 양만큼 제올라이트의 함량이 감소하기 때문으로 판단된다. Z-PA와 Z-BA의 흡착평형시간을 비교해 보면 Sr 이온이 Z-BA 표면의 흡착점으로부터 흡착이 진행되다가 펠릿 내부의 흡착점으로 확산되면서 흡착평형에 도달하기 때문으로 Sr 이온의 흡착시 Z-PA보다는 Z-BA가 물질전달저항이 커지기 때문에 흡착 평형시간이 길어진 것으로 사료된다[ 20].
3.2.2. 흡착 속도식
Z-PA 및 Z-BA에 의한 Sr 이온의 흡착속도를 유사 1차 속도식과 유사 2차 속도식을 각각 적용하여 검토하였다.
유사 1차 속도식은 다음과 같이 나타낸다[ 21]. 여기서, k1은 유사 1차 속도상수(1/min)이고, qe와 qt는 각각 평형흡착시간과 시간 t에서의 흡착량(mg/g)이다.
또한 유사 2차 속도식은 다음과 같이 나타낸다.[ 22] 여기서, k2는 유사 2차 속도상수(g/mg·min)이다.
Z-PA를 흡착제로 사용한 경우에는 Table 2에서 보면 유사 1차 속도식의 경우는 결정계수( r2)가 0.6241~0.9215이나, 유사 2차 속도식의 경우는 0.9994~0.9999이며, Z-BA를 사용한 경우에는 Table 3에서 보듯이 유사 1차 속도식의 경우는 r2은 0.9463~0.9867이나, 유사 2차 속도식의 경우는 0.9796~0.9977로써 Z-PA와 Z-BA 모두 유사 2차 속도식에 잘 맞는 것을 알 수 있다. 이는 본 연구자들이 합성 제올라이트로 Cu와 Zn의 제거 연구[ 23]와 합성 제올라이트로 Sr 이온의 제거 연구[ 24]에서와 같은 결과를 보였다. El-Kamash [ 11]도 제올라이트를 이용한 Sr 이온 흡착 연구 결과에서 실험결과에서 유사 1차 속도식보다는 유사 2차 속도식에 의해 더 잘 예측될 수 있었다고 하였다. 이러한 결과는 Sr의 흡착이 물리흡착보다는 화학흡착에 의해 빠르게 진행되기 때문에 흡착속도가 유사 2차 속도식에 더 잘 맞는 결과를 보여 주고 있다. 또한, Table 2에서 Z-BA가 Z-PA에 비해 유사 1차식에서 상대적으로 r2이 높게 나타난 것은 Sr 이온의 흡착시 Z-BA의 공극까지의 물질전달저항에 커져 흡착 속도도 느려지면서 물리흡착과 유사한 경향성을 보인 것으로 사료된다.
3.2.4. 흡착 등온식
흡착제와 흡착질 분자의 흡착 현상을 단분자층 흡착을 가정한 Langmuir 등온식은 다음과 같이 표현된다.
여기서, qm은 Sr 이온의 최대 흡착량(mg/g), kL는 Langmuir 상수(L/mg) 및 Ce는 평형흡착농도(mg/L)이다.
흡착제와 흡착질 분자의 흡착 현상을 다분자층 흡착으로 설명한 Freundlich 등온식은 다음과 같다.
여기서, kF는 Freundlich 상수(L/mg)이고, 1/n은 흡착강도에 대한 상수이다.
Fig. 6은 Z-PA와 Z-BA에 의한 Sr 이온의 등온 평형 실험 결과와 이를 식 (5)와 (6)에 적용하여 계산한 값을 비교하여 나타낸 것이고, 이로부터 구한 파라미터 값들을 Table 4에 요약하였다. Table 4에서 r 2를 비교해 보면 Z-PA와 Z-BA의 경우 모두 Freundlich 등온식 보다는 Langmuir 등온식에 더 부합하는 것으로 나타났다. Z-PA에 의한 Sr 흡착은 C e가 134.47 mg/L 이상에서 qe값이 225.76~233.58 mg/g으로 흡착 평형에 도달하며, Langmuir 등온식에도 잘 부합하는 전형적인 화학흡착에 대한 경향을 보였다. 하지만, Z-BA에 의한 Sr 흡착은 C e가 91.50~273.34 mg/L으로 증가함에 따라 qe가 82.98~126.49 mg/g으로 점차 증가하는 경향을 보여 화학흡착에 진행이 되지만, Z-BA의 내부 공극으로 Sr 이온이 전달되는 과정에 저항이 발생하여 물리흡착과 유사한 경향을 보인 것으로 판단된다. 이러한 결과는 본 연구자들이 합성 제올라이트를 이용한 Sr 제거연구[ 24]에서 Langmuir 등온식에 더 부합하는 결과와 유사하였다. Langmuir 등온식으로부터 구한 최대흡착량은 Z-PA는 233.32 mg/g, Z-BA는 164.60 mg/g이었다. Z-PA에 비해 Z-BA의 흡착량이 작은 것은 Z-BA의 제조시에 바인더가 첨가됨으로써 제올라이트의 함량이 상대적으로 작기 때문으로 사료된다.
3.3. 연속식 실험
고정층 칼럼에서 처리한 용액의 양인 처리부피(Veff)는 다음과 같고,
컬럼에서 흡착된 Sr의 흡착량( q)은 다음과 같이 된다[ 25]. 여기서 q는 흡착량(mg/g), t는 운전시간(min), Q는 유량(mL/min), C0는 유입농도(mg/L)이다.
컬럼으로 유입된 Sr의 총량(m)은 다음과 같으며
컬럼에서 Sr의 제거율( R)은 다음과 같다[ 26].
Fig. 7은 Sr 이온의 유입 유량을 1.4 mL/min으로 일정하게 하고 Sr 이온의 유입 농도를 100, 150, 250 mg/L로 변화시키면서 얻은 파과곡선을 나타낸다. Fig. 7의 파과곡선으로부터 파과시간(τ 0.06)과 포화시간(τ 0.95)을 구하고 식 (6)~ (9)에서 q와 R 등의 변수들을 구하여 Table 5에 나타내었다. Table 5에서 보듯이 Sr 용액의 유입농도가 100, 150 및 250 mg/L로 증가함에 따라 Veff는 각각 62 L, 50 L 및 38 L로 감소하였으며, 파과시간은 각각 207 h, 140 h 및 46 h로 감소하였다. 이 결과는 고정층 칼럼으로 유입되는 Sr 용액의 유입농도가 증가함에 따라 흡착질과 흡착제의 농도차에 따른 흡착 구동력이 커져 컬럼내에 충전된 흡착제의 활성점의 포화속도가 증가하기 때문으로 판단된다. Sr 용액의 유입농도가 증가함에 따라 q는 점차 증가하는 경향을 보이지만, 유입농도의 증가에 따른 컬럼을 통과하는 Sr의 총량이 증가하기 때문에 R은 감소하였다.
고정층 흡착컬럼의 성능을 해석하는데 가장 널리 사용되는 모델식 중의 하나인 Thomas 모델식은 다음과 같이 표현된다[ 27]. 여기서 kTh는 Thomas 속도상수(mL/ minxmg), qe는 Sr 흡착 용량(mg/g), 그리고 X는 흡착제 양(g)이다.
실험 자료를 Thomas 모델 식 (1)에 적용하고 비선형 회귀를 사용하여 구한 kTh, qe, 및 r 2 값들을 Table 6에 나타내었 다. Thomas 모델식을 적용한 경우에 Table 6에서 보면 r 2 값이 0.9901~0.9980였으며, Fig. 7에서 보듯이 Thomas 모델식은 실험결과를 잘 나타내주었다. Table 6에서 보면 유입 농 도가 증가함에 따라 qe값이 증가하지만 kTh값은 감소한다는 것을 보여주고 있다. 이는 흡착 구동력이 흡착제 상의 Sr 이온과 용액중의 Sr 이온 사이의 농도차이므로, Sr의 농도가 높아짐에 따라 흡착 구동력이 높아져 흡착컬럼의 성능을 더 향상시키기 때문으로 생각된다.
4. 결 론
NaA 제올라이트 분말(Z-PA)과 이로부터 제조한 펠릿(Z-BA)을 이용하여 수중의 Sr 이온 흡착특성을 검토하기 위하여 회분식 실험과 연속식 실험을 수행하였다.
회분식 실험결과에서 Z-PA와 Z-BA에 의한 Sr 이온의 흡착은 유사 2차 속도식이 유사 1차 속도식에 비해 더 잘 부합하였다. 등온 흡착실험 결과는 Langmuir 등온식을 잘 만족하였으며, Langmuir 등온식으로부터 구한 최대 흡착량은 Z-PA는 233.32 mg/g, Z-BA는 164.60 mg/g으로써 Z-BA의 경우에 제조시 첨가한 바인더 양만큼 흡착량이 작았다. 또한, 연속식 실험에서 Sr 용액의 유입농도가 100, 150 및 250 mg/L로 증가할 경우 처리 부피(Veff)는 각각 62 L, 50 L 및 38 L로 감소하였으며, 파과시간은 각각 207 h, 140 h 및 46 h로 감소하였다. 유입농도가 증가함에 따라 흡착량(q)은 증가하였으나, 총 제거율(R)은 감소하였다. Thomas 모델식은 실험으로부터 얻은 파과곡선결과를 잘 모사해 주었다.
Fig. 1.
XRD peaks patterns of (a) Z-PA and (b) JCPDS card. 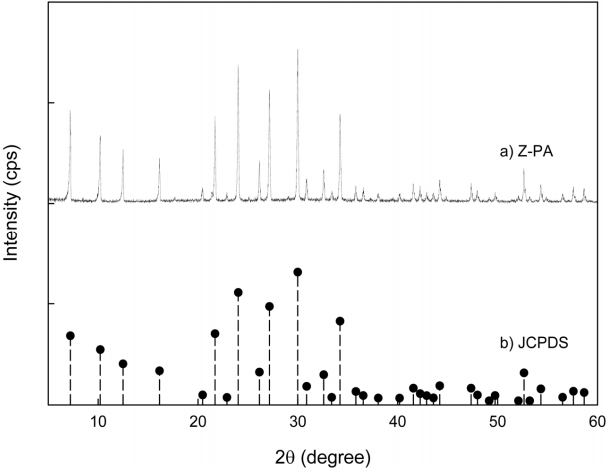
Fig. 2.
SEM images of (a) Z-PA and (b) Z-BA. 
Fig. 3.
Effect of contact time on the adsorption capacity of Sr ions by (a) Z-PA and (b) Z-BA. 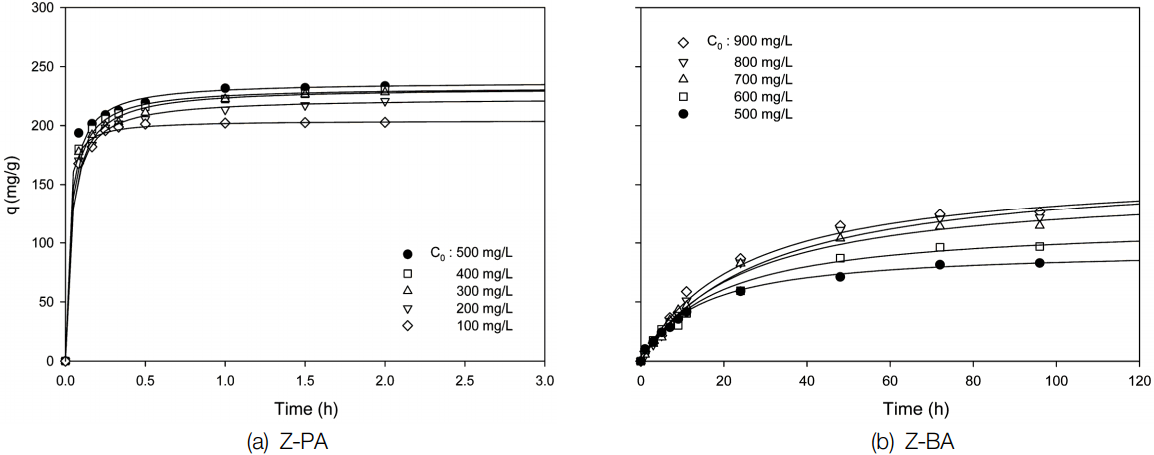
Fig. 4.
Linear plots for the adsorption of Sr ions by Z-PA. 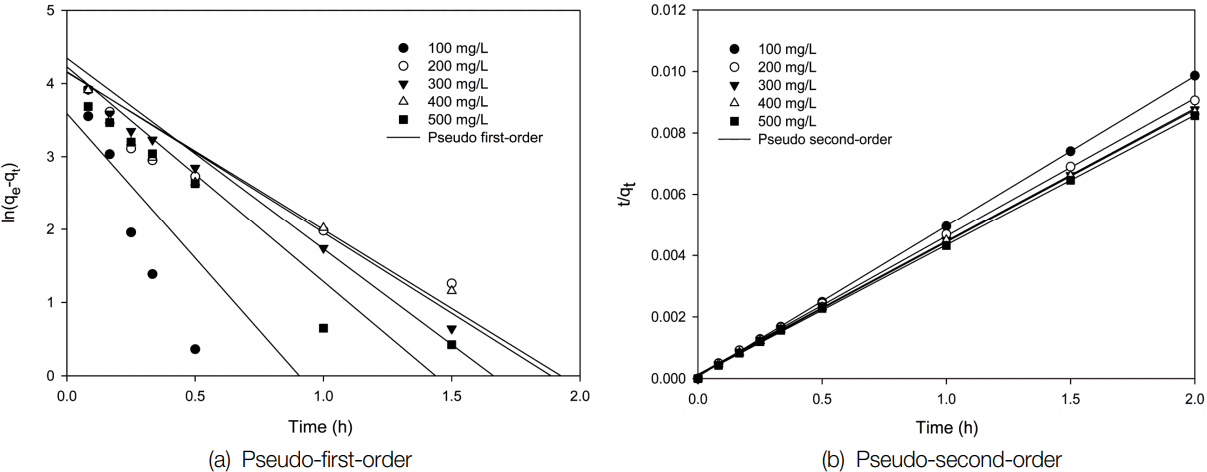
Fig. 5.
Linear plots for the adsorption of Sr ions by Z-BA. 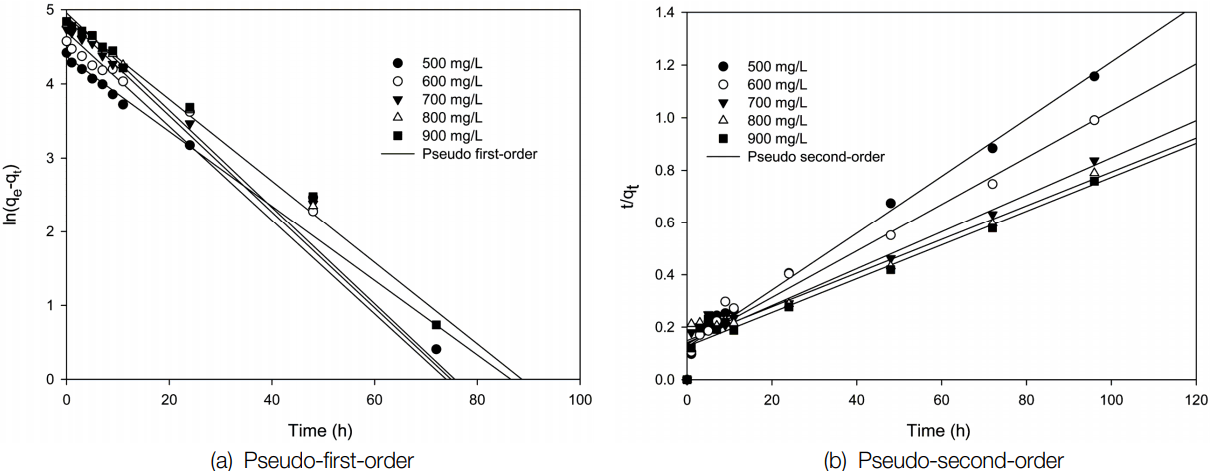
Fig. 6.
Adsorption isotherm of strontium ion on Z-PA and Z-BA and fits of Langmuir and Freundlich models. 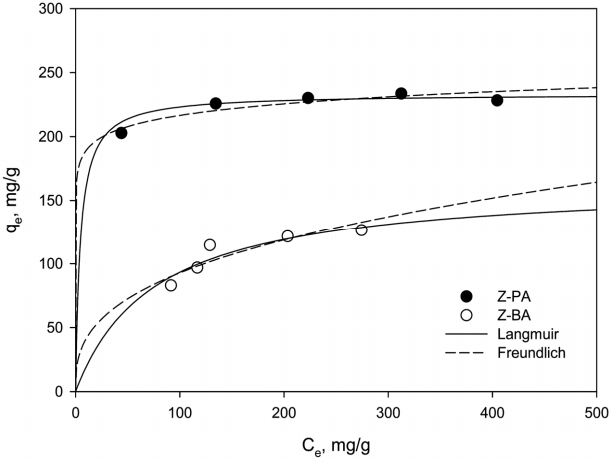
Fig. 7.
Breakthrough curves for different inlet Sr concentrations (Z-BA height : 10 cm, velocity : 1.4 mL/min, particle size : 0.35 mm). 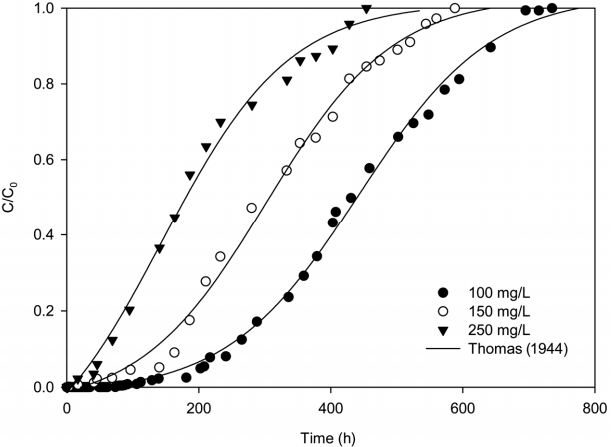
Table 1.
Chemical composition of Z-PA and Z-BA
|
Composition (wt%) |
Powder
|
Bead
|
|
Z-PA |
Z-BA |
|
SiO2
|
59.25 |
69.48 |
|
Al2O3
|
26.66 |
19.72 |
|
Na2O |
13.33 |
9.29 |
|
CaO |
0.76 |
0.53 |
|
Fe2O3
|
- |
0.03 |
|
etc. |
- |
0.95 |
|
|
total |
100.00 |
100 |
|
|
SiO2/Al2O3 mole ratio |
3.77 |
5.98 |
|
|
Si/Al mole ratio |
1.89 |
2.99 |
Table 2.
Kinetic data calculated for the adsorption of Sr ions by Z-PA
|
C0 (mg/L) |
Pseudo-first-order
|
Pseudo-second-order
|
|
qe (mg/g) |
k1 (1/h) |
r2
|
qe (mg/g) |
k2 (g/mg∙h) |
r2
|
|
100 |
21.97 |
0.0410 |
0.6241 |
202.77 |
0.0063 |
0.9999 |
|
200 |
47.88 |
0.0328 |
0.7938 |
220.76 |
0.0029 |
0.9997 |
|
300 |
61.49 |
0.0352 |
0.8726 |
228.25 |
0.0205 |
0.9995 |
|
400 |
76.25 |
0.0423 |
0.8818 |
230.08 |
0.0020 |
0.9994 |
|
500 |
73.17 |
0.0387 |
0.9215 |
233.58 |
0.0022 |
0.9994 |
Table 3.
Kinetic data calculated for the adsorption of Sr ions by Z-BA
|
C0 (mg/L) |
Pseudo-first-order
|
Pseudo-second-order
|
|
qe (mg/g) |
k1 (1/h) |
r2
|
qe (mg/g) |
k2 (g/mg∙h) |
r2
|
|
500 |
90.25 |
0.0532 |
0.9867 |
90.252 |
0.0010 |
0.9977 |
|
600 |
118.25 |
0.0483 |
0.9584 |
118.25 |
0.0005 |
0.9796 |
|
700 |
130.05 |
0.0615 |
0.9505 |
130.05 |
0.0003 |
0.9973 |
|
800 |
131.33 |
0.0513 |
0.9463 |
131.33 |
0.0003 |
0.9977 |
|
900 |
134.80 |
0.0591 |
0.9572 |
134.80 |
0.0004 |
0.9828 |
Table 4.
Comparison of adsorption isotherm constants of Sr ions by Z-PA and Z-BA
|
Material |
Langmuir
|
Freundlich
|
|
qm (mg/g) |
kL (L/mg) |
r2
|
kF (L/mg) |
1/n
|
r2
|
|
Z-PA |
233.32 |
0.2184 |
0.9994 |
164.84 |
0.0592 |
0.8423 |
|
Z-BA |
164.60 |
0.0131 |
0.9707 |
18.05 |
0.3554 |
0.8062 |
Table 5.
Characteristic parameters obtained from breakthrough curves for different inlet Sr concentrations (Z-BA height : 10 cm, velocity : 1.4 mL/min, particle size : 0.35 mm)
|
Co (mg/L) |
Breakthrough time τ0.05 (h) |
Saturation time τ0.95 (h) |
Effluent volume Veff (L) |
Total amount adsorbed (mg) |
Total amount removed (mg) |
Removal R (%) |
Adsorption capacity qe (mg/g) |
|
100 |
207 |
668 |
62 |
6207.6 |
4055 |
65.3 |
135.17 |
|
150 |
140 |
454 |
49 |
7408.8 |
4091 |
55.2 |
136.35 |
|
250 |
46 |
353 |
38 |
9534 |
4184 |
43.9 |
139.49 |
Table 6.
Parameters predicted from Thomas model
|
Co (mg/L) |
qe,exp (mg/g) |
qe,cal (mg/g) |
KTh x 106 (mL/min∙mg) |
r2
|
|
100 |
135.17 |
122.31 |
1.74 |
0.9980 |
|
150 |
136.35 |
129.99 |
1.36 |
0.9966 |
|
250 |
139.49 |
131.49 |
1.02 |
0.9901 |
References
1. B.. Hu, B.. Fugetsu, H.. Yu, Y.. Abe, Prussian blue caged in spongiform adsorbents using distomite and carbon nanotubes for elimination of cesium, J. Hazard. Mater., 217, 85-91(2012).
2. C.. Willms, Z.. Li, L.. Allen, C. V.. Evans, Desorption of cesium from kaolinite and illite using alkylammonium salts, Appl. Clay Sci., 25, 125-133(2004).  3. Y.. Sabriye, E.. Sema, Adsorption characterization of strontium on PAN/Zeolite composite adsorbent, World J. Nucl. Sci. Technol., 1, 6-12(2011).  4. E. I.. Kurbatova, A. I.. Ksenofontov, A. M.. Dmitriyev, J. L.. Regens, Irradiation of sorbents by ions of polymorphic metals for modeling 90strontium sedimentation, Environ. Sci. Pollut. Res. Int., 14(4), 251-255(2007).  5. B. K.. Singh, R.. Tomar, R.. Tomar, S. S.. Tomar, Sorption of homologues of radionuclides by synthetic ion exchanger, Microporous Mesoporous Mater., 142, 629-640(2011).  6. W. W.. Yang, G. S.. Luo, X. C.. Gong, Extraction and separation of metal ions by a column packed with polystyrene microcapsules containing Aliquat 336, Sep. Purif. Technol., 43, 175-182(2005).  7. S. A.. Khan, R.. Rehman, M. A.. Khan, Sorption of strontium on bentonite, Waste Manage., 15(8), 641-650(1995).  8. S. D.. Richardson, M. J.. Plewa, E. D.. Wagner, R.. Schoeny, D. M.. DeMarini, Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research, Muta. Res., 636, 178-242(2007).  9. S.. Chegrouche, A.. Mellah, M.. Barkat, Removal of strontium from aqueous solutions by adsorption onto activated carbon: kinetic and thermodynamic studies, Desalination., 235(3), 306-318(2009).  10. I.. Smiciklas, S.. Dimovic, I.. Plecas, Removal of Cs 1+, Sr 2+ and CO 2+ from aqueous solutions by adsorption on natural clinoptilolite, Appl. Clay Sci., 35(1), 139-144(2007).  11. A. M.. El-Kamash, Evaluation of zeolite A for the sorptive removal of Cs + and Sr 2+ ions from aqueous solutions using batch and fixed bed column operations, J. Hazard. Mater., 151(2), 432-445(2008).  12. H.. Faghihian, M.. Iravani, M.. Moayed, M.. Ghannadi- Maragheh, Preparation of a novel PAN-zeolite nanocomposite for removal of Cs + and Sr 2+ from aqueous solutions: Kinetic, equilibrium, and thermodynamic studies, J. Chem. Eng., 222, 41-48(2013).  13. M.. Gulay, M.. Yakup, Removal of heavy mercury(II), cadmium(II) and zinc(II) metal ions by live and heat inactivated Lentinus edodes pellets, J. Chem. Eng., 143(1-3), 133-140(2008).  14. W. T.. Kim, S. O.. Lee, Y. H.. Yun, B. S.. Shin, Ammonia removal characteristics of artificial zeolite pellet using multi-stage adsorption column, J. Korean Res. Recycling., 7(1), 20-26(1998).
15. R. S.. Juang, H. J.. Shao, Effect of pH on competitive adsorption of Cu(II), Ni(II), and Zn(II) from water onto chitosan beads, Adsorption., 8(1), 71-78(2002).  16. J. A. C.. Silva, A. E.. Rodrigues, Sorption and diffusion of n-pentane in pellets of 5A zeolite, Eng. Chem. Res., 36(2), 493-500(1997).  17. S. W.. Han, D. K.. Kim, I. G.. Hwang, J. H.. Bae, Development of pellet-type adsorbents for removal of heavy metal ions from aqueous solutions using red mud, J. Korean Soc. Atmos. Environ., 8(2), 120-120(2002).
18. A.. Bhatnagar, V. J. P.. Vilar, C. M. S.. Botelho, R. A. R.. Boaventura, A review of the use of red mud as adsorbent for the removal of toxic pollutants from water and wastewater, Environ. Technol., 32(3), 231-249(2011).  19. M. G.. Lee, S. K.. Kam, K. H.. Suh, Adsorption of nondegradable eosin Y by activated carbon, J. Environ. Sci. Int., 21(5), 623-631(2012).  20. J. M.. Park, S. K.. Kam, M. G.. Lee, Adsorption characteristics of lithium ion by zeolite modified in K+, Na+, Mg2+, Ca2+, and Al3+ forms, J. Korean Soc. Environ. Eng., 22(12), 1651-1660(2013).
21. S.. Lagergren, Zur theorie der sogenannten adsorption geloster stoffe kungliga Sevenska Vetenskapasakademiens, Handlingar., 24, 31-39(1898).
22. Y. S.. Ho, G.. McKay, The kinetics of sorption of basic dyes from aqueous solution by sphagnum moss peat, Can. J. Chem. Eng., 76, 822-827(1998).  23. C. H.. Lee, Cu and Zn ions adsorption properties at various pH with a synthetic zeolite, J. Korean Soc. Environ. Eng., 21, 805-813(2012).  24. C. H.. Lee, J. M.. Park, M. G.. Lee, Adsorption characteristics of Sr(II) and Cs(I) ions by zeolite synthesized from coal fly ash, J. Environ. Sci. Int., 23(12), 1987-1998(2014).  25. Z.. Aksu, F.. Gönen, Biosorption of phenol by immobilized activated sludge in a continuous packed bed: prediction of breakthrough curves, Process Biochem., 39, 599-613(2004).  26. S. H.. Hasana, P.. Srivastavaa, M.. Talatb, Biosorption of lead using immobilized Aeromonas hydrophila biomass in up flow column system: Factorial design for process optimization, J. Hazard. Mater., 177, 312-322(2010).  27. H. C.. Thomas, Heterogeneous ion exchange in a flowing system, J. Am. Chem. Soc., 66, 1466-1664(1944). 
|
|

















