The Korean text of this paper can be translated into multiple languages on the website of http://jksee.or.kr through Google Translator.
칼슘이온과 초기 pH가 TiCl4 응집제의 인 제거에 미치는 영향
Abstract
This study experimentally determined the effect of calcium ion (Ca2+) (0-0.55 mM) and intial pH (4.0-10.0) on phosphorus (P) removal in synthetic wastewater (2 mg P/L) using titanium tetrachloride (TiCl4) (0.12-0.18 mM). At TiCl4 concentration ([TiCl4])=0.12 mM, the P removal efficiency was the highest (95.1%) at pH 7 but the efficiency decreased to 51.4% at pH 8. The P removal efficiency was 55.6% at Ca2+ concentration ([Ca2+])=0 mM but the efficiency increased to 90.5% at [Ca2+]=0.045 mM at [TiCl4]=0.12 mM. On the other hand, the P removal efficiency difference was not large (96.5-99.5%) with [Ca2+] at [TiCl4]=0.15-0.18 mM. Within the design boundaries of 0.00≤[Ca2+]≤0.18 mM and 7.0≤initial pH≤9.0 at [TiCl4]=0.12 mM, the 90% P removal efficiency could be achieved at [Ca2+]≥0.10 mM with pH 8.0 and [Ca2+]≥0.12 mM with pH 9.0.
Key words: Ca2+, Coagulation, Phosphorus, Titanium Tetrachloride
요약
본 연구에서는 TiCl4 (0.12-0.18 mM)를 이용하여 합성 폐수(2 mg P/L)내 인을 제거할 때, 칼슘이온(Ca2+) (0-0.55 mM) 이 인 제거에 미치는 영향을 알아보았다. TiCl4 0.12 mM일 때 초기 pH(4.0-10.0)에 따른 실험결과 pH 7에서 인 제거율이 95.1%로 가장 높았고, pH 8에서 인 제거율이 51.4%로 떨어졌다. TiCl4 0.12 mM에서 Ca2+농도 0 mM일 때 인 제거율은 55.6%, Ca2+농도 0.045 mM에서는 90.5%로 증가하였다. 반면에 TiCl4 0.15-0.18 mM에서는 Ca2+농도에 따른 인 제거율(96.5-99.5%)의 차이는 미미하였다. TiCl4 농도를 0.12 mM로 고정하고, 초기 pH 7.0-9.0, Ca2+ 농도 0.00-0.18 mM 범위에서 반응표면분석법을 이용하여 분석한 결과, 실험 범위내에서 인 제거율 90%이상을 얻기 위해서는 Ca2+ 농도는 pH 8.0에서 0.10 mM, pH 9.0에서 0.12 mM 이상이 필요하다.
주제어: Ca2+, 응집, 인, 사염화티타늄
서 론
2012년 환경부는 I 지역기준(처리용량 500 m 3 이상) 폐수종말처리장 총인(total-phosphorous, T-P)의 수질기준을 0.2 mg P/L로 강화하였다[ 1]. 인은 호소의 부영양화 원인 물질 중 하나로 농도가 높아지면 조류의 증가로 수질오염의 원인이 된다. 인의 발생원으로는 농약, 축산폐수, 생활하수 등이 있다. 이러한 인을 제거하기 위하여 물리적 처리, 화학적 처리, 생물학적 처리, 식생을 이용한 처리 등의 다양한 방법을 병행하고 있다. 생물학적 처리방법은 다양한 운전조건이 요구되며 제거 가능한 인 농도의 한계가 있어 방류수 수질기준에 적합하도록 인을 처리하기 위해서는 물리-화학적 처리방법의 도움이 필요하다[ 2]. 물리-화학적 처리에서 가장 많이 쓰이는 방법은 응집-침전이다. 응집과 침전 과정에서 쓰이는 응집제의 종류로 알루미늄염, 철염이 있다. 하지만 기존 응집에 쓰이는 대부분의 응집제는 많은 하수슬러지를 발생시키고 처리에 어려움을 겪고 있다. 철염은 부식성이 높고 중화제 소요량이 높으며 최적 pH 영역이 좁으며 알칼리 한정 적용성이 있어 한정적이다[ 3]. 특히 알루미늄은 독성효과가 있는 것으로 알려져 있고, 적은 농도의 알루미늄이라도 생물에 농축되어 독성을 유발할 수 있다[ 4, 5]. 티타늄 계열 응집제는 기존 응집제들의 문제점을 보완하기 위한 물질로 국내외에서 연구되고 있다. 티타늄(Ti)은 인체에 미치는 영향이 적고 부식저항성이 작아 치과주조용 티타늄합금, 체내이식재료로 관심을 받고 있다[ 6]. 티타늄 계열 응집제로부터 발생한 티탄염 슬러지를 소성할 경우 산화티탄(TiO 2)을 생산할 수 있다[ 6]. 현재 TiO 2는 광촉매 기능이나 자외선 차단기능을 활용하여 첨가제로서 특히 섬유나 화장품의 중요한 성분으로 많이 이용되고 있다. 본 연구진에서 발표한 티타늄을 이용한 응집 관련 연구자료를 보면 낮은 응집제(TiCl 4) 농도와 높은 pH에서 인 제거효율이 낮았다[ 7]. 이는 염기성 조건에서 제타전위는 음의 값을 나타내고 있는데, TiCl 4가 제타전위를 중화시켜 응집하는데 도움을 주지만[ 8], 낮은 농도와 높은 pH에서는 제타전위의 중화를 기대하기 어려운 것으로 보인다. 콜로이드 안정성은 응집의 중요한 인자인데, 이것은 제타전위에 따라 정해진다. 제타전위의 절댓값이 0에 가까워짐에 따라 콜로이드 입자의 반발력은 감소하게 되고 콜로이드 안정성은 떨어지게 된다. 콜로이드 안정성이 떨어지게 되면, 불안정한 콜로이드는 응집하게 된다. 즉 제타전위의 절댓값을 작게 해줌으로써 콜로이드를 활성화시키고 그에 따라 응집효율을 증가시킨다[ 9]. 알칼리 토금속은 물에 넣으면 가수분해 되어 (+)전하를 가진 미립자가 발생하게 된다. 이렇게 나온 (+)전하를 가진 미립자는 TiCl 4의 제타전위 중화를 도와준다[ 8]. 따라서 수질인자 중 하나인 총경도(total hardness), 이온 강도(ionic strength) 등에 영향을 미치는 Ca 2+은 TiCl 4의 제타전위의 중화를 도와 응집에 영향을 미침을 예상할 수 있다. 하지만 TiCl 4를 이용한 인 응집 처리 시 Ca 2+이 인 제거에 미치는 영향을 보고한 문헌은 찾아보기 힘들다. 이에 TiCl 4 농도([TiCl 4])에 따른 pH와 Ca 2+ 농도([Ca 2+])가 인 제거효율에 미치는 영향을 알아보고자 하였다.
2. 연구방법
2.1. 실험방법
실험에 사용한 인공폐수는 하수처리장 2차 침전조 유출수 수질을 고려하여 인 2 mg P/L, 알칼리도 100 mg CaCO3/L가 되도록 증류수에 KH2PO4 (98%, 대정화금)와 NaHCO3 (99.5-100.3%, Wako)를 첨가하여 제조하였다. 초기 pH에 따른 실험은 NaOH (97.0%, 대정화금)와 HCl (35.0%, 대정화금)을 1 N로 제조하여 pH를 조절하였다. TiCl4 (20 wt%, (주)빛과 환경, 대한민국)와 CaCl2 (99%, Junsei Chenical Co., Ltd.)를 이용하여 [TiCl4] (0.12-0.18 mM)에 따라 [Ca2+] (0.00-0.55 mM)가 인 제거에 미치는 영향을 알아보았다. 이 때 pH는 조절하지 않았다. 응집 실험을 위해서 jar tester (M-Tops사(社), SF6, 대한민국)를 사용하였다. 교반 시간은 급속(120 rpm) 1분, 완속(30 rpm) 20분으로 실험하였고, 30분간 침전하였다.
2.2. 분석방법
pH는 pH meter (UB-10, DENVER instrument)를 이용하여 측정하였다. 인 농도는 상등액을 GF/C (0.45 μm)로 여과하여 Standard method 4500-P [ 10]에 따라 분석한 후 제거효율을 구하였다. 인 농도 분석에는 UV-Vis Spectrophotometer (Libra S60, Biochrom)를 사용하였다.
2.3. 실험설계
실험에 사용한 실험계획법은 일반적으로 2차 모형의 추정을 위한 연구에 사용되는 최적화 알고리즘인 반응표면분석법(response surface analysis, RSA)의 중심합성설계법(central composite design, CCD)이다. 중심합성설계법에 의해 계획된 실험을 수행하여 데이터를 얻은 후에 회귀분석을 통해 반응표면을 추정한다. 추정된 반응표면식을 이용해 독립변수의 변화에 따른 반응변수의 변화정도를 분석하는 민감도 분석을 행하며 실험결과들을 연속적으로 분석하여 체계적이고 신뢰도가 높은 최적조건을 산출할 수 있도록 한다. 실험 설계 및 분석은 통계프로그램인 미니텝(Minitab Inc. Release 14)을 사용하였다.
본 연구는 초기 pH와 [Ca 2+]를 독립변수로 하여 중심합성설계법에 따라 실험을 계획한 후 실험을 수행하였다. [TiCl 4]는 0.12 mM로 고정하였고, pH는 인 제거효율이 급격히 떨어지는 pH 8을 중심점으로 하여 pH를 7.0-9.0로 조절하였다( Fig. 1). pH를 염기성조건으로 선정한 이유는 산성조건에 비해 인 제거효율이 낮아 염기성조건에서 Ca 2+이 인 제거에 미치는 영향을 보기 위함이다. [Ca 2+]의 범위는 Ca 2+에 따른 인 제거효율이 95.0%가 되는 0.18 mM을 최대치로 설정하여 0.00 mM과 0.18 mM의 중간인 0.09 mM을 중앙점으로 하였다( Fig. 2). pH와 [Ca 2+]를 이용한 2인자설계를 하기 위하여 총 9개의 실험점과 실험 자체의 순수오차를 보정하기 위해 중앙점(pH 8.0, [Ca 2+] 0.09 mM)을 5번 반복하여 총 13개의 실험을 수행하였다( Table 1).
3. 결과 및 고찰
3.1. pH와 Ca2+ 농도가 인 응집에 미치는 영향
[TiCl 4]가 상대적으로 낮은 때(0.12 mM), pH 7에서 인 제거율이 95.1%로 높았지만 pH 8부터 인 제거효율이 51.4%로 급격히 감소하였다( Fig. 1) [ 7, 11]. 이는 pH 7에서 제타전위의 절댓값이 낮기 때문에 응집이 잘 되었으며 pH가 증가함에 따라 절댓값이 증가하여 응집효율이 감소하였기 때문인 것으로 추정된다[ 12]. 또한 산성일 때가 염기성일 때보다 전체적인 인 제거율이 높은데, 그 이유는 최종 pH의 영향으로 보인다. 본 연구에서 초기 pH가 8-10일 때 최종 pH는 6.5-7.3이었고, 초기 pH가 4-7일 때 최종 pH는 3-5.5이었다. 본 연구진에서 최종 pH와 [TiCl 4]의 관계를 조사한 결과 최종 pH가 3-5.6일 때 인 제거효율이 우수한 것으로 나타났다(자료는 제시하지 않음). 이는 초기 pH가 염기성일 때가 산성일 때보다 전체적인 인 제거효율이 낮음을 간접적으로 보여주고 있다. 합성폐수 2 mg P/L에 TiCl 4을 주입하지 않고 Ca 2+ (0.09-0.18 mM)만 첨가하였을 때 인 제거효율은 1%미만으로 거의 제거되지 않았다. 반면에 [TiCl 4] = 0.12 mM일 때 인 제거효율은 [Ca 2+] = 0 mM에서 55.6%, [Ca 2+] = 0.045 mM에서 90.5%, [Ca 2+] = 0.54 mM에서 97.3%로 [TiCl 4]가 상대적으로 낮을 때 [Ca 2+]가 증가함에 따라 인 제거효율은 급격히 증가하였다( Fig. 2). 선행연구에 따르면 TiCl 4를 이용한 유기물 응집 처리 시에도 이와 비슷한 경향을 보였다[ 13]. 이는 Ca 2+이 주입되면 TiCl 4의 제타전위 중화를 도와 응집을 촉진시키기 때문인 것으로 보인다[ 9]. 상대적으로 농도가 높은 [TiCl 4] = 0.15-0.18 mM일 때는 인 제거효율이 [Ca 2+] = 0 mM에서 96.5-98.9%, [Ca 2+] = 0.22-0.27 mM에서 98.1-99.5%, [Ca 2+] = 0.45-0.55 mM에서 98.3-99.5%로 Ca 2+의 효과는 미미하였다. 그 이유는 TiCl 4가 제타전위의 중화를 하기 때문인 것으로 보인다. 따라서 [TiCl 4]가 낮을수록 [Ca 2+]의 영향이 큼을 알 수 있다.
3.2. Ca2+ 농도와 pH에 따른 반응표면분석법
인 제거효율을 종속변수로 중심합성설계법에 따라 진행된 실험결과는 실험범위 내에서 인 제거효율은 40-95%로 나타났다( Table 1). 우선 실험점에 대한 1차 선형모델의 결정계수(coefficient of determination, R 2)가 70.2%로 낮아 2차 모델로 분석하였다. pH 2 항의 p-value가 0.233로 pH 2 항과 인 제거효율의 상호작용이 유의하지 않았다. 이에 pH 2 항을 소거하여 모델을 분석한 결과, 적합성 결여는 p-value가 0.225(p>0.05)로 적합한 모델로 분석되었고, 항별 p-value는 1차 항인 [Ca 2+]의 경우 0.001 이하, pH의 경우 0.018, 2차 항인 [Ca 2+]2의 경우 0.002, 교차항인 [Ca 2+] × pH의 경우 0.012로 적합한 모델로 분석되었다( Table 2). 결정계수는 94.5%로 신뢰 가능한 모델로 나타났으며, 분석 결과로 얻은 계수를 이용하여 식 (1)
과 같은 회귀 모형식을 도출하였다. 모델의 적절성을 판단하기 위해 잔차 그래프( Fig. 3)를 나타내었다. 잔차 그래프가 실험값과 잔차가 어떠한 형식이나 경향을 나타내지 않았으므로, 실험점 간의 영향이 없는 것으로 보인다. 본 실험에서 전체적으로 pH가 증가함에 따라 인 제거율이 감소하지만, Ca 2+을 주입하였을 때 같은 pH에서 인 제거율이 증가함을 알 수 있다( Fig. 4). 또한 같은 인 제거효율을 얻기 위해서는 pH가 높을수록 [Ca 2+]도 높아짐을 알 수 있다. 예를 들어 인 제거효율을 90% 이상을 얻기 위해서는 pH 7.0에서 [Ca 2+] = 0.06 mM, pH 8.0에서 [Ca 2+] = 0.10 mM, pH 9.0에서 [Ca 2+] = 0.12 mM이상이 필요한 것으로 예측되었다. 실험범위내에서 인 제거효율에 미치는 영향은 pH (p = 0.018)에 비해 [Ca 2+](p<0.001)가 더 컸다. 이는 등고선도( Fig. 4)에서 [Ca 2+] 축의 등고선 간격이 pH 축보다 조밀함을 통해 한 번 더 확인할 수 있다.
4. 결 론
1) [TiCl4]가 낮을 때는(0.12 mM) Ca2+을 주입함에 따라 인 제거효율이 증가하였다.
2) [TiCl4] = 0.12 mM일 때 인 제거율 90% 이상을 얻기 위해서는 pH 7.0에서 Ca2+이 0.06 mM, pH 8.0에서 0.10 mM, pH 9.0에서 0.12 mM이상 필요하다.
Acknowledgments
본 연구는 환경부의 환경정책기반공공기술개발사업과 2016년도 강원대학교 대학회계 학술연구조성비(관리번호-520160386)에서 지원받았습니다.
Fig. 1.
Effect of initial pH on phosphorus removal at [TiCl4] = 0.12 mM. 
Fig. 2.
Effect of calcium concentration on phosphorus removal with TiCl4 concentration. 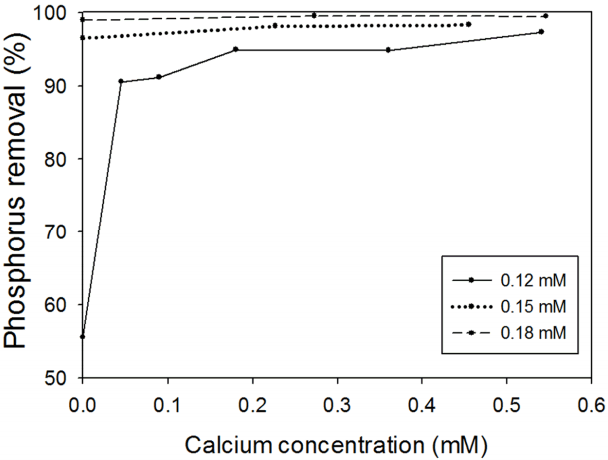
Fig. 3.
Residual plots of the quadratic model (Eq. (1)) for phosphorus removal. 
Fig. 4.
Two-dimensional contour plots and three-dimensional contour plots of the quadratic model for phosphorus removal with respect to calcium concentration and initial pH within the design boundaries. 
Table 1.
Experimental design and phosphorus removal
|
Trial |
Independent variables
|
Observation
|
|
Calcium concentration (mM) |
Initial pH |
Phosphorus removal (%) |
|
Linear design |
1 |
0.00 |
7.0 |
75.0 |
|
2 |
0.18 |
7.0 |
93.9 |
|
3 |
0.00 |
9.0 |
39.7 |
|
4 |
0.18 |
9.0 |
93.0 |
|
5a)
|
0.09 |
8.0 |
87.5±3.2 |
|
Quadratic design |
6 |
0.00 |
8.0 |
51.4 |
|
7 |
0.18 |
8.0 |
95.0 |
|
8 |
0.09 |
7.0 |
93.9 |
|
9 |
0.09 |
9.0 |
91.8 |
Table 2.
Analysis of variance for response of dependent variable (phosphorus removal)
|
Responses |
Sources |
DFa)
|
SSb)
|
MSc)
|
F value |
p value |
|
Phosphorus removal (%) |
Model |
4 |
3334.51 |
833.63 |
30.12 |
0.000 |
|
Linear |
2 |
2475.27 |
1237.63 |
44.71 |
0.000 |
|
Quadratic |
1 |
523.21 |
523.21 |
18.90 |
0.002 |
|
Crossproduct |
1 |
293.08 |
293.08 |
10.59 |
0.012 |
|
Residual |
8 |
221.43 |
27.68 |
|
|
|
Lack of fit |
7 |
218.92 |
31.27 |
12.47 |
0.215 |
|
Pure error |
1 |
2.51 |
2.51 |
|
|
|
Total |
12 |
|
|
|
|
References
1. Ministry of Environment (MOE), Water quality and ecosystem conservation Act Ministry of Envionment, Korea(2016).
2. B. E.. Rittmann, P. L.. McCarty, Environmental biotechnology : Principles and applications McGraw-Hill(2001).
3. J.. Galloux, L.. Chekli, S.. Phuntsho, L. D.. Tijing, S.. Jeong, Y. X.. Zhao, B. Y.. Gao, S. H.. Park, H. K.. Shon, Coagulation performance and floc characteristics of polytitanium tetrachloride and titanium tetrachloride compared with ferric chloride for coal mining wastewater treatment, Sep. Purific. Technol., 152, 94-100(2015).  4. C. J.. Park, D. H.. Kim, S. H.. Han, C. G.. Myung, Toxic effects of aluminium on freshwater animals : review, Korean J. Environ. Biol., 32(4), 271-285(2014).  5. S. H.. Han, D. H.. Choi, Effects of aluminum feedings on aluminum, phospholipid and catecholamine concentrations in old rat brain tissue, J. Korean Food Culture., 24(2), 236-243(2009).
6. H. K.. Shon, S.. Vigneswaran, I. S.. Kim, J.. Cho, G. J.. Kim, J. B.. Kim, J. H.. Kim, Preparation of titanium dioxide (TiO 2) from sludge produced by titanium tetrachloride (TiCl 4) flocculation of wastewater, Environ. Sci. Technol., 41(4), 1372-1377(2007).  7. S. Y.. Shin, J. H.. Kim, J. H.. Ahn, Optimization of TiCl 4 concentration and initial pH for phosphorus removal in synthetic wastewater, J. Korean Soc. on Water Environ., 31(6), 619-624(2015).  8. Y. X.. Zhao, B. Y.. Gao, B. C.. Cao, Z. L.. Yang, Q. Y.. Yue, H. K.. Shon, J. H.. Kim, Comparison of coagulation behavior and floc characteristics of titanium tetrachloride (TiCl 4) and polyaluminum chloride (PACl) with surface water treatment, Chem. Eng. J., 166, 544-550(2011).  9. N.. Tambo, Y.. Watanabe, Physical characteristics of flocs-I. the floc density function and aluminium floc, Water Res., 38(5), 409-419(1979).  10. APHA, Standard method for the examination of water & wastewater, 22nd ed., American Public Health Association, Washington D. C., USA(2012).
11. Y. X.. Zhao, B. Y.. Gao, H. K.. Shon, B. C.. Cao, J. H.. Kim, Coagulation characteristics of titanium(Ti) salt coagulant compared with aluminum(Al) and iron(Fe) salts, J. Hazard. Mater., 185, 1536-1542(2011).  12. H.. Matsumura, K.. Furusawa, Electrical phenomena at the surface of phospholipid membranes relevant to the sorption of ionic compounds, Adv. Colloid Interface Sci., 30, 71-109(1989).  13. Y. X.. Zhao, H. K.. Shon, S.. Phuntsho, B. Y.. Gao, Removal of natural organic matter by titanium tetrachloride: The effect of total hardness and ionic strength, J. Environ. Manage., 134, 20-29(2014). 
|
|














